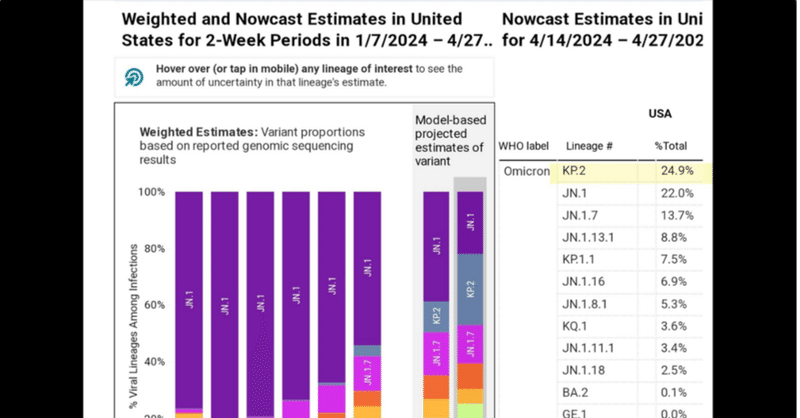
KP.2株の報告数の増加
Dr. Geert Vanden Bossche2024年4月28日のSubstackへの投稿
Is the spike protein of KP.2 adorned with additional glycan chains?
5月1日のHP(Voice For Science and Solidarity)への投稿
KP.2's increase in prevalence
の翻訳です。原文を参照の上ご利用ください。
(2024/5/4 HP版に合わせてタイトル変更しました。)
KP.2株のスパイクタンパク質は、さらなる糖鎖で飾られているだろうか。
最近、SARS-CoV-2のKP.2変異株 (JN.1.11.1.2)は、これまでの主流であった「親」変異株、すなわちJN.1株(それ自身はBA.2.86株の子孫である。) に速やかに取って代わりうるという報告がなされた(https://www.biorxiv.org/content/10.1101/2024.04.24.590786v1; fig. 1)。この進化はこれまでに観察されてきたトレンド、すなわち、新たなJN.1子孫株の適応上の優位性は、JN.1に取って代わるほど十分に強くはなく、そのため、異なる、より伝播性の高いJN.1変異株が出現し続ける、というトレンドとは明らかに異なる(https://www.voiceforscienceandsolidarity.org/scientific-blog/how-things-could-change-het-kan-verkeren[和訳])。
下記の図2は、感染したウィルスの子孫ウイルス粒子が抗原提示細胞に取り込まれるよりも、抗原提示細胞に吸着するように変化することについて示しているが、図に示されたことに従えば、ウイルス粒子の移動性樹状細胞への吸着増強と、ワクチンに由来する潜在性中和抗体に対するKP.2株の強い抵抗性が組み合わさると、細胞傷害性T細胞の活性化が減弱し、ウイルスが再び拡大するようになる。これによって、糖鎖を増やしたSARS-CoV-2変異株の伝播が促進されるようになる。これは、ウイルス表面のタンパク質、例えば、スパイクタンパク質の糖鎖付加によって、糖鎖ウイルスと、樹状細胞表面に発現したレクチンとの結合を強化できるためである[1]。ウイルスと、樹状細胞上に発現したレクチンとの結合が強まると、子孫ウイルス粒子に樹状細胞表面への結合が増し、それによって、多反応性非中和抗体に対する免疫圧力が増す[https://www.voiceforscienceandsolidarity.org/scientific-blog/i-can-now-spot-the-tsunami-at-the-horizon (和訳); https://www.voiceforscienceandsolidarity.org/scientific-blog/jn-1-quasispecies (和訳)]。
ウイルスに新たな糖鎖が付加されると、ウイルスの固有感染性が低下する可能性があるが、それでもなお、最終的に、伝播性の強化によってKP.2がJN.1よりも高い適応度を持つ結果となる可能性はある。糖鎖の追加によって、ウイルスと潜在性中和抗体の結合がさらに弱まる可能性が高いためである。さらに、KP.2株の樹状細胞表面への吸着性が増すため、JN.1の子孫ウイルス粒子の固有感染性も制限される。
KP.2の出現と拡大は、上述のウイルス進化と拡大のダイナミクスによって説明できるだろう。「KP.2の同定頻度の増大は、この変異株がこれまでの系統を凌駕し、現在進行中のパンデミックの動態に大きな影響を与える要因になりうることを明確に示している」(https://www.thailandmedical.news/news/study-identifies-virological-characteristics-of-the-sars-cov-2-kp-2-variant-one-of-the-variants-behind-spring-s-silent-covid-19-surge)
私の知る限り、KP.2の糖鎖プロファイルはまだ報告されていない。しかし、KP.2の固有感染性は(JN.1に比較して)かなり弱いことが明らかであるにも関わらず、感染拡大において明らかに競争上の優位性を示している。それでもやはり、KP.2の適応上の優位性は、最終的にウイルスの継続的拡大を保証するには不十分であろうと私は考えている。したがって、私は、KP.2変異株は、スパイクタンパク質の糖鎖追加によって多反応性非中和抗体の病原性抑制作用に打ち勝つ新たなコロナウイルス系統に、近いうちに取って代わられるだろうと深く懸念している。そうなって初めて、ウイルスは効果的な増殖優位性を取り戻す。しかし、ウイルス複製の劇的な増加は、宿主ー宿主間の伝播によってではなく、主に、感染した宿主内で起こるだろう。
結論として、ウイルス学的に特異なKP.2の振舞いをより良く理解し、KP.2がCOVID-19ワクチン接種者に対して病原性を増した新たなコロナウイルス系統出現の前兆となりうるかを判断するにはKP.2の糖鎖プロファイルを調べることが極めて重要である。スパイクタンパク質の構造変化がどのようなものであるかに関わらず、KP.2がJN.1準種集団の中で確固たる地位を占めることができたことは、ウイルスが、構造的にも機能的にも劇的な変身を遂げる準備を整えたということを示唆していると考えられる(https://www.voiceforscienceandsolidarity.org/scientific-blog/jn-1-quasispecies)[和訳]。このため、高度にCOVID-19ワクチンを接種された集団で、増強された重症疾患の大波を起こしうる新たなコロナウイルス系統、すなわち、HIVICRON、が突然出現する可能性がある。
[1] レクチンとは、ウイルスなどの病原体上に存在する、特定の糖鎖構造に特異的に結合できるタンパク質である。
初期オミクロン子孫株は多反応性非中和抗体依存性感染増強を介して標的宿主細胞に侵入する(❶)。多反応性非中和抗体は樹状細胞に吸着した子孫ウイルスに結合する。その後、樹状細胞は肺や他の遠隔臓器に移動する(❷)。他方、それまでの立体的免疫再集中でプライミングされた抗体は、抗原的により遠くなった免疫逃避変異株に低親和性で結合し、抗体-ウイルス複合体を形成し、巡回する抗原提示細胞に取込まれる(❸)。大きな抗体-ウイルス複合体は抗原提示細胞に、より取込まれるため、細胞傷害性T細胞が強く活性化される。そのためウイルスに感染した宿主細胞が排除されるようになる。
非常に感染性の高いオミクロン子孫株は、多反応性非中和抗体依存性感染増強に頼ることなく標的宿主細胞へ侵入できる。非常に感染性の高い変異株が増殖することによって、組織常在性樹状細胞への子孫ウイルスの吸着が促進されるような免疫環境が作られる。新たに出現する、より伝播性の強いオミクロン子孫株(JN.1一族のメンバーなど)は、その固有感染性の高さによって、遊走性樹状細胞への子孫ウィルス粒子の吸着をより増加させ、その結果、抗原提示細胞によるウイルスの取込みは減少する。抗原提示細胞へのウイルス取り込みが低下するとCD4+T細胞のプライミングが促進される。このようなT細胞の中には自己反応性のものもあるが、外来性因子に反応するものもあるだろう。しかし外来反応性であっても、抗体に覆われた大きなウイルス複合体では、スパイクタンパク質関連B細胞エピトープが免疫認識されないため、それまでの立体的免疫再集中によってプライミングされた抗体を再増加(ブースト)させるためのヘルパーT細胞として働くことはできない。それまでの立体的免疫再集中によってプライミングされた抗体がブーストされなければ、多反応性非中和抗体の産生も弱まる。
これらの、より感染性で炎症性の変異株(JN.1一族)は着実に拡大しているため、樹状細胞に吸着した高感染性子孫ウイルス粒子の増加と多反応性非中和抗体の産生減少があいまって、高度にC-19ワクチンを接種された集団では、ウイルス病原性に対する免疫選択圧力が着実に増加している。これが、最終的に、高度にC-19ワクチンを接種された集団で、多反応性非中和抗体によるワクチン・ブレークスルー感染を促進する能力を持ち、その結果、重症C-19疾患増強の巨大な波を引き起こす新たなコロナウイルス系統が選択される原動力となる。
いただいたサポートは一般社団法人ワクチン問題研究会に寄付されます。
