
COVID19に関連した中枢神経障害
Crit Care Clin. 2022 Jul;38(3):553-570.
PMID: 35667743
【ポイント】
■ COVID-19の神経学的合併症は一般的であり, 軽症から重症の患者で起こり得る.
■ 急性虚血性脳卒中などの脳血管合併症は, COVID-19患者全体の約1.5%にみられる. 一方, 脳静脈洞血栓症は稀で, 脳出血は抗凝固療法の結果や脳梗塞に付随して起こり得る.
■ 昏睡や遷延性意識障害は, ウイルス感染の結果やベンゾジアゼピン系鎮静薬の長期使用, 肝腎機能低下による薬物代謝遅延により起こり得る.
■ 譫妄はCOVID-19で一般的である. 面会制限が譫妄発生率上昇の重要な要因となっている可能性がある.
■ COVID-19回復期の神経学的合併症は, 軽症患者でも持続する倦怠感, 頭痛, ブレインフォグ, うつ, 不安, 体位性頻脈症候群などが生じる.
■ ICU生存者は集中治療後症候群など多岐にわたり, 長期的なフォローアップが必要である.
【イントロダクション】
■ 本稿執筆時点で, 世界中で3億4000万人が新型コロナウイルスSARS-CoV-2 (COVID-19)に罹患し, パンデミック開始以来557万人が死亡している.
■ COVID-19は,様々な臓器に影響を及ぼし, 軽症から致死的な症状を引き起こす多臓器ウイルス感染症候群である.
■ 神経学的合併症はしばしば報告されており, ウイルス感染による直接的・間接的な影響, 治療の合併症, あるいは偶発的に合併したものと考えられている.
■ これらの障害は急性期だけでなく, 初回感染後数週間から数ヶ月にわたって持続・発症し, COVID-19後遺症(PASC)やロングCOVIDと呼ばれる.
■ 重症患者は軽症患者と比較して神経学的合併症のリスクが高い.
■ 神経学的合併症の見逃しや診断の遅れが予後不良につながっている可能性がある.
■ 本総説では, COVID-19の急性期神経学的合併症とPASCにおける神経学的症状についてまとめた.
【疫学】
■ 神経学的症状のリスクはCOVID-19重症度に相関して増加するが, 初期症状が軽度の患者でも神経学的後遺症を呈することがある.
■ 嗅覚障害, 味覚障害, 倦怠感, 倦怠感, 頭痛から, 脳卒中, 脳炎, ギラン・バレー症候群(GBS)などが含まれる.
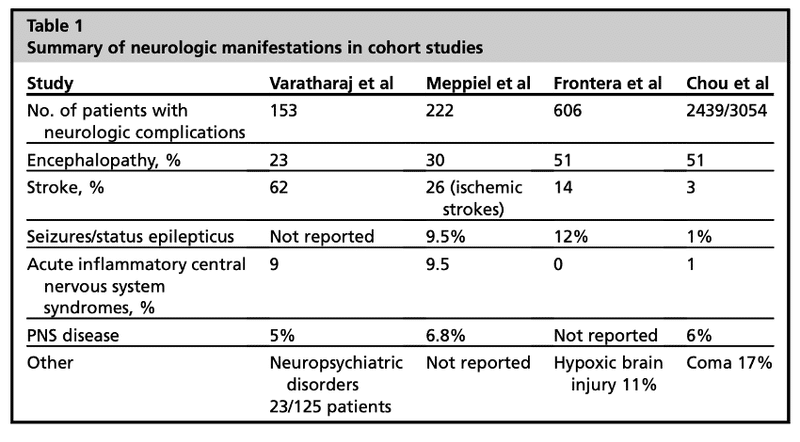
■ COVID-19の神経学的合併症に関する知見は主に観察研究に基づいている.
■ 最も一般的な神経学的症状は筋肉痛(22%), 味覚障害(20%), 嗅覚障害(18%), 頭痛(12%), めまい(11%), 脳症(9.4%), 脳卒中(2.5%)であった. 筋肉痛, CK, LDHの上昇, 脳卒中は重症例で有意に多かった.
【COVID-19の急性期神経精神症状と後遺症のリスク因子】
■ 高齢者, 多数の併存疾患, ヒスパニック系, 南アジア系, 黒人, 混血, 既存の神経疾患を有する患者は, COVID-19の急性期神経学的合併症を発症するリスクが高い.
■ PASCのリスク因子としては, 40歳以上, 白人, 女性などがある.
■ システマティックレビュー9では, PASCの神経精神学的影響に対する以下のリスク因子が特定された.
▫️ うつ病・不安(生存者の20-40%): 女性, 感染した家族がいる, 感染後の身体症状, 重症感染, 炎症マーカーの上昇, 精神疾患の既往歴.
▫️ 外傷後ストレス障害(PTSD)(生存者の20-30%): 女性, 若年, 重症, 精神疾患の既往歴, 肥満, 2型糖尿病, 自己免疫疾患.
▫️ 記憶障害, 集中力障害, 多重課題処理困難, 処理速度低下などの認知機能障害(生存者の20-30%): 譫妄, 高齢.
【病態】
■ COVID-19は初期のウイルス血症期, 次に血栓形成・炎症期, その後免疫調節異常期を経過すると考えられている.
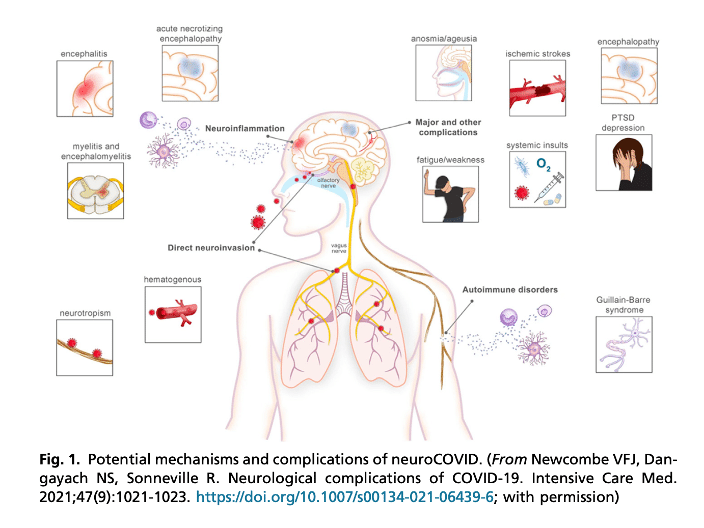
■ COVID-19スパイクタンパク質は各臓器のACE2受容体に結合し, 炎症カスケードを活性化する. また, 血管内皮のACE2受容体に結合し, 血栓形成を促進する. SARS-CoV-2ウイルスがACE2に結合することにより, ミトコンドリア機能と内皮型一酸化窒素合成酵素活性を阻害し, 二次的に心血管系や脳血管系への影響を引き起こす可能性がある.
■ 中枢神経系におけるACE2受容体濃度が限られていることから, 直接的なウイルス侵入は稀な現象かもしれない. 実際, 剖検研究では脳内のウイルス粒子は同定されることはあるが稀である. これが脳への低ウイルス侵入の結果なのか, あるいはこれらの患者が死亡時にはすでに初期ウイルス血症期から炎症期・血栓形成期に移行していたためかは不明である.
【炎症】
■ 剖検連続切片では, ほとんどの脳でミクログリアの活性化, ミクログリア結節, ニューロン食作用が観察された. これらは脳実質への直接的なウイルス感染の結果ではなく, 全身性炎症の結果によるもので, 低酸素・虚血の相乗効果が加わった可能性が高い.
■ 43例の死後脳を検討した研究では, COVID-19患者の神経病理学的変化は軽度で, 脳幹部の神経炎症性変化が最も一般的な所見であった. SARS-CoV-2による直接的なCNS損傷の証拠は見られなかった. 8例の死後検体を含む研究では, 血管周囲の炎症はあるがウイルス粒子は認めなかった. そのためCOVID-19は血管内皮障害と微小血管障害を惹起する可能性があることが示唆された. 昏睡や遷延性意識障害の患者では, 全身性の炎症反応が重い場合に生じることがある.
【血栓形成】
■ COVID-19は血管内皮障害を引き起こし, 血栓形成を促進すると考えられている. COVID-19 ARDSの患者は, 非COVID-19患者と比較して, 様々な血栓形成因子や血栓性イベントが多かった.
【治療による影響】
■ 重症COVID-19患者は, 脳症やICUに関連して筋力低下のリスクが高い. これらの神経学的影響は, 鎮静, 不動化, 社会的孤立の長期化により, 譫妄やPICSのリスクが高まってしまう. これらの要因の一部は基礎疾患の重症度に関連していたが, 他の要因はスタッフの安全, PPE不足, 薬剤不足, 面会制限によるA2Fバンドルの遵守率低下によるものと考えられる.
【神経学的合併症】
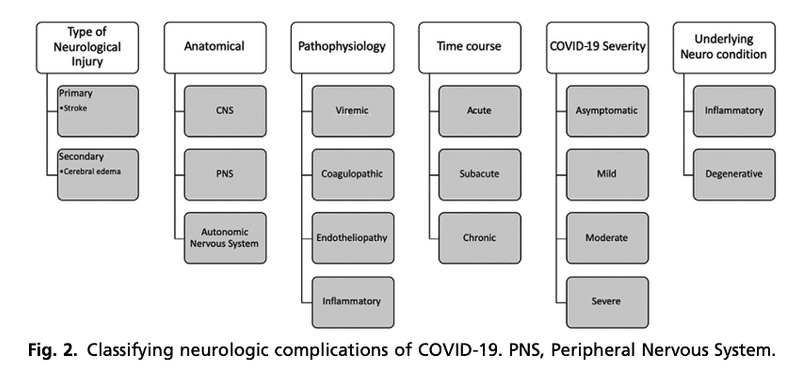
■ 神経学的合併症は, 脳血管障害, CNS炎症性疾患, 脱髄疾患, 脳症, 末梢神経障害, 味覚・嗅覚障害, その他に大別される. 図2は, COVID-19の神経学的合併症を分類するいくつかの方法を示している.
【神経診断検査, 神経モニタリング 】
■ COVID-19患者における神経学的合併症の早期診断は, ベッドサイド診察が重要である.
■ 診察で得た情報から画像検査や電気生理学的検査につながっていく.
【画像所見】
■ 重症COVID-19患者は, 血行動態や換気/酸素化の面で不安定なため, MRI検査のために数分間仰臥位を維持することが困難な場合がある.
■ このような神経学的合併症が疑われる患者に対しては, まずCTスキャンを行うのが適切であろう. 脳血管合併症のリスクが高いため, CTやMRI検査と同時に動脈系・静脈系の血管撮影を行った方がよいだろう.
■ 重症COVID-19患者でよく見られる画像所見としては, 白質脳症, 大血管閉塞パターンの虚血・梗塞, 髄膜増強, 脳炎, 高血圧性脳出血とは異なる部位の出血(抗凝固療法による可能性がある葉状や皮質性), 灌流異常などがある.
■ 昏睡/DOC(disorder of consciousness)患者のもう一つの重要な所見は, 微小出血である. 別の症例集積では, COVID-19入院患者115例中25例(22%)でMRIにより脳微小出血が確認され, しばしば白質脳症を伴っていた. これらは呼吸器疾患の重症度が高い患者ほど認めやすい.
■ その他の所見としては, 可逆性後頭葉白質脳症症候群, 低酸素性虚血性脳症に典型的な所見がある. 後ろ向き多施設研究(n=64)では, 髄膜増強が17%, 脳炎が13%にみられ, MRI検査の46%は正常であった.
【脳脊髄液検査とバイオマーカー】
■ COVID-19患者の脳脊髄液では, 通常, 細胞増多は見られない. 脳脊髄液所見は炎症性から, 異常が蛋白上昇のみの場合まで様々である. COVID-19患者18例の脳脊髄液検査を含む症例対照研究では, 細胞増多がないこと, 炎症性マーカーやサイトカインの増加がないこと(IL-6, フェリチン, D-ダイマー)が示された. また, 非COVID-19脳卒中患者とCOVID-19脳卒中患者では, 炎症性サイトカイン(IL-6, TNFα, IL-12p70)の増加が同程度であることがわかった.
■ COVID-19中等症~重症患者のシリーズでは, 細胞増多はないが, 可溶性神経炎症マーカー(ネオプテリン, β2ミクログロブリン, IgG指数), 血液脳関門の破綻(アルブミン比), 軸索障害(CSFニューロフィラメント軽鎖タンパク質[NfL])の上昇を認めることが明らかになってきた. しかし, CNSのウイルス感染に典型的な白血球反応やその他の免疫学的特徴は認めない. COVID-19の神経学的症状を有する患者では, CSF細胞増多は感染中または感染後の脳炎や多発根神経炎に関連している. 抗GD1bおよび抗Caspr2抗体やミエリン関連糖タンパクの上昇がみられ, SARS-CoV-2による二次性自己免疫の可能性が示唆される.
【血清バイオマーカー】
■ ニューロフィラメントL(NFL), GFAP, タウ蛋白などの脳損傷の血清マーカーは, 入院患者で重症度に依存して上昇し, 4ヶ月後のフォローアップ時にも上昇が持続していた. これらの患者では, NFLとGFAPの上昇が炎症性サイトカインや自己抗体の上昇と関連していた.
■ 別の症例対照研究では, COVID-19入院後48時間以内の57例の患者と20例の対照群の血漿検体を用いて, 6つの脳損傷分子(BIM), 2つの内皮損傷分子(EIM), ケモカイン/サイトカインのレベルを調べた. 3つのBIM(MAP2, NSE, S100B), 2つのEIM(sICAM1, sVCAM1), 7つのケモカイン・サイトカイン(GRO, IL10, sCD40L, IP10, IL1Ra, MCP1, TNFα)は, COVID-19群で対照群と比較して有意(P<0.05)に上昇していた.
■ まとめると, COVID-19脳症はCSF細胞増多は認められないが, 蛋白レベルの上昇とオリゴクローナルバンドを認めることがある. COVID-19における血漿およびCSFのサイトカイン, GFAP, NFLの上昇は, ミクログリアの活性化とそれに続くニューロン障害を伴う炎症と全身の炎症反応を反映していると考えられる. 炎症メカニズムのさらなる証拠として, 髄膜の高信号や微小出血を含む広範な白質異常などの画像所見がある. これらのバイオマーカーの多くは臨床ケアの一環としては日常的に測定されておらず, いつ, どの程度の上昇が, 臨床応用前にどのような意味を持つのかについてさらなる研究が必要である.
【嗅覚障害・味覚障害】
■ 27,000例以上の患者を対象とした83の研究のメタ解析では, 嗅覚障害は48%の症例で発生していた. パンデミック初期に死後脳MRIで嗅球の関与が報告された. ほとんどの患者は嗅覚障害と味覚障害から回復する. 他のCOVID-19変異株でこのような高い嗅覚障害の発生率がみられるかどうかは, 今後の検討課題である.
【頭痛】
■ 頭痛はCOVID-19の一般的な症状である. 3,598例の患者を対象としたメタ解析では, COVID-19感染患者の11-14%に頭痛がみられた. 中国からの初期の研究では, 頭痛の発生率はさらに低く, 約6.5-8%であった. COVID-19患者47例を対象としたコホート研究では, 64%に頭痛がみられた. 94%の患者が両側性の頭痛を報告し, 53%が重度の頭痛, 15%が中央値15日間の持続性頭痛を報告した.
【脳卒中】
■ COVID-19患者における脳卒中のリスクと転帰について, いくつかのコホート研究とメタ解析が行われている. COVID-19パンデミック以前から, 敗血症や炎症が脳卒中を引き起こすことが知られていた. COVID-19における脳卒中の初期報告の1つでは, 108,571例のCOVID-19患者のうち, 急性脳卒中が1.4%(95%信頼区間:1.0-1.9)に発症した. 研究者らは, COVID-19患者におけるインフルエンザ患者(0.9%)と比較して, より多くのCOVID-19患者が脳卒中を発症すると結論づけた.
■ 大血管の閉塞はは, 若年, 無症状, または軽症のCOVID-19症例で初めて報告された. その後の研究で, COVID-19脳卒中患者の平均年齢は, 非COVID-19脳卒中患者の平均年齢よりもわずかに低いが, 若年患者(<50歳)ではそれほど多くなないことが示された. また, COVID-19脳卒中患者は併存疾患の影響が強い. 脳卒中のメカニズムは, 血栓塞栓症, 大動脈アテローム硬化症, COVID-19関連心筋炎, 不整脈, 原因不明など様々である.
■ 129,491例の患者を対象とした46研究のレビューでは, COVID-19脳卒中患者はパンデミック前と比較して若年で男性で多く, 脳卒中の重症度が高かった. 研究者らは, 血栓溶解療法の実施率に差はなかったが, COVID-19患者の方が血栓除去術を受けるている割合が多かった.
■ COVID-19患者の脳卒中死亡率は, 同程度の脳卒中重症度の非COVID-19患者と比較して高い. 米国31施設の多施設共同研究(n=230)では, 患者102/203例(50%)は転帰不良で, 観察された死亡率は35/219例(38.8%)であった. COVID-19脳卒中患者の院内死亡率は約38.1%, 脳内出血(ICH)は58.3%であった.
■ COVID-19による脳卒中に高度の脳浮腫をきたした患者は予後良好との報告があり, COVID19感染を理由に手術の適応から除外するべきではない.
【脳出血】
■ 脳出血はCOVID-19後脳梗塞よりも少なく, 脳卒中全体の約20%を占め, その発生率は0.2%から0.86%である.
■ この割合は, 脳出血の世界的発生率(10万人年あたり24.6人, すなわち1人年あたり0.02%)よりも高い. COVID-19脳卒中患者の20%未満が脳出血である. システマティックレビューでは, 23研究14,8148例のCOVID-19 脳出血患者を含む推定発生率は0.7%であった.
■ Vizient Clinical Data Baseのデータを分析し, 194病院のCOVID-19脳出血患者559例と非COVID-19 脳出血対照群23,378例を比較した研究では, COVID-19患者は入院期間が長く(21.6日 vs 10.5日), 集中治療期間が長く(16.5日 vs 6.0日), 院内死亡率が高かった(46.5% vs 18.0%). COVID-19による脳出血またはクモ膜下出血患者は, 人種・民族的マイノリティ, 糖尿病, 肥満である可能性が高く, 対照群と比較して死亡率が高く, 入院期間が長かった.
■ COVID-19に伴う脳出血患者139例を対象としたメタ解析では, これらの患者は, COVID-19に関連しない脳出血とは異なる特徴を有していた. すなわち, 脳葉型の部位(67%), 多発性(36%)が多く, 抗凝固療法の割合が高く, 死亡率が高かった. システマティックレビューでは, 高齢, 非白人, 人工呼吸を要する呼吸不全, 抗凝固療法が脳出血のリスク因子として特定された.
【クモ膜下出血】
■ Vizientデータベースを用いてCOVID-19 SAH症例と非COVID-19 SAH対照群を比較した研究では, 119病院からSAH-COVID患者212例と対照群5029例が得られた. SAH-COVIDコホートでは, 対照群と比較して入院期間(26.9日 vs 13.4日), 集中治療期間(21.9日 vs 9.6日), 院内死亡率(42.9% vs 14.8%)が高かった.
■ Cerner非識別化COVID-19データセットを用いた62医療施設のデータを含む別のコホート研究では, COVID-19患者85,645例中86例(0.1%), 非COVID-19患者197,073例中376例(0.2%)にSAHが認められた. 研究者らは, COVID-19患者ではSAHのリスクは増加しなかったが, 全身合併症により死亡率が高くなったと考えられる(31.4% vs 12.2%)と述べている.
【脳静脈洞血栓症】
■ COVID-19パンデミック第1波のピーク時(2020年3月から5月)のニューヨーク市の症例集積では, 13,500例中12例でCVSTが診断され, 発生頻度は100万人あたり0.088人であった. 一般集団におけるCVSTは年間100万人あたり5人である.
■ COVID-19患者34,331例を対象としたシステマティックレビューでは, CVSTの推定発生頻度は0.08%であった. 上矢状静脈洞と横静脈洞が急性CVSTの最も一般的な部位であった. CVSTとワクチン誘発性血小板減少症(VITT)については, 本総説の後半で述べる.
【体外式膜型人工肺(ECMO)と神経学的合併症】
■ COVID-19に対するECMOの神経学的合併症に関するシステマティックレビューでは, 症例集積と後ろ向きコホート研究から1322例の患者が含まれ, 脳内出血(ICH), 虚血性脳卒中, 低酸素性虚血性脳損傷の有病率は, それぞれ5.9%(78例), 1.1%(15例), 0.3%(4例)であった.
■ 10研究で死亡が報告された1296例のECMO患者の全体死亡率は36%(477例)で, 神経学的イベントを有する患者サブセットの死亡率は92%であった.
■ ECMO患者の多施設症例対照研究では, COVID-19患者29/142例(20%)で脳出血が発生し, 非COVID-19患者では4/68例(6%)で発生した.
■ 脳出血を有するCOVID-19患者の半数が臨床症状のある脳出血を有し, 3分の1が院内死亡した. 重症度に関わらず, 脳出血合併時のICU死亡率は88%であった. 本研究では, COVID-19に伴うECMO患者では, 非COVID-19患者と比較して, 脳出血の調整リスクが6倍, 脳出血発生率が3.5倍高いことが示された. COVID-19とCOVID-19以外のARDS患者を比較した別の研究では, ARDS患者の10%で脳出血が検出された. COVID-19患者で抗血小板療法と治療的抗凝固療法の割合が統計的に高かったにもかかわらず, COVID-19によるARDS患者と他の原因によるARDS患者で脳出血の発生率は同程度であった.
【譫妄・脳症】
■ 11,553例のCOVID-19患者を対象とした48研究のシステマティックレビューでは, COVID-19患者の譫妄の推定有病率, 発生率, 死亡率はそれぞれ24.3%, 32.4%, 44.5%であった.
■ COVID-19入院患者419例のコホート研究では, 約80%が入院時から入院後のいずれかの時点で神経学的合併症と診断され, そのうちの30%が脳症であった. さらに, これらの患者は, 他のICU管理が必要な疾患と比較して, 長期の人工呼吸と鎮静・筋弛緩薬の投与を必要とすることが多い.
■ 重症COVID-19患者を対象としたコホート研究では, 84%の患者に神経症状, 主に譫妄がみられた. その後の研究(n=140)では, 70%の患者がICU滞在中に不穏を発症した. また, 半数以上(17/28)の患者でMRI異常がみられ, 半数以上(18/28)で髄液に炎症所見がみられた. 脳波では非特異的所見のみであった.
■ COVID-D コホートスタディ(重症 COVID-19 患者 2,088 例を対象)では, 55% の患者に譫妄がみられた. 人工呼吸, 拘束具の使用, ベンゾジアゼピン, オピオイド, 血管収縮薬の持続投与, 抗精神病薬の使用はの譫妄リスク因子で, 家族の面会(直接または仮想)は譫妄リスクを低下させた.
【昏睡・脳炎】
■ COVID-19で意識障害を呈した患者のうち, 昏睡患者では血清炎症マーカーが昏睡を呈さなかった患者と比較して高値であった. 鎮静薬中止後, COVID-19による重度の呼吸不全患者は, 完全に意識が回復するまでに数週間の無意識状態が続くことがある.
■ 前向き縦断研究で, 鎮静薬や脳の構造的損傷では説明できないDoCを呈したCOVID-19重症患者のうち, 脳MRIを繰り返し実施して記録した. 画像に加えて, 安静時機能的MRIと拡散MRIを実施し, 健常対照群および重度の外傷性脳損傷によるDoC患者と比較した. 本研究に含まれた12例の患者のうち, 1例は登録直後に死亡し, 残りの患者は鎮静薬中止後0~25日で意識を回復した. 長期の回復期間がみられることから, これらの患者の予後判定には注意が必要である.
【集中治療後症候群(PICS)とCOVID-19後遺症(PASC)】
■ PICSは,集中治療管理後に身体的, 認知的, 精神的に新規または悪化した機能障害をさす.
■ COVID-19患者と非COVID-19患者の両方を含む622例の単施設観察コホート研究(年齢中央値64歳, 女性36%)では, 294例のうち16%と13%の患者が退院後1ヶ月と3ヶ月時点でPTSDの疑い, 29%と20%が不安の疑い, 32%と24%がうつ病の疑いと報告した. 研究者らは, COVID-19入院患者と非COVID-19入院患者で神経精神症状のリスクは同程度であり, パンデミック期には両方のコホートのニーズに焦点を当てた入院患者の長期フォローアップが必要であると結論づけた.
■ ニューヨーク市の前向きコホート研究では, COVID-19生存者の90%が1つ以上のPICS領域の機能障害を呈していた. 別のコホート研究では, COVID-19 ICU生存者32例のうち87.5%(28例)が3ヶ月の時点で日常生活のレベルに戻れておらず, 40%の患者で複数の領域に障害がみられた.
■ 患者と介護者に対しては, 持続する症状をモニターするよう教育し, PASCの患者のニーズに対応するため, 多職種連携によるフォローアップを受けるべきである.
■ COVID-19専門センターは全ての国で広く利用できるわけではないが, そのようなセンターの認知度を高め, 遠隔医療によるフォローアップを行うことで, COVID-19生存者のニーズを満たす上でのギャップを埋めることができるかもしれない.
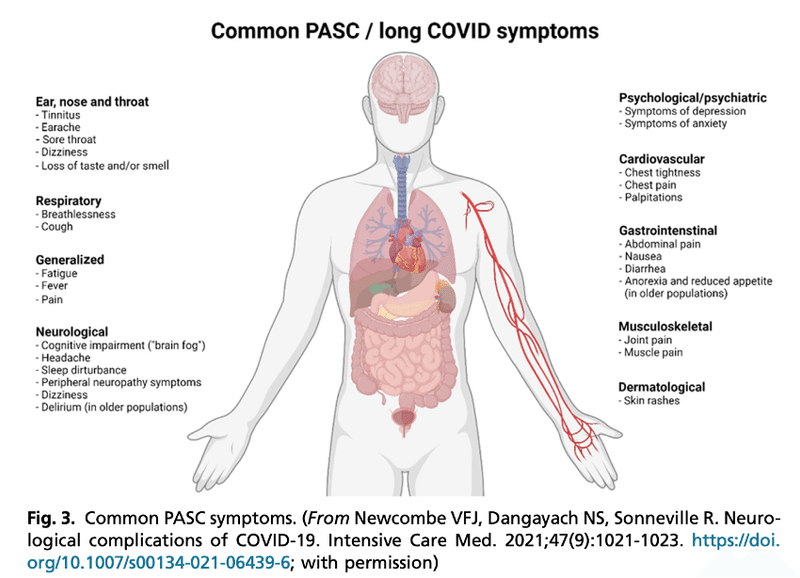
■ 研究によると, COVID-19患者の約半数がPASCを発症すると報告されている. 急性期のCOVID-19と同様に, PASCにも多臓器症状が含まれる. COVID-19生存者は多臓器にわたってケアが必要であることを認識し, 多職種連携クリニックでフォローアップを受ける必要がある. 集中治療の生存者では, 様々な領域(身体的, 認知的, 行動的)の障害はPICSとして特徴づけられている. 重症患者の生存者のためのクリニックは, 急性期および非入院COVID-19患者のPASCサバイバーシップに対応するためのモデルとなる. より良い経過の理解や症状のクラスタリングのためだけでなく, サバイバーシップの軌跡に関するデータを収集するのに役立つ. 多職種連携プログラムには, リハビリテーションサービス, ソーシャルワークと福祉支援, 薬局, 専門医療, 訓練を受けたモデレーターによる構造化された支援プログラムへのアクセスが含まれるべきである. プライマリケアとの連携も不可欠である.
■ PASCクリニックは, SARS-CoV-2感染後のサバイバーシップの軌跡に関する知識を深め, サービスの革新と提供を改善するための研究の機会も提供する. フォローアップとリハビリテーションのためのリソースは国によって, また国内でも異なるが, 認知度を高め, 遠隔医療などのイノベーションによって, COVID-19生存者のニーズを満たすためのギャップを埋めることができるかもしれない. 症状評価は退院後4~6週間および12週間に実施し, 他の臓器系(例えば肺, 血液)の関与に関するフォローアップに加えて, 神経精神症状のスクリーニング, および進行中の臨床試験, 身体療法, 作業療法, 認知療法への早期紹介を行うことができる.
【ワクチンの神経学的合併症】
■ 世界の様々な地域で, いくつかのCOVID-19ワクチンが承認され使用されている. ワクチンによる有害事象を追跡・報告するためのシステムは, 世界の様々な地域で異なる. 例えば, 米国ではワクチン有害事象報告システム(VAERS), 英国ではコロナウイルス Yellow Card 報告ウェブサイト (https://coronavirus-yellowcard.mhra.gov.uk/) などがある.
■ 患者や医療提供者は誰でも, 米国疾病予防管理センター(CDC)のVAERSを通じてワクチンの副作用を報告することができる. 患者, 提供者, 製造業者は, 米国食品医薬品局の有害事象報告システムにも合併症を報告することができる.
■ 最も一般的な神経学的症状は, めまい, 頭痛, 痛み, 筋痙攣, 筋肉痛, 感覚異常で, これらはワクチン接種による急性の一過性の影響として起こることが予想される. まれに振戦, 複視, 耳鳴り, 発語障害, 発作, 帯状疱疹の再活性化が報告されている.
■ 2021年のVAERSデータベースでは, 報告頻度順に顔面神経麻痺, GBS, 脳卒中, 横断性脊髄炎, 急性散在性脳脊髄炎がある. 一過性の頭痛, 筋肉痛, 倦怠感は, 臨床試験の参加者の約5%で報告されている.
■ 英国からの報告では, 自己対照症例シリーズ研究により, ChAdOx1nCoV-19(アストラゼネカ)の初回接種後28日以内(n=20,417,752)またはBNT162b2(ファイザー)(n=12,134,782), およびSARS-CoV-2陽性検査後(n=2,005,280)の神経学的合併症による入院リスクを調査した. アストラゼネカワクチンではGBS(接種15-21日後の発生率比[IRR]2.90)とベル麻痺(15-21日後のIRR1.29)のリスク上昇がみられた. ファイザーワクチンでは出血性脳卒中のリスク上昇がみられた(15-21日後のIRR1.38). スコットランドの独立したコホートでも, アストラゼネカワクチンとGBSの関連(1-28日後のIRR2.32)がさらに裏付けられた. SARS-CoV-2陽性検査後28日以内のすべての神経学的転帰のリスクは実質的に高く, GBS(IRR5.25)も含まれていた.
【脳静脈洞血栓症とワクチン誘発性血小板減少症(VITT)】
■ Ad26.COV2.Sワクチン接種後の血小板減少を伴うCVSTの最初の12例が米国で重篤な事象として報告された. 英国では, 2022年1月12日までに, 医薬品・医療製品規制庁(MHRA)にCOVID-19ワクチンアストラゼネカ接種後に血小板減少を伴う大血栓塞栓症435例のYellow Card報告を受けている. 435例中49例は2回目接種後に報告された. 435例中217例は女性, 214例は18-93歳の男性であった. 全体の症例死亡率は18%で76例が死亡し, そのうち6例は2回目接種後に発生した. CVSTは157例(平均年齢46歳), その他の大血栓塞栓症は278例(平均年齢54歳)で血小板減少を伴っていた. 英国における1月12日時点のCOVID-19ワクチンアストラゼネカの推定初回接種回数は2,490万回, 2回目接種回数は2,420万回であった. 報告発生率は女性の方が男性よりも高い傾向があるというエビデンスがあるが, これはすべての年齢層で見られるわけではなく, その差は小さいままである. 2回目接種後の血小板減少を伴う血栓塞栓症の全体発生率は100万回あたり2.0例であった. COVID-19ワクチンアストラゼネカを接種した様々な年齢層の患者数の違いを考慮すると, このデータは2回目接種後の若年成人層(18-49歳で100万回あたり1.0例)の方が高齢層(50歳以上で100万回あたり2.1例)よりも報告発生率が低いことを示している. 科学的レビューでは, 血小板減少を伴わないCVSTとCOVID-19ワクチンアストラゼネカの関連性がある可能性が結論づけられた.
■ 現在の米国と英国の政府機関であるCDCとMHRAのアドバイスでは, ワクチン接種はメリットがリスクを上回ると結論づけており, これは神経学的観点から間違いないだろう. 因果関係を確立するためには, Brighton コラボレーションガイドラインを介するなど, 臨床的な症例定義を確立する必要がある. また, 新興の問題(VITTなど)には, 臨床医主導の定義が必要である. 因果関係を評価する際には, WHO GACVSやブラッドフォード・ヒルの基準87などのツールを使用することができるが, 著者らは時間的関係, 個人的リスク因子, 他の原因の可能性を考慮して, 関連する神経学的またはその発生を蓋然性の高い症例, 蓋然性のある症例, 蓋然性の低い症例に分類する基準を追加で提案している. このようなSARS-CoV-2ワクチン接種キャンペーンの緊急事態では, 継続中のランダム化比較臨床試験が実行不可能および/または非倫理的な場合があり, 三角測量などの疫学的因果関係評価方法が使用される可能性がある.
この記事が気に入ったらサポートをしてみませんか?
