チップ上の脈管形成オルガノイド:機能的血管系を有するオルガノイドの工学的戦略
Shun Zhang , Zhengpeng Wan and Roger D. Kamm ORCID
マサチューセッツ工科大学生物工学部、マサチューセッツ州ケンブリッジ、米国 電子メール:rdkamm@mit.edu
2020年11月23日受領 , 2021年1月14日受理
2021年1月15日初版発行
元記事はこちら。
https://pubs.rsc.org/en/content/articlehtml/2021/lc/d0lc01186j
要旨
ヒトオルガノイドは、均質な多能性幹細胞(PSC)から自己組織化して分化させたもので、生体内の対応する細胞の主要な構造的・機能的特性を再現しています。
オルガノイド技術の急速な発展とその多様な応用にもかかわらず、真に生体内と同様の機能を実現するための主な制約は、成熟した構造組織の欠如と組織サイズの制限であり、これらはいずれも機能的な血管系を欠くことによる直接的な結果である。灌流可能な血管がない場合、オルガノイド内の中心領域は、拡散だけでは対応できない代謝要求の増加により、発生中にすぐに壊死してしまいます。このように、オルガノイドが数百ミクロン以上に成長し、胚・胎児期を超えて成熟するためには、オルガノイドモデルに機能的な血管系を組み込むことが不可欠である。
ここでは、オルガノイドの血管形成とin vitro毛細血管床の工学的構築に関する最近の進歩をレビューし、さらにそれらをマイクロ流体ベースのプラットフォーム上で統合し、in vitroでオルガノイド全体に灌流血管を確立するための戦略について検討します。
張 俊
Shun Zhangは、Juan Carlos del Álamo博士とJuan Lasheras博士の指導のもと、2018年にカリフォルニア大学サンディエゴ校の機械工学科で博士号を取得しました。博士論文は、軟体運動における流動、収縮、接着の力学に関するものである。現在、マサチューセッツ工科大学のRoger Kamm研究室で博士研究員として勤務している。現在の研究テーマは、マイクロ流体チップを用いたin vitro血管網の構築と、そのオルガノイドモデルへの応用である。
Zhengpeng Wan(ワン・チェンペン・ワン)
Zhengpeng Wanは、2018年に清華大学から生物学の博士号を取得しました。Wanli Liuの研究室でBリンパ球のメカノバイオロジーを研究した。現在、マサチューセッツ工科大学のRoger D. Kammの研究室でポスドクとして、マイクロ流体技術を用いた脈管形成腫瘍およびオルガノイドモデルに取り組んでいる。
ロジャー・D・カム
1978年以来、マサチューセッツ工科大学の生物工学および機械工学の特別教授を務めている。以前は細胞力学や分子力学、現在は人工生体システムなど、生物学と力学の境界領域における研究活動の発展に長年貢献してきた。現在は、マイクロ流体技術を用いた健康および病気の器官機能モデルの開発に取り組んでおり、特に血管形成に焦点をあてている。
1 はじめに
オルガノイドは、過去10年間に達成された大きな技術的ブレークスルーを象徴しています。「臓器に似ている」という最も一般的な定義に従えば、オルガノイドの作成は、1900年代初頭にウィルソンが解離したスポンジ細胞が自己組織化し、生物全体を生み出すことができることを証明するまでさかのぼることができます3。
ヒト胚性幹細胞(ESC)の分離とヒト人工多能性幹細胞(iPSC)の樹立に成功し、オルガノイド技術に新たなフロンティアが開かれたことは、過去10年間の笹井グループとクレバースグループによる画期的な研究により顕著である。笹井らは、ESCが自己凝集して皮質組織や光カップに分化することを示し4、一方Cleversらは、腸管成体幹細胞(ASC)から生体内と同様のクリプトビラス構造を持つ腸管オルガノイドを作製できることを実証しました5。
それ以来、オルガノイドの定義は、ESCs、ASCs、iPSCから誘導された複数の臓器特異的細胞型を持つ自己組織化3次元細胞集合体で、構造構成、細胞組成、生理学、機能性の程度は異なるものの、生体内の対応する細胞を再現するものと広く受け入れられている。現在、3つの生殖細胞層から発生する臓器を模倣した様々なオルガノイドの作製に成功しており、その多くは複数の作製プロトコルが利用可能です。
また、オルガノイドは、先天性欠損症、癌、感染症、変性疾患など、様々な遺伝性疾患や疾病の研究に広く利用されています2。今回のCOVID-19のパンデミックにおいても、ヒトオルガノイドモデルは、SARS-COV-2感染に感受性がある様々な臓器における発症機構の理解に重要な役割を果たしており、これは対応する治療法の開発の鍵となります。7,8 さらに、疾患モデルへのオルガノイドの応用が成功すれば、薬剤スクリーニングや個別医療への新しいアプローチの扉を開くことになります。このような素晴らしい成果と急速な進化にもかかわらず、この分野はまだ初期段階にあり、いくつかの制限と満たされていないニーズが、より広い応用とより大きな影響の妨げとなっている。
大きな制約のひとつは、灌流可能な血管系がないことである。血管は、単に導管としての役割を果たすだけでなく、多くの生理的事象において重要な役割を果たしていますが、その主要な機能は、栄養、酸素、代謝廃棄物、さまざまな細胞の輸送であることに変わりはありません。灌流可能な血管系を持たない3次元培養のオルガノイドは、栄養、酸素、代謝廃棄物の交換を受動拡散にのみ依存しています。しかし、細胞の密度や代謝活性にもよりますが、拡散の有効距離は通常約300ミクロン以下であり、次第にネクロティックコアが発達していきます。9 血管を組み込むことで、オルガノイド全体のサイズと寿命が大幅に向上し、胚・胎児期を超えてオルガノイドが臓器に類似する鍵となり、臓器代替に用いられる可能性も出てくるかもしれません。さらに、ネクロティックコアを回避することで、正しい領域パターンとクロストークを確立することができ、オルガノイドはより高いレベルで生体内の生理・機能を再現することが可能になる。さらに、血管内皮によるパラクラインシグナル伝達や、基底膜と他の細胞種との相互作用により、オルガノイドの成熟度が向上する可能性もある。その結果、腸や大腸のオルガノイドのように、栄養や酸素の不足が制限因子とならない自己組織化した内腔構造を持つオルガノイドであっても、血管網を取り込むことで恩恵を受ける可能性があるのです。
近年、内皮細胞(EC)との共培養、中胚葉前駆細胞との共分化、in vivo移植、機械的刺激や誘導性遺伝子回路の組み込みなど、様々な手法でオルガノイドの血管形成能力を開発する努力が続けられている。10-12 現在までに、オルガノイド内の灌流可能な血管系は、宿主動物への移植によってのみ証明されており、そこでは、本来の血管系が異所性の移植片に侵入したり、あらかじめ血管を確保したオルガノイドと吻合することが確認されています11,13。
移植前にオルガノイドの前血管新生やECとの共培養が必要かどうかはまだ議論の余地があるが、適切な条件下では移植されたオルガノイドはやがて宿主によって血管新生されることは疑う余地がない。多くの場合、移植されたオルガノイドは、宿主の血管系とともに成熟度の向上を示し、オルガノイドに機能的な血管系を組み込むことの重要性がさらに示されている11,13,14。しかし、オルガノイド内で様々な程度の血管化が誘導されているものの、in vitroのアプローチでは、オルガノイド内での血管内灌流に成功した例はまだない。オルガノイド技術の急速な進歩に伴い、複雑な生物学的事象を研究するために、ホストされたオルガノイド全体に機能的な血管系を持つin vitroプラットフォームが急務となっている。例えば、臓器特異的な転移や免疫細胞の移動は、機能的な血管を通して対応する細胞を灌流することによって調べることができます。また、複数の血管を持つオルガノイドを直接血管床と接続することで、臓器間の相互作用の研究にも利用できる。さらに、このようなプラットフォームを用いることで、より成熟した生理学的に適切なオルガノイドを作成することができ、より良いオルガノイドモデルを提供することができます。
オルガノイド技術の発展と並行して、フィブリン、コラーゲン、マトリゲルなどの天然素材から、PEGやその誘導体などの合成生体適合素材まで、様々なハイドロゲルを用いてin vitroで機能的な血管を構築する方法論が確立されてきました15。 -17,19
前者は、3つの流路、中央のゲル領域、両脇の2つの培地流 路を持つマイクロ流体デバイスがよく使われます。数日以内に、ECは自己組織化し、灌流可能な内腔を持つネットワークを形成し、生体内の血管新生と血管新生の過程を模倣する。
自己組織化とは対照的に、プレパターニングアプローチは、多くの場合、様々な3Dプリント法を利用したり、犠牲材料を用いたりして、ハイドロゲルの足場を作ることから始まります20,21。
自己組織化された血管系とは異なり、構造、方向、形状があらかじめ定義されているため、単純なマクロスケールのチャネルでも、複雑なミクロスケールの血管でも形成することが可能です。このような努力に触発され、近年、ますます多くの試験管内血管組織が構築されてきています22-24。
これらの技術は、in vivo でバルクの組織や臓器を作るような組織工学に広く取り入れられ、オルガンオンチップシステムへと発展した。このシステムは、オルガノイド技術と並行して、対応する臓器の生理・機能を再現する多細胞 in vitro の器官型モデルを構築するという同じ目標を持っている25。
オルガンオンチップは、一般に、目的とする生理機能に必須と考えられる要素のみをマイクロ流体デバイスに集積し、細胞の種類、構造構成、微小環境などを精密に制御するものである。
一方、オルガノイドは、均質な造血幹細胞から始まり、自発的に自己組織化し、生体内を模倣した3次元構造へと分化していくことが多い。このような自己組織化の特性から、現時点では、オルガノイド全体に灌流可能な血管系を直接構築することは不可能である。
しかし、血管形成ハイドロゲルの進歩は、オルガノイドの血管形成のための有望な戦略である。さらに、血管拡張ハイドロゲルは、血管拡張前のオルガノイドをin vitroで培養する際の毛細血管床として適している可能性があり、内外の血管を吻合してオルガノイド内で機能的な血管内灌流を得るという長年の目標がある。
ここでは、PSC由来オルガノイドの血管新生とin vitro毛細血管床の構築に関する最新技術をレビューし、
さらに、埋め込み型オルガノイド全体に機能的な微小血管網(MVN)を構築することを目指して、これら二つのシステムを統合する戦略について、現在の課題と将来の方向性を強調しながら議論します。
2 オルガノイドの前血管形成技術
生体は本来、血管新生を促す能力を有している。これまでの研究から、あらかじめ内部血管が発達していないオルガノイドでも、生体内移植後に宿主によってうまく血管化されることが示されている。特に、顕著な血管網構造を持たずに外胚葉の発達を促すことで生成された脳オルガノイドがその一例である。Mansourらは、マウスモデルにhPSC由来の脳オルガノイドを移植し、オルガノイド移植片において機能的な血管系、アポトーシスの減少、神経細胞分化の改善を示した13。この例に基づくと、オルガノイド内に機能的血管を組み込むための実行可能な戦略は、in vitroで人工血管床にオルガノイドを埋め込み、近傍血管からの血管新生を誘導し、この自然のプロセスを単に発生させることであると思われる。しかし、線維芽細胞スフェロイドモデルや癌モデルを除いて26,27、このような戦略は、あらゆる種類のPSC由来オルガノイドの全体および内部に完全に灌流可能な血管系を形成することに成功したとは証明されていない。その上、いくつかのグループは、移植後の前血管形成オルガノイドの生存率と成熟度を著しく向上させたことを証明している。これらの証拠を総合すると、たとえ灌流が証明されなくても、オルガノイドの前血管形成は、in vitroで真に灌流可能なオルガノイドプラットフォームに不可欠な部分であることが示唆される。
本節では、PSC由来オルガノイドの前血管形成戦略について考察する。ここでは、オルガノイドの種類別に整理するのではなく、方法論別に分類する。なぜなら、これらの戦略は比較的汎用性が高く、様々な種類のオルガノイドに適用できると考えるからである。
2.1 内皮細胞との共培養
オルガノイドの血管新生で最も直感的な方法は、内皮細胞(血液やリンパ管の内表面を覆う単層の扁平上皮細胞)との共培養でしょう。この方法は、3つの生殖細胞層すべてから作製されたオルガノイドに適用され、さまざまな程度の血管新生が達成されている11, 14, 28。しかし、うまく実施するには、共培養のタイミングに関して慎重な計画が必要であり、オルガノイド作製プロトコルに強く依存する。今日、PSC 由来のオルガノイドを生成するために利用可能な多数のプロトコルは、大きく2つのカテゴリーに分類することができます。一つは胚性体(EB)の初期形成を伴うもので、胚発生前の胚とほぼ同様に3つの原始生殖層の初期発生を規定するPSCの3次元凝集体である。そして、生化学的な合図によって特定の1つの生殖層の発生が促進され、その後、特定のオルガノイドに分化していく。もう一つは、2次元単培養で造血幹細胞を前駆細胞に分化させることから始め、特定の器官の適切な機能に不可欠な複数の細胞型を混合し、最終的に目的のオルガノイドに成長させるアプローチである。後者の方法で作製されたオルガノイドでは、前駆細胞、EC、その他の支持細胞を混合して3次元凝集体を形成する混合ステップでECが組み込まれることが多い。例えば、Takebeらは、iPSC由来の肝内胚葉、ヒト臍帯静脈内皮細胞(HUVEC)、ヒト骨髄間葉系幹細胞(MSC)をMatrigel上に播種して血管新生肝芽(LB)を開発した11(Fig. 1A1)。ヒトiPSC-LBは、移植後さらに成熟が進み、高レベルのヒトアルブミンを産生するようになり ました。特に、移植後48時間以内に機能的な吻合が確立され、宿主血管から移植片内のヒト血管にデキストラン色素を灌流することによって確認された。これらの研究ではいずれも、ECを含まないコントロールのオルガノイドは血管新生と生着に失敗しており、移植前にオルガノイドの血管新生にECを組み込むことの重要性がさらに強調されている。
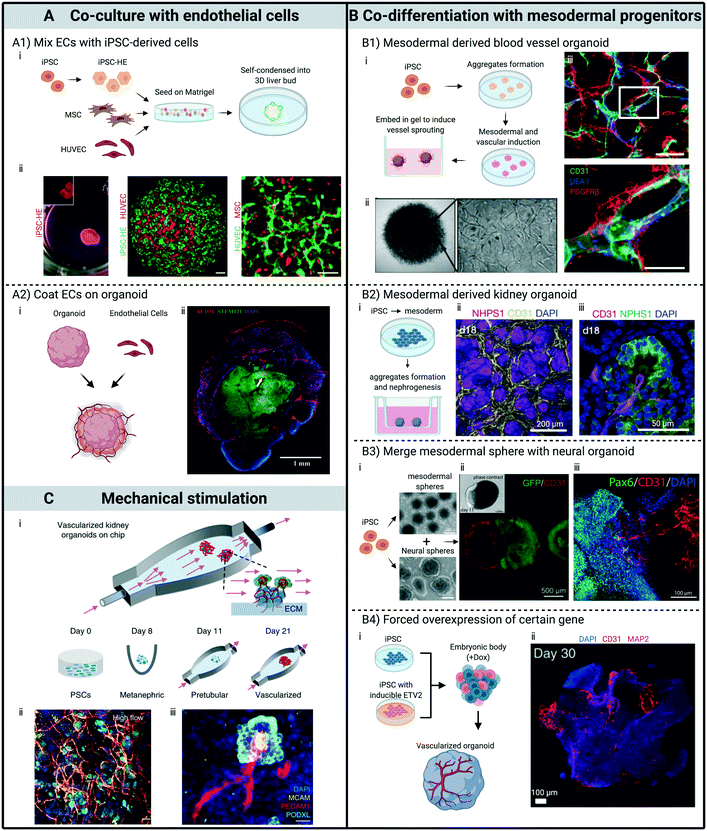
(i)はすべて、様々な前血管新生オルガノイドを開発するプロセスの模式図である。(A)ECとの共培養によるもの。(A1)ECとiPSC由来細胞を混合してオルガノイドを形成。ECはオルガノイド内で自己組織化し、ネットワークを形成した。スケールバー:100μm (A2)オルガノイド上のECの被覆。脳オルガノイドの外層に毛細血管が入り込んでいることを示す免疫染色(ECを塗布し共培養して20日後)。(B)中胚葉系前駆細胞との共分化により。(B1)中胚葉の発生と血管の指定を調節することによって形成されたヒト血管オルガノイド。成熟したオルガノイドは、周皮細胞(PDGFRβ)に覆われた内皮チューブ(CD31とUEA-I)を含んでいる。スケールバー、50μm。(B2)中胚葉由来の前駆細胞集団の誘導により発生した腎臓オルガノイド。培養18日目の(ii)腎間質内のCD31+内皮ネットワークと(iii)糸球体への浸潤を示す免疫蛍光画像。(B3)中胚葉前駆細胞スフェロイドと合体して発生した血管前駆神経オルガノイド。180日目にCD31+内皮ネットワークがPax6+神経部分に浸潤していることが免疫染色で確認された。(B4)ETV2を強制的に過剰発現させ、脳内オルガノイド内に血管形成を誘導する。20%の細胞でETV2を強制発現させた脳内オルガノイドでは、30日目に豊富な血管様構造を免疫染色で示す。(C)機械的刺激によるもの。腎臓オルガノイドは、外部流下で培養すると、血管形成と成熟が促進されることがわかった。血管マーカーの共焦点3Dレンダリングにより、(ii)豊富な血管構造、(iii)腎臓オルガノイドに壁せん断応力を制御した流れを与えると、さらに糸球体区画に拡張・侵入していることが明らかになった。(A1) 参考文献11より引用 11, with permission of Springer Nature. (A2) Wolters Kluwer Health, Inc.の許可を得て、文献28から引用した。 (B1) Springer Natureの許可を得て、文献41から引用した。41, with permission of Springer Nature. (B2) Springer Natureの許可を得てref.40から引用した。40, Springer Natureの許可を得て掲載。(B3)参考文献45,46から引用。45と46から、クリエイティブ・コモンズ・ライセンスのもとで許可を得て引用した。(B4)参考文献12から引用。12から引用し、Springer Natureの許可を得ている。(C)参考文献10から引用。10から引用し、Springer Natureの許可を得ている。
PSCsを複数の臓器特異的細胞型に共分化させるEB形成プロトコールに従って得られたオルガノイドでは、最初にPSCsとECを直接混合して3D凝集体を形成すると、しばしば異なる細胞集団の相分離や適切な細胞系列への分化の失敗が起こります31。しかし、EB形成プロトコールに基づいて作製されたオルガノ イドを血管新生させるために、後の時点でECを組み込むことは可能 です。Phamらは、34日目にiPSC由来のECを、同じiPSC株由来の脳オルガノイドに塗布しました。さらに2週間in vitroで培養したところ、オルガノイドの周囲にはCD31+構造が豊富に存在し、その外層には毛細血管様構造が成長していた。その後、オルガノイドをマウス脳に移植したところ、移植後2週間で血管があらかじめ形成された脳オルガノイドのみが生存した28(図1A2)。Songらは、D14でhiPSC由来の大脳皮質スフェロイドと同系統のECスフェロイドを組み立てた。このハイブリッドスフェロイドは、血液脳関門(BBB)タンパク質に関連する遺伝子発現レベルの上昇を示した。しかし、この研究では、ECが血管新生によって皮質スフェロイドの血管網を発達させたという証拠はない32。
特定のオルガノイドが模倣する生体内の相手に応じて、ECの種類も慎重に選択する必要があります。例えば、大脳のECは、アストロサイトおよび周皮細胞とともに、脳の微小血管系に典型的なタイトバリアを形成しています34。このタイトバリアは、受動拡散による一部の分子の通過や、様々な栄養素や高分子の選択的輸送を可能にするが、ほとんどの溶質、特に有害物質の中枢神経系への侵入を防ぐ35。対照的に、肝静脈毛細血管は、不連続な柵状内皮とその下に基底膜を持つ。この多孔質のバリアは、溶質やコロイドを肝小葉に確実に送り込むとともに、ガス交換、栄養吸収、スカベンジング、解毒などの肝機能の適切な実行に寄与している36。
現在、オルガノイドと共培養するために、様々な種類のECが利用されています。その中でもHUVECは、入手・培養が容易であることから、最も広く利用されています。さらに、HUVECは胎児の臍帯から採取されるため、PSC由来のオルガノイドが類似している胎児期や胚期の組織と適合していることも利用されています。プライマリーECの使用と比較して、iPSCは大量のECを生成するための無制限のソースを提供します。iPSC由来ECのもう一つの利点は、他のすべての臓器特異的な細胞種と3D凝集体で共分化できることで、生体内の臓器形成に酷似しています。37-39 さらに、患者特異的なiPSC細胞を用いてECとそれに対応するオルガノイドの両方を作製することは、異種移植片に対する宿主の複雑な免疫反応を避けることができるため、再生医療などのトランスレーショナルアプリケーションにおいて最も有望視される可能性があります。
2.2 中胚葉系前駆細胞との共分化
胚の血管系の発生は、中胚葉由来の血管芽細胞の分化に始まり、十分な栄養と酸素、そして成長因子を供給して胚の器官を生体内で急速に成長させるために器官形成と密接に連携している。中胚葉は胚発生中のEC前駆細胞の唯一の供給源であることから、オルガノイドの成長と同時に中胚葉の発達を促し、さらにECに分化させることも、オルガノイドの前血管形成のための戦略として可能である。しかし、EC共培養と比較すると、導入のタイミングや得られるECの数をコントロールすることは容易でない。しかし、共分化法は器官形成における新生血管の発達をより忠実に模倣しているため、器官形成や組織形成につながる発生事象の研究において、しばしば好んで使用される。さらに、オルガノイドの発生と同時にECを共分化させることで、このシステムに魅力的な複雑さが加わり、発生段階におけるECを含む異なる細胞タイプ間の複雑な相互作用を研究する機会を提供する。
中胚葉から発生したオルガノイドからは、しばしばPSC由来のECが自然発生的に得られるが、これは中胚葉由来という共通点によるものと思われる。2015年、Takasatoらは、腎臓間充織前駆細胞に対する集合管前駆細胞の優先的誘導を制御する既知の発生メカニズムを利用して、集合管ネットワークに関連するネフロンを含む腎臓オルガノイドを作成した40。驚くべきことに、培養18日後に内腔を持つ内皮ネットワークが形成され、内皮に沿ってPDGFRα+血管周囲細胞と糸球体に侵入する初期の中膜細胞は、ヒト胎児腎で認められたようだった (Fig. 1B2)。Wimmerらによって報告されたヒト血管オルガノイドは、もう一つの優れた例である。著者らは、ヒトiPSC凝集体の中胚葉の発生とその後の血管の仕様を誘導するために、多段階のプロトコルを開発した。この人工血管は、周皮細胞、内皮細胞、間葉系幹細胞、造血系細胞からなり、基底膜に包まれた自己組織化毛細血管網を有していた(Fig. 1B1)。血管オルガノイドは、移植後、動脈、細動脈、細静脈を含む安定した灌流血管樹を形成した。このヒト血管は、糖尿病患者の血管の構造的・機能的変化を忠実に再現しており、糖尿病性血管障害のモデル化および制御因子の同定に信頼性の高いツールとして使用することができる。
成長因子と培地の適切な組み合わせにより、中胚葉の発育を他の胚葉とともに誘導し、内胚葉または外胚葉由来の血管性オルガノイドを生成することができる。Wuらは、肝分化培地に25%のmTeSRを添加することにより、内胚葉と中胚葉の一部を同時に誘導し、ヒトiPSCから機能的な肝胆膵オルガノイドを作成する方法を報告しました42。この処理により、初期の肝分化はわずかに遅れましたが、胆道指定が行われるようになりました。肝細胞様細胞と胆管細胞様細胞のオルガノイド内での共分化が目的であったにもかかわらず、15日目には中胚葉由来の内皮細胞がオルガノイド全体に管状構造として出現した。一方、中胚葉と外胚葉の共発達を促進することは、ある経路を活性化して細胞を外胚葉の運命に導くと中胚葉の分化が制限されることが知られており、依然として困難である43。 Hamらは、大脳オルガノイドの生成過程で血管内皮増殖因子(VEGF)を補充し、ECマーカーを発現する血管構造を観察した。Wörsdörferらは、別々に培養した神経球と中胚葉球を後期で融合させるという異なる方法をとり、180日共培養後に集合体の神経部と中胚葉部の界面からCD31+構造が神経組織へ侵入することを確認した(図1B3)。しかし、中胚葉部には広範な血管網があるにもかかわらず、神経部では血管の発芽はほとんど見られなかった45,46。
遺伝子工学の進歩は、適切な成長因子のカクテルを見つけるという面倒な作業を回避して、共分化によってオルガノイドを血管化するための解決策を提供する可能性を持っている。2015年にMoritaらがETS転写因子2(ETV2)を介してヒト線維芽細胞を機能的な内皮細胞に変換する方法を報告して以来47、内皮および造血系への細胞の特定におけるETV2の役割は、広範囲に研究および利用されています。Wangらは、中胚葉分化の中間段階でETV2をコードする改変mRNAを時間的に送達することにより、13種類のヒトiPSC株を機能的なECに分化させる際に極めて高い効率(90%以上)を達成しました48。Cakirらは、この技術を利用してオルガノイドを血管新生させた最初の研究者である。ドキシサイクリン(Dox)誘導性ETV2遺伝子を導入したiPSCを最初の3次元凝集体に20%組み込むことで、従来の脳オルガノイド培養プロトコールに従ってオルガノイド内に血管構造を発現させることに成功したのである。血管が形成されたオルガノイドは、血管のないオルガノイドに比べ、成熟した神経細胞が多く、高い神経細胞活性を示すことが確認された。さらに、血管を形成した脳オルガノイドを移植すると、コントロールオルガノイドよりも血管の透過性が低下し、灌流が促進された12 (Fig. 1B4)。本研究で得られた顕著な知見の一つは、ETV2を過剰発現したiPSCのサブセットが、外胚葉の運命に分化を誘導する成長因子を含む培養液中でさえ、依然としてECに強固に分化できることである。この結果は、内部転写因子の過剰発現が、外部の微小環境における分化シグナルとは無関係に、あるいはそれを上書きして作用することを本質的に示唆している。これは、ECをシステムに組み込むためのかなり汎用的な方法論であり、あらゆる種類のオルガノイドに広く適用できる可能性があると考えられる。ETV2の活性化がECへの分化を誘導するという特異的な機能を果たすのに比べ、より特異性の低い転写因子を過剰発現させると、内皮前駆細胞を含む複数の前駆細胞が生成されることがある。Guyeらは、GATA6を異種発現させたiPS細胞から肝臓の蕾のような組織を作製しました。一過性の強制的なGATA6発現により、内胚葉および中胚葉由来の前駆細胞が、GATA6発現レベルおよび組織状況の複雑な関数として、急速に出現した。2週間以内にCD31+細胞とCD34+細胞が出現し、血管様ネットワークを形成し、その周囲にはCEBPα、HNF4α、分泌型α-1アンチトリプシン(AAT)等のマーカーを発現する肝運命を担う細胞からなる微細構造が形成されました。また、AAT、アルブミン、フィブリノーゲンの安定した産生により、胎児肝様機能も確認されています。さらに、CD45やヘモグロビンを発現する小さな球状の細胞が14日目以降に内皮管から出芽し、15日目にはヘモグロビンγが有意に上昇しており、胎児の赤血球形成が確定的に示唆されています49。
2.3 機械的刺激
発達中の血管は、隣接する細胞外マトリックス(ECM)の粘弾性特性から血管周囲の細胞によって生じる牽引応力まで、生体内で様々な力学的手がかりにさらされる。また、ECは循環血流と周辺組織の界面を形成しているため、脈動血流や一方向の血流、経壁流、間質流によって生じるせん断応力にもさらされている。in vitroでの血管新生、血管新生、3次元毛細血管形態形成に対する力学的要因の影響を調べるために作られた様々なマイクロ流体プラットフォームは、生理学的に機能する血管系の誘導と維持に力学的合図が重要な役割を果たすことを確認しました15、50、51 オルガノイド開発に関しても力学的要因の重要性がますます認識されてきています。マイクロ流体装置内の膵島および腸のオルガノイドモデルでは、発育中のオルガノイドに連続的な培地フローを与えることの利点が報告されています52,53。
しかし、機械的要因は、血管系やオルガノイドの発生において生化学的要因と同様に重要である可能性があるにもかかわらず、その研究は非常に少なく、おそらく個々の機械的要因を調査したり実装するのに適したプラットフォームを設計するのが複雑なためであると考えられます。したがって、バイオメカニカル制御の欠如は、成熟したオルガノイドやより生理学的に適切なモデルをさらに開発するための決定的な制限として認識されている。2019年、Homanらは、カスタマイズされたハイドロゲルの上で腎臓オルガノイドを流動下で培養するin vitro方法を報告し、オルガノイド内のECネットワークの形成とオルガノイドからの発芽を誘導しました10(図1C)。私たちの知る限り、これは機械的刺激のみによってオルガノイド内の血管系が改善されることを示した唯一のin vitroアプローチである。流れによるせん断応力は、内皮前駆細胞の内在性プールを拡大し、内皮前駆細胞はさらに分化して血管網へと自己組織化し、場合によっては尿細管と密接に関連した糸球体構造へと成長することが分かった。10日間フローさせたオルガノイドは、無フローのコントロールオルガノイドと比較して、成熟が促進され、尿細管上皮トランスポーター、成体転写因子の発現が増加し、糸球体の血管形成と足部プロセスの成熟が促進されました。この研究で使用したECMの組成と培養液中のウシ胎児血清の添加は、内皮ネットワークの拡大に同様に寄与すると思われるが、フローによるシアストレスの組み込みは、血管構造の改善と成熟の発達に重要な役割を演じた。
このセクションで述べた方法論は、試験管内の微小環境を正確に制御できるという利点を持つマイクロ流体技術の統合と相乗的に作用する可能性があります。これには、成長因子、モルフォゲン、およびECMの硬さ、応力、間質および対流によって引き起こされる圧力勾配などの力学的因子の空間的・時間的分布が含まれる。オルガノイドモデルでは様々な程度の脈管形成が達成されているが、いずれも生体内移植なしに完全に灌流可能な機能を持つことはまだ証明されていないことに注意すべきである。従って、オルガノイドはまだin vitroで真に血管が形成されたとは言えない。
3 in vitroにおける機能的毛細血管床の構築
オルガノイドモデルで灌流を実現するための大きな制約の一つは、内部の血管系と周囲のECMに存在する外部機能的血管との機能的吻合を開発することである。灌流可能な試験管内毛細血管床の工学的な関連分野の進歩は、前血管形成されたオルガノイドを受け入れるのに適した様々なプラットフォームを提供し、その結果、開発したオルガノイド全体で完全に灌流できる試験管内システムという最終目標に近づいてきている。このセクションでは、血管形成ハイドロゲルおよび関連するマイクロ流体デバイスを設計するための利用可能な技術に焦点を当てます。これらは、自己組織化と事前パターン化の2つの大きなカテゴリーに分類することができます。
3.1 自己組織化血管網
これらのデザインは、自然の自己組織化および自己組織化の原理を利用し、生体内で血管形成および血管新生が起こるような条件を促進するものである。自己組織化アプローチの大きな利点は、生体内の血管の成長・発達過程と類似しているため、ハイドロゲル内のECが自発的に血管を形成し、機能と形態の両面で生体内の対応するものを模倣できることである。生体内では、発生途上の胚で血管新生が起こり、最も初期の一次血管叢が形成される。これは、中胚葉細胞が血管芽細胞に分化することから始まる。54 In vitroの血管新生モデルは、一般的にマイクロ流路を利用し、ECを含む様々な種類のハイドロゲルを播種することができます16,17,55。Whislerらは、このアプローチに従って、ヒト肺線維芽細胞(HLF)と共培養したフィブリンゲル中にHUVECを播種し、正確に間隔をあけたマイクロポストで仕切られた3本の平行流路を持つマイクロ流体チップの中央領域に配置しました(図2A1)。このため重合前の液体ゲルが中央流路に閉じ込められました(図2B)。その後、培養液を外側の流路に導入し、血管系の発達を支援した。この結果、蛍光ビーズまたはデキストラン色素の灌流によって確認されるように、4-7日で灌流可能なネットワークが形成された。細胞の播種密度、フィブリノゲン濃度、追加のVEGFやスフィンゴシン-1-フソファート(S1P)などの複数の要因が、微小血管網の形態的特性に影響を与えることがわかりました17。驚くべきことに、支持細胞との共培養は、網の退行を回避し1週間以上安定した血管を維持するために重要であることがわかってきました。HLFの他にも、脂肪組織由来間質細胞56やMSC57がin vitroでMVNを長期間維持するために支持的な役割を果たすことが、他の研究によって明らかにされている。同様の機能的な毛細血管床は、様々な設計のマイクロ流体デバイスによって得られている。例えば、Moyaらは、高スループットマイクロ流体プラットフォームに統合された複数のダイヤモンド形状のゲル領域上でヒト毛細血管床を培養した。15 Xiaolin Wangらはさらに、ダイヤモンド形状のマイクロ流体デバイスをECライニング戦略と統合し、毛細血管ネットワークと大きなECライニングマイクロ流体チャンネル間の吻合を証明した58。

(A)自己組織化により形成された血管系。(A1) 血管新生により形成された血管床。(i)マイクロ流体デバイスの中央ゲルチャネルにECと線維芽細胞の混合物を注入することにより、1週間で灌流可能な血管系が形成される様子を示す模式図。(ii) 7日目には、ECは自己組織化し、連続した細胞間結合タンパク質VE-cadherinを発現し、内腔の周りにコラーゲンIV基底膜を沈着させた生体様毛細血管となった。(iii) 70 kDaデキストランの灌流により内腔の開存が確認された。スケールバー、20μm。(A2)血管新生とそれに続く埋没スフェロイドとの一体化により形成された血管床。(i)中央ゲルチャンネルの界面に播種したECから誘導された血管新生萌芽によって血管新生した繊維芽細胞スフェロイドを示す模式図である。スフェロイド内の灌流は、(ii)デキストラン色素および(iii)マイクロビーズの導入により確認される。(B) プレパターニング技術によって作製された血管系。(B1)一時的な足場の周りに形成された機能的な血管網。(i)細胞を含むマトリックスが一時的な足場を取り囲むように導入され、その後、取り除かれるか溶解される様子を示す模式図である。その後、開いたチャネルにECが導入され、元の足場と同じような血管構造が形成される。(ii) 代表的なチャネルの断面画像は、内皮化した特許内腔を示す。スケールバー、200μm。(B2)あらかじめ設計されたパターンに従って細胞を含むバイオインクを直接堆積させることにより、アディティブバイオプリンティング法で作製した血管構造体。(i) バイオプリンティングによる内皮化心筋の作製過程を示す模式図。(ii)共焦点蛍光画像は、ECによって形成された管状構造を示す。(iii) バイオプリントされた内皮化血管構造体上に心筋細胞を播種して形成された内皮化心筋組織を示す模式図および共焦点蛍光画像。(A1)文献から引用した。55, Oxford University Pressの許可を得て引用。(A2)オックスフォード大学出版局の許可を得て、文献26から引用した。(B1) Springer Natureの許可を得て、文献20から引用した。(B2)Elsevierの許可を得て、文献21から引用した。
新しい血管を生成するもう一つの重要な生理的プロセスは、血管新生である。血管新生とは異なり、血管新生は既存の血管から血管新生萌芽を開始する。血管新生促進因子に応答して、ECはプロテアーゼによりECMを分解して親血管壁から脱出し、無血管領域への新血管の成長を可能にする。59,60 ECMの酵素分解、EC増殖、浸潤、管形成、血管安定化を含むこのプロセスを広範囲に調べるために、数多くのマイクロ流体モデルやハイドロゲルに基づくアッセイがデザインされてきた50, 61, 62。 このようなハイドロゲルをPDMSベースのマイクロ流体装置に組み込むと、1週間以内にゲル領域の大部分にわたって先端細胞の移動と管腔の形成が可能になり、時には機能的な血管床に至ることもあります。反対側からゲル内に萌芽したHUVECは互いに融合し、血管新生によって自然に灌流可能なMVNとなりました26,27 (Fig. 2A2)。機能的な血管は、異なる播種戦略によって、同じマイクロ流体プラットフォームで血管新生または血管新生のいずれによっても得ることができる。例えば、Kimらは、2つの培地チャンネルで区切られた3つの平行なゲル領域を持つマイクロ流体チップを設計した。19 マイクロポストも、ゲルを対応するチャンネルに閉じ込めるのに十分な表面張力を発生させるように配置された。中央のゲルチャンネルにHUVECを、外側のゲル領域にHLFを播種するか、あるいは中央のチャンネルを満たしたアセラーフィブリンのマトリックスの左側壁面にHUVECを、外側のチャンネルに反対側のHLFを播種すれば、それぞれ血管新生または血管新生により灌流可能な血管を確立することができる。
自己組織化したin vitroのMVNとin vivoの毛細血管の類似性は、形態と機能の両面から多くの研究によって証明されています。CD31、血管内皮(VE)-カドヘリン、タイトジャンクションタンパク質zonula occuldins-1(ZO-1)、ラミニンやコラーゲンIVなどの基底膜タンパク質などのネットワークの接続性と成熟度を示すために免疫蛍光がよく使われる, 15,19,66
灌流は、培地に蛍光色素を導入し、血管の充満を画像化することで最もよく判定されるが。さらに、in vitroの自己組織化3Dネットワークの完全性と適切なバリア機能は、透過性の測定によって特徴づけられ、同じ細胞を用いたトランスウェルでの測定値よりも最大で2桁低く、in vivoでの観察値と同等であることが示された19, 55, 69, 70。70,71 生体内の機能をさらに再現するために、関連する種類の細胞を共培養し、自己組織化アプローチによって器官型血管系が設計された。Campisiらは、iPSC由来内皮細胞と初代脳周皮細胞およびアストロサイトからなる三培養系を用いて、ヒトBBB微小血管モデルを開発した34。このモデルは、灌流可能で選択的な微小血管を示し、透過性は従来のin vitroモデルより低く、ラット脳のin vivo測定値とほぼ同じであった。HUVECと支持細胞から開発された血管系と比較すると、オーガノタイプの血管系は、より生理的な微小環境を提供するので、宿主であるオルガノイドにとってより有益である可能性があります。
最近、このような自己組織化された灌流可能な血管を、マイクロ流体デバイス内の大きな組織と統合する試みもなされている。Nashimotoらは、HUVECsとHLFsを混合したスフェロイドを同様の3チャンネルデバイスの中央部に播種して、このアイデアを実証した。続いて、HUVECが中央ゲルの両側壁に播種された26(図2A2)。共培養したスフェロイドから分泌される血管新生因子に刺激され、側壁のECは血管新生芽としてゲル内に侵入し、スフェロイドに向かって到達した。4日目には、共培養スフェロイドと側壁から発生した血管がスフェロイドの周辺部で合流し、吻合していた。驚くべきことに、これらの機能的な吻合は、スフェロイドを含む中心ゲル全体に完全に灌流可能なネットワークを形成し、スフェロイドのコアへの蛍光デキストラン色素の灌流に成功したことで証明された。同じプラットフォームと戦略を用いて、彼らは最近、EC、HLFおよび癌細胞を混合して形成された、完全に灌流可能な癌スフェロイドを実証しました。27 PSC由来のオルガノイドに同じアプローチはまだ実施されていませんが、この研究は、in vitroでオルガノイドと末梢毛細管床を通して完全に機能する血管を実現する有望な戦略を提供しています。
3.2 プレパターニング
単一血管から生体内のような複雑な血管系まで、事前に定義された形状を持つ特徴的な機能的血管床が、様々なプレパターニング技術によって実証されています。これらはさらに、減法的アプローチと加法的アプローチに分類することができます。
サブトラクティブアプローチでは、通常、あらかじめ重合したハイドロゲルを一時的に鋳型に流し込んで、ハイドロゲル内に3Dチャネルのネットワークを形成する。この鋳型はその後溶解または除去され、灌流のための中空チャネルが残る。その後、ECをチャネルに播種し、チャネル壁面に単層を形成させます(Fig. 2B1)。例えば、Chrobakらは、ステンレス針を抜いてコラーゲンゲル内に形成した中空チャネル内にECを播種し、灌流可能な内皮チューブを作製しました。72 犠牲材を用いた成形は、一軸の単血管にとどまらず、複雑な血管網を構築する可能性がある。Millerらは、3Dプリントした糖質ガラス格子を生体適合性のある犠牲テンプレートとして用い、生きた細胞を含むECMに埋め込んで血管組織を作成する方法を報告した20。この格子は、完全培地に10分間浸漬すると容易に溶解し、ECが生息しうる相互接続した円筒状のチャネルが残った(図2B1)。この研究で、著者らは、直径150〜750μmの灌流可能なネットワークを実証することに成功した。最近、犠牲となる足場から作られた機能的な血管網が、オルガノイドベースの組織の開発をサポートするために採用されている。Skylar-Scottらは、コラーゲンとマトリゲルの溶液中に多数のPSC由来オルガノイドを凝縮させ、細胞密度の高い血管組織を作製した76。その後、ゼラチンでできた犠牲インクで溶液中に足場を印刷し、それを溶かしてECを播種した。この方法により、長時間灌流すると融合し、同期して拍動する灌流可能な心筋組織が作製された。しかし、印刷された血管の直径が大きかったため、微小血管が形成されておらず、このことが、この心筋組織で観察された収縮力が比較的低かったことの一因と考えられる。サブトラクティブな方法でハイドロゲル内に複雑なチャネルを形成するもう一つのあまり一般的でない方法は、レーザー切断システムで直接穴を開けることである。77,78 しかし、この方法を最大限に利用するには、ハイドロゲル材料がレーザー波長に対応する適切な特性を備えていなければならず、利用できる材料の選択肢が限られる。しかし、これらの方法のいずれにおいても、直径の小さな チャンネルは内皮化が困難であるため、この方法で形成され たネットワークのほとんどは毛細血管サイズの血管を欠いて いるという制約がある。
例えば、3Dバイオプリンティングにより、目的の細胞を組み込んだハイドロゲルを層ごとに堆積させることで、試験管内血管床を付加的に得ることも可能である。この方法によって、あらかじめ設計されたパターンや配列で、ECを他の細胞タイプとともに堆積させることにより、さまざまな血管のあるin vitro組織が設計されてきました21,79-81。一例として、Zhangらは、まず血管系足場を、EC21を含むカスタマイズしたバイオインクで印刷し、内皮化心筋を作製しました(図2B2参照)。足場は、印刷後、UV照射による架橋でさらに安定化された。その後、ECはマイクロファイバーの周辺に移動し、一般に15日目頃までにコンフルエントな内皮を形成した。その後、心筋細胞を3次元内皮床に播種し、自発的かつ同期的な収縮が可能な整列した心筋を作製しました。ECはまた、同軸フィラメントの印刷によって、他の細胞とともに特定のパターンで印刷することもできる。Leongらは、細胞を含んだ高分子電解質ハイドロゲル繊維を個々に調整し、中心をEC、周囲を肝細胞や脂肪細胞前駆細胞で囲んで、パターン化した肝臓や脂肪組織の構築物を作りました81。オルガノイドの血管形成にプレパターニング技術を応用することについてのより詳しい議論は、文献にあります。82.
以上のようなアプローチには、それぞれ長所と短所がある。プレパターニング技術によって作られた血管床の形状は、完全に制御することができる。しかし、一時的な型を作る材料の物理的限界、バイオプリントに用いるノズルの大きさ、小径の穴にECを移行させることの難しさなどから、形成し内皮化できる血管の直径(100μm以上)は通常、生体内の毛細血管の直径よりも一桁大きくなる。一方、自己組織化MVNは、形態・機能ともに生体内の毛細血管を模倣しているが、自然に形成される血管系の形状をあらかじめ定義することはできない。幸いなことに、複合的な方法は、まず一時的な成形によって 血管足場を形成し、その後、血管新生萌芽を誘導して、ECが並んだ 内皮から周囲のゲルに成長させて、生体内の毛細血管のようにすることで、 両方の戦略の利点を得ることができます83,84。
4 試験管内血管床と血管形成前のオルガノイドとの間の吻合の確立
これまで、3つの生殖細胞層すべてに由来する血管形成前のオルガノイドを得るための多くの技術、および生体内の毛細血管の形態と機能の両方を再現するさまざまな人工血管床について述べてきました。しかし、この2つのアプローチを組み合わせて、血管床とオルガノイド全体にわたって完全に灌流可能なシステムを構築するには、まだ課題が残っています。主な課題は、機能的な吻合を実現するために、あらかじめ血管を形成したオルガノイドと毛細血管床をin vitroで完全に統合することと、この共培養システムの開発を支援する適切な微小環境を構築することにある。このセクションでは、考慮すべきいくつかの重要な要素に焦点を当て、さらにin vitroでオルガノイドと血管床の機能的な吻合を確立するための可能な戦略について述べます。
ハイドロゲルの選択は、オルガノイドと毛細血管床を共培養する際に考慮すべき最も重要な点かもしれません。ハイドロゲルは、足場となるマトリックスを提供するだけでなく、多数の有益な成長因子や接着分子を補い、さらにオルガノイドと血管系の発達を促進するために適切な機械的支持とシグナル伝達を提供します85。オルガノイドや血管床の培養には、生体親和性に優れ、細胞親和性に優れ、入手が容易な天然素材が圧倒的に多く採用されています。しかし、オルガノイドと発達中の血管床では、しばしば異なる培養条件や異なるハイドロゲルを必要とすることに注意しなければならない。オルガノイドの発生過程では、Engelbreth-HolmSwarmマウス肉腫に由来し、天然のECMに酷似したマトリゲルに埋め込まれることが最も多い。その代わりに、機能的なin vitro MVNは、一般的にコラーゲンやフィブリン内で増殖させ、局所マトリックスがECやFBによってリモデリングされ、管腔が形成される15,17,67。実験デザインにおいては、共培養を成功させるため に、支持マトリックスの適合性を最適化する必要がある。ごく最近、Rajasekarらは、患者由来の結腸オルガノイドを自己組織化した血管網内で共培養するマイクロ流体チャンバーを作製しました86。同様に、彼らは、ECはマトリゲル中ではなくフィブリン中で自己組織化して機能的血管を形成するが、結腸オルガノイドはマトリゲル中で適切に発達するがフィブリン中で増殖しないことを見いだしました。このジレンマは、オルガノイドと血管系の両方の発生をサポートすることが示されている、フィブリンと10%マトリゲルの混合ハイドロゲル中で共培養することで解決された。さらに、この装置をプログラム可能なロッカーに設置し、毛細血管床を流れる腔の周期的な流れを維持した。従来の静止状態に比べて、結腸オルガノイドは、このようなプラットフォームで一定の灌流を行うことで著しく成長した。しかし、大腸オルガノイドのごく近傍に灌流可能な血管が存在することは、組織学および蛍光粒子の灌流によって確認されたが、オルガノイドへの血管内灌流や内部の血管系との機能的吻合を直接証明するものはまだ存在しない。
支持マトリックスに加えて、培養液も最適化する必要がある。EC用培地は、VEGF、EGF、FGFなどECの増殖に不可欠な成分を含み、血管の発達や機能維持のために一般的に使用されています。一方、オルガノイド用培地は、特定の細胞系譜への効率的な分化を促進するために様々な成長因子を含んでいます。通常、内皮細胞用培地とオルガノイド用培地の組み合わせ比率を変えて滴定することで、共培養システムをサポートする最適な混合培地を決定することができる。ただし、混合培地にオルガノイドやMVNsの発生を妨げる阻害物質が含まれていないことが条件である。ほとんどの場合、オルガノイドは、均質な造血幹細胞が自己組織化した細胞構造を持つ前駆細胞に分化する時期まで、最初は標準的なオルガノイド形成プロトコルに従って別々に培養された。未分化なPSC集合体と早い段階で共培養すると、培地中の血管成長因子やECからのパラクラインシグナルの存在により、オルガノイドの正常な発生が阻害されると思われる。Dox誘導系を利用すれば、内部の転写因子を強制的に過剰発現させることで、微小環境における分化シグナルを上書きすることができるが、現時点では利用可能な遺伝子回路がほとんどないのが現状である。
現在の共培養法の多くは、あらかじめ作製した血管床の上にオルガノイドを播種したり、オルガノイドをECや他の支持細胞とともにハイドロゲル混合物に包埋することから始まる。これは、オルガノイドをハイドロゲル内に封じ込めずに懸濁液中で培養する、いくつかのオルガノイド培養プロトコルと相反するものである。しかし、ハイドロゲルに包埋するか、低粘着性プレートや懸濁液で直接培養するか、オルガノイドを増殖させる特定の微小環境を選択することは、依然として経験的考察によるところが大きく、多くのアプローチが可能であり、試されてきた。ハイドロゲル内に包埋されないオルガノイドは、共培養に適している可能性があります。しかし、発育中のオルガノイドを丸底の超低密着性プレートに置く代わりに、マイクロ流体チャンバー内でゼラチンとフィブリンからなる最適化ハイドロゲルの上に播種したのです10。マトリックスとの直接接触により、血管マーカーPECAM1の末梢発現が上昇し、血管網が隣接するECMに伸長し、オルガノイドの上部に外部せん断応力を与えると、さらに改善されました。このように、「インサイドアウト」アプローチにより、完全灌流システムを構築できるかもしれません。オルガノイド内に形成された血管網は、周囲のマトリックスに拡張・成長し、マイクロ流体デバイスの灌流チャンネルに到達するか、隣接するMVNと合流します(Fig.3)。このメカニズムは、高度な生物工学技術によってマトリックス内の血管新生促進因子の時空間分布を正確に制御することで、より強固に確立することができます88。

オルガノイドを毛細血管床に埋め込む前、オルガノイドは自己由来の血管網を有している。埋め込み後、ハイドロゲル内の血管(赤)とオルガノイド由来の血管系(青)は、「インサイドアウト」または「アウトサイドイン」方式で機能的に接続されるようになる。前者は、オルガノイド由来の血管が周囲のECMに拡張・伸展し、ハイドロゲル内の確立されたMVNと吻合することに依存する。後者は、血管床を構成していたECから血管新生萌芽が誘導され、オルガノイドを貫通してオルガノイド由来の血管に接続することで駆動する。
あるいは、機能的な吻合は、同様に血管新生によって駆動される逆の「アウトサイドイン」メカニズムによって得られるかもしれない(図3)。これは、外部の血管床を構成するECから血管新生萌芽を誘導してオルガノイド内に侵入させ、オルガノイド内に提示されたECや内皮前駆細胞によって形成された血管に接続させるというものである。このような機構は、あらかじめ血管が形成されたオルガノイドを生体内に移植した後に、宿主の血管系が移植片に侵入し、機能的に結合して血管形成オルガノイドを確立する過程に酷似している11。この機構を活性化するために、VEGFなどの血管形成促進因子が、コアに見られる低酸素状態に対する自然の反応としてオルガノイド内の実質細胞から分泌されている。さらに、前節で述べたように、スフェロイドは同様のアプローチで内部血管系を発達させ、灌流できることが証明されている26,27。
5 結論と展望
過去 10 年間にオルガノイド技術は急速に進歩しましたが、機能的な血管系を持たないこ とは、in vivo 生理学を効果的に再現することを妨げる大きな障壁の一つと広く認識されています。今日まで、オルガノイドの完全な血管内灌流は移植によってのみ報告されており、オルガノイドを臓器機能や疾患の便利なin vitroモデルとして使用することの利点の多くが否定されている。したがって、オルガノイドの生物医学的応用を拡大するために、埋め込まれたオルガノイド全体に機能的な血管系を組み込んだ人工的なin vitroプラットフォームが急務である。この総説では、私たちのコミュニティがこの目的を達成するために必要なステップと可能な手段について議論した。これには、あらかじめ血管を形成したオルガノイドの作成、あらかじめ確立した毛細血管床へのオルガノイドの埋め込み、オルガノイドと外部MVNとの機能的吻合の確立などが含まれる。
オルガノイドに血管系を組み込むことには、多大な努力が払われてきました。様々なタイプのオルガノイドのプロトコールが数多くあるにもかかわらず、それらの戦略の多くはむしろ一般的であり、我々が議論した特定の例を超えて拡張する可能性を秘めています。現時点では、それぞれのタイプのオルガノイドには、通常、複数の異なる生成プロトコルが関連付けられており、そのほとんどは、まだ経験的な考察に基づくものです。機能的特徴、相対的な細胞構成、生成の効率といった点で、異なるプロトコルの間の詳細な比較はほとんど行われていません。さらに、実質細胞との複雑な相互作用、適切な微小環境、関連するサイトカインや成長因子など、血管の発達を促進する多様なメカニズムや因子を特定する上で、我々の知識はまだかなり限定的である。今後、オルガノイドの血管形成に関連する生物学の基礎に新たな焦点が当てられ、特に機械的な合図や新しい遺伝子回路を利用した血管形成のメカニズムが発見されることが予想されます。このように、血管形成は、複数の因子を統合し、最適なオルガノイド誘導プロトコルと相乗的に作用させることで、より強固で効果的な方法でオルガノイド内に誘導されることになるであろう。
このような血管は、あらかじめ形成された流路網に播種するか、あるいは自然な自己組織化、自己集合によって形成されるのが一般的である。現時点では、播種したECの血管新生あるいは脈管形成による3Dハイドロゲルマトリックス内の自己組織化血管網は、自己組織化血管網が形態および機能の両面において生体内の毛細血管に酷似しているので、血管構築前のオルガノイドを宿す方法として選ばれている。しかし、バイオプリンティングとスキャフォールディングの急速な技術進歩により、近い将来、毛細血管スケールで内皮を持つ血管を作製することが可能になると予想されます。これは、特定の形状、細胞組成、関連する成長因子の時空間分布をあらかじめパターン化した、生理学的に適切で完全に制御された血管系の作製を促進することを約束するものである。この方法が、自然の自己組織化よりも効果的であることが証明されるかどうかは、まだわからない。また、長期培養では、オルガノイドの成長と発達に伴って必要と思われるネットワークのリモデリングの重要性についても疑問が残る。
共培養を成功させるためには、オルガノイドと人工血管の両方の発生と成長をサポートするために、外部支持マトリックスを最適化する必要があります。現在、ほとんどのアプローチは、その生体適合性と利便性から、天然のハイドロゲルを採用している。しかし、天然のハイドロゲルは、機械的特性やリガンドの提示を個々に制御することが難しく、容易に変更することができない。さらに、例えばMatrigelのような動物由来のマトリックスの組成は十分に定義されておらず、バッチ間のばらつきがあるため、実験間の再現性が制限されることがある。逆に、完全に定義された合成ハイドロゲルは、微小環境の物理的・生体分子的特性を完全に制御して信頼性を向上させるのに適した3Dマトリックスとして機能する可能性があることが実証されています。iPSC-ECは、プライマリーECと同様に機能的な血管を 形成する能力があることが証明されています68,91。このことは、PSC由来のECは、埋め込まれたオルガノイドの存在下で、複雑な相互作用を通じて、器官型の血管系を形成するようにリモデリングし進化する可能性が高いため、潜在的に有益であると考えられます。血管内灌流が可能になれば、真に機能的な血管系をオルガノイドモデルにもたらし、オルガノイドが生体内を模倣する生理的妥当性を大幅に向上させることができます。生体内移植によるオルガノイドの血管内灌流の成功は、適切な微小環境が与えられれば、ほとんどの種類のオルガノイドが既存の血管床を介して血管化できることを明確に示している。このプロセスの重要なステップを理解し、特定し、最終的には完全に灌流されたシステムを構築するために必要な生化学的、機械的な合図をin vitroで実行するためには、さらなる努力が必要である。そのためには、様々な学問分野の科学者や技術者が一丸となって取り組む必要があります。私たちは、バイオマテリアル、マイクロ流体工学、幹細胞生物学などのさまざまな進歩が集結し、最終的にin vitroでの血管内灌流を伴う完全な血管形成オルガノイドを実現することを想定しています。この目標が実現すれば、オルガノイド技術の応用をさらに拡大するための貴重なツールとなることでしょう。
利益相反
RDKは、マイクロ流体デバイスを製造するAIM Biotech社の共同設立者であり、重要な財務的利害関係を有しています。また、RDKはAmgen、Biogen、W. L. Goreから研究支援を受けている。
参考文献
J. Kim, B.-K. Koo and J. A. Knoblich, Human organoids: model systems for human biology and medicine, Nat. Rev. Mol. Cell Biol., 2020, 19, 1-14 検索 PubMed.
M. A. Lancaster and J. A. Knoblich, Organogenesis in a dish: Modeling development and disease using organoid technologies, Science, 2014, 345(6194), 1247125 CrossRef.
H. V. Wilson, A new method by which sponges may be artificially reared, Science, 1907, 25(649), 912-915 CrossRef CAS.
M.
T. また、このような細胞間シグナリングは、細胞間相互作用がない場合にも有効である。
E. Karzbrun, A. Kshirsagar, S. R. Cohen, J. H. Hanna and O. Reiner, Human Brain Organoids on a Chip Reveal the Physics of Folding, Nat. Phys., 2018, 14(5), 515-522検索PubMed.
J. Zhou, C. Li, X. Liu, M. C. Chiu, X. Zhao and D. Wang, et al., Infection of bat and human intestinal organoids by SARS-CoV-2, Nat. Med., 2020, 1-7検索PubMed.
V. Monteil, H. Kwon, P. Prado, A. Hagelkrüys, R. A. Wimmer and M. Stahl, et al., Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2, Cell, 2020, 181(4), 905-913.e7 CrossRef CAS.
M. Geiger, Fundamentals of Vascular Biology, Springer, 2019 検索PubMed.
K. A. Homan, N. Gupta, K. T. Kroll, D. B. Kolesky, M. Skylar-Scott and T. Miyoshi, et al., Flow-enhanced vascularization and maturation of kidney organoids in vitro, Nat. Methods, 2019, 16(3), 255-262 CrossRef CAS.
T. Takebe, K. Sekine, M. Enomura, H. Koike, M. Kimura and T. Ogaeri, et al., Vascularized and functional human liver from an iPSC-derived organ bud transplant, Nature, 2013, 499(7459), 1-5 CrossRef.武部、関根、榎村、小池、木村、小粥、他、iPSC由来の臓器芽移植による血管形成と機能的ヒト肝臓、2013,1-5.
B. Cakir, Y. Xiang, Y. Tanaka, M. H. Kural, M. Parent and Y.-J. Kang, et al., Engineering of human brain organoids with a functional vascular-like system, Nat. Methods, 2019, 16(11), 1169-1175 CrossRef CAS.
A. A. Mansour, J. T. Gonçalves, C. W. Bloyd, H. Li, S. Fernandes and D. Quang, et al., An in vivo model of functional and vascularized human brain organoids, Nat. Biotechnol., 2018, 36(5), 432-441 CrossRef CAS , Available from: http://www.nature.com/articles/nbt.4127.
Y. Takahashi, K. Sekine, T. Kin, T. Takebe and H. Taniguchi, Self-Condensation Culture Enables Vascularization of Tissue Fragments for Efficient Therapeutic Transplantation, Cell Rep., 2018, 23(6), 1620-1629 CrossRef CAS.をご参照ください。
M. L. モヤ、Y.-H. Hsu, A. P. Lee, C. C. W. Hughes and S. C. George, In VitroPerfused Human Capillary Networks, Tissue Eng., Part C, 2013, 19(9), 730-737, CrossRef CAS.
.........................................................
J. A. Whisler, M. B. Chen and R. D. Kamm, Control of Perfusable Microvascular Network Morphology Using a Multiculture Microfluidic System, Tissue Eng., Part C, 2014, 20(7), 543-552 CrossRef CAS.
R. D. Kamm, R. Bashir, N. Arora, R. D. Dar, M. U. Gillette and L. G. Griffith, et al.、Perspective。The promise of multi-cellular engineered living systems, APL Bioeng., 2018, 2(4), 040901 CrossRef.
S. Kim, H. Lee, M. Chung and N. L. Jeon, Engineering of functional, perfusable 3D microvascular networks on a chip, Lab Chip, 2013, 13(8), 1489-1500 RSC.
J. S. Miller, K. R. Stevens, M. T. Yang, B. M. Baker, D.-H. このような場合、灌流可能な人工三次元組織のためのパターン化された血管網の迅速なキャスティング、Nat. Mater., 2012, 11(9), 768-774 CrossRef CAS.
Y. S. Zhang, A. Arneri, S. Bersini, S. -R. Shin, K. Zhu and Z. Goli-Malekabadi, et al., Bioprinting 3D microfibrous scaffolds for engineering endothelialized myocardium and heart-on-a-chip, Biomaterials, 2016, 110(c), 45-59, CrossRef CAS.
S. Guo, I. Redenski, S. Landau, A. Szklanny, U. Merdler and S. Levenberg, Prevascularized Scaffolds Bearing Human Dental Pulp Stem Cells for Treating Complete Spinal Cord Injury, Adv. Healthcare Mater., 2020, 9(20), 2000974 CrossRef CAS.
L. Perry, U. Merdler, M. Elishaev and S. Levenberg, Enhanced Host Neovascularization of Prevascularized Engineered Muscle Following Transplantation into Immunocompetent versus Immunocompromised Mice, Cell, 2019, 8(12), 1472 CrossRef CAS.
S. Ben-Shaul, S. Landau, U. Merdler and S. Levenberg, Mature vessel networks in engineered tissue promote graft-host anastomosis and prevent graft thrombosis, Proc. Natl. Acad. Sci. U. S. A., 2019, 116(8), 2955-2960 CrossRef CAS.
S. N. Bhatia and D. E. Ingber, Microfluidic organs-on-chips,Nat.Bhatia、D. E. Ingber、Microfluidic organs-on-chips, Nat. Biotechnol., 2014, 32(8), 760-772 CrossRef CAS.
Y. 梨本 孝、林 崇、國田 勇、中益 彰、Y.-S. Torisawa and M. Nakayama, et al., Integrating perfusable vascular networks with a three-dimensional tissue in a microfluidic device, Integr. Biol., 2017, 9(6), 506-518 CrossRef.
Y. Nashimoto, R. Okada, S. Hanada, Y. Arima, K. Nishiyama and T. Miura, et al., Vascularized cancer on a chip: The effect of perfusion on growth and drug delivery of tumor spheroid, Biomaterials, 2020, 229, 119547 CrossRef CAS.
M. T. Pham, K. M. Pollock, M. D. Rose, W. A. Cary, H. R. Stewart and P. Zhou, et al., Generation of human vascularized brain organoids, NeuroReport, 2018, 29(7), 588-593 CrossRef.をご参照ください。
T. Takebe, M. Enomura, E. Yoshizawa, M. Kimura, H. Koike and Y. Ueno, et al., Vascularized and Complex Organ Buds from Diverse Tissues via Mesenchymal Cell-Driven Condensation, Cell Stem Cell, 2015, 16(5), 556-565 クロスリードCAS.
G. Pettinato, S. Lehoux, R. Ramanathan, M. M. Salem, L.-X. He and O. Muse, et al., Generation of fully functional hepatocyte-like organoids from human induced pluripotent stem cells mixed with Endothelial Cells, Sci. Rep., 2019, 9(1), 8920-8921 CrossRef.
M. S. Steinberg, On the mechanism of tissue reconstruction by dissociated cells, I. Population kinetics, differential adhesiveness, and the absence of directed migration, Proc. Natl. Acad. Sci. U. S. A., 1962, 48(9), 1577 CrossRef CAS.
L. Song, X. Yuan, Z. Jones, K. Griffin, Y. Zhou and T. Ma, et al., Assembly of Human Stem Cell-Derived Cortical Spheroids and Vascular Spheroids to Model 3-D Brain-like Tissues, Sci. Rep., 2019, 9(1), 5977 クロスリファレンス(Scientific Rep., 2019).
W. C. Aird, Phenotypic heterogeneity of the endothelium: I. Structure, Function, and mechanisms, Circ. Res., 2007, 100(2), 158-173 CrossRef CAS.
M. Campisi, Y. Shin, T. Osaki, C. Hajal, V. Chiono and R. D. Kamm, 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, Biomaterials, 2018, 180, 117-129Ref CAS.
N. J. Abbott, A. A. Patabendige, D. E. Dolman, S. R. Yusof and D. J. Begley, Structure and function of the blood-brain barrier, Neurobiol. Dis., 2010, 37(1), 13-25 CrossRef CAS.
K. また、このような場合にも、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。Physiol., 2011, 5(4), 1751-1774検索 PubMed.
C. プラサ、S. C. ロサ、E. セヴィン、R. セッチェリ、M. -P. Dehouck and L. S. Ferreira, Derivation of brain capillary-like endothelial cells from human pluripotent stem cell-derived endothelial progenitor cells, Stem Cell Rep., 2019, 13(4), 599-611 CrossRef.をご参照ください。
G. Sriram, J. Y. Tan, I. Islam, A. J. Rufaihah and T. Cao, Efficient differentiation of human embryonic stem cells to arterial and venous endothelial cells under feeder- and serum-free conditions, Stem Cell Res. Ther., 2015, 6(1), 261 CrossRef.ヒト幹細胞から血管内皮細胞への効率的な分化。
G. I. Uenishi, H. S. Jung, A. Kumar, M. A. Park, B. K. Hadland and E. McLeod, et al., NOTCH signaling specifies arterial-type definitive hemogenic endothelium from human pluripotent stem cells, Nat. Commun., 2018, 9(1), 1-14 CrossRef CAS.
M. Takasato, P. X. Er, H. S. Chiu, B. Maier, G. J. Baillie and C. Ferguson, et al., Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis, Nature, 2015, 526(7574), 564-568 CrossRef CAS.
R. A. Wimmer, A. Leopoldi, M. Aichinger, N. Wick, B. Hantusch and M. Novatchkova, et al., Human blood vessel organoids as a model of diabetic vasculopathy, Nature, 2019, 565(7740), 505-510 CrossRef CAS.に掲載されています。
F. Wu, D. Wu, Y. Ren, Y. Huang, B. Feng and N. Zhao, et al., Generation of hepatobiliary organoids from human induced pluripotent stem cells, J. Hepatol., 2019, 70(6), 1145-1158 クロスリファレンス(CrossRef)。
N. Sasai, R. Yakura, D. Kamiya, Y. Nakazawa and Y. Sasai, Ectodermal factor restricts mesoderm differentiation by inhibiting p53, Cell, 2008, 133(5), 878-890 クロスリファレンスCAS.
O. 李鍾燮、李鍾燮、李鍾燮、李鍾燮、李鍾燮、李鍾燮、李鍾燮、李鍾燮 李(Lee), ヒト胚性幹細胞から形成された脳オルガノイドにおける血管形成, Biochem. Biophys. Res. Commun., 2020, 521(1), 84-90 CrossRef CAS.
P. Wörsdörfer, N. Dalda, A. Kern, S. Krüger, N. Wagner and C. Kwok, et al., Generation of complex human organoid models including vascular networks by incorporation of mesodermal progenitor cells, Sci. Rep., 2019, 9(1), 15663 CrossRef.
P. Wörsdörfer, A. Rockel, Y. Alt, A. Kern and S. Ergün, Generation of Vascularized Neural Organoids by Co-culturing with Mesodermal Progenitor Cells, STAR Protoc., 2020, 1(1), 100041 CrossRef.(中胚葉前駆細胞との共培養による脈管形成神経オルガノイドの作製、STAR Protoc.
R. 森田倫明, 鈴木正樹, 笠原宏, 清水直樹, 七田亨, 関谷哲也, 他, ETS転写因子ETV2はヒト線維芽細胞を機能的内皮細胞へ直接転換させる, Proc. Natl. Acad. Sci. U. S. A., 2015, 112(1), 160-165 CrossRef CAS.
K. Wang, R.-Z. Lin, X. Hong, A. H. Ng, C. N. Lee and J. Neumeyer, et al., Robust Differentiation of human pluripotent stem cells into endothelial cells via temporal modulation of ETV2 with modified mRNA, Sci. Adv., 2020, 6(30), eaba7606 CrossRef CAS , Available from: http://advances.sciencemag.org/content/6/30/eaba7606.abstract.(英語)。
P. Guye, M. R. Ebrahimkhani, N. Kipniss, J. J. Velazquez, E. Schoenfeld and S. Kiani, et al., Genetically engineering self-organization of human pluripotent stem cells into a liver bud-like tissue using Gata6, Nat. Commun., 2019, 7(1), 1-12検索PubMed.
J. W. Song and L. L. Munn, Fluid forces control endothelial sprouting, Proc. Natl. Acad. Sci. U. S. A., 2011, 108(37), 15342-15347 CrossRef CAS.
V. Vickerman and R. D. Kamm, フローゲートによる血管新生スイッチのメカニズム:細胞-マトリックスおよび細胞-細胞接合部における初期シグナル伝達イベント, Integr. Biol., 2012, 4(8), 863-874 CrossRef CAS.
M. J. Workman, J. P. Gleeson, E. J. Troisi, H. Q. Estrada, S. J. Kerns and C. D. Hinojosa, et al., Enhanced Utilization of Induced Pluripotent Stem Cell-Derived Human Intestinal Organoids Using Microengineered Chips, Cell. Mol. Gastroenterol. Hepatol., 2018, 5(4), 669-677.e2 CrossRef.
T. Tao, Y. Wang, W. Chen, Z. Li, W. Su and Y. Guo, et al., Engineering human islet organoids from iPSCs using an organ-on-chip platform, Lab Chip, 2019, 19(6), 948-958 RSC.
J. D. Coffin, J. Harrison, S. Schwartz and R. Heimark, Angioblast differentiation and morphogenesis of the vascular endothelium in the mouse embryo, Dev. Biol., 1991, 148(1), 51-62 CrossRef CAS.
M. Biol., 2013, 5(10), 1262-1271 CrossRef CAS.
B. アンドレ、H.イチャンティ、S.カリーズ、A.ハイスターカンプ、S.シュトラウス、P.-M. Vogt, et al., Formation of three-dimensional tubular endothelial cell networks under defined serum-free cell culture conditions in human collagen hydrogels, Sci. Rep., 2019, 9(1), 5437 クロスリファレンス.
T. Takebe, N. Koike, K. Sekine, M. Enomura, Y. Chiba and Y. Ueno, et al.、Generation of functional human vascular network、Transplant. Proc., 2012, 44(4), 1130-1133 CrossRef CAS.
X. Wang, D. T. T. Phan, A. Sobrino, S. C. George, C. C. W. Hughes and A. P. Lee, Engineering anastomosis between living capillary networks and endothelial cell-lined microfluidic channels, Lab Chip, 2016, 16(2), 282-290 RSC.
W. Risau, 血管新生のメカニズム, Nature, 1997, 386(6626), 671-674 CrossRef CAS
P. Carmeliet and R. K. Jain, Molecular mechanisms and clinical applications of angiogenesis, Nature, 2011, 473(7347), 298-307 CrossRef CAS.
W. A. Farahat, L. B. Wood, I. K. Zervantonakis, A. Schor, S. Ong and D. Neal, et al., Ensemble analysis of angiogenic growth in three-dimensional microfluidic cell cultures, PLoS One, 2012, 7(5), e37333Ref CAS.
D.-H. T. Nguyen, S. C. Stapleton, M. T. Yang, S. S. Cha, C. K. Choi and P. A. Galie, et al., Biomimetic model to reconstitute angiogenic sprouting morphogenesis in vitro, Proc. Natl. Acad. Sci. U. S. A., 2013, 110(17), 6712-6717 CrossRef CAS.
L. L. Bischel, E. W. K. Young, B. R. Mader and D. J. Beebe, Tubeless microfluidic angiogenesis assay with three-dimensional endothelial lined microvessels, Biomaterials, 2013, 34(5), 1471-1477, CrossRef CAS.
V. Nehls and D. Drenckhahn, A microcarrier-based cocultivation system for the investigation in the factors and cells involved in angiogenesis in three-dimensional fibrin matrices in vitro, Histochem. Cell Biol., 1995, 104(6), 459-466 CrossRef CAS.
M. 中津正樹、R. C. Sainson、J. N. Aoto、K. L. Taylor、M. Aitkenhead and S. Pérez-del-Pulgar, et al., Angiogenic sprouting and capillary lumen formation modeled by human umbilical vein endothelial cells (HUVEC) in fibrin gels: the role of fibroblasts and Angiopoietin-1☆, Microvasc. Res., 2003, 66(2), 102-112 CrossRef CAS.
J. H. Yeon, H. R. Ryu, M. Chung, Q. P. Hu and N. L. Jeon, In vitro formation and characterization of a perfusable three-dimensional tubular capillary network in microfluidic devices, Lab Chip, 2012, 12(16), 2815-2822 RSC.
C. B. Weinberg and E. Bell, A blood vessel model constructed from collagen and cultured vascular cells, Science, 1986, 231(4736), 397-400 CrossRef CAS.
D. G. Belair, J. A. Whisler, J. Valdez, J. Velazquez, J. A. Molenda and V. Vickerman, et al., Human Induced Pluripotent Stem Cell Derived Endothelial Cellsから形成されるヒト血管組織モデル、Stem Cell Rev. Rep., 2014, 11(3), 511-525 CrossRef.
J. P. Morgan, P. F. Delnero, Y. Zheng, S. S. Verbridge, J. Chen and M. Craven, et al., Formation of microvascular networks in vitro, Nature, 2013, 8(9), 1820-1836
G. S. Offeddu, K. Haase, M. R. Gillrie, R. Li, O. Morozova and D. Hickman, et al., An on-chip model of protein paracellular and transcellular permeability in microcirculation, Biomaterials, 2019, 212, 115-125 CrossRef CAS.
G. S. Offeddu, L. Possenti, J. T. Loessberg Zahl, P. Zunino, J. Roberts and X. Han, et al., Application of Transmural Flow Across In Vitro Microvasculature Enables Direct Sampling of Interstitial Therapeutic Molecule Distribution, Small, 2019, 15(46), 1902393 CrossRef CAS.
K. M. Chrobak, D. R. Potter and J. Tien, Formation of perfused, functional microvascular tubes in vitro, Microvasc. Res., 2006, 71(3), 185-196 CrossRef CAS.
N. Sadr, M. Zhu, T. Osaki, T. Kakegawa, Y. Yang and M. Moretti, et al., SAM-based cell transfer to photopatterned hydrogels for microengineering vascular-like structures, Biomaterials, 2011, 32(30), 7479-7490, CrossRef CAS.
H. 吉田宏樹, 松崎正樹, 明石光伸, 生分解性ハイドロゲルによる多層型毛細血管アナログ, In Vitro Drug Permeability Assays (薬物透過性試験), Adv. Funct. Funct. Mater., 2012, 23(14), 1736-1742 CrossRef.
A. P. Golden and J. Tien, Fabrication of microfluidic hydrogels using molded gelatin as a sacrificial element, Lab Chip, 2007, 7(6), 720-725 RSC.
M. A. Skylar-Scott, S. G. M. Uzel, L. L. Nam, J. H. Ahrens, R. L. Truby and S. Damaraju, et al., Biomanufacturing of organ-specific tissues with high cellular density and embedded vascular channels, Sci. Adv., 2019, 5(9), eaaw2459 CrossRef CAS.
M. Radisic, H. Park, F. Chen, J. E. Salazar-Lazzaro, Y. Wang and R. Dennis, et al., Biomimetic approach to cardiac tissue engineering: oxygen carriers and channeled scaffolds, Tissue Eng., 2006, 12(8), 2077-2091 CrossRef CAS.
S. N. Nazhat, E. A. Abou Neel, A. Kidane, I. Ahmed, C. Hope and M. Kershaw, et al., Controlled microchannelling in dense collagen scaffolds by soluble phosphate glass fibers, Biomacromolecules, 2007, 8(2), 543-551, CrossRef CAS.
C. Xu, Z. Zhang, K. Christensen, Y. Huang, J. Fu and R. R. Markwald, Freeform Vertical and Horizontal Fabrication of Alginate-Based Vascular-Like Tubular Constructs Using Inkjetting, J. Manuf. Sci. Eng., 2014, 136(6), 157-158 CrossRef.「インクジェットによるアルギン酸ベースの脈管状構築物の垂直・水平方向の自由形状作製」,J. Manuf.
A. Sala, P. Hänseler, A. Ranga, M. P. Lutolf, J. Vörös and M. Ehrbar, Engineering 3D cell instructive microenvironments by rational assembly of artificial extracellular matrices and cell patterning, Integr. Biol., 2011, 3(11), 1102-1110 CrossRef.
M. このような場合、細胞は、細胞外マトリックスと細胞パターンの合理的な組合せにより、組織環境を整えることができる。Commun., 2013, 4(1), 2353 CrossRef.
S. Grebenyuk and A. Ranga, Engineering Organoid Vascularization, Front. Bioeng. Biotechnol., 2019, 7, 82 CrossRef.
D.-H. T. Nguyen, S. C. Stapleton, M. T. Yang, S. S. Cha, C. K. Choi and P. A. Galie, et al., Biomimetic model to reconstitute angiogenic sprouting morphogenesis in vitro, Proc. Natl. Acad. Sci. U. S. A., 2013, 110(17), 6712-6717 CrossRef CAS.
J. Paek, S. E. Park, Q. Lu, K.-T. Park, M. Cho and J. M. Oh, et al., Microphysiological Engineering of Self-Assembled and Perfusable Microvascular Beds for Production of Vascularized Three-Dimensional Human Microtissues, ACS Nano, 2019, 13(7), 7627-7643 CrossRef CAS.をご参照ください。
H. Liu, Y. Wang, K. Cui, Y. Guo, X. Zhang and J. Qin, Advances in Hydrogels in Organoids and Organs-on-a-Chip, Adv. Mater., 2019, 31(50), 1902042 CrossRef CAS.
S. Rajasekar, D. S. Y. Lin, L. Abdul, A. Liu, A. Sotra and F. Zhang, et al., IFlowPlate-A Customized 384-Well Plate for the Culture of Perfusable Vascularized Colon Organoids, Adv.Mater., 2020, 30, 2002974 CrossRef.
R. Morizane, A. Q. Lam, B. S. Freedman, S. Kishi, M. T. Valerius and J. V. Bonventre, Nephron organoids derived from human pluripotent stem cells model kidney development and injury, Nat. Biotechnol., 2015, 33(11), 1193-1200 CrossRef CAS.
F. E. Freeman, P. Pitacco, L. H. van Dommelen, J. Nulty, D. C. Browe and J.-Y. Shin, et al., 3D bioprinting spatiotemporally defined patterns of growth factors to tight control tissue regeneration, Sci. Adv., 2020, 6(33), eabb5093 CrossRef CAS.
C. W. van den Berg, L. Ritsma, M. C. Avramut, L. E. Wiersma, B. M. van den Berg and D. G. Leuning, et al., Renal subcapsular transplantation of PSC-derived kidney organoids in vivo induced neo-vasculogenesis and significant glomerular and tubular maturation, Stem Cell Rep.,2018, 10(3), 751-765 CrossRef.
E. Cambria, K. Renggli, C. C. Ahrens, C. D. Cook, C. Kroll and A. T. Krueger, et al, Covalent modification of synthetic hydrogels with bioactive proteins via sortase-mediated ligation, Biomacromolecules, 2015, 16(8), 2316-2326 CrossRef CAS.をご参照ください。
S. L. Natividad-Diaz, S. Browne, A. K. Jha, Z. Ma, S. Hossainy and Y. K. Kurokawa, et al., A combined hiPSC-derived endothelial cell and in vitro microfluidic platform for assessing biomaterial-based angiogenesis, Biomaterials, 2019, 194, 73-83 CrossRef CAS.
P. N. Ingram, L. E. Hind, J. A. Jiminez Torres, A. Huttenlocher and D. J. Beebe, An Accessible Organotypic Microvessel Model Using iPSC-Derived Endothelium, Adv. Healthcare Mater., 2018, 7(2), 1700497 CrossRef.をご参照ください。
Y. Koui, T. Kido, T. Ito, H. Oyama, S.-W. Chen and Y. Katou, et al., iPSC由来実質細胞および非実質細胞によるin vitroヒト肝臓モデル, Stem Cell Rep., 2017, 9(2), 490-498 CrossRef CAS.
この記事が気に入ったらサポートをしてみませんか?
