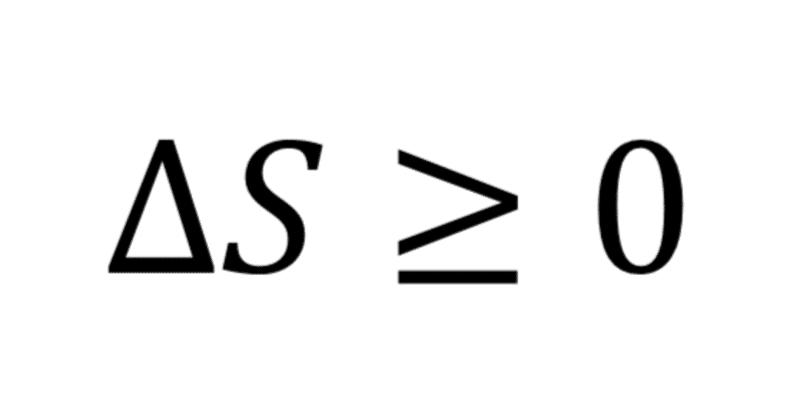
ジェイラボワークショップ第42回『熱力学~エントロピーとは~』【物理学部】[20221024-1106] #JLWS
今回は,物理学部で輪読をしている『熱力学=現代的な視点から』(田崎晴明)の1章から6章までをベースとし,「エントロピー」の理解をゴールとしたワークショップを行いました.以下はそのログになります.「★」がついたものだけで読み物としては完結しているので忙しい方は「★」だけ読んでもらってもかまいませんが,「★」以外も含めて全部読んだ方がより空気感を味わえると思います.参加者のコメントについては,発言者の頭に「■」をつけ,その返信には発言者の頭に「・」をつけています.なお,実際のWSで配布したpdfの資料については著作権の関係でこのnote記事には載せないのでご了承ください.
オープニング(Day1)
★Naokimen
皆さんおはようございます(こんばんは)。今日から物理学部のワークショップが始まります。
今回のテーマは「熱力学〜エントロピーとは〜」です。物理学部では4月から田崎晴明さんの『熱力学-現代的な視点から』のゼミを行なっており、その1章から6章までをベースにして熱力学の内容を紹介します。ただし、高度な数学の知識は前提とせず、一般書のレベルに噛み砕いて説明するのでご安心ください。
「エントロピー」という言葉自体は聞いたことがあるのではないでしょうか?今回はこのエントロピーを理解することがゴールになります。
WSの流れは以下の通りです:
Day1
第1章 熱力学とはなにか(Shun)
Q1,Q2
Day2
夜にQ2の解答・解説
Day3
第2章 平衡状態の記述(Yuta)
Q3
Day4
夜にQ3の解答・解説
Day5
第3章 等温操作とHelmholtzの自由エネルギー(チクシュルーブ隕石)
Q4,Q5
Day6
夜にQ4,Q5の解答・解説
Day7
第4章 断熱操作とエネルギー(Yuta)
Q6
Day8
夜にQ6の解答・解説
Day9
第5章 熱とCarnotの定理(チクシュルーブ隕石)
Q7
Day10
夜にQ7の解答・解説
Day11
第6章 エントロピー(Yuta)
Q8,Q9
Day12
休み
Day13
夜にQ9の解答・解説
Day14
Q10
基本的に1章あたり2日間で、そのうちの1日目にまとめの文章、資料、クイズを投稿します。「まとめの文章」については数式を基本的に用いずに説明しているので、読み物として読んでみてください。pdfで投下される「資料」については数式を用いて「まとめの文章」についてのより細かい説明が書かれています。興味のある方はお読みください。結構分量が多いので「まとめの文章」を読んでわからないところだけ読むという形でもいいと思います。高校数学は前提にしていますが、大学で学ぶ数学は前提としていないので、あまり恐れず読んで頂ければ幸いです。熱力学で難しいのはロジックの部分であり、式変形などはあまり難しくありません。時間のある方は資料も全部読み、がんばって最後までついてきていただけると嬉しいです。
このWSを通して全部で10個の質問・クイズ(Q1-Q10)を出します。いつでも回答をお待ちしているので、ぜひお答えください。ただし、上のスケジュール内で「夜にQ○○の解答・解説」と書いてあるのものについてはその日の夜に解答・解説が投稿されるのでご了承ください。選択式のクイズもその根拠が言えるならそれも合わせて投稿していただけると嬉しいです。また、質問はいつでも大歓迎なので何か疑問点があれば気軽に質問していただければありがたいです。
それでは2週間よろしくお願いします。
第1章 熱力学とはなにか(Day1,2)
★Shun
こんにちは.第1章を担当しますShunです.第1章では高等学校で学習した理想気体の状態方程式から始めて熱力学を外観し,導入する内容となっています.このまとめの文章に続いて資料とクイズ 2 問を投稿します.よろしくお願いします.
断面積が A のピストンがついたシリンダーの中に物質量 N の理想気体を入れ,装置全体が一定の温度 T の環境の中にある状況を考えます.理想気体とは,分子間力と分子の体積を無視できると仮定した仮想的な気体のことです.(この仮定をしない,現実世界に存在する気体を実在気体といいます.)理想気体の体積を一定の値 V に保つために,ピストンを F の力で押しているとします.このとき,気体の圧力 p は力 F を断面積 A で除した値 F/A となるように,力学的に求めることができます.一方,理想気体の状態方程式(以後,状態方程式とする.) pV = NRT によって N,T,V と気体定数 R だけを用いて圧力 p を求めることもできます.状態方程式は,投稿した資料の冒頭で軽く説明しているのでピンとこない方は読んでみてください.次に,シリンダーを少しだけ動かしたときに気体が外界にする仕事を考えます.仕事とは,外力 F と変位 s の内積 F・s で定義されます.外力が一定かつ変位と平行であり,変位が線形である場合は,仕事は外力と変位のそれぞれの大きさの積で求めることができます.言葉で表すと,(仕事)=(力の大きさ)×(力の方向に動いた距離)ということになります.ここでは具体的な計算は省きますが,状態方程式が気体の行う仕事と関連付けられていることが資料中の簡単な計算から分かり,現時点ではよく分からない熱力学的な系の性質を,力学的な仕事という具体的で明確にわかることで特徴付けることができています.このように,ピストンを動かす等の,仕事を主役とした操作的な視 点から熱力学を構築していこうとする姿勢を田崎熱力学はとっています.
高等学校までの熱力学では,ピストン内の気体と仕事の関係というかなり限定的なものだけを 対象としてきました.しかし,本来熱力学はもっと普遍的な構造を対象に議論することが可能な 学問です.例えば,断熱操作の可逆性・不可逆性といった系の性質とは無関係なことについての議論が今後展開されていきます.
では,第1章の資料とクイズを投稿します.
★Q1
【Q1】熱力学を学んだことはありますか?
:1: 高校で学んだことがある 11
@Hiroto, @Yuta, @ゆーろっぷ, @匿名希望, @chiffon cake, @ていりふびに, @あんまん,
@イスツクエ, @Yujin, @Shun, @Tsubo
:2: 大学で学んだことがある 8
@Hiroto, @Takuma Kogawa, @匿名希望, @西住, @あんまん, @イスツクエ, @Yujin, @Shun
:3: 学んだことはない 3
@蜆一朗, @YY 12, @コバ★Q2
【Q2】pV = NRT は実在気体でも正確に成り立つと思いますか?理由を書けそうな方はぜひ書いてみてください.
:1: 成り立つと思う
:2: 成り立つとは思わない 11
@Hiroto, @蜆一朗, @Takuma Kogawa, @ゆーろっぷ, @匿名希望, @chiffon cake, @ていりふびに,
@あんまん, @イスツクエ, @Tsubo, @コバ★Shun
【Q2】の解答です.
答え 成り立たない.
解説
実在気体は完全な理想気体ではないため,状態方程式は実在気体では正確には成り立たないです.しかし,実在気体を高温・低圧にすることで理想気体との差を小さくすることができます.実在気体が理想気体に近づくのは,高温にすることで,分子間力を無視できるくらいに激しく気体分子が熱運動をし,また低圧にすることで,単位体積あたりの分子の体積が小さくなるなるからです.実は,分子間力と分子の体積を考慮してより正確に状態を記述できるようにした van der Waals の状態方程式というものもあります.
第2章 平衡状態の記述(Day3,4)
★Yuta
こんにちは、こんばんは、Yutaです。第2章を担当します!本論に入るので長くなりますが、読んでいただけると嬉しいです。1章同様、このまとめの文章と資料とクイズを1問投稿します。よろしくどーぞ。
第1章で熱力学の大雑把な概観が掴めたところで、早速本論に入っていきましょう。第2章では今後使っていく用語の定義がメインになります。表現の仕方を決めたりするだけなので、そこまで議論が進んでいくわけではありませんから、落ち着いて一つずつ押さえていきます。
一成分の流体(液体や気体のこと)が、容器に詰まっている状況を考えます。この時、容器の中の流体を特徴づけるのは主に体積 V と物質量 N です。物質量とは、流体を構成する粒子の個数のことです。体積は容器の内側の寸法を測って流体が入っている部分の体積を計算してやれば求められますし、物質量は、(流体の入った容器の重さ)―((何も入っていない)容器の重さ)を求めることで気体の重さがわかるので、そこから化学的な計算をしてやることで求められます。この体積 V と物質量 N は、容器を密閉した後に操作できるかできないかという明確な違いがあります。体積 V は容器を閉じた後でも、例えば容器の気体の入った部分の体積をピストンを使って力学的に変えてやることができます。一方物質量 Nは、一同容器を閉じると、例えば半分だけ取り出すといったことは人間の手では不可能なわけです。また、体積 V と物質量 N には共通点もあります。流体の入った同じ状況の容器を系の密度を一定としたまま、全体の大きさをλ倍したとき、体積はλV、物質量はλNとなり、λ倍されます。こういった性質をもつ、体積 V や物質量Nのような変数を示量変数と呼ぶことにします。
次の話に移りましょう。
ここでは、熱力学的な系の外に、マクロな「力学的世界」が存在することを前提に議論を進めていきます。マクロな「力学的世界」とは、通常 Newton 力学の世界を想定するのが自然で標準的なのですが、熱力学での議論において必要なのは、「力学的世界がどれだけの仕事を受け取るか」という情報だけであり、Newton 力学はその一例にすぎず、このように体系化されている必要はありません。とにかく、「力学的世界」が何であれ、我々が熱力学の議論をしていくにあたって必要な情報は「力学的世界」が受け取る仕事のみであり、これからは単に「外界」と呼ぶことにします。熱力学的な世界は力学的な世界では見られなかった多様な性質を示します。目に見えないエネルギーの移動があるわけですから、マクロな力学だけでは記述が難しいです。この二つの世界をつなぐのが上で紹介した示量変数です。これを力学的に操作することでブラックボックスになっている熱力学的な世界の定量的な情報を得ることができるのです。
上で考えた容器のような一つのまとまりを系と呼ぶことにします。
この系の示量変数の組を外界からの力学的操作で変化させるのが、最も基本的な操作になります。体積Vと物質量Nの示量変数の組(V,N)の系に壁を差し込んで二つの部分に分けることを考えます。壁を差し込むと、(V,N)は{(V’,N’),(V’’,N’’)}へと分かれます。壁を差し込むという操作は外界からの操作の一種と考えることができ、この時の定量的な情報(力学的な量である「仕事」)は、系が十分に大きく壁が十分に薄ければ、一切必要ないとします。また、壁を取り除く操作も仕事は必要ないとします。われわれが系の示量変数を制御するための力学的な操作は、これまでに説明したものプラスこういった壁の操作の組み合わせで実現されます。
次に温度一定の環境にある熱力学的な系の平衡状態について議論します。
環境とは、大気や海水のような系を取り巻く巨大な系のことです。環境は系より十分大きいので系の影響で変化することなどは一切考えません。平衡状態とは、その系がマクロな観点からは、つまり私たちの肉眼では時間変化が認識できない状態のことです。平衡状態では、系の性質は時間が経っても変化しません。温度の変化があるのみの非平衡状態であればわれわれは認識できない恐れもあるのではないかと思われますが、例えば温度差があれば流体においては対流が起きますので、そういう切り口から何かしらの工夫をした認識の仕方は考えられるかと思います。
「環境の中に環境に比べて十分小さな熱力学的な系を置いたまま十分に長い時間が経過すれば、その系は平衡状態に達する。」
というのが最初の要請になります。要請というのは、大雑把に言うと数学でいう公理のことですが、物理学は自然科学なので、数学のようにかっちりと定まった公理から出発するわけではありません。物理は通常、実験などで現象を採集し、共通原理を見出し、それらを元に体系化された理論を組んでいくという順番で理論が完成していきます。共通原理を見出す過程でたいてい飛躍が生まれます。Newton は天と地の運動の統一という当時ではとんでもない飛躍をさせたわけですが、要するに理論が完成しても、より少ない原理から同じ理論を導き出すこともできるかもしれないわけです。理論の出発点である公理や原理が「暫定的」である点で数学とは違います。
環境、と一口に言っても色々な環境があります。外気、海水、液体窒素 etc...当然それらは異なった状態にあり得るわけですが、その中にある系の平衡状態「だけ」を考えるとき、われわれは環境の「温度」のみが影響するということを経験的に、あるいは直感的に知っているのではないでしょうか。こういう事実も要請しておきます。
「各々の環境を特徴づける温度Tという実数の量があり、環境に置いた熱力学的な系の平衡状態を左右するのは、環境の温度だけである。つまり、等しい温度の環境の中にある熱力学的な系の平衡状態は、示量変数の組が等しければ、つねに等しい。」
これが二つ目の要請になります。
これを認めると、もはや温度Tの環境下で平衡に達した系の温度もTであるとするのが自然なので、これも認めることにします。ここで都合よく登場した温度Tですが、経験的に分かるようにこれは系を2倍しても2倍になりませんよね。温度Tも系を特徴づける量ですが、系の大きさが変わっても不変である量のことを特に示強変数と呼ぶことにします。先の要請二つを認めれば、熱力学的な系の状態は、温度Tと示量変数の組の値 X=(V,N)で完全に区別できるようになります。これによって、温度と示量変数を合わせた(T;X)という組で平衡状態が指定できます。
次に断熱された系の平衡状態について。
断熱とはすごく身近な概念です。例えば魔法瓶。魔法瓶の容器は壁が二重になっていて間が真空ですから、冷めるのが凄く遅い。こういう容器を囲む壁を断熱壁と呼ぶことにします。断熱壁で囲んだ熱力学的な系に行なう操作はすべて断熱変化と呼ばれます。
断熱壁で囲まれた系も十分に長い時間が経つと平衡状態に達しますが、必ずしも環境の温度と等しくはありません。環境とは断熱されて温度が等しくなるとは限らないからです。
ではわれわれは断熱壁で囲まれた系の温度をどうやって測るのか?それは簡単なことで、小さな温度計を系の中に差し込んでやればいいのです。温度計も一つの熱力学的な系なので、その状態変化から温度を情報として読み取ることができます。「小さな」とつけたのは、「系への影響を無視できるほどに」という意味です。
本日は以上とします。ここまで読んでくださりありがとうございました。
★Q3
【Q3】「示量変数」「示強変数」が理解できているか確認しましょう。次の状態量はそれぞれ「示量変数」と「示強変数」のどちらか答えよ。(1)物質量N(2)圧力P(3)温度T
:1: (1)示量変数 2
@匿名希望, @Hiroto
:2: (1)示強変数
:3: (2)示量変数
:4: (2)示強変数 2
@匿名希望, @Hiroto
:5: (3)示量変数
:6: (3)示強変数 2
@匿名希望, @Hiroto★Yuta
【Q3】の解答
(1)示量変数(2)示強変数(3)示強変数
でした。系全体をλ倍したとき、物質量はλ倍になります。圧力と温度は変化がありません。よって上のような解答になります。
明日からは第3章です。引き続きよろしくどーぞ。
第3章 等温操作とHelmholtzの自由エネルギー(Day5,6)
★チクシュルーブ隕石
こんにちは。第3章を担当するチクシュルーブ隕石です。よろしくどーぞ!特に【Q5】については多くの視点(物理学的、工学的、哲学的…)からでも回答いただけると嬉しいです!
今日は田崎熱力学でいう第3章にあたる部分について紹介・解説していきたいと思います。
今回のテーマは等温操作とHelmholtzの自由エネルギーです。等温操作とはいかなる操作なのかを出発点にして最終的に等温環境におけるHelmholtzの自由エネルギーがどのようなものなのかについて考えていきたいと思います。
まず等温操作という言葉を聞いたことがある方はとても多いと思います。高校物理を履修した人ならば間違いなく聞いたことがある言葉です。しかし、この言葉の意味を正確に説明できるでしょうか?等温操作は「等温環境の中で行うというだけでその操作の途中については系の内部の温度は気にしない操作」の事を指しています。本日説明させていただく等温操作は上記のような意味で用いているのでこれを把握した上で読み進めていただくようお願い致します。
また、「示量変数の時間変化が非常にゆっくりしているために操作の途中でも系が常に平衡状態にあるとみなすことができる極限的な操作」の事を一般に準静的な操作と呼びます。特に準静的な等温操作の事を等温準静操作と言います。今後準静的な操作に着目をする場面は多いためしっかりと押さえておくとより学びが多いと思います。
次に熱力学の基本的要請の一つであるKelvinの原理について説明していきたいと思います。この原理の主張を見る前に、主張の内容を正確に理解する為に等温サイクルについて説明します。はじめにある平衡状態にある系が存在しているとして、等温操作を施した結果、最終的に最初と同じ平衡状態に戻るような操作を等温サイクルと言います。この等温サイクルに関するKelvinの原理は単純明快で「等温サイクルが外界に対して正の仕事をすることはない」と主張するものです。(田崎熱力学では、系が外界に行う仕事と系が環境から吸収する熱に注目するという立場をとって議論が進められています。それに従い、我々物理学部も同様の立場をとっています。)第二種永久機関とは熱源から得た熱エネルギーを完全に力学的仕事など他の形のエネルギーに転換する仮想的な装置と定義されています。Kelvinの原理は同時に第二種の永久機関の存在を否定しています。
また、Kelvinの"原理"としているのには大きな理由があり、この原理が経験法則とも言えるものであることが大きく関わっています。この世界を見渡してみてもKelvinの原理に反するような結果をもたらすような構造を持った生物などがいない事がこの原理が成り立っていることの証左となっています。
さて、ここからはついに等温環境にある熱力学系におけるHelmholtzの自由エネルギーについて見ていきたいと思います。このHelmholtzの自由エネルギーは熱力学において力学のポテンシャルエネルギー(位置エネルギー)に非常に酷似した性質を持っています。具体的にはどちらもある状態からある状態へ移るときの外界へ行う仕事が初めの状態と終わりの状態のHelmholtzの自由エネルギー[ポテンシャルエネルギー]の差で与えられるという性質があります。ここで重要なのは、この性質は初めの状態から終わりの状態へと移る過程によらず、初めの状態と終わりの状態が定まるとその間の仕事は一意に定まるということです。
具体的として重力ポテンシャルを考えましょう。基準水平面からの高さをzとし、重力ポテンシャルをV(z)とすると、
V(z)=mgz と表されます。
今、粒子を高さz1から高さz2まで(手で支えて)移動させたとしましょう。この時、粒子がした仕事(重力がした仕事)はmg(重力)×(z1-z2)(その方向に動いた距離)=mgz1-mgz2と表されます(重力が下向きに働くことに注意)。一方、mgz1=V(z1) 、mgz2=V(z2)なので、この仕事はV(z1)-V(z2)と表すこともでき、仕事がポテンシャルエネルギーの差で表され、それは過程によらず、初めの状態と終わりの状態(この例では高さz1、z2)を定めれば一意に定まります。このような関係がHelmholtzの自由エネルギーでも成り立つということになります。
最初に、等温環境のHelmholtzの自由エネルギーを定義する時に肝要な量として最大仕事という概念があり、今後何度も出てくる概念です。ここからは最大仕事について詳しく説明させていただきます。
まずある等温操作を考え、その操作の間に外界に行う仕事のうち最大値を最大仕事と言います。最大仕事は初めの状態と終わりの状態が定まる事で一意に定まる量です。この最大仕事は特に重要な性質として、先ほどの等温操作と初めの状態と終わりの状態が同じ平衡状態となっているような等温準静操作の間に系が外界に行う仕事に等しいという性質があり、これを最大仕事の原理といいます。(最大仕事はこのほかにもいくつか性質を持っていますが、ここに書くのは難しいので解説pdfの方にのせております。)
この最大仕事を用いてHelmholtzの自由エネルギーは定義されます。Helmholtz の自由エネルギーがポテンシャルエネルギーと似た性質を持つのはこの最大仕事の性質によるものなのです。
本日はここまでとさせていただきたいと思います。文章だけでは伝えきれていないことがあるため、解説pdfを一読して理解を深めていただければ幸いです。
★Q4
【Q4】次の機関は実際に作ることができるでしょうか、できないでしょうか?できれば理由もお聞かせください。 船を走らせることを考える。船の推進に使われたエネルギーは水の運動に変化し、水の運動はやがて水温の一部に変化する。もしここで、海水の水温を動力源としてもう一度船の推進力に変えることができれば、この船は他に何の燃料も使わずに永久に走り続けることができる。
:1: できる
:2: できない 3
@ていりふびに, @蜆一朗, @コバ★Q5
【Q5】Kelvinの原理を破る機関が存在するとすれば、我々の世界はどのように変化すると考えられるか。
★チクシュルーブ隕石
【Q4】の答え できない
熱は必ず温度の高い方から低い方に移動する。仮定した船を実現しようとすると加速をするときは船は周囲の水より冷たく、減速するときは船が周囲の水より温かくなければならない。これは異なる温度の船が存在する必要があるために、矛盾である。この例は第二種永久機関であり、このような機関が存在するならば Kelvin の原理が成立しないということになってしまいます。
【Q5】の答えの一例
単一の温度であるような環境に該当の機関を置くことでエネルギーが生まれ続けるため、エネルギ―の完全なる自給が可能になる。
【Q5】の解答として示したものは一例に過ぎません。【Q5】についてだけでなく、これまでの質問や文章・解説pdfなどに自分なりの考えや意見をお持ちの方、是非回答を今回のWS期間中引き続きお待ちしております!
なお、明日からは第4章が始まります。
第4章 断熱操作とエネルギー(Day7,8)
★Yuta
こんばんは、第4章もYutaが担当します。よろしくどーぞ。
第 2 章で紹介した断熱壁で囲まれた系において行なう断熱操作についての議論を進めていきます。
熱力学的な系が平衡状態(T;X)にあるとき、断熱壁で囲み、われわれが自由に操作できる示量変数 X を X’に変化させると、新たな平衡状態(T’;X’)に達します。このとき T’は系が操作に応じて決めた温度になります。操作の最初と最後で断熱壁に囲まれている操作のことを断熱操作と呼びます。また、等温の場合と同様に操作の途中もつねに平衡状態にある、準静的な断熱操作を断熱準静操作と呼びます。断熱準静操作は等温準静操作と同様、逆向きに実行することが可能です。示量変数の組 X から X’に何らかの操作で到達できるなら、当然、系が決定する任意の T‘について(T;X)から(T’;X’)への断熱準静操作は実行可能になります。
ここで、「示量変数 X をわずかにゆっくり変化させたとき、温度 T もわずかに変化する」ことを要請しておきます。つまり、T’は X’に連続に依存するということです。
これにより、任意の示量変数 X’, 温度 T’について、示量変数 X から X’まで移ることが可能な何らかの操作があれば、断熱準静操作も可能であるといえます。
他にどのような断熱操作が可能か考えていきます。
考えるうえで、認めてやる要請を一つ設けます。示量変数の組を変えずに温度を上げる断熱操作の存在です。この操作の際、外界から系に正の仕事を行なう必要があります。1章で出てきた例のように気体を素早く膨張させてから収縮させれば、このような温度上昇の断熱操作を実現できます。ピストンをがちゃがちゃ往復させてやると流体中に流れが生じ、それが摩擦や粘性によって消失する際に「摩擦熱」が発生して系の温度が上がる、といったことをイメージしていただければいいかと思います。これを認めてやると、示量変数の組XからX’へ何らかの操作で移ることが可能であるとき、任意の温度 T, T’について、(T; X)から(T’; X’)またはその逆方向に移る断熱操作のうち少なくとも一方が必ず可能であることが示せます。
次に、熱力学におけるエネルギー保存則と断熱仕事についてみていきます。
力学的な系が外界に行なう仕事は、保存力の場合、途中の経路によらず始めと終わりの状態だけで決まるのに対し、等温操作で外界に行なう仕事は操作の方法や途中経過に依存しました。しかし、任意の断熱操作では、仕事は途中経過によらないという素晴らしい性質があり、これを要請します。力学とのアナロジーのような形で指定したこの性質が実は、高校で習ったような熱力学第一法則の正体です。
断熱操作において始状態と終状態を指定してやることによって、途中経過によらず決まる仕事を断熱仕事と呼びます。断熱仕事は、状態1から3へ移る操作の際の断熱仕事が、状態1から2、状態2から3へ移る操作の断熱仕事の単純な和になっているのが有難いです。この時状態1と3を同じ状態としても、これは断熱操作の一種なので成り立ち、状態1から1へ移る際の仕事は0なので、例えば、状態1から4、状態4から1へ移る仕事は逆符号の関係になります。
最大仕事から Helmholtz の自由エネルギーを定義したのと同じように、断熱仕事を用いて新しい状態量である「エネルギー」が定義できます。これは高校物理では内部エネルギーと呼ばれていた物理量です。
任意の温度と示量変数の組(T;X)から基準状態(T*;X*)に移る際に系が外界にする仕事を断熱操作でのエネルギーと定義します。基準状態まで移る操作が存在するとは限らないのですが、そういう操作が存在しない場合は、基準状態から逆に移る操作が可能なことが上で書いた結果を使っていえるので、その断熱仕事の逆符号をエネルギーと定義することにします。
温度を上げる操作についての要請で保証される断熱操作では、系が外界にする仕事は必ず負になるので、エネルギーは温度の増加関数になります。こう定義すると、熱力学的な系がある状態から別の状態へ断熱操作で移る際に、系が外界にする仕事は、二つの状態のエネルギーの差に等しくなります。これが上で書いた要請をエネルギー保存則と呼ぶ理由です。
上で、エネルギー保存則は前提として認めてしまったわけですが、高校で習うような分子運動論を知っていると、違和感があると思います。高校の分子運動論では、この(内部)エネルギーは、力学のエネルギー保存則の単純な帰結として「証明」できるものになっていました。なので、高校物理をやった人は仮定しなくてもよいのではないか、という疑問があるかもしれません。確かに、熱力学の対象となるマクロな系といえども力学の法則にしたがう多数の粒子からなり、全体としてエネルギー保存の式に従うというのが、現代の物理学の常識ですが、このような常識は Newton 力学あるいは量子力学が数学的な体系として完成したときに論理的必然としてマクロな系でのエネルギー保存則が導かれるかというと、そうではありません。われわれはエネルギー保存則に代表される熱力学的な観測事実から、マクロな物質が Newton 力学あるいは量子力学に従う数多くの粒子から構成されているという仮説と完璧に整合しているから、それらが適用できるということです。
経験科学としての論理的な順序について、まず熱力学におけるエネルギー保存則という実験事実があり、そこから分子運動論的な考察を経て、マクロな物質にも力学的考察が適用できるという信念が生まれてくるということになります。
本日は以上になります。以下、資料と【Q6】です。掘り下げると深い問題なので、チャレンジしてみてください。
★Q6
【Q6】単原子分子気体の熱容量は 3NR/2 でしたが、二原子分子理想気体はどのようになるでしょうか?
:1: 3NR/2
:2: 5NR/2 4
@Takuma Kogawa, @Hiroto, @匿名希望, @イスツクエ
:3: 7NR/2
:4: 9NR/2■Naokimen
すでに答えが出ている質問でも何かしら投票していただけるととても嬉しいです
■匿名希望
理学系の熱力学の教科書が今回のWSでの参考文献になっているようですが、機会があれば是非、機械系の熱力学の教科書も参照してみて下さい。工学系である以上、理学系の教科書よりも、図が多用されているようで、特に、日本機会学会の、JSMEテキストシリーズ 熱力学 は、機械系学生の熱力学におけるバイブル的存在でもあり、非常にお勧めできます。
www.amazon.co.jp/dp/4888981043
・Naokimen
コメントありがとうございます。実は僕が1回生の時に受けた熱力学の授業でその本を使っていました(間違えて工学部の先生の授業をとってしまいました)。その本は熱力学の基礎とその応用が網羅的に書かれている反面、等温・断熱操作、エントロピーの導入といった熱力学の理論の部分はあまり書かれていないという印象があります。ただ、熱力学の基礎の必要最低限のことは結構わかりやすく書かれていますし、サイクルなどの応用の部分が詳しく載っているので工学系の人にとっては良い本なのではないかなと思います。
★Yuta
【Q6解答・解説】(解答)5NR/2
(解説)実は、古典統計力学(古典力学を用いた統計力学)で計算すると二原子分子の熱容量は 7NR/2 となってしまいます。まだ量子力学がなかった 19 世紀末の当時、この計算結果が実験値 5NR/2 と一致しないことにボルツマンをはじめとする物理学者たちは頭を悩ませていました。その後、この問題は量子力学の登場により解決されることとなります。具体的には、室温では量子力学の効果により二原子分子の振動の自由度が凍ってしまい、その分だけ 7NR/2 から熱容量が小さくなり、二原子分子の熱容量は 5NR/2 であることが分かりました。興味のある人は「19 世紀物理学の 2 つの暗雲」と検索してみると面白いかもしれません。
明日から第5章です。
第5章 熱とCarnotの定理(Day9,10)
★チクシュルーブ隕石
こんにちは。第5章はチクシュルーブ隕石が担当させて頂きます!
今日は田崎熱力学の第 5 章にあたる部分について紹介・説明させていただこうと思います。 今回取り扱うテーマは熱と Carnot の定理(Carnot サイクル)についてです。解説 pdf を随時 並行で観ながら読み進めていただけるとより深い理解をすることができると思います。
まず初めに「熱」についてお話ししていきたいと思います。ここまで熱力学の話を進めてき てわざわざ熱の話をするのかと思う方がいらっしゃるかもしれませんが、実はここまでの 説明の中に「熱」という概念は登場していませんでした。 前項で断熱操作について取り扱った時に、最初と最後で熱を断った状態で行う操作全般を を断熱操作であるという説明があったと思いますが、直接に「熱」という概念に触れるまで には至っていません。ここからは最大吸熱量という概念を導入する事を目標として「熱」に ついて語っていきたいと思います。
示量変数の組 X で記述される系について等温操作を行うとして、この操作を行う間に系が 外界に対して行う仕事を W、内部エネルギーの変化を ΔU とした時に W=-ΔU という断 熱操作のときのエネルギー保存の式は成り立たないのです。しかし、エネルギー保存の式が 成り立つのは断熱操作であり等温操作では成立しないとしてしまう事は、統一的に物事を 見ていくという物理の思想にそぐわず、あまり建設的な議論となりません。 そこで等温操作でもエネルギー保存則が成り立つために新たな概念を導入する運びとなり ました。その新たな概念こそが「熱」なのです。等温操作においては先ほどのエネルギー保 存の式に系が環境から受け取った熱 Q(もっといえば熱という形で受け取ったエネルギー) を加えた式 W=-ΔU+Q として定義します。(解説 pdf ではより大学で学ぶ熱力学に即し た形で同じ意味の等式を書いております。) おそらくこの形の式を見たことがある方は多くいらっしゃるかと思いますが、このエネル ギー保存則の式こそがまさに高校物理で学ぶ熱力学第一法則となっているのです。また、こ の等式を書き直してΔU=-W+Q とする事で熱 Q の意味をより強く表記に反映する表現方 法もあります。ここで改めて気をつけていただきたい点は二点あり、その一つ目は「熱」と いう存在を私たちが視認することはできないという点です。あくまでマクロな視点から系 が外界にした仕事として私たちが認識できない存在を環境から受け取った熱としてみなし ているのです。また、二つ目は熱を状態量として定義したのではなくエネルギーの移動の一 形態として熱という概念が導入されたという点です。かなりまどろっこしい部分ではあり ますが非常に重要なので是非この二点を押さえた上で読み進めていただきたいです。 さてここからは最大吸熱量について考えていきたいと思います。 この等温操作を行う時に操作の方法を工夫することで吸熱量 Q を最大にする事を考えます。 先ほど説明した等温操作のエネルギー保存則の式から吸熱量 Q を最大にするためには仕事 を最大にすれば良いことが分かります。 断熱操作の章の復習をすると、内部エネルギーの変化によるエネルギーは初めの状態と終 わりの状態が定まると一意に定まる量なので仕事を最大にすれば良いのです。最大の仕事を考える上で用いる概念は最大仕事です(最大仕事については等温操作を取り扱った第 3 章 に説明があります。)。こうして得られたこの等温操作における最大の吸熱量を最大吸熱量 と呼びます。第 3 章でみたように、最大仕事は Helmholtz の自由エネルギーで書くことが できるため、最大吸熱量は Helmholtz の自由エネルギーと内部エネルギーで書けるのです。 最大吸熱量を表現する時に等温環境における Helmholtz の自由エネルギーを用いて書くこ とができるのは非常に面白いのでは無いでしょうか?最大吸熱量の持つ詳しい性質等は解説 pdf の方に書いてありますので一読いただきたいです。
ここからは Carnot の定理に関する話を進めていこうと思います。具体的な内容に触れる前 に、ここからは特に式変形を追わなければ理解が難しい面が出てくると思いますので、是非 解説 pdf を併読いただきながら読んでくださることをオススメいたします。
まず Carnot の定理で主張されていることは「最大吸熱量の比が熱力学的な系と参照点(始 状態と終状態)の選び方によらず、二つの温度によってのみ定まる」ということです。この 定理を証明するために私たちは Carnot サイクルと呼ばれるサイクルを考えます。このサイ クルは温度の異なる二つの熱源の間で動作する可逆な熱力学サイクルの一種なのですが、 このままでは二つの環境を利用する Carnot サイクルに対して Kelvin の原理を適応するこ とができません。そこで新たに逆回りの Carnot サイクルを組み合わせることによって全体 として見た時に実質的に一つの環境と相互作用をしているように見なすことのできる等温 サイクルを作るようにします。そのようにして作られた特定の等温準静操作の最大吸熱量 が結果として 0 となります。このことを系は環境と全く熱のやり取りをしていないと考え、 特定の等温準静操作を同時に断熱準静操作としても捉え直すという試みを Carnot は行いま した。この着想を元にして Carnot の定理を証明・説明していくことができるのです。
最後に熱機関の効率と熱機関としての Carnot サイクルの存在について考えていこうと思い ます。熱機関とは熱の形でエネルギーを受け取り、力学的なエネルギーという形で出力する 装置のことを言います。熱機関というと少し難しいように思われる方がいらっしゃるかも しれませんが、熱機関は私たちの生活の周りに満ち溢れています。古くは産業革命などの時 代からさまざまな機械を効率的に動かすために数多くの熱機関が生み出されてきました。 特に身近なところだと車のエンジンも熱機関の一つです。熱機関を考える時の観点として 常に受け取ったエネルギーのうちどの程度が利用可能に変換できるかという指標である熱 効率というものが考えられていました。そこに現れたのが Carnot サイクルの存在です。 このサイクルの熱効率が普遍的な上限であり、Carnot サイクル以上に効率の良いサイクル が無いということが証明されたのです。解説 pdf に詳しく熱効率の普遍的な上限を求めて いる記述ありますが、Carnot サイクルが最高の熱効率を持っていることを定量的に示され たということは非常に興味深いことだと言えます。
本日の投稿はここまでにさせていただきます。
解説 pdf を一読いただくことで理解を深めていただければ幸いです。
★Q7
Q7】熱は潜在的に系の内部に存在する状態量であるか?
:1: Yes
:2: No 2
@Hiroto, @匿名希望★チクシュルーブ隕石
【Q7】の答え No
熱はエネルギーの移動の一形態で、我々が力学的な仕事として認識できないエネルギーを 熱と定めています。また、上で確認していただいたように熱は操作の過程に依存するもので あるために、熱は状態量ではありません。
明日から第6章です。第6章では主にエントロピーについての話が登場します。このWSでは熱力学の等温・断熱操作を出発点として、エントロピーの正体に迫る事が大きな目的でしたが、遂にエントロピーとは何かを語る時がきました!
是非楽しんでいただければ嬉しいです。
第6章 エントロピー(Day11,12,13)
★Yuta
第6章です。Yutaがやります。よろしくどーぞ!
さて、長く続けてきた熱力学の理論の説明も最終回、クライマックスです。エントロピーをようやく導入します。詳しい式変形や導入の経緯は資料を読んでいただくことにして、流れだけ書かせていただきます。おそらく言葉だけでは分かった気がしないと思うので、この部分に関しては、資料の式変形も合わせて見ていただいた方が分かりやすいと思います。
まず、温度 T,T’を行き来する断熱準静操作を二つ考えます。それらの間に Carnot の定理の最大吸熱量の比の普遍性から関係式が立式できます。最大吸熱量は Helmholtz の自由エネルギーとエネルギーの和として表せることから、結果として式の中には温度 T,T’と、Helmholtz の自由エネルギー、エネルギーが残ることになります。ここで、断熱準静操作系のエントロピーは系のエネルギーと Helmholtz の自由エネルギーの差を温度で割ったものとして定義します。
Helmholtz の自由エネルギーは基準点を置いて定義していたので絶対的な値ではなく、不定性がありましたから、エントロピーも当然その不定性を踏襲することになります。しかし、うまい具合に基準状態を決めてやると、不定性を解消できることが知られています。詳しくは資料に書いてあるので気になる方はどうぞ。
エントロピーの定義は示唆に富んでいます。系のエネルギーと Helmholtz の自由エネルギーは一致しない、つまり、温度一定の環境での仕事と断熱壁に囲まれた場合の仕事が一致しないことが前提として組み込まれているということです。
Carnot の定理とエントロピーの定義から、互いに断熱準静操作で移りあえる状態ならば、二つの状態のエントロピーは等しいことと、たがいに何らかの操作で移りあえる状態について、もしそれらのエントロピーが等しいならば、断熱準静操作が可能であることが導かれます。後者の方は、エントロピーが温度の増加関数(温度に比例する)ということも前提にしています。
また、エントロピーを用いると、示量変数を固定したまま温度を上げる断熱操作が不可逆であること(Planck の原理)が示せます。証明は省略しますが、簡単にいうとこれは、摩擦などの力学的な操作でものを暖めることはできても、冷やすことはできないという実験事実に対応します。
エントロピーの最も本質的な性質は、エントロピーの大小関係によって、断熱操作が可能かどうか完全に決定されるという点にあるということです。これをエントロピー原理といいます。ちゃんとした主張として書くと、「示量変数の組 Xで記述される任意の熱力学的な系について、X と X’を互いに何らかの操作で移りあえるとしたとき、任意の温度 T で、状態(T;X)でのエントロピーが状態(T’;X’)でのエントロピーより大きくならないことが、状態(T;X)から状態(T’;X’)への断熱操作が可能であるための必要十分条件である」というふうになります。
さらに、こういった変数が他にはなくエントロピーのみであることも示すことができます。(これは資料に載っていないですが、参考にした本に証明が載っているので、知りたければ物理学部員に聞いてください)
系の中でも部分的に温度が違う状態、例えば一つの系を断熱壁で二つの部分に分けて何か操作をしてやったとき、温度が違う部分が生まれます。こういう状態を複合状態と呼ぶのですが、この時、それぞれの部分の状態を A と B、変化後を A’,B’とします。また、状態 A のエントロピーを S(A)と書くことにします。
まず、S(A)>S(A’)のとき、状態 A から A’に断熱操作で移ることはできない、というのがエントロピー原理を使うと言えることです。断熱操作が可能か不可能かの基準にエントロピーが使えます。
しかし、状態 B と B’におけるエントロピーの差が A と A‘のエントロピーの差より大きいとき、エントロピーS(A)+S(B)<S(A’)+S(B’)が成り立つことがあり、そうすると複合状態(A,B)から(A’,B’)に移ることが可能になります。
まとめると、A から A’、B から B’へそれぞれ何らかの操作で移ることができ、S(A)+S(B)<S(A’)+S(B’)が成り立つとすると、(T;A,B)から(T’;A,B)へ移る断熱操作が可能だということになります。これは A 系における「不可逆性」を B 系の十分な「可逆性」で「打ち消す」ことによって A 系単独では不可能な操作を行うことができるという、エントロピーの不思議な特徴を示す例です。
エントロピー原理によって、熱力学的な系において、ある状態を別の状態へ移す断熱操作が可能かどうかは、二つの状態のエントロピーの大小によって完全に決定されることが分かりました。断熱準静操作はエントロピーを一定に保ちますが、近似的にしろ準静操作を実現するには恐ろしく注意深い操作が必要になります。そこで、一般の熱力学的な系で断熱操作を行い、状態(T;X)から(T’;X’)が得られるなら、この操作の間にエントロピーは増大しているだろうと思われます。言い換えれば、断熱された系に様々な操作を行うと、エントロピーは増加し続けていくということです。これが有名なエントロピー増大則のことです。断熱された系での自発的な変化では必ずエントロピーが増加するといった狭い意味でよく書かれていますが、実際はもっと広い意味で成り立っており、外界からエネルギーを使って仕事をしてやっても、外界に仕事としてエネルギーを取り出してやっても、エントロピー増大を食い止めることはできないというより広い内容を含んでいます。熱として外界とエネルギーをやり取りできれば、エントロピーは減少できますが、仕事としてのみエネルギーをやり取りする限りは決して減少できません。これがエントロピー増大則の本質といえるでしょう。
系の内部に断熱壁を設ければ部分的に温度が異なる平衡状態が作り出せました。これを複合状態と断熱操作の章で紹介しましたが、エントロピー原理はこの複合状態でも成り立つことが知られています。証明もできますが、興味があれば資料に書いてあるのでそちらを読んでください。この具体例として熱的接触でのエントロピーの増加が挙げられます。示量変数の組が一定値に固定された熱容量一定の固体の系があり、それぞれ温度が違うものを断熱壁で仕切って並べ、断熱壁を透過壁に置き換えてやります。そうすると、二つの固体のエネルギーは変化しますが、我々の目に見えるエネルギーのやり取りがないので熱のみのやり取りが起こったことになります。
このとき、エントロピーの変化を計算してやると、正になることがわかるので、二つの物体の温度が等しくなる断熱操作は不可逆であることが分かります。勿論、この逆操作におけるエントロピーの減少分を打ち消すほどエントロピーが増加する操作を一緒に行なえば、逆操作に当たる断熱操作も可能になるのがエントロピーの醍醐味であり不思議なところです。
というわけでエントロピーまでの熱力学の理論の一連の流れをざっとさらいましたが、いかがだったでしょうか。きっと、言葉面だけでは理解した気持ちにはなれないと思います。我々物理学部の説明力不足な面もあるのかもしれませんが、普通の言葉だけで書こうとするといかに冗長でまどろっこしく、分かりにくい表現になってしまうかがわかる良い経験になったかもしれません。もし私たちの説明がある程度わかっていただけたのなら、それはそれで嬉しいです。WS で紹介する内容は以上になりますが、資料は専門外の人でもわかりやすく書くよう心掛けましたので目を通していただけると幸いです。
本日は、【Q8】、【Q9】を投下して終了します。明日11/4はWSお休みなので、答えていただけると嬉しいです!明後日11/5の夜までにいただいたメッセージの返信を随時投稿します。
★Q8
【Q8】エントロピー増大則の不等式を見たことがありますか?
:1: 見たことがある 3
@Yujin, @Hiroto, @匿名希望
:2: 見たことがない 5
@蜆一朗, @コバ, @けろたん, @イスツクエ, @ていりふびに★Q9
【Q9】エントロピー増大則の身近な例を何か思いつきますか?
■匿名希望
Q9に関して、
自分の部屋の状態とかですかね。
引っ越し直後はものがきれいに整頓されているのに、時間が経つにつれて無秩序にぐちゃぐちゃになるあの感じもエントロピー増大則に感じます。
・Hiroto
僕もこの匿名さんの例を挙げようと思ったのですが、ぼんやりとした記憶で「エントロピーを部屋の乱雑さで捉えるのは間違い!」という否定意見も見かけたことがあり、その点も含めて物理学部の有識者に答えていただきたい気持ちがあります(変な要望すみません笑)。
・Yuta
匿名希望さん、Hirotoさん、コメントありがとうございます。エントロピーは、ここで考えている熱力学上では「熱力学的系の断熱操作における操作の不可逆性の指標」として導入された状態量でした。
現実世界に適用する場合、外界から断熱された系として何を選べばいいかが重要になってきますが、今回の場合、モノを動かすのは人間で、モノと熱のやり取りをするので、部屋と人を合わせた系を考えないといけません。すると、人間がモノを動かすとき体内でエネルギーの変換等が行われているので、モノを片付けるにしてもモノを散らかすにしても系のエントロピーは増加していることになります。これはエントロピー増大則には矛盾していません。部屋を外界から断熱された系とみなし、モノを動かすのに人間ではなく何らかの外界からの仕事を使うとすると、その仕事が断熱準静的過程ならエントロピーは変化しないことになりますが、厳密に断熱準静的過程をすることは現実には不可能なので、エントロピーは増大することになります。
現実には実現不可能な前提条件なので、エントロピー増大則を現実世界に適用するのは間違いといえば間違いですが、比喩として用いる分にはわかりやすい例ではないかというのが物理学部からの意見になります。
★Yuta
すみません…今気づきましたが、第6章の資料を貼るのを忘れていました。
【Q9】解答例
コーヒーをかき混ぜると元に戻らない、固体が水に溶ける現象など
エンディング(Day14)
★Q10
【Q10】ここまでの熱力学の理論をどのくらい理解できましたか?
:1: よく理解できた 2
@匿名希望, @Yujin
:2: 大体理解できた 1
@Hiroto
:3: あまり理解できなかった 2
@蜆一朗, @コバ
:4: まったく理解できなかった★Yuta
追加の【Q10】になります!参加してくださった方は、回答よろしくお願いします。本日は、部長による終わりの挨拶でこのWSを締めくくりたいと思います。
★Naokimen
これで今回のワークショップ「熱力学〜エントロピーとは〜」を終了します。2週間ありがとうございました。note記事にログが残りますので、時間がなくて最後まで追えなかった人などはぜひ空いている時間等に読んでいただければ幸いです。なお、著作権の関係で、pdfとして添付した資料はnote記事には載せないので、興味のある人はダウンロードしてもらって構いません(外部に漏らさないようにお願いします)。では、次回またお会いしましょう。次回のテーマは「特殊相対論入門」です。お楽しみに。
この記事が気に入ったらサポートをしてみませんか?
