中学生理科 化学分野のまとめ
今回は、小学校から一気に難易度が上がる科目の一つである、中学理科を解説していきます。理系科目超絶得意だった私が、誰よりも分かりやすく解説していきます。今回は化学分野です。
水溶液の性質
▼濃度の計算方法
(例)水100gに食塩50gが溶けている。この水溶液の濃度は何%?
(答)50÷(100+50)×100≒33.3%
(ポイント)
・水溶液の濃度=溶質のg÷溶液(溶質+溶媒)のg
溶液(溶質+溶媒)で割ることに注意!!!
▼溶解度
溶解度とは、「溶媒100gに限界まで溶質が何g溶けるか」という数値です。これは、温度によって変わりますし、また溶質によっても数値が変わります。
例えば、塩化ナトリウム(食塩)の場合20°Cだと35.8g、ミョウバンの場合20°Cだと11gとなります。
溶解度は普通、以下のグラフで示されます。このグラフを溶解度曲線といいます。
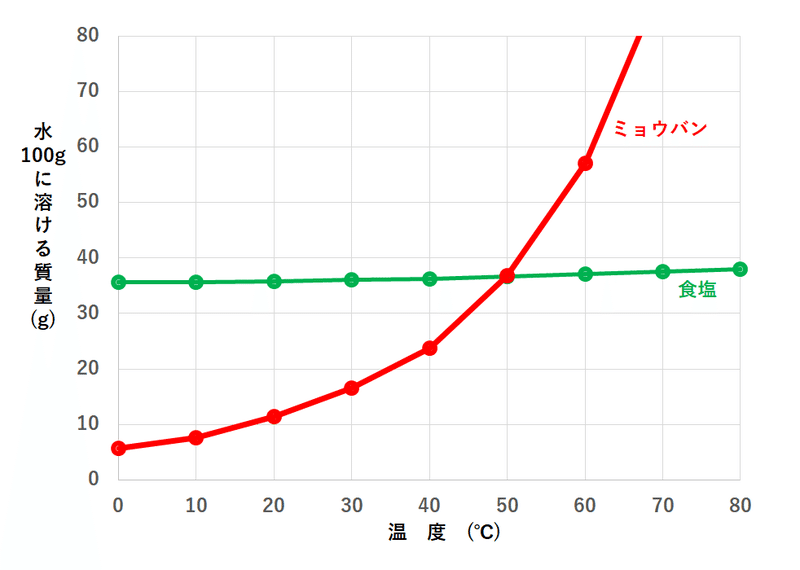
溶解度はミョウバンの場合、20°Cだと11g、60°Cだと57gということが上の曲線から分かりますね。
そして、限界まで溶質を溶かした溶液を、飽和水溶液といいます。
さらに、「塩化ナトリウムの場合20°Cだと35.8g」と述べましたが、同じ温度で水が2倍の200gあった場合、溶解度も同じく2倍になり35.8×2=71.6gとなります。
(ポイント)
・溶解度とは、「溶媒100gに限界まで溶質が何g溶けるか」という数値
・同じ温度で溶媒が2倍あった場合、溶解度も2倍になる
▼再結晶
再結晶とは、「溶解度の差を利用して、溶質を溶かされていない状態に戻すこと」です。
例えば、下の溶解度曲線で、ミョウバンの溶解度は温度によって差があることに気が付きます。
ここから先は
4,361字
/
12画像
¥ 1,280
この記事が気に入ったらサポートをしてみませんか?
