
公務員試験化学(化学結合)
このnoteでは、ワンコインで公務員試験でよく出る知識を解説します。
ながら勉強とか、スキマ時間勉強で気軽に1点とりましょう!
お題
化学結合に関する記述として,妥当なものはどれか。
1.電気陰性度の大きい原子が隣接分子の水素原子と引き合うような、水素原子を仲立ちとした分子間の結合を水素結合という。
2.2個の原子の間で、それぞれの原子が価電子を出して引き合うような、互いの静電気的な力(クーロン力)による結合を共有結合という。
3.陽イオンと陰イオンとの間に働く力をファンデルワールス力といい、この力による結合をイオン結合という。
4.金属の原子が集合した金属の単体において、隣り合う2個の原子の間で共有される価電子による結合を金属結合という。
5.電荷の片寄りがある極性分子の分子間に働く、無極性分子より強い静電気的な引力による結合を配位結合という。
本テーマは以下のnoteの続きものになります。
こちらの後半部分を読んでいないと内容の理解が難しいので、セットで学習をおすすめします!
なお、化学結合の分野も出題されやすくて、かつ、得点しやすいテーマです。
化学結合
原子同士の結合や分子同士の結合のことを化学結合と呼びます。
❶原子同士の結合
・イオン結合
・共有結合
・金属結合
❷分子同士の結合
・分子間力
・水素結合
原子間の結合
イオン結合
陽イオンと陰イオンの間に生じるクーロン力(静電気力)によって結合が形成される。

共有結合
原子間で最外殻電子(価電子)を出し合い、共有電子対を作って結合することを共有結合という。
電子を共有した結果各原子は希ガス型電子配置となって安定する。

共有結合によってできる物質を分子と呼ぶ。
金属結合
金属原子の最外殻の一部が重なり、価電子が全ての原子に共有されることでできる結合。
この時の価電子は特定の軌道に縛られることなく自由に動き回れるので自由電子と呼ぶ

補足:配位結合
窒素Nの最外殻電子数は5個であり、これに水素H×3個と共有結合するとアンモニアNH3となる。
下の図のように、アンモニアは非共有電子対(どの原子とも共有していない電子のペアのこと)をもつが、これにどさくさに紛れて水素イオンH+(こいつは電子を一つももたない!)がくっつくことができる。
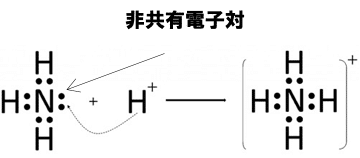
このような、非共有電子対を介した結合を配位結合といい、見かけ上共有結合と区別はつかない。
この記事が気に入ったらサポートをしてみませんか?

