プラナリアの有性化物質 ~アミノ酸の不思議~ 論文紹介
プラナリアの有性化物質 ~アミノ酸の不思議~
論文掲載年 2017年
掲載雑誌 Scientific Reports
論文タイトル The identification of D-tryptophan as a bioactive substance for postembryonic ovarian development in the planarian Dugesia ryukyuensis
和文タイトル リュウキュウナミウズムシの胚発生後に起きる卵巣形成を促す生物活性物質としてD-トリプトファンを発見した
著者 Kazuya Kobayashi, Takanobu Maezawa, Hiroyuki Tanaka, Hiroyuki Onuki, Yurie Horiguchi, Hiroshi Hirota, Tetsuo Ishida, Kihachiro Horiike, Yasutoshi Agata, Manabu Aoki, Motonori Hoshi and Midori Matsumoto
論文へリンク https://www.nature.com/articles/srep45175
プラナリアの有性化を誘導する物質を発見した2017年の論文です。
プラナリアは再生で有名な生物です。半分に切ったり、もっとたくさんに切り刻んだりしても、その断片から一匹のプラナリアが再生します。今回の論文では、有名な再生ではなく性の転換を扱っています。性転換というとオスからメスに、メスからオスにということが思いつきますが、プラナリアは雌雄同体ですので、オス、メスというものが存在しません。プラナリアの性転換は無性から有性への転換のことになります。
プラナリアは種類によって増殖の仕方が違います。無性生殖する種類、有性生殖する種類、そしてその両方をする種類の3つがあります。無性生殖では体がちぎれ、ちぎれた部分が再生することで増殖します。有性生殖では雌雄同体ですが、別々の個体が交接することで精子の交換を行い、受精卵を産みます。3つ目の両方する種類は季節によって増殖方法を変えている種類です(漫画参照)。無性生殖では生殖器官(卵巣、精巣、交接器官など)は必要ないため、無性生殖するプラナリアは生殖器官を持ちません。一方で、有性生殖では生殖器官が必要になります。そのため、生殖方法を変えるには、生殖器官を新たに作る必要があります。生殖器官を持たない無性のプラナリアに、生殖器官を持つ有性のプラナリアを食べさせることで有性化することが分かっています。今回の論文で使われているリュウキュウナミウズムシはイズミオオウズムシという有性のプラナリアを刻んでエサにすることで安定的に有性化することが出来ます。つまり、このエサの中に有性化させる物質があることが分かります。今回の論文ではこの物質を発見することに成功しています。その結果が新たな疑問を生み出していることが、いかにも科学研究らしいです。
プラナリアには再生以外にも、今回の論文で取り上げたような面白い現象があります。今後も注目して行きたいと思います。
補足は論文には書かれていないことです。分かりやすくするために追加した文章になります。
この論文で分かったこと
・有性化物質としてトリプトファンを発見した。
・トリプトファンは卵巣形成を誘導できるが、完全な有性化は出来ない。
・トリプトファンのD体はL体より500倍も強い能力を持つため、主にD-トリプトファンが卵巣形成を誘導している。
[背景]
多くの動物は始原生殖細胞を体細胞とは区別し、胚発生の間に生殖細胞の発生を始めます。(補足:始原生殖細胞から卵原細胞、卵母細胞、または精原細胞、精母細胞へと分化して最終的に卵や精子になる。)しかし、体内に多能性幹細胞を持つヒドラ、プラナリア、環形動物(ミミズなど)や群体ボヤといった動物では、胚発生が終わった後に多能性幹細胞や休止中の始原生殖細胞から生殖細胞の発生が起こります。この胚発生後に起こる生殖細胞の発生のメカニズムはほとんど分かっていません。
淡水生のプラナリアは新生細胞と呼ばれる多能性幹細胞を持っています。新生細胞はプラナリアの体全体にあり、再生を行うために全ての種類の細胞に分化することが出来ます。いくつかの種類のプラナリアは有性生殖と同じように無性生殖で増えることが出来ます。無性生殖では生殖器官が出来ることのないまま分裂し、失った部分を再生します(漫画参照)。それらは季節ごとに両性の生殖器官を作り、有性化します。研究室では低温に置くことで季節変化を促すことが出来ますが、有性化を完全に起こすことは出来ません。その為、有性化の仕組みの研究には、確実に再現性良く有性化を起こす方法が必要です。無性のプラナリアは、同じ種類または別の種類の有性のプラナリアを切り刻んで与えることで有性化することが報告されています。このことは、有性のプラナリアには有性化を誘導する物質(有性化物質)が含まれていることを示しています。この物質が何であるかを決めるために、無性のプラナリアを有性化させるシステムを作りました。無性のリュウキュウナミウズムシは有性のイズミオオウズムシをエサとして与えることで有性化させることが出来ます。これまでの研究では、この物質は熱に強く、水に溶けやすいことが分かっています。
無性のリュウキュウナミウズムシは頭の後ろの予定卵巣領域にメスの始原生殖細胞(将来卵になる)を持っています。有性化するときは、初めにこの始原生殖細胞から卵原細胞、そして卵母細胞が出来始めます。卵巣が成長した後に、オスの始原生殖細胞が出来始め、新生細胞から卵黄腺と交接器官が出来始めます。最終的に、全ての生殖器官が成熟します(図1)。つまり、有性化物質は最初にメスの始原生殖細胞から卵巣を作ることを引き起こすことが分かります。卵巣が成長しなければ、他の生殖器官は決して作られることはありません。このことは、有性化物質が少なくとも卵巣形成に関係している物質を含んでいることを示しています。
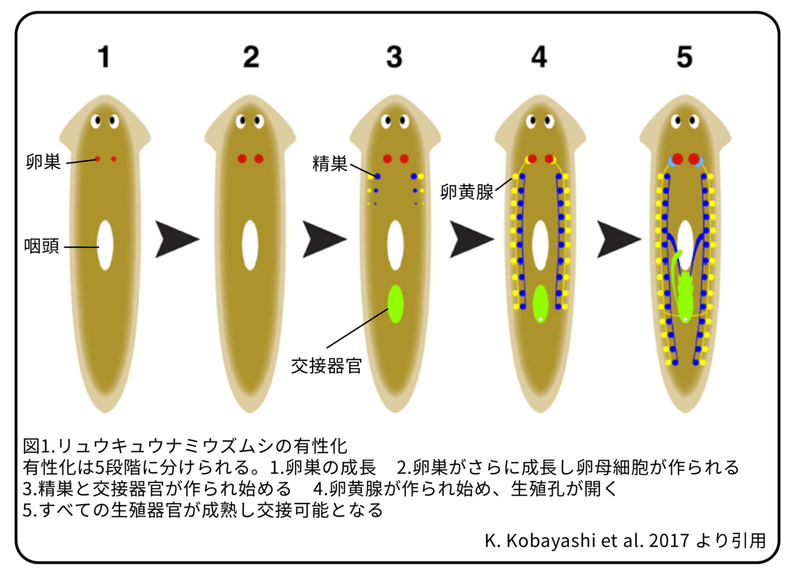
本研究では、卵巣形成に関係する有性化物質を発見することを目的としました。その結果、D-トリプトファンが有性化物質であることを発見しました。このことは生殖細胞の発生に対するアミノ酸のような低分子量物質の役割について、新たな研究の道筋を開きました。
[結果]
イズミオオウズムシからL-トリプトファンを発見
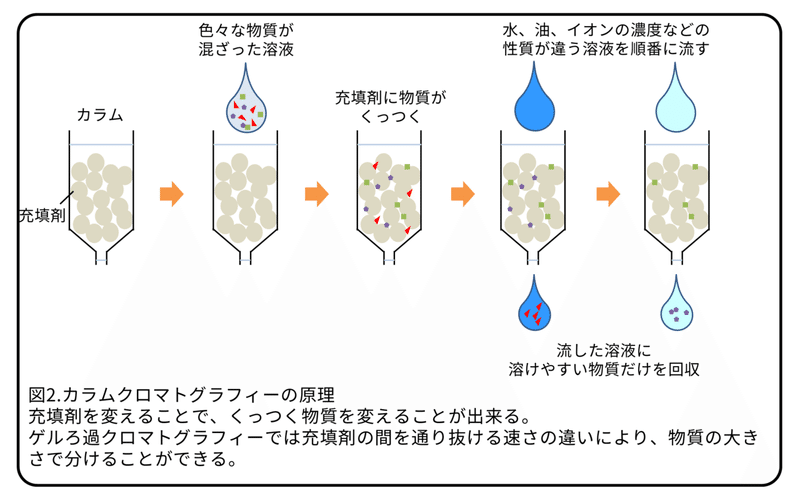
有性化物質を探すために12 gの凍らせたイズミオオウズムシ(約210匹)を使い、図3 にある順番でカラムクロマトグラフィー(原理は図2参照)を行いました。各段階で分けられた溶液は乾燥させた後に、いつものエサである鶏のレバーに混ぜてプラナリアに与えました。この方法では、エサを4週間与えた後に卵巣と交接器官を外見で確認することで評価しました。もし、エサに有性化物質が含まれていれば、無性だったプラナリアに卵巣と交接器官を確認することが出来ます。実際に、卵巣と交接器官が確認できたプラナリア(図3、CO)では、全ての生殖器官が出来始めていました。一方で、卵巣だけが確認できたプラナリア(図3、OV)では、他の生殖器官はまだ出来始めていませんでした。イズミオオウズムシを210匹すりつぶし、超遠心で沈殿と上澄みに分けました。この上澄みを濃縮した後にシリカゲルのカラムに加えた後に、メタノール濃度が0、10、100%の溶液を順に流して回収しました(図3、Fr.M0,Fr.M10,Fr.M100)。Fr.M0またはFr.M10を混ぜたエサを与えたプラナリアは25匹全てで卵巣と交接器官が確認できました。以前にFr.M0を与えたプラナリアではFr.M10を与えたプラナリアよりも性成熟のマーカー遺伝子が強く発現していることが分かっていましたので、今後はFr.M0を使うことにしました。Fr.M0を使って、シリカゲルのカラム、ゲルろ過クロマトグラフィー、イオン交換クロマトグラフィーを順に行い、各段階でエサに混ぜることで有性化をすることを確認したものを次の操作に使うように実験を行いました(図3)。完全な有性化を誘導する能力は、操作を重ねていく段階で徐々に弱くなっていきましたが、卵巣形成を誘導する能力は操作が終わった溶液に残っていました(図3、Q1)。これは完全な有性化にはいくつかの段階があり、複数の物質によって制御されていることを示唆しています。そこで、本研究では、最初の段階である卵巣形成を誘導する物質を発見することを試みました。
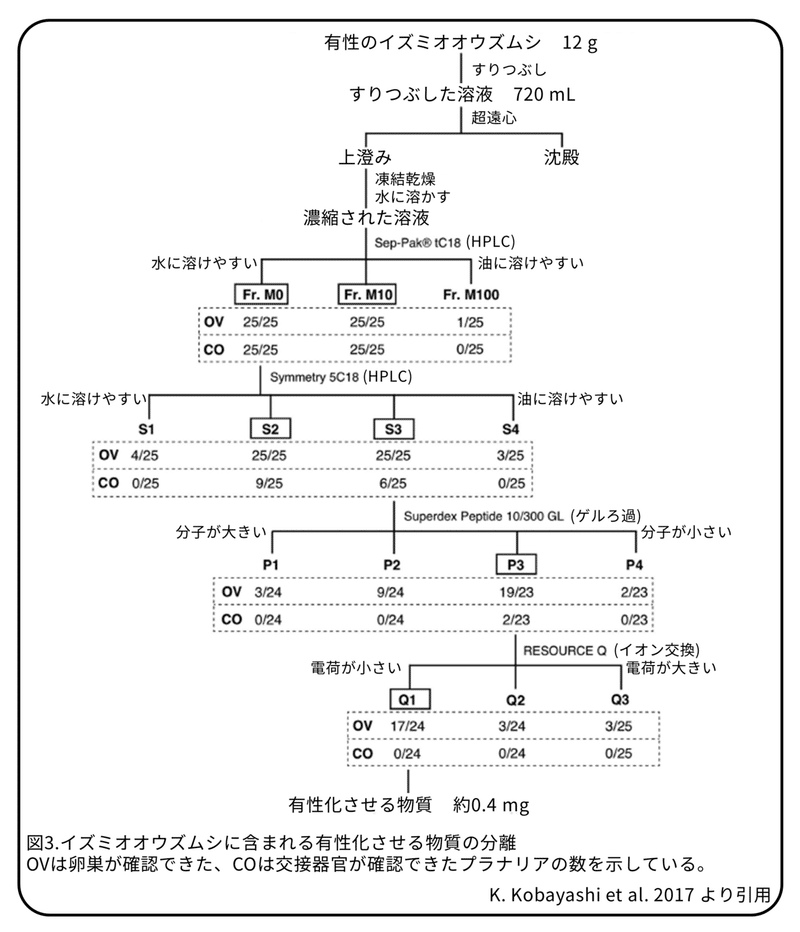
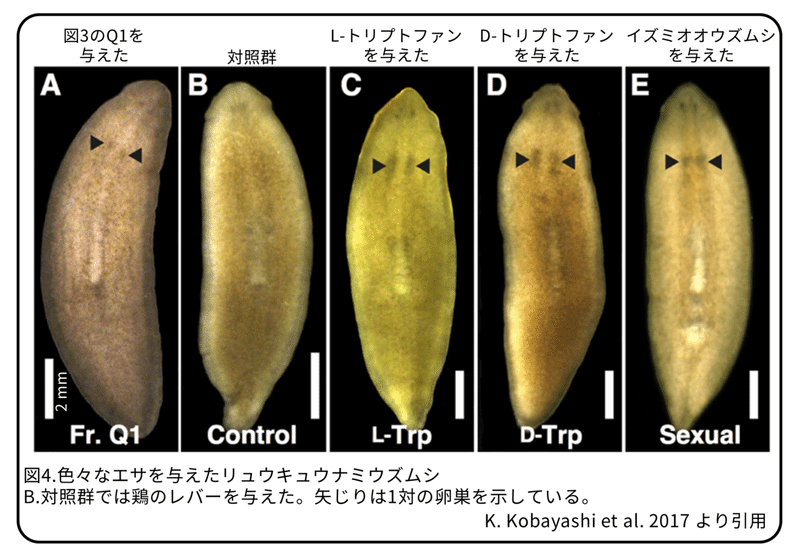
Q1を与えた無性のプラナリアは卵巣形成が誘導されました(図4)。この溶液を凍結乾燥したところ0.4 mgの無色の粉末(物質1)になりました。物質1を解析したところ、市販のトリプトファンと一致することが分かりました。立体構造を解析した結果、L体であることが分かり、物質1はL-トリプトファンであることが分かりました。
L-トリプトファンの投与によって無性のプラナリアに卵巣が形成される
予備実験からFr.M10(図3)にもトリプトファンが含まれていることが分かりました。イズミオオウズムシにトリプトファンがどれだけ含まれているかを調べるために、新たに4 gのイズミオオウズムシを使い、同じ操作を行ってFr.M0とFr.M10を回収しました。この二つを合わせた溶液に含まれるトリプトファンは2160 ㎍(イズミオオウズムシ1 g当たり540 ㎍)でした。
L-トリプトファンが効果的に卵巣形成を誘導できるのかどうかを確認するために、いつものエサとして使っている鶏レバーに含まれるL-トリプトファンの量を調べることが必要でした。鶏のレバーには卵巣形成を誘導する能力はありません(図4B)。鶏レバー4 gに含まれるトリプトファンは480 ㎍(鶏レバー1 g当たり120 ㎍)でした。鶏レバーは4週間で150 mg与えていましたので、トリプトファンの量としては20 ㎍より少ないことになります。そこで、与える市販のトリプトファンの最小量を0.3 ㎍/匹/日(L-トリプトファン200 ㎍を4週間で25匹のプラナリアに与える)にしました。(補足:鶏レバーの4週間での量がプラナリア何匹に対して与えられていたのかは書かれていないため分から無い。通常は、同じ条件で実験をするため、鶏のレバーの量は25匹に対するものだと考えると、最小量としてその10倍を使ったことになる。)逆に、4 gのイズミオオウズムシに含まれるトリプトファンが2160 ㎍だったので、最大量を3 ㎍/匹/日(L-トリプトファン2000 ㎍を4週間で25匹のプラナリアに与える)にしました。(補足:詳細は書かれていないが、4週間で25匹に与えるイズミオオウズムシが4 gだったためであると思われる。)市販のL-トリプトファンを毎日4週間与えたところ、Q1を与えた時と同様に卵巣形成が誘導されました。7週間以上与えると、卵巣は前後に成長しました(図4C)。
イズミオオウズムシにはD-トリプトファンがあり、卵巣形成に影響する
予備実験ではトリプトファンのL体でもD体でも卵巣形成を誘導することが分かりました(L体D体については図5参照)。イズミオオウズムシにD-トリプトファンが含まれているかを調べたところ、トリプトファン全体の0.5%がD-トリプトファンでした。つまり、4 gのイズミオオウズムシには10 ㎍のD-トリプトファンが含まれていました。
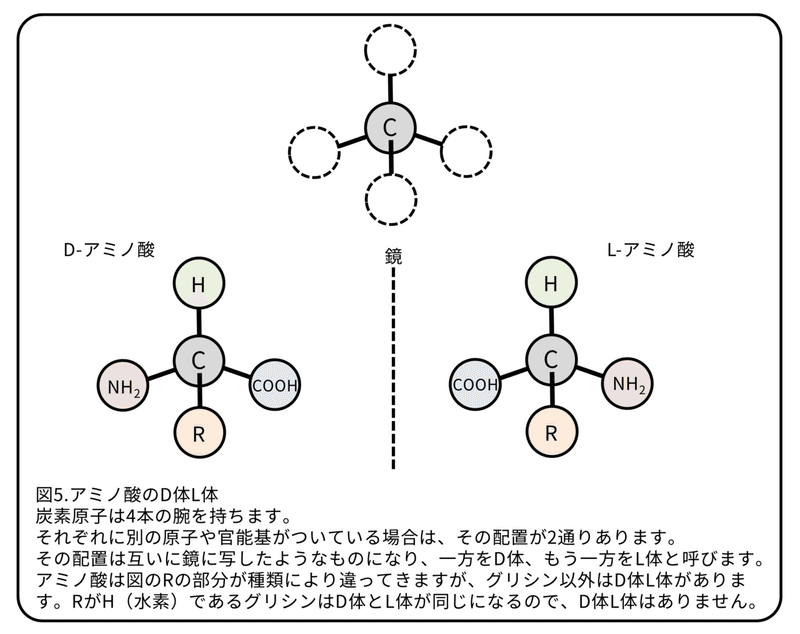
D-トリプトファンを無性のプラナリアに与えてみました。4 gのイズミオオウズムシに含まれる量を参考にして、0.01 ㎍/匹/日(D-トリプトファン約10 ㎍を4週間で25匹のプラナリアに与える)を標準量にしました。このプラナリアはQ1を与えた時と同様に卵巣形成が誘導されました(図4D)。面白いことに、0.0001 ㎍/匹/日(D-トリプトファン約0.1 ㎍を4週間で25匹のプラナリアに与える)の量でも卵巣形成は誘導されました。
L-またはD-トリプトファンの卵巣形成を誘導する効果を50%有効量として計算したところ、D体は0.55±0.11 ng/匹/日となり、L体の0.30±0.03 ㎍/匹/日の500倍の効果があることが分かりました。(補足:50%有効量は与えられたプラナリアの半分が有性化するトリプトファンの量。少ないほど効果が強い。)
トリプトファンを投与したプラナリアの卵巣の状態を遺伝子発現
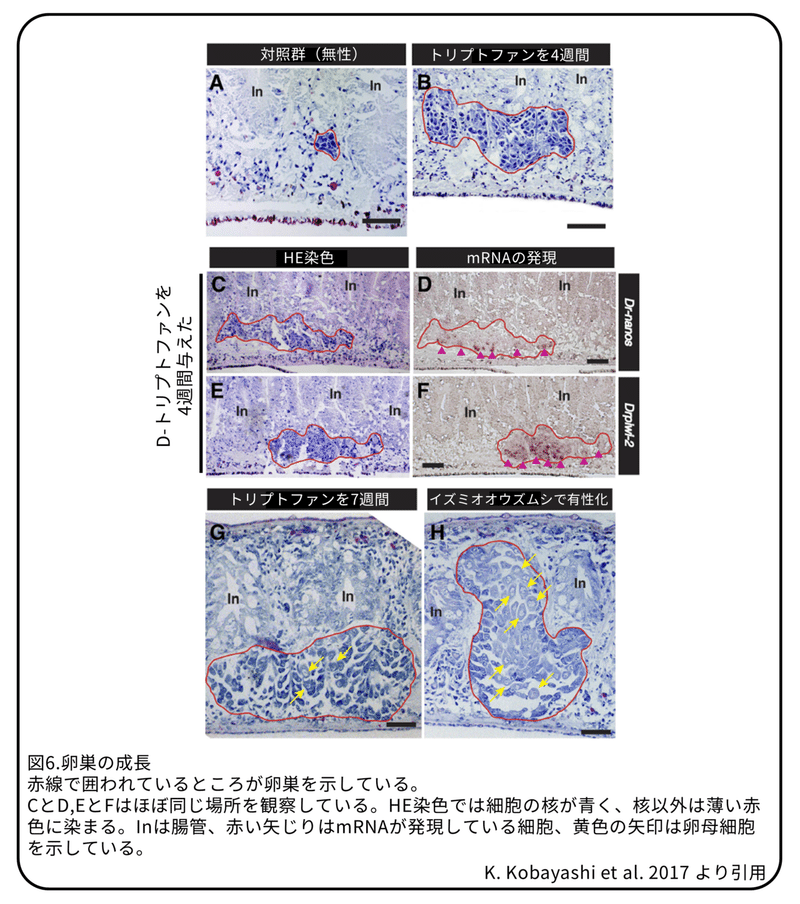
トリプトファンによって誘導された卵巣を組織学的に解析しました。鶏レバーを与えられたプラナリアでは卵巣原基が確認できました(図6A)。一方で、D-トリプトファンを4週間与えられたプラナリアでは始原生殖細胞が増殖している様に見えました(図6B)。この細胞が始原生殖細胞か卵原細胞かを調べるために、Dr-nanosとDr-piwi2という遺伝子の発現を調べました。無性のプラナリアではDr-nanosは卵巣原基に、Dr-piwi2は卵巣原基と同じように新生細胞に発現していました。有性のプラナリアではDr-nanosは卵原細胞や卵母細胞ではなく始原生殖細胞に強く発現していました。一方で、Dr-piwi2は卵母細胞ではなく、始原生殖細胞と卵原細胞に強く発現していました。D-トリプトファンを与えたプラナリアではDr-nanosとDr-piwi2の発現が卵巣で見られました(図6D, F)。これはD-トリプトファンを与えたことによって始原生殖細胞から卵原細胞への分化が進んでいることを示しています。D-トリプトファンを7週間まで与えた場合、卵巣は十分に大きくなり、性的に成熟したプラナリアと同じように見えました。組織学的解析では、D-トリプトファンによって誘導された卵巣には少しの卵母細胞が確認されましたが、性的に成熟したプラナリア(イズミオオウズムシを与えられたプラナリア)では多くの卵母細胞が確認されました(図6G,H)。この結果はトリプトファンが卵母細胞の成熟にほとんど効果が無いことを示しています。
無性と有性のリュウキュウナミウズムシの体内にあるトリプトファンの解析
無性と有性のリュウキュウナミウズムシ4 g(無性は約2000匹、有性は約400匹)に含まれるトリプトファンの量を測定しました。有性のプラナリアではトリプトファンの量が多く、無性のプラナリアと比較して約25倍の量がありました(無性のプラナリア:70 ㎍/g、有性のプラナリア:1780 ㎍/g)。D-トリプトファンの割合について調べたところ、無性のプラナリアでは全トリプトファンの0.2%、有性では1.4%がD-トリプトファンでした。
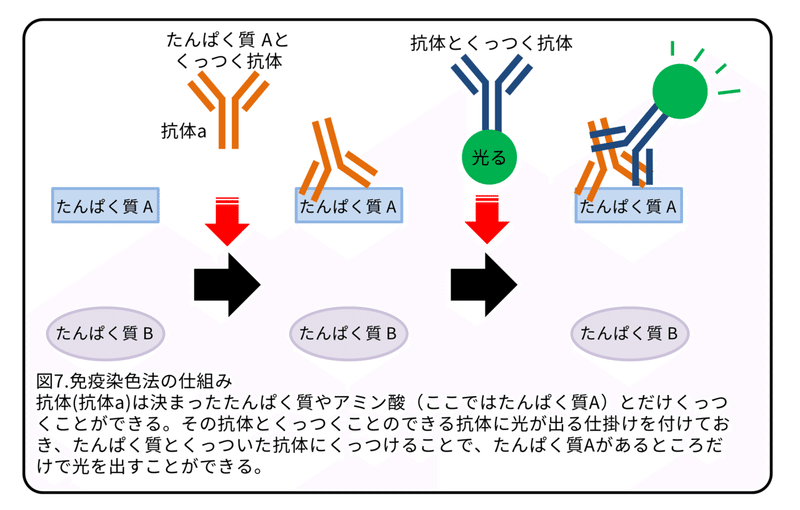
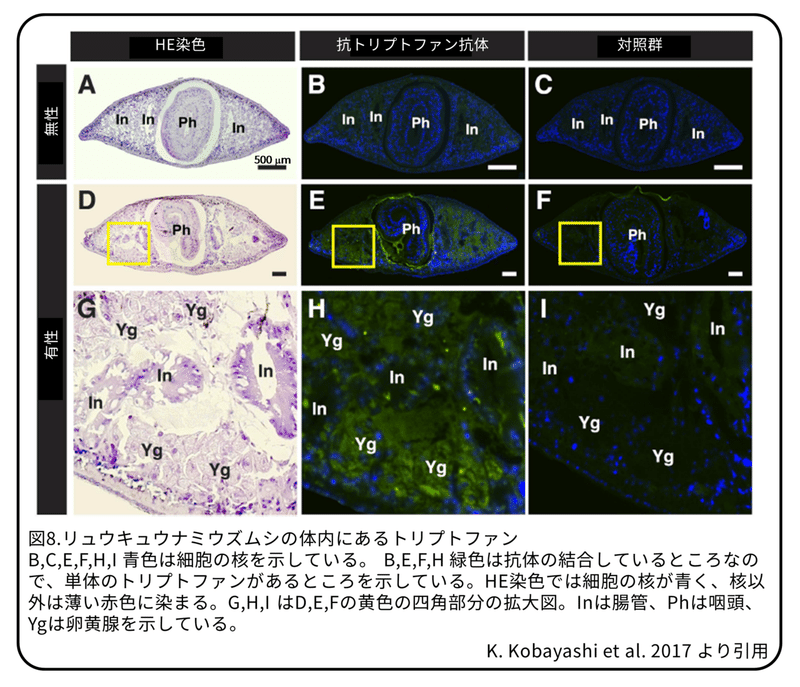
有性のプラナリアが大量のトリプトファンをどこに貯蔵しているかを調べるために、単体のトリプトファンを認識する抗トリプトファン抗体を使って免疫染色(原理は図7参照)を行いました。無性のプラナリアでは、腸管に弱い光が見られました(図8B)。有性のプラナリアでは、咽頭を囲む細胞層と卵黄腺に強い光が見られました(図8E,H)。この結果から、有性のプラナリアでは遊離しているトリプトファンはほとんどが卵黄腺にあることが分かりました。
[考察]
本研究では、卵母細胞は未成熟なままでしたが、卵巣形成を誘導する物質としてD-トリプトファンとL-トリプトファンを発見しました。トリプトファンによって誘導された卵巣には少ないながらも卵母細胞がありましたので、トリプトファンには始原生殖細胞から卵原細胞へと分化させる能力あると言えます。このことから、トリプトファンは始原生殖細胞の増殖と卵原細胞への分化の両方もしくはどちらか一方に対して重要な役割を持っているだろうと考えられます。一般的に、単体のD-アミノ酸はL-アミノ酸からアミノ酸ラセマーゼという酵素により作られます。多量のL-トリプトファンをプラナリアに与えることで、L-トリプトファンから作られたD-トリプトファンを含む代謝物の増加を引き起こし、この代謝物が卵巣形成に影響していると考えられます。D-トリプトファンによる卵巣形成を誘導する能力はL-トリプトファンの500倍も強いため、D-トリプトファンが主に卵巣形成を誘導する物質として働いるはずです。
今回の結果より、L-トリプトファンはリュウキュウナミウズムシ4 g当たり、無性の場合は0.6 ㎍、有性の場合は100 ㎍含まれていることになります。また、免疫染色の結果より、多量のL-トリプトファンは主に卵黄腺にあると考えられます。D-アミノ酸の生成と分解はラセマーゼとD-アミノ酸分解酵素によって制御されています。しかし、L-トリプトファンからD-トリプトファンを作るラセマーゼはどの動物でもまだ見つかっていません。プラナリアでは、未発見のラセマーゼによってD-トリプトファンが作られていると考えられます。また、プラナリアの腸内細菌によってD-トリプトファンが作られ、プラナリアに与えられている可能性もあります。D-トリプトファンを含む、中性・塩基性D-アミノ酸を分解するD-アミノ酸酸化酵素はヒトを含むいくつかの動物で発見されています。以前に、リュウキュウナミウズムシのD-アミノ酸酸化酵素がD-トリプトファンを分解することは確かめられています。この酵素はリュウキュウナミウズムシの卵塊内にはほとんどありません。(補足:プラナリアではいくつかの受精卵と栄養を含んだ卵黄腺細胞をひとまとめにした卵塊という形で卵を産む。)これは卵黄腺にあるD-トリプトファンはD-アミノ酸酸化酵素による分解から守られていることを示しています。また、有性のプラナリアでは無性のプラナリアよりも多量のD-トリプトファンを持っていることの理由の一つでもあります。卵黄腺細胞に含まれたD-トリプトファンは胚発生中の栄養として使われるので、胚はD-トリプトファンを受け取っていると考えられます。胚発生の最後の段階では、卵巣は形成され始めませんが、メスの始原生殖細胞は現れます。孵化後にプラナリアの幼体はこのD-トリプトファンを卵巣形成のために使うのではないかと考えられます。(補足:有性のリュウキュウナミウズムシからは無性と有性の両方が生まれる。)
D-アミノ酸酸化酵素は無性のプラナリアで多く発現していることが分かりました。面白いことに、このD-アミノ酸酸化酵素を人為的に減らすことで、無性のプラナリアは有性化しました。これはD-アミノ酸酸化酵素の減少によりD-トリプトファンの濃度が上昇し、その結果、卵巣形成が誘導されたことを示しています。自然界では、環境の変化によってリュウキュウナミウズムシの有性化が誘導されます。この環境変化は、無性のプラナリアにエサからのD-トリプトファンの蓄積やD-アミノ酸酸化酵素の抑制や未発見のラセマーゼの活性化を引き起こし、その結果としてD-トリプトファンの増加により有性化を誘導すると考えられます。リュウキュウナミウズムシにとって、L-トリプトファンの代謝の変化は有性化の最初の段階に必要であると考えられます。
色々なD-アミノ酸が多くの動物で見つかっています。また、これらのD-アミノ酸がその生物で重要な役割を持っていることも分かっています。リュウキュウナミウズムシでは、D-トリプトファンがどのようにして始原生殖細胞の増殖や分化を制御しているのかはまだ分かりません。ヒトの白血球では、D-トリプトファンがナイアシン受容体を通して走化性誘因物質して働いていることが分かっています。しかし、リュウキュウナミウズムシのmRNAデータベースや別のプラナリア(Schmidtea mediterranea)のゲノムデータベースにこのナイアシン受容体の遺伝子は見つかりません。プラナリアではD-トリプトファンは未知の受容体を通して働いている可能性があります。本研究の結果はD-アミノ酸が卵巣形成を制御している最初の報告となります。多くの動物で、D-トリプトファンによって誘導される卵巣形成の新しい共通のメカニズムが近いうちに明らかにされるかもしれません。
よろしくお願いします。
