
薬剤性腎障害(主に間質性腎炎について)
入院中の患者で状態は落ち着いているのにCreだけ急に上がってきたというとき、腎後性でも腎前性でもなさそうという場合は本症を疑います。発症までにかなりの時間を要するものもあるので、外来でも原因不明の腎障害の中に紛れていることもあるかもしれません。
CJASN Review 2022(PMID: 35273009)、CJASN Review 2017(PMID: 28893923)、Current opinion in Clitical Care Review 2019(PMID: 31483318)、up to dateより
【Take home message】
・急性間質性腎炎は、抗菌薬、NSAIDs、PPI、免疫チェックポイント阻害薬が原因となりやすい
・発症時期は、数日〜数週間〜数ヶ月と様々で年単位のこともある
・皮疹、発熱、好酸球増多を3徴とするが、伴わないことの方が多い
・特異的な検査は腎生検のみ
・治療は、原因薬剤の中止、コルチコステロイドを使用する場合もある
・急性尿細管壊死は、いわゆる腎毒性を持つ薬剤、結晶性腎症は、尿細管で結晶化する薬剤とある程度知られてる薬剤で生じる
・いずれも治療は、原因薬剤の中止と腎臓に優しい管理(ボリュームの適正化、他の腎毒性のある薬剤の回避など)
<薬剤性腎障害の主な機序>
・急性間質性腎炎(AIN:acute interstitial nephritis)
・急性尿細壊死(ATN:Acute Tubular Necrosis)
・結晶性腎症(Crystallin Nephropathies)
・その他(偽性AKIと血行力学的AKI)
急性間質性腎炎(AIN:Acute Interstitial Nephritis)
<総論>
・尿細管間質における免疫細胞の浸潤によって組織学的に特徴付けられる免疫介在性の腎障害
・多くの患者(特にICUの患者)は、アレルギーを示唆する特徴がなく、生検を受けていないため、ATNと誤って認識されることがよくある
・薬剤はAINの最も多い原因であり、先進国で見られるAINの原因の70%以上を占めると推定されている
・生検で証明された薬剤誘発性AINの半数のみがAKIを呈しており、残りは緩徐に進行性の腎障害を呈していた
<原因薬剤>
・多くの薬剤がAINを引き起こすが、抗菌薬、NSAIDs、PPI、免疫チェックポイント阻害薬が最も一般的な原因
・抗菌薬はAINの原因の半数以上を占める
・抗菌薬の中でも、βラクタム系、サルファ剤、リファンピシン、キノロン系が多い
・抗菌薬関連AINは、急速なAKIの発症につながり、典型的なアレルギーの特徴と関連していることがある
・NSAIDsはAINの原因の10~15%を占める
・抗菌薬とは対照的に、NSAIDs関連AINは投与後数週間〜数カ月後(年単位のことも)に出現し、典型的なアレルギー反応を示さず、臨床診断が困難な場合がある
・PPIはAINのもう一つの重要な原因
・発生率は、10,000人年あたり0.8-3.2と推定される
・PPIによるAINは、典型的なアレルギー症状がなく、AINの発症までに時間を要するため、見逃されている可能性がある
・免疫チェックポイント阻害薬(ICPI)は新たに発見されたAINの原因薬剤
・ICPIのCTLA-4、PD-1、PDL-1阻害薬が含まれる
・ICPIによるAINの発症率は不明だが、ICPIによるAKIは2-5%を推定されている
■原因薬剤一覧
・抗菌薬:ペニシリン系、セフェム系、ST合剤、キノロン系、マクロライド系、リファンピシン
・抗ウイルス薬:アシクロビル、ホスカルネット、アバカビル、アタザナビル
・抗潰瘍薬:PPI、H2 blocker
・鎮痛薬:NSAIDs(COX-2阻害薬含む)
・利尿薬:ループ利尿薬、サイアザイド系利尿薬
・抗てんかん薬:フェノバルビタール、カルバマゼピン、フェニトイン
・免疫チェックポイント阻害薬:PD-1阻害薬、PD-L1阻害薬、CTLA-4阻害薬
・抗癌剤:イホスファミド、ペメトレキセド
・血管新生阻害薬:ベバシズマブ、ソラフェニブ
・その他:リチウム、アロプリノール、メサラジン
●薬剤暴露からどれくらいの期間で発症するか?(up to date)
・典型的な発症時期は定まっていない
・2回目以降の暴露では3〜5日後で発症することがある
・初めての暴露では数週〜数ヶ月後まで遅れることがある
・しかし、初めての薬剤暴露からの発症期間は、薬剤により差が大きい(リファンピシンは1日、NSAIDsは18ヶ月)
<臨床所見/検査所見>
○臨床症状
・皮疹、発熱、好酸球増多のアレルギー症状を3徴とするが、発生頻度はまれ
●3徴(皮疹、発熱、好酸球増多)の頻度は?(up to date)
128人を対象としたAINのケースシリーズ(70%が薬剤性AIN)の症状の頻度は、
皮疹15%、発熱27%、好酸球増多23%、3徴すべて揃う10%
と発症頻度は低いため、3徴は伴わない方が多い
○尿検査
・膿尿は50%で見られるが、白血球円柱はほとんど見られない
・赤血球が見られることもあり、赤血球円柱の報告もある
・尿所見が陰性でもAINは除外できない
・様々な程度の蛋白尿を伴うことがある
・ネフローゼレベルに達することもある
・好酸球尿(尿中好酸球≧1%で定義)が見られることもある
・好酸球尿は、AINを他のAKIと区別するのに役立たない
566人の患者が腎生検と尿中好酸球検査を受けた
好酸球尿を認めた179人のうち、生検でAINが認められたのは28人のみ
逆に好酸球尿を認めなかった387人のうち、63人は生検でAINが証明された
・一方で、尿中好酸球が≧5%まで増加すると診断的価値があるという報告もある
○腎生検
・病理学的には、間質性炎症細胞浸潤と尿細管炎がAINの特徴
・細胞浸潤は、CD4+、CD8+T細胞が主体だが、マクロファージやB細胞が見られることもある
・特に抗生物質では、好酸球や肉芽腫が見られることもある
・NSAIDsによるAINでは好酸球は見られない
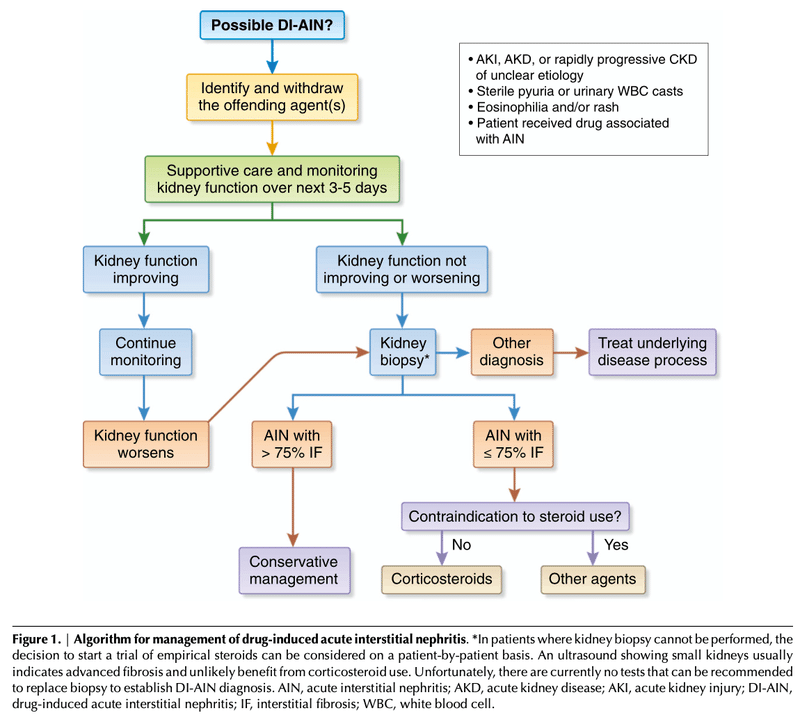
●AINに対して腎生検をすべきか?
・薬剤誘発性AINの診断は、腎生検なしでは困難
・治療によるリスクを伴うコルチコステロイドを使用する場合は、生検でAINを証明することが望ましい
・腎生検は、尿細管線維化、尿細管萎縮、糸球体硬化の程度など予後の情報も得られ、治療方針の決定の指標にもなる
・例えば、75%を超える間質線維化/尿細管萎縮および重度の糸球体硬化がある場合は、コルチコステロイドでの治療を避けるべき
・コルチコステロイドの早期開始は、長期的な腎機能改善と関連しているため、AINを疑う症例はなるべく早く腎生検を施行した方がよい
・生検ができず、AINの可能性が高い場合は、経験的にコルチコステロイドによる治療開始の検討をする
・現時点では、非侵襲的にANIを診断する方法はない
<治療>
○薬剤の中止
・原因薬剤の早期発見と中止が明確な治療の第一歩となる
・腎生検が検討されている間に中止を遅らせるべきではない
・原因薬剤に暴露期間が長いほど、腎機能が回復する可能性が低くなる
○コルチコステロイド
・RCTは施行されておらず、エビデンスは観察研究によるもの
・ステロイドの効果を受けられる可能性があるサブグループとしては、生検前のeGFRが高く、組織学的に細胞浸潤が強く、線維化が少ない患者が推測されている
・間質性線維化/尿細管萎縮の割合が多い、エコーで腎萎縮がある場合はコルチコステロイドの反応性が乏しいことと関連していた
・線維化の進行した患者(≧75%の線維化)ではコルチコステロイドは避けるべき
・早期のコルチコステロイドの投与が長期的な腎機能改善と関連している
・コルチコステロイドの治療を考慮する場合は、診断後1-2週間以の投与が望ましい
・研究でのレジメンは、
メチルプレドニゾロン 250-500mg 静注 → PSL 1mg/kg/日 内服、もしくは、PSL 1mg/kg/日 内服
・コルチコステロイドの初期投与量に関わらず、PSL 1mg/kg/日を約1〜1.5ヶ月継続する(この期間内に腎機能が改善することがほとんどであるため)
・腎機能の改善が得られない場合は、1.5ヶ月を超えてコルチコステロイドに投与を延長しない
・腎機能の改善は主に1ヶ月以内に見られるため、治療に反応が見られない場合はステロイドを約4-6週間で速やかに漸減することが推奨される
・腎機能の改善が得られ、コルチコステロイドの副作用が問題になる症例では、小規模のケースシリーズでミコフェノール酸モフェチルへの切り替えを支持している
<予後>
・進行性の尿細管間質の炎症と線維形成により、恒久的な腎障害を生じる可能性がある
・過去の研究では、約50%の患者がAIN後にCKDを発症すると推定されている
・腎生検後6ヶ月までにベースラインから中央値 eGFR 11の低下を来す
急性尿細管壊死(ATN:Acute Tubular Necrosis)
<総論>
・抗菌薬、化学療法、カルシニューリン阻害薬、造影剤などのさまざまなクラスの薬剤で発生する直接的なATNはAKIの一般的な原因となる
・複数の腎毒性および背景にある併存疾患への暴露は、ATNの発生率を高める
・高齢者、腎疾患の既往、血管内脱水は重要なリスク因子となる
■原因薬剤一覧■
・抗菌薬:アミノグリコシド、バンコマイシン、コリスチン、ポリミキシン
・抗真菌薬:アムホテリシンB
・抗ウイルス薬:シドホビル、テノホビル、アデホビル、ホスカルネット
・鎮痛薬:NSAIDs(COX-2阻害薬含む)、アセトアミノフェン過量内服
・抗癌剤:シスプラチン、イホスファミド、ペメトレキセド
・免疫抑制剤:シクロフォスファミド、タクロリムス
・ビスフォスフォネート製剤:ゾレドロン酸、パミドロン酸
・造影剤:ヨード造影剤
<急性尿細管壊死のリスク>
修正可能なリスク
・脱水(Volume deplesion)and/or 低血圧
・腎毒性のある薬剤の併用
・腎毒性薬への高用量、長期の暴露
・GFRに対する高用量の薬剤投与
修正不可のリスク
・高齢、特にCKD患者(eGFR<45)
・肝疾患、糖尿病、心不全、大手術(特に心血管)などの併存する状態
・ICU、熱傷ユニット、CCUなどの高リスクな状況
・敗血症などのショック状態
・臓器移植、造血幹細胞移植
・遺伝的な高感受性
<予防と治療>
・ATNに対する特異的な治療はない
・治療は、
原因薬剤の中止
輸液による腎灌流の増加によるさらなる腎障害の回避
その他の腎毒性物質の回避
・予防が重要であり、
腎毒性のある薬剤の特異的な戦略(減量、代替薬の使用、併用薬を避けるなど)
ATNのリスクが高い状況を認識、回避
結晶性腎症(Crystallin Nephropathies)
<総論>
・尿細管内の結晶沈着の組織学的所見によって特徴づけられる
・尿沈渣における結晶を含む円柱の所見は、有用な非侵襲的診断検査であり、腎生検を省略できる可能性がある
・腎臓内での結晶沈着は主に、薬剤/代謝産物が腎排泄であることと尿中の薬物過飽和により生じる
・結晶形成をきたす薬物過飽和は、脱水により尿流量低下を来すことで生じる
・また薬物の過剰投与により、尿中薬物濃度の上昇は結晶形成の原因となる
・尿pHも、原因薬剤のpKに応じて影響する
・例としては、メトトレキサートやサルファ剤は酸性尿で結晶を生じやすく、インジナビル、アタザナビル、シプロフロキサシンはアルカリ尿で結晶を生じやすい
・腎疾患の既往がある場合は、結晶性腎症のリスクが高まる可能性がある
■原因薬剤一覧■
・メトトレキサート
・アモキシシリン
・シプロフロキサシン、レボフロキサシン
・ST合剤
・アシクロビル
・ホスカルネット
・抗HIV薬(アタザナビル、ダルナビル)
・リン酸ナトリウム下剤
・トリアムテレン
<予防と治療>
・治療としては、
原因となる薬剤の中止
体液量の回復と尿細管血液量の増加のための輸液
その他の腎毒性物質の回避
特異的治療としては、
結晶の溶解させるための尿pHの調整
血中・尿中の薬物濃度を下げるための介入
腎代替療法
・予防としては、
GFRに応じた適切な薬物投与量
根底にある尿量低下を補正する、尿量を多く維持する
尿細管内血症の沈殿を防ぐための尿pHの達成(薬剤による)
偽性AKIと血行力学的にAKIを来す薬剤
<偽性AKI>
近位尿細管から尿へのCre分泌の低下
・シメチジン
・ST合剤(トリメトプリム)
・チロシンキナーゼ阻害薬(イマチニブなど)
<血行力学的AKI>
遠位細動脈の血管収縮を阻害し、GFR低下
・ACEi、ARB
輸入細動脈の拡張作用を有するプロスタグランジンの産生を阻害
・NSAIDs
尿細管糸球体フィードバックによる輸入細動脈の血管収縮
・SGLT2i
輸入細動脈の血管収縮(エンドセリン、トロンボキサン、RAAS活性化など)
・カルシニューリン阻害薬
<コメント>
・どの臓器においても「くすりはリスク」である気持ちを持っておくことが重要ですね
・まずは疑って中止・変更を考えることが大切です
この記事が気に入ったらサポートをしてみませんか?
