インドでの感染に関連する B.1.617 は、フューリンによるスパイク開裂の強化を示す(2021年5月)
The SARS-CoV-2 variants associated with infections in India, B.1.617, show enhanced spike cleavage by furin
インドでの感染に関連する SARS-CoV-2 の亜種、B.1.617 は、フューリンによるスパイク開裂の強化を示しています。
Abstract
2019 年に出現した SARS-CoV-2 ウイルスのスパイク (S) 糖タンパク質には、配列 681PRRAR/S686 を持つ S1/S2 接合部に次善のフューリン切断部位が含まれていました。
この切断部位は、ウイルスの効率的な気道複製、伝達、および病原性のために必要です。
B.1.617 系統は最近インドで出現し、国全体に相当な疾病負荷がかかっています。
初期の証拠は、B.1.617.2 (B.1.617 の下位系統) が現代の系統よりも伝染性が高いことを示唆しています。
B.1.617 とその亜系統には、このフューリン切断部位をさらに最適化すると予測される置換 P681R を含む S 変異のコンステレーションが含まれています。
B.1.617 系統のウイルスが S 切断を強化したという実験的証拠を提供します。細胞内で発現した B.1.617 S タンパク質のプロセシングの強化は P681R によるものであり、また、この変異により、組換えフューリンによるB.1.617 S1 / S2切断部位のペプチド模倣物のより効率的な切断が可能になります。
まとめると、これらのデータは、この新たな系統のウイルスがフューリンによる S 切断を強化していることを示しており、これが伝染性と病原性を強化している可能性があると私たちは推測しています。
Introduction
最も近い既知の近縁種とは異なり、SARS-CoV-2 スパイク (S) タンパク質には、気道細胞での SARS-CoV-2 複製を強化し、ウイルスの病原性と伝染性に寄与するフューリン切断部位が S1/S2 接合部に含まれています。
プロデューサー細胞における S タンパク質の事前切断により、SARS-CoV-2 はエンドソーム制限因子を回避して細胞表面で標的細胞に入ることができます。
ただし、2019 年後半に出現した初期の SARS-CoV-2 分離株の切断部位は最適ではなく、最適化された切断部位の結果として伝達が増加したバリアントの進化の可能性が残されています。
2020 年末に向けて、SARS-CoV-2 のパンデミックは新しい段階に入り、伝染性、病原性、抗原性などのウイルス特性が変化した「懸念される変異株」系統が繰り返し出現しました。
これらの亜種の中で最も広まっており、最も特徴付けられているのは、英国で最初に見つかった B.1.1.7 系統です。これは、他の循環株と比較して伝染性と病原性が増加しています。
B.1.1.7 S の S1/S2 切断部位には、ウイルス出芽中の翻訳後 S1/S2 切断を強化する P681H 変異が含まれていることを、私たちや他の人が以前に説明しました。
ほぼ同時に発生した他の広く流通している亜種には、それぞれ南アフリカとブラジルで最初に発見された B.1.351 系統と P.1 系統が含まれます。それらは抗原回避を示すが、フューリン切断部位での変化を含みません。
2021 年 5 月の時点で、B.1.617 系統を含む多くのバリアント系統が記載されています。
インドでこの系統が出現したのは、全国で記録的な疾病負荷が発生した時期と重なり、その医療インフラの部分的な崩壊につながりました。
英国からの初期の証拠は、B.1.617 亜系統 (B.1.617.2) の 1 つが、B.1.1.7 に匹敵するか、それ以上に高い透過性を持っている可能性が高いことを示唆しています。
B.1.617 とその亜系統にはいくつかの S 変異が含まれており、一部は他の変異体と共有され、抗原回避に関連しています (表 1 を参照)。
すべての B.1.617 サブ系統によって共有される 1 つの S 置換は P681R であり、これがフューリン切断部位をさらに最適化すると仮定します (681PRRAR/S686 から 681RRRAR/S686、図 1a)。
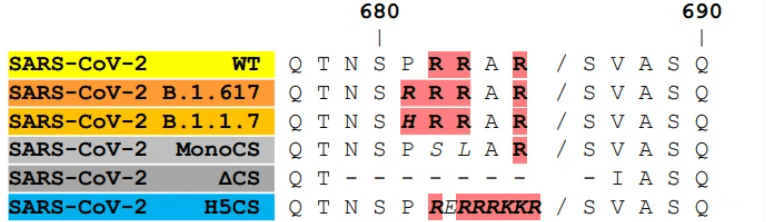
このレポートでは、S1/S2 切断部位に対する P681R の影響を特徴付けます。
Results and discussion
B.1.617 の S タンパク質が、以前に循環していた株よりも S1/S2 で高度な翻訳後切断を受けるかどうかを調べるために、いくつかの B.1.617 系統ウイルス (1 x B.1.617.1 および 2 x B.1.617.2) を分離し、それらの S1/S2 切断を、以前に循環していた系統 B.1.238 の系統(D614G のみが含まれる)と比較しました。
B.1.617系統のSタンパク質はすべて、より高度に切断され(50%以上の切断)、コントロールウイルス(~33% 切断)よりも切断されたS2の比率が高く、完全長Sの検出率が低かった (図 1b、c)。

B.1.617 S のどのアミノ変化がその強化された切断の原因であるかを特徴付けるために、SARS-CoV-2 完全な B.1.617.1 S を含む偽ウイルスを生成し、それを D614G スパイク (WT) を備えた偽ウイルスと比較しました。
以前に観察したように、偽ウイルスで発現した SARS-CoV-2 スパイクには、切断されたスパイクが多く含まれています。
WT Sは完全長(〜20%)と切断(〜80%)Sの両方を示しましたが、B.1.617.1 Sは切断が大幅に強化され(〜95%)、完全長タンパク質がほぼ完全に欠如しています(図1d 、e)。

P681Rのみ(D614Gバックボーン上)でこの表現型を伝達するのに十分であり(約96%切断)、H5N1鳥インフルエンザウイルスヘマグルチニンからの完全に最適化されたフューリン切断部位を運ぶ前述のSタンパク質と同様のレベルに切断が強化されました( ~97% 切断)。
これは、P681R のみが、B.1.617 系統のウイルスに見られる強化された S 切断の原因であることを示唆しています。
次に、B.1.617 S に見られる最適化された切断部位がフューリンによる直接的な切断を可能にするかどうかを判断するためのアッセイを実施しました。
681P (WT)、681R、または2 つのアルギニンが非塩基性残基に置換された一塩基変異体 (monoCS) (図 1a を参照)を含む SARS-CoV-2 テストペプチドの S1/S2 切断部位に対応する蛍光標識ペプチドを切断する組換えフューリンの能力を測定しました。
予想されたように、monoCS は、以前に説明されたように、フューリンによって効率的に切断された WT ペプチドと比較して、組換えフリンによって十分に切断されませんでした (図 1f)。

P681R は、フーリンのペプチド切断能力を大幅に強化しました。アルギニン置換が B.1.617 S タンパク質の切断強化の原因であることが確認されました。
結論として、B.1.617およびB.1.1.7(P681Hを含む)で見られる強化されたS1 / S2切断が、これらのSARS-CoV-2バリアントの強化された伝達性に寄与している可能性があると推測します。
B.1.1.7 および B.1.617 と同様に、他のいくつかの新しい系統にはフューリン切断部位に突然変異が含まれています。
これらの系統は、より迅速な伝達またはより高い病因の早期の証拠のために、綿密な監視下に置くことをお勧めします。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
