2024年度 大学入学共通テスト 問題解説「化学」
注釈者コメント
第1問
問1 配位結合の定義を理解していれば解けます.
問2 液体と気体の体積を比較する問題です.よくある気体の法則(ボイル・シャルルの法則)を使う場面ではないので要注意です.計算が煩雑です.
問3 コロイド粒子の性質を使う基本的な問題です.
問4 水の状態図から状態変化を読み取る基本的な問題です.温度と密度のグラフはあまり見ないですが,グラフから情報を読み取るのは難しくないと思います.問4cは計算が煩雑です.
第2問
問1 吸熱反応では反応後のエネルギーが高くなることを理解していれば解けます.
問2 ルシャトリエの原理(平衡移動の原理)を理解していれば解けます.
問3 電池の問題では「反応式で電子が何個生成するか」を把握しておく必要があります.「反応物の総量1kg」という設定がいやらしいですが,電気化学のセオリーだと,反応物の総量(kg)→総物質量(mol)→電子の物質量(mol)→電気量Q…という手順ですが,設問は電気量Qの大小を比較せよなので電子の物質量や電気量Qの具体的な数値を求める必要はありません.実際に物質量を求めようとすると端数が出る割り算になって計算に時間がかかります.こういう問題設定は計算時間を節約するための小手先のテクニックを暗に要求していて不愉快です.質量と物質量の関係から化学反応の量的関係を導くというのが化学の本質ですが,出題者はその必要はないといっているのです.
問4 弱酸の電離と中和滴定についての基本的な問題です.グラフから数値を読み取れれば解けます.
第3問
問1 実験室で試薬をあつかうときに関する基本的な問題です.
問2 アスタチン(At)の性質を他のハロゲンの性質から推定する問題です.反応性については推定できますが,常温で水に溶けにくいかどうかは知識問題で,高校教科書に記載されていないので大学入試問題としては不適切です.そもそもアスタチンは自然界にはほとんど存在せず,粒子加速器を使ってやっと発見された元素で,生成してもすぐに他の元素に変化してしまいます.その元素の性質を問うことにどれほどの意味があるのでしょうか.
問3 基本的な知識問題です.
問4 ニッケルの電気分解による精錬は教科書に記載されていません.精錬に惑わされず,反応式だけ見て解答すればよいでしょう.式(1)ではCuCl2が消費されてCuClが生成し,式(2)では逆にCuClが消費されてCuCl2が生成するので,CuClとCuCl2がお互いに循環していることに要注意です.
第4問
問1 アセトアルデヒドの工業的製法ですが,覚えてなくても生成物の分子式から推定できます.
問2 基本的な知識問題です.
問3 基本的な知識問題です.
問4 基本的な知識問題です.bはβ-ラクタム環を構成する原子の種類と数に着目すれば解けます.
第5問
質量分析法は教科書に記載されていません.また,質量分析装置は非常に高価で,大学でも設置されている研究室は限られています.実物を見たことのある受験生はほとんどいないと思います.初見のトピックについて限られた試験時間内に解答させることは,受験生のどのような能力を測定しているのでしょうか.設問自体は単純な問いなので,よく読めば化学の知識がなくても正解できますが,地アタマの良いひとが得点できて,地道にコツコツ勉強したひとが得点できないような出題方針は甚だ疑問です.また,問3と問4の問題文に示されている図で,質量スペクトルの横軸が相対質量になっていますが,実際の質量分析法では,質量スペクトルの横軸は(イオンの質量)/(イオンの電荷)の意味のm/zです.1価イオンと2価イオンでは質量が同じでも検出部でのイオンの飛行距離が異なるからです.質量分析法の原理を無視した図と問題設定はミスリーディングであり,大学入学後の分析化学の学習を妨げるものです.
問1 単純な比例計算です.
問2 質量分析法に惑わされず,異なる原子を混合した状況に置き換えたら暗算で解けます.1種類の同位体だけを含む試薬は非常に高価です(同位体同士は物理的・化学的性質がほとんど同じなので分離するには精密で大掛かりな実験装置が必要).そのため,この設問の実験IIは実際にはおこなわれません.机上の空論です.
問3a クロロメタンの分子量を塩素の2種類の同位体ごとに分ければ解けます.
問3b 分子イオンの相対質量を求めます.電子の質量は非常に小さいので無視できます.
問3c 分子の断片のとりうる可能性を考えます.
解答時間が60分なので,大問あたり12分.大問のなかに小問が6問あるので1問あたり2分で解答しなくてはなりません.教科書に記述がない初見のトピックがあるのに問題数が多すぎです.
第1問 次の問い(問1〜4)に答えよ.
問 1 次のイオンのうち,配位結合してできたイオンとして適当でないものを,次の1〜4のうちから一つ選べ.

配位結合とは,結合している片方の原子から非共有電子対を提供して,その電子対を両方の原子で共有している結合のことである.
1:Nの非共有電子対をH+と共有しているので配位結合
2:Oの非共有電子対をH+と共有しているので配位結合
3:錯イオン(金属イオン+非共有電子対をもつ分子)なので配位結合
4:ギ酸イオンはギ酸分子からH+がはずれたものなので配位結合ではない
答:4
問 2 温度111 K,圧力1.0×10^5 Paで,液体のメタンCH4(分子量16)の密度は0.42 g/cm^3である.同圧でこの液体16 gを300 Kまで加熱してすべて気体にしたとき,体積は何倍になるか.最も適当な数値を,次の1〜4のうちから一つ選べ.ただし,気体定数はR = 8.3×10^3 Pa・L/(K・mol)とする.
液体状態と気体状態でそれぞれの体積を求める.
液体のメタンの体積
16 g ÷ 0.42 g/cm^3 ≈ 38.1 cm^3
気体のメタンの体積
理想気体の状態方程式より,V = nRT/P.メタン16 gは1 molなので,気体の体積は
(8.3 × 10^3) × (300 K) ÷ (1.0 × 10^5 Pa) = 24.9 L = 24.9 × 10^3 cm^3
(注)1 L = 1000 cm^3
気体と液体の体積比は
(24.9 × 10^3) / (38.1) ≈ 653 ≈ 6.5 × 10^2
答:1
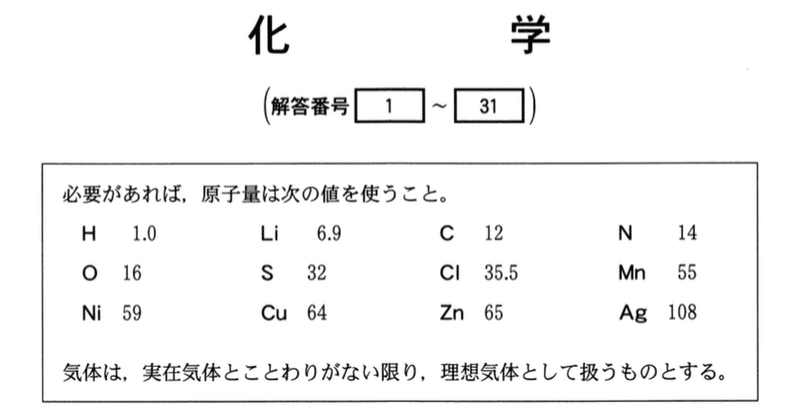
問 3 水に入れてよくかき混ぜたグルコース,砂,およびトリプシン(水中で分子コロイドになる)のうち,ろ紙を通過できるものと,セロハンの膜を通過できるもの組合せとして最も適当なものを,次の1~9のうちから一つ選べ.
粒子の大きさの順は,グルコース < トリプシン < 砂 である.トリプシンはコロイド粒子なので,ろ紙を通過できるがセロハンの膜を通過できない.したがって,
ろ紙を通過できるもの:グルコースとトリプシン
セロハンの膜を通過できるもの:グルコース
答:4
問 4 水 H2O(分子量18)に関する次の問い(a〜c)に答えよ.
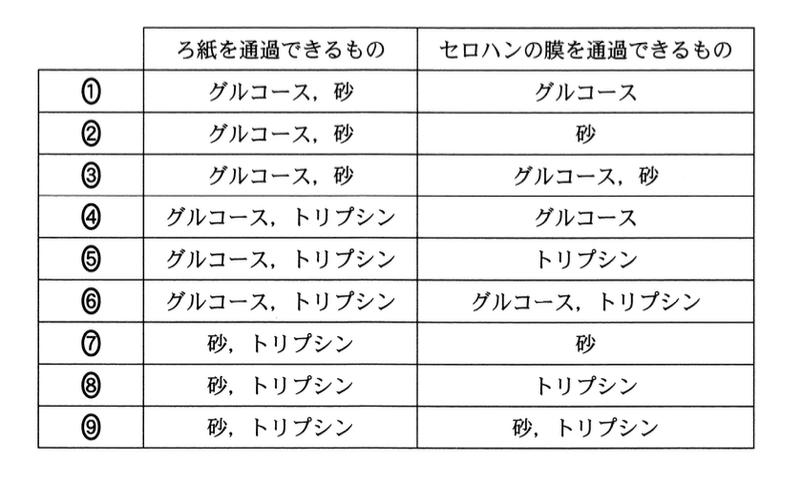
a 図1は水の状態図である.水の状態変化に関する記述として誤りを含むものはどれか.最も適当なものを,後の1〜4のうちから一つ選べ.
1.2 × 10^2 Paの圧力のもとでは,氷は0°Cより低い温度で昇華する.
正しい
2.0°Cのもとで,1.01 × 10^5 Paの氷にさらに圧力を加えると,氷は融解する.
正しい
3.0.01°C,6.11 × 10^2 Paでは,氷,水,水蒸気の三つの状態が共存できる.
正しい.水の三重点である.
4.9 × 10^4 Paの圧力のもとでは,水は100°Cより高い温度で沸騰する.
誤り.100°Cより低い温度で沸騰する.
答:4
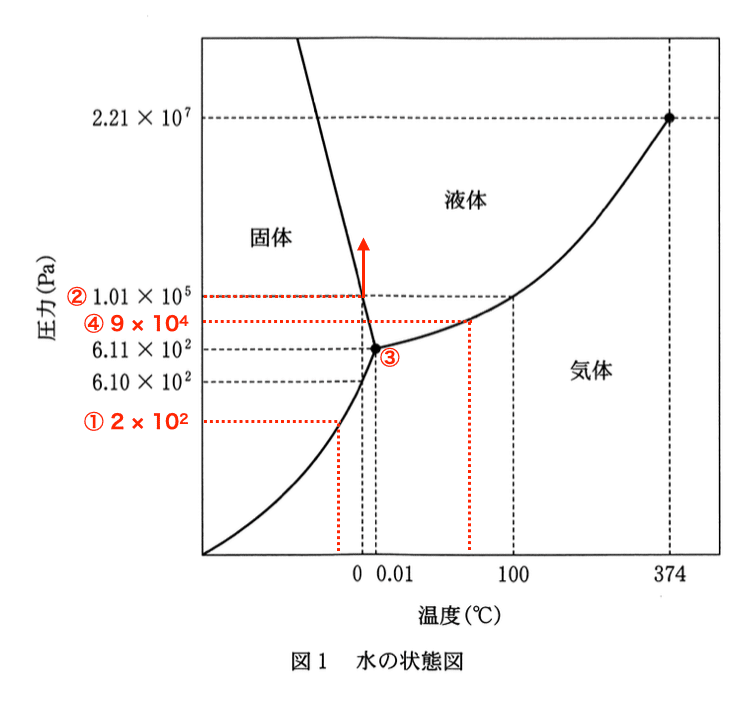
b 図2は1.01 × 10^5 Paの圧力のもとでも氷および水の密度の温度変化を表したものである.この図から読み取れる内容として正しいものはどれか.最も適当なものを,後の1〜4のうちから一つ選べ.
1.0°Cでの氷1 gの体積は同温での水1 gの体積よりも小さい.
誤り.氷のほうが密度が小さいので,体積が大きい.
2.氷の密度は0°Cで最大になる.
誤り.最小になる.
3.12°Cでの水の密度は,–4°Cでの過冷却の状態の水の密度よりも大きい.
正しい.グラフから,わずかに大きいことが読み取れる.
4.断熱容器に入った4°Cの水の液面をゆっくりと冷却すると,温度の低い水が下の方へ移動する.
誤り.4℃の水が最大密度なので,温度の低い水は上の方へ移動する.
答:3
c 1.01 × 10^5 Paの圧力のもとにある0°Cの氷54 gがヒーターとともに断熱容器の中に入っている.ヒーターを用いて6.0 kJの熱を加えたところ,氷の一部が融解して水になった.残った氷の体積は何cm^3か.最も適当な数値を,次の1〜6のうちから一つ選べ.ただし,氷の融解熱は6.0 kJ/molとし,加えた熱はすべて氷の融解に使われたものとする.また,氷の密度は図2から読み取ること.
6.0 kJの熱で融解する氷の物質量は,
(6.0 kJ) ÷ (6.0 kJ/mol) = 1.0 mol
なので,質量に換算すると18 gの氷が融解した.
残った氷の質量は
54 g – 18 g = 36 g
図2より,0℃の氷の密度は0.917 g/cm^3と読み取れるので,残った氷の体積は,
(36 g) ÷ (0.917 g/cm^3) ≈ 39.2 cm^3
答:5
第2問 次の問い(問1〜4)に答えよ
問 1 市販の冷却剤には,硝酸アンモニウムNH4NO3(固)が水に溶解するときの吸熱反応を利用しているものがある.この反応のエネルギー図として最も適当なものを,次の1〜4のうちから一つ選べ.ただし,太矢印は反応の進行方向を示す.
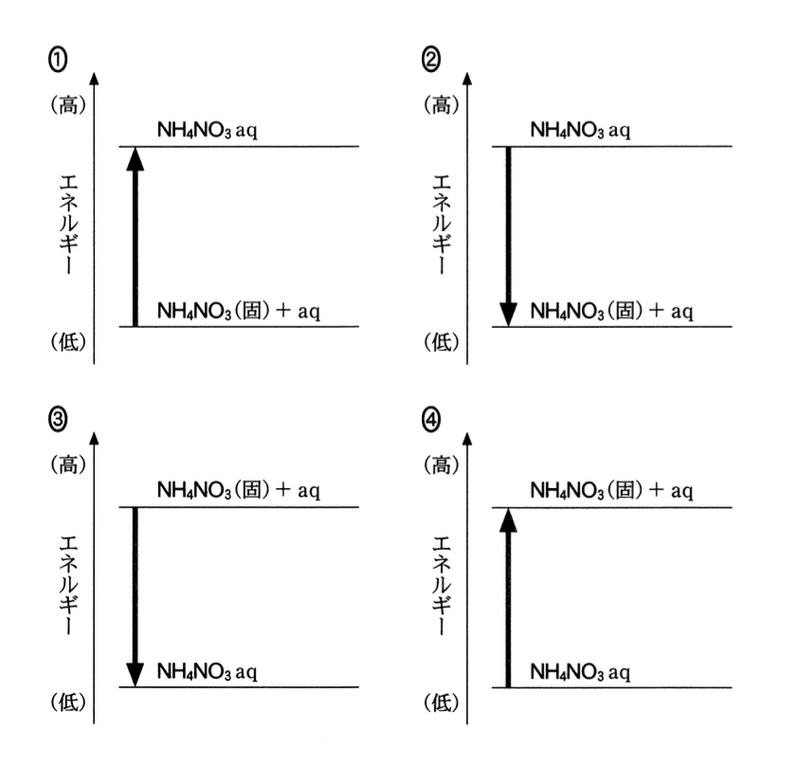
吸熱反応では,エネルギーを吸収するので反応後のほうがエネルギーが高くなる.また,反応前は固体,反応後は溶液である.
答:1
問 2 容積可変の密閉容器に二酸化炭素CO2と水素H2を入れて,800°Cに保ったところ,次の式(1)の反応が平衡に達した.
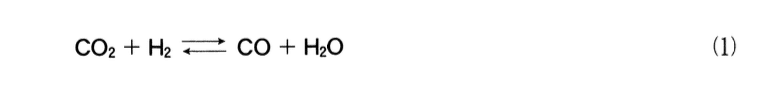
平衡状態のCOの物質量を増やす操作として最も適当なものを,次の1〜4のうちから一つ選べ.ただし,反応物,生成物はすべて気体として存在し,正反応は吸熱反応であるものとする.
1.密閉容器内の圧力を一定に保ったまま,容器内の温度を下げる.
誤り.正反応は吸熱反応なので,温度を下げると温度が上がる方向(逆反応)に平衡が移動して,COが減る.
2.密閉容器内の温度を一定に保ったまま,容器内の圧力を上げる.
誤り.反応の前後で総物質量は変化しないので,圧力を上げても(下げても)平衡は移動しない.
3.密閉容器内の温度と圧力を一定に保ったまま,H2を加える.
正しい.加えたH2を減少させる方向(正反応)に平衡が移動するのでCOが増える.
4.密閉容器内の温度と圧力を一定に保ったまま,アルゴンを加える.
誤り.アルゴンを加えると反応物と生成物の分圧は小さくなるが,反応の前後で総物質量は変化しないので平衡は移動しない.
答:3
問 3 アルカリマンガン乾電池,空気亜鉛電池(空気電池),リチウム電池の,放電における電池全体での反応はそれぞれ式(2)〜(4)で表されるものとする.それぞれの電池の放電反応において,反応物の総量が1 kg消費されるときに流れる電気量Qを比較する.これらの電池を,Qの大きい順に並べたものはどれか.最も適当なものを,後の1〜6のうちから一つ選べ.ただし,反応に関与する物質の式量(原子量・分子量を含む)は表1に示す値とする.
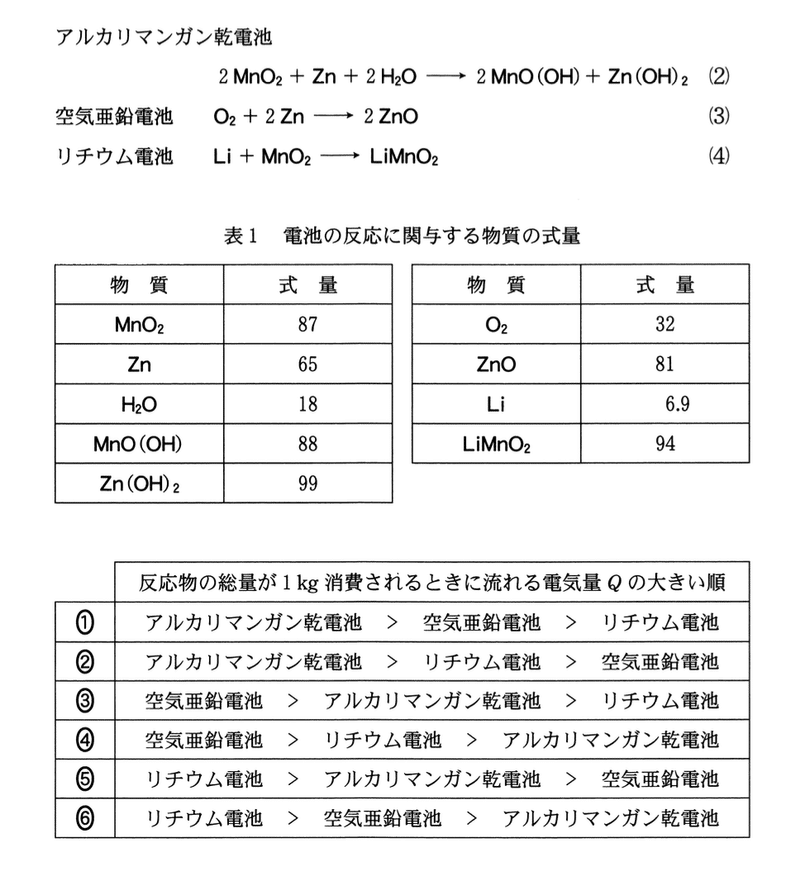
それぞれの電池の反応式において,電子を含む半反応式は次のとおりである.
アルカリマンガン乾電池: Zn → Zn(2+) + 2e
空気亜鉛電池: 2 Zn → 2 Zn(2+) + 4e
リチウム電池: Li → Li(+) + e
それぞれの電池の反応式において,反応物の式量の総和を求める.
アルカリマンガン乾電池
左辺の式量の総和:
2 × 87 + 65 + 2 × 18 = 275 (g/mol)
空気亜鉛電池
左辺の式量の総和:
32 + 2 × 65 = 162 (g/mol)
リチウム電池
左辺の式量の総和:
6.9 + 87 = 93.9 (g/mol)
それぞれの電池の反応式において,電子1 molを生成するのに必要な反応物の質量は,
アルカリマンガン乾電池: 275 ÷ 2 = 137.5 g
空気亜鉛電池: 162 ÷ 4 = 40.5 g
リチウム電池: 93.9 ÷ 1 = 93.9 g
反応物の総量がいずれの電池でも1 kgで同じなので,電気量Qが多い順は,電子1 molを生成するのに必要な反応物の質量が少ない順になる.したがって,空気亜鉛電池 > リチウム電池 > アルカリマンガン乾電池 の順になる.
答:4
問 4 1価の弱酸HAの電離,およびHA水溶液へ水酸化ナトリウムNaOH水溶液を滴下するときの水溶液中の分子やイオンの濃度変化に関する次の問い(a〜c)に答えよ.ただし,水溶液の温度は変化しないものとする.
a 純水に弱酸HAを溶解させた水溶液を考える.HA水溶液のモル濃度c(mol/L)とHAの電離度αの関係を表したグラフとして最も適当なものを,次の1〜5のうちから一つ選べ.ただし,HA水溶液のモル濃度がC0(mol/L)のときのHAの電離度をα0とし,αは1よりも十分小さい ものとする.
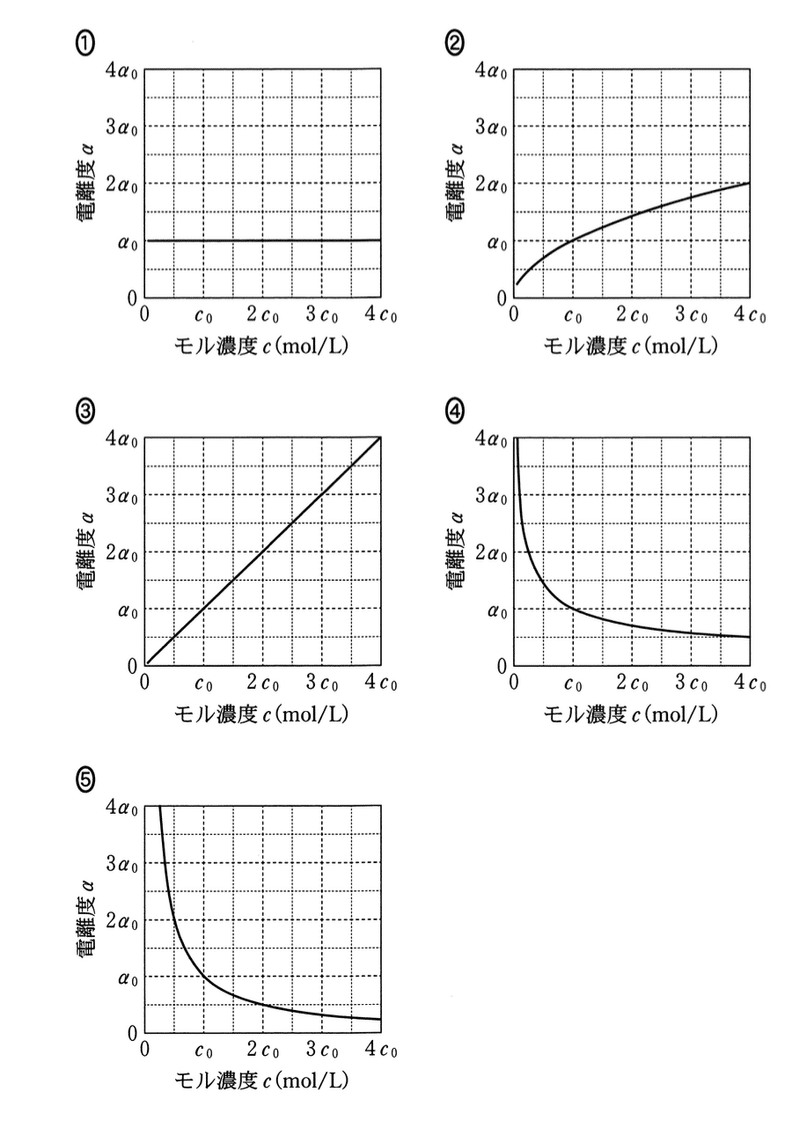
弱酸では,
モル濃度cが小さいとき:電離度αは大きい.
モル濃度cが大きいとき:電離度αは小さい.
したがって,正解は4または5である.
電離度αが1よりも十分小さいとき,近似的に以下の式が成り立つ.
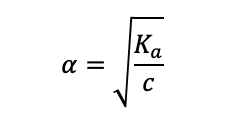
この式によると,モル濃度cが4倍(=4c0)になると電離度αは1/2(=0.5α0)になるので,正解は4である.
答:4
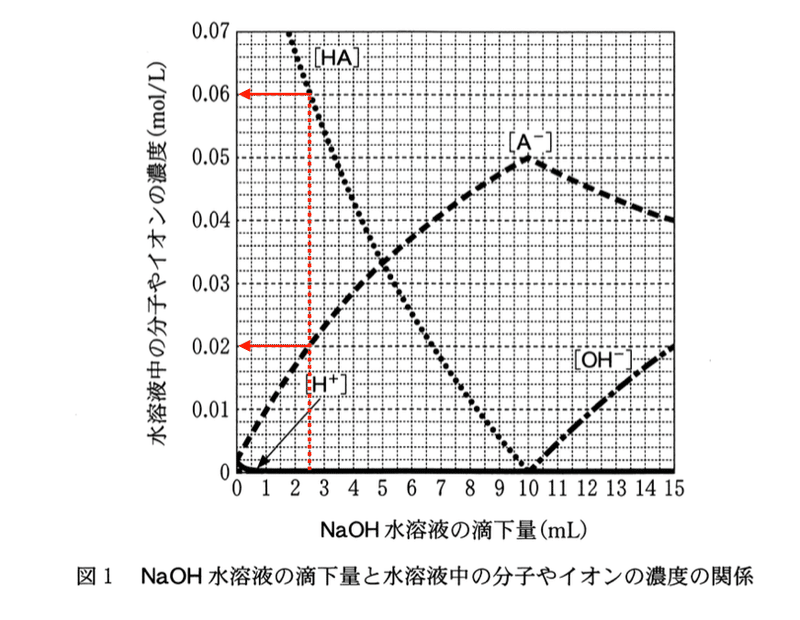
b モル濃度0.10 mol/LのHA水溶液10.0 mLに,モル濃度0.10 mol/LのNaOH水溶液を滴下すると,水溶液中のHA,H(+),A(–),OH(–)のモル濃度[HA],[H+],[A-],[OH]は,図 1 のように変化する.NaOH水溶液の滴下量が2.5 mLのとき,H(+)のモル濃度は[H+] = 8.1 ✕ 10^(-5) mol/Lである.弱酸HAの電離定数Kaは何mol/Lか.最も適当な数値を,後の1〜6のうちから一つ選べ.
弱酸の電離定数Kaは以下の式で定義される.
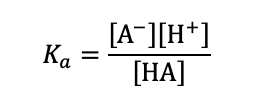
グラフより,NaOH水溶液の滴下量が2.5mLのとき,[A-] = 0.02 mol/L,[HA] = 0.06 mLを読み取り,問題文から[H+] = 8.1 × 10^(-5) mol/Lなので,それぞれの値を上の式に代入して,
Ka = (0.02) × (8.1 × 10^(-5)) ÷ (0.06) = 2.7 × 10^(-5) mol/L
答:2
c bで設定した条件において,NaOH水溶液の滴下に伴う水溶液中の分子やイオンの濃度変化を説明する記述として,下線部に誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.

1.正しい.水溶液全体では電荷を帯びていないので陽イオンと陰イオンの総数は等しい.
2.正しい.水のイオン積 [H+][OH-] は一定である.
3.正しい.グラフより,NaOH水溶液の滴下量が10 mLまで[A-]は増加していく.
4.誤り.中和反応はNaOH水溶液の滴下量が10 mLになった時点で終了する.
答:4
第3問 次の問い(問1〜4)に答えよ.
問 1 実験室で使用する化学物質の取扱いに関する記述として下線部に誤りを含むものを,次の1〜5のうちから二つ選べ。

1.誤り.ナトリウムは灯油(石油)中に保存する.
2.正しい.
3.誤り.濃硫酸に少量の水を加えると激しく発熱して危険である.希硫酸をつくるときは,水に濃硫酸を少しずつ加える.
4.正しい.
5.正しい.
答:1と3
問 2 17族に属するフッ素F,塩素CI,臭素Br,ヨウ素I,アスタチンAtはハロゲンとよばれる.Atには安定な同位体が存在しないが,F,CI,Br,Iから推定されるとおりの物理的・化学的性質を示すとされている.Atの単体や化合物の性質に関する記述として適当でないものを,次の1〜4のうちから一つ選べ.
1.Atの単体の融点と沸点は,ともにハロゲン単体の中で最も高い.
2.Atの単体は常温で水に溶けにくい.
3.硝酸銀水溶液をアスタチン化ナトリウムNaAt水溶液に加えると,難溶性のアスタチン化銀AgAtを生じる.
4.臭素水をNaAt水溶液に加えても,酸化還元反応は起こらない.
1.正しい.Atはハロゲンのうちでもっとも原子番号が大きいので,融点と沸点も高いと推定できる.
2.正しい(?).ヨウ素の単体は常温で固体であるから,Atの単体も常温で固体と考えられる.水に溶けにくいかどうかは不明.
3.正しい.塩素の類推で推定できる.(NaClは水に溶けやすいが,AgClは難溶性である)
4.誤り.ハロゲンは原子番号が小さいほど陰イオンになりやすい(還元されやすい=酸化力が強い)ので,NaBrと単体のAtが生成する酸化還元反応が起こる.
答:4(あきらかな誤りとして)
問 3 表1にステンレス鋼とトタンの主な構成元素を示す.アとイに当てはまる元素として最も適当なものを,後の1~5のうちから一つずつ選べ.

ステンレス鋼:鉄とクロムとニッケルの合金
トタン:亜鉛めっきされた鋼板
答:ア 3,イ 4
問 4 ニッケルの製錬には,鉱石から得た硫化ニッケル(II)NiSを塩化銅(II)CuCl2の水溶液と反応させて塩化ニッケル(II)NiCl2の水溶液とし,この水溶液の電気分解によって単体のニッケルNiを得る方法がある.次の問い(a〜c)に答えよ.
a 塩酸で酸性にしたCuCI2水溶液に固体のNiSを加えて反応させると,式(1)に示すように,NiSはNiCl2の水溶液として溶解させることが できる.なお,硫黄Sは析出し分離することができる.
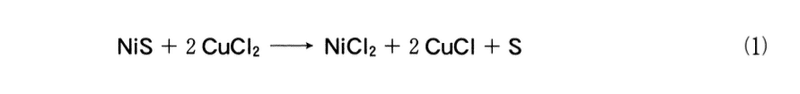
式(1)の反応におけるニッケル原子と硫黄原子の化学変化に関する説明の組み合わせとして正しいものはどれか.最も適当なものを,次の1〜6のうちから一つ選べ.
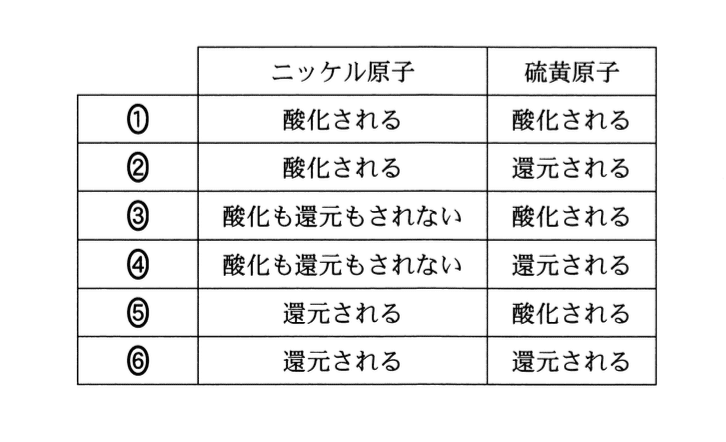
ニッケルと硫黄の酸化数の変化はつぎのとおりになる.
ニッケル:+2 → +2 酸化も還元もされない
硫黄: -2 → 0 酸化される
答:3
b 式(1)でNiCl2と塩化銅(I)CuCIが得られた水溶液に塩素Cl2を吹き込むと,式(2)に示すようにCuCIからCuCl2が生じ,再び式(1)の反応に使うことができる.

CuCl2を40.5 kg使い,NiSを36.4 kg加えてCl2を吹き込んだ.式(1)と(2)の反応によって,すべてのニッケルがNiCl2 として水溶液中に溶解し,銅はすべてCuCl2に戻されたとする.このとき式(1)と(2)の反応で消費されたCl2の物質量は何molか.最も適当な数値を,次の1〜8のうちから一つ選べ.
NiSの式量:59 + 32 = 91
NiS 36.4 kgの物質量:36400 (g) ÷ 91 (g/mol) = 400 mol
式(1)より,1 molのNiSが1 molのNiCl2に変化するときに,2 molのCuClが生成するので,CuClは800 mol生成する.
式(2)より,CuCl 2 molとCl2 1 molが反応するので,消費されたCl2は800 mol ÷ 2 = 400 molになる.
(別解)式(1)と式(2)の両辺を足すと以下の式(3)になる.
NiS + Cl2 → NiCl2 + S (3)
もともと存在するNiSの物質量は400 molなので,NiSをすべてNiCl2に変化させるために必要なCl2の物質量は式(3)より400 molである.
(注)CuClとCuCl2は式(1)と式(2)で循環しており,触媒と同じように作用しているとみなすことができる.したがって,物質の収支を考えなくてよい.
答:5
c 式(1)でNiCl2とCuCIが得られた水溶液からCuCIを除いた後,その水溶液を電気分解すると,単体のNiが得られる.このとき陰極では,式(3)と(4)に示すようにNiの析出と気体の水素H2の発生が同時に起こる.陽極では,式(5)に示すように気体のCI2が発生する.
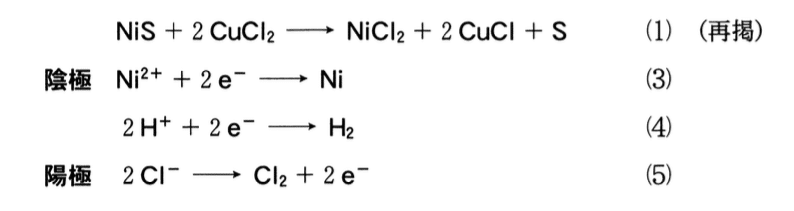
電気分解によりH2とCl2が安定に発生しはじめてから,さらに時間t(S)だけ電気分解を続ける.この間に発生するH2とCI2の体積が,温度T(K),圧力P(Pa)のもとでそれぞれVH2(L)とVCl2(L)のとき,陰極に析出するNiの質量w(g)を表す式として最も適当なものを,後の1〜6のうちから一つ選べ.
ただし,Niのモル質量はM(g/mol),気体定数はR(Pa・L/(K・mol))とする.また,流れた電流はすべて式(3)〜(5)の反応に使われるものとし,H2とCl2の水溶液への溶解は無視できるものとする.
この水溶液にはNiCl2だけが溶けているとする(未反応のCuCl2は残っていない).電気分解で発生する水素と塩素の物質量をそれぞれnH2,nCl2とすると,気体の状態方程式より,
水素の物質量:
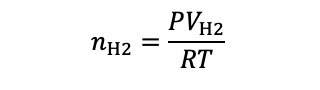
塩素の物質量:
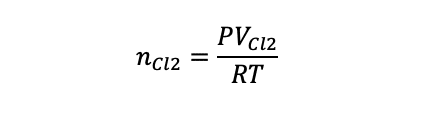
また,ニッケルの物質量をnNiとする.
電気分解では(陰極を通過する電子の物質量)=(陽極を通過する電子の物質量)が成り立つ.また,式(3)(4)(5)より,いずれの反応も2個の電子が電極を通過する.したがって,
(nNi × 2) + (nH2 × 2) = (nCl2 × 2)
が成り立つ.この式を変形して,
nNi = nCl2 – nH2
となり,析出したニッケルの質量(w)は,ニッケルのモル質量(M)を使うと次の式で表すことができる.
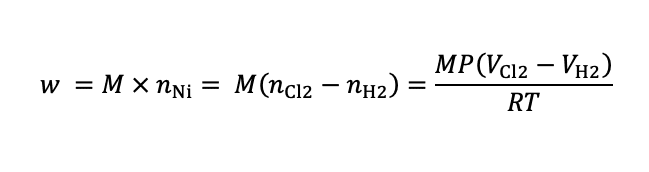
答: 2
第4問 次の問い(問1〜4)に答えよ.
問 1 式(1)のようにエチレン(エテン)CH2=CH2を,塩化パラジウム(II)PdCl2と塩化銅(II)CuCl2を触媒として適切な条件下で酸化すると,化合物Aが得られる.化合物Aの構造式として最も適当なものを,後の1〜4のうちから一つ選べ.
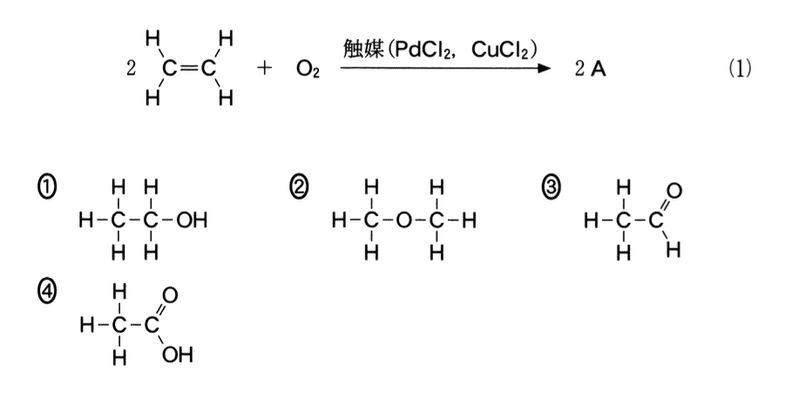
式(1)はエチレンからアセトアルデヒドを合成する工業的製法である.(反応式から,副生成物が生じない付加反応であることがわかる.分子式がC2H4Oであれば正解になる)
答:3
問 2 高分子化合物に関する記述として下線部に誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.
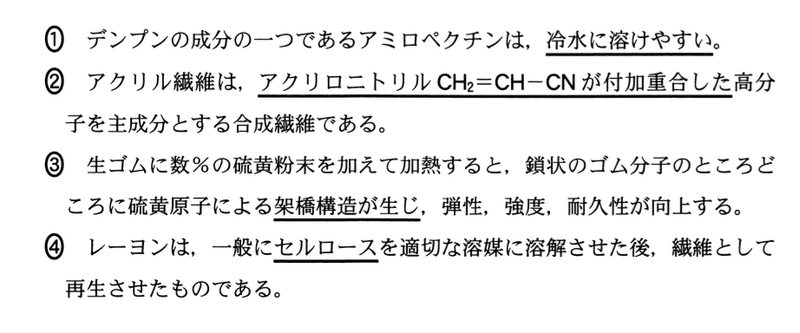
1.誤り.アミロペクチンは冷水に溶けにくい.
2.正しい
3.正しい
4.正しい
答:1
問 3 図1に示すトリペプチドの水溶液に対して,後に示す検出反応ア 〜ウをそれぞれ行う.このとき,特有の変化を示す検出反応はどれか. すべてを正しく選択しているものとして最も適当なものを,後の1〜7のうちから一つ選べ.
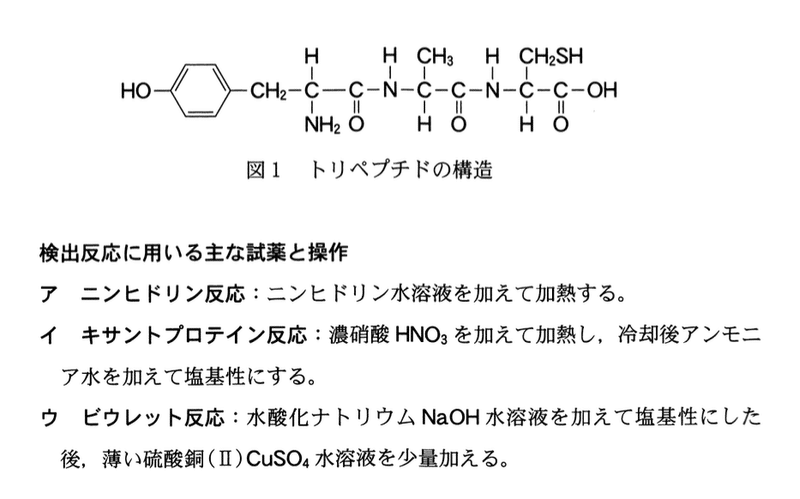
ア:正しい.ニンヒドリン反応はアミノ酸の-NH2基を検出する.
イ:正しい:キサントプロテイン反応は芳香族アミノ酸を検出する.
ウ:正しい:ビウレット反応は2つ以上のペプチド結合をもつトリペプチド以上のペプチドを検出する.
答:7
問 4 医薬品に関する次の問い(a〜c)に答えよ.
a ヤナギの樹皮に含まれるサリシンは,サリチルアルコールとグルコースが 脱水縮合したかたちのグリコシド結合をもつ化合物である.サリシンは消化管を通る間に,図2に示すように加水分解される.生成したサリチルアルコールは酸化され,生じたサリチル酸が解熱鎮痛作用を示す.しかしサリチル酸を服用すると胃に炎症を起こすため,そのかわりにアセチルサリチル酸が開発された.アセチルサリチル酸のように病気の症状を緩和する医薬品を対症療法薬という.
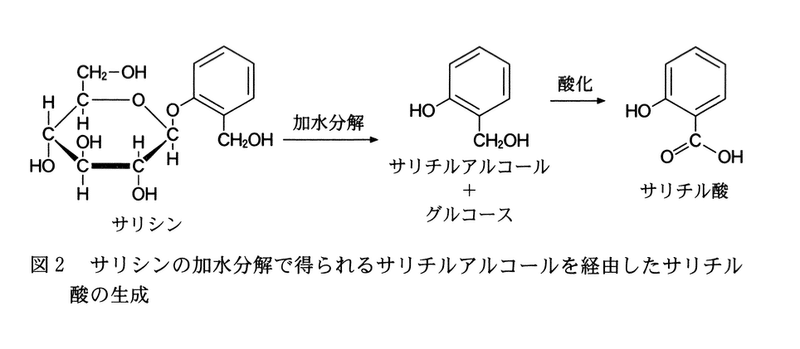
次の記述のうち下線部に誤りを含むものはどれか.最も適当なものを,次の1〜4のうちから一つ選べ.

1.正しい
2.誤り.銀鏡反応は還元末端(ホルミル基)をもつ単糖を検出する.サリシンは還元末端をもたないので銀鏡反応を示さない.
3.正しい
4.正しい
答:2
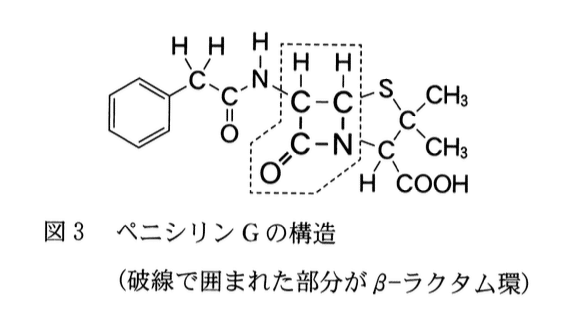
b イギリスの細菌学者フレミングがアオカビから発見した抗生物質ペニシリンGは,病原菌の増殖を抑えて感染症を治す化学療法薬である.図3に示 すペニシリンGは,破線で囲まれたβ-ラクタム環とよばれる環状のアミド構造をもつことで抗菌作用を示す.
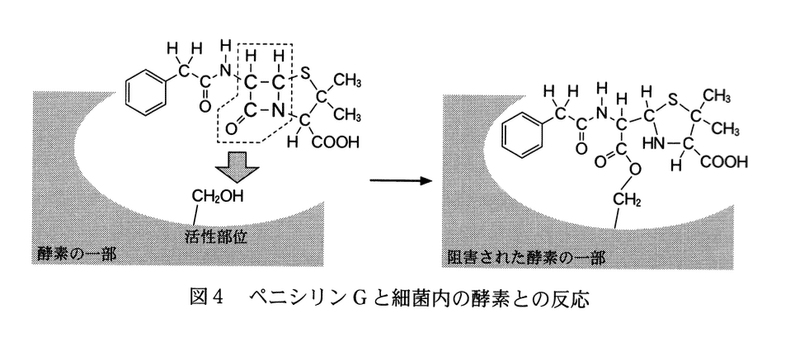
ペニシリンGのβ-ラクタム環は反応性が高く,図4のように細菌の増殖に重要なはたらきをする酵素の活性部位にあるヒドロキシ基と反応する.その結果,この酵素のはたらきが阻害されるため,細菌の増殖が抑えられる.
分子内の脱水反応によりβ-ラクタム環ができる化合物はどれか.最も適当なものを,次の1〜5のうちから一つ選べ.
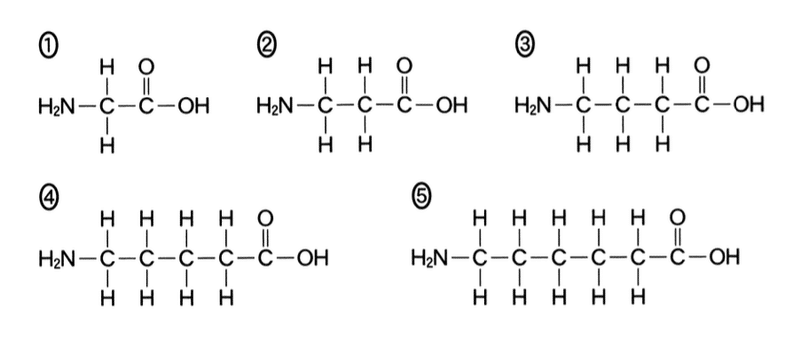
β-ラクタム環は炭素3個と窒素1個でできているので,原子の個数が同じである化合物2が正解になる.-NH2と-OHからH2Oがはずれて環化する.
答: 2
c p-アミノ安息香酸エチルは局所麻酔薬として用いられる合成医薬品である.図5にトルエンから化合物A,B,Cを経由して合成する経路を示す.化合物Bとして最も適当なものを,後の1〜6のうちから一つ選べ.
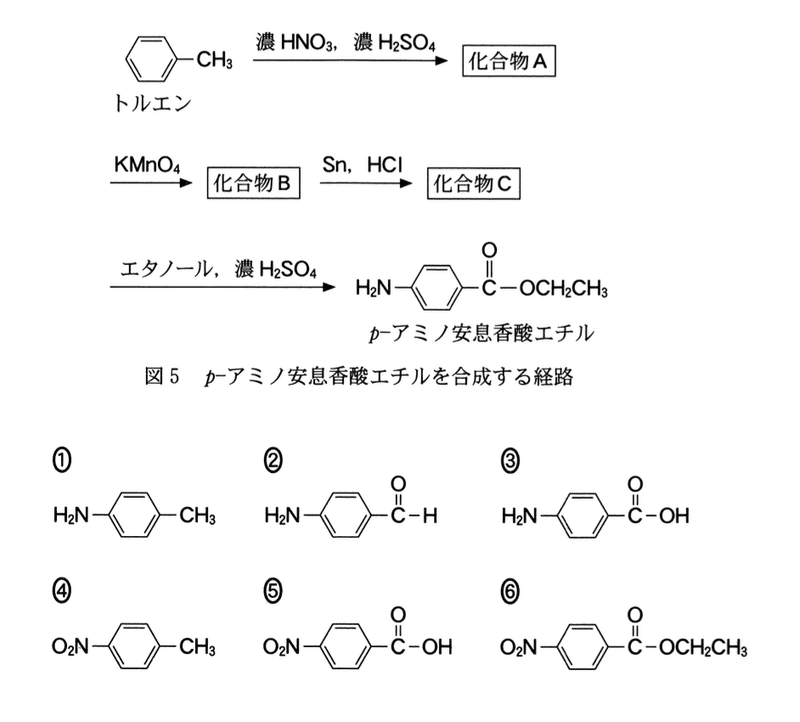
合成経路は以下のとおりである.
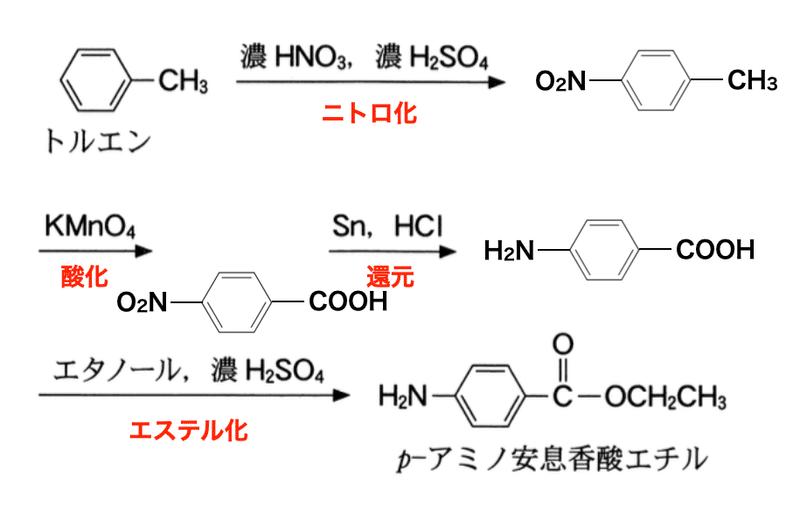
答: 5
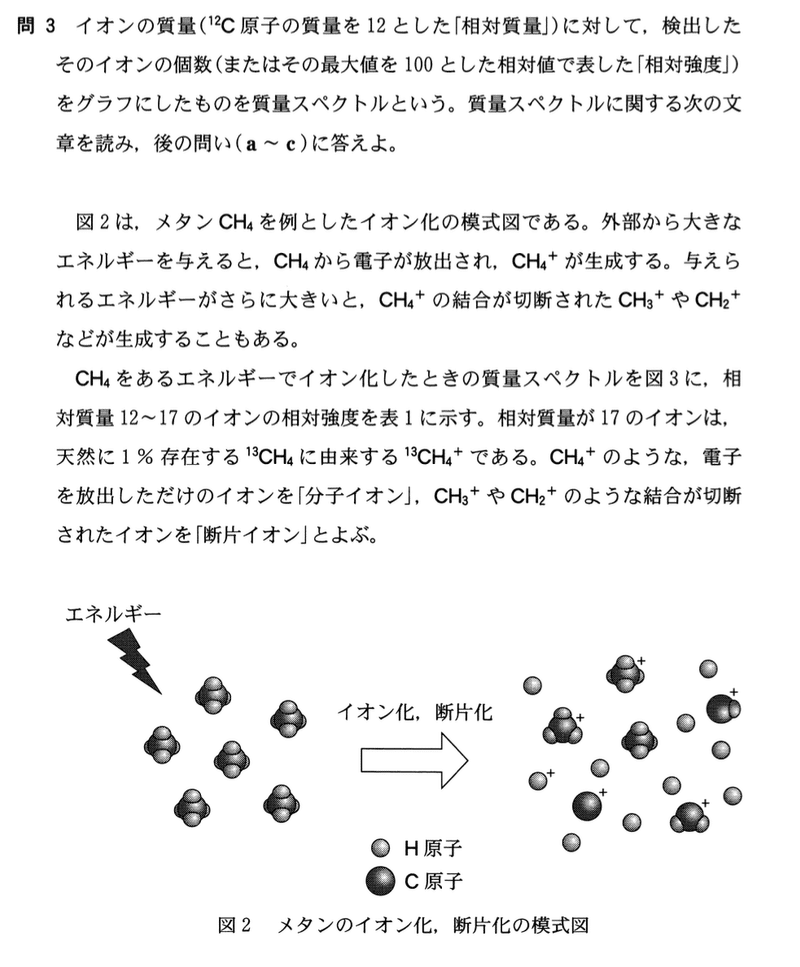
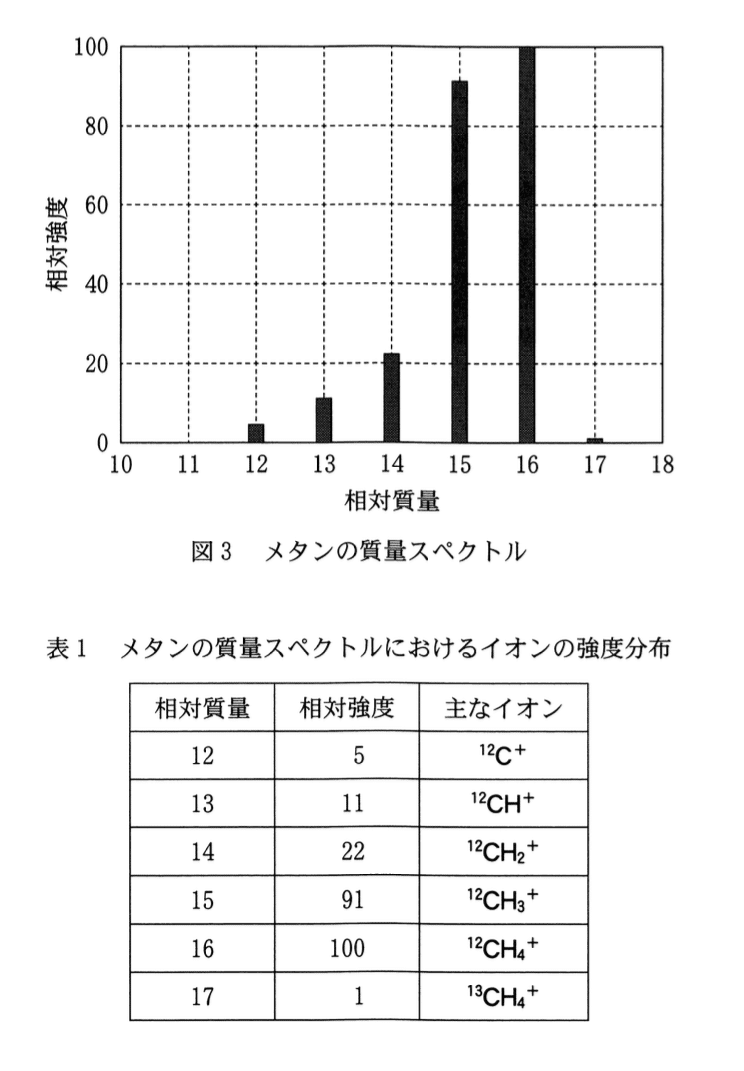
第5問 質量分析法に関する次の文章を読み,後の問い(問1〜3)に答えよ.

問 1 下線部(a)に関連して,質量分析法はスポーツ競技における選手のドーピング検査などに利用されている.ドーピング検査では,検査対象となった選手から90 mL以上の尿を採取し,その一部を質量分析に用いて,対象物質の量が適正な範囲内であるかを調べる.
テストステロンは,生体内に存在するホルモンであるが,筋肉増強効果があるためドーピング禁止物質に指定されている.
図1に既知の量のテストステロンを含む尿を質量分析法で分析した結果を示した.横軸は,尿3.0 mLに含まれるテストステロンの質量で,縦軸は,テストステロンに由来する陽イオンA(+)の検出された個数(信号強度)である.ここで縦軸の数値は,尿3.0 mL中のテストステロンの質量が5.0 ✕ 10^(-8) gのときのA(+)の信号強度を100とした相対値で表している.
ある選手の尿3.0 mLから得られたA(+)の信号強度は10であった.この選手の尿90 mL中に含まれるテストステロンの質量は何gか.最も適当な数値を、後の1〜6のうちから一つ選べ.
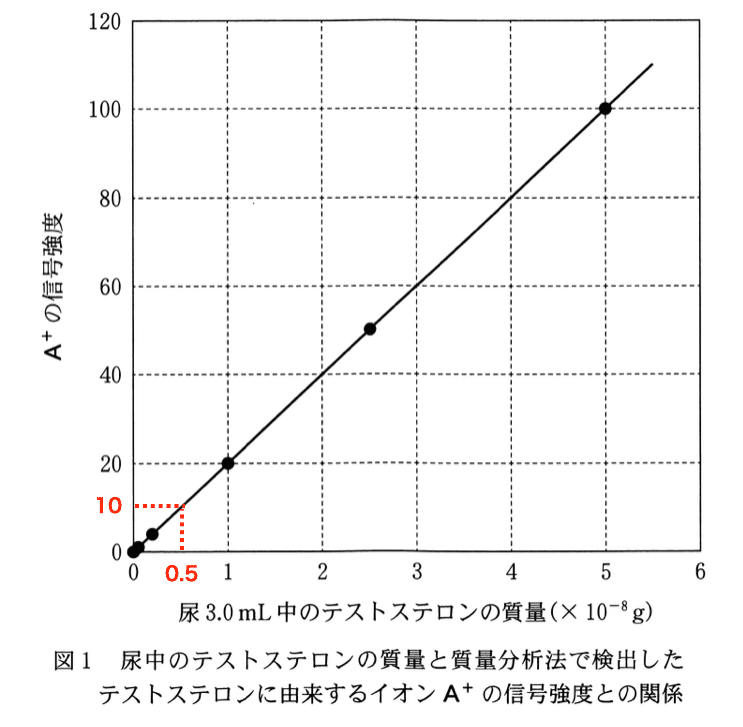
グラフより,信号強度10に相当する「尿3.0 mL中のテストステロンの質量」は,0.5 × 10^(-8) gと読み取れる.したがって尿90 mL中のテストステロンの質量は,
(0.5 × 10^(-8)) × (90/3.0) = 15 × 10^(-8) = 1.5 × 10^(-7) g
答: 4
問 2 下線部(b)に関連して,質量分析法により,ある元素の同位体の物質量の割合を測定することで,試料中に含まれるその元素の物質量を求めることができる.
ある金属試料✕中に含まれる銀Agの物質量を求めるため,次の実験I・IIを行った.金属試料✕中に含まれていたAgの物質量は何mol か.最も適当な数値を,後の1〜4のうちから一つ選べ.

実験IIの操作は次の図のように考えることができる.(107Agと109Agのモル比は3対1)
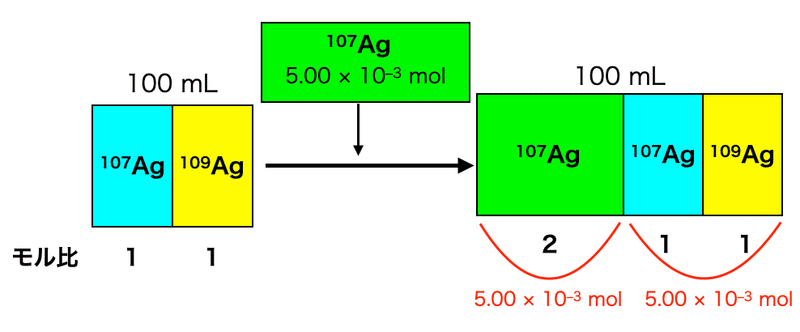
図から,もともと存在していた107Agと109Agの物質量の合計は5.00 × 10^(-3) molだとわかる.実験Iの液量は実験IIの液量の2倍なので,最初のAgの物質量は,
(5.00 × 10^(-3)) × 2 = 1.00 × 10^(-2) mol
答: 3
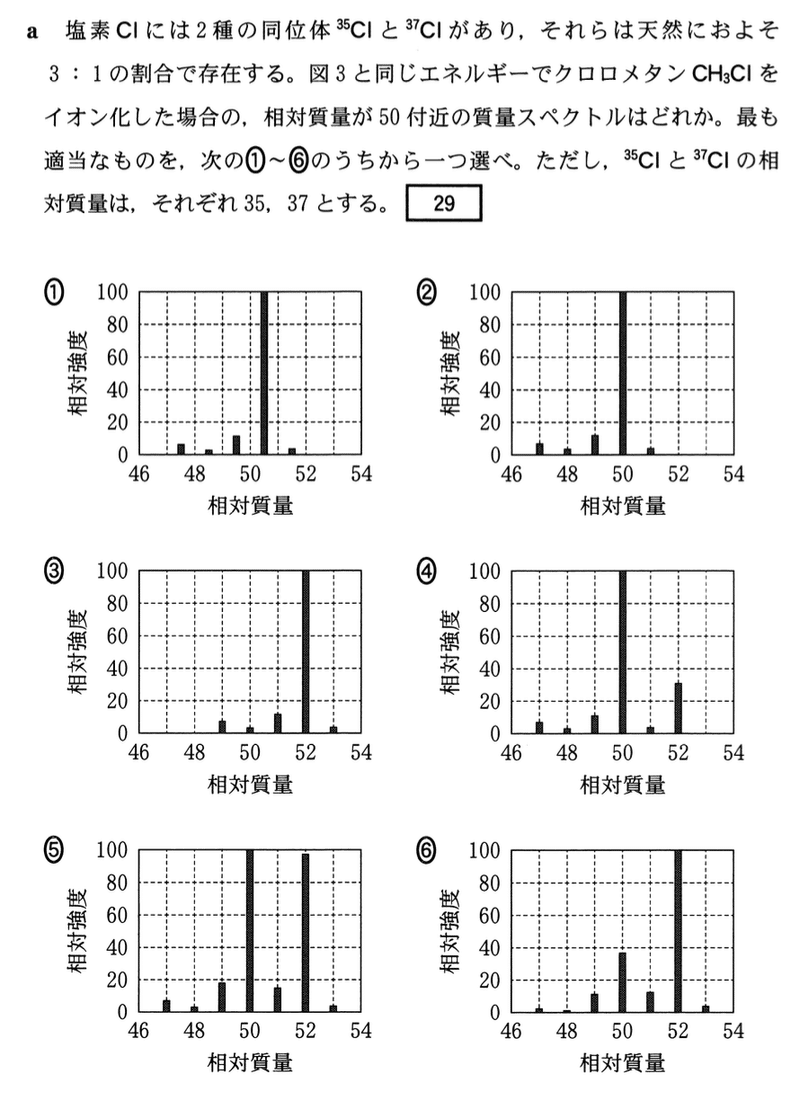
クロロメタンの分子量は,塩素の同位体2種類で異なり,
(35)Clを含むもの: 50
(37)Clを含むもの: 52
である.
塩素の同位体の天然存在比は,(35)Cl:(37)Cl = 3:1 なので,相対質量50の相対強度が3,相対質量52の相対強度が1になっているスペクトルは4である.
答: 4
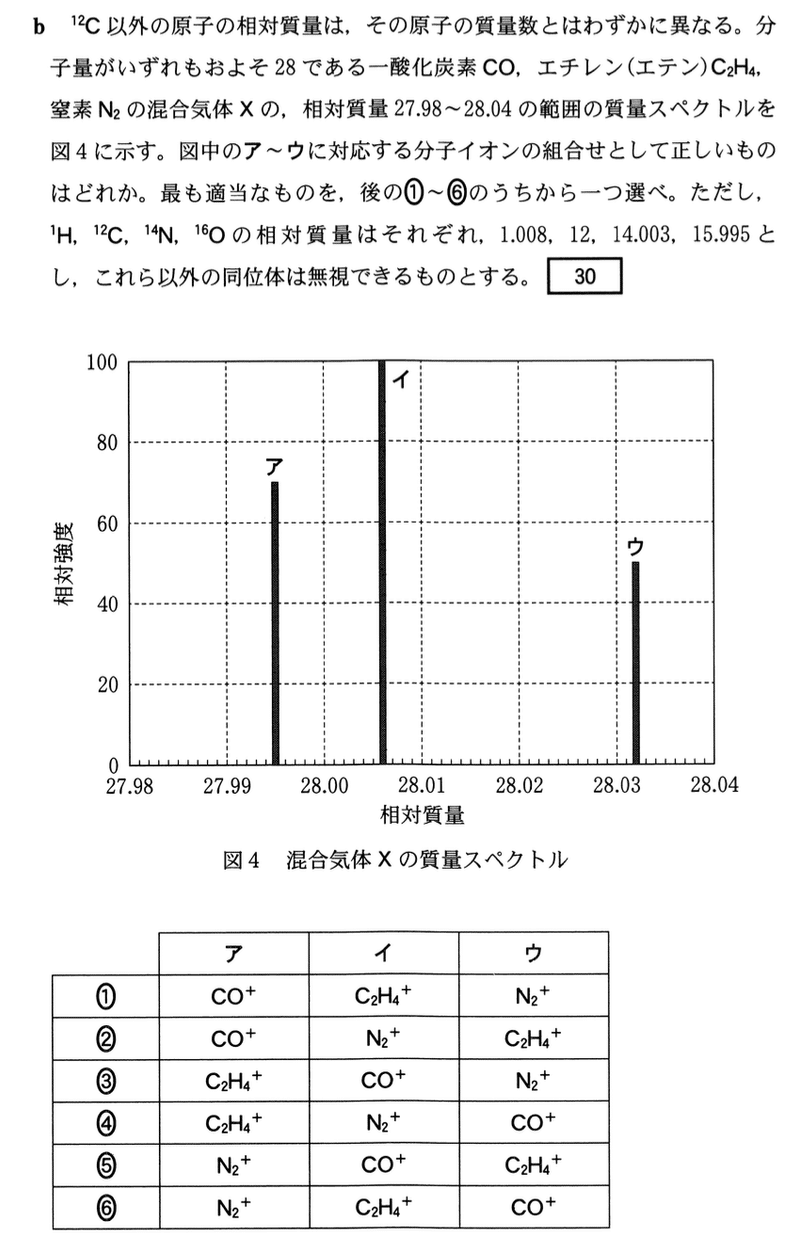
それぞれの分子イオンを構成する原子の相対質量の和を求める.
CO(+): 12 + 15.995 = 27.995 ア
C2H4(+): 12 × 2 + 1.008 × 4 = 28.032 ウ
N2(+): 14.003 × 2 = 28.006 イ
答: 2

メチルビニルケトンの考えられる断片と相対質量は次の図のとおりである.
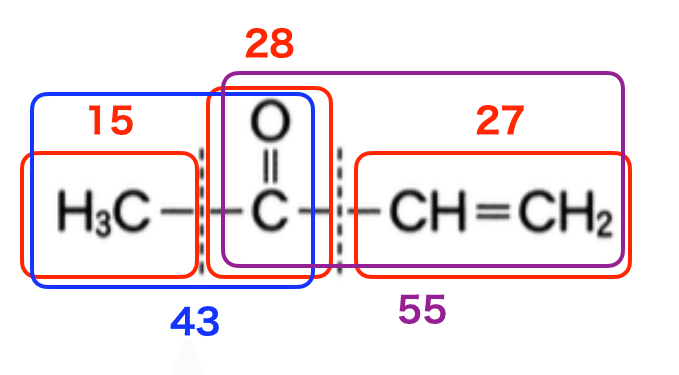
これら以外の相対質量を含むスペクトルは誤りである.
答: 1
この記事が気に入ったらサポートをしてみませんか?
