
原田義也「化学熱力学」は名著
詳しい情報については、リンク先をみてみてください。詳細まで書いてしまうと、長くなってしまうため、書いていません。当記事では、個人を特定できるリンクを一切使っていません。ご安心して、リンク先の情報をいただけます。
上の続き。
わたしが一番好きな熱力学の本は
『化学熱力学 (物理化学入門シリーズ)』裳華房,2012 は、『化学熱力学(修訂版)』を新たに文字や図版を組み直したリニュアル版。『化学熱力学(修訂版)』に比べて1割程度の内容が減っています。
物理の棚に置いておらず、化学棚にあるため、存在をずっと知りませんでした。
"ザク"カラーで、初版が1984年発行、修訂版2002年、と決して新しくはない本です。
名著です。
裳華房さんがずっと出版し続けるだけあります。
買ったときのことを覚えています。アマゾンで購入して、昼頃に届き、読み始め出して、気づいたら22:00を過ぎていました。
ここまで読み耽る専門書は稀です。物理の人でも愛読書になりえます。
田崎熱や清水熱とは異なった視点で、「熱力学の力」を感じられるはずです。
※ 原田『化学熱力学』は清水熱でいうI.B型です。
著者の原田義也先生は、物理化学専門の方です。また、タイトルが「化学熱力学」ですが、しっかり、「物理での熱力学のこころ」を書いてくれています。
たとえば、
熱力学的帰結の一つに、$${C_p -C_v > 0}$$があります。これはどういう意味でしょうか?
van der Waals 状態方程式を、天下りではなく、式の形や係数の必然性を答えられますか?
熱力学の式に追われている人には、これらの描像は見えていなかったりします。原田『化学熱力学』では、 導出だけで終えるのではなく、得られた結論の吟味をひとこと加えてくれています。
全般的に、
物理の熱力学の内容は抜かりはなく、論理的に破綻なく、エレガントに展開しつつも、
「化学熱力学」も漏れなく解説されている。
物理の熱力学では端折られ傾向である、後半の"平衡~相"以降も詳説されている。
一般的な熱力学の教科書を三宅哲『熱力学』とすれば、原田『化学熱力学』ではその内容を完全にカバーしています。物理の人でも原田『化学熱力学』だけの所有で事足ります。
※ ただし熱力学不等式は載っていません。『統計物理学ハンドブック』を参考にしてください。
なお、「化学熱力学」とは、
物理の「熱力学」に加えて、
相平衡の対象として、気体だけではなく、溶液(理想液体)も扱い、
束一的性質(蒸気圧降下、沸点上昇、凝固点降下、浸透圧)
も議論されます。
物理の熱力学以上に、エンタルピー(定圧過程)、ギブスの自由エネルギー(等温等圧)が多用され、化学ポテンシャルや相の概念も具体的に豊富に現れます。
もっとわかりやすい違いは、物理での熱力学では、相といえば水の3相しか出てきません。
※ 演習などでは水以外も取り扱いますが、ここまでたどり着けない学生が多いです。
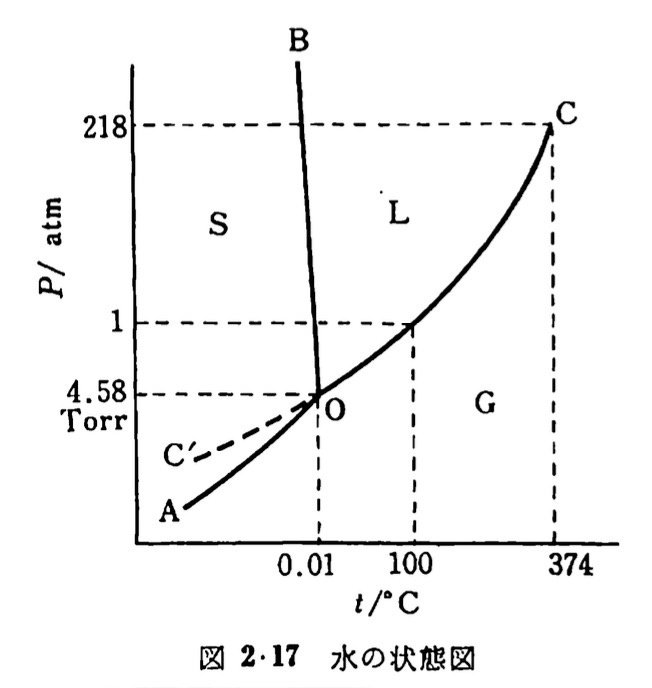
この3相の状態図はよく見かけます。
S:Solid(固相)、L:Liquid(液相)、G:Gas(気相)です。
しかし現実は、つぎのような状態図も存在します。硫黄には2つの固相があり、斜方硫黄$${S_\alpha}$$と単斜硫黄$${S_\beta}$$で表示されています。炭素も黒鉛やダイヤモンドのように固相がいくつもあります。
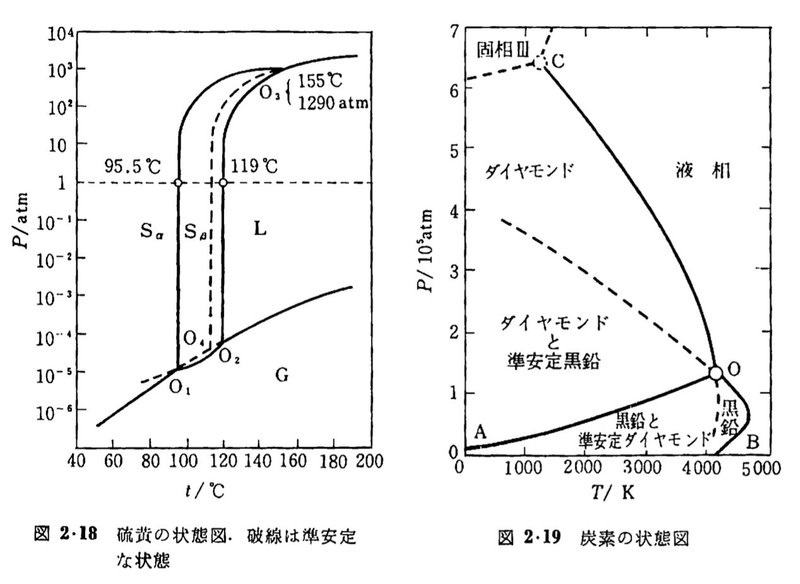
ギブスの相律(成分数-相数+2)の本領は、このような多様な相をもつ物質で発揮されます。
多成分、多様な物質を吟味してこそ、熱力学が見えてきます。原田『化学熱力学』は、250ページと決して厚くはない本だけれど、ここまで豊富な熱力学が収まっています。
物理の人にとっては、物理の熱力学では見たことのない、物質の熱力学を知ることができます。
とはいっても、ほとんどの人にとって、化学熱力学に馴染みがありません。
原著 Atkins "Elements of Physical Chemistry,7e",Oxford University Press,2017
前版にあたる『アトキンス 物理化学要論 第5版』東京化学同人,2012をユーズドで買ってもいいと思います。
アトキンスの本は、ちょっと高いし。。。重いし。
現実世界(リアル)での熱力学の使い方が載っています。内容量と難易度バランスから『アトキンス物理化学要論』で留めるのいいでしょう。物理の人からすれば物理化学の熱力学は、熱力学とは別の分野にみえるほど、興味志向のベクトルが異なります。深入りすると物理に戻ってこれなくなり、統計力学に進めなくなります。『アトキンス物理化学要論』の統計熱力学の部も、統計力学のダイジェストとして、統計力学の手法がまとめられています。
重い本ですけど一読の価値あります。書店の棚で、隣にズレるか、背面を振り返るだけです。
最後に
エントロピーを知って、熱力学関数を導入していく際、
熱力学では$${U}$$,$${H}$$,$${F}$$,$${G}$$,$${S}$$,$${T}$$,$${P}$$,$${V}$$のパラメータが出てきます。$${\displaystyle\left.\frac{\partial \bigcirc}{\partial \Box}\right)_{\triangle}}$$を、パラメータの関係性を考えずに、個数を単純計算すると$${8 \times 7 \times6=336}$$パターン。
院生のときにTAしていたときに、教室のみんなが混乱していました。わたしも熱力学を習ったばかりのときは、まるで理解しておらず、関係式を書けませんでした。
これについては、早々にボルン図式 (熱力学の四角形)で暗記してしまった方がいいです。
書籍であれば、三宅哲『熱力学』,裳華房,1989のp.106に載っています。
熱力学の四角形を見るだけで、次の関係式を書けてしまうのです。
※ 実際に三宅哲『熱力学』の「四角形」を見ながら書いています。
$$
\begin{cases}
F =& U - TS \\
G =& F + pV = U -TS +pV \\
H =& U + pV \\
\end{cases}
$$
$$
\begin{cases}
dU =& T\:dS - p\:dV \\
dF =& -S\:dT - p\:dV\\
dG =& -S\:dT + V\:dp\\
dH =& T\:dS +V \:dp\\
\end{cases}
$$
$$
\begin{cases}
\displaystyle \left( \frac{\partial U}{\partial S}\right)_V= T,
\quad \left(\frac{\partial U}{\partial V}\right)_S= -p \\
\displaystyle \left(\frac{\partial F}{\partial T}\right)_V= -S ,\quad\left( \frac{\partial F}{\partial V}\right)_T= -p \\
\displaystyle \left( \frac{\partial G}{\partial T}\right)_p= -S,
\quad \left(\frac{\partial G}{\partial p}\right)_T= V \\
\displaystyle \left( \frac{\partial H}{\partial S}\right)_p= T,
\quad \left(\frac{\partial H}{\partial p}\right)_S= V \\
\end{cases}
$$
ここは原田『化学熱力学』には載っていないので、追記しました。
#大学生 #AI #数学 #物理 #データサイエンス #物理学 #人工知能 #物理がすき #大学数学 #理論物理学 #大学生活 #独学 #熱力学 #統計力学 #化学 #化学熱力学
この記事が気に入ったらサポートをしてみませんか?
