免疫調節の主要なメカニズム 食物繊維と酸代謝産物
第66巻 2023年3月, 101737
免疫調節の主要なメカニズム 食物繊維と酸代謝産物
https://www.sciencedirect.com/science/article/pii/S1044532323000283?via%3Dihu
著者リンク オーバーレイパネルを開くLiang Xie a b, Md Jahangir Alam a, Francine Z. Marques b c, Charles R. Mackay a d
もっと見る
概要
共有
引用
https://doi.org/10.1016/j.smim.2023.101737Get 権利と内容
ハイライト
食物繊維の不足が西洋の疾病の蔓延の根底にある。
腸内細菌叢は食物繊維を酸、すなわち短鎖脂肪酸に発酵させる。
食物繊維の発酵と酸の生産が腸内細菌叢を形成する。
食物繊維と酸は免疫ホメオスタシスを調節する。
食物繊維に基づく新しい薬用食品は西洋の疾病に有効である可能性がある。
要旨
食事と腸内細菌叢は生理学と健康に大きな影響を及ぼすが、そのメカニズムはまだ解明されていない。ここでは、腸内細菌叢産物、特に短鎖脂肪酸(SCFA)が、腸と免疫のホメオスタシスを維持するために利用するいくつかの経路について概説する。食物繊維は大腸で腸内細菌叢によって発酵され、酢酸、プロピオン酸、酪酸などのSCFAが大量に産生される。食物繊維とSCFAは上皮の完全性を高め、それによって全身性の内毒素血症を抑制する。さらに、SCFAはヒストン脱アセチル化酵素(HDAC)を阻害し、遺伝子の転写に影響を与える。SCFAはまた、GPR43のような「代謝物感知型」Gタンパク質共役受容体(GPCR)に結合し、免疫恒常性を促進する。大腸で産生される大量のSCFAはpHを下げるのに十分であり、腸上皮や免疫細胞に発現するGPR65などのプロトンセンサーの機能に影響を与える。GPR65は抗炎症性のGαs共役型受容体で、炎症性サイトカインの抑制につながる。炎症性疾患におけるGPR65の重要性は、ヒトの炎症性腸疾患、アトピー性皮膚炎、喘息に関連するミスセンス変異体I231L(rs3742704)に関連する遺伝学によって強調されている。腸内で特定のSCFAを大量に放出する特殊な食餌を用いて、これらの経路を操作する余地は非常に大きく、化学修飾食品に依存する治療法は有望なアプローチであると考える。このようなアプローチには、高SCFA産生食が含まれ、マウスモデルにおいて多くの炎症性西洋疾患を減少させることが示されている。これらの食事は、腸の完全性の向上、腸内細菌叢の変化、免疫ホメオスタシスの促進など、様々なレベルで作用する。
前の記事
次の記事
略語
SCFAs
短鎖脂肪酸
DP
重合度
IBD
炎症性腸疾患
黄砂
デキストラン硫酸ナトリウム
T2D
2型糖尿病
CVDs
心血管疾患
血圧
血圧
HMOs
ヒトミルクオリゴ糖
CRC
大腸がん
CAZymes
糖質活性酵素
レジスタントスターチ
レジスタントスターチ
AX
アラビノキシラン
HDAC
ヒストン脱アセチル化酵素
GPCR
Gタンパク質共役型受容体
HIF-1α
低酸素誘導因子1α
トレグ
制御性T細胞
TH1
1型ヘルパーT細胞
TH17
17型ヘルパーT細胞
TH2
2型ヘルパーT細胞
NOD
非肥満性糖尿病
HAMS
高アミロースメイズデンプン
HAMSA
酢酸抱合HAMS
HAMSB
酪酸抱合HAMS
HAMSP
プロピオン酸抱合HAMS
キーワード
短鎖脂肪酸(SCFA)
GPR43
GPR65
プロトンセンシング
食物繊維
腸内細菌叢/マイクロバイオーム
はじめに
常在腸内細菌の主な機能は、食物繊維を短鎖脂肪酸(SCFA)と呼ばれる代謝産物に分解し、宿主細胞でエネルギー源として利用することである。本総説で概説するように、他のシステムもSCFAを認識するように進化してきた。例えば、免疫システムはSCFAをホメオスタシスと健康のための薬剤として利用している。ヒトの寿命は食物繊維によって延びると考えられるため、食物繊維がどのように健康を促進するのかを理解する必要がある。食物繊維とは、小腸での消化を免れ、少なくとも10個の単量体単位の重合度(DP)を有する炭水化物重合体であり、国連食糧農業機関と世界保健機関によって定義されている[1]。ほとんどの高所得国では、食物繊維のDPの閾値は3単量体単位までである[2], [3], [4]。食物繊維のほとんどは、植物細胞由来のオリゴ糖(DP 3-9)または多糖類(DP≥10)である。数十年前にさかのぼる研究は、食物繊維が、欧米諸国(西洋病)でますます蔓延している心代謝疾患、胃腸疾患、アレルギー疾患、および癌 [5], [6], [7], [8], [9] において明らかに有益な役割を果たすことを示している。食物繊維の健康効果は、大腸の常在腸内細菌叢による発酵性に大きく起因している [10], [11]。食物繊維の微生物発酵の最終産物は、一群の有機酸であるSCFAs [12]であり、約10年前まではほとんど無視されていたが、現在では腸と免疫のホメオスタシスにとって重要な分子群のひとつと考えられている。SCFAは強力な免疫調節物質であり、現在では食物繊維による健康効果の根底にあると考えられている [13] 。食物繊維の健康効果とその根底にある免疫調節作用は、栄養、腸内細菌叢、宿主の健康が複雑に絡み合っていることを示す最良の例であろう。本総説では、食物繊維の健康効果と、腸内細菌叢による食物繊維のSCFAsへの発酵について論じる。食物繊維によってもたらされる腸内細菌叢の変化と免疫制御について要約する。最後に、ヒトの疾患に対する新しいアプローチ、すなわち食物繊維とSCFAに基づく薬用食品が、炎症性疾患や心代謝性疾患の治療と予防に役立つ可能性について述べる。食物繊維は西洋の病気のリスクを減らす
食物繊維の高摂取量(50~120g/日)と西洋病の相対的欠如との関連は、1960年代にウガンダで研究していたデニス・バーキット(Denis Burkitt)によって初めて観察された[14], [15], [16]。マフィン、ピザ、アイスクリーム、パスタなどの西洋食品は一般的に繊維質が少ないが、アフリカの農村部では繊維質の豊富な未加工の植物からほとんどの食品を調達している。ウガンダの農村部の平均的な成人(約100g)と英国(約15g)の1日の繊維消費量に顕著な差があることに気づき [17]、彼は西洋の病気の根本的な原因は、彼らの食事に食物繊維が不足していることであるという仮説を立てた [16], [18] 。この仮説は後にバーキット仮説と名付けられた。バーキットの仮説が確立されて以来、食物繊維の健康効果の根底にある生理学的根拠が徐々に明らかになってきた [19], [20] 。現在では、食事リスクは年間女性死亡者数(348万人)の約13.5%、男性死亡者数(447万人)の約14.6%を占めており、食物繊維の不足はこの負担に大きく寄与している [21], [22].2011年、私たちは、欧米諸国におけるアレルギーと喘息の増加の説明として、衛生仮説よりもむしろ食物繊維の不足が有力であるという仮説を立てた [23] 。ここ数十年で、複数のメタアナリシスにより、食物繊維の高摂取が全死亡および様々な西洋疾患のリスク低下と関連することが独立して報告され [5], [6], [7], [8] 、この仮説がさらに検証された。ヒトの寿命は食物繊維の摂取量を増やすことで大幅に延びる可能性があり、いわゆるブルーゾーン(ギリシャのイカリア島、イタリアのサルデーニャ島、日本の沖縄、コスタリカのニコヤ島、米国のロマリンダ島)における寿命の延長と健康は、おそらく食物繊維の大量摂取に起因していると考えられる。
2.1. 胃腸障害
西洋食との関連性が最も早く認識されたのは、胃腸障害(便秘、憩室症)および心臓代謝疾患(肥満、糖尿病、心血管疾患)であった [16], [24]。胃腸の健康における食物繊維の利点は、最近Gillらによってレビューされている [10]。食物繊維は腸の通過を促進し [25], [26], [27], [28], [29]、便の回数を増加させる [29], [30], [31]。さらに、食物繊維は便の硬さを改善し、便の重量を増加させる [32], [33], [34], [35], [36]。これらの観察は、読者の経験にも当てはまるかもしれない。これらの効果は、粘液産生を機械的に誘発し、腸上皮バリアを強化する [37], [38]。同時に、食物繊維の保水能力は、下痢時の便形成を助け、異常な腸通過を正常化する [39], [40], [41]。これと同様に、食物繊維の大量摂取は、炎症性腸疾患(IBD) [42], [43] 、憩室疾患 [44], [45], [46] 、便秘 [47] のリスク低下と強く関連している。我々の研究では、食事から食物繊維を除去すると、デキストラン硫酸ナトリウム(DSS)誘発大腸炎モデルの疾患に劇的かつ深刻な影響を与えた [48], [49] 。IBDにおける食物繊維の保護的役割は、ランダム化臨床試験(RCT) [50], [51] でさらに確認されている。
2.2. 心臓代謝性疾患
食物繊維は、腸の通過を促進し、腸でのホルモン分泌を変化させ、小腸での脂質およびグルコースの吸収を低下させる [52], [53] 。食物繊維が血糖値や血中コレステロールのコントロールに有益であることは、各国の当局による複数の食品ガイドラインで一貫している [1], [2], [3], [4], [8]。食物繊維によるこのような代謝調節は、当然のことながら、肥満、高脂血症、高血糖、2型糖尿病(T2D)、心血管疾患(CVD)[8]などの心代謝性疾患のリスク低下につながり、これらは特に高所得国において、世界的な健康に対する主要な負担となっている[21]。
食物繊維はT2D [54], [55], [56], [57], [58]や高脂血症 [5], [59]を改善する。National Health and Nutrition Examination Survey (NHANES) [60], [61], [62]のデータベースでは、食物繊維の高摂取は成人および小児の体重低下とも関連している。フィンランド糖尿病予防研究(Finnish Diabetes Prevention Study)では、食物繊維の摂取量を増やすことで、体重減少やウエストの縮小が達成された [58] 。興味深いことに、EPIC-InterActコンソーシアムによって実施されたメタアナリシスでは、体格指数(BMI)の調整により、食物繊維の摂取とT2Dとの関連は統計的に有意ではなくなっており [55]、体重が食物繊維によるグルコースコントロールを促進する重要な因子であることが示唆されている。
4635人の成人参加者を対象とした185の前向き研究および58の臨床試験から得られた約1億3500万人年のデータを含むメタアナリシスでは、食物繊維を最も多く摂取している人は、最も少ない人に比べて、心血管関連死亡、冠動脈性心疾患の発症、脳卒中の発症および死亡、T2Dのリスクが15~30%減少していた[6]。食物繊維の成人1日平均摂取量は、これらの心代謝性疾患に対する最適な効果を得るためには25~29g以上であるべきであり、食物繊維の摂取量が多いほどさらなる効果が得られる可能性が高い [6]。特に、高血圧はCVDの最も重要な危険因子であることは間違いない [63], [64], [65], [66], [67], [68], [69], [70], [71], [72], [73], [74], [75]。最近の総説では、食物繊維がどのようにBPを調節するかをエレガントにまとめている [76]。食物繊維の高摂取は、ヒトの低BPと関連している [6], [77], [78]。前臨床動物実験では、高繊維食は実験的高血圧モデルにおいてBP上昇を抑制し [79]、一方、食物繊維の不足はBPを悪化させる [80]。RCTでは、食物繊維の補給が高血圧患者のBPコントロールを補助することが支持されている [81], [82], [83]。健常人における食物繊維によるBP低下は、タイプ特異的な効果に一貫性がなく、依然として結論が出ていない [84], [85], [86]。
2.3. アレルギー性疾患
喘息、食物アレルギー、アレルギー性鼻炎、アトピー性皮膚炎を含むアレルギー性疾患の有病率は、急速な世界的な西洋化とともに、過去数十年で劇的に増加している。世界人口の約20%が、少なくとも1種類のアレルギー性疾患に罹患している [87] 。欧米型の食生活は、アトピーや喘息の主要な危険因子であるようだ [88] 。我々は最近、食物繊維を含む食事がアレルギー疾患に及ぼす影響についてレビューした [9] 。さらに最近のメタアナリシスでは、毎日の食事摂取が、特に男性において、アレルギー疾患のリスクおよび重症度と逆相関することが検証されている [89], [90] 。食物繊維のサプリメントは、成人喘息患者の肺機能を改善し、気道炎症を抑制する [91], [92]。動物モデルでは、食物繊維は喘息 [48], [93], [94], 食物アレルギー [95], アトピー性皮膚炎 [96], [97] に効果がある。しかし、最近の研究では、イヌリン繊維が2型炎症を誘発するという矛盾した結果がマウスで報告されている [98]。
アレルギー性疾患の発症率は、若年者や乳児 [99], [100], [101], [102] にピークがあり、その繊維摂取量は母乳育児に大きく依存している。興味深いことに、母乳育児はアレルギー疾患のリスクを大幅に減少させる [103], [104]。ヒト母乳には、水溶性繊維の一群である多様なヒトミルクオリゴ糖(HMO、200種類以上)が多量(約10g/L)に含まれている [20]。HMOsはおそらく母乳育児によるアレルギー疾患からの保護をもたらし、HMOsの補給は乳児期のアトピー性皮膚炎のリスクを減少させる [105], [106], [107]。
2.4. 大腸がんおよび他のがん
Burkittは、食物繊維の不足と大腸がん(CRC)との関連を最初に記録した。彼は、食物繊維によって誘発される腸管通過時間の短縮が、管腔内の発癌物質と腸粘膜との接触時間を減少させ、大腸発癌を抑制すると提唱した [15], [16], [17]. スカンジナビアと日本における初期の疫学研究は、彼の仮説を支持した [108], [109] 。23の研究から2018年に行われた最新の世界がん研究基金のメタアナリシスでは、食物繊維の摂取は大腸がんのリスクを低下させると結論づけられた[110]。我々は、炎症誘発マウス大腸がんモデルにおいて、高繊維摂取が腫瘍増殖を抑制することを観察した [49]。大腸がんに加えて、高繊維摂取は食道がん [111]、胃がん [112]、肝臓がん [113]、乳がん [114]、腎がん [115]、およびすべてのがん死亡のリスク低下とも関連している [7], [116], [117]。
2.5. なぜ食物繊維は西洋の病気に対する共通の答えなのか?
上にまとめたように、バーキットの仮説は多くの研究によって検証され、さらに支持されている。食物繊維は、その多くが全身的に、あるいは生理学的に消化管から遠位で起こる、これらの異種の西洋疾患にどのように役立つのでしょうか?Burkittはまず、ヒトの健康における食物繊維の重要性を、消化管生理の調節に帰着させた(図1)[19]、[20]。しかし、これではアレルギーやその他多くの西洋の病気に対する食物繊維の影響を説明することはできない。免疫反応の制御と腸内細菌叢の維持という、当時のバーキットには理解できなかった2つの要因が、この疑問に対する答えになりそうだ(図1)。CVD、T2D、アルツハイマー病を含むすべての西洋の病気は、炎症反応の過剰活性化と関連している [118] 。欧米型の食事は、一般的に食物繊維の摂取が不足しているため、慢性的な低悪性度炎症を引き起こす可能性がある [119], [120]。急速な都市化が進行しているタンザニアで最近行われた研究では、伝統的な農村部のライフスタイルと比較して、西洋食を含む西洋化した都市部のライフスタイルは、より炎症性の免疫表現型をもたらすことが実証された [121] 。食物繊維の健康上の利点、特に抗炎症作用は、腸内細菌叢による発酵とこのプロセスの最終産物であるSCFAによってもたらされることを示す証拠が増えている。
ダウンロード 高解像度画像ダウンロード(370KB)
ダウンロード フルサイズ画像のダウンロード
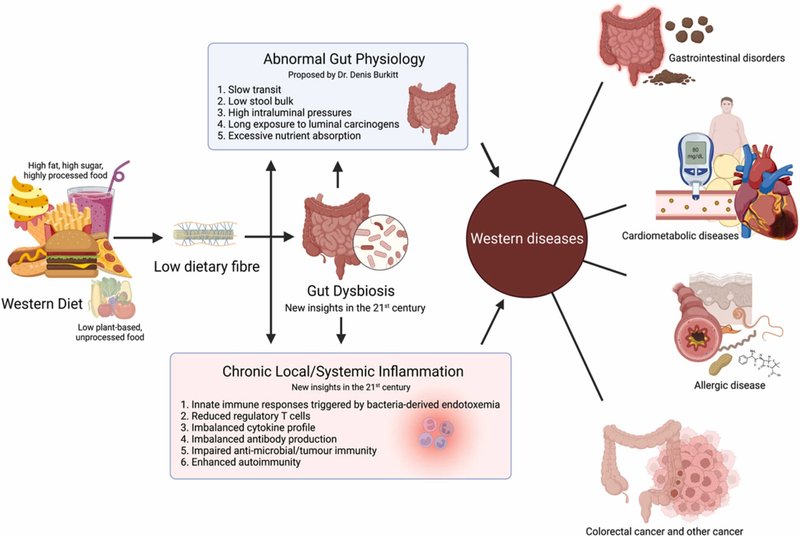
図1. 21世紀のバーキット仮説。食物繊維が不足した欧米型食生活は、さまざまな西洋病の発症の根底にある。デニス・バーキット博士は、これが腸の異常な生理機能の調節障害によってもたらされていると提唱した。バーキット博士の提唱は1970年代に確立されて以来検証されてきたが、21世紀に入ってからの大きな進歩により、欧米食が引き起こす西洋病には腸内細菌異常と慢性炎症が寄与していることが浮き彫りになった。Biorender.comで作成されました。
食物繊維は、その構造的に長い長鎖とグリコシド結合で結ばれた複雑な側枝のために、小腸で消化されにくい。ヒトは食物の糖鎖を消化するごく限られた数の酵素しか持っていないが、1014以上の常在腸内細菌叢は、グリコシド加水分解酵素や多糖類リザーゼを含む多様な炭水化物活性酵素(CAZymes)を産生し、食物繊維を発酵可能な単糖類に加水分解する [122], [123] 。これらの単糖をさらに発酵させると、SCFAが生成される。これらのプロセスは、アデノシン三リン酸(ATP)の純生成につながり [124]、細菌の増殖と活動を促進する燃料となる [125]。最も豊富な3つのSCFA、酢酸、プロピオン酸、酪酸は、生成される全SCFAの95%以上を占める[126]。大腸内容物と糞便中の酢酸、プロピオン酸、酪酸のモル比は、それぞれ約60:20:20である [124], [127], [128]。近位結腸では腸内細菌叢がSCFAを大量に産生するため、3つの主要なSCFAの濃度は近位結腸で非常に高く、最大140mMである [127], [128]。SCFAが吸収され、SCFA産生が減少するにつれて、SCFA濃度は結腸に沿って徐々に低下し、遠位結腸では約20mMとなる [127], [128]。食物繊維は腸内細菌叢を形成する
2010年に発表された画期的な研究によると、繊維質を多く摂取しているアフリカの農村部の子供たちの腸内細菌叢は、西洋的な食生活を送っているヨーロッパの子供たちと比較して、バクテロイデーテス属が多く、ファーミキューテス属が少なく、糞便中のSCFAsが多いことが明らかになった [129]。興味深いことに、このような所見は、痩せ型と肥満型の間のマイクロバイオームの違いに似ている [130], [131] 。腸内細菌叢組成の異常交代である腸内細菌異常症は、ほとんどすべての西洋医学的疾患 [132], [133], [134], [135], [136], [137], [138]、特に炎症性疾患 [139] と関連している。驚くべきことに、欧米のライフスタイルは、都市住民の腸内細菌叢のいくつかの種を永久的に減少させており、その主な原因は食物繊維の摂取不足であると考えられる [140]。低繊維食は、ヒトの微生物叢をコロニー形成したマウスにおいて、3世代以内に微生物の多様性を不可逆的に減少させた [141]。以下のセクションでは、食物繊維が腸内細菌叢を形成する2つの可能なメカニズムについて議論する。
3.1. エネルギー源としての食物繊維が腸内微生物の競争を促進する
近位結腸の内腔酸素濃度は宿主によって約0.6%に制限されており、嫌気的環境となっている [142]。そのため、腸内細菌叢のほとんどは、エネルギー源としてほとんど嫌気性発酵に依存している。腸内細菌叢は非常に代謝が活発である。腸内細菌叢の代謝速度は、ほとんどが食物繊維の発酵に依存しており、250~300kcal/日で、宿主の肝臓の代謝速度に匹敵する [143]。このプロセスの実体として、大腸内での食物繊維の利用可能性は、腸内細菌叢の組成を大きく形成する(図2)[144]。一般的に、離乳後の食物繊維摂取は、成体期においてバクテロイデーテス門やクロストリジア綱のメンバーなどの偏性嫌気性発酵菌の優勢につながる [145], [146]。食物繊維が不足すると腸内細菌叢が飢餓状態に陥り、宿主の健康に有害な結果をもたらすことになる [147]。
ダウンロード 高解像度画像のダウンロード(431KB)
ダウンロード フルサイズ画像のダウンロード
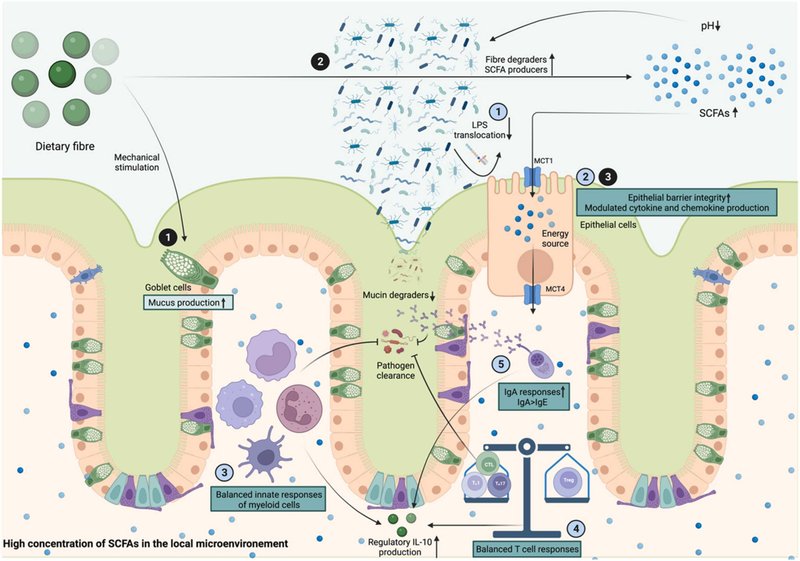
図2. 食物繊維は腸のホメオスタシスを改善する。食物繊維は腸内細菌叢によって発酵され、その結果、短鎖脂肪酸(SCFA)が大量に産生され、内腔pHが低下する。SCFAsはpH依存性の単糖輸送体(MCTs)によって上皮細胞内を輸送される。食物繊維は腸管バリアの完全性を促進し、微妙な局所免疫ホメオスタシスを維持することで、腸管ホメオスタシスを改善する。食物繊維は3つのメカニズム(黒丸の数字)を通して腸管バリアの完全性を改善する。1) 食物繊維はそのままの形で、粘液を産生するように杯細胞を機械的に刺激する。2) 食物繊維は、局所的な微生物競争の中で繊維分解物質とSCFA産生物質を好むため、粘液層を損なうムチン分解物質の増殖を抑制する。3) SCFAは、上皮細胞に活力を与え、タイトジャンクションタンパク質の発現増加やインフラマソームの活性化など、上皮細胞の活性を調節することにより、上皮の完全性を高める。食物繊維は、5つのメカニズム(水色の丸の中の数字)を通して、局所免疫ホメオスタシスに有益である。1)腸管バリアーの完全性が向上することで、リポ多糖の移動が減少し、内毒素血症と炎症が軽減する;2)SCFAは上皮細胞のサイトカインとケモカインの産生を調節する;3)SCFAとプロトンは骨髄細胞の自然免疫反応のバランスをとる; 4)SCFAとプロトンは、1型ヘルパーT(TH1)細胞、17型ヘルパーT(TH17)細胞、細胞傷害性CD8+Tリンパ球(CTL)のエフェクター機能と制御性T(Treg)細胞の制御機能のバランスをとる。これらのメカニズムを利用して、食物繊維は、効率的に病原体を除去し、同時に過剰な炎症を防ぐ局所的なホメオスタシスをエレガントに維持する。Biorender.comで作成されました。
食物繊維は、非常に多様な構造 [10], [11] を有する広範囲の抵抗性炭水化物を含み、腸内細菌叢は異なる繊維を分解する能力において様々である [148], [149] 。したがって、食物繊維は、微生物の代謝および腸内細菌叢の構成に種類特異的な影響を及ぼす [150], [151], [152]。
例えば、レジスタントスターチ(RS)は、小腸においてヒト由来の酵素に対して耐性を示す食物デンプンである。大腸内では、Ruminococcus bromiiやBifidobacteria adolescentisなどの一次分解酵素がRSの滑らかな表面を侵食し、発酵性オリゴ糖を遊離し、乳酸や酢酸などの代謝産物を放出する。Eubacterium rectaleやRoseburia属、Butyrivibrio属などの二次分解物質(主に酪酸産生菌)が分解に加わり、大量の酪酸を産生する [152]。したがって、RSの補給は、通常、これらのRS分解酵素の相対的な存在量を増加させ [153], [154], [155]、他のSCFAよりも酪酸産生を選択的に促進する [154], [155], [156], [157]。しかしながら、ヒトには個人差があり、これはベースライン時のコアマイクロバイオーム中の一次分解酵素のレベルによると考えられる [153], [155], [157]。さらに、RSには5つのタイプがある:RS1、物理的にアクセスできないデンプン;RS2、ネイティブな粒状デンプン;RS3、レトログレードデンプン;RS4、化学的に修飾されたデンプン;RS5、デンプン-脂質複合体 [152]。RS5を除く全てのタイプのRSは発酵性が高い [10]。RS分解酵素は、異なるタイプのRSに対して嗜好性を示す [152]。RS4はファーミキューテスよりバクテロイデーテスを好むが、RS2はファーミキューテスを好む [158], [159], [160]。化学修飾の違いによるRS4の構造の違いが、腸内細菌叢の構成や微生物の代謝プロファイルを形成している可能性がある [151]。例えば、結晶性のトウモロコシRS4は、予想通りE. rectaleを増殖させ、糞便中の酪酸を増加させる[151]。架橋タピオカRS4は、パラバクテロイデス・ディスタゾニスを増殖させ、糞便中のプロピオン酸を増加させる[151]。対照的に、架橋ポテトRS4は、プラセボ(消化性コーンスターチ)と比較して、マイクロバイオームとSCFA産生にほとんど影響を及ぼさない[151]。
RSと比較して、イヌリンなどの非デンプン性多糖類は、腸内細菌叢の組成に異なる影響を及ぼし [153], [154] 、種類特異的な様相を示す [150], [161] 。イヌリンとオリゴフルクトースがビフィズス菌を増殖させ、腸内環境と一般的な健康に役立つことはよく知られている [162]。さらに最近では、イヌリンサプリメントが腸内細菌叢のバクテロイデーテス(Bacteroidetes)個体群を促進することが報告されている[98]。最近の研究では、アラビノキシラン(AX)とイヌリンのサプリメントが、ヒトの腸内細菌叢と関連する代謝および免疫特性に及ぼす影響を総合的に評価した [150]。AXとイヌリンは、繊維発酵菌として知られるバクテロイデス・オバタス(Bacteroides ovatus)やバクテロイデス・キシラニソルベンス(Bacteroides xylanisolvens)の濃縮など、腸内細菌叢に与える影響を共有していたが、いくつかの特異的な特徴も示していた[150]。例えば、AXはRoseburia属を用量反応的に増加させ、イヌリンはBifidobacterium属を増加させた[150]。興味深いことに、これらの特異的パターンは脂質代謝における異なる反応と関連しており、AXは血中コレステロールを減少させたが、イヌリンは影響を及ぼさなかった[150]。この発見は、異なる種類の繊維の異なる影響が、実質的に異なる生理学的結果につながる可能性を示唆しているが、この理論を検証するためにはさらなる研究が必要である。
3.2. SCFAによる酸性pHがマイクロバイオームを形成する
栄養素をめぐる微生物の競合とは別に、大腸内腔のpHは食物繊維が腸内細菌叢を形成するもう一つの要因である(図2)。大腸内ではSCFAが多く存在するため、大腸内腔のpHは6.5程度と酸性に傾く [163], [164], [165], [166]。細菌の16 s rRNAの塩基配列決定により、pH(pH 6.0、6.5、6.9)がin vitroでのヒト糞便濃縮培養の微生物群集構造を決定する原動力であることが示された [167]。培養サンプルは、主座標分析においてpH(67%)に基づいて主にクラスタリングされ、これは酸性培養において乳酸桿菌門が拡大し、バクテロイデス門と腸内細菌門が減少したことに起因している [167]。pHの変化は腸内細菌叢の代謝、特に食物繊維の発酵によるSCFA産生を深く制御する。ヒト腸内細菌叢のin vitro培養における総SCFA産生量が最も多いのは、通常、結腸近位部の正常pHであるpH6.0であった [168]。酪酸産生は酸性(pH5.5-6.0)によって有意に促進され、酪酸産生菌であるRoseburia、Faecalibacterium prausnitzii、Coprococcus comes、E. rectaleは、このような酸性pH下でより豊富に存在した [167], [169], [170], [171] 。ほとんどの研究は酸性域(pH < 7.0)で行われたが、pH値が7.0を超えると酪酸産生量は低下した [170]。特に、酪酸産生菌であるFaecalibacteriaとC. comesは7.5以上のpHに極めて敏感であった [170]。pHが6.0-7.0の範囲では、プロピオン酸産生が酪酸産生を上回り、pHが6.5-7.0の範囲では、Veillonella、Megasphaera elsdenii、特定のバクテロイデーテス(Bacteroides fragilis、B. ovatus)などのプロピオン酸産生菌が優勢な炭水化物発酵菌となった [167], [169], [170]。しかし、pH値が7.0を超えると、プロピオン酸の蓄積量は低下し、プロピオン酸生産者の数も増加した [170]。宿主の体内に存在する主なSCFAである酢酸の生産は、異なるpH下で比較的安定していた [170]。腸内細菌叢の中で最も多く存在する上位2つの門については、一般的に、酢酸とプロピオン酸を主な代謝最終産物とするバクテロイデーテスは弱酸性のpH(pH5.5)に対して比較的敏感であり、一方、酪酸を代謝最終産物とするファーミキューテスは酸性pHに対してより寛容であった [168], [171]。
さらに、低pHは複数の病原性細菌の過剰繁殖を抑制することが長い間判明している。ヒト大腸内のSCFA比率に似たカクテルは、pH6.0では大腸菌に対して96%の増殖阻害を示したが、pH7.0ではわずか2%の阻害しか観察されなかった[172]。大腸の嫌気性感染のほとんどはクロストリジウムによって誘発され、酸性pHはin vitroのヒト腸内細菌叢培養におけるクロストリジウムの割合を減少させる [167], [170], [171]。アルカリ性便のpHは、消化器症状を有する患者において、主要な医療関連感染症であるクロストリジウム・ディフィシル(Clostridioides difficile)感染症 [173] の素因となる [174] 。さらに、大腸に常在しているもうひとつの一般的な病原体である黄色ブドウ球菌は、6.5以下の酸性pHに感受性があった [175], [176] 。食物繊維による免疫調節
4.1. 腸の完全性
腸上皮には、杯細胞という特殊な上皮細胞群が存在する。これらの細胞は継続的に粘液を分泌して腸上皮を覆う層を形成し、腸管内腔と宿主組織との間に物理的および免疫的バリアを提供している [177], [178] 。食物繊維が不足すると、腸上皮バリアが損なわれ、一般に「リーキーガット」として知られる [179] 。リーキーガットは、宿主がリポ多糖(LPS)などの腸管腔由来の内毒素、さらには病原性細菌にさらされる機会を増加させる。循環中のLPSは、免疫細胞によって発現されるToll様受容体4(TLR4)に結合し、核因子κB(NF-κB)経路の活性化と下流の炎症性サイトカイン産生を促進する[180]。これは、西洋病につながる慢性的な低悪性度炎症の根底にある、もっともらしいメカニズムである [118], [181]。さらに、リーキーガットは大腸内の相対的な酸素濃度を上昇させ、酸素に敏感なSCFA生産者に害を与え、病原性細菌の増殖を可能にする [145], [146], [182]。最も極端なシナリオでは、末梢血中の細菌の回避が重篤な急性炎症を引き起こし、敗血症を引き起こし、最終的には死に至る可能性がある [183] 。
食物繊維はどのようにして腸の完全性を維持するのか?前述のように、食物繊維はそのままの形で腸上皮による粘液分泌を機械的に刺激することができる(図2)[37]、[38]。食物繊維と粘液の粘性は、細菌の粘膜層への侵入を制限する。酢酸などのSCFAもまた、適切な粘液産生の維持を促進する(図2)[184]。SCFAの酸化は、大腸細胞へのエネルギー供給の60-70%を供給し、酪酸が好ましいエネルギー源となり [185]、杯細胞は粘液産生を促進するエネルギー源として酪酸を利用する [186]。大腸細胞による酪酸の代謝は、大腸の低酸素性微小環境の原因となっている。局所的低酸素は、転写因子である低酸素誘導因子1α(HIF-1α)を安定化させ、腸上皮の完全性を改善する [187]。さらに、SCFAは上皮細胞によって発現される少なくとも2つのGPCR、GPR43とGPR109Aを活性化する。下流のシグナル伝達経路はインターロイキン18(IL-18)の産生を促進し、NOD-、LRR-、ピリン・ドメイン含有タンパク質3(NLRP3)インフラムソームの活性化を誘導し[49]、[188]、腸管バリアの維持に寄与している[189]。さらに、酪酸によるGPR109Aの活性化は、腸上皮細胞によるクローディン-3、オクルディン、ゾヌリン-1などのタイトジャンクションタンパク質の発現をアップレギュレートする[190]。
腸内細菌叢も腸のバリア維持に関与している。微生物叢の中には、発酵基質として食物繊維よりも宿主の粘液を好む種があり、ムチン分解菌として知られている。食物繊維が不足すると、Akkermansia muciniphilaやBacteroides caccaeなどのムチン分解菌が増殖する [123]。対照的に、酪酸産生菌であるE. rectaleはほぼ枯渇し、別のSCFA産生菌であるBacteroides ovatusの増殖は食物繊維の欠乏によって著しく抑制された [123]。一貫して、低繊維食はムチン糖鎖を分解する微生物遺伝子も上昇させる [123]。さらに、食物繊維が不足すると、一部の繊維分解因子は、代わりにムチン糖鎖を分解するように代謝をシフトせざるを得なくなる [191] 。したがって、低繊維食による腸内細菌異常症は、腸上皮バリアーを障害し、全身性の炎症反応を誘発する。
4.2. SCFAs
SCFAsは免疫学的環境に応じて、制御性免疫応答と効果性免疫応答の両方を促進する。SCFAによる免疫調節の基盤となる2つの主要なメカニズムは、1)ヒストン脱アセチル化酵素(HDAC)の阻害とそれによる転写調節、2)SCFAを感知するGPCR(GPR41、GPR43、GPR109A)とその下流のシグナル伝達経路の活性化である[13]。
SCFAと最初に出会う細胞として、腸管上皮細胞はSCFAの存在下でエフェクター免疫応答と制御性免疫応答の両方を示す(図2)。LPSまたは腸内常在菌抽出物に応答して、低濃度のSCFA(酢酸10mMまたは酪酸1mM)は炎症性サイトカイン、IL-6、腫瘍壊死因子α(TNFα)の産生を促進する、 顆粒球マクロファージコロニー刺激因子(GM-CSF)およびケモカイン、ケモカイン(C-X-Cモチーフ)リガンド1(CXCL1)およびCXCL10は、GPR41およびGPR43依存的に上皮細胞によって産生される。これは、感染に対するTヘルパー(TH1)応答を適時に引き出すために重要である [192]。一方、高濃度のSCFA(20~100mM)は、in vitroで腸管上皮細胞株によるCXCL8やケモカイン(C-Cモチーフ)リガンド20(CCL20)などのケモカインの産生を低下させることが報告されている[193]、[194]。大腸細胞は、細菌量の減少とともに、近位結腸から遠位結腸へのSCFA濃度の変化にさらされているため、これらの矛盾した結果は、腸の恒常性にとって重要である可能性がある。
SCFAはまた、免疫防御の他の生得的構成要素も調節する。SCFAは好中球やマクロファージのHDACやNF-ĸB活性を阻害し、炎症性サイトカインの産生や増殖などの炎症活性を抑制する [195], [196], [197], [198]。好中球の遊走アッセイに対するSCFAの影響については、in vitroでは相反する結果が報告されているが、炎症性疾患のin vivoモデルにおいて、SCFAの補給が好中球の動員を効果的に減少させることが繰り返し実証されている[199]。酪酸塩はまた、樹状細胞(DC)の分化と成熟を抑制する [196], [200]。さらに、SCFAは、DCが抗炎症性サイトカインプロファイルを発現するように導き、T細胞をプライミングするDCの能力を損なう [196], [201]。酪酸によるHDAC3の阻害は、哺乳類ラパマイシン標的(mTOR)キナーゼ活性を抑制し、マクロファージの抗菌プログラムを強化する。さらに、高繊維食は、I型インターフェロン(IFN)応答を促進することにより、単球の抗腫瘍性プログラムを確立することができる [203]。
適応免疫に関して、SCFAの免疫機能で最もよく知られているのは、制御性T(Treg)細胞の分化と機能を高めることであろう。Treg細胞は、転写因子Foxp3の発現によって特徴づけられる特殊な免疫抑制性CD4+ T細胞群であり [204]、 [205]、 [206]。Treg細胞は、自己寛容の確立と過剰な炎症の抑制に重要な役割を果たしている [204]。SCFAは、単独または混合で、Treg集団を拡大し、IL-10の産生を促進する [207], [208], [209]。SCFAは、HDAC活性の阻害を通じて機能し、Foxp3遺伝子座のアセチル化を促進し、Foxp3の発現を促進する [207], [208], [209]。HDAC9は、Treg細胞の分化と機能を抑制する最もよく知られたHDACである [210]。我々の動物実験では、SCFAによるHDAC9阻害が、高繊維食による喘息に対する世代を超えた保護を説明する可能性が示唆された [93]。さらに、SCFAはGPR43とGPR109aの活性化を通じて抗原提示細胞の寛容原性表現型を誘導し、Tregの分化を促進する [95], [188]。
SCFAによるHDAC阻害はまた、ナイーブT細胞のmTOR経路をエピジェネティックに制御し、続いて制御性IL-10発現T細胞とエフェクターIFNγ発現TH1およびIL-17発現17型ヘルパーT細胞(TH17)の分化を促進する[211]。SCFAが誘導するエフェクターT細胞のIL-10産生は、腸のホメオスタシスを定常状態に維持する(図2)[212]。一方、SCFAによるTH1およびTH17エフェクター機能の亢進は、感染に対する免疫バリアを提供する(図2)[192]。さらに、酪酸はIFNγ産生を高めるなど、CD8+ T細胞の細胞毒性を促進する [213]。SCFAは、CD8+ T細胞の代謝を調節することにより、メモリーCD8+ T細胞が生存し、最適な機能を発揮するのを助ける [214], [215]。細胞傷害性CD8+ Tリンパ球(CTL)やキメラ抗原受容体(CAR)T細胞をSCFAにさらすと、その代謝やエピジェネティクスが再プログラムされるため、抗腫瘍活性が向上する [216], [217]。興味深いことに、TH1応答とTH2応答は互いに相反しており [218]、SCFAによるTH1サイトカイン産生への嗜好性は、TH2サイトカイン(すなわち、IL-4、IL-13)の産生を阻害する可能性がある。さらに、プロピオン酸はTH2分化を促進するDCの能力を低下させ、GPR41依存的にマウスアレルギー性喘息を抑制した [94]。TH2サイトカイン産生の阻害は、IgE反応の低下につながる[219]。さらに、SCFAはB細胞のHDACを阻害し、腸管IgA(図2)と全身性IgG応答の両方を促進するため [220]、 [221]、抗菌応答をサポートし、アレルゲンとの結合においてIgEと競合する [222]。SCFAはまた、HDACを阻害することによってIL-10を産生する制御性B細胞の分化を促進し(図2)、免疫系におけるその制御的役割をさらに強調している [223], [224]。非肥満性糖尿病(NOD)モデル動物では、酢酸塩が自己反応性T細胞を増殖させるB細胞の自己抗原提示能を抑制することが観察された [225]。SCFAによって引き起こされるこれらのメカニズムは、感染症、腫瘍、アレルギー性疾患、自己免疫から保護する適切なTH1/TH2バランスを確立する可能性がある。
4.3. 見落とされている視点:低pH
大腸内のSCFAsの量が多いと、内腔のpHは6.5程度と酸性に傾く [163], [164], [165], [166]。酸性pHには免疫抑制作用があり、これがSCFAの抗炎症作用をもたらすと考えられる。例えば、低pHは好中球の遊走 [226]、[227]および呼吸バースト [228]、[229]、[230]、[231]を阻害する。興味深いことに、SCFAは酸性pH5.5では好中球のバーストを阻害するが、pH7.4では阻害しないことから [232]、SCFAアニオンではなくプロトンがこの抑制機能の主要なドライバーであることが示唆される。細胞外アシドーシスはまた、単球/マクロファージのNF-κB活性化を低下させ [233], [234] 、TNFαを抑制し、IL-10の産生を増加させる(図2) [235], [236], [237], [238]。さらに、低いpHは、CD4+とCD8+ T細胞の両方において、T細胞の活性化と分化に重要なmTOR複合体1(mTORC1)活性を阻害する [239] [240] [241]。実際、酸性pH6.6は、in vitroでT細胞の増殖と活性化を阻害する [242]。CTLの細胞傷害性は、乳酸アシドーシスによって抑制される [243], [244], [245]が、これはSCFAによるCTLの細胞傷害性亢進のバランスをとり、CTLを介する自己免疫疾患を予防しているのかもしれない。これらの知見を支持し、我々は、大腸内の酸性pHがSCFAの抗炎症作用を媒介する重要な因子である可能性が高いことを主張する。
我々は以前、プロトン感受性GPCRであるGPR65が、SCFAを含む酸性代謝産物の保護的役割の重要なメディエーターとして機能する可能性を提唱した [246]。GPR65は、正常な結腸内の平均pHと同様の酸性pHで活性化され [247], [248], [249] 、特に免疫細胞に濃縮されている [250], [251], [252] 。I231Lのミスセンス変異体(rs3742704)を含むヒトGPR65遺伝子座内の複数の多型は、IBDのトップリスク遺伝子座の中で際立っている [253], [254], [255], [256], [257]。GPR65の欠損が動物モデルにおいて大腸炎を悪化させるという証拠 [258], [259], [260] とともに、これらの結果は、GPR65をIBD管理のための主要な治療標的とし、発酵性繊維の健康上の利点を説明する可能性の高いメカニズムとしている。GPR65はGαsタンパク質と結合し、アデニルシクラーゼ/cAMPシグナル伝達経路を活性化する [261]。その活性化は、上述のSCFAの影響と同様に、マクロファージ [262], [263], [264] やT細胞 [257], [264] からのTNFαやIL-6の産生を阻害する。GPR65の活性化もまた、酸性pH(6.5)下での好中球の遊走阻害の根底にある [257]。GPR65の欠損は、抗菌性オートファジー、TH17およびTH22の分化を阻害し、DCによる抗原提示を亢進させる [260]。しかし、GPR65が食物繊維の有益性を媒介することを裏付ける直接的な証拠はまだ確立されていない。
4.4. 免疫緊張の新規モデル
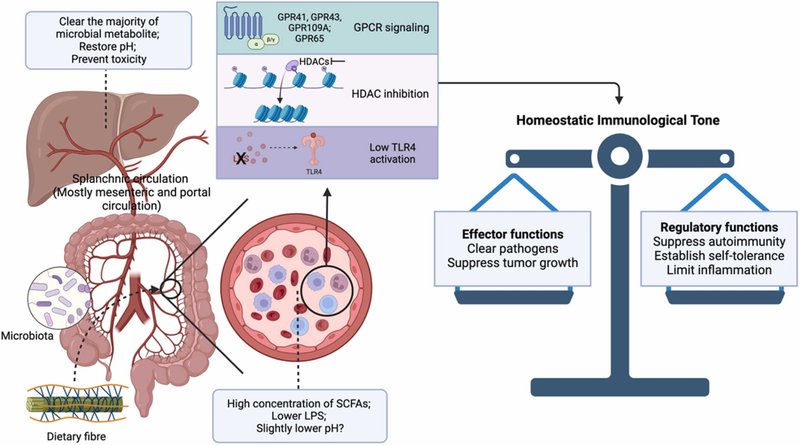
大腸内腔におけるSCFAsの濃度は高いが、吸収されたSCFAsの大部分(生成されたSCFAsの95%以上)は大腸細胞および肝細胞によって代謝される [127], [185], [265]。腸及び肝臓におけるSCFAのクリアランスにより、末梢血に過剰に高濃度のSCFAが蓄積することが防止され[265]、[266]、[267]、その結果、高血糖、神経障害、さらには望ましくない炎症反応[268]、[269]、[270]を含む毒性作用が生じる。そのため、マウスやヒトの末梢血中では、プロピオン酸と酪酸はほとんど検出されないが、酢酸は約70μMのレベルで存在する [13], [127], [128], [271], [272]。さらに、血液中の全身の生理的pHは、約7.4の弱塩基性に厳密に維持されている。SCFAやプロトンのような食物繊維由来の因子が、このような低い全身レベルで、宿主の生理機能に全身的に重大な影響を及ぼすとは考えにくい。ここで我々は、大腸局所微小環境と脾循環(主に腸間膜循環と肝門脈循環)が、SCFAが全身生理学的に重要な役割を果たす主要な部位である可能性を提唱する(図2)。腸管内腔と門脈におけるSCFAsの濃度は、全身循環におけるSCFAsの存在量と比較して有意である(門脈循環では約350μM、酢酸、プロピオン酸、酪酸のモル比は約69:23:8)[127]。大腸の微小環境と脾循環におけるpHの測定は非常に困難であり、我々の知る限りデータはない。しかし、腸上皮の低酸素状態は、局所環境を酸性に導くはずである [273]。さらに、モノカルボン酸トランスポーター(MCT)によるSCFAやその他の有機酸の膜貫通輸送は、同じ方向へのプロトン輸送を伴う(図2)[13]、[124]、[274]。私たちは、SCFAが有意に存在する場合、比較的低いpHを伴うと考えるのが妥当であろう。脾循環の血流は、総心拍出量の25~30%を占める [275]。つまり、血液中の免疫細胞、主に好中球と単球/マクロファージ、さらにT細胞とB細胞は、SCFAが豊富で弱酸性の免疫調節環境に定期的(約1440回/日、13.5~16.2秒/回)に曝されることになる[275][276]。HDAC阻害の速度は不明であるが、GPCRの活性化の引き金となるのは数秒である [48]。大腸の微小環境と脾循環における定期的な免疫調節チャレンジは、肺で赤血球がガス交換を行うのと同様のメカニズムで、免疫系の恒常的な調子(免疫学的調子)を確立できる可能性がある [277]。したがって、食物繊維の摂取量を増やすことで、恒常的な免疫系の調子を高め、健康全般に有益な効果をもたらす可能性がある(図3)。食物繊維が不足すると、腸の完全性が損なわれ、内毒素血症が引き起こされ、炎症性免疫学的緊張が確立され、西洋の疾病を引き起こす可能性がある。
ダウンロード 高解像度画像ダウンロード(357KB)
ダウンロード フルサイズ画像のダウンロード
図3. 食物繊維はホメオスタシス的な免疫学的基調を確立し、全身的な利益をもたらす。食物繊維は、脾臓循環(主に腸間膜循環と門脈循環)に吸収される微生物代謝産物のレベルを調節する。この循環は、短鎖脂肪酸(SCFA)が多く、腸由来のエンドトキシン、すなわちリポ多糖(LPS)が少ないか、あるいは存在しないことが特徴で、全身循環に比べてpHがわずかに低い可能性がある。脾臓循環におけるこのユニークな免疫学的ニッチは、循環中の免疫細胞に定期的なチャレンジを与えるため、有益な代謝物を感知するGタンパク質共役受容体(GPCR)を活性化し、ヒストン脱アセチル化酵素(HDAC)を阻害し、炎症性toll様受容体4(TLR4)シグナル伝達を遮断することによって、その応答を調節する。脾臓循環における免疫調節は、恒常的な免疫学的緊張を確立し、西洋の疾病を制御する。残留した微生物の代謝産物は、全身毒性を防ぐために肝臓で排出される。食物繊維の摂取が不足すると、この恒常的な免疫学的調子が損なわれ、西洋病のリスクが高まる。Biorender.comで作成。5.西洋の病気をコントロールするための食物繊維補給の課題
バーキットは、西洋病のリスクを最小限に抑えるために、1日50g以上の食物繊維摂取を提唱した。平均的な成人は、慢性疾患を予防するために> 25 g /日の食物繊維を消費するために2003年にWHOによって推奨された [278]、一方、高所得国で推奨される毎日の食物繊維消費量はほとんど25〜35 gである [8]。食物繊維の最大の利点は、> 35 gの毎日の繊維消費によってのみ達成される可能性がある[6]。しかし、この量の食物繊維摂取はほとんどの社会では困難であり、世界の1日平均食物繊維摂取量は約11g/日に過ぎない [22]。ヨーロッパの成人は約20g/日の食物繊維を摂取しているが、北米の成人は約16g/日しか摂取していない [8]。食物繊維の補給は、西洋の疾患に対する複数の臨床試験で適用されているが、一貫性のない結果しか得られていない [8], [20] 。食物繊維摂取に関する11の介入臨床研究を含むシステミックレビューでは、食物繊維サプリメントの抗炎症効果は限定的であった [279]。しかしながら、対象となった研究のほとんどでは、食物繊維サプリメントは習慣的な食事に追加されたものであったため、参加者の実際の食物繊維摂取量には疑問があった。これらの臨床研究の矛盾は、おそらく異なる種類の繊維の発酵性の違いと、参加者のベースラインのマイクロバイオームの違いに由来する。
天然由来の繊維はすべて何らかの形で発酵可能であるが、食物繊維の発酵性は、その構造の複雑さの違いや必要な酵素を有する特定の微生物の存在によって異なる [280]。フルクタンなどの分子サイズが小さく、物理的構造が単純な繊維は、近位結腸の腸内細菌叢によって速やかに発酵される [281]。分子サイズと物理的構造が大きくなるにつれて、繊維の発酵速度は低下し、発酵部位は結腸のより遠位部へと拡大する [282], [283], [284]。セルロース、リグニン、および非常に大きな分子サイズまたは非常に複雑な物理構造を有するその他の繊維は、最小限の発酵性しか有さない。重要な健康上の利点を有する繊維のグループは、RS、イヌリン、オリゴフルクトースなどの中程度またはゆっくりと発酵する繊維であり、その発酵は近位結腸から横行結腸、さらには遠位結腸にまで及ぶ[11]、[162]、[285]ため、おおよその濃度でSCFAの存在を広げる。しかしながら、先に議論したように、RS、イヌリンに対する反応は、腸の機能と組成におけるマイクロバイオームのベースラインの個人差により、かなりの個人差を示す [150], [153], [155], [157]。さらに、イヌリン繊維は最近、マウスにおいて微生物叢由来のコール酸の全身レベルを上昇させ、2型炎症を誘発することが判明した [98]。今後、さまざまな種類の食物繊維のタイプに特異的な免疫への影響を明らかにする研究が必要であり、それによって望ましくない副作用を回避し、西洋の疾病に取り組むために食物繊維を使用することの有効性を促進できる可能性がある。
食物繊維サプリメントの臨床におけるもう一つの重要な課題は投与量である。動物モデルにおける食物繊維の劇的な効果は、通常、ヒトの臨床試験で使用される用量と比較して、体重ベースで40倍高い用量の食物繊維によってもたらされる [286]。これは、100gを超える食物繊維の1日の消費量に似ている [287] 。しかしながら、西洋化した集団は、マイクロバイオームの永続的なベースラインの変化および関連する炎症反応のために、このレベルでの高食物繊維の介入中に望ましくない副作用に苦しむ可能性が高い [288]。例えば、1日30gのイヌリンサプリメントは、炎症性サイトカイン、IL-6、TGF-βおよびVEGF-Aのレベルを有意に増加させ、最近のヒトの評価では肝臓障害を引き起こす可能性さえある [150]。西洋の疾病をコントロールするためには、食物繊維に基づくより良い戦略、あるいは新しい薬用食が必要である。特別SCFA食-薬用食品の夜明け?
我々は、酢酸塩(HAMSA)、プロピオン酸塩(HAMSP)、酪酸塩(HAMSB)を結合させた高アミロースメイズデンプン(HAMS)飼料という改良型RSを使用することで、バルクまたは特定の食物繊維サプリメントから一歩進んだ。未修飾のHAMSと比較して、SCFAを結合させたこれらのHAMSベースの飼料は、天然由来の繊維では達成できない、大量のSCFAの緩慢で持続的かつ選択的な放出を保証する[289]。これらの飼料は、HAMSのバルク効果と粘性を保持し、大腸における天然のSCFA産生と吸収をモデル化しているため、SCFAを直接補給するよりも優れている。したがって、宿主に望ましくない副作用を引き起こす可能性が低い。
これらの飼料は、免疫系や炎症性疾患に対する特定のSCFA(すなわち、酢酸塩対酪酸塩)の影響を評価するための強力なツールであることが証明されている[184]、[207]、[225]、[290]、[291]。15%HAMSPまたは15%HAMSB(重量/重量)を添加した食餌は、糞便内容物中のプロピオン酸または酪酸のレベルを5μmol/g未満から15-20μmol/gに促進し、マウスの結腸におけるTreg細胞の増殖を促進し、その結果、腸の恒常性を改善した[207]。我々は、HAMSAまたはHAMSB食による4週間の食事介入により、自己膵β細胞に対する自己免疫を顕著に抑制することで、雌性NODマウスの1型糖尿病(T1D)の発症率を低下させることに成功した[225]。注目すべきことに、HAMSAまたはHAMSBを摂取したマウスの肝門脈血中には、それぞれ約1500μMの酢酸および約90μMの酪酸が観察され、HAMSを摂取したマウスの肝門脈血中(約800μMの酢酸および約20μMの酪酸)よりもはるかに高い値を示した[225]。末梢静脈血中のSCFAs濃度は、HAMSAまたはHAMSBを与えたNODマウスでも同様にはるかに高い[225]。T1Dに加えて、我々は最近、HAMSB食とオキサリプラチンを用いた化学療法を併用すると、マウスのMc38結腸がん細胞によって誘発された皮下腫瘍がほぼ完全に消失することを報告した[216]。我々はまた、全身性エリテマトーデス、関節リウマチ、アトピー性皮膚炎および心血管疾患のマウスモデルにおいて、HAMSA、HAMSBまたはHAMSPによる疾患抑制を観察した(未発表データ)。いくつかの症例では、薬理学的阻害では達成できなかったレベルまで病気が抑制された。動物モデルからのこれらの報告は、HAMSA、HAMSPおよびHAMSBが西洋の疾患を抑制する有益な免疫学的基調の維持に寄与していることを裏付けている。最近のトランスレーショナル研究では、20人のT1D患者に40g/日のHAMSBを6週間摂取させたところ、全身性炎症の抑制に成功したが、満足な血糖コントロールは達成できなかった [292]。我々の第II相クロスオーバープラセボ対照二重盲検RCT試験では、未治療の本態性高血圧患者において、40g/日のHAMSAB摂取による3週間の介入により、24時間収縮期血圧の臨床的に関連性のある6.1mmHgの低下が達成された [293], [294]。我々は、末梢血漿中の酪酸レベルを14.1倍の約35μg/mgまで増加させることに成功したが、これは従来の食物繊維サプリメントには見合わないものであった [293], [294]。これらの2つの限られた規模の試験では、明らかな副作用は観察されなかった。我々は、動物モデルにおけるこれらの食事の印象的な効能を臨床応用に変換することは、最適な用量と期間を見つけるという点で、食物繊維サプリメントと同様の課題に直面するであろうことを認める。
1オンスの予防は1ポンドの治療に勝る。疾患治療におけるHAMSA、HAMSB、HAMSPの有効性に加え、食物繊維またはHAMS食は、適切な免疫学的基調を確立し、多くの疾患の発症を予防する効果的な方法である可能性がある。これらの食事は摂取しやすく、天然物である。酢酸、酪酸、プロピオン酸をHAMSに結合させるのは、比較的簡単な化学反応である。マウスモデルや予備的RCTで達成されたのと同じ程度まで、ヒトの疾病が抑制されることが期待される。しかし、望ましくない副作用、特に胃腸症候群については、まだ総合的に評価する必要がある。結論
世界的なデータから明らかなように、私たちは十分な食物繊維を摂っていない。このことは、腸内細菌叢の構成、SCFAの産生、免疫学的な異常な緊張など、下流に壊滅的な結果をもたらす可能性がある。もともとは、IBDや喘息といった古典的な炎症性疾患が影響を受けると考えられていた。しかし、現在では、糖尿病、CVD、脂肪肝、アルツハイマー病など、ほとんどの西洋医学的疾患は、食物繊維摂取量の低下とそれに伴うSCFAレベルの低下によって影響を受けている可能性が高いことが裏付けられている。GPR41、GPR43、GPR109A、GPR65など、さまざまなGPCRが関与している。HDAC阻害の相対的な寄与はまだ不明である。炎症性疾患を予防し、長生きするためには、ヒトは食物繊維の摂取量を1日35g以上に増やすべきである。食物繊維とSCFAに基づく新しい薬用食餌は、西洋の疾病をコントロールするための強力なツールであり、医薬品の補完的アプローチとなるはずである。
利益相反
C.R.M.は、ヒトの病気を治療するためにHAMSA、HAMSPを製造する会社の創設者である。
謝辞
L.X.とM.J.A.はMonash Graduate Scholarshipsの支援を受けている。F.Z.M.はSylvia and Charles Viertel Charitable Foundation FellowshipのSenior Medical Research FellowshipおよびNational Heart Foundation Future Leader Fellowship (105663)の支援を受けている。C.R.M.は、オーストラリア保健医療研究評議会、保健省(APP1148476)の支援を受けている。
特集記事推薦記事
参考文献
[1]
Food and Agriculture Organization/World Health Organization Codex Alimentarius Commission. コーデックス委員会: 栄養表示に関するガイドライン CAC/GL 2-1985. (FAO、2021年)。
Google Scholar
[2]
欧州議会および理事会規則(EC)No 1924/2006および(EC)No 1925/2006を改正し、欧州委員会指令87/250/EEC、理事会指令90/496/EEC、欧州委員会指令1999/10/EC、欧州議会および理事会指令2000/13/EC、欧州委員会指令2002/67/ECおよび2008/5/EC、ならびに欧州委員会規則(EC)No 608/2004を廃止する、消費者への食品情報の提供に関する2011年10月25日付欧州議会および理事会規則(EU)No 1169/2011(EEA関連文書)。Off. J. Eur. Union, 2011. 20.
Google Scholar
[3]
連邦登記局. Federal Register81, 33581-34240 (2016).
Google Scholar
[4]
オーストラリア・ニュージーランド食品基準コード - 基準1.2.7 - 栄養、健康および関連クレーム.
Google Scholar
[5]
栄養科学諮問委員会。炭水化物と健康https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/445503/SACN_Carbohydrates_and_Health.pdf ( 2015).
Google Scholar
[6]
A. レイノルズ
炭水化物の質とヒトの健康:一連のシステマティックレビューとメタアナリシス
ランセット(2019年)393頁
Google Scholar
[7]
Y. Park, et al.
NIH-AARP diet and health studyにおける食物繊維摂取と死亡率
Arch. Intern. Med., 171 (12) (2011), pp.
PDFで見る
スコープで見るGoogle Scholar
[8]
A.M.スティーブン
ヨーロッパにおける食物繊維:定義、ソース、勧告、摂取量と健康との関係についての知識の現状
Nutr. Res. Rev. (2017), p. 30
Google Scholar
[9]
C. McKenzie, et al.
栄養-腸内細菌-生理学軸とアレルギー疾患
Immunol. Rev., 278 (1) (2017), pp.
論文を見る
CrossRefView in ScopusGoogle Scholar
[10]
S.K. Gill, et al.
胃腸の健康と病気における食物繊維
Nat. Rev. Gastroenterol. Hepatol. (2020)
Google Scholar
[11]
D. So, et al.
食物繊維とIBS:個別化医療の時代における機能的特性を臨床的価値に変換する
Gut, 70 (12) (2021), p. 2383
論文を見る
CrossRefView in ScopusGoogle Scholar
[12]
D.L.トッピング、P.M.クリフトン
短鎖脂肪酸とヒト大腸機能:レジスタントスターチと非スターチ多糖類の役割
Physiol. Rev., 81 (3) (2001), pp.
PDFで見る
CrossRefScopusで表示Google Scholar
[13]
J. Tan, et al.
健康と疾患における短鎖脂肪酸の役割
Adv. Immunol., 121 (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[14]
D. バーキット
関連疾患関連原因?
Lancet, 294 (7632) (1969), pp.1229-1231
PDFで記事を見るScopusで記事を見るGoogle Scholar
[15]
D. バーキット
因果関係の手がかりとしての関係
Lancet, 296 (7685) (1970), pp.1237-1240
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
[16]
バーキット、D.とH.トローウェル、精製炭水化物食品と疾患、食物繊維のいくつかの意味合い。1975.
グーグル奨学金
[17]
D.P.バーキット
結腸および直腸癌の疫学
癌, 28 (1) (1971), pp.
PDFで見る
スコープで見るGoogle Scholar
[18]
D.P.バーキット、H.C.トローウェル
食物繊維と西洋の病気
Ir. Med J., 70 (9) (1977), pp.
スコープで見るGoogle Scholar
[19]
J.H.カミングス、A.エンジニア
デニス-バーキットと食物繊維仮説の起源。
Nutr. Res. Rev., 31 (1) (2018), pp.
記事を見る
CrossRefView in ScopusGoogleスカラー
[20]
S.J. オキーフ
食物繊維不足と高所得者の生活習慣病との関連: バーキット仮説再訪。
Lancet Gastroenterol. Hepatol. (2019), p. 4
Google Scholar
[21]
C.J.L. Murray, et al.
204の国と地域における87の危険因子の世界的負担、1990-2019年:世界疾病負担調査2019のための系統的分析
Lancet, 396 (10258) (2020), pp.1223-1249
Google Scholar
[22]
A. Afshin, et al.
195カ国における食事リスクの健康への影響、1990-2017年:世界疾病負担調査2017のための系統的分析
Lancet, 393 (10184) (2019), 1958-1972頁
PDFで見る
スコープで見るGoogle Scholar
[23]
K.M.マスロフスキー、C.R.マッケイ
食事、腸内細菌叢、免疫応答
Nat. 免疫学, 12 (1) (2011), pp.
CrossRefScopusで見るGoogle Scholarで見る
[24]
T. 薙ぎ払い、G.キャンベル
糖尿病、冠状血栓症とサッカリン病
John"/right, Bristol (1966)
Google Scholar
[25]
D.P.バーキット、A.R.ウォーカー、N.S.ペインター
便および通過時間に対する食物繊維の影響、および疾患の原因におけるその役割
ランセット(1972)、2頁
Google Scholar
[26]
R.F.ハーヴェイ、E.W.ポマーレ、K.W.ヒートン
腸管通過における食物繊維の増加の影響
Lancet (1973), p. 1
PDFを見る記事を見るScopusGoogle Scholarで見る
[27]
I.M.ベアード
健常人における消化管通過、便重量および便回数、細菌叢、便中胆汁酸に対する2種類の食物繊維サプリメントの影響
Metabolism (1977), p. 26
Google Scholar
[28]
J.S. Gear, et al.
繊維と腸通過時間
Br. J. Nutr. (1981), p. 45
Google Scholar
[29]
J. Stevens, et al.
サイリウムと小麦ふすまの胃腸通過時間と便の特性に対する効果の比較
J. Am. Diet. Assoc. (1988), p. 88
CrossRefView in ScopusGoogle Scholar
[30]
G.A. Spiller, et al.
サイリウム種子ハイドロコロイドおよびセルロースとペクチンの混合物のバルク下剤効力
J. Clin. Pharm. (1979), p. 19
Google Scholar
[31]
V. ヴクサン
推奨レベルまで食物繊維摂取量を増加させるための穀物の使用と、北米の食事を摂取する健康な人の腸機能に対する食物繊維の効果
Am. J. Clin. Nutr. (2008), p. 88
Google Scholar
[32]
N.C.スアレス、A.C.フォード
系統的レビュー:慢性特発性便秘の管理における繊維の効果
Aliment. Pharmacol. Ther. (2011), p. 33
Google Scholar
[33]
S. クリストドゥリデス
メタアナリシスによる系統的レビュー:成人の慢性特発性便秘に対する食物繊維補給の効果
Aliment. Pharmacol. Ther. (2016), p. 44
Google Scholar
[34]
S.M. Hongisto, et al.
食物繊維が豊富なライ麦パンと乳酸菌GGを含むヨーグルトの組み合わせは、自己申告便秘の女性の腸機能を改善する
Eur. J. Clin. Nutr. (2006), p. 60
Google Scholar
[35]
R. Holma, et al.
便秘は、小麦パンや下剤よりもライ麦パンの方が、胃腸への悪影響を増加させることなく緩和される。
J. Nutr. (2010), p. 140
Google Scholar
[36]
J. Vries, et al.
ヒトの糞便重量および通過時間に対する穀類、果物および野菜繊維の効果:介入試験の包括的レビュー
Nutrients (2016), p. 8
Google Scholar
[37]
S.N. Heller, et al.
食物繊維:小麦ふすまの粒径が若年成人男性の大腸機能に及ぼす影響
Am. J. Clin. Nutr., 33 (8) (1980), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
[38]
J. トムリン、N.W.リード
難消化性プラスチック粒子の緩下作用
BMJ (1988), p. 297
グーグル学者
[39]
M. 加藤
無細胞でのRNA顆粒の形成:低複雑性配列ドメインがハイドロゲル内で動的線維を形成する
細胞 (2012), p. 149
Google Scholar
[40]
D.Z.ブリス
便失禁に対する食物繊維補給:無作為化臨床試験
Res. Nurs. Health (2014), p. 37
Google Scholar
[41]
N. Washington, et al.
サイリウムによるラクチュロース誘発下痢の緩和:運動性と発酵への影響
Am. J. Clin. Nutr. (1998), p. 67
Google Scholar
[42]
A.N.アナンタクリシュナン
食物繊維の長期摂取とクローン病および潰瘍性大腸炎のリスクに関する前向き研究
Gastroenterology (2013), p. 145
Google Scholar
[43]
F. Li, et al.
野菜と果物の摂取と炎症性腸疾患のリスク:メタ分析
Eur. J. Gastroenterol. Hepatol. (2015), p. 27
Google Scholar
[44]
L.L.ストレート
前向きコホート研究において、西洋型食事パターンは憩室炎発症リスクを増加させ、慎重な食事パターンは憩室炎発症リスクを減少させる
消化器病学(2017年)、152ページ
Google Scholar
[45]
F.L.クロウ
食物繊維源と憩室疾患発症率:英国女性の前向き研究
Gut (2014), p. 63
CrossRefGoogle Scholar
[46]
D. Aune, et al.
食物繊維の摂取と憩室性疾患のリスク:前向き研究の系統的レビューとメタ分析
Eur. J. Nutr. (2020), p. 59
Google Scholar
[47]
L. デュカス、W.C.ウィレット、E.L.ジョバンヌッチ
女性を対象とした研究における身体活動、食物繊維摂取、およびその他のライフスタイル変数と便秘の関連性
Am. J. Gastroenterol. (2003), p. 98
Google Scholar
[48]
K.M. Maslowski, et al.
腸内細菌叢と化学誘引性受容体GPR43による炎症反応の制御
ネイチャー, 461 (7268) (2009), 1282-1286頁
CrossRefView in ScopusGoogle Scholar
[49]
L. Macia, et al.
メタボライトセンシングレセプターGPR43とGPR109Aは、インフラマソームの制御を通じて食物繊維による腸の恒常性維持を促進する。
Nat. Commun., 6 (2015), p. 6734
スコープで見るGoogle Scholar
[50]
L. Wedlake, et al.
炎症性腸疾患の治療と維持における食物繊維:ランダム化比較試験の系統的レビュー
Inflamm. Bowel Dis. (2014), p. 20
Google Scholar
[51]
C.S. Brotherton, et al.
食物繊維の摂取を避けることは、6ヵ月間のクローン病再燃のリスクが高いことと関連する。
Clin. Gastroenterol. Hepatol. (2016), p. 14
Google Scholar
[52]
J.H.カミングス、A.M.スティーブン
炭水化物の用語と分類
Eur. J. Clin. Nutr. (2007), p. 61
CrossRefView in ScopusGoogle Scholar
[53]
T. 高橋、他。
結晶セルロースは血漿グルコース濃度を低下させ、ラットの消化物粘度を上昇させることにより水分吸収を促進する。
J. Nutr. (2005), p. 135
CrossRefView in ScopusGoogle Scholar
[54]
A. Rivellese, et al.
糖尿病患者におけるグルコースコントロールと血清リポ蛋白に対する食物繊維の効果
Lancet, 316 (8192) (1980), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[55]
インターアクト・コンソーシアム
ヨーロッパ8カ国における食物繊維と2型糖尿病の発症率:EPIC-InterAct Studyと前向き研究のメタアナリシス
Diabetologia, 58 (7) (2015), pp.1394-1408
Google Scholar
[56]
D.E. Threapleton, et al.
食物繊維摂取と糖尿病リスク:前向き研究の系統的レビューとメタ解析
Proc. 栄養学会、72(OCE4)(2013)、記事E253
グーグル学者
[57]
B. Yao, et al.
食物繊維摂取と2型糖尿病リスク:前向き研究の用量反応解析
Eur. J. Epidemiol., 29 (2) (2014), pp.
CrossRefScopusで表示Google Scholar
[58]
J. Lindström, et al.
高繊維質・低脂肪食は長期的な体重減少と2型糖尿病リスクの低下を予測する:フィンランド糖尿病予防研究
Diabetologia, 49 (5) (2006), pp.
CrossRefView in ScopusGoogle Scholar
[59]
L. Brown, et al.
食物繊維のコレステロール低下効果:メタアナリシス
Am. J. Clin. Nutr., 69 (1) (1999), pp.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[60]
A.M. Albertson, et al.
米国における全粒穀物の消費傾向と体重測定との関連:横断的な国民健康栄養調査2001年から2012年の結果
Nutr. J., 15 (1) (2016), p. 8
ScopusGoogle Scholarで見る
[61]
D.E.キング、A.G.マイナス3世、C.A.ランボーン
米国における食物繊維摂取量の傾向、1999-2008年
J. Acad. Nutr. Diet., 112 (5) (2012), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[62]
M. Reicks, et al.
米国人口の総食物繊維摂取量は、全粒穀物消費量と関連している:国民健康栄養調査2009年から2010年の結果
Nutr. Res., 34 (3) (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[63]
S. Oparil, et al.
高血圧
Nat. Rev. Dis. Prim., 4 (1) (2018), p. 18014
ScopusGoogle Scholarで見る
[64]
S. Lewington, et al.
血管死亡率と普段の血圧の年齢別関連性:61の前向き研究における100万人の成人の個人データのメタ分析
Lancet, 360 (9349) (2002), pp.
スコープで見るGoogle Scholar
[65]
アジア太平洋コホート研究
アジア太平洋地域における血圧と心血管疾患
J. Hypertens., 21 (4) (2003)
Google Scholar
[66]
S.P.ケネリー、B.A.ローラー、R.A.ケニー
総説:血圧と認知症-包括的レビュー
Ther. Adv. Neurol. Disord., 2 (4) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[67]
S. Czernichow, et al.
ベースライン血圧に応じた血圧降下および異なる血圧降下レジメンの主要心血管イベントに対する効果:ランダム化試験のメタアナリシス
高血圧, 29 (1) (2011)
Google Scholar
[68]
S.I. Sharp, et al.
高血圧は血管性認知症の潜在的危険因子である:系統的レビュー
Int. J. Geriatr. Psychiatry, 26 (7) (2011), pp.
CrossRefView in ScopusGoogle Scholar
[69]
G.M. Singh, et al.
心血管疾患および糖尿病に対する代謝危険因子の年齢別定量的効果:プール解析
PLoS One, 8 (7) (2013), Article e65174
CrossRefView in ScopusGoogle Scholar
[70]
M.H. Olsen, et al.
現在および将来の世代における血圧上昇の世界的負担に対処するための行動への呼びかけとライフコース戦略:高血圧に関するランセット委員会
Lancet, 388 (10060) (2016), pp.2665-2712
PDFを見る記事を見るScopusGoogle Scholarで見る
[71]
X. Xie, et al.
心血管および腎アウトカムに対する集中的な血圧降下の効果:最新の系統的レビューおよびメタ解析
Lancet, 387 (10017) (2016), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[72]
D. Ettehad, et al.
心血管疾患と死亡予防のための血圧降下:系統的レビューとメタ分析
Lancet, 387 (10022) (2016), 957-967頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[73]
J.D. Bundy, et al.
収縮期血圧の低下と心血管疾患および死亡のリスク:系統的レビューとネットワークメタ解析
JAMA Cardiol., 2 (7) (2017), 775-781頁
CrossRefScopusで見るGoogle Scholarで見る
[74]
K.T.ミルズ、A.ステファネスク、J.ヘー
高血圧の世界疫学
Nat. Rev. Nephrol., 16 (4) (2020), pp.223-237
CrossRefScopusで見るGoogle Scholarで見る
[75]
B. Zhou, et al.
血圧上昇および高血圧に対する世界的疫学、健康負担および効果的な介入策
Nat. Rev. Cardiol., 18 (11) (2021), pp.
CrossRefView in ScopusGoogle Scholar
[76]
C. シュー、F.Z.マルケス
腸内細菌叢を介して作用する食物繊維がどのように血圧を下げるか
Curr. Hypertens. Rep.
Google Scholar
[77]
P. Du, et al.
穀物からの食物繊維摂取と中年後期女性における高血圧リスク:SWAN研究の結果
Front. Nutr. (2021), p. 8
Google Scholar
[78]
G.S. Aljuraiban, et al.
総食物繊維、不溶性および水溶性食物繊維の摂取量と血圧との関係:INTERMAP研究
Br. J. Nutr., 114 (9) (2015), pp.
スコープで見るGoogle Scholar
[79]
F.Z. Marques, et al.
高繊維食と酢酸補給は腸内細菌叢を変化させ、高血圧マウスにおける高血圧と心不全の発症を予防する
Circulation, 135 (10) (2017), pp.
スコープで見るGoogle Scholar
[80]
D.M. Kaye, et al.
プレバイオティック食物繊維の欠乏と腸内代謝感知受容体を介した不十分なシグナル伝達が心血管疾患につながる
Circulation, 141 (17) (2020), pp.1393-1403
CrossRefScopusで表示Google Scholar
[81]
M.T. Streppel, et al.
食物繊維と血圧:無作為化プラセボ対照試験のメタアナリシス
Arch. Arch. Intern. Med., 165 (2) (2005), pp.
CrossRefScopusで表示Google Scholar
[82]
S.P. Whelton, et al.
食物繊維の摂取が血圧に及ぼす影響:ランダム化比較臨床試験のメタアナリシス
J. Hypertens., 23 (3) (2005), pp.
CrossRefView in ScopusGoogle Scholar
[83]
A.N. Reynolds, et al.
高血圧および心血管疾患管理における食物繊維:系統的レビューとメタ分析
BMC Med., 20 (1) (2022), p. 139
CrossRefScopus で表示Google Scholar
[84]
C.E. Evans, et al.
食物繊維の種類が血圧に及ぼす影響:健常人を対象としたランダム化比較試験のシステマティックレビューとメタアナリシス
J. Hypertens., 33 (5) (2015), pp.
スコープで見るGoogle Scholar
[85]
K. Khan, et al.
粘性水溶性食物繊維の血圧に対する効果:ランダム化比較試験のシステマティックレビューとメタアナリシス
Nutr. Metab. Cardiovasc Dis., 28 (1) (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[86]
L. Hartley, et al.
心血管疾患の一次予防のための食物繊維
Cochrane Database Syst. Rev., 2016 (1) (2016), p. Cd011472
Google Scholar
[87]
B.J.H. Dierick, et al.
喘息、アレルギー性鼻炎、アトピー性皮膚炎と食物アレルギーの負担と社会経済学
Expert Rev. Pharm. Outcomes Res., 20 (5) (2020), pp.437-453
CrossRefScopusで見るGoogle Scholarで見る
[88]
G.デヴリュー、A.シートン
アトピーと喘息の危険因子としての食事
J. Allergy Clin. 免疫学, 115 (6) (2005), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[89]
H. Lee, et al.
韓国成人における食物繊維摂取とアレルギー疾患および関連疾患の関連性
Int J. Environ. Res Public Health, 18 (6) (2021)
Google Scholar
[90]
R.M. Andrianasolo, et al.
食物繊維の摂取量と喘息(症状とコントロール)との関連:フランス全国eコホートNutriNet-Santéからの結果
Br. J. Nutr., 122 (9) (2019), pp.
CrossRefView in ScopusGoogleスカラー
[91]
M.M. Root, et al.
健康的な食事指数2005と選択された多量栄養素は、ヒトにおける肺機能の改善と相関している
Nutr. Res., 34 (4) (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[92]
R. McLoughlin, et al.
成人の喘息患者における水溶性食物繊維の補給とプロバイオティクスの併用: 7日間の無作為化二重盲検三方向クロスオーバー試験
eBioMedicine, 46 (2019), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[93]
A.N. Thorburn, et al.
喘息は母親の食事と細菌代謝産物の影響を受ける発達由来の疾患であるという証拠
Nat. Commun., 6 (2015), p. 7320
ScopusGoogle Scholarで見る
[94]
A. Trompette, et al.
食物繊維の腸内細菌叢代謝はアレルギー性気道疾患と造血に影響する
Nat. Med, 20 (2) (2014), pp.159-166
CrossRefView in ScopusGoogle Scholar
[95]
J. Tan, et al.
食物繊維と細菌SCFAは、多様な細胞経路を通じて経口耐性を増強し、食物アレルギーから保護する
Cell Rep., 15 (12) (2016), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[96]
A. Trompette, et al.
腸由来の短鎖脂肪酸は、ケラチノサイトの代謝と分化を促進することにより、皮膚バリアの完全性を調節する
粘膜免疫学 (2022)
Google Scholar
[97]
M.J. Alam, et al.
アトピー性皮膚炎を治療するための微生物叢の操作:機能と治療法
病原体, 11 (6) (2022)
Google Scholar
[98]
M. Arifuzzaman, et al.
イヌリン繊維は微生物叢由来の胆汁酸と2型炎症を促進する
Nature, 611 (7936) (2022), pp.
CrossRefView in ScopusGoogle Scholar
[99]
T. ビーバー
アトピー性皮膚炎
Ann. Dermatol., 22 (2) (2010), pp.
CrossRefView in ScopusGoogle Scholar
[100]
S. ワイディンガー、N. ノヴァク
アトピー性皮膚炎
Lancet, 387 (10023) (2016), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[101]
S.C.ダルマージ、J.L.ペレ、A.カストヴィッチ
小児および成人における喘息の疫学
Front. Pediatr. (2019), p. 7
Google Scholar
[102]
W. ロー、M.L.K.タン
グローバルな文脈における食物アレルギーの疫学
Int J. Environ. Res Public Health, 15 (9) (2018)
Google Scholar
[103]
M.S.エフライエル、A.ベナー
発展途上国における授乳期間と小児アレルギー疾患リスク
Allergy Asthma Proc., 29 (4) (2008), pp.
CrossRefGoogle Scholar
[104]
C.Y. Chiu, et al.
6ヵ月間の母乳育児は、乳汁感作の減少および幼児期の湿疹リスクと関連する:PATCH出生コホート研究
Med. (Baltim. ), 95 (15) (2016), Article e3391
スコープで見るGoogle Scholar
[105]
J.P.シュラキ
母乳の有益な効果に対するヒト乳オリゴ糖の寄与は、乳児用ミルクの改善を期待させるか?
Crit. Rev. Food Sci. Nutr., 61 (9) (2021), pp.
CrossRefScopusで表示Google Scholar
[106]
L. ボーデ
ヒトミルクオリゴ糖:すべての赤ちゃんにはシュガーママが必要である
糖鎖生物学, 22 (9) (2012), pp.
CrossRefScopusで表示Google Scholar
[107]
S. Zhang, et al.
栄養のゴールドスタンダード:ヒトミルクオリゴ糖のレビューと乳児腸内細菌叢への影響
Microb. Cell Factor., 20 (1) (2021), p. 108
Google Scholar
[108]
R. マクレナン、O.M.イェンセン
スカンジナビアの2つの集団における食物繊維、通過時間、糞便細菌、ステロイド、および大腸がん。国際がん研究機関腸内微小生態学グループからの報告。
Lancet, 2 (8031) (1977), pp.
スコープで見るGoogle Scholar
[109]
E.L. Wynder, et al.
結腸直腸癌の環境因子。II
Jpn. Epidemiol. データがん, 23 (5) (1969), pp.1210-1220
ScopusGoogle Scholarで見る
[110]
World Cancer Research Fund/American Institute for Cancer Research, Diet, nutrition, physical activity and colorectal cancer. 米国がん研究所、2018年
Google Scholar
[111]
H.G. Coleman, et al.
食物繊維と食道の前がん病変およびがんのリスク:系統的レビューとメタ分析
Nutr. Rev., 71 (7) (2013), pp.
CrossRefScopusで表示Google Scholar
[112]
Z. Zhang, et al.
食物繊維の摂取は胃がんのリスクを減少させる: メタアナリシス
Gastroenterology, 145 (1) (2013), pp.
e3
CrossRefScopusで表示Google Scholar
[113]
K.E.ブラッドベリ、P.N.アップルビー、T.J.キー
果物、野菜、食物繊維の摂取量とがんリスクとの関係:欧州がん栄養前向き調査(EPIC)からの知見
Am. J. Clin. Nutr., 100 (suppl_1) (2014), pp.394S-398S
PDFを見る記事を見るCrossRefGoogle Scholar
[114]
S. Chen, et al.
食物繊維の摂取と乳がんリスク:疫学研究のシステマティックレビューとメタアナリシス
オンコターゲット, Vol 7 (No 49) (2016)
グーグル スカラー
[115]
T.-b Huang, et al.
食物繊維の摂取と腎細胞がんのリスク:メタアナリシスからのエビデンス
Med. Oncol., 31 (8) (2014), p. 125
スコープで見るGoogle Scholar
[116]
Y. Kim, Y. Je
食物繊維の摂取と心血管疾患およびすべてのがんによる死亡率:前向きコホート研究のメタアナリシス
Arch. Cardiovasc. Dis., 109 (1) (2016), pp.39-54
PDFを見る記事を見るGoogle Scholar
[117]
D. Aune, et al.
全粒穀物摂取と心血管疾患、がん、全死因および原因別死亡のリスク:前向き研究の系統的レビューおよび用量反応メタ解析
BMJ, 353 (2016), p. i2716
CrossRefView in ScopusGoogle Scholar
[118]
D. Furman, et al.
生涯にわたる疾患の病因における慢性炎症
Nat. Med., 25 (12) (2019), 1822-1832頁
CrossRefView in ScopusGoogleスカラー
[119]
A. クライスト、M.ラウターバッハ、E.ラッツ
西洋の食事と免疫システム:炎症との関係
Immunity, 51 (5) (2019), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[120]
A.N.ソーバーン、L.マシア、C.R.マッケイ
食事、代謝産物、「欧米型」炎症性疾患
Immunity, 40 (6) (2014), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[121]
G.S. Temba, et al.
健康なタンザニア人の都市生活は、食事と代謝の変化によって引き起こされる炎症状態と関連している
Nat. 免疫学, 22 (3) (2021), pp.287-300
CrossRefView in ScopusGoogle Scholar
[122]
A. El Kaoutari, et al.
ヒト腸内細菌叢における糖質活性酵素の存在量と多様性
Nat. Rev. Microbiol (2013), p. 11
Google Scholar
[123]
M.S.デサイ
食物繊維を欠乏させた腸内細菌叢は大腸粘液バリアを劣化させ、病原体感受性を高める
Cell (2016), p. 167
Google Scholar
[124]
G. den Besten, et al.
食事、腸内細菌叢、宿主のエネルギー代謝の相互作用における短鎖脂肪酸の役割
J. 脂質研究, 54 (9) (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[125]
A.H. Stouthamer
微生物細胞物質の合成に必要なATP量に関する理論的研究
Antonie Van. レーウェンフック, 39 (1) (1973), pp.
スコープで見るGoogle Scholar
[126]
クック、セリン
総説:健康と病気における短鎖脂肪酸
Aliment. Pharmacol. Ther., 12 (6) (1998), pp.
スコープで見るGoogle Scholar
[127]
J.H. Cummings, et al.
ヒト大腸、門脈、肝および静脈血中の短鎖脂肪酸
Gut, 28 (10) (1987), p. 1221
CrossRefView in ScopusGoogle Scholar
[128]
J.M. Wong, et al.
大腸の健康:発酵と短鎖脂肪酸
J. Clin. Gastroenterol., 40 (3) (2006), pp.
CrossRefView in ScopusGoogle Scholar
[129]
C. De Filippo, et al.
ヨーロッパとアフリカ農村部の小児における比較研究から明らかになった腸内細菌叢の形成における食事の影響
Proc. Natl. Acad. Sci., 107 (33) (2010), p. 14691
CrossRefView in ScopusGoogle Scholar
[130]
P.J. Turnbaugh, et al.
エネルギー収穫能力が増大した肥満関連腸内細菌叢
ネイチャー, 444 (7122) (2006), pp.
CrossRefView in ScopusGoogle Scholar
[131]
E. Ley Ruth, et al.
肥満は腸内微生物の生態系を変化させる
Proc. Natl. Acad. Sci., 102 (31) (2005), pp.
Google Scholar
[132]
W.E.ラフ、T.M.グライリング、M.A.クリーゲル
免疫介在性疾患における宿主-微生物叢相互作用
Nat. Rev. Microbiol., 18 (9) (2020), pp.
CrossRefView in ScopusGoogle Scholar
[133]
F.Z.マルケス、C.R.マッケイ、D.M.ケイ
腸の感情を超えて:腸内細菌叢はどのように血圧を制御するか
Nat. Rev. Cardiol., 15 (1) (2018), pp.
CrossRefScopusで表示Google Scholar
[134]
R. Muralitharan Rikeish, et al.
微生物による同調圧力
高血圧, 76 (6) (2020), pp.
Google Scholar
[135]
W.H.W.タン、T.キタイ、S.L.ヘイゼン
心血管系の健康と疾患における腸内細菌叢
Circ. Res., 120 (7) (2017), 1183-1196頁
スコープで見るGoogle Scholar
[136]
Y. ファン、O. ペダーセン
ヒトの代謝の健康と疾患における腸内細菌叢
Nat. Rev. Microbiol., 19 (1) (2021), pp.
CrossRefScopusで表示Google Scholar
[137]
L.H.モライス、H.L.シュライバー、S.K.マズマニアン
行動と脳疾患における腸内細菌叢-脳軸
Nat. Rev. Microbiol., 19 (4) (2021), pp.
CrossRefScopusで表示Google Scholar
[138]
C.-B. Zhou, Y.-L. Zhou, J.-Y. 方
がん免疫応答と免疫療法における腸内細菌叢
Trends Cancer, 7 (7) (2021), 647-660頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[139]
N. Kamada, et al.
免疫と炎症性疾患における腸内細菌叢の役割
Nat. Rev. Immunol., 13 (2013), p. 321
CrossRefScopusで見るGoogle Scholarで見る
[140]
S.A.スミッツ
タンザニアのハザ狩猟採集民の腸内細菌叢における季節循環
Science (2017), p. 357
Google Scholar
[141]
E.D. Sonnenburg, et al.
食事が誘発する腸内細菌叢の世代を超えた複合的な絶滅
ネイチャー, 529 (7585) (2016), 212-215頁
CrossRefView in ScopusGoogle Scholar
[142]
S. Friedman Elliot, et al.
嫌気性腸内腔の起源における微生物対化学
Proc. Natl. Acad. Sci., 115 (16) (2018), pp.
グーグル スカラー
[143]
Z. Wang, et al.
成人期における主要臓器・組織の特異的代謝率:安静時エネルギー消費のメカニズムモデルによる評価
Am. J. Clin. Nutr., 92 (6) (2010), pp.
PDFを見る記事を見るCrossRefScopusで見るGoogle Scholar
[144]
N.M.コロパトキン、E.A.キャメロン、E.C.マーテンス
糖鎖代謝はどのようにヒト腸内細菌叢を形成するか
Nat. Rev. Microbiol., 10 (5) (2012), pp.323-335
CrossRefScopusで見るGoogle Scholarで見る
[145]
J.Y.リー、R.M.ツォリス、A.J.バウムラー
マイクロバイオームと腸内恒常性
サイエンス, 377 (6601) (2022), p. eabp9960
スコープで見るGoogle Scholar
[146]
M.X.ビンドロス、A.J.バウムラー
非伝染性疾患の生殖器理論
Nat. Rev. Microbiol., 16 (2) (2018), 103-110頁
CrossRefView in ScopusGoogle Scholar
[147]
E.D.ソネンバーグ、J.L.ソネンバーグ
微生物の自己を飢えさせる:微生物がアクセス可能な炭水化物が欠乏した食事の有害な結果
Cell Metab. (2014), p. 20
グーグル・スカラー
[148]
A.A. Salyers, et al.
ヒト大腸由来バクテロイデス菌株によるムチンと植物多糖類の発酵
Appl. Environ. 微生物学, 33 (2) (1977), pp.
CrossRefView in ScopusGoogle Scholar
[149]
A.A. Salyers, et al.
ヒト大腸の嫌気性細菌によるムチンと植物多糖類の発酵
Appl. Environ. 微生物, 34 (5) (1977), pp.
CrossRefView in ScopusGoogle Scholar
[150]
S.M. Lancaster, et al.
ヒトにおける特定の繊維による分子および微生物プロファイルの全体的、特徴的、および個人的変化
Cell Host Microbe, 30 (6) (2022), pp.
e7
スコープで見るGoogle Scholar
[151]
E.C. Deehan, et al.
個別の食物繊維構造による精密なマイクロバイオーム調節が短鎖脂肪酸産生を誘導する
Cell Host Microbe, 27 (3) (2020), pp.
e6
スコープで見るGoogle Scholar
[152]
P.A.ドブラノフスキー、A.スティンツィー
レジスタントスターチ、マイクロバイオーム、精密調節
腸内細菌, 13 (1) (2021), p. 1926842
スコープで見るGoogle Scholar
[153]
A.W. Walker, et al.
ヒト大腸内細菌叢における優性および食事反応性細菌群
ISME J., 5 (2) (2011), pp.
CrossRefView in ScopusGoogle Scholar
[154]
T. Baxter Nielson, et al.
3種類の発酵性繊維を用いた食事介入に対するヒト腸内細菌叢と短鎖脂肪酸の動態
mBio, 10 (1) (2019), pp.e02566-18
Google Scholar
[155]
A. Venkataraman, et al.
レジスタントスターチの食事補充に対するヒトマイクロバイオームの多様な反応
Microbiome, 4 (1) (2016), p. 33
ScopusGoogle Scholarで見る
[156]
J. Phillips, et al.
レジスタントスターチがヒトの糞便嵩および発酵依存性事象に及ぼす影響
Am. J. Clin. Nutr., 62 (1) (1995), pp.
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
[157]
A.L. McOrist, et al.
糞便中酪酸濃度は個人差が大きいが、レジスタントスターチを多く含む食事により通常上昇する
J. Nutr., 141 (5) (2011), pp.
PDFを見るCrossRefを見るScopusGoogle Scholarを見る
[158]
B. Upadhyaya, et al.
食事性レジスタントスターチ4型がヒト腸内細菌叢と免疫代謝機能に及ぼす影響
Sci. Rep., 6 (1) (2016), p. 28797
ScopusGoogle Scholarで見る
[159]
I. Martínez, et al.
レジスタントスターチ2型と4型は、ヒト被験者の糞便微生物叢の組成に異なる影響を及ぼす
PLoS One, 5 (11) (2010), Article e15046
CrossRefScopusで表示Google Scholar
[160]
T.V. Maier, et al.
食事性レジスタントスターチがヒト腸内細菌叢、メタプロテオーム、およびメタボロームに及ぼす影響
MBio, 8 (5) (2017), pp.e01343-17
Google Scholar
[161]
E.D.ソネンバーグ
腸内バクテロイデス種における多糖利用の特異性が食事誘発性微生物叢の変化を決定する
Cell (2010), p. 141
Google Scholar
[162]
D. Meyer, M. Stasse-Wolthuis
イヌリンとオリゴフラクトースのビフィズス形成作用と腸の健康への影響
Eur. J. Clin. Nutr., 63 (11) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[163]
D.F. Evans, et al.
健常歩行者における消化管pHプロファイルの測定
Gut, 29 (8) (1988), pp.
CrossRefView in ScopusGoogle Scholar
[164]
J.M. Maurer, et al.
intellicapシステムを用いた健康なボランティアにおける消化管pHおよび通過時間プロファイリングにより、コロパルス錠剤の回腸-結腸放出が確認された。
PLoS One, 10 (7) (2015), Article e0129076
CrossRefView in ScopusGoogle Scholar
[165]
J. フォーリングボルグ
ヒト消化管の管内pH
Dan. Med Bull., 46 (3) (1999), pp.
スコープで見るGoogle Scholar
[166]
S.G. Nugent, et al.
炎症性腸疾患における腸管内腔pH:決定因子の可能性とアミノサリチル酸塩および他の薬剤による治療への影響
Gut, 48 (4) (2001), pp.
スコープで見るGoogle Scholar
[167]
Z.E. Ilhan, et al.
糞便濃縮培養におけるpHを介した微生物と代謝の相互作用
mSphere, 2 (3) (2017), pp.
Google Scholar
[168]
W.S.F. Chung, et al.
食物繊維によるヒト腸内細菌叢の調節は種レベルで起こる
BMC Biol., 14 (1) (2016), p. 3
ScopusGoogle Scholarで見る
[169]
W. Walker Alan, et al.
pHとペプチドの供給は、ヒト大腸の微生物群集内の細菌集団と短鎖脂肪酸比率を根本的に変えることができる
Appl. 微生物学, 71 (7) (2005), 3692-3700頁
Google Scholar
[170]
G.ラバ、S.アダムバーグ、K.アダムバーグ
酸性pHは糞便微生物叢によるペクチンからの酪酸産生を促進する
FEMS Microbiol. Lett., 368 (7) (2021)
fnab042
Google Scholar
[171]
S.H. Duncan, et al.
ヒト大腸内細菌叢の種構成を決定するpHの役割
Environ. Microbiol, 11 (8) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[172]
M.J.ウォリン
揮発性脂肪酸とルーメン液による大腸菌増殖の抑制
Appl. Microbiol., 17 (1) (1969), pp.
スコープで見るGoogle Scholar
[173]
M. Haque, et al.
医療関連感染 - 概要
Infect. Drug Resist, 11 (2018), pp.2321-2333
CrossRefScopusで表示Google Scholar
[174]
P. Gupta, et al.
アルカリ性大腸内圧はクロストリジウム・ディフィシル感染の素因となるか?
South Med J., 109 (2) (2016), pp.
CrossRefView in ScopusGoogle Scholar
[175]
V. Iyer、J. Raut、A. Dasgupta
in vitroにおける表皮ブドウ球菌および黄色ブドウ球菌の増殖に及ぼすpHの影響
J. Med. Microbiol., 70 (9) (2021)
Google Scholar
[176]
J.M. Boyce, et al.
下痢とメチシリン耐性黄色ブドウ球菌の消化管コロニー形成に関連した広範な環境汚染
Infect. Control Hosp. Epidemiol., 28 (10) (2007), pp.1142-1147
CrossRefView in ScopusGoogle Scholar
[177]
M.E.V.ヨハンソン、G.C.ハンソン
腸管粘液とムチンの免疫学的側面
Nat. Rev. Immunol., 16 (10) (2016), pp.
CrossRefScopusで表示Google Scholar
[178]
M.E.V.ヨハンソン、H.シェーヴァル、G.C.ハンソン
健康と病気における消化管粘液システム
Nat. Rev. Gastroenterol. Hepatol., 10 (6) (2013), pp.352-361
CrossRefScopusで表示Google Scholar
[179]
B.O. Schroeder, et al.
ビフィズス菌または食物繊維は、食事誘発性微生物叢が介在する大腸粘液の劣化を予防する
細胞宿主微生物, 23 (1) (2018), pp.
e7
スコープで見るGoogle Scholar
[180]
E.M.ポールソン-マクダーモット、L.A.J.オニール
リポ多糖受容体Toll様受容体-4によるシグナル伝達
免疫学, 113 (2) (2004), 153-162ページ
スコープで見るGoogle Scholar
[181]
F. Violi, et al.
腸由来の低悪性度内毒素血症、アテローム血栓症と心血管疾患
Nat. Rev. Cardiol. (2022)
Google Scholar
[182]
X. Byndloss Mariana, et al.
微生物叢が活性化したPPAR-γシグナルが腸内細菌異常症の拡大を抑制する
サイエンス, 357 (6351) (2017), pp.
Google Scholar
[183]
M.W. Adelman, et al.
敗血症の発症、維持、転帰における腸内マイクロバイオームの役割
Crit. Care, 24 (1) (2020), p. 278
スコープで見るGoogle Scholar
[184]
S. 福田、他。
ビフィズス菌は酢酸産生により腸管病原体感染から身を守ることができる
Nature, 469 (7331) (2011), pp.
CrossRefGoogle Scholar
[185]
W.E.ローディガー
ラット結腸の分離上皮細胞による栄養素の利用
消化器病学, 83 (2) (1982), 424-429頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[186]
E. Gaudier, et al.
酪酸はグルコースを除去した腸管上皮杯細胞におけるMUC遺伝子発現を特異的に調節する
Am. J. Physiol. 肝臓生理学, 287 (6) (2004), pp.
スコープで見るGoogle Scholar
[187]
Caleb J. Kelly, et al.
微生物叢由来の短鎖脂肪酸と腸管上皮HIFのクロストークは組織バリア機能を増強する
Cell Host Microbe, 17 (5) (2015), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[188]
N. Singh, et al.
ナイアシンと常在性代謝産物酪酸の受容体Gpr109aの活性化は、大腸の炎症と発がんを抑制する
免疫, 40 (1) (2014), pp.
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
[189]
M.H. Zaki, et al.
NLRP3インフラマソームは実験的大腸炎における上皮の完全性の喪失と死亡率から保護する
免疫, 32 (3) (2010), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[190]
W. Feng, et al.
酪酸ナトリウムは離乳子豚の下痢を抑制し、GPR109A依存的に大腸のタイトジャンクションタンパク質の発現を促進する。
Cell. Physiol. Biochem., 47 (4) (2018), pp.
CrossRefView in ScopusGoogle Scholar
[191]
L. Sonnenburg Justin, et al.
腸に適応した細菌共生生物による生体内での糖鎖採食
サイエンス, 307 (5717) (2005), pp.
Google Scholar
[192]
M.H. Kim, et al.
短鎖脂肪酸は腸管上皮細胞のGPR41およびGPR43を活性化し、マウスの炎症反応を促進する
Gastroenterology, 145 (2) (2013), pp.
Google Scholar
[193]
C. Iraporda, et al.
微生物発酵によって産生される乳酸と短鎖脂肪酸は、腸管上皮細胞と骨髄系細胞における炎症反応を抑制する
免疫生物学, 220 (10) (2015), 1161-1169頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[194]
M. Asarat, et al.
短鎖脂肪酸はin vitroヒト腸管上皮細胞株からのIL-8の分泌を制御する
Immunol. Investig., 44 (7) (2015), 678-693ページ
CrossRefView in ScopusGoogle Scholar
[195]
M.A.R. Vinolo, et al.
好中球による炎症性メディエーターの産生に対する短鎖脂肪酸の抑制効果
J. Nutr. Biochem., 22 (9) (2011), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[196]
L. Liu, et al.
酪酸はヒト単球由来樹状細胞の分化と機能を阻害する
細胞免疫学, 277 (1-2) (2012), pp.
PDFを見る記事を見るGoogle Scholar
[197]
M.C. Maa, et al.
酪酸は、Src増強およびフォーカルアドヒージョンキナーゼ活性の抑制により、リポ多糖を介したマクロファージ遊走を減少させた
J. Nutr. Biochem, 21 (12) (2010), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[198]
P.V. Chang, et al.
微生物代謝産物である酪酸は、ヒストン脱アセチル化酵素阻害を介して腸管マクロファージ機能を制御する
Proc. Natl. Acad. Sci. USA, 111 (6) (2014), 2247-2252頁
CrossRefView in ScopusGoogle Scholar
[199]
H.G. Rodrigues, et al.
好中球の動員、機能および生存の調節因子としての脂肪酸
Eur. J. Pharmacol., 785 (2016), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[200]
A.L. Millard, et al.
酪酸塩はヒト単球由来樹状細胞およびマクロファージの分化、成熟および機能に影響を及ぼす
Clin. Exp. Immunol., 130 (2) (2002), pp.
スコープで見るGoogle Scholar
[201]
C. Nastasi, et al.
酪酸およびプロピオン酸は、抗原提示細胞によるIL-12産生を抑制することにより、抗原特異的CD8+ T細胞の活性化を阻害する。
Sci. Rep., 7 (1) (2017), p. 14516
スコープで見るGoogle Scholar
[202]
J. Schulthess, et al.
短鎖脂肪酸酪酸はマクロファージに抗菌プログラムを刷り込む
Immunity (2019)
グーグル スカラー
[203]
K.C. Lam, et al.
微生物叢がSTING-type I IFN依存的に腫瘍微小環境の単球リプログラミングを引き起こす
細胞 (2021)
Google Scholar
[204]
J.A.ブルーストーン、A.K.アッバス
自然制御性T細胞と適応制御性T細胞
Nat. Rev. Immunol., 3 (3) (2003), pp.
CrossRefScopusで見るGoogle Scholarで見る
[205]
S. 堀, 野村智昭, 坂口眞一郎
転写因子Foxp3による制御性T細胞発生の制御
サイエンス (2003), p. 299
Google Scholar
[206]
J.D.フォンテノ、M.A.ギャビン、A.Y.ルーデンスキー
Foxp3はCD4+CD25+制御性T細胞の発生と機能をプログラムする
Nat. Immunol.
Google Scholar
[207]
Y. 古澤、他。
腸内細菌由来の酪酸は大腸制御性T細胞の分化を誘導する
ネイチャー, 504 (7480) (2013), pp.
CrossRefView in ScopusGoogle Scholar
[208]
N. Arpaia, et al.
常在細菌が産生する代謝産物は末梢制御性T細胞の生成を促進する
ネイチャー, 504 (7480) (2013), 451-455頁
CrossRefScopusで表示Google Scholar
[209]
M. Smith Patrick, et al.
微生物の代謝産物である短鎖脂肪酸が大腸トレグ細胞の恒常性を制御する
サイエンス, 341 (6145) (2013), pp.
Google Scholar
[210]
R. Tao, et al.
脱アセチル化酵素阻害は制御性T細胞の生成と機能を促進する
Nat. Med., 13 (11) (2007), pp.
CrossRefView in ScopusGoogle Scholar
[211]
J. Park, et al.
短鎖脂肪酸は、ヒストン脱アセチル化酵素の抑制とmTOR-S6K経路の制御により、エフェクターT細胞と制御性T細胞の両方を誘導する
粘膜免疫学, 8 (1) (2015), pp.
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
[212]
M. Sun, et al.
微生物叢由来の短鎖脂肪酸はTh1細胞のIL-10産生を促進し、腸の恒常性を維持する
Nat. Commun., 9 (1) (2018), p. 3555
スコープで見るGoogle Scholar
[213]
M. Luu, et al.
腸内細菌叢由来代謝産物酪酸によるCD8+ T細胞のエフェクター機能の制御
Sci. Rep., 8 (1) (2018), p. 14430
スコープで見るGoogle Scholar
[214]
A. Bachem, et al.
微生物叢由来の短鎖脂肪酸は抗原活性化CD8+ T細胞の記憶能を促進する
Immunity (2019)
グーグル スカラー
[215]
Maria L. Balmer, et al.
メモリーCD8+ T細胞は、最適な機能のためにストレスによって誘導される酢酸濃度の増加を必要とする
Immunity, 44 (6) (2016), pp.1312-1324
PDFで記事を見るScopusで記事を見るGoogle Scholar
[216]
Y. He, et al.
腸内微生物の代謝産物は、細胞傷害性CD8(+)T細胞免疫の調節により抗がん治療の効果を促進する
細胞代謝, 33 (5) (2021), pp.
e7
スコープで見るGoogle Scholar
[217]
M. Luu, et al.
微生物性短鎖脂肪酸はCD8+ T細胞応答を調節し、癌の養子免疫療法を改善する
Nat. Commun., 12 (1) (2021), p. 4077
スコープで見るGoogle Scholar
[218]
P. キッド
Th1/Th2バランス:仮説、その限界、健康と病気への影響
交互。Med. Rev., 8 (3) (2003), pp.
スコープで見るGoogle Scholar
[219]
R.L. Coffman, et al.
B細胞刺激因子-1はリポ多糖活性化B細胞のIgE応答を増強する
J. 免疫学, 136 (12) (1986), 4538-4541頁
CrossRefView in ScopusGoogle Scholar
[220]
M. Kim, et al.
腸内微生物の代謝産物が宿主の抗体応答を促進する
Cell Host Microbe, 20 (2) (2016), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[221]
W. Wu, et al.
微生物叢の代謝産物である短鎖脂肪酸アセテートは、GPR43を介する微生物叢に対する腸管IgA応答を促進する。
粘膜免疫学, 10 (4) (2017), 946-956頁
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
[222]
M.H. Shamji, et al.
アレルギー疾患におけるアレルゲン特異的IgE、IgGおよびIgAの役割
アレルギー, 76 (12) (2021), 3627-3641頁
CrossRefView in ScopusGoogle Scholar
[223]
C.I. Daien, et al.
腸由来の酢酸は抗炎症作用を持つB10細胞を促進する
JCIインサイト, 6 (7) (2021)
Google Scholar
[224]
F. Zou, et al.
HDAC阻害およびp38 MAPK活性化における短鎖脂肪酸の効果は、B10細胞の生成および機能促進に重要である。
Cell Death Dis., 12 (6) (2021), p. 582
スコープで見るGoogle Scholar
[225]
E. Marino, et al.
腸内微生物の代謝産物が自己免疫T細胞の頻度を制限し、1型糖尿病を予防する
Nat. Immunol., 18 (5) (2017), pp.
CrossRefView in ScopusGoogle Scholar
[226]
M. ラビノビッチ、M.J.デステファノ、M.A.ジエザノフスキー
アガロース下での好中球遊走:培地pHと浸透圧の低下による刺激
J. Reticuloendothel. Soc., 27 (2) (1980), pp.
Google Scholar
[227]
O.D. Rotstein, et al.
in vitroにおける好中球遊走に対するpH低下と低酸素の悪影響
J. Surg. Res, 45 (3) (1988), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[228]
T.G.ガビッグ、S.I.ベアマン、B.M.バビオール
ヒト好中球の呼吸バーストにおける酸素張力とphの影響
Blood, 53 (6) (1979), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[229]
L. シムチョビッツ
細胞内pHはヒト好中球によるスーパーオキシドラジカルの生成を調節する
J. Clin. Investig., 76 (3) (1985), pp.
CrossRefView in ScopusGoogle Scholar
[230]
A. Ahlin, et al.
好中球膜電位変化とホモ型凝集動態はpH依存性である:慢性肉芽腫性疾患の研究
J. Lab Clin. Med, 125 (3) (1995), pp.
スコープで見るGoogle Scholar
[231]
B. Leblebicioglu, et al.
炎症を起こした歯肉溝で観察されるpH変化は、in vitroでヒト多形核白血球の活性化を調節する。
J. Periodo, 67 (5) (1996), pp.
CrossRefをScopusで表示Google Scholar
[232]
O.D.ロットスタイン、P.E.ナスミス、S.グリンスタイン
バクテロイデス副産物のコハク酸は細胞内pHを低下させることにより好中球の呼吸バーストを阻害する
Infect. Immun., 55 (4) (1987), pp.
CrossRefView in ScopusGoogle Scholar
[233]
J. Grabowski, et al.
腫瘍壊死因子の発現は酸性環境にさらされると改善される
J. Surg. Res., 173 (1) (2012), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[234]
J.A.ケラム、M.ソング、J.リー
乳酸と塩酸は、LPS刺激RAW 264.7細胞において異なるパターンの炎症反応を誘導する。
Am. J. Physiol. Regul. Integr. Comp. Physiol., 286 (4) (2004), pp.
スコープで見るGoogle Scholar
[235]
E.J. Hanly, et al.
腹腔鏡手術における腹膜アシドーシスの免疫保護作用
外科, 142 (3) (2007), pp.357-364
PDFを見る記事を見るScopusで見るGoogle Scholar
[236]
A. Bidani, et al.
肺胞マクロファージによる腫瘍壊死因子α放出のpH感受性の証拠
肺, 176 (2) (1998), pp.
スコープで見るGoogle Scholar
[237]
K. Dietl, et al.
乳酸と酸性化はヒト単球のTNF分泌と解糖を阻害する
J. Immunol., 184 (3) (2010), p. 1200
CrossRefView in ScopusGoogle Scholar
[238]
S.F. Fernandez, et al.
低pH環境ストレスは、ラット肺胞マクロファージにおけるLPSおよびLTA刺激による炎症性サイトカイン産生を抑制する
BioMed Res. Int., 2013 (2013), Article 742184
スコープで見るGoogle Scholar
[239]
H. チー
T細胞の運命決定におけるmTORシグナルの制御と機能
Nat. Rev. Immunol., 12 (5) (2012), pp.
CrossRefScopusで見るGoogle Scholarで見る
[240]
K.N.ポリッツィ、J.D.パウエル
mTORによるT細胞の制御:既知のものと未知のもの
Trends Immunol., 36 (1) (2015), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[241]
Z.E. Walton, et al.
酸はmTORの阻害を通じて低酸素状態で概日時計を停止させる
Cell, 174 (1) (2018), 72-87ページ
e32
ScopusGoogle Scholarで見る
[242]
M. Bosticardo, et al.
低い細胞外pHによるヒトTリンパ球の偏った活性化は、B7/CD28コスティミュレーションによって拮抗される
Eur. J. Immunol., 31 (9) (2001), 2829-2838頁
スコープで見るGoogle Scholar
[243]
K. Fischer, et al.
腫瘍細胞由来乳酸のヒトT細胞に対する抑制効果
Blood, 109 (9) (2007), pp.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[244]
A. Brand, et al.
LDHA関連乳酸産生はT細胞およびNK細胞による腫瘍免疫サーベイランスを鈍らせる
Cell Metab., 24 (5) (2016), 657-671頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[245]
Y. 中川、他。
抗原特異的細胞傷害性Tリンパ球の機能と発達に及ぼす細胞外pHと低酸素の影響
Immunol. Lett., 167 (2) (2015), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[246]
J.K. Tan, et al.
メタボライトを感知するGタンパク質共役型受容体-食事に関連した免疫制御の促進因子
Annu Rev. Immunol., 35 (2017), 371-402 ページ
CrossRefScopusで表示Google Scholar
[247]
E.J. Sanderlin, et al.
酸性ストレス応答におけるpH感知Gタンパク質共役型受容体の新たな役割
細胞健康 細胞骨格, 7 (2015), pp.
スコープで見るGoogle Scholar
[248]
M.G. Ludwig, et al.
プロトンを感知するGタンパク質共役型受容体
ネイチャー, 425 (6953) (2003), 93-98頁
ScopusGoogle Scholarで見る
[249]
F. 岡島
細胞外酸性化とプロトン感受性GPCRによる炎症の制御
セルシグナル, 25 (11) (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[250]
T.S.P. Heng, et al.
免疫ゲノムプロジェクト:免疫細胞における遺伝子発現ネットワーク
Nat. 免疫学, 9 (10) (2008), pp.
CrossRefView in ScopusGoogle Scholar
[251]
M. Uhlen, et al.
プロテオミクス。ヒトプロテオームの組織ベースマップ
Science, 347 (6220) (2015), p. 1260419
ScopusGoogle Scholarで見る
[252]
J. Thul Peter, et al.
ヒトプロテオームの細胞内マップ
Science, 356 (6340) (2017), p. eaal3321
Google Scholar
[253]
A. Franke, et al.
ゲノムワイドなメタアナリシスにより、確認されたクローン病感受性遺伝子座の数が71に増加
Nat. Genet, 42 (12) (2010), 1118-1125頁
CrossRefViewをScopusで見るGoogle Scholar
[254]
X. Ke
一般的な複合型ヒト疾患のリスク遺伝子座における複数の独立した効果の存在
Am. J. Hum. Genet, 91 (1) (2012), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[255]
V. Ballester, et al.
プエルトリコにおけるNOD2およびIL23Rと炎症性腸疾患の関連性
PLoS One, 9 (9) (2014), Article e108204
CrossRefView in ScopusGoogle Scholar
[256]
J.Z. Liu, et al.
炎症性腸疾患の38の感受性遺伝子座を同定し、集団間で共有される遺伝的リスクを浮き彫りにする関連解析
Nat. Genet., 47 (9) (2015), pp.
CrossRefView in ScopusGoogle Scholar
[257]
L. Xie, et al.
pHとプロトンセンサーGPR65はアトピー性皮膚炎の感受性を決定する
J. 免疫学 (2021), p. ji2001363
Google Scholar
[258]
K.G. Lassen, et al.
GPR65の遺伝子コード変異はリソソームpHを変化させ、リソソーム機能障害と大腸炎リスクを関連付ける
免疫, 44 (6) (2016), 1392-1405頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[259]
I. Tcymbarevich, et al.
マクロファージにおけるpH感知受容体TDAG8 [GPR65]の欠如は、炎症性腸疾患のマウスモデルにおいて有害な役割を果たす
J. クローンズ大腸炎(2018)
グーグル スカラー
[260]
X. Chen, et al.
pHセンシングは免疫細胞の細胞代謝とリソソーム内機能を調節することで組織の炎症を制御する
Nat. Immunol.
Google Scholar
[261]
R. ロバート、C.R.マッケイ
ガルファス共役型GPCR GPR65とGPR174。免疫反応のダウナー
Immunol. Cell Biol., 96 (4) (2018), 341-343ページ
CrossRefView in ScopusGoogleスカラー
[262]
C. C.茂木、他。
腹膜マクロファージにおける細胞外酸性化による炎症性サイトカイン産生抑制におけるプロトンセンサーTDAG8の関与
J. 免疫学, 182 (5) (2009), 3243-3251頁
CrossRefView in ScopusGoogle Scholar
[263]
X.D. He, et al.
腹膜マクロファージにおけるデキサメタゾンの抗炎症作用におけるプロトン感受性受容体TDAG8の関与
Biochem Biophys. Res Commun., 415 (4) (2011), 627-631頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[264]
Y. 小野澤ほか.
T細胞死関連遺伝子8の活性化はin vitroにおけるT細胞およびマクロファージのサイトカイン産生を制御する
Eur. J. Pharm., 683 (1-3) (2012), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[265]
J.G. Bloemen, et al.
手術時に測定されたヒトにおける腸と肝臓を介した短鎖脂肪酸交換
Clin. Nutr., 28 (6) (2009), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[266]
J.G. Bloemen, et al.
短鎖脂肪酸の交換:肝硬変、機能障害肝はまだそれらをクリアすることができますか?
Clin. Nutr., 29 (3) (2010), pp.
PDFで記事を表示Scopusで記事を表示Google Scholar
[267]
M.A. Puchowicz, et al.
肝臓における酢酸標識のゾーン化:MIDAによる脂肪生成の研究への影響
Am. J. Physiol. Metab., 277 (6) (1999), pp.
スコープで見るGoogle Scholar
[268]
B. フェリス、D.R.ウィット、B.T.ハリス
プロピオン酸血症:神経病理学的症例報告と先行例のレビュー
Arch. Pathol. Lab. Med., 127 (8) (2003), pp.
CrossRefGoogle Scholar
[269]
J.G.マンズ、J.M.ボダ
子羊および成羊における酢酸、プロピオン酸、酪酸およびグルコースによるインスリン放出
Am. J. Physiol. コンテンツ, 212 (4) (1967), pp.
CrossRefView in ScopusGoogle Scholar
[270]
P. Mirmonsef, et al.
短鎖脂肪酸は単独およびtoll様受容体リガンドとの併用で炎症性サイトカイン産生を誘導する
Am. J. Reprod. 免疫学, 67 (5) (2012), pp.
CrossRefScopusで表示Google Scholarで表示
[271]
E.W.ポマーレ、W.J.ブランチ、J.H.カミングス
ヒト大腸における炭水化物発酵と静脈血中酢酸濃度との関係
J. Clin. Investig., 75 (5) (1985), pp.
CrossRefView in ScopusGoogle Scholar
[272]
S.G.ピーターズ、E.W.ポマーレ、C.A.フィッシャー
手術時の大腸ラクツロース注入後の門脈および末梢血短鎖脂肪酸濃度
Gut, 33 (9) (1992), p. 1249
CrossRefView in ScopusGoogle Scholar
[273]
E.R.スウェンソン
低酸素とその酸塩基の影響:山から悪性腫瘍まで
Adv. Exp. Med Biol., 903 (2016), pp.
CrossRefView in ScopusGoogle Scholar
[274]
M.A. Felmlee, et al.
モノカルボン酸トランスポーター(SLC16):機能、制御、健康と疾患における役割
Pharmacol. Rev., 72 (2) (2020), p. 466
CrossRefScopusで見るGoogle Scholarで見る
[275]
D. ハーパー、B.チャンドラー
脾循環
BJA Educ., 16 (2) (2016), 66-71ページ
PDFで記事を見るScopusで記事を見るGoogle Scholar
[276]
N.R.モリス、他。
心不全における運動中の肺-肺循環時間
Eur. J. Appl. Physiol., 106 (4) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[277]
K. スレーシュ、L.A.下田
ラングサーキット (2016)
[278]
食事、栄養と慢性疾患の予防。World Health Organ Tech Rep Ser, 2003. 916: p. i-viii, 1-149, backcover.
Google Scholar
[279]
A.E. Buyken, et al.
炭水化物の質と炎症マーカーとの関連:観察研究と介入研究の系統的レビュー
Am. J. Clin. Nutr., 99 (4) (2014), pp.
PDFを見る記事を見るCrossRefScopusで見るGoogle Scholar
[280]
C. Alexander, et al.
視点:難消化性炭水化物発酵からの短鎖脂肪酸の生理学的重要性
Adv. Nutr., 10 (4) (2019), pp.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[281]
B. ウィルソン、K.ウィーラン
プレバイオティクスであるイヌリン型フルクタンとガラクトオリゴ糖:定義、特異性、機能、胃腸障害への応用
J. Gastroenterol. Hepatol. (2017), p. 32
Google Scholar
[282]
H.D.ホルシャー
食物繊維とプレバイオティクスと消化管微生物叢
腸内細菌, 8 (2) (2017), 172-184頁
CrossRefView in ScopusGoogle Scholar
[283]
D.J.A.ジェンキンス、C.W.C.ケンドール、V.ブクサン
イヌリン、オリゴフルクトースと腸機能
J. Nutr., 129 (7) (1999), pp.
PDFを見る記事を見るCrossRefGoogle Scholar
[284]
D.C. Hernot, et al.
特定のフルクタン、ガラクトオリゴ糖、およびポリデキストロースの影響を受けたin vitro発酵プロファイル、ガス産生速度、および微生物叢の変調
J. Agric. Food Chem., 57 (4) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[285]
A. マッキンタイア、P.R.ギブソン、G.P.ヤング
食物繊維からの酪酸産生とラットモデルにおける大腸癌予防効果
Gut, 34 (3) (1993), p. 386
CrossRefView in ScopusGoogle Scholar
[286]
G.シャーフスマ、J.L.スラビン
ヒトの食事におけるイヌリンフルクタンの意義
Compr. Rev. Food Sci. Food Saf., 14 (1) (2015), pp.
CrossRefScopusで表示Google Scholar
[287]
K. Makki, et al.
食物繊維が宿主の健康と疾患における腸内細菌叢に及ぼす影響
Cell Host Microbe, 23 (6) (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[288]
H.A.グラビツキー、J.L.スラビン
低消化性炭水化物の消化管への影響
Crit. Rev. Food Sci. Nutr., 49 (4) (2009), pp.
CrossRefScopusで表示Google Scholar
[289]
T. Morita, et al.
ラットにおけるアセチル化および非変性高アミローストウモロコシデンプンの比較効果
澱粉-Stärke, 57 (6) (2005), pp.
CrossRefView in ScopusGoogle Scholar
[290]
J.M. Clarke, et al.
ラットにおけるアゾキシメタン誘発腸がんに対する高アミロースメイズデンプンおよびブチリル化高アミロースメイズデンプンの効果
発がん, 29 (11) (2008), 2190-2194頁
CrossRefScopusで見るGoogle Scholarで見る
[291]
Y.A. Yap, et al.
酢酸産生食は腸内感染に対する免疫および抗菌プログラムを刷り込む
Clin. Immunol., 10 (1) (2021), Article e1233
スコープで見るGoogle Scholar
[292]
K.J. Bell, et al.
ヒト1型糖尿病におけるメタボライトベースの栄養補給は微生物叢と免疫調節に関連する
Microbiome, 10 (1) (2022), p. 9
スコープで見るGoogle Scholar
[293]
H.A. Jama, et al.
未治療の本態性高血圧患者において、腸内微生物の代謝産物が24時間収縮期血圧を低下させる
medRxiv (2022)
p. 2022.06.20.22276673
Google Scholar
[294]
H.A. Jama, et al.
未治療の本態性高血圧患者におけるHAMSABによるプレバイオティクス介入を第II相ランダム化試験で評価
Nat. Cardiovasc. Res.
Google Scholar
引用者 (1)
創傷感染における腸の役割とは?
2023年、外科学の進歩
要旨を見る
2023 エルゼビア社発行
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect® は Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
