微生物由来の短鎖脂肪酸:ウイルス感染症におけるその役割と機序
生物医学・薬理学
第160巻 2023年4月 114414号
レビュー
微生物由来の短鎖脂肪酸:ウイルス感染症におけるその役割と機序
著者リンクオーバーレイパネルChongchong Feng a, Chengxun Jin b, Kexin Liu c, Zecheng Yang d
もっと見る
概要
共有
引用元
https://doi.org/10.1016/j.biopha.2023.114414
権利と内容を取得する
クリエイティブ・コモンズ・ライセンスのもと
オープンアクセス
ハイライト
SCFAはバリア機能およびウイルス感染に対する免疫に重要である。
酢酸塩と酪酸塩が肺のウイルス感染を防ぐという証拠が強調されている。
SCFAは、ウイルスのライフサイクル、炎症、免疫など、いくつかのメカニズムを通じて、ウイルス感染を妨害することができる。
SCFAはマクロファージの機能を再構築し、好中球による組織への害を軽減する。
SCFAは、ウイルス感染症の新たな治療ターゲットとなる可能性がある。
概要
微生物由来の短鎖脂肪酸(SCFA)は、腸管バリアの保護や感染症時の免疫反応の制御に重要な役割を担っている。最近の研究により、ウイルス感染によって局所の微生物叢とSCFA合成が変化することが明らかになり、個人のSCFAレベルの低さとウイルス感染症の罹患リスク上昇を関連付ける証拠が増えてきている。ウイルスの種類に応じて、SCFAは抗ウイルスまたはプロウイルス活性を有する可能性がある。例えば、酪酸は、マウスがインフルエンザに感染したときに起こる、気道への好中球の浸潤による組織傷害を防ぐ。骨髄由来の遊離脂肪酸受容体3(FFAR3)は酪酸によって誘導され、単球を炎症性マクロファージではなく代替活性化マクロファージ(AAM)に変換し、肺における好中球の動員を減少させることにつながる。SCFA酪酸塩を投与すると、CD8 + T細胞の代謝と機能活性が向上し、インフルエンザウイルスに対する応答性が高まった。さらに、SCFAは、ウイルス性疾患に対するインターフェロン(IFN)応答を制御する可能性がある。微生物叢由来の酢酸は、Gタンパク質共役型受容体43(GPR43)依存的にIFN-βをブーストすることにより、呼吸器合胞体ウイルス(RSV)を抑制する可能性がある。SCFAを産生するLachnospiraceaeまたは外来酢酸をマウスに注射すると、RSV肺ウイルス量が減少し、肺の炎症細胞のリクルートを防ぎ、動物の生存率が上昇する。酪酸塩とプロピオン酸塩の両方が同等の安全策を提供することが示されている。酢酸塩の投与に反応して NF-kappa B (NF-kB) p65 が核内に転移して増加したことから、GPR43 相互作用と IFN-β 産生の関連に NF-kB 活性が関与していることが科学的に証明されていますが、このメカニズムについてはさらなる調査が必要です。今回は、様々なウイルス感染時のSCFAの機能を批判的に分析し、SCFAの持つ多くの影響と作用機序について考察し、まとめてみたい。
前の記事へ次の記事へ
キーワード
SCFAsGPCRsウイルス感染症免疫調節炎症インターフェロン
はじめに
ヒトの消化管には,古細菌,真菌,細菌,ウイルスなど100兆個以上の微生物が生息しており,宿主の恒常性維持に重要な役割を果たしている[1], [2].これらの微生物は、私たちの消化管に生息しているだけでなく、代謝、内分泌、免疫プロセスなど、数多くの宿主の生理的活動の制御に寄与しています[3]。腸内細菌叢は、ヒトゲノムには存在しない酵素を産生し、外来性および内因性の基質の分解に重要な役割を果たし、多種多様な代謝中間体の生成につながることでヒトの代謝において重要な機能を担っています[4]。微生物が産生する代謝産物は、宿主と微生物叢の間の双方向コミュニケーションにおいて重要な機能を果たしています。ホメオスタシスと健康は、この分子的な相互作用に依存しており、免疫機能の調節と免疫記憶の発達に不可欠である。
微生物の代謝産物が宿主の生理機能に大きな影響を与える可能性があることを示す証拠が次々と出てきています[5]。腸内細菌は、部分的に消化可能な多糖類と非消化可能な多糖類を分解して短鎖脂肪酸(SCFAs)を合成します [6]。SCFAは、栄養、健康、微生物叢の関係において重要な役割を担っており、様々なメカニズムによって多くの疾患から身を守っています。SCFAは、腸内細菌が難消化性の食物繊維を発酵させる際に生成されます[7]。SCFAの含有量は、宿主の食物および腸内の嫌気性細菌の両方によって影響を受けます[7]。最も多く研究されているSCFAは、プロピオン酸、酪酸、酢酸の3つです。免疫系と宿主の病態生理に影響を与えるSCFAの重要性はよく知られています [8], [9]。SCFAの免疫調節作用は、ヒストン脱アセチル化酵素(HDAC)のアンタゴニスト、Gタンパク質共役受容体(GPCR)の増幅器、オートファジーの調節因子としての機能にまで遡ることができる[10]。
体内のSCFAsの量は、ウイルス感染を制御するために利用される可能性がある。例えば、酪酸は、ヒストン脱アセチル化酵素(HDAC)の活性を抑制する能力により、潜在性エプスタインバーウイルス(EBV)およびヒト免疫不全ウイルス1型(HIV-1)の再活性化に関連している [11], [12]. しかし、SCFAは、培養腸生検における重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)の増殖には影響を与えない。同時に、酪酸はインターフェロン(IFN)刺激遺伝子(ISG)の発現を減少させ、その結果、IFN感受性のウイルスのスペクトルによる感染に対して細胞の脆弱性が高くなることが分かっている[13], [14]。SCFAは、ウイルス病原体に対して、ウイルスの種類に応じて、ウイルスの複製を阻害したり促進したりする、相反する作用を有することが示されている。例えば、酪酸は、組織損傷を引き起こす可能性のある気道に侵入する好中球の数を減少させることにより、マウスにおけるインフルエンザウイルス疾患を予防する可能性がある[15]。好中球の移動の減少と、酪酸塩を介した骨でのFFAR3誘導の間に相関があった。このため、肺では単球が分化し、炎症性マクロファージではなく、代替活性化マクロファージ(AAM)になりやすいことがわかった。炎症性マクロファージと比較して、AAMは好中球化学誘引物質C-X-C Motif Chemokine Ligand 1(CXCL1)を低レベルで生成している。酪酸塩処理はまた、CD8 + T細胞のインフルエンザに対する反応を、特にこれらの細胞の代謝率およびエフェクター活性を増加させることによって改善した[15]。根本的な原因は不明であるが、CD8 + Tリンパ球のこれらの機能的変化は、遊離脂肪酸受容体3(FFA3)に大きく依存している。このレビューでは、ウイルス感染を通して起こるSCFAの複数の作用と作用機序を検討し、説明している。
短鎖脂肪酸の生成、受容体、シグナル伝達経路
SCFAは、2~6個の炭素を含む脂肪族尾部の存在によって特徴付けられるカルボン酸の一種である[16]。SCFAは宿主の代謝過程、特に肝臓で自然に生成されることもあるが、合成の主要な部位は大腸であり、無菌マウスで発見されない理由を説明するには、特定の大腸菌の存在が必要である。肝臓は、SCFAを生産する主要な臓器である[16]。食物繊維とレジスタントスターチの発酵から生成される主なSCFAは、酢酸(C2)、プロピオン酸(C3)、および酪酸(C4)である。これらのSCFAは近位側結腸で非常に多く(70〜140mM)生成されるが、遠位側結腸(20〜70mM)や回腸遠位部(20〜40mM)では少なくなっている[17]。大腸でのプロピオン酸、酪酸、酢酸合成のモル比は 60:25:15 であるが、栄養や微生物叢の多様性、発酵の場所、宿主の遺伝子型などの変数によって比率が異なる可能性がある [18], [19].大腸細胞は酪酸の大部分を利用し、酢酸とプロピオン酸は門脈によって肝臓に輸送される。肝細胞はプロピオン酸のさらなる代謝を担うが、酢酸は肝臓に留まるか末梢静脈系に排出される[16]。
SCFAsの大部分は消化管で生成・利用されるが、肝臓にもプロピオン酸と酢酸の一部が取り込まれ、エネルギーを生成するトリカルボン酸サイクルの前駆体としてグルコースを生成するために効果的に消化される [3].非イオン化体で存在するごく一部のSCFAは、非イオン拡散によって上皮バリアを通過することができるが、ほとんどのSCFAはイオン性で存在し、宿主に入るには特殊な輸送体が必要である。したがって、粘膜を介したSCFAのさらなる輸送には、2つの主要な受容体による能動輸送が必要である。これらの受容体はモノカルボン酸トランスポーター1(MCT-1)およびナトリウム結合モノカルボン酸トランスポーター1(SMCT-1)受容体です [3]。MCT-1 と SMCT-1 は共に結腸細胞だけでなく、盲腸や小腸を含む消化管全体に多く発現しています [16]。リンパ球はMCT-1の発現が高く、細胞内へのSCFA取り込みの重要性を示している[20]。さらに、腎臓と甲状腺はそれぞれSMCT-1の発現を有している。SMCT-1との結合は酪酸が最も親和性が高く、次いでプロピオン酸、酢酸の順である(Fig.1)[21]。
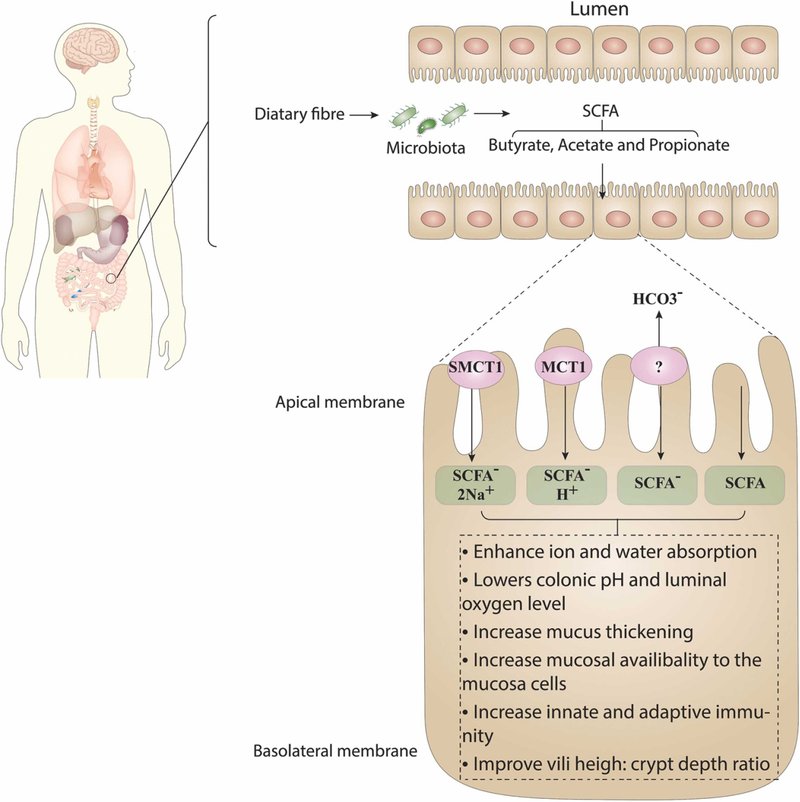
図1
ダウンロード 高解像度画像のダウンロード (320KB)
ダウンロード フルサイズ画像のダウンロード
図1. 短鎖脂肪酸(SCFA)の産生、受容体、機能。図に示すように、SCFAは腸内細菌が難消化性食物繊維を発酵させる際に生成されます。最も重要なSCFAは、酢酸、プロピオン酸、酪酸である。SCFAは、モノカルボン酸トランスポーター1(MCT-1)およびナトリウム結合モノカルボン酸トランスポーター1(SMCT-1)の受容体を介して粘膜を通過し、活発に輸送されます。また、図にあるSCFAの機能として、例えば自然免疫や適応免疫の向上、粘膜細胞への利用率の向上などが挙げられます。
SCFAが生理的反応に影響を及ぼすためには、主に2つのシグナル伝達経路が存在する。まず、プロピオン酸と酪酸は、HDACが遺伝子発現を直接阻害する典型的な例示的分子である[5]。SCFAが効果を発揮する2つ目のメカニズムは、GPCR、特にGPR41、GPR43、GPR109Aを介したシグナル伝達である[22]。GPR43遺伝子は、消化管全体、特に免疫細胞で発現していることが発見されている。免疫系における樹状細胞(DC)、好中球、マクロファージでのGPR43およびGPR109Aの発現は、SCFAが免疫反応において重要な機能を果たすことを示す証拠となります[23]。大腸炎と関節炎の両方のモデルにおいて、GPR43遺伝子には抗炎症作用があることが発見されました[24]。SCFAを用いたGPR41及びGRP109A発現の活性化は、体重に好ましい影響をもたらすことが合理的な疑いを超えて示されている[25]。アミノ酸配列の 43% を共有する GPR43 と GPR41 は、どちらも酢酸、プロピオン酸、酪酸を結合することができます [26]。酪酸は、これらのSCFAの中で、ヒトに特異的に発現しているGPR109A遺伝子の最も強力な活性化物質である。一方、プロピオン酸はGPR41とGPR43の遺伝子に対して高い選択性を示しました[27]。リガンドや関与する細胞の種類によって、特定の受容体がシグナルを発信している可能性がある。このため、研究者らは、特定の受容体またはその受容体に関連するシグナル伝達経路を標的としてSCFAを変化させる薬物を設計することが、疾患の治療に有益であることを示唆している。
短鎖脂肪酸の 健康および疾患における役割
SCFAは、粘膜だけでなく全身的なコンパートメントにおける恒常性反応のメディエーターとして作用する[28]。SCFAは、遊離脂肪酸受容体2(FFAR2)に依存する経路を用いて、制御性T細胞(Tregs)を介して大腸免疫寛容を誘導する[29]。これらの接続は、抗炎症メディエーターであるインターロイキン(IL)- 10を生成し、マウスモデルにおいて大腸炎を予防するのに必要である [29], [30], [31]。最近、腸管上皮細胞において、SCFAの抗コリテックス活性は、炎症誘導につながり、炎症期間中のバリア機能の改善とバリア破裂の予防につながることがわかった[30]。別の場所で詳細に議論されているHDACを抑制するプロピオン酸酪酸の能力は、これらの化合物の抗炎症作用の主な原因である[32]、[33]。
SCFAは、腸を超えた方法でアレルギー反応と喘息から保護する。動物モデルでは、抗生物質によるディスバイオーシスは、重度のアレルギー性肺炎を引き起こす。[34]. Tヘルパー(Th)2型(Th2)細胞数の修正と循環免疫グロブリンE(IgE)の量の減少によって、SCFAの処方は抗生物質の摂取に関連するアレルギー性の肺の炎症を減衰させる [35]。さらに、高繊維食の消費は、アレルギー性肺炎のモデルを減少させるのに役立ちます。これは、SCFA(プロピオン酸)の細菌合成により達成され、Ffar3依存経路を通じて肺のTh2反応の刺激を抑制します[36]。最近、マウスの重要なウィンドウ内でSCFAに幼少期に曝露することで、喘息以外の成人期の免疫病理学から保護されることが証明された。離乳期を通じて、あるいは無菌状態で、あるいは離乳後に元生殖細胞でコロニー形成したマウスに抗生物質を投与すると、離乳期を通じて特定の病原体を含まないマウスやコロニー形成したマウスに比べて、成体における大腸炎、アレルギー、大腸がん(CRC)に対する高い脆弱性に寄与する [37].この免疫病理学に対する微生物群の免疫は、離乳期にSCFAを投与することによって、マウスで再構成される可能性がある。これは、RAR関連オーファン受容体γT陽性(RORγt+)Tregが、初期発生におけるこの重要な瞬間に誘導される場合にのみ可能である[37]。微生物叢が産生するSCFAは、ヒトの免疫とは無関係に、感染に対する直接的な防御を提供する可能性がある。マウスで酪酸産生菌(Clostridiaなど)を枯渇させると、チトクロームbd-IIオキシダーゼ依存的に大腸腸管細胞の酸素化が進む [38]。これらの条件は好気性腸内病原体(例えばサルモネラ菌)にとって好都合であり、大腸炎の程度の上昇と病原体の伝播につながる。このことは、SCFAが腸内の局所的な生息環境を変化させ、感染を防いでいることを示唆している[39]。SCFAは、腸内病原体によるコロニー形成に対する抵抗性を媒介する役割も担っている。常在菌のレベルが低いマウスは、プロピオン酸のレベルが低いためにサルモネラに感染しやすく、サルモネラの増殖を直接的に制限している可能性がある。このため、マウスはより発症しやすくなっています[40]。その結果、微生物叢が産生するSCFAは、代謝、増殖、分化など、宿主に対して幅広い影響を与えることが、現在では十分に立証されている[41]。我々は、ヒトの健康をより良く保護し促進するために、腸内の微生物叢、宿主、病原体の複雑な相互作用におけるSCFAsの機能を同時に完全に明らかにする研究を行うことを提案する。
ウイルス感染症における短鎖脂肪酸の機能と作用機序
以前、我々はSCFAがHDAC阻害剤として作用し、ヒストンアセチル化を増加させる可能性について議論した[42]。酪酸処理によりヒストンアセチル化が進み、潜伏感染した上皮細胞でウイルス遺伝子の転写が増加し、最終的にウイルス再活性化につながることが示されている。今井ら[43]によれば、Porphyromonas gingivalisが大量に産生する酪酸は、HDACを阻害し、ACH-2細胞やU1細胞のHIV-1遺伝子発現を増加させ、HIV-1の再活性化を誘発すると考えられています。HIV-1遺伝子発現の増加は、主にHIVの進行に寄与している可能性がある。同様に、今井ら[44]は、P. gingivalisの高ブチレートがHDACブロッカーとして作用し、EBV陽性ヒトBL細胞株およびLuc B95-8-221細胞のBZLF1遺伝子発現を増加させ、潜伏ウイルスが破壊されて再活性化する可能性を発見している。今井ら [44] が P. gingivalis の培養上清に見出した酪酸は、ヒストン脱アセチル化酵素を阻害することでヒストンのアセチル化を増加させる。
別の研究では、酪酸の補給はマウスのインフルエンザに対する抵抗性を改善した[15]。骨髄造血は酪酸塩の影響を受け、(FFAR3を介して)循環単球の頻度が増加し、最終的に活性化マクロファージに分化したためである。CXCL1の産生が減少した結果、好中球の移動が止まり、炎症による組織損傷が後者では減少した。また、酪酸はナイーブT細胞からのエフェクター細胞の分化・誘導を促進し、代謝反応を改善した。インフルエンザウイルスに対するエフェクター性能の向上は、FFAR3および脂肪酸β酸化代謝を介したCD8 + T細胞の活性化に関連していた[15]。最近、SCFAが馬ヘルペスウイルス感染症の重症度を下げることが示された。複製後、ウイルスは白血球に関連したウイルス血症によって呼吸器上皮に大きく散布される。しかし、SCFA処理は、呼吸器上皮におけるウイルス複製にはほとんど影響を及ぼさない一方で、横方向のウイルス拡散を防止した。さらに、SCFAは内皮細胞における接着分子の産生を制限した。これは、感染した免疫細胞から内皮細胞へのウイルスの伝達を減少させ、ひいてはウイルスの拡散を防止するものである[45]。これらの知見は、肺ウイルス感染に対するSCFAsの酢酸および酪酸の保護効果を強調し、これらの物質の複雑で多面的な活性を強調するものである。ここでは、SCFAの役割とウイルス感染全体でその効果を発揮するメカニズムに関する研究を紹介する(表1)。
表1. ウイルス感染症における微生物叢由来短鎖脂肪酸の役割と作用機序
SCFA の種類 生産菌 研究環境 ウイルス感染 メカニズム 結論 参考文献
プロピオン酸、酢酸、酪酸 - In vitro SARS-CoV-2 ACE2 腸内細菌叢が産生するSCFAは、安静気道上皮細胞におけるACE2発現を有意に減少させた[54]。 [54]
プロピオン酸、酢酸、酪酸 クロストリジウム属 In vivo SARS-CoV-2 ACE2、GPR41、GPR43 SCFAは、ACE2発現を低下させ、GPR41および43を介した適応免疫応答を増加させることにより、雄動物の呼吸器系および腸系のウイルス負荷を低下させた。 [244]
酪酸-in vivo SARS-CoV-2 ACE2 酪酸は、SARS-CoV-2遺伝子をダウンレギュレートしながらTLRと抗ウイルス経路を促進した[62]。 [62]
Porphyromonas gingivalis In vitro EBV ZEBRA P. gingivalisはクロマチン変化を介してEBVの再活性化を引き起こし、酪酸はこの作用に関与していた。 [44]
Porphyromonas gingivalis In vitro HIV HIV-1 P. gingivalisは、酪酸によるクロマチンリモデリングを通じてHIV-1を再活性化する可能性がある[43]。 [43]
Fusobacterium Nucleatum, Clostridium cochlear um, Eubacte iummultiforme, Anaerococcus tetradius HIV HIV-1 潜在的なHIVプロウイルスは酪酸を作る細菌によって再活性化する可能性があり、したがってそれらを除去すればAIDS発症を阻止できる可能性がある. [245]
プロピオン酸、酢酸、酪酸 - In vitro HIV CD66b, CD16, CD62L, CXCR4, NET 酪酸はCD66bを減少させる一方でCD16とCD62Lを増加させ、低活性化と長寿を示唆したが、プロピオン酸はCD54とCXCR4を上げて熟年表現型となった。抗HIV薬の酢酸塩と酪酸塩は、高齢女性における好中球の動員およびディフェンシン産生を阻害した。 [246]
酪酸菌 酪酸菌生産菌 臨床 アデノウイルス、コロナウイルス、インフルエンザ、パラインフ ルエンザ、RSV 抗炎症 Allo-HCT 患者において、糞便微生物群の酪酸菌生産菌は LRTI に対して保護的であった。 [247]
酪酸-in vitro インフルエンザ、レオウイルス、HIV ISG 他の要因の中で、酪酸はISGがタイプIFNに反応する方法に影響を与える。 [248]
In vivo チクングニアウイルス Th17/IL-17, AP-1, NF-κB 高繊維食は好中球の反応、特に Th17/IL-17 を増加させた。 [249]
プロピオン酸、酢酸、酪酸 - In vitro EHV1 ICAM-1, VCAM-1 プロピオン酸、酢酸、酪酸はEHV1接種単核細胞との共培養の前に内皮への免疫細胞の接着を減少させる。 [250]
酪酸塩 - In vitro インフルエンザウイルス、レオウイルス、HIV-1、ヒトメタニューモウイルス、水疱性口内炎ウイルス RIG-I, IFITM3 酪酸塩は、IFN刺激に対するヒトおよびマウス細胞のRIG-IおよびIFITM3などの抗ウイルスISG生成物のレベルを低下させる。 [251]
プロピオン酸 - In vitro 及び in vivo HSV Treg プロピオン酸は、CD4 T細胞におけるTreg形成を促進しながら、Th1及びTh17の活性化を減少させた[252]。 [252]
酢酸-in vitro および ex vivo RSV RIG-I SCFA-酢酸は、RIG-I発現の調節を介してRSV感染の重症度を減少させた。 [253]
プロピオン酸、酢酸、酪酸 - In vivo インフルエンザ CXCL1、CD8 + T細胞 発酵繊維とSCFAは自然免疫と適応免疫を制御し、インフルエンザを浄化して免疫関連疾患を予防する。 [243]
酪酸 - In vitro ロタウイルス PERK-eIF2α を介したアポトーシス 酪酸は、GPR109aを介してPERK-eIF2シグナル伝達経路を変化させることによりERS介在アポトー シスを抑制し、ロタウイルス予防および治療に対する新しいアイデアを提供する。 [254]
酪酸塩-CgaとDlk1を介したin vitro HSV-1再活性化 酪酸塩は、宿主のエピジェネティクスを修正する薬理作用と、1時間後の免疫反応を刺激または抑制しないことの2つの要素でHSV-1再活性化に関与している。 [255]
酪酸-in vivo HPV HPV16 E6/E7 扁桃体細菌発酵産物は、HPV陽性中咽頭癌の危険因子である高リスクのHPV感染を維持する可能性がある。 [256]
酢酸塩-in vitro インフルエンザ-酢酸塩は、抗炎症性メディエーターを増加させることにより、インフルエンザウイルス量を減少させる可能性がある。 [257]
酢酸塩 - In vivo RSV IFNAR 最近の研究では、酢酸塩がIFN-、GPR43、IFNARを介して肺上皮細胞で抗ウイルス作用を持つことが示されている。 [258]
4.1. ウイルスの入り口
細胞の入り口は、ウイルスのライフサイクルにおける重要なステップである[46]。ウイルスは、新しい宿主細胞に感染する前に、まず細胞膜に侵入し、多くの場合、細胞壁にも侵入する必要がある。動物ウイルスが、ウイルス受容体として知られる細胞表面分子に付着することが、このアプローチの最初のステップである[46]。ウイルスと直接相互作用してウイルス粒子を捕捉することに加え、有益な細菌は、ウイルス受容体を占有することで宿主細胞へのウイルス付着を物理的に阻害することもある[47]。実験室試験からの証拠は、プロバイオティクスEnterococcus faecium NCIMB 10415が吸着剤の直接捕捉によってH1N1およびH3N2豚インフルエンザウイルス粒子を結合し分離できることを示し、Staphylococcus epidermidis ATCC 12228の試験データからATCC生物レベルでの抗ウイルス活性を確認しました[48]、[49]。また、細菌のリポ多糖(LPS)はin vitroでヒトおよび鳥インフルエンザ株の安定性を低下させたが、これは宿主由来およびインフルエンザAウイルスのサブタイプに影響された[50]。一方、LPSのような細菌細胞壁成分への結合は、他の実験環境において、ビリオンの安定化だけでなく、エンテロウイルスの感染性や共感染の増加をもたらしました[51], [52]。
研究者たちは、初めて、マウス肉腫ウイルス形質転換ラット細胞(MSV-NRK)において、表面糖ペプチド、糖脂質、フィブロネクチン、ヘキソース取り込み、細胞-基質接着などの形質転換に関連する生化学パラメータの変化が、酪酸誘導性細胞平坦化とどのように相関しているかを調べた [53].彼らは、GM3ガングリオシドと類似のガングリオシドGDlaが大量に生成する前、あるいは同時に細胞の扁平化が起こることを発見している。また、最初の細胞平面化の段階では、放射性同位元素で標識したフコースの新規フコース含有要素であるグルコピラノシル・フコピラノシル・トレオニンへの取り込みが増加することが示された[53]。逆に、次のステップである細胞濾過では、トリプシン感受性表面フコペプチドの分子量分布の変化が観察された[53]。細胞-基質間の接着が大幅に改善されたにもかかわらず、酪酸をコートしたMSV-NRK細胞では表面のフィブロネクチンが存在しなかった[53]。このことは、酪酸塩がMSV-NRK細胞の変化した表現型の生成に関与する時間的ダイナミクスを解読するための有用なツールであることを示唆している。
SARS-CoV-2は、オリジナルのSARS-CoVやNL63コロナウイルスと同様に、アンジオテンシン変換酵素2(ACE2)の細胞外ドメインに結合することでヒト呼吸器細胞に感染する [54]。ウイルスの複製および疾患の重症度に影響を与える重要な因子には、ACE2の発現およびACE2に対するウイルスの親和性が含まれる。[55], [56]. コロナウイルス疾患2019(COVID-19)による重症度の向上と死亡は、すべてACE2の過剰発現と関連しており、これは喫煙、糖尿病、および心血管障害と関連している[57]。COVID-19の重篤な症状の頻度や発生率が成人と比べて小児で少ないのは、ACE2が成人と比べて発現が少ないからだと考えられる[58]。したがって、COVID-19の研究では、鼻の組織におけるACE2の発現にどのような因子が影響するかを明らかにする必要がある。
さらに、鼻の上皮細胞におけるACE2の発現をダウンレギュレートする努力は、SARS-CoV-2の広がりを抑え、潜在的な治療アプローチとして機能する可能性がある。様々な治療領域で有用である可能性があるSCFA受容体は、有望な薬物ターゲットです[59]。SCFAsの受容体であるGPR41、およびGPR43は、最近鼻粘膜で同定され、低レベルまたは高レベルのSCFAsは、細胞の生存に負の影響を与えないことが観察された[60]。治療戦略の一環として投与されたプロピオン酸、プロピオン酸ナトリウム、酪酸、または吉草酸は、一緒に投与するとSARS-CoV-2感染から保護することができます。ACE2が心臓保護および肺の特性を持つことを示す報告がある[61]。ACE2の全身的な阻害が、特にSARS-CoV-2感染の後期において、COVID-19に負の影響を与える可能性がある。したがって、SCFAsの外用による鼻腔内ACE2濃度の局所発現を抑えることは、本疾患の初期治療だけでなく、COVID-19の予防にも役立つ可能性があると思われる。Takabayashiら[54]は、試験したすべてのSCFAが、気道上皮細胞において濃度依存的にdsRNA誘発のACE2 mRNA発現増加を抑制することを報告した。すべての証拠を一緒に考慮すると、SCFAは、呼吸器上皮細胞におけるdsRNAとACE2発現の悪循環を破壊することによって、COVID-19の初期段階において予防だけでなく臨床効果も有するようである。このような影響を示すとすれば
別の研究において、Liら[62]は、ハイスループットRNAシーケンスを使って、結腸オルガノイドの転写パターンに対する酪酸の効果を調査した。彼らは、酪酸塩処理により、オルガノイドにおいて4526遺伝子のアップレギュレーションと3167遺伝子のダウンレギュレーションを引き起こしたことを報告した。SARS-CoV-2感染は、これらの遺伝子のいくつかの活性と関連していた。酪酸は、SARS-CoV-2が宿主細胞に侵入するためのタンパク質であるAce2およびTmprss2のレベルを有意に低下させた。酪酸は、ACE2の脱落に関与するメタロペプチダーゼであるAdam17の発現を増加させた。これらの知見から、SCFAである酪酸は、膜のACE2レベルを低下させることによりウイルス感染を抑制することができると考えられ、これは、ACE2の転写発現の減少、ACE2の排出の増加、ウイルスのスパイクタンパク質の活性化の減少が介在している可能性が考えられた。
4.2. ウイルスの増殖と発癌経路
ウイルスの中には、繁殖を成功させるために宿主の微生物叢またはその構成要素と相互作用するように適応したものがある [63] 。ヒト血液型抗原(HBGAまたはblood group antigens)は、ヒトノロウイルスの受容体または共受容体である[63]。ヒトノロウイルスは、HBGAを発現する腸内細菌が存在しないとB細胞に感染できないため、本研究においてJonesら[64]は、ノロウイルスの伝播および感染が、宿主におけるHBGA発現細菌の存在に影響されることを明らかにした。重要なことは、抗生物質を使用して正常な腸内細菌叢を減少させると、ウイルス力価が著しく低下することであり、このメカニズムは、常在細菌叢がウイルスの繁殖を抑制する能力にあると思われる [64]。ウイルスが腸内細菌叢をどのように変化させるかについての研究は急速に拡大しているが、多くの疑問が未解決のままである。
ヒトパピローマウィルス(HPV)は、ケラチノサイトに感染するDNAウィルスであり、HPVとして知られている。HPVは、小型で、エンベロープを持たない、円形の二本鎖ウイルスである[65]。高リスク型HPVは、E6およびE7として知られる2つの主要なオンコプロテインのコード化に関与している。これらのオンコプロテインは、感染したケラチノサイトが癌に進行する際に重要な役割を果たす[65]。レチノブラストーマ(RB1)腫瘍抑制タンパク質はE7オンコプロテインによって不活性化され、細胞周期チェックポイントタンパク質とTP53腫瘍抑制タンパク質はE6オンコプロテインによって不活性化される [66], [67]。E6およびE7オンコプロテインは、細胞極性、細胞周期、およびアポトーシスに関与するものを含む様々な細胞プロセスを破壊するために協力する。これにより、細胞周期の調節異常やゲノムの不安定性が引き起こされる[68]、[69]。E6/E7 のノックダウンによる老化または細胞死の誘導は、HPV 誘発悪性腫瘍の維持におけるこれらの癌遺伝子の重要な機能を示唆している [70], [71]。中咽頭におけるHPV陽性扁平上皮癌(SCC)の非常に高い頻度は、HPV誘発性腫瘍形成を促進する明確な局所変数の存在を支持している[65]。クリプト上皮へのリンパ球の連続的な浸潤は、その下にあるリンパ組織の境界に位置する緩いネットワークの形成につながる。嫌気性菌は深部クリプトの低酸素環境で増殖し、酪酸などの多種多様な基質を発酵させて口臭を引き起こす [72], [73].HDAC阻害剤である酪酸が腸の保護機能を調節し、腸上皮の健康を増進することが示されており、酪酸がエピジェネティック・モディファイアとして作用する可能性が示唆されている [74], [75]。一方、酪酸はHPV不死化培養上皮細胞で試験したところ、原体効果と抗がん作用があることがわかった[76], [77]。HPVは一般的なヒト疾患であるが、HPVによって引き起こされるほとんどの感染症は、宿主の免疫系によって治療される可能性がある。これには、ハイリスクグループのメンバーによって運ばれる感染症も含まれる。一方、ごく一部の個人は慢性感染を起こす可能性があり、これは癌のリスク上昇と関連している。[78], [79]. HPV16のオンコプロテインは、ヒトがHPVの自然宿主であるにもかかわらず、ヒトの細胞で起こるのと同様の方法でマウスのTP53およびRB1経路を標的とすることが研究で示されている[80]。その結果、マウスは、前癌であれ癌であれ、HPVとその宿主との関係を調査するための優れた動物モデルである。
酪酸塩療法は、HPV16 E6/E7 発現ケラチノサイトの in vivo および in vitro の両方の特性を修正することが、Li らによって示された[65]。この細胞は免疫不全のトランスジェニックマウスに注入されるため、治療によってより長く生存することができ、その成長パターンも変化するのである。彼らの発見は、持続的なHPV感染と扁桃腺細菌が産生する代謝産物との間に関連性がある可能性を示唆している。本研究では、HPVの癌遺伝子を高レベルで発現しているケラチノサイトを用い、酪酸処理による細胞寿命と活性への影響を調査した[65]。ネイティブなウイルスプロモーターを用いた同様の研究は、本研究を補完し、全体的なエピジェネティック効果を評価するために、ウイルス転写に対する環境影響を含めることで、さらなる次元の価値を提供することになる。酪酸処理によりHPVオンコプロテインで形質転換したケラチノサイトの生存期間が延長することから、常在菌は高リスクHPV感染の慢性化と頭頸部SCCの傾向の両方に関与していると思われる。
4.3. 溶血性再活性化
ウイルス遺伝子の発現、ウイルスDNAの複製、および新しいウイルス粒子の形成は、すべて感染の溶解期に起こり、ウイルスの拡大および持続に不可欠な段階となっている [81] 。より低い程度ではあるが、常在菌の微生物相も間接的にウイルス感染を促進し、溶解性の再活性化を調節するのに役立っている可能性がある。Asaiらの研究 [82] によると、口腔内細菌培養液のSCFAは、EBVの初期抗原の開発に関与していることが示唆されています。Gorresら[83]は、EBVおよびヘルペスウイルスの溶解性再活性化におけるSCFAの機能についての詳細を知るために、SCFAおよびアンタゴニストのパネルを採用した。これらの研究者は、ヒストン脱アセチル化酵素を阻害するすべてのSCFAがヘルペスウイルスを再活性化し得ることに注目した。しかしながら、これらのSCFAの選択されたサブセットのみがEBVを再活性化することができた[83]。
全ヒトの90%以上が、一般的なグラム陰性ヘルペスウイルスであるEBVに感染している[44]。このウイルスは口腔咽頭上皮で複製され、唾液の接触による初感染後、B細胞に広がり、宿主の一生を休眠状態におく[44]、[84]。カルシウムイオノフォア、12-O-テトラデカノイル-ホルボール-13-アセテート、トランスフォーミング増殖因子β(TGF-β)、抗免疫グロブリンなどの様々な誘導剤で処理すると、EBVの潜伏型が活性化して溶血複製サイクルが開始されることがあります。これは、EBVの潜伏型を誘導することによって行うことができる[85]、[86]。最初に転写されるEBVにコードされた即時型BZLF1遺伝子は、ロイシンジッパー転写活性化因子のbZIPファミリーのメンバーである配列特異的DNA結合タンパク質であるZEBRAを生成する[84], [86], [87].潜伏期においても、BZLF1 mRNAもZEBRAタンパク質も検出されない[84]。ZEBRAはEBVの初期および後期遺伝子をトランス活性化する能力があるため、潜伏感染B細胞における潜伏から溶解複製サイクルへの移行を制御する上で重要な役割を果たしている [87], [88]。休眠状態のEBVの再活性化は、子孫ウイルスの産生をもたらし、感染性単核球症や自己免疫疾患、ホジキン病、鼻咽頭癌、BLなどの様々な悪性腫瘍を含むヒト疾患の発症に寄与する[89]、[90]。今回の発見は、EBV潜伏の持続と中断を支配する新しいメカニズムの発見につながりました。この機構は,ヌクレオソームの調整とヒストンの修飾に関連している [91], [92], [93].潜伏期間中、ヒストン蛋白はBZLF1遺伝子プロモーターをクロマチン構造に結合し、遺伝子転写をサイレンシングしている。これは、睡眠状態が潜伏状態と関連しているために起こる [44]。BZLF1プロモーターに隣接するコアヒストン蛋白質の低アセチル化はその抑制と一致し、隣接するコアヒストン蛋白質の高アセチル化はBZLF1遺伝子の転写活性化に関連している。この2つのプロセスは、潜伏期間の維持に重要であると考えられている[44]。Sp1/Sp3 および myocyte enhancer-binding factor-2 (MEF2D) は、HDAC 分子を BZLF1 プロモーターに勧誘することによって転写抑制因子として作用し、EBV 潜伏期の維持に関与する細胞タンパク質である [94], [95].バルプロ酸、トリコスタチンA、酪酸はHDACアンタゴニストであり、BL細胞から培養した様々な細胞株において、BZLF1プロモーターのヒストンアセチル化とEBV再活性化を誘導することが報告されている[96]、[97]、[98]。EBV感染における最も差し迫った問題の1つは、ウイルスが休眠状態から感染性溶血サイクルに切り替わるきっかけを突き止めることである。今井ら[44]は、P. gingivalis培養上清の生物活性を調べることにより、歯周病の原因となるグラム陰性嫌気性細菌を解析した。この上清は EBV の再活性化に成功し,EBV 感染者における歯周病と EBV 関連疾患の病態生理的連関が示唆された.今井ら[44]は、ヒストンのアセチル化と脱アセチル化がBZLF1遺伝子の転写に重要であることを明らかにし、特にヒストンのアセチル化がP. gingivalisによって促進され、ウイルスの休眠に関与していることを明らかにした。最も強力なHDACアンタゴニストの1つは酪酸であり、多くのウイルスおよび細胞遺伝子の発現を制御することが実証されている[44]。今井ら[44]は、P. gingivalis培養上清に、HDACを阻害し、ヒストンのアセチル化を増加させる酪酸が含まれていることを実証している。酪酸は、P. gingivalis培養上清に含まれるZEBRAの強力な発現誘導物質であることが初めて明らかになりました。いくつかの研究により、酪酸の腹腔内注射は、いくつかのEBV悪性腫瘍において、溶解性EBV感染を活性化し、in vivoでZEBRA発現を誘導することが示され、これらの結果を裏付けている[98]、[99]。
後天性免疫不全症候群(AIDS)の発症を引き起こすウイルス複製の速度は、主にHIV-1遺伝子の活性発現の様式によって決定される[43]。インテグラーゼは、HIV-1プロウイルスDNAのヌクレオソームへの取り込みに必要である。HIV-1感染が起こると、局所的なヌクレオソームの配置がプロウイルスの長末端反復配列(LTR)から転写活性を制御する[100], [101], [102].サイトカインを含む様々な外部からの刺激によるシグナル伝達は、HIV-1遺伝子の発現を誘導する[100], [101], [102]。例えば、HDACアンタゴニストの酪酸ナトリウムやトリコスタチンAは、ウイルス遺伝子の発現を刺激することが実証された[103], [104]。HIV-1ゲノムは潜伏感染細胞に存在し、そこでヘテロクロマチン複合体に組み込まれ、転写的に不活性なプロウイルスを残存させる[105], [106]。HIV-1 LTRからの転写活性化はプロウイルス近傍のコアヒストンタンパク質の高アセチル化と関連し,その抑制はHDACによって促進される低アセチル化と関連していた[103], [104], [107], [108], [109].HIV患者における異なる細菌による感染とAIDS発症との関連として、微生物の共感染とその組み合わせがHIV複製を促進する可能性が繰り返し示されてきた。今井ら[43]は、歯周病と関連するP. gingivalis(グラム陰性嫌気性菌)の培養上清(csp)の生物学的作用を検討した。その培養上清はHIV-1の再活性化をうまく刺激することが示され、歯周障害とHIV-1患者のAIDSの臨床経過との間に病態生理学的関係の可能性が示唆された。
また,今井らの研究により,P. gingivalis の代謝物がウイルス潜伏の破綻に直接関与するヒストンのアセチル化を刺激することが示された[43].このアセチル化、脱アセチル化、あるいはヌクレオソームヒストンタンパク質の生物学的修飾は、組み込まれたHIV-1プロウイルスの転写活性に関与している。酪酸は、何百もの細胞およびウイルス遺伝子の発現を制御することが示されており、ヒストン脱アセチル化酵素の最も有力な拮抗薬の1つとなっている[43]。これらの知見は、酪酸を含有するcspがHDACをブロックし、ヒストン3および4のアセチル化を増加させる可能性があることを実証している。
最後に、酪酸ナトリウムの単回および反復投与は、マウスにおける単純ヘルペスウイルス1型(HSV-1)の再活性化を75-100%の頻度で促進することが示されている[110]。Clementらの研究[111]では、酪酸ナトリウム処理後0.5時間でラット三叉神経節(TG)においてHSV-1ゲノムに関連するクロマチン構造パターンの変化が検出された。HSV-1感染により不活性化したPC-12ニューロンを酪酸ナトリウムを用いてin vitroで再活性化させた[112].LAT陽性17Synとその変異体であるLAT陰性17Pst(LAT-negative)の2つのウイルスは、いずれも17株由来であり、Clementら[111]は、これらのウイルスに感染した休眠マウスのTGにおける宿主遺伝子の発現の差異を検討した[113]。Clementら[111]は、マウスに酪酸ナトリウムを注射した1時間後に、17Pst変異体(LAT陰性)が作り出す遺伝子発現パネルが、17Syn親が作り出す遺伝子発現パネルと異なることを、サブトラクション法を用いて明らかにした。これらの結果は、HSV-1ビリオン成分VP16のトランスフェクションがin vitroで八量体含有ヒストンH2Bを活性化するが、ウイルス感染を引き起こさないことを示す他の研究とも一致するものであった。
4.4. ウイルスによるアポトーシス
ウイルス感染などの様々な細胞外刺激を細胞が認識すると、特定の細胞内シグナルネットワークが活性化され、最終的にアポトーシスと呼ばれる過程を経て細胞死に至る[114], [115]. 例えば、ロタウイルス(RV)感染は、腸管バリアを破壊し、腸管ホメオスタシスを変化させ、その両方がアポトーシスのプロセスを通じて上皮細胞死を誘導する可能性がある [116], [117].最近の知見では、ウイルスへの感染が宿主細胞の小胞体(ER)の均衡を乱し、最終的にERストレス(ERS)をもたらす可能性があることが示されている[118]、[119]。ERS時にリン酸化される重要なER膜貫通タンパク質の1つは、プロテインキナーゼRNA様ERキナーゼ(PERK)と呼ばれるものである。PERKの関与の結果として、真核生物開始因子2α(eIF2)のαサブユニットのその後のリン酸化が起こった[120]。eIF2αのリン酸化は、アクチベーター転写因子4(ATF4)の活性化の促進に関与し、その結果、プロアポトーシスC/EBP相同タンパク質(CHOP)の産生を増加させる[121]。CHOP は,プロアポトーシス蛋白質 Bax をアップレギュレートし,抗アポトーシス蛋白質 B-cell lymphoma 2 (Bcl-2) をダウンレギュレートすることによってアポトーシスを誘導する [122], [123].また,CHOP はアポトーシス蛋白質 Bax をアップレギュレートすることによってアポトーシスを誘導する.感染細胞では、様々なウイルスがPERK-eIF2α-CHOPシグナル伝達経路を活性化し、感染細胞集団の死をもたらすことが示されている [124], [125]。
酪酸ナトリウムがtert-ブチルヒドロペルオキシドによる酸化ストレスとアポトーシスからヒト髄核細胞を保護することが示された[126].SCFAの無機型である酪酸ナトリウムは、細胞が自己破壊するプロセスであるアポトーシスの制御に重要な要素である[126], [127], [128]. 以前の研究では、酪酸ナトリウムが2型糖尿病ラットのPERK-eIF2αシグナル伝達経路を阻害し、その結果、ERSによる膵島β細胞のアポトーシスが減少することが示された [129]。IPEC-J2細胞におけるRV誘発細胞アポトーシスに対する酪酸ナトリウムの予防的役割の可能なメカニズムを解明するために、Zhaoら[130]は、酪酸ナトリウムがRV誘発細胞アポトーシスを抑制することを明らかにした。Zhaoら[130]は、ERSとアポトーシスに関連するタンパク質の量を調査した。RV感染に応答して、彼らの発見は、p-PERK、p-eIF2α、cleaved caspase-9、およびcleaved caspase-3のタンパク質量が有意に増加することを示した。
さらに、酪酸ナトリウムで前処理すると、切断型p-PERK、p-eIF2α、カスパーゼ-9、および切断型カスパーゼ-3の濃度が有意に減少した。これらのデータはすべて、SB が PERK-eIF2α シグナル伝達経路の活性化を通じて RV 誘発アポトーシスを減少させたことを示している。Zhao ら [130] は、酪酸ナトリウムが PERK-eIF2 シグナル伝達経路のダウンレギュレーションによって IPEC-J2 を RV 誘発アポトーシスから保護することを示した最初のグループである。これは、酪酸ナトリウムがPERKに結合する能力をブロックすることによって行われた。GPR109aは腸管上皮に発現する酪酸特異的GPCRであり、SCFAの生理活性を促進する役割を担う可能性が研究されている[131], [132]. 酪酸は、抗炎症および免疫調節に重要な役割を果たすだけでなく、GPR109a依存的に大腸癌に対する防御に寄与することから、より注目を集めている[133], [134], [135]。Zhaoら[130]は、酪酸ナトリウムがIPEC-J2細胞で発現するGPR109a mRNAの量を増加させることを観察した。酪酸ナトリウムの抗アポトーシス作用は、GPR109a遺伝子をsiRNAを用いた遺伝子サイレンシングにより不活性化すると減少し、酪酸ナトリウムによるPERK-eIF2αシグナル伝達経路の阻害が阻害された。これらの結果は、酪酸ナトリウムの保護的役割は、GPR109a の誘導に関連している可能性を示唆する。GPR109aの活性化により、酪酸ナトリウムは2,4,6-trinitrobenzene sulfonic acidによって引き起こされる炎症反応と上皮バリアの破壊を抑制することができる。また、酪酸ナトリウムは、GPR109a依存的に大腸タイトジャンクションタンパク質の発現を増加させ、離乳子豚の下痢を予防することによって、下痢止め効果を発揮した[133], [136]。全体として、我々の発見は、酪酸ナトリウムが GPR109a 受容体を介して PERK-eIF2α シグナル伝達経路を調節することにより、RV による細胞のアポトーシスを防ぐことを示唆するものである。今回の研究成果により、酪酸ナトリウムが GPR109a を介した PERK-eIF2α シグナル伝達経路の調節により RV 誘発アポトーシスを減 少させることが初めて明らかになった。これは、この分野における重要な前進であった。これらの知見は、酪酸ナトリウムが腸管上皮細胞におけるRV誘発性アポトーシス細胞死の制御に関与する、これまで知られていなかったメカニズムに迫るものである。
4.5. ウイルス感染時の免疫調節
免疫反応に対するSCFAの効果は、消化器系を超え、肺や脳などの器官における末梢反応に影響を与える可能性がある[137]。食物繊維およびSCFAは、DC、マクロファージ、好中球およびTregに作用して免疫反応を抑制するため、健康的な食生活の重要な構成要素となっている [36], [138], [139], [140], [141]。SCFAの多面的作用のため、特定の関連する生理学的文脈におけるSCFAの活性から推論する必要がある-これは治療薬としてSCFAを生産し使用する可能性を考えると特に必要なことである。発酵性食物繊維を豊富に含む食事は、アレルギー性気道刺激からマウスを保護することが判明している [137] 。SCFAは、FFAR3依存的な方法でT細胞にアレルゲンを十分に提示しない気道のDCの数を増加させることにより、この抵抗を促進する。この抗原提示の変化により、Th2細胞応答が減少し、肺活量が改善される [36]。このTh2細胞応答の欠陥活性化が、より一般的な炎症抑制を反映し、その結果、感染症に対してより脆弱になるのかどうかは不明である。Trompetteら [137] は、食物繊維とSCFAが、2つの異なるメカニズムでインフルエンザウイルス感染に抵抗することを発見した。高繊維食は骨髄造血に影響を与え、インフルエンザに感染したマウスの肺にAAMを蓄積させる結果となった。これらのマクロファージはCXCL1の生成を抑え、気道への好中球の早期浸潤を抑え、その結果、過剰な組織傷害を回避することができた。食物繊維の発酵は、CD8 + T細胞の代謝とウイルスクリアランスも増加させた。有益な効果は FFAR3 に依存し、SCFA の経口投与で十分であった。Trompetteら[138]は、食物繊維がCD8 + T細胞の代謝を修正し、エフェクター機能を加速および改善する可能性があることを示唆している。高脂肪食(HFD)投与マウスのナイーブCD8 + T細胞は、ミトコンドリア密度の増加、最大呼吸および呼吸容量の増加を示し、酸化的リン酸化(OXPHOS)を利用する能力が向上していることを示している。同時に、解糖能力も向上していた。OXPHOS経路は、エネルギーを生産するためにナイーブTリンパ球によって主に使用される[142], [143]。効果的な細胞分化の間,細胞代謝は解糖に切り替わり,細胞の成長と増殖に必要な代謝中間体の合成を保証する [142], [143].Trompetteら[137]は、HFD給餌マウスのCD8 + T細胞の短期刺激時に、高い解糖率およびOXPHOS活性が同時に存在することを見出した。これは、食物繊維が、記憶想起反応によっても示されるように、細胞代謝を変化させることによって、迅速なエフェクター細胞の増殖および関与を高めることを示唆するものである。さらに、HFD食マウスのエフェクター細胞は、より高い機能を示す。CD8 + T細胞の機能は、グルコースの供給と取り込みに大きく依存している(図2)[144]。SCFAは、FFAR3が媒介するCD8 + T細胞の代謝および行動の変化を部分的に媒介する。FFAR3が細胞の代謝に影響を与えるメカニズムはまだ不明である。一つの理論は、細胞外シグナル制御キナーゼ(ERK)が活性化されることであり、これはT細胞においてグルコースの取り込みと解糖を増加させることが示されている[145]。しかしながら、HFD食マウスのCD8 + Tリンパ球の細胞代謝に対する酪酸の効果は、FFAR3以外にも依存する。ミトコンドリアへの脂肪酸の侵入を防ぐことによって脂肪酸酸化(FAO)を阻害する薬剤であるエトモキシルも、CD8 + T細胞の酪酸曝露によって引き起こされる代謝および機能的変化を逆転させることができる。FAOの基質として機能し、GPRシグナルを誘導することに加えて、酪酸のようなSCFAは、直接細胞に入る可能性がある [146], [147]. FAOの間に産生されたアセチル-CoAは、その後OXPHOSおよび解糖系プロセスを駆動するために使用される可能性がある [148] 。結論として、食物繊維とSCFAは、CD8 + T細胞の代謝を異なる方法で変化させ、ウイルス感染に直面してエフェクターT細胞の迅速かつ長期的な誘導を保証する可能性があります。この知見は、全身性細菌感染後の内因性血中酢酸濃度の上昇が、細胞代謝を解糖方向にシフトさせることによってCD8メモリーT細胞の迅速な動員を誘導するという以前の研究と一致する [149] 。結論として、Trompetteら[137]は、食物繊維およびSCFAが、組織損傷を低減し、適応的な抗ウイルス防御を強化することによって、重症インフルエンザ感染から保護する可能性があることを示した。食物繊維およびSCFAは、自然免疫応答を調節し、組織保護プロセスを増強し、特異的な適応免疫応答を促すことによって、疾患から保護する免疫学的バランスを確立する可能性がある。インフルエンザ感染後の保護的免疫応答の形成および免疫介在性病態の軽減に対する食物繊維の有益な効果は、ウイルス感染症の予防および治療目的でのSCFAsの使用についてさらなる調査を必要とします。
Fig.
ダウンロード 高解像度画像のダウンロード(251KB)
ダウンロード フルサイズ画像のダウンロード
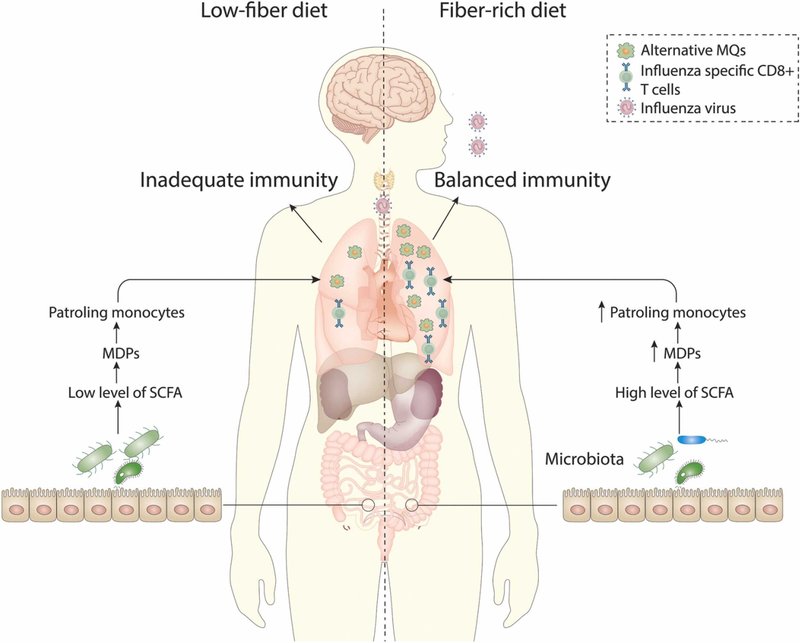
図2. インフルエンザウイルス感染における短鎖脂肪酸(SCFA)の役割の模式図。発酵性食物繊維であるイヌリンとその代謝物であるSCFAを多く含む餌を与えたマウスでは、好中球による免疫病理の抑制とT細胞代謝の上昇を介した抗ウイルスCD8 + T細胞応答の増加により、インフルエンザ感染に対する宿主防御能の向上が観察されました。また、骨髄におけるマクロファージ前駆体の増加は、SCFAsが造血に影響を与える方法の一つである。その上、具体的には、SCFAは好中球による組織損傷を軽減する方法でマクロファージの性能を修正する。別の状態では、低食餌繊維でインフルエンザ感染に対する宿主防御が損なわれている[243]。
SCFAは、腸内の炎症反応を防止する免疫調節因子として重要な機能を果たすことが示されている[32]。それにもかかわらず、FRTにおけるSCFAsの過剰なレベルは、炎症反応を増加させるようである [150], [151], [152]。しかしながら、生殖器の炎症反応はHIVの脆弱性を促進することが知られており、個人における自然免疫とHIV感受性に対する高レベルのSCFAの影響についてはほとんど理解されていない[151], [153]。最近、健康な女性の生殖器(FRT)の好中球が、HIVの活性化に反応して好中球細胞外トラップ(NET)を生成することが示された[154]。抗菌性の粒状タンパク質と結合したDNAの細胞外放出を含むNET放出と呼ばれるプロセスによって、HIVがin vitroで中和される可能性が示された[154], [155], [156]。
対照的に、性感染症(STI)の文脈における炎症プロセスに関する研究は、子宮頸液中の好中球由来の化学物質とHIV感染の可能性の増加との関連を示した [157], [158], [159]。これらの相反する可能性のある結果は、微生物相の変化が好中球の活性と抗HIV反応にどのように影響するかについての我々の知識におけるギャップを浮き彫りにしている。好中球は、主要なSCFA受容体であるGPR43のレベルが高いため、微生物代謝産物の変化による調節のターゲットになりそうです [160] 。Carrillo-Salinasら[161]は、病的なSCFAレベルが、年齢依存的に好中球の活性化、分泌パターン、および抗HIV活性を変えることを見いだした。異なるSCFAが好中球に異なる影響を与えることが示され、高齢女性の好中球はSCFA投与により制御可能であることが示された。この結果は、若年女性と高齢女性において、微生物の変化がメタボロームと自然免疫(好中球を介する)にどのように影響するかを理解する上で、性器管内の微生物多様性の関連性を強調するものであった。この研究の目的は、自然免疫における好中球の役割と、これらの細胞がマイクロバイオームと微生物化学物質の変化にどのように反応するかをよりよく理解することです。これらのプロセスを研究するために、Carrillo-Salinasら [161] は、高濃度環境が好中球に及ぼし得る影響を調べるために、in vitroモデルを開発した。これは、プロピオン酸、酢酸、酪酸を含む3種類のSCFAに血中好中球を曝露することで達成された。これらのSCFAは、膣内細菌異常の状況においてFRT生殖器に致死量まで蓄積される [150], [162], [163], [164]. Carrillo-Salinasら[161]は、上記のように設定した場合、各SCFAに特有の変化があることを指摘した。酪酸は、CD66b発現のダウンレギュレーション、CD16及びCD62Lのアップレギュレーションを含む、変化した表現型を好中球に示させた。好中球が成熟状態に入ると、移動と成熟のマーカーであるCD62Lの発現が減少する。CD66bは接着分子であり、活性化された好中球に特徴的である。CD16は好中球の生存に関与している[165], [166], [167], [168]. このため、高濃度の酪酸は非産卵性成熟好中球に低刺激を誘発し、これらの細胞の寿命を延ばすことにつながることが示唆された。細菌性膣炎の女性は、膣内好中球のCD16発現が増加しており、末梢好中球をin vitroで高濃度の酪酸で処理すると好中球の死滅が抑制される。これらの知見は、いずれもこれまでの研究成果と一致する[169]、[170]。青山ら[171]は、高濃度の酪酸で処理すると好中球のアポトーシスの割合が高くなるが、これは培養20時間後にのみ起こり、3時間後にのみ変化が観察され、Carrillo-Salinasらが示したデータとも一致する [161]。さらに、プロピオン酸で処理すると、CD54(ICAM-1)の発現が特異的に増加した。これは、通常、移動する好中球で増加するが、組織常在や循環する好中球では増加しない [172]。これらの結果は、SCFAレベルを増加させる生殖器内の微生物変化が、好中球の生理的活性を損ない、抗ウイルス能力を低下させる可能性を示唆している。
4.6. ウイルス感染における炎症
過去数年にわたり、SCFAが体内の炎症に関与していることも理解されている [173] 。疫学的研究によると、食物繊維の摂取量の増加は、心血管効率を改善し、炎症プロセスを減少させる可能性があり、一方、食物繊維不足の食事は、炎症性疾患のリスク増加と関連している[174]、[175]。これまで、ウイルス感染による炎症性病変の治療のための食事管理という戦略は、軽視されてきた。Sumbriaら [176] は、食事の変化が、眼球のHSV感染に反応して起こる免疫炎症反応の重症度にどのように影響するかについての研究を行った。彼らは、食事にプロピオン酸ナトリウムを加えると、間質角膜炎の病変の重症度が大幅に低下することを示し、食事の操作が自然の宿主であるヒトにおけるヘルペス病変の影響を軽減する方法となる可能性を提起した。間質角膜炎は,ヒトの感染に対する免疫反応によって引き起こされる病変であり,マウスモデルを用いて検討した[177], [178].免疫病理学は、T細胞によって駆動されていると広く信じられている。しかし、他の細胞や分子のプレーヤーがほぼ確実に関与している [179]。CD4、Th1、Th17細胞、そしておそらくCD8 T細胞などのリンパ系細胞が組織損傷に関与しているが、好中球やマクロファージなどの非リンパ系細胞も関与している [180], [181], [182].制御性T細胞(Treg)及び特異的サイトカインは、病変の発現レベルを変える可能性がある [183]、[184]。フォークヘッドボックスタンパク質P3(Foxp3)+CD4 T細胞は、最も研究上の関心を集めている制御細胞であるが、T細胞(IL-10産生)及びマクロファージの特定のサブタイプ(M2)も炎症反応のレベルを調節できるかもしれない [184], [185].その結果、治療と管理の目標の1つは、炎症性参加者の数を減らし、同時に、組織損傷を引き起こす炎症プロセスを制御するTregを含む構成要素の数を増やすことである。最新の研究成果によると、SCFA塩であるプロピオン酸ナトリウムを食事に取り入れることは、所期の目標を達成するための効率的な方法であるという。このため、プロピオン酸ナトリウムを補給したマウスで観察された間質性角膜炎病変は著しく減少し、眼炎症反応の性質が変化した。また、これらの病変部ではマクロファージや好中球の減少が観察され、T細胞サブセットの割合の変化から、Th1細胞やTh17細胞よりもTreg細胞が多くなっていることが分かりました。さらに、対照食を与えたマウスと比較して、プロピオン酸ナトリウムを補充したマウスは、いくつかの炎症性メディエーターやケモカイン、および炎症反応に関与する他のタンパク質要素の発現レベルが低いことが示された。自己免疫炎症モデルにおいて、酪酸またはプロピオン酸の補給と高繊維食を用いた試験の結果も、同様の傾向を示した [186], [187]. したがって、食事管理は、ウイルス感染や他のタイプの炎症反応に対する全身的な炎症の発生を抑えるために使用されるかもしれない。さらに、肺における調節不全の炎症結果は、特定の個人におけるCOVID-19感染の重大な、時には致命的な結果であることに留意することが重要である[188]。IL-6のような炎症性メディエーターに対して向けられたステロイドまたは高価なモノクローナル抗体が、この疾患に対する現在の標準的治療法である[189]、[190]。高繊維質の食事を与えること、またはプロピオン酸ナトリウムのような栄養補助食品を投与することは、COVID-19病変の炎症作用を軽減するための低コストで簡単な方法である可能性がある。重症で慢性的な性器ヘルペスの病変も、食事の変更やサプリメントの使用に反応することがある。
チクングニアウイルス(CHIKV)リウマチ免疫病理学は、Prowと同僚によって報告されたように、高繊維食によって変化することが示された[191]。筋損傷は減少したが、浮腫、Th17/IL-17活性、好中球の動員、乾癬様特性の増加が見られた。これは、高繊維食が炎症反応を抑えるはずだという、非感染環境で行われた多数の研究結果とは対照的である。CHIKV感染後の抗ウイルスおよび炎症プロセスの複雑な相互作用、異なる細胞タイプの感染、および異なるSCFAの相互作用のため、高繊維食がCHIKV関節炎の好中球刺激性変化に影響を与える可能性があるメカニズムは、複雑であろう [192], [193], [194], [195], [196]. Provoらは、CHIKV関節炎中の高繊維食マウスの足におけるマクロファージクリアランスフェーズシグネチャー遺伝子のダウンレギュレーションを強調している[191]。多くの場合、好中球の消失と組織治癒の開始は、侵入マクロファージによる可溶性相の表現型の採用と一致する[197], [198], [199].遺伝子セット濃縮解析(GSEA)および好中球は、高繊維食動物におけるCHIKV関節症がマクロファージ分化の遅延と関連していることを示した。いくつかの研究は、創傷治癒が抗炎症剤によって損なわれること、および高繊維食が損傷後の組織再生にプラスの効果を持つことを示している [192], [200], [201], [202]. マウスにおけるインフルエンザ感染症に対する高繊維食のプラスの効果にもかかわらず、マクロファージ活性を再構成することによって好中球を介した組織害を制御するSCFAも必要であり、これは繊維が免疫病理学に影響を与える重要な方法であることを示している[15]。Prowらによると、酪酸塩の摂取はCHIKV関節炎全体の浮腫を増悪させた[191]。Prowと同僚によると、酪酸塩の摂取はCHIKV関節炎の全体を通して浮腫を悪化させた[192]。しかし、関与するプロセスは、高繊維食で確認されたプロセスとは異なるようであった。RNA-Seqを用いたデータ解析は、AP-1およびNF-κB機能の変化と細胞周期停止の開始が関与している可能性を示唆した。酪酸は、内皮細胞に影響を与えることで浮腫を増加させる[191]。CHIKVは体内の内皮細胞を死滅させ、浮腫はCHIKV病の頻繁な兆候である。NF-kBの活性化は、内皮バリアの完全性の回復とそれに続くこの転写因子のアクチベーター・プロテイン1(AP-1)への変換に必要である。酪酸塩に関する先行研究と一致して、Prowら[191]は、酪酸塩が古典的なNF-κB経路を強く阻害する一方で、特定のAP-1活性を高めることを発見した。CHIKV感染下では、重要な経路のアップレギュレーションにより、内皮バリアーの修復が最適でなくなり、より高い浮腫を引き起こす可能性がある。今回発表されたCHIKV急性リウマチ熱の免疫病理に関する知見は、SCFAや高繊維食による疾患の軽減を示す文献の大半とは全く対照的である。この研究のほとんどは、非感染性の医療分野で行われているため、感染症における食物繊維とSCFAの効果は、特に強い全身感染と組織再生を必要とする広範囲の組織損傷を伴う場合、不明確である。食物繊維とSCFAのポジティブな健康効果は、食物繊維とSCFAのネガティブな効果を発見した他の多くの調査研究によって証明されているように、しばしば非常に文脈依存的でありうる [203]、[204]。
4.7. ウイルス感染におけるIFN産生
腸内細菌叢が抗ウイルス制御に影響を及ぼすことが示されている方法の1つは、IFN応答を調節することである [7]。IFNは、ウイルス感染に応答して宿主細胞から放出されるサイトカインの一種であり、重要な抗ウイルス効果を有する [205], [206] 。IFNには2つの機能がある:第1に、感染細胞及び周辺細胞に急性の抗ウイルス状態を確立すること、第2に、DCの活性化を介して最も顕著に、適応免疫と自然免疫を結びつける[206]、[207]。これまでのところ、腸内細菌叢は、ウイルスと環境に応じて、IFNシグナル伝達を刺激したり抑制したりするという証拠がある [208], [209].驚くべきことに、IFN応答に対する腸内細菌叢の影響は、広範囲のウイルスにおいて保存されているようであり、微生物叢中のいくつかの細菌およびその代謝産物は、IFNシグナル伝達を刺激する可能性がある。腸内細菌叢は、微生物と宿主の相互作用の主要な促進剤として、またPRRリガンドの供給源として機能しうる多様な化合物を作り出している。
SCFAは、ウイルス感染に対するIFN応答を調節する可能性があることを示唆する多くの証拠がある。RSVに対する微生物相によって産生される酢酸の抗ウイルス活性は、GPR43依存性のIFN-β産生の増加によって部分的に媒介される[210]。気道のRSVウイルス負荷の減少、肺への炎症性細胞の勧誘の減少、および全体の寿命の増加が、SCFA産生菌(Lachnospiraceae種)または外因性酢酸を投与したマウスで観察された[210]。研究は、酪酸とプロピオン酸の両方が保護機能を有することを示唆している[210]。GPR43誘導とIFN-β合成の関係はまだ不明である。酢酸処理後のNF-kB p65核転位の増加は、NF-kBシグナリングの関与を示唆する[210]。In vitroの研究では、酪酸がISGの発現を再配列することで多くのウイルス(hMPV、HIV、A型インフルエンザウイルス、レオウイルスなど)の増殖を増加させることが示された。合成HDAC拮抗薬もISG発現を低下させ、ヒストンアセチルトランスフェラーゼ(HAT)拮抗薬はこの抑制を回復させることから、酪酸のISG誘導抑制能力はHDAC阻害活性の結果であると理論づけられている [13].
これまでの研究で、微生物叢の構成と腸内SCFAレベルの変化もRSV感染に重要であることが示されている。Antunesら[211]は、酢酸がGPR43を誘導することにより、肺上皮細胞における1型インターフェロン反応とISG産生を後押しして、RSVによる発病から保護することを発見した。彼らの結果は、非消化器感染症や炎症性疾患における腸内細菌叢と関連代謝物の重要性を強調するものである[211]。Lynchら[212]は、腸内細菌叢とプロピオン酸が成体マウスにおける気管支炎の予防と喘息の確立に寄与することを見いだした。Antunesら[211]は、彼らの研究において、RSV感染既往の酢酸、酪酸、プロピオン酸を経口投与した後、同等の予防効果があることを示した。驚くべきことに、彼らは、感染中にマウスに酢酸塩を経口投与し、24時間後に経鼻投与した場合、良好な効果を発見した。この後者の知見は、酢酸塩がRSV感染症の管理に有用であることを示唆している。プロピオン酸の保護効果がTreg細胞に依存することを示したLynchら[212]によって見出されたこととは逆に、Antunesら[211]は、酢酸ナトリウムがT細胞から独立したプロセスに影響を与えることを見出した。Antunesら[211]は、酢酸塩が、in vitroおよびin vivoにおいて、ヒト呼吸器細胞株およびRSV感染マウスの肺におけるIFN-β応答を変化させることを見出した。このメカニズムは、in vitroおよびin vivoで1型IFN受容体(IFNAR)がない場合に損なわれることが発見されたため、RSV感染に対するアセテートの防御にとって重要であった。また、この知見は、RSV感染を通じてIFN-βの役割を示唆するものである[213]。さらに、IFN-1の生成と肺ウイルス感染に対する免疫における微生物叢の役割は、すでに確立されている [209], [214], [215]。
IFN-1は、ウイルス認識後にIFNAR 1または2に結合する。これは、JAK-STAT経路を含むシグナル伝達カスケードを開始し、抗ウイルスISGの転写を増加させる[216]。IFN-βは、他のタイプのIFNよりもI型受容体への親和性が高く、最も効果的な受容体アゴニストとなっている。Antunesら[211]は、RSV感染マウスの肺において、酢酸処理により、異なる抗ウイルスISGs、Isg15、及びOas1(2'-5'-オリゴアデニル酸合成酵素1)の転写が増加することを発見した。この発見は、酢酸の保護機能におけるIFNARの顕著な機能に基づいている。Oas1タンパク質がRSV 40の複製速度を低下させる可能性があることが判明しており、これは酢酸がこのような効果を持つ理由も説明できる戦略である[217]。RSV感染は、感染24時間後にコントロールと酢酸処理マウスの肺に同程度のウイルス量が存在することからわかるように、酢酸処理によって付与される抗ウイルス活性によって完全に根絶されたわけではなかった。しかし、より長い期間の後では、この変数に有意かつ一定の減少を引き起こした。Antunesら[211]の知見は、高繊維食、繊維強化ミルク、あるいは酢酸塩などの低コストの治療が、RSV誘発性気管支炎を効果的に予防・治療しうるという考えを支持するものであった。要約すると、ここで示された知見は、RSV感染に対する防御機構を実証するものである。この防御機構には、腸内細菌が産生する代謝物である酢酸が関与し、GPR43とIFNARが協調して肺でIFN-βを産生することが示されている。この方法は、他のウイルスによる疾患に対する防御にも有用であると考えられる。
短鎖脂肪酸の新規治療標的およびウイルス感染症に対する次世代プロバイオティクスとしての可能性
SCFAには抗ウイルス作用があるため、SARS-CoV-2の大流行を食い止めるために使用することを検討する価値がありそうです。臓器機能不全、バリアリーク、不規則なサイトカイン分泌は、この呼吸器症候群の症状である[218], [219]. SARS-CoV-2感染は、A型インフルエンザウイルスと同様に、ヒトや動物モデルで腸内細菌の異常を引き起こす[220]。腸内細菌叢によるSCFA合成の減少は、A型インフルエンザ及びSARS-CoV-2の両方の感染に関連している[220]。前述のように、SCFAは、エフェクターT細胞活性及びISG発現を増強することにより、抗ウイルス機能を高める可能性がある。その結果、SCFAは、RSV感染で示されるように、SARS-CoV-2のウイルス量を減少させる可能性がある。加えて、SCFAは、炎症反応(特に感染部位)を減少させ、上皮膜を強化する可能性がある[220]。したがって、COVID-19の動物モデルにおけるSCFAの治療効果を調査し、ヒトに有用であるかどうかを調べることが急務である。
最近の臨床調査では、全血中のFFAR2受容体発現が高い敗血症患者は、30日間の生存期間が長いことが判明した[221]。天然または合成リガンドを用いて FFAR2 を調節することで、感染予防が改善される可能性がある。食生活の変化は、循環系におけるSCFAレベルを押し上げ、疾患の転帰を変える可能性がある。感染症におけるFFAR2の変化は、興味深いものである。SCFAの特異的な免疫調節作用を特定するためには、さらなる研究が必要である。これは、免疫反応の改善は、感染症時には有利であるが、炎症性腸疾患(IBD)のような慢性炎症関連疾患を悪化させる可能性があるためである。Galapagosら[222]は、ヒトFFAR2特異的阻害剤であるGLPG0974を、IBD潰瘍性大腸炎の治療薬として第1相および第2相臨床試験で評価しました。GLPG0974は実験室では有望視されたものの、最終的には意図した臨床目標を達成することができず、挫折してしまったのです。一方、GLPG0974は、炎症組織への好中球の動員および移動を阻害したことから、ヒト白血球のFFAR2調節がヒト患者に影響を与える可能性が示唆された[223]。FFAR2の広範な誘導は感染症対策に有益であるが,代謝や脳機能など他の生理的メカニズムにFFAR2が関与するため,いくつかの負の影響を及ぼす可能性がある[222].しかしながら,FFAR2の一過性の修飾は,重症敗血症を含む生命を脅かす状態において,免疫応答を増強し,感染症の予後を改善するための治療アプローチとなる可能性がある.
現在、体内のSCFAsレベルを修正する(ほとんどの場合、増加させる)方法として、プレバイオティクス、プロバイオティクス、およびその両方の組み合わせという3つの主要な方法がある[220]。摂取することができるプロバイオティクスとして知られる生きた細菌は、健康に良い影響を与える[224]。プレバイオティクスは、吸収される前に細菌が腸内で分解する可能性のある微量栄養素(通常は食物繊維)である。プロバイオティクスおよびプレバイオティクスは、微生物叢の増殖および代謝機能にも影響を与える可能性がある [225]、[226]。これらのプロセスは完全には解明されていないが、前臨床実験では、プロバイオティクス、プレバイオティクス、またはそれらの混合物が呼吸器感染症に対する抵抗力を高めることが示されている [227], [228]。ほとんどのプロバイオティクスは乳酸菌で構成されており、SCFA産生腸内細菌の増殖を刺激する可能性がある[229]。Lactobacillus rhamnosusとLactobacillus gasseriは、RSVだけでなくインフルエンザからマウスを防ぐかもしれない[226], [227], [230]. 同様に、プロバイオティクス療法は、細菌性呼吸器疾患を減少させることが示されている[15]、[210]、[231]、[232]。プレバイオティクスは、動物実験によれば、RSVおよびインフルエンザ感染に対する免疫を改善する[15]、[210]。免疫反応の制御とSCFA産生の増加がこの上昇に関連していた。プレバイオティクスは、研究[233]、[234]によると、若い年齢で呼吸器感染症から子供を保護する可能性があります。優れた方法は、プロバイオティクスとプレバイオティクスを組み合わせることです。この手法はCOVID-19についても研究されており、現在プロバイオティクスを用いた臨床研究では、患者や医療従事者のウイルス量、不定愁訴期間、ウイルス排泄量について調査しています[224]。
呼吸器感染症の低減や予防のために,補完代替医療が世界的に提唱されている.プロバイオティクスは、ウイルス性呼吸器感染症の治療の可能性として提案されています。世界保健機関(WHO)および国連食糧農業機関(FAO)は、健康への好ましい影響を引き出す可能性のある細菌として説明しています[235]。宿主の腸内細菌叢と宿主の免疫系との間の相互作用において健全な均衡を維持し、感染性病原体に対する抵抗力を増加させる可能性があることが示されている[236]。この結果として、呼吸器系に影響を与えるウイルス感染症の予防と治療の両方の方法として提案されている[237]。この文脈で、次世代プロバイオティクス(NGP)は、急性上気道感染症を最小限に抑えることが報告されている[235]。[235]. NGPは、呼吸器系ウイルス感染症と戦うことができる新しい抗ウイルス化合物の発見を容易にする可能性を持っている。
SCFAs、γ-アミノ酪酸、インドール、二次胆汁酸などの代謝産物は、腸内の微生物叢によって産生される。二次胆汁酸や酪酸は,COVID-19 などのウイルス性呼吸器感染症の治療への可能性が示されている代謝産物である [235].酢酸は、Akkermansia muciniphila、Lactobacillus属、Bacteroides属、Bifidobacterium属など多くの細菌によって生成され、プロピオン酸は、Roseburia inulinivorans、Bacteroides属、Salmonella属、Veillonella属によって合成される [32], [238].酪酸は、Roseburia属、Faecalibacterium prausnitzii属、およびEubacterium rectale属によって生産される。 腸内の微生物相とその代謝物、特にSCFAsが、炎症反応および感染に対する宿主の防御に影響を与える可能性を示す証拠が存在する。免疫系は酪酸の影響を受けている可能性がある。さらに、結腸細胞に重要なエネルギーを供給し、健康な腸管バリアの成長と維持を促進します[239]。酪酸産生菌は、研究対象者のウイルス性下気道感染症(LRTI)の可能性を減少させた [240]。酪酸は、ヒストンデアセチラーゼを阻害することによって、マウスの肺のIL-10を回復させることが示されている[241]。しかし、酪酸は、肺のような遠隔臓器の健康と機能を維持する役割も担っている。インフルエンザ感染による酪酸またはプロピオン酸は、肺のリンパ球抗原6C(Ly6C)単球の増加をもたらす[242]。これらの単球は、活性化によりマクロファージに分化し、好中球化学誘引物質(CXCL1)のレベルが低くなる。この結果、好中球の流入が減少し、最終的にインフルエンザによる肺疾患の危険性が低くなる[235]。腸内細菌叢の形態と機能は、SARS-CoV-2に対する異なるグループの個人の感受性の基礎となる生物学的プロセスの可能性がある。ヒト腸管由来のNGPは、肺の微生物叢を回復させ、肺の免疫力を向上させる可能性を持っています。いくつかの研究で示されているように、消化器系と呼吸器系はつながっています。この2つの器官間の相互作用の可能性は、血流を通して運ばれる可溶性微生物代謝産物によって媒介されている可能性があります。消化管内微生物叢は、二次胆汁酸やSCFAを含む幅広い代謝産物を分泌しています。NGPは、腸内細菌の変化を調節したり、肺で作用する化合物を分泌することで、免疫反応を回復させる可能性があります。呼吸器系ウイルス疾患全体にプロバイオティクスが有効である可能性を考えると、SARS-CoV-2疾患における治療としての使用は研究されるべきであろう。しかし、これらのNGPまたはその代謝物のウイルス性疾患との闘いへの応用の可能性については、さらなる研究が必要である。
結論と今後の方向性
過去10年間で、腸内細菌叢が、腸の局所的および全身的にウイルス感染症に大きく影響することがますます明らかになってきた。ウイルス感染症の制御における微生物叢由来化合物の機能についての認識が高まっているが、腸管内の常在菌が腸管ウイルス感染症に様々な直接的影響を与える可能性があることはよく知られている。代謝産物は、腸管上皮を通過して循環系に拡散する能力があるため、腸管外の部位での感染に対する宿主の反応を変化させることができる。この点に関して議論され続けている概念の一つは、微生物叢が産生するSCFAsの抗ウイルスあるいは抗ウィルス活性が、モデル系と調査対象のウィルスに依存するということである。新規で強力な抗ウイルス剤の開発は、微生物叢によって生成されたSCFAがウイルス感染に影響を与える分子メカニズムや、これらの反応の非常に多様な性質をより良く理解することから恩恵を受ける可能性がある。
細菌が生成するSCFAがウイルス感染症の発症や重症化に影響を与えるという証拠が次々と得られている。しかし、SCFAの作用機序は複雑であり、またその作用の発揮方法も状況に大きく依存する。SCFAの生理的特性を深く理解することは、FFARアゴニズムに基づく効率的な薬理学的アプローチを開発するために不可欠である。この理解を深めることが必要である。一方、局所および全身のSCFA濃度を変化させるプレバイオティクスおよびプロバイオティクスの使用は有益であると思われる。人における決定的な証拠はないが、微生物叢によって生成されるSCFAは、様々な健康障害の予防や治療のための治療薬としての可能性があることを示唆する実験データが存在する。これは、個人における決定的なエビデンスがないにもかかわらずです。SCFA療法は多くの疾患の治療に有望であるが、より大規模な臨床試験でその有効性が確認されるまでは、常用することを推奨することはできない。SCFA投与におけるこの一貫性のなさは、SCFAを大腸に送達するための独自のターゲティング技術の必要性を強調しており、それにより、より信頼性の高い正確な投与が可能になると考えられる。これらのプロセスでは微生物叢および代謝の不均一性が重要な役割を果たすため、宿主の基質およびエネルギー代謝に根本的に影響を与える可能性のある栄養および身体活動の要素を標準化するか、少なくとも評価する必要がある。さらに、メタゲノミクス、メタトランススクリプトミクス、メタボロミクス、エピジェネティクスにおける先進的なアプローチにより、SCFAsの個人への影響に関する情報が得られるかもしれない。SCFAsはヒトの栄養、恒常性、抵抗性に影響を与え、細菌の体力に影響を与える可能性があるため、宿主にも影響を与える可能性がある。ウイルスによる感染症は世界的に罹患率や死亡率に大きな影響を及ぼしており、その関連する感受性メカニズムの解明とSCFAを用いた治療法の開発が不可欠である。
資金提供
本研究は、吉林省自然科学基金(No.3D5222852429)「superenhancer regulates the phenotype of gastric cancer cells through LMNA gene and its mechanism」というプロジェクトの支援を受けて実施された。
CRediTの著者による貢献声明
Chongchong Fengは、研究デザインに参加し、ドラフトを書き、文書資料を収集した。Zecheng YangとKexin Liuは、原稿執筆、調査、図表作成に参加した。Chengxun Jinは概念設計に参加し、原稿を執筆した。最終的な原稿は全著者が読み、承認した。
利益相反に関する声明
著者らは、利益相反の申告はしていない。
謝辞
なし。
参考文献
[1]
R. Mirzaei, B. Bouzari, S.R. Hosseinii-Fard, M. Mazaheri, Y. Ahmadyousefi, M. Abdi, S. Jalalifar, Z. Karimitabar, A. Teimoori, H. Keyvani
神経系疾患における微生物相由来短鎖脂肪酸の役割
Biomed. Pharmacother., 139 (2021), Article 111661
PDFを見る記事を見るScopusGoogle Scholarで見る
[2]
R. Mirzaei, A. Afaghi, S. Babakhani, M.R. Sohrabi, S.R. Hosseinii-Fard, K. Babolhavaeji, S.K.A. Akbari, R. Yousefimashouf, S. Karampoor
癌の発生と予防における微生物叢由来の短鎖脂肪酸の役割
Biomed. Pharmacother., 139 (2021), Article 111619
PDFを見る記事を見るScopusGoogle Scholarで見る
[3]
R. Mirzaei, E. Dehkhodaie, B. Bouzari, M. Rahimi, A. Gholestani, S.R. Hosseini-Fard, H. Keyvani, A. Teimoori, S. Karampoor
微生物叢由来の短鎖脂肪酸の宿主および病原体に対する二重の役割
Biomed. Pharmacother., 145 (2022), Article 112352
PDFを見る記事を見るScopusGoogle Scholarで見る
[4]
S.A. Jasim, M.J.C. Opulencia, A.A. Ramírez-Coronel, W.K. Abdelbasset, M.H. Abed, A. Markov, G.R.L. Al-Awsi, J.A. Shamsiev, A.T. Hammid, M.N. Shalaby
免疫代謝における微生物叢由来の短鎖脂肪酸の新たな役割
Int. Immunopharmacol., 110 (2022), Article 108983
Google Scholar
[5]
J. コン、シュウ、チャン
宿主の健康と疾患における腸内細菌叢由来の短鎖脂肪酸
Nutrients, 14 (9) (2022)
Google Scholar
[6]
M. Rudiansyah, S.A. Jasim, B.S. Azizov, V. Samusenkov, W.K. Abdelbasset, G. Yasin, H.J. Mohammad, M.A. Jawad, T. Mahmudiono, S.R. Hosseini-Fard
IBD治療におけるマイクロバイオームベースの新たなアプローチ。SCFAsからウロリチンAまで
J. Dig. Dis. (2022)
Google Scholar
[7]
N.I. Wirusanti、M.T. Baldridge、V.C. Harris
インターフェロンシグナルを介したウイルス感染症の微生物学的制御
Trends Microbiol, 30 (8) (2022), pp.778-792
PDFを見る記事を見るScopusGoogle Scholarで見る
[8]
B. バン デル ヒー、J.M. ウェルズ
短鎖脂肪酸による宿主生理の微生物による制御
Trends Microbiol, 29 (8) (2021), pp.700-712.
PDFを見る記事を見るScopusGoogle Scholarで見る
[9]
C.H.キム
腸内細菌叢由来の短鎖脂肪酸によるリンパ球の機能制御
Cell Mol. Immunol., 18 (5) (2021), pp.1161-1171.
CrossRefView in ScopusGoogleスカラー
[10]
S. デリュー、K.マチエルス、J.レーズ、K.フェルベケ、S.フェルメイア
短鎖脂肪酸とその生産生物:IBDの見落とされた治療法?
EBioMedicine, 66 (2021), Article 103293
PDFを見る記事を見るScopusGoogle Scholarで見る
[11]
K. 今井 浩二、落合 浩二、岡本 哲也
歯周病菌Porphyromonas gingivalisによるHIV-1潜伏感染の再活性化にはヒストン修飾が関与していること
J. Immunol. (Baltim. Md. 1950), 182 (6) (2009), pp.3688-3695
CrossRefView in ScopusGoogle Scholar
[12]
K. 今井宏樹, 井上博之, 田村誠, M.E. Cueno, 井上博之, 武市修一, 草間賢一, 斎藤一, 落合和弘
歯周病菌Porphyromonas gingivalisはヒストン修飾によりEpstein-Barrウイルス溶解スイッチトランザクティベータZEBRAを誘導する。
バイオキミー, 94 (3) (2012), pp.839-846
PDFを見る記事を見るScopusGoogle Scholarで見る
[13]
M. ケムドゥパティ, A.D. ケニー, A.C. スミス, R.J. フィリンジャー, L. チャン, A. ザニ, S.L. リュー, M.Z. アンダーソン
酪酸はインターフェロン刺激による特異的発現をリプログラムする
Genes, 94 (16) (2020)
Google Scholar
[14]
L.B. Pascoal, P.B. Rodrigues, L.M. Genaro, A. Gomes, D.A. Toledo-Teixeira, P.L. Parise, K. Bispo-Dos-Santos, C.L. Simeoni, P.V. Guimarães, L.I. Buscaratti, J.G.A. Elston, H. Marques-Souza, D. Martins-de-Souza, M.L.S. Ayrizono, L.A. Velloso, J.L. Proenca-Modena, P.M.M. Moraes-Vieira, M.A.S. Mori, A.S. Farias, M.A.R. Vinolo, R.F.Leal.
微生物叢由来の短鎖脂肪酸は、ヒト大腸サンプルのSARS-CoV-2感染を妨げない
13 (1) (2021), pp.1-9
CrossRefView in ScopusGoogle Scholar
[15]
A. Trompette, E.S. Gollwitzer, C. Pattaroni, I.C. Lopez-Mejia, E. Riva, J. Pernot, N. Ubags, L. Fajas, L.P. Nicod, B.J. Marsland
食物繊維はLy6c(-)パトロール単球の造血およびCD8(+)T細胞の代謝を形成することにより、インフルエンザに対する防御を与える。
イミュニティ, 48 (5) (2018), pp.992-1005
e8
ScopusGoogle Scholarで見る
[16]
J. タン、C.マッケンジー、M.ポタミティス、A.N.ソーバーン、C.R.マッケイ、L.マキア
健康および疾病における短鎖脂肪酸の役割
アドバンス・イムノル, 121 (2014), pp.91-119
PDFを見る記事を見るScopusGoogle Scholarで見る
[17]
J.M. Wong, R. De Souza, C.W. Kendall, A. Emam, D.J. Jenkins
大腸の健康:発酵と短鎖脂肪酸
J. Clin. Gastroenterol., 40 (3) (2006), pp.235-243.
CrossRefView in ScopusGoogle Scholar
[18]
H. 桑原彰彦、大友良英、加地郁夫、田中亮、唐木誠一郎
短鎖脂肪酸受容体GPR41とGPR43の大腸機能への役割
J. Physiol. Pharm. 59, Suppl 2 (2008), pp.251-262
ScopusGoogle Scholarで見る
[19]
R. ブルマー
総説:大腸機能に対する酪酸の役割
Aliment Pharm. Ther., 27 (2) (2008), 記事 104119
Google Scholar
[20]
A.P. Halestrap、M.C. Wilson
モノカルボン酸トランスポーターファミリー-役割と調節機構
IUBMB Life, 64 (2) (2012), pp.109-119
CrossRefView in ScopusGoogle Scholar
[21]
V. Ganapathy, E. Gopal, S. Miyauchi, P.D. Prasad
腫瘍抑制因子候補であるSLC5A8の生物学的機能
Biochem. Soc. Trans., 33 (1) (2005), pp.237-240.
ScopusGoogle Scholarで見る
[22]
S. Sivaprakasam、P.D.Prasad、N.Singh
炎症と発癌における短鎖脂肪酸とその受容体の有用性
Pharm. Ther., 164 (2016), pp.144-151.
PDFを見る記事を見るScopusGoogle Scholarで見る
[23]
D. ワンダース、E.C. グラフ、R.L. ジャッド
GPR109AおよびGPR81遺伝子発現に対する高脂肪食の影響
Biochem. Biophys. Res. Commun., 425 (2) (2012), pp.278-283.
PDFを見る記事を見るScopusGoogle Scholarで見る
[24]
K.M. Maslowski、A.T. Vieira、A. Ng、J. Kranich、F. Sierro、D. Yu、H.C. Schilter、M.S. Rolph、F. Mackay、D. Artis、R.J. Xavier、M.M. Teixeira、C.R. Mackay
腸内細菌叢と化学誘引物質受容体GPR43による炎症反応の制御
ネイチャー, 461 (7268) (2009), pp.1282-1286
CrossRefView in ScopusGoogle Scholar
[25]
I. 木村聡、井上大輔、前田拓也、原隆史、市村明彦、宮内正喜、小林正樹、平沢明彦、辻本巖
短鎖脂肪酸とケトンはGタンパク質共役型受容体41 (GPR41) を介して交感神経系を直接制御する
Proc. Natl. Acad. Sci. USA, 108 (19) (2011), pp.8030-8035
CrossRefView in ScopusGoogle Scholar
[26]
L.A. Stoddart, N.J. Smith, L. Jenkins, A.J. Brown, G. Milligan
遊離脂肪酸受容体2および遊離脂肪酸受容体3の膜貫通ドメインV、VI、VIIの保存された極性残基は、短鎖脂肪酸の結合および機能に必要である
J. Biol. Chem., 283 (47) (2008), pp.32913-32924
PDFを見る記事を見るCrossRefを見る in ScopusGoogle Scholar
[27]
M. このように、GPR109Aは、GMP(General Rights Management System)の一種である。
GPR109A は細菌発酵産物である酪酸の G タンパク質共役型受容体で、大腸の腫瘍抑制因子として機能する。
Cancer Res., 69 (7) (2009), pp.2826-2832.
ScopusGoogle Scholarで見る
[28]
R. Corrêa-Oliveira, J.L. Fachi, A. Vieira, F.T. Sato, M.A.R. Vinolo
短鎖脂肪酸による免疫細胞機能の制御
Clin. Transl. Immunol., 5 (4) (2016), Article e73
CrossRefView in ScopusGoogleスカラー
[29]
P.M. Smith, M.R. Howitt, N. Panikov, M. Michaud, C.A. Gallini, M. Bohlooly-y, J.N. Glickman, W.S. Garrett
微生物代謝産物である短鎖脂肪酸が大腸Treg細胞のホメオスタシスを制御する
サイエンス, 341 (6145) (2013), pp.569-573
CrossRefView in ScopusGoogle Scholar
[30]
L. マキア、タン、ヴィエイラ、リーチ、スタンレー、ルオン、丸屋、マッケンジー、土方、ウォン
メタボリックシンドローム受容体GPR43とGPR109Aはインフラマソームの制御を通じて食物繊維による腸のホメオスタシスを促進する
Nat. Commun., 6 (1) (2015), pp.1-15
Google Scholar
[31]
M. Sun, W. Wu, L. Chen, W. Yang, X. Huang, C. Ma, F. Chen, Y. Xiao, Y. Zhao, C. Ma.
微生物叢由来の短鎖脂肪酸はTh1細胞IL-10産生を促進し、腸のホメオスタシスを維持する
Nat. Commun., 9 (1) (2018), pp.1-15
Google Scholar
[32]
A. コー、F.デヴァダー、P.コヴァチェヴァ-ダッチャリー、F.ベッケド
食物繊維から宿主生理まで:重要な細菌代謝産物としての短鎖脂肪酸
セル, 165 (6) (2016), pp.1332-1345
PDFを見る記事を見るScopusGoogle Scholarで見る
[33]
R. シルデリンク、C. ベルサイデン、W.J. デ ヨンゲ
腸管免疫とホメオスタシスにおけるヒストン脱アセチル化酵素の食事性阻害剤
Front. Immunol., 4 (2013), p.226.
Google Scholar
[34]
S.L. Russell, M.J. Gold, M. Hartmann, B.P. Willing, L. Thorson, M. Wlodarska, N. Gill, M.R. Blanchet, W.W. Mohn, K.M. McNagny
幼少期の抗生物質による微生物相の変化は、アレルギー性喘息への感受性を高める
EMBO Rep., 13 (5) (2012), pp.440-447
CrossRefGoogle Scholar
[35]
A. Cait, M. Hughes, F. Antignano, J. Cait, P. Dimitriu, K. Maas, L. Reynolds, L. Hacker, J. Mohr, B. Finlay
微生物が引き起こすアレルギー性肺炎は短鎖脂肪酸によって改善される
粘膜免疫学, 11 (3) (2018), pp.785-795
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[36]
A. トロンペット、E.S.ゴルウィッツァー、K.ヤダヴァ、A.K.シシェルスティール、N.シュレンガー、C.ゴンブル、C.ブランチャード、T.ジュント、L.P.ニコッド、N.L.ハリス
食物繊維の腸内細菌叢代謝はアレルギー性気道疾患と造血に影響する
Nat. Med., 20 (2) (2014), pp.159-166
CrossRefView in ScopusGoogleスカラー
[37]
Z. アル・ナバニ、S・デュラロワ、R・マルケス、C・クース、S・アル・ブーニー、F・デジャルダン、T・スパルワッサー、M・ベラール、N・サーフ=ブッセサン、G・エベール
成体における免疫病理学的抵抗性には、微生物叢に対する離乳期の反応が必要である
イミュニティ, 50 (5) (2019), pp.1276-1288
e5
ScopusGoogle Scholarで見る
[38]
J.L. マッカヴィル、G.Y. チェン、V.D. クエバス、K. トロハ、J.S. エアーズ
健康と疾患における微生物叢の代謝産物
Annu. Rev. Immunol., 38 (2020), pp.147-170
CrossRefView in ScopusGoogle Scholar
[39]
F. リベラ=チャベス、L.F.チャン、F.フェイバー、C.A.ロペス、M.X.ビンドロス、E.E.オルサン、G.シュー、E.M.ベラスケス、C.B.レブリージャ、S.E.ウインター
腸内細菌叢から酪酸産生性クロストリジウムを枯渇させると、好気性ルーメンにサルモネラの増殖が促進される
セルホスト・マイクロビー, 19 (4) (2016), pp.443-454
PDFを見る記事を見るGoogle Scholar
[40]
A. ジェイコブソン、L. ラム、M. ラジェンドラム、F. タンブリーニ、J. ハニーカット、T. ファム、W. ヴァントレン、K. プルス、S.R. ステーブラー、K. ルゴ
腸内常在菌が産生する代謝産物がサルモネラ菌感染に対するコロニー形成抵抗性を媒介する
セルホスト・マイクロベ、24 (2) (2018), pp.296-307
e7
ScopusGoogle Scholarで見る
[41]
Y.P.シルバ、A.ベルナルディ、R.L.フロッツァ
腸内細菌叢由来の短鎖脂肪酸が腸脳コミュニケーションに果たす役割
Front. Endocrinol., 11 (2020), p.25.
ScopusGoogle Scholarで見る
[42]
X. Guan、W. Li、H. Meng
諸刃の剣。口腔と消化管における酪酸の役割
Mol. Oral Microb., 36 (2) (2021), pp.121-131
CrossRefView in ScopusGoogle Scholar
[43]
K. 今井 圭介,落合 浩二,岡本 哲也
歯周病菌Porphyromonas gingivalisによるHIV-1潜伏感染の再活性化にはヒストン修飾が関与していること
J. Immunol., 182 (6) (2009), pp.3688-3695.
CrossRefView in ScopusGoogle Scholar
[44]
K. 今井秀樹, 井上浩之, 田村正, M.E. Cueno, 井上浩之, 武市修一, 草間賢一, 斎藤一, 落合和裕
歯周病菌Porphyromonas gingivalisはヒストン修飾によりEpstein-Barrウイルス溶解スイッチトランザクティベータZEBRAを誘導する。
バイオキミー, 94 (3) (2012), pp.839-846
PDFを表示する記事を表示するScopusGoogle Scholarで表示する
[45]
K.C.K. Poelaert, J. Van Cleemput, K. Laval, S. Descamps, H.W. Favoreel, H.J. Nauwynck
腸の本能を超えて:代謝性短鎖脂肪酸がαヘルペスウイルスの病原性を調節する
フロント・マイクロバイオル, 10 (2019), p.723
ScopusGoogle Scholarで見る
[46]
D. ベッラ
ウイルスの付着と侵入における細胞接着分子の役割、ロンドン王立協会の哲学的取引(philosophical transactions of the Royal Society of London
Ser.B Biol. Sci., 370 (2015) (1661), p. 20140035
Google Scholar
[47]
I. スパコバ、I.デ・ブーク、P.A.ブロン、P.デルプッテ、S.ルベール
呼吸器系ウイルス感染症に対する局所的な微生物治療薬
Trends Mol. Med., 27 (6) (2021), pp.538-553
PDFを見る記事を見るScopusGoogle Scholarで見る
[48]
Z. Wang, W. Chai, M. Burwinkel, S. Twardziok, P. Wrede, C. Palissa, B. Esch, M.F. Schmidt
Enterococcus faeciumの豚インフルエンザウイルス増殖に対するin vitroでの抑制効果
PloS One, 8 (1) (2013)
e53043
Google Scholar
[49]
H.-W. チェン、P.-F. Liu, Y.-T. Liu, S. Kuo, X.-Q. Zhang, R.T. Schooley, H. Rohde, R.L. Gallo, C.-M. Huang
鼻腔内常在菌Staphylococcus epidermidisはインフルエンザウイルスに対抗する
Sci. Rep., 6 (1) (2016), pp.1-12
Google Scholar
[50]
C. バンドーロ、J.A.ランスタドラー
細菌リポ多糖はインフルエンザウイルスを不安定化させる
MSphere, 2 (5) (2017), pp.e00267-17
Google Scholar
[51]
A.K. Berger、H. Yi、D.B. Kearns、B.A. Mainou
細菌と細菌のエンベロープ成分が哺乳類レオウィルスの耐熱性を高める
PLoS Pathog., 13 (12) (2017), Article e1006768
CrossRefView in ScopusGoogleスカラー
[52]
C.M. Robinson、P.R. Jesudhasan、J.K. Pfeiffer
細菌リポ多糖の結合はビリオンの安定性を高め、腸管ウイルスの環境適応力を促進する
セルホスト・マイクロビー, 15 (1) (2014), 36-46頁
PDFを見る記事を見るScopusGoogle Scholarで見る
[53]
D.P. Via、S. Sramek、G. Larriba、S. Steiner
マウス肉腫ウイルス感染ラット細胞の膜糖鎖に及ぼす酪酸ナトリウムの影響
J. Cell Biol., 84 (2) (1980), pp.225-234.
ScopusGoogle Scholarで見る
[54]
T. 高林、吉田、井本、R.P.Schleimer、藤枝、S.
鼻粘膜におけるSARS-CoV-2受容体angiotensin converting enzyme 2の発現制御、American
J. Rhinol. Allergy, 36 (1) (2022), pp.115-122.
CrossRefView in ScopusGoogle Scholar
[55]
M. Hoffmann, H. Kleine-Weber, S. Schroeder, N. Krüger, T. Herrler, S. Erichsen, T.S. Schiergens, G. Herrler, N.-H. Wu, A. Nitsche
SARS-CoV-2の細胞侵入はACE2およびTMPRSS2に依存し、臨床的に証明されたプロテアーゼ阻害剤によって阻止される
Cell, 181 (2) (2020), pp.271-280
e8
ScopusGoogle Scholarで見る
[56]
P. Zhou, X.-L. Yang, X.-G. Wang, B. Hu, L. Zhang, W. Zhang, H.-R. Si, Y. Zhu, B. Li, C.-L. Huang. 朱 昱、李 喆、黄 慈朗
コウモリ由来と思われる新型コロナウイルスに関連した肺炎の発生
Nature, 579 (7798) (2020), pp.270-273
CrossRefGoogle Scholar
[57]
S.J. Brake、K. Barnsley、W. Lu、K.D. McAlinden、M.S. Eapen、S.S. Sohal
喫煙はアンジオテンシン変換酵素2受容体をアップレギュレートする:新規コロナウイルスSARS-CoV-2(Covid-19)の接着部位となる可能性
MDPI (2020), p. 841
CrossRefView in ScopusGoogle Scholar
[58]
S. ブニャヴァニッチ、A.ドー、A.ビセンシオ
小児および成人におけるアンジオテンシン変換酵素2の鼻腔内遺伝子発現について
Jama, 323 (23) (2020), pp.2427-2429
CrossRefView in ScopusGoogle Scholar
[59]
D. ボロニーニ、A.B.トービン、G.ミリガン、C.E.モス
短鎖脂肪酸の受容体の薬理と機能
Mol. Pharmacol., 89 (3) (2016), pp.388-398.
CrossRefView in ScopusGoogleスカラー
[60]
Y. 井本、加藤 淳、高林 崇、坂下 正樹、J. Norton、L. Suh、R. Carter、A. Weibman、K. Hulse、W. Stevens
短鎖脂肪酸はGPR41&43を介して気道上皮細胞の組織プラスミノーゲンアクチベータを誘導する
Clin. Exp. アレルギー, 48 (5) (2018), pp.544-554
CrossRefView in ScopusGoogleスカラー
[61]
R. ゾンマーシュタイン、M.M.コーヘン、F.H.メッサーリ、C.グラーニ
コロナウイルス症2019(COVID-19):アンジオテンシン変換酵素阻害薬/アンジオテンシン受容体拮抗薬は二相性を持つか?
J. Am. Heart Assoc., 9 (7) (2020), 記事 e016509
ScopusGoogle Scholarで見る
[62]
J. リー、E.M.リチャーズ、E.M.ハンドバーグ、C.J.ペピン、M.K.ライザダ
正常血圧ラットの腸管上皮オルガノイドにおいて、酪酸がCOVID-19関連遺伝子を制御する
高血圧, 77 (2) (2021), pp.e13-e16
ScopusGoogle Scholarで見る
[63]
N. Li, W.T. Ma, M. Pang, Q.L. Fan, J.L. Hua
常在菌の微生物叢とウイルス感染:包括的レビュー
フロント・イムノア, 10 (2019), p.1551
ScopusGoogle Scholarで見る
[64]
M.K. Jones、M. Watanabe、S. Zhu、C.L. Graves、L.R. Keyes、K.R. Grau、M.B. Gonzalez-Hernandez, N.M. Iovine, C.E. Wobus, J. Vinjé, S.A. Tibbetts, S.M. Wallet、S.M. Karst
腸内細菌はヒトおよびマウスノロウイルスのB細胞への感染を促進する
サイエンス, 346 (6210) (2014), pp.755-759
CrossRefView in ScopusGoogle Scholar
[65]
M. Li, E.M. McGhee, L. Shinno, K. Lee, Y.L. Lin.
微生物代謝物である酪酸への曝露は、ヒトパピローマウイルス16 E6/E7不死化ケラチノサイトのin vivoでの生存時間を延長し、増殖パターンを変化させる。
Am. J. Pathol., 191 (10) (2021), pp.1822-1836
PDFを見る記事を見るScopusGoogle Scholarで見る
[66]
M. シェフナー、B.A.ウェルネス、J.M.ホイブレグツ、A.J.レバイン、P.M.ハウリー
ヒトパピローマウイルス16型および18型にコードされるE6オンコプロテインは、p53の分解を促進する
セル, 63 (6) (1990), pp.1129-1136
PDFを見る記事を見るGoogle Scholar
[67]
M. Scheffner, K. Münger, J.M. Huibregtse, P.M. Howley
ヒトパピローマウイルスE7-E6融合タンパク質によるレチノブラストーマタンパク質の標的型分解
エンボジャパン, 11 (7) (1992), pp.2425-2431
CrossRefView in ScopusGoogle Scholar
[68]
S. Duensing, L.Y. Lee, A. Duensing, J. Basile, S. Piboonniyom, S. Gonzalez, C.P. Crum, K. Munger
ヒトパピローマウイルス16型E6およびE7オンコプロテインは、セントロソーム重複を細胞分裂周期から切り離すことにより、協力して分裂異常とゲノム不安定性を誘発する
Proc. Natl. Acad. Sci. USA, 97 (18) (2000), pp.10002-10007
ScopusGoogle Scholarで見る
[69]
A.E. White、E.M. Livanos、T.D. Tlsty
HPVオンコプロテインによる正常ヒト線維芽細胞のゲノム完全性と細胞周期制御の差異的破壊
Genes Dev., 8 (6) (1994), pp.666-677.
CrossRefView in ScopusGoogle Scholar
[70]
R.A. DeFilippis, E.C. Goodwin, L. Wu, D. DiMaio
内在性ヒトパピローマウイルスE6およびE7タンパク質は、HeLa子宮頸がん細胞における増殖、老化、およびアポトーシスを異なる方法で制御している。
J. Virol., 77 (2) (2003), pp.1551-1563
ScopusGoogle Scholarで見る
[71]
S.M. Horner、R.A. DeFilippis、L. Manuelidis、D. DiMaio
ヒトパピローマウイルスE6遺伝子の抑制は、HeLa子宮頸がん細胞においてp53依存性、テロメラーゼ非依存性の老化およびアポトーシスを開始させる
J. Virol., 78 (8) (2004), pp.4063-4073
ScopusGoogle Scholarで見る
[72]
A. Jensen, H. Fagö-Olsen, C.H. Sørensen, M. Kilian(イェンセン、ファゴー・オルセン、C.H.ソレンセン、M.キリアン
健康状態および扁桃炎再発に関連する扁桃クリプト微生物叢の種レベルまでの分子マッピング
PLoS One, 8 (2) (2013), 記事e56418
CrossRefView in ScopusGoogle Scholar
[73]
N. セガタ、S.K.ハーケ、P.マンノン、K.P.レモン、L.ウォルドロン、D.ゲバース、C.ハッテンハワー、J.イザール
7つの口腔表面、扁桃腺、咽頭および便サンプルに基づく成人消化管内細菌群の構成
ゲノムバイオロジー, 13 (6) (2012), p. R42
CrossRefView in ScopusGoogle Scholar
[74]
S.J. O'Keefe
食事、微生物およびその代謝産物、そして大腸がん
Nat. Rev. Gastroenterol. Hepatol., 13 (12) (2016), pp.691-706
CrossRefView in ScopusGoogleスカラー
[75]
S.E.プライド、S.H.ダンカン、G.L.ホールド、C.S.スチュワート、H.J.フリント
ヒト大腸における酪酸生成の微生物学的研究
FEMS Microbiol Lett., 217 (2) (2002), pp.133-139.
PDFを見る記事を見るScopusGoogle Scholarで見る
[76]
A.Z. Decrion-Barthod、M. Bosset、M.L. Plissonnier、A. Marchini、M. Nicolier、S. Launay、 J.L. Prétet、J. Rommelaere、 C. Mougin
UCN-01を添加した酪酸ナトリウムは子宮頸がん細胞に対して顕著な抗腫瘍活性を示す
抗がん剤研究, 30 (10) (2010), pp.4049-4061
ScopusGoogle Scholarで見る
[77]
Z. を使用することで、より効果的な治療が可能となる。
[酪酸ナトリウムのヒトパピローマウイルスによる不死化食道上皮の悪性化に対するプロモーター効果].
中华冰.李雪沢.智慧. J. Pathol., 31 (4) (2002), pp.327-330
ScopusGoogle Scholarで見る
[78]
M.B. Carper, S. Troutman, B.L. Wagner, K.M. Byrd, S.R. Selitsky, K. Parag-Sharma, E.C. Henry, W. Li, J.S. Parker, S.A. Montgomery, J.L. Cleveland, S.E. Williams, J.L. Kissil, D.N. Hayes, A.L. Amelio.
HPV16(+)頭頸部扁平上皮癌の免疫不全マウスモデル
セル・リップ, 29 (6) (2019), pp.1660-1674
e7
ScopusGoogle Scholarで見る
[79]
E.L.フランコ、L.L.ヴィラ、J.P.ソブリノ、J.M.プラド、M.C.ルソー、M.デシー、T.E.ローハン
子宮頸癌の高リスク地域の女性における子宮頸部ヒトパピローマウイルス感染の獲得とクリアランスの疫学的研究
J. Infect. Dis., 180 (5) (1999), pp.1415-1423
ScopusGoogle Scholarで見る
[80]
S. Shanmugasundaram、J. You
ヒトパピローマウイルスの持続感染をターゲットにする
ウイルス, 9 (8) (2017)
Google Scholar
[81]
S.D. Ma、S. Hegde、K.H. Young、R. Sullivan、D. Rajesh、Y. Zhou、E. Jankowska-Gan, W.J. Burlingham, X. Sun, M.L. Gulley, W. Tang, J.E. Gumperz, S.C. Kenney
エプスタイン・バー・ウイルス感染の新しいモデルから、リンパ腫の発生における初期の溶菌性ウイルスタンパク質の発現の重要な役割が明らかになった
J. Virol., 85 (1) (2011), pp.165-177
ScopusGoogle Scholarで見る
[82]
S. 浅井, 中村由紀夫, 山村雅彦, 池澤秀樹, 並河郁夫
口腔内細菌培養液に含まれる短鎖脂肪酸のEpstein-Barrウイルス誘導能に関する定量的解析
Arch. Virol., 119 (3-4) (1991), pp.291-296.
ScopusGoogle Scholarで見る
[83]
K.L. Gorres、D. Daigle、S. Mohanram、G. Miller
短鎖および中鎖脂肪酸によるEpstein-Barr VirusおよびKaposi sarcoma associated herpesvirusの溶血サイクルの活性化および抑制
J. Virol., 88 (14) (2014), pp.8028-8044
ScopusGoogle Scholarで見る
[84]
S.H.スペック、T.チャティラ、E.フレミントン
エプスタイン・バー・ウイルスの再活性化:BZLF1遺伝子の制御と機能
Trends Microbiol., 5 (10) (1997), pp.399-405.
PDFを見る記事を見るScopusGoogle Scholarで見る
[85]
A. Faggioni, C. Zompetta, S. Grimaldi, G. Barile, L. Frati, J. Lazdins
カルシウム調節による潜伏感染細胞でのEpstein-Barrウイルスゲノムの活性化
Science, 232 (4757) (1986), pp.1554-1556
CrossRefView in ScopusGoogle Scholar
[86]
E. フレミントン、S.H.スペック
Epstein-Barrウイルス溶解スイッチ遺伝子BZLF1のプロモーターにおけるフォルボール・エステル応答要素の同定
J. Virol., 64 (3) (1990), pp.1217-1226
CrossRefView in ScopusGoogle Scholar
[87]
T. 鶴見俊輔、藤田稔、工藤明彦
潜伏性・溶解性Epstein-Barrウイルス複製戦略
Rev. Med. Virol., 15 (1) (2005), pp.3-15
ScopusGoogle Scholarで見る
[88]
K. 高田、清水直樹、佐久間聡、小野義人
EBV DNA断片のトランスフェクションによる潜在性Epstein-Barrウイルス(EBV)ゲノムの活性化
J. Virol., 57 (3) (1986), pp.1016-1022.
CrossRefView in ScopusGoogle Scholar
[89]
H. 井上博之、坪田一男、小野正樹、木津祐一郎、水野文彦、高田和久、山田耕一、柳賢一、林祥平、斉藤一郎
シェーグレン症候群における臓器特異的自己抗原に対するEBV介在性フォドリン切断の関与の可能性
J. 免疫学, 166 (9) (2001), pp.5801-5809
CrossRefView in ScopusGoogle Scholar
[90]
A. 田中 浩二, 重松 弘, 小島 正, 坂下 浩, 草間 圭司
成人スティル病患者に発症したメトトレキサート関連リンパ増殖性障害
J. Oral. Maxillofac. Surg., 66 (7) (2008), pp.1492-1495.
PDFを見る記事を見るScopusGoogle Scholarで見る
[91]
G. Frumento
第三者ドナーを用いたEBV関連疾患に対する養子縁組T細胞免疫療法の前臨床開発
バーミンガム大学、(2018)
Google Scholar
[92]
J.K. カントリーマン、L. グラドヴィル、G. ミラー
ヒストン脱アセチル化酵素阻害剤による潜伏期間破壊に不応なエプスタインバーウイルス感染細胞株では、溶血サイクル制御遺伝子のプロモーター上でヒストンの過アセチル化が起こる
J. Virol., 82 (10) (2008), pp.4706-4719
ScopusGoogle Scholarで見る
[93]
T. 村田稔彦、堀田直樹、遠山晋一、中山晋一、千葉晋一、磯村浩二、大島毅、神田知也、鶴見知也
Epstein-Barr ウイルス BZLF1 タンパク質のスモイル化による転写抑制とヒストン脱アセチル化酵素の会合との関連性
J. Biol. Chem., 285 (31) (2010), pp.23925-23935
PDFを見る記事を見るScopusGoogle Scholarで見る
[94]
H. Gruffat, E. Manet
A. Sergeant, EBV即時型遺伝子BZLF1におけるMEF2を介したクラスII HDACのリクルートメントが潜伏とクロマチンリモデリングを関連付ける
EMBO Rep., 3 (2) (2002), pp.141-146
ScopusGoogle Scholarで見る
[95]
S. リウ、P. リウ、A. ボラス、T. チャティラ、S.H. スペック
エプスタイン・バー・ウイルスの溶解スイッチのサイクロスポリンA感受性誘導は、MEF2ファミリーメンバーが関与する新規経路を介する。
EMBO J., 16 (1) (1997), pp.143-153
ScopusGoogle Scholarで見る
[96]
L. Gradoville, D. Kwa, A. El-Guindy, G. Miller(グラドビル、D. クワ、A. エル・グインディ、G. ミラー
プロテインキナーゼC非依存的なEpstein-Barrウイルス溶解サイクルの活性化
J. Virol., 76 (11) (2002), pp.5612-5626
ScopusGoogle Scholarで見る
[97]
W.-h Feng、S.C. Kenney
バルプロ酸はEBV陽性腫瘍の化学療法の効果を、溶解性ウイルス遺伝子発現の増加によって高める
Cancer Res., 66 (17) (2006), pp.8762-8769.
ScopusGoogle Scholarで見る
[98]
A.K. Saemundsen, B. Kallin, G. Klein
Epstein-Barrウイルスに潜伏感染した細胞における細胞およびウイルスのDNA合成に対するn-酪酸の影響
Virology, 107 (2) (1980), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
[99]
S.J. Mentzer、J. Fingeroth、J.J. Reilly、S.P. Perrine、D.V. Faller
Epstein-Barr-Virus関連リンパ腫におけるアルギニン酪酸によるガンシクロビル感受性の誘導
血球,分子,疾患,24 (2) (1998), pp.114-123
PDFを見る記事を見るScopusGoogle Scholarで見る
[100]
S.A.ウィリアムズ、W.C.グリーン
HIVの統合後潜伏を制御する宿主因子
Trends Microbiol., 13 (4) (2005), pp.137-139.
PDFを見る記事を見るCrossRefGoogle Scholar
[101]
W.C. Greene、B.M. Peterlin
HIVの細胞内における驚くべき航海の記録。将来の治療へのパスポートとしての基礎科学
Nat. Med., 8 (7) (2002), pp.673-680.
ScopusGoogle Scholarで見る
[102]
E. Verdin、D.Nase I-ハイパーセンシティブ(Nase I-hypersensitive
の遺伝子内エンハンサーに関連している。
J. Virol., 65 (12) (1991), pp.6790-6799
CrossRefView in ScopusGoogle Scholar
[103]
P.L. Sheridan、T.P. Mayall、E. Verdin、K.A. Jones
ヒストンアセチルトランスフェラーゼはin vitroでHIV-1エンハンサー活性を制御する
Genes Dev., 11 (24) (1997), pp.3327-3340
CrossRefView in ScopusGoogle Scholar
[104]
E.I. Golub、G. Li、D.J. Volsky
酪酸ナトリウムによる休眠HIV-1の誘導:HIV-1プロモーターの活性化におけるTATAボックスの関与
AIDS (Lond., Engl. ), 5 (6) (1991), pp.663-668
CrossRefView in ScopusGoogle Scholar
[105]
A. マルチェロ
潜伏期間:HIV-1の隠れた課題
レトロバイオロジー, 3 (1) (2006), pp.1-9
Google Scholar
[106]
G. Marzio、M. Giacca
HIV-1遺伝子発現のクロマチン制御
Struct. Biol. Funct. Genom. (1999), pp.205-216
CrossRefView in ScopusGoogle Scholar
[107]
M. Lusic, A. Marcello, A. Cereseto, M. Giacca
LTRプロモーターにおけるヒストンアセチル化と因子リクルートメントによるHIV-1遺伝子発現の制御
EMBO J., 22 (24) (2003), pp.6550-6561
ScopusGoogle Scholarで見る
[108]
J.J. Coull, F. Romerio, J.-M. Sun, J.L. Volker, K.M. Galvin, J.R. Davie, Y. Shi, U. Hansen, D.M. Margolis
ヒト因子YY1およびLSFはヒストン脱アセチル化酵素1のリクルートメントを介してヒト免疫不全ウイルス1型ロングターミナルリピートを抑制する
J. Virol., 74 (15) (2000), pp.6790-6799
ScopusGoogle Scholarで見る
[109]
S.A. Williams, L.F. Chen, H. Kwon, C.M. Ruiz-Jarabo, E. Verdin, W.C. Greene
NF-κB p50はHDACの動員および転写開始の抑制を介してHIVの潜伏を促進する
EMBO J., 25 (1) (2006), pp.139-149
CrossRefView in ScopusGoogle Scholar
[110]
D.M. Neumann、P.S. Bhattacharjee、J.M. Hill
酪酸ナトリウム:眼球モデルにおける単純ヘルペスウイルス1型のin vivo再活性化の化学的誘導剤
J. Virol., 81 (11) (2007), pp.6106-6110.
ScopusGoogle Scholarで見る
[111]
C. Clement, P.S. Bhattacharjee, M. Kumar, T.P. Foster, H.W. Thompson, J.M. Hill.
酪酸処理後のHSV-1潜伏TGにおけるマウス遺伝子のアップレギュレーションは、LAT-ICP0遺伝子座の複数の役割を示唆している
Invest. Ophthalmol. Vis. Sci., 52 (3) (2011), pp.1770-1779
CrossRefView in ScopusGoogle Scholar
[112]
R.J. Danaher, R.J. Jacob, M.R. Steiner, W.R. Allen, J.M. Hill, C.S. Miller.
ヒストン脱アセチル化酵素阻害剤は、神経細胞において潜伏期関連転写物非依存的に単純ヘルペスウイルス1型の再活性化を誘導する
J. Neurovirology, 11 (3) (2005), pp.306-317
CrossRefView in ScopusGoogle Scholar
[113]
D.C. Bloom, G.B. Devi-Rao, J.M. Hill, J.G. Stevens, E.K. Wagner.
単純ヘルペスウイルス1型のエピネフリンによる潜伏感染ウサギの再活性化過程における生体内分子生物学的解析
J. Virol., 68 (3) (1994), pp.1283-1292.
CrossRefView in ScopusGoogle Scholar
[114]
X. Shen, L. Yin, X. Pan, R. Zhao, D. Zhang
豚流行性下痢ウイルス感染による豚腸管上皮細胞の細胞周期の阻害とアポトーシスの誘導
Micro Pathog., 147 (2020), Article 104378
PDFを見る記事を見るScopusGoogle Scholarで見る
[115]
X. Huang, W. Liu, J. Zhang, Z. Liu, M. Wang, L. Wang, H. Zhou, Y. Jiang, W. Cui, X. Qiao, Y. Xu, Y. Li, L. Tang
強毒性感染性滑液包病ウイルスによる免疫傷害は、腓骨包の炎症、アポトーシス、炎症性サイトカインのアンバランスに関与している。
Dev. Comp. Immunol., 114 (2021), Article 103839
PDFを見る記事を見るScopusGoogle Scholarで見る
[116]
X. Mao, C. Gu, H. Hu, J. Tang, D. Chen, B. Yu, J. He, J. Yu, J. Luo, G. Tian(マオ、グー、ヒュ、タン、チェン、ルオ、ティエン
ラクトバチルス・ラムノサスGGの食事による補給は、豚ロタウイルスに感染した離乳子豚の腸の粘膜バリア機能を改善する。
PLoS One, 11 (1) (2016), Article e0146312
CrossRefView in ScopusGoogleスカラー
[117]
X. マオ、フー、シャオ、チェン、ユウ、ヘー、ユウ、鄭、ルオ、ルオ、ワンの各氏
レンチナン投与による離乳子豚モデルでのロタウイルスによる腸管バリア機能障害の緩和
フードファンクション, 10 (4) (2019), pp.2094-2101
CrossRefView in ScopusGoogleスカラー
[118]
Q. Zhang、Y. Xu、R. Chang、D. Tong、X. Xu
伝達性胃腸炎ウイルスNタンパク質は小胞体ストレスを引き起こし、ブタ腸管上皮細胞におけるインターロイキン8の発現とその細胞内局在をアップレギュレートする
Res. Vet. Sci., 119 (2018), pp.109-115
PDFを見る記事を見るGoogle Scholar
[119]
J. ターピン、E. フルマンス、W. ハラビ、J.G. ハダド、C. エル カラムーニ、P. デプレ、P. クレイビッチ トロット、W. ヴィラナイクン
ジカウイルスによるUPR活性化中のA549細胞におけるシャペロンGRP78/BiP発現の転覆
バイオキミー, 175 (2020), pp.99-105
PDFを見る記事を見るScopusGoogle Scholarで見る
[120]
J.D.マルホトラ、R.J.カウフマン
小胞体とアンフォールドドタンパク質反応
Semin. Cell Dev. Biol., 18 (6) (2007), pp.716-731
PDFを見る記事を見るScopusGoogle Scholarで見る
[121]
郭怡浩、王怡、白怡、劉茂、王赫朗
メタンフェタミンによる慢性肺障害における小胞体ストレスとPERK-eIF2α-CHOPシグナルを介したアポトーシス
Environ. Toxicol. Pharm., 49 (2017), pp.194-201
PDFを見る記事を見るScopusGoogle Scholarで見る
[122]
K.D. マッカロー、J.L. マーティンデール、L.O. クロッツ、T.Y. アウ、N.J. ホルブルック
Gadd153は、Bcl2のダウンレギュレーションと細胞のレドックス状態の乱れによって、細胞を小胞体ストレスに感作させる
Mol. Cell Biol., 21 (4) (2001), pp.1249-1259
ScopusGoogle Scholarで見る
[123]
H. Puthalakath, L.A. O'Reilly, P. Gunn, L. Lee, P.N. Kelly, N.D. Huntington, P.D. Hughes, E.M. Michalak, J. McKimm-Breschkin, 本山直樹, 後藤哲, S. Akira, P. Bouillet, A. Strasser
小胞体ストレスはBH3のみからなるタンパク質Bimの活性化によりアポトーシスを誘発する
Cell, 129 (7) (2007), pp.1337-1349
PDFを見る記事を見るScopusGoogle Scholarで見る
[124]
N. カタンサロ、X.J.Meng
アンフォールドタンパク質応答(UPR)の誘導はブタ繁殖・呼吸器症候群ウイルス(PRRSV)の複製を抑制する
Virus Res., 276 (2020), Article 197820
PDFを見る記事を見るScopusGoogle Scholarで見る
[125]
Z. 重実、馬場由紀夫、原直樹、松廣壽一、香川博之、渡辺恒夫、藤室正人
原発性滲出液リンパ腫におけるERストレスのunfolded protein response、細胞生存率、ウイルス複製への影響
Biochem. Biophys. Res. Commun., 469 (3) (2016), pp.565-572.
PDFを見る記事を見るScopusGoogle Scholarで見る
[126]
X. Liu, C. Jiang, G. Liu, P. Wang, M. Shi, M. Yang, Z. Zhong, S. Ding, Y. Li, B. Liu, Y. Cao
酪酸ナトリウムは、PPARγにより制御されたKlothoの発現を上昇させることにより、ヒト髄核細胞の酸化ストレスから保護する。
Int Immunopharmacol., 85 (2020), Article 106657
PDFを見る記事を見るScopusGoogle Scholarで見る
[127]
A. セカバト、J.M.サン、J.R.デイビー
トリコスタチンAと酪酸によるヒストン脱アセチル化酵素活性の競合的阻害
Biochem. Cell. Biol. = Biochim. Et. Biol. 細胞, 85 (6) (2007), pp.751-758
ScopusGoogle Scholarで見る
[128]
L. 酪酸ナトリウムは、高脂肪食によって誘発される心筋梗塞を予防する。
酪酸ナトリウムのII型糖尿病マウスにおける高脂肪食誘発性心機能障害および代謝異常に対する保護効果
J. セルバイオケム, 118 (8) (2017), pp.2395-2408
CrossRefView in ScopusGoogleスカラー
[129]
Y. Hu, J. Liu, Y. Yuan, J. Chen, S. Cheng, H. Wang, Y. Xu
酪酸ナトリウムは小胞体ストレスのPERK-CHOP経路を阻害することにより2型糖尿病を緩和する
Environ. Toxicol. Pharm., 64 (2018), pp.112-121
PDFを見る記事を見るScopusGoogle Scholarで見る
[130]
Y. Zhao、N. Hu、Q. Jiang、L. Zhu、M. Zhang、J. Jiang、M. Xiong、M. Yang、J. Yang、L. Shen、S. Zhang、L. Niu、L. Chen、D. Chen
IPEC-J2細胞におけるロタウイルス誘発小胞体ストレスによるアポトーシスに対する酪酸ナトリウムのPERK-eIF2αシグナル伝達経路を介した保護効果
J. Anim. Sci. Biotechnol., 12 (1) (2021), p.69.
PDFを見る記事を見るCrossRefGoogle Scholar
[131]
V. ガナパシー、M.タンガラジュ、P.D.プラサード、P.M.マーティン、N.シン
短鎖脂肪酸のトランスポーターとレセプターが大腸菌と宿主の間の分子的リンクとなる
Curr. Opin. Pharmacol., 13 (6) (2013), pp.869-874.
PDFを見る記事を見るScopusGoogle Scholarで見る
[132]
C.C.ブラッド、C.タン、S.オッフェルマンズ
エネルギー代謝産物に対するGタンパク質共役型受容体の新しい治療標的としての役割
Nat. Rev. Drug Discov., 11 (8) (2012), pp.603-619
CrossRefView in ScopusGoogle Scholar
[133]
酪酸ナトリウムが炎症を抑制することを明らかにした。
酪酸ナトリウムはTNBS誘発炎症性腸疾患マウスにおいて炎症を抑制し、上皮のバリア性を維持する。
EBioMedicine, 30 (2018), pp.317-325
PDFを見る記事を見るScopusGoogle Scholarで見る
[134]
S. エランゴバン、R・パタニア、S・ラマチャンドラン、S・アナンス、R・N・パディア、L・ラン、N・シン、P・M・マーチン、L・ホーソーン、P・D・プラサード、V・ガナパシー、M・タンガラジュ
ナイアシン/酪酸受容体GPR109Aは細胞生存を抑制することにより乳腺腫瘍の発生を抑制する
キャンサーレジデンス, 74 (4) (2014), pp.1166-1178
ScopusGoogle Scholarで見る
[135]
N. シン、A. グラフ、S. シバプラカサム、E. ブレイディ、R. パディア、シ、M. タンガラジュ、P. D. プラサド、S. マニカッサミー、D.H. マン、J.R. リー、S. オファーマンズ、V. ガナパシー
ナイアシンおよび常在菌代謝物酪酸の受容体であるGpr109aの活性化は、大腸の炎症および発がんを抑制する
イミュニティ, 40 (1) (2014), pp.128-139
PDFを見る記事を見るCrossRefを見る in ScopusGoogle Scholar
[136]
W. Feng, Y. Wu, G. Chen, S. Fu, B. Li, B. Huang, D. Wang, W. Wang, J. Liu
酪酸ナトリウムは離乳子豚の下痢を抑制し、GPR109A依存的に大腸のタイトジャンクションタンパク質の発現を促進させる。
Cell. 生理科学・生化学: Int. J. Exp. Cell. Physiol., Biochem., Pharmacol., 47 (4) (2018), pp.1617-1629
CrossRefView in ScopusGoogleスカラー
[137]
A. トロンペット、E.S.ゴルウィッツァー、C.パッタローニ、I.C.ロペス-メヒア、E.リバ、J.ペルノ、N.ウバッグ、L.ファジャス、L.P.ニコド、B.J.マーズランド
食物繊維はLy6c-パトローリング単球の造血とCD8+T細胞の代謝を形成することにより、インフルエンザに対する防御を与える。
イミュニティ, 48 (5) (2018), pp.992-1005
e8
ScopusGoogle Scholarで見る
[138]
A. ミラード、P.メルテス、D.イッテレ、F.ヴィラール、P.ジャンヌソン、J.ベルナール
酪酸は、ヒト単球由来樹状細胞およびマクロファージの分化、成熟および機能に影響を及ぼす
Clin. Exp. Immunol., 130 (2) (2002), pp.245-255
ScopusGoogle Scholarで見る
[139]
P.V. Chang, L. Hao, S. Offermanns, R. Medzhitov
微生物代謝物である酪酸はヒストン脱アセチル化酵素の阻害を介して腸管マクロファージの機能を調節する
Proc. Natl. Acad. Sci., 111 (6) (2014), pp.2247-2252
CrossRefView in ScopusGoogleスカラー
[140]
M.A. Vinolo、E. Hatanaka、R.H. Lambertucci、P. Newsholme、R. Curi
好中球のエフェクター機構に対する短鎖脂肪酸の効果
Cell. Biochem. Funct: Cell. Biochem. Modul. Act. Agents Or. Dis., 27 (1) (2009), pp.48-55
CrossRefView in ScopusGoogle Scholar
[141]
N. アルパイア、C. キャンベル、X. ファン、S. ディキイ、J. ファン デル ビーケン、P. デロウス、H. リュー、J.R. クロス、K. プフェッファー、P.J. コファー
常在菌が産生する代謝産物は、末梢性制御性T細胞の生成を促進する
ネイチャー, 504 (7480) (2013), pp.451-455
CrossRefView in ScopusGoogle Scholar
[142]
M.D.バック、D.O.サリバン、E.L.ピアース
T細胞の代謝が免疫を動かす
J. Exp. Med., 212 (9) (2015), pp.1345-1360
CrossRefView in ScopusGoogleスカラー
[143]
D. オサリバン、E.L.ピアース
治療のためのT細胞代謝の標的化
トレンド・イミュノル, 36 (2) (2015), pp.71-80
PDFを見る記事を見るGoogle Scholar
[144]
S.R. Jacobs、C.E. Herman、N.J. MacIver、J.A. Wofford、H.L. Wieman、J.J. Hammen、J.C. Rathmell
グルコースの取り込みはT細胞の活性化において制限的であり、CD28を介したAkt依存性および独立性の経路を必要とする
J. Immunol., 180 (7) (2008), pp.4476-4486
CrossRefGoogle Scholar
[145]
A.J. Marko, R.A. Miller, A. Kelman, K.A. Frauwirth
刺激されたTリンパ球におけるグルコース代謝の誘導は、マイトジェン活性化プロテインキナーゼシグナルによって制御される
PloS One, 5 (11) (2010), Article e15425
CrossRefView in ScopusGoogle Scholar
[146]
G. Den Besten, K. Van Eunen, A.K. Groen, K. Venema, D.-J. Reijngoud, B.M. Bakker
食事、腸内細菌叢、宿主のエネルギー代謝間の相互作用における短鎖脂肪酸の役割
J. Lipid Res., 54 (9) (2013), pp.2325-2340.
PDFを見る記事を見るScopusGoogle Scholarで見る
[147]
C.C.Blad, C.Tang, S.Offermanns
エネルギー代謝産物に対するGタンパク質共役型受容体の新しい治療標的としての役割
Nat. Rev. Drug Discov., 11 (8) (2012), pp.603-619
CrossRefView in ScopusGoogle Scholar
[148]
M. キム・チエ、J・パーク、C.H.・キム
腸内細菌の代謝産物は宿主の抗体反応を促進する
セルホストマイクロビー, 20 (2) (2016), pp.202-214
PDFを見る記事を見るScopusGoogle Scholarで見る
[149]
M.L. Balmer、E.H. Ma、G.R. Bantug、J. Grählert、S. Pfister、T. Glatter、A. Jauch、S. Dimeloe、E. Slack、P. Dehio
メモリーCD8+ T細胞は、最適な機能を発揮するために、ストレスによって誘導された酢酸濃度の増加を必要とする
イミュニティ, 44 (6) (2016), pp.1312-1324
PDFを見る記事を見るScopusGoogle Scholarで見る
[150]
D.J. Delgado-Diaz, D. Tyssen, J.A. Hayward, R. Gugasyan, A.C. Hearps, G. Tachedjian
最適および非最適の膣内細菌叢に関連する乳酸および短鎖脂肪酸によって子宮膣上皮細胞から誘発される異なる免疫応答
Front. Cell. Infect. Microbiol., 9 (2019), p. 446
Google Scholar
[151]
P. ミルモンセフ、M.R.ザリファード、D.ギルバート、H.マキンデ、A.L.ランデイ、G.T.スピアー
短鎖脂肪酸は単独およびtoll様受容体リガンドとの併用で炎症性サイトカイン産生を誘導する
Am. J. Reprod. Immunol. (N. Y. N. Y.: 1989), 67 (5) (2012), pp.391-400
CrossRefView in ScopusGoogle Scholar
[152]
E. アマベベ、D.O.C.アヌンバ
女性の腸内細菌と生殖器細菌によるクロストークと短鎖脂肪酸の免疫後遺症への影響の違い
フロント・イムノア, 11 (2020), p.2184
ScopusGoogle Scholarで見る
[153]
P. セルホースト、L. マッソン、S.D. イスマイル、N. サムスンダー、N. ギャレット、L.E. マンスール、Q. アブドゥールカリム、S.S. アブドゥールカリム、 J.S. パスモア、C. ウィリアムソン
子宮頸管炎症は感染力の弱いHIV亜型の獲得を促進する
Clin. Infect. Dis: Off. Publ. Infect. Dis. Soc. Am., 64 (1) (2017), pp.79-82
CrossRefView in ScopusGoogleスカラー
[154]
F.D. バー、C. オクセンバウアー、C.R. ウィラ、M. ロドリゲス=ガルシア
好中球細胞外トラップは女性生殖器におけるHIV感染を防ぐ
Mucosal Immunol., 11 (5) (2018), pp.1420-1428
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[155]
T. 齊藤 淳、駒野 淳、齊藤 祐子、三澤 徹、高濱 正、小崎 孝、上畑 孝、岩崎 裕、大森 寛、山岡 聡、山本 直樹、櫻井 孝夫
好中球細胞外トラップはヒト免疫不全ウイルス-1に対する宿主防御応答を媒介する
Cell host Microbe, 12 (1) (2012), pp.109-116
PDFを見る記事を見るScopusGoogle Scholarで見る
[156]
V. ブリンクマン、U. ライヒャルト、C. グースマン、B. フォーラー、Y. ウーレマン、D.S. ワイス、Y. ワインラウフ、A. ジークリンスキー
好中球の細胞外トラップが細菌を殺す
サイエンス, 303 (5663) (2004), pp.1532-1535
ScopusGoogle Scholarで見る
[157]
K.B. Arnold, A. Burgener, K. Birse, L. Romas, L.J. Dunphy, K. Shahabi, M. Abou, G.R. Westmacott, S. McCorrister, J. Kwatampora, B. Nyanga, J. Kimani, L. Masson, L.J. Liebenberg, S.S. Abdool Karim, J.A. Passmore, D.A. Lauffenburger, R. Kaul, L.R. McKinnon
女性生殖器における炎症性サイトカインレベルの上昇は、プロテアーゼ、粘膜バリアー蛋白質の発現の変化、およびHIV感受性標的細胞の流入と関連している
粘膜免疫学, 9 (1) (2016), pp.194-205
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[158]
S.R.ファン、X.P.リュー、Q.P.リャオ
細菌性膣炎女性の膣洗浄液中のヒトディフェンシンおよびサイトカインについて
Int. J. Gynaecol. Obstet: オフ。臓器Int. Fed. Gynaecol. Obstet., 103 (1) (2008), pp.50-54
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[159]
P. レビンソン、R. コール、J. キマニ、E. ングギ、S. モーゼス、K.S. マクドナルド、K. ブロリデン、T. ヒルボド
性器液中の自然免疫因子レベル:αディフェンシンおよびLL-37と性器感染症およびHIV獲得増加との関連性
エイズ, 23 (3) (2009), pp.309-317
ScopusGoogle Scholarで見る
[160]
E. Le Poul、C. Loison、S. Struyf、J.Y. Springael、V. Lannoy、M.E. Decobecq、S. Brezillon、V. Dupriez、G. Vassart、J. Van Damme、M. Parmentier、M. Detheux
短鎖脂肪酸に対するヒト受容体の機能的特徴および多形核細胞活性化におけるその役割について
J. Biol. Chem., 278 (28) (2003), pp.25481-25489
PDFを見る記事を見るScopusGoogle Scholarで見る
[161]
F.J. Carrillo-Salinas、S. Parthasarathy、L. Moreno de Lara、A. Borchers、C. Ochsenbauer
短鎖脂肪酸は年齢依存的に好中球の抗ウィルス機能を低下させる
Cells, 11 (16) (2022)
Google Scholar
[162]
S. アル・ムシュリフ、A.エリー、B.M.ジョーンズ
嫌気性菌由来の有機酸による走化性阻害は細菌性膣炎における膿性反応を防ぐ可能性がある
J. Med. Microbiol., 49 (11) (2000), pp.1023-1030.
CrossRefView in ScopusGoogle Scholar
[163]
A.N. Chaudry, P.J. Travers, J. Yuenger, L. Colletta, P. Evans, J.M. Zenilman, A. Tummon
細菌性膣炎の治療を受けている患者における膣酢酸の分析
J. Clin. Microbiol., 42 (11) (2004), pp.5170-5175
ScopusGoogle Scholarで見る
[164]
P. Mirmonsef, D. Gilbert, M.R. Zariffard, B.R. Hamaker, A. Kaur, A.L. Landay, G.T. Spear
女性生殖器における自然免疫反応に対する常在菌の影響
Am. J. Reprod. Immunol. (N. Y., N. Y.: 1989), 65 (3) (2011), pp.190-195
CrossRefView in ScopusGoogle Scholar
[165]
J. Yoon, A. Terada, H. Kita
CD66bはヒト好酸球の接着と活性化を制御する
J. Immunol. (Baltim., Md.: 1950), 179 (12) (2007), pp.8454-8462
CrossRefView in ScopusGoogle Scholar
[166]
I. Dransfield, A.M. Buckle, J.S. Savill, A. McDowall, C. Haslett, N. Hogg
好中球のアポトーシスはCD16(FcγRIII)発現の低下と関連している
J. Immunol. (Baltim., Md.: 1950), 153 (3) (1994), pp.1254-1263
CrossRefView in ScopusGoogle Scholar
[167]
M. カサノバ・アセベス、C・ピタバル、L・A・ワイス、C・ノンベラ・アリエッタ、R・シェーヴル、他。
好中球クリアランスを介した造血ニッチのリズミカルなモジュレーション
Cell, 153 (5) (2013), pp.1025-1035
PDFを見る記事を見るGoogle Scholar
[168]
D. Zhang, G. Chen, D. Manwani, A. Mortha, C. Xu, J.J. Faith, R.D. Burk, Y. Kunisaki, J.E. Jang, C. Scheermann, M. Merad, P.S. Frenette
好中球の老化はマイクロバイオームによって制御されている
ネイチャー, 525 (7570) (2015), pp.528-532
Google Scholar
[169]
J. ベギーニ、P.C.ジラルド、R.リボルディ、R.L.アマラル、J.エレウテリオ・ジュニア、S.S.ウィトキン、F.ギマランイス
女性膣炎患者の膣内好中球におけるCD16発現の変化
Eur. J. Obstet.・Gynecol.・Reprod. Biol., 167 (1) (2013), pp.96-99
PDFを見る記事を見るScopusGoogle Scholarで見る
[170]
D. モルディング、J.A.クエール、R.E.ストリンガー、C.A.ハート、S.W.エドワード
酪酸ナトリウムによる好中球のアポトーシスの制御
Biol: J. Int. Assoc. Biol. Stand., 24 (4) (1996), pp.301-306.
PDFを見る記事を見るScopusGoogle Scholarで見る
[171]
M. 青山真一, 小谷淳一, 宇佐美満隆
酪酸およびプロピオン酸はHDAC阻害剤活性を介して活性化または非活性化好中球のアポトーシスを誘導するが、GPR-41/GPR-43経路を活性化することはない
Nutr. Burbank, Los Angel Cty. カリフォルニア州、26 (6) (2010), pp.653-661
PDFを見る記事を見るScopusGoogle Scholarで見る
[172]
C. シルベストレ-ロイグ、A.イダルゴ、O.ソーンレイン
好中球の不均一性:ホメオスタシスと病態への影響、血液
J. Am. Soc. Hematol., 127 (18) (2016), pp.2173-2181.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[173]
Y. Yao, X. Cai, W. Fei, Y. Ye, M. Zhao, C. Zheng(ヤオ、X.カイ、W.フェイ、Y.イェ、M.ザオ、C.チェン
短鎖脂肪酸の免疫、炎症および代謝における役割
Crit. Rev. Food Sci. Nutr., 62 (1) (2022), pp.1-12.
Google Scholar
[174]
J.W. Anderson、P. Baird、R.H. Davis、S. Ferreri、M. Knudtson、A. Koraym、V. Waters、C.L. Williams
食物繊維の健康効果
Nutr. Rev., 67 (4) (2009), pp.188-205.
CrossRefView in ScopusGoogle Scholar
[175]
D.J.モリソン、T.プレストン
腸内細菌叢による短鎖脂肪酸の形成とヒトの代謝への影響
腸内細菌, 7 (3) (2016), pp.189-200
CrossRefView in ScopusGoogleスカラー
[176]
D. サンブリア、E.バーバー、B.T.ラウス
プロピオン酸ナトリウムを食事に補充すると、ウイルス性免疫炎症性病変の重症度が抑制される
J. Virol., 95 (4) (2021)
Google Scholar
[177]
C. ジョンストン、L.コリー
単純ヘルペスウイルス感染症の最新概念:生殖器管内排菌の診断と病原性
Clin. Microbiol. Rev., 29 (1) (2016), pp.149-161
CrossRefGoogle Scholar
[178]
P.S.ビスワス、B.T.ラウス
HSV角膜炎の初期イベント--盲点となる疾患の舞台を設定する
微生物感染症, 7 (4) (2005), pp.799-810
PDFを見る記事を見るScopusGoogle Scholarで見る
[179]
B.T.ラウス、S.スヴァス
制御細胞と感染性因子:友好的な関係と逆行する関係
J. Immunol. (Baltim. Md.: 1950), 173 (4) (2004), pp.2211-2215
CrossRefView in ScopusGoogle Scholar
[180]
T.L. Keadle, J.L. Morris, J.S. Pepose, P.M. Stuart(キール、モリス、ペポーズ、スチュアート
CD4(+)およびCD8(+)細胞はマウスにおける再発性角膜ヘルペスの発症に重要な役割を果たす。
Micro Pathog., 32 (6) (2002), pp.255-262.
PDFを見る記事を見るScopusGoogle Scholarで見る
[181]
A. Suryawanshi, T. Veiga-Parga, N.K. Rajasagi, P.B. Reddy, S. Sehrawat, S. Sharma, B.T. Rouse.
単純ヘルペスウイルスによる角膜免疫病態におけるIL-17およびTh17細胞の役割
J. Immunol. (Baltim. Md.: 1950), 187 (4) (2011), pp.1919-1930
CrossRefView in ScopusGoogle Scholar
[182]
U. Jaggi, M. Yang
M2様マクロファージ応答が亢進した状態での貪食の増加は、HSV-1の初感染および潜伏感染の増加と相関している
infection, 16 (10) (2020), Article e1008971
CrossRefView in ScopusGoogle Scholar
[183]
S. スバス、A.K.アズクール、B.S.キム、U.クマラグル、B.T.ラウス
CD4+CD25+制御性T細胞はウイルス性免疫炎症性病変の重症度を制御する
J. Immunol. (Baltim., Md.: 1950), 172 (7) (2004), pp.4123-4132
CrossRefView in ScopusGoogle Scholar
[184]
P.P. Sarangi、S. Sehrawat、S. Suvas、B.T. Rouse
IL-10と自然制御性T細胞:単純ヘルペスウイルス誘発性眼球免疫病理における2つの独立した抗炎症機序
J. Immunol. (Baltim. Md.: 1950), 180 (9) (2008), pp.6297-6306
CrossRefView in ScopusGoogle Scholar
[185]
D.H. Lee, H. Ghiasi
単純ヘルペスウイルス1感染におけるM1マクロファージとM2マクロファージの役割
J. Virol., 91 (15) (2017) に掲載されました。
Google Scholar
[186]
A. Haghikia, S. Jörg, A. Duscha, J. Berg, A. Manzel, A. Waschbisch, A. Hammer, D.H. Lee, C. May, N. Wilck, A. Balogh, A.I. Ostermann, N.H. Schebb, D.A. Akkad, D.A. Grohme, M. Kleinewietfeld, S. Kempa, J. Thöne, S. Demir, D.N. Müller, R. Gold, R.A. Linker
食餌性脂肪酸は小腸を介して中枢神経系の自己免疫に直接影響を与える
イミュニティ, 43 (4) (2015), pp.817-829
PDFを見る記事を見るGoogle Scholar
[187]
M. 水野大輔、能登大輔、加賀直樹、千葉晃、三宅聡明
自己免疫疾患モデルの病態における短鎖脂肪酸の二重の役割
PLoS One, 12 (2) (2017), Article e0173032
CrossRefView in ScopusGoogleスカラー
[188]
D.M.モレンス、A.S.ファウチ
新興パンデミック病:COVID-19に至るまで
セル, 182 (5) (2020), pp.1077-1092
PDFを見る記事を見るScopusGoogle Scholarで見る
[189]
X. Xu, M. Han
トシリズマブによる重症COVID-19患者の有効な治療法
117 (20) (2020), pp.10970-10975
CrossRefGoogle Scholar
[190]
Z. Ye, Y. Wang, L.E. Colunga-Lozano, M. Prasad, W. Tangamornsuksan, B. Rochwerg, L. Yao, S. Motaghi, R.J. Couban, M. Ghadimi, M.M. Bala, H. Gomaa, F. Fang, Y. Xiao, G.H. Guyatt
COVID-19,他のコロナウイルス感染症,インフルエンザ,市中肺炎,急性呼吸窮迫症候群のエビデンスに基づくCOVID-19における副腎皮質ホルモンの有効性と安全性:系統的レビューとメタ解析
CMAJ Can. Med. Assoc. J. De. l'Assoc. Med. Can., 192 (27) (2020), pp.E756-e767
CrossRefGoogle Scholar
[191]
N.A. Prow, T.D.C. Hirata, B. Tang, T. Larcher, P. Mukhopadhyay, T.L. Alves, T.T. Le, J. Gardner, Y.S. Poo, E. Nakayama, V.P. Lutzky, H. I. Nakaya, A. Suhrbier
高繊維食と酪酸によるチクングニアウイルスリウマチ免疫病理の増悪
フロント・イムノア, 10 (2019), p.2736
ScopusGoogle Scholarで見る
[192]
X. Meng, H.Y. Zhou, H.H. Shen, E. Lufumpa, X.M. Li, B. Guo, B.Z. Li.
微生物-メタボライト-宿主軸、ヒト自己免疫の病態と治療における双方向作用
Autoimmun. Rev., 18 (5) (2019), pp.455-475.
PDFを見る記事を見るScopusGoogle Scholarで見る
[193]
M. リー、B.ヴァン・エッシュ、G.T.M.ワゲナー、J.ガーセン、G.フォルカート、P.A.J.ヘンリクス
短鎖脂肪酸の免疫細胞および内皮細胞に対するプロおよび抗炎症効果
Eur. J. Pharmacol., 831 (2018), pp.52-59
PDFを見る記事を見るCrossRefGoogle Scholar
[194]
M.A. Vinolo、G.J. Ferguson、S. Kulkarni、G. Damoulakis、K. Anderson、Y.M. Bohlooly、L. Stephens、P.T. Hawkins、R. Curi
SCFAはGPR43受容体を介してマウスの好中球の化学走性を誘導する
PLoS One, 6 (6) (2011), Article e21205
CrossRefView in ScopusGoogle Scholar
[195]
A. スールビア
チクングニヤのリウマチ症状:新たな概念と介入策
Nat. Rev. Rheumatol., 15 (10) (2019), pp.597-611.
CrossRefView in ScopusGoogleスカラー
[196]
A. ソアレス・シャノスキー、N.バプティスタ
チクングニアウイルスに急性感染した被験者のシステム分析
PLoS Pathog., 15 (6) (2019), Article e1007880
CrossRefView in ScopusGoogleスカラー
[197]
O. ソーンレイン、L.リンドボム
炎症の発症と消失における貪食細胞の連携
Nat. Rev. Immunol., 10 (6) (2010), pp.427-439
CrossRefView in ScopusGoogle Scholar
[198]
J. Wang
組織傷害と修復における好中球
セル・ティッシュ・リサーチ, 371 (3) (2018), pp.531-539
CrossRefView in ScopusGoogleスカラー
[199]
S.Y. キム、M.G. ナイル
創傷治癒におけるマクロファージ:活性化と可塑性
97 (3) (2019), pp.258-267
CrossRefView in ScopusGoogle Scholar (英語)
[200]
M. ルウ、A.ヴィセクルナ
短鎖脂肪酸:T細胞の免疫代謝を調節する細菌メッセンジャー
Eur. J. Immunol., 49 (6) (2019), pp.842-848.
CrossRefView in ScopusGoogleスカラー
[201]
H. ザオ・フレミング、A・ハンド、K・チャン、R・ポラック、A・ノースカット、D・ジェイコブ、S・ディサナイケ、K・P・ランボー
オピオイド危機を背景とした非ステロイド性抗炎症薬の術後合併症への影響
バーンズトラウマ、6(2018)、25頁
ScopusGoogle Scholarで見る
[202]
A.S. Wang, E.J. Armstrong, A.W. アームストロング
コルチコステロイドと創傷治癒:周術期における臨床的考察
Am. J. Surg., 206 (3) (2013), pp.410-417.
PDFを見る記事を見るScopusGoogle Scholarで見る
[203]
J. パーク、C.J.ゲルゲン
短鎖脂肪酸の慢性的な上昇は、T細胞を介した尿管炎と水腎症を誘発する
J. Immunol., 196 (5) (2016), pp.2388-2400.
CrossRefView in ScopusGoogleスカラー
[204]
J.P. Miles, J. Zou, M.V. Kumar, M. Pellizzon, E. Ulman, M. Ricci, A.T. Gewirtz, B. Chassaing
低脂肪食および高脂肪食に発酵性食物繊維を添加すると、黄砂誘発性急性大腸炎の重症度が増悪する。
Inflamm. Bowel Dis., 23 (7) (2017), pp.1133-1143
CrossRefView in ScopusGoogleスカラー
[205]
E.C. Borden, G.C. Sen, G. Uze, R.H. Silverman, R.M. Ransohoff, G.R. Foster, G.R. Stark
50歳になったインターフェロン:過去、現在、そして未来の生物医学への影響
Nat. Rev. Drug Discov., 6 (12) (2007), pp.975-990
CrossRefView in ScopusGoogle Scholar
[206]
F. マクナブ、K.メイヤー-バーバー、A.シャー、A.ワック、A.オガーラ
感染症におけるI型インターフェロン
Nat. Rev. Immunol., 15 (2) (2015), pp.87-103.
CrossRefView in ScopusGoogleスカラー
[207]
L. Ye, D. Schnepf
インターフェロン-λは自然免疫と適応的粘膜免疫応答をオーケストレーションする
19 (10) (2019), pp.614-625
CrossRefView in ScopusGoogleスカラー
[208]
K.L.ステファン、M.V.キム、岩崎敦子、D.L.カスパー
ウイルス感染に対する自然抵抗性の共存微生物叢による調節
Cell, 183 (5) (2020), pp.1312-1324
e10
ScopusGoogle Scholarで見る
[209]
M.C. Abt, L.C. Osborne, L.A. Monticelli, T.A. Doering, T. Alenghat, G.F. Sonnenberg, M.A. Paley, M.Antenus, K.L. Williams, J. Erikson, E.J. Wherry, D. Artis
自然免疫系の活性化閾値を調整する内在性細菌
免疫, 37 (1) (2012), pp.158-170
PDFを見る記事を見るScopusGoogle Scholarで見る
[210]
K.H. アントゥネス、J.L. ファチ、R. デ・パウラ、E.F. ダ・シルバ、L.P. プラル
微生物叢由来の酢酸は、GPR43タイプ1インターフェロン応答を通じて呼吸器合胞体ウイルス感染から保護される
Nat. Commun., 10 (1) (2019), p. 3273
ScopusGoogle Scholarで見る
[211]
K.H.アントゥネス、J.L.ファチ、R.デ・パウラ、E.F.ダ・シルバ、L.P.プラル、A.Á.ドスサントス、G.B.M.ディアス、J.E.バルガス、R.プガ、F.Q.メイアー、F.マイート、C.R.ザラテ-ブラデス、N.J.アヤミ、M.R.サンタナ、T.カンデレイバ、H.G.ロドリーグズ、M. Schmiele, M.T.P. Silva Clerici, J.L. Proença-Modena, A.T. Vieira, C.R. Mackay, D. Mansur, M.T. Caballero, J. Marzec, J. Li, X. Wang, D. Bell, F.P. Polack, S.R. Kleeberger, R.T. Stein, M.A.R. Vinolo, A.P.D. de Souza.
微生物叢由来の酢酸は、GPR43タイプ1インターフェロン応答を通じて呼吸器合胞体ウイルス感染から保護される
Nat. Commun., 10 (1) (2019), p. 3273
ScopusGoogle Scholarで見る
[212]
J.P.Lynch, R.B.Werder
形質細胞様樹状細胞はセマフォリン4aを介したT regの拡大によりウイルス性気管支炎と喘息から保護する
215 (2) (2018), pp.537-557
CrossRefView in ScopusGoogleスカラー
[213]
M. ゴリツカ、S. マクリス、F. カウサー、L.R. デュラント、C. ペレイラ、熊谷 泰、F.J. カーリー、M. マック、S. アキラ、C. ヨハンソン
肺胞マクロファージ由来のI型インターフェロンは、抗ウイルス単球の動員を通じてRSVに対する自然免疫を制御している。
J. Exp. Med., 212 (5) (2015), pp.699-714.
CrossRefView in ScopusGoogleスカラー
[214]
A.J. McFarlane, H.J. McSorley, D.J. Davidson, P.M. Fitch, C. Errington, K.J. Mackenzie, E.S. Gollwitzer, C.J.C. Johnston, A.S. MacDonald, M.R. Edwards, N.L. Harris, B.J. Marsland, R.M. Maizels, J.Schwarze
腸管蠕虫によるタイプIインターフェロンシグナルは、微生物叢との相互作用を通じて肺ウイルス感染から保護される
J. Allergy Clin. Immunol., 140 (4) (2017), pp.1068-1078.
e6
ScopusGoogle Scholarで見る
[215]
A.L.スティード、G.P.クリストフイ
微生物代謝物デサミノチロシンは、I型インターフェロンを介してインフルエンザから保護する
357 (6350) (2017), pp.498-502
CrossRefView in ScopusGoogleスカラー
[216]
J.W.ショッギンズ
インターフェロン刺激遺伝子:ウイルス病原体における役割
Curr. Opin. Virol., 6 (2014), pp.40-46
PDFを見る記事を見るScopusGoogle Scholarで見る
[217]
J. Dhar, R.A. Cuevas, R. Goswami, J. Zhu, S.N. Sarkar, S. Barik
2'-5'-オリゴアデニル酸合成酵素様タンパク質はrespiratory syncytial virusの複製を阻害し、viral nonstructural protein 1の標的となる。
J. Virol., 89 (19) (2015), pp.10115-10119
ScopusGoogle Scholarで見る
[218]
S. カラムプール、K. ヘサミザデ、F. マレキ、M. ファラフマンド、H. ザヘドナサブ、R. ミルザイ、H. バヌーン、F. ザマニ、M. ハジババ、A. タビブザデ
コロナウイルス感染症2019(COVID-19)の病態における好中球エラスターゼ(NE)酵素と炎症の相関の可能性
Int. Immunopharmacol., 100 (2021), Article 108137
PDFを見る記事を見るScopusGoogle Scholarで見る
[219]
S. カラムプール、K. ヘサミザデ、Z. シャムス、A.G. ノビン、M. ファラハマンド、H. ザヘドナサブ、R. ミルザイ、F. ザマニ、M. ハジババ、B. ブザーリ
COVID-19の減弱におけるロバスタチンの役割
Int. Immunopharmacol., 101 (2021), Article 108192
PDFを見る記事を見るScopusGoogle Scholarで見る
[220]
M.G. Machado、V. Sencio、F. Trottein
感染症治療の可能性を秘めた短鎖脂肪酸:肺を詳しく見てみる
Infect. Immun., 89 (9) (2021), Article e0018821
Google Scholar
[221]
Z.J. カー、A. ヴァン・デ・ルー、G. フェール、J.D. リー、A. カンセルマン、V. ルイス=ベラスコ
全血のFFA2/GPR43受容体発現の増加は敗血症患者の30日生存率の増加と関連する
BMC Res.ノート, 11 (1) (2018), p.41
ScopusGoogleスカラーで見る
[222]
K. シュラッテラー、A.ペシェル、D.クレッチマー
短鎖脂肪酸とFFAR2の活性化-感染症治療の新しい選択肢?
Front. Cell. Infect. Microbiol., 11 (2021), Article 785833
ScopusGoogle Scholarで見る
[223]
A.T. Suckow, C.P. Briscoe
FFA受容体の翻訳に関する重要な質問:薬理学から医薬品まで
Handb. Exp. Pharmacol., 236 (2017), pp.101-131.
ScopusGoogle Scholarで見る
[224]
R. Mirzaei、A. Attar、S. Papizadeh、A.S. Jeda、S.R. Hosseinii-Fard、E. Jamasbi、S. Kazemi、S. Amerkani、G.R. Talei、P. Moradi
コロナウイルス病2019(COVID-19)に対する緩和戦略としてのプロバイオティクスの新たな役割
Arch. Virol., 166 (7) (2021), pp.1819-1840.
CrossRefView in ScopusGoogleスカラー
[225]
L. マキア、J. タン、A.T. ヴィエイラ、K. リーチ、D. スタンレー、S. ルオン、丸屋真一、C. イアン・マッケンジー、土方章、 C. ウォン、L. ビンジ、A.N. Thorburn, N. Chevalier, C. Ang, E. Marino, R. Robert, S. Offermanns, M.M. Teixeira, R.J. Moore, R.A. Flavell, S. Fagarasan, C.R. Mackay.
メタボリックセンシングレセプターGPR43およびGPR109Aは、インフラマソームの制御を通じて食物繊維による腸のホメオスタシスを促進する
Nat. Commun., 6 (2015), p. 6734
ScopusGoogle Scholarで見る
[226]
J.A. Song, H.J. Kim, S.K. Hong, D.H. Lee, S.W. Lee, C.S. Song, K.T. Kim, I.S. Choi, J.B. Lee, S.Y. Park(以上、敬称略。
Lactobacillus rhamnosus M21の経口摂取はインフルエンザウイルス致死性感染マウスの生存率を高める
J. Microbiol. Immunol. Infect. Wei mian yu gan ran za zhi, 49 (1) (2016), pp.16-23
PDFを見る記事を見るScopusGoogle Scholarで見る
[227]
T. シンデ、P.M.ハンスブロ、S.S.ソハル、P.ディングル、R.エリ
SARS-CoV-2を含むウイルス性呼吸器感染症に対抗するためのプロバイオティクスと植物バイオアクチブによる代謝・免疫フィットネス促進による微生物叢調整栄養学的アプローチ
微生物, 8 (6) (2020)
Google Scholar
[228]
L. レイトランタ、A.ピットカランタ、R.コルペラ
呼吸器ウイルス感染症におけるプロバイオティクス
Eur. J. Clin. Microbiol. Infect. Dis: Off. Publ. Eur. Soc. Clin. Microbiol., 33 (8) (2014), pp.1289-1302
CrossRefView in ScopusGoogleスカラー
[229]
R. ナグパル、S. ワン、S. アフマディ、J. ヘイズ、J. ガリアーノ、S. スバシュチャンドラボース、D.W. キッツマン、T. ベクトン、R. リード、H. ヤダヴ
ヒト由来のプロバイオティクスカクテルは、マウスとヒトの腸内細菌群の調節を介して短鎖脂肪酸の産生を増加させる
8 (1) (2018), p. 12649
ScopusGoogle Scholarで見る
[230]
原田 悟、F. He、蛭田直樹、川瀬正樹、久保田晃、平松正樹、ヤウジヒロシ
Lactobacillus rhamnosus GGの経鼻投与は呼吸器系免疫反応を調節することによりH1N1インフルエンザウイルス感染からマウスを保護する。
Lett. Appl. Microbiol., 50 (6) (2010), pp.597-602.
ScopusGoogle Scholarで見る
[231]
A. Shoaib, L. Xin, Y. Xin
乳酸菌の経口投与は緑膿菌および黄色ブドウ球菌の肺感染症の増悪を緩和する
Pak. J. Pharm. Sci., 32 (4) (2019), pp.1621-1630.
ScopusGoogle Scholarで見る
[232]
A.T.ヴィエイラ、V.M.ロシャ、L.タバレス、C.C.ガルシア、M.M.テシェイラ、S.C.オリベイラ、G.D.カサーリ、C.ガンバ、F.S.マルティン、J.R.ニコーリ
常在菌型プロバイオティクスBifidobacterium longum 5(1A)の経口投与によるKlebsiella pneumoniae肺感染症の制御と免疫調節作用
マイクロブズ インフェクツ, 18 (3) (2016), pp.180-189
PDFを見る記事を見るScopusGoogle Scholarで見る
[233]
S. アルスラノグル、G.E.モロ、J.シュミット、L.タンドイ、S.リッサルディ、G.ベーム
プレバイオティックオリゴ糖の混合物を用いた早期の食事介入は、生後2年間のアレルギー症状および感染症の発生を減少させる
J. Nutr., 138 (6) (2008), pp.1091-1095
PDFを見る記事を見るScopusGoogle Scholarで見る
[234]
I. Shahramian, G. Kalvandi, H. Javaherizadeh, M. Khalili, N.M. Noori, M. Delaramnasab, A. Bazi
生後1年間の体重増加、下痢、便秘、発熱、呼吸器感染症に対するプレバイオティクス補給の効果
J. Paediatr. Child Health, 54 (8) (2018), pp.875-880
CrossRefView in ScopusGoogleスカラー
[235]
T. ゴーティエ、S.ダビッド-ル・ガール、A.スイダン、Z.タマナイ-シャコリ、A.ジョリヴェ-グジョン、O.ロレアル、L.ブサルギン
COVID-19における次世代プロバイオティクスとその代謝物
微生物, 19 (9) (2021), p. 5
Google Scholar
[236]
E.S.リー、E.J.ソン、Y.D.ナム、S.Y.リー
ヒトの健康と疾病におけるプロバイオティクス:ニュートリビオティックスからファーマバイオティックスへ
J. Microbiol. (ソウル., 韓国), 56 (11) (2018), pp.773-782
CrossRefView in ScopusGoogleスカラー
[237]
C. Hill, F. Guarner, G. Reid, G.R. Gibson, D.J. Merenstein, B. Pot, L. Morelli, R.B. Canani, H.J. Flint, S. Salminen, P.C. Calder, M.E. Sanders
専門家によるコンセンサス文書。プロバイオティクスとプレバイオティクスの国際科学協会による、プロバイオティクスという用語の範囲と適切な使用に関するコンセンサス・ステートメント。
Nat. Rev. Gastroenterol. Hepatol., 11 (8) (2014), pp.506-514.
CrossRefView in ScopusGoogleスカラー
[238]
J. フェルナンデス、S.レドンド-ブランコ、I.グティエレス-デル-リオ、E.M.ミグエレス、C.J.ビラール、F.ロンボ
短鎖脂肪酸に対する食物性プレバイオティクスの大腸菌叢発酵と抗炎症および抗腫瘍剤としての役割:レビュー
J. Funct. Foods, 25 (2016), pp.511-522
PDFを見る記事を見るScopusGoogle Scholarで見る
[239]
L. Zheng, C.J. Kelly
微生物由来の酪酸はIL-10受容体依存的なクローディン-2の抑制を介して上皮バリア機能を促進する
J. Immunol., 199 (8) (2017), pp.2976-2984.
CrossRefGoogle Scholar
[240]
B.W. Haak、E.R. Littmann、J.L. Chaubard、A.J. Pickard、E. Fontana、F. Adhi、Y. Gyaltshen、L. Ling、S.M. Morjaria、J.U. Peled、M.R. van den Brink、A.I. Geyer、J.R. Cross、E.G. Pamer、Y. Taur
酪酸産生微生物による腸内コロニー形成がallo-HCT後の呼吸器ウイルス感染に与える影響
ブラッド, 131 (26) (2018), pp.2978-2986
PDFを見る記事を見るScopusGoogle Scholarで見る
[241]
K. Chakraborty、M. Raundhal、B.B. Chen、C. Morse、Y.Y. Tyurina、A. Khare、T.B. Oriss、R. Huff、J.S. Lee、C.M. Croix St、S. Watkins、R.K. Mallampalli、V.E. Kagan、A. Ray、P.Ray
マイトDAMPカルジオリピンは、細菌性肺炎の際に持続的な炎症を引き起こすIL-10産生をブロックする
Nat. Commun., 8 (2017), p. 13944
ScopusGoogle Scholarで見る
[242]
A.T.ダン、B.J.マーズランド
微生物、代謝産物、そして腸-肺軸
Mucosal Immunol., 12 (4) (2019), pp.843-850.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[243]
A. トロンペット、E.S.ゴルウィッツァー、C.パッタローニ、I.C.ロペス-メヒア、E.リバ、J.ペルノ、N.ウバッグ、L.ファジャス、L.P.ニコド、B.J.マーズランド
食物繊維はLy6c-パトローリング単球の造血とCD8+T細胞の代謝を形成することにより、インフルエンザに対する防御を与える。
イミュニティ, 48 (5) (2018), pp.992-1005
e8
ScopusGoogle Scholarで見る
[244]
J.A. Brown、K.Z. Sanidad、S. Lucotti、C.M. Lieber、R.M. Cox、A. Ananthanarayanan、S. Basu、J. Chen、M. Shan、M. Amir
腸内細菌叢由来の代謝産物はSARS-CoV-2感染に対する防御効果をもたらす
腸内細菌, 14 (1) (2022), p.2105609
ScopusGoogle Scholarで見る
[245]
K. 今井和彦、山田耕筰、田村睦美、落合賢一、岡本知也
多種多様な酪酸産生菌による潜在的HIV-1の再活性化
Cell. Mol. Life Sci., 69 (15) (2012), pp.2583-2592.
CrossRefView in ScopusGoogle Scholar
[246]
F.J. Carrillo-Salinas, S. Parthasarathy, L. Moreno de Lara, A. Borchers, C. Ochsenbauer, A. Panda, M. Rodriguez-Garcia(以下、「ロドリゲス・ガルシア」という。
短鎖脂肪酸は年齢依存的に好中球の抗ウィルス機能を低下させる
セルズ, 11 (16) (2022), p.2515
CrossRefView in ScopusGoogle Scholar
[247]
B.W. Haak, E.R. Littmann, J.-L. Chaubard, A.J. Pickard, E. Fontana, F. Adhi, Y. Gyaltshen, L. Ling, S.M. Morjaria, J.U. Peled
酪酸産生菌の腸内コロニー形成が同種造血幹細胞移植後の呼吸器ウイルス感染症に与える影響、血液
J. Am. Soc. Hematol., 131 (26) (2018), pp.2978-2986
PDFを見る記事を見るScopusGoogle Scholarで見る
[248]
M. Chemudupati, A.C. Smith, R.J. Fillinger, A.D. Kenney, L. Zhang, A. Zani, S.-L. Liu, M.Z. Anderson, A. Sharma, J.S. Yount
短鎖脂肪酸酪酸はインターフェロン刺激遺伝子を抑制することでウイルス感染を促進する
bioRxiv (2020)
Google Scholar
[249]
N.A. Prow, T.D. Hirata, B. Tang, T. Larcher, P. Mukhopadhyay, T.L. Alves, T.T. Le, J. Gardner, Y.S. Poo, E. Nakayama
高繊維食と酪酸によるチクングニアウイルスリウマチ免疫病理の増悪
Front. Immunol., 10 (2019), p.2736.
ScopusGoogle Scholarで見る
[250]
K.C. Poelaert、J. Van Cleemput、K. Laval、S. Descamps、H.W. Favoreel、H.J. Nauwynck
腸の本能を越えて:代謝性短鎖脂肪酸がアルファヘルペスウイルスの病原性を調節する
Front. Microbiol., 10 (2019), p.723.
ScopusGoogle Scholarで見る
[251]
M. Chemudupati, A.D. Kenney, A.C. Smith, R.J. Fillinger, L. Zhang, A. Zani, S.-L. Liu, M.Z. Anderson, A. Sharma, J.S. Yount
酪酸はインターフェロン刺激による特定遺伝子の発現をリプログラミングする
J. Virol., 94 (16) (2020), pp.e00326-20
Google Scholar
[252]
D. サンブリア、E.バーバー、B.T.ラウス
プロピオン酸ナトリウムの補給は、ウイルス性免疫炎症病変の重症度を抑制する
J. Virol., 95 (4) (2021), pp.e02056-20
ScopusGoogle Scholarで見る
[253]
K.H. Antunes, R.T. Stein, C. Franceschina, E.F. da Silva, D.N. de Freitas, J. Silveira, M. Mocellin, L. Leitão, J.L. Fachi, L.P. Pral, Acetate triggers antiviral response mediated by RIG-I in cells from infants with respiratory syncytial virus bronchiolitis, (2021).
Google Scholar
[254]
Y. Zhao、N. Hu、Q. Jiang、L. Zhu、M. Zhang、J. Jiang、M. Xiong、M. Yang、J. Yang、L. Shen
IPEC-J2細胞におけるロタウイルス誘発小胞体ストレスによるアポトーシスに対する酪酸ナトリウムのPERK-eIF2αシグナル経路を介した保護効果
J. Anim. Sci. Biotechnol., 12 (1) (2021), pp.1-12.
Google Scholar
[255]
C. Clement, P.S. Bhattacharjee, M. Kumar, T.P. Foster, H.W. Thompson, J.M. Hill.
酪酸処理後のHSV-1潜伏TGにおけるマウス遺伝子のアップレギュレーションは、LAT-ICP0遺伝子座の複数の役割に関与していること
Invest. Ophthalmol. Vis. Sci., 52 (3) (2011), pp.1770-1779
CrossRefView in ScopusGoogle Scholar
[256]
M. 李、E.M.McGhee、新野、K.Lee、Y.-L. Lin
微生物代謝物である酪酸への曝露は、ヒトパピローマウイルス16 E6/E7不死化ケラチノサイトのin vivoでの生存時間を延長し、増殖パターンを変化させる。
Am. J. Pathol., 191 (10) (2021), pp.1822-1836
PDFを見る記事を見るScopusGoogle Scholarで見る
[257]
H. ショクヒ・タルギ、P.メアボド、F.フォトゥヒ、M.アミニナサブ
アニオン性化合物であるアスコルビン酸塩、酢酸塩およびクエン酸塩のin vitro抗インフルエンザ評価
Virol. J., 19 (1) (2022), pp.1-12
Google Scholar
[258]
K.H. Antunes, J.L. Fachi, R. de Paula, E.F. da Silva, L.P. Pral, A.Á. ドス・サントス、G.B.M.ディアス、J.E.バルガス、R.プガ、F.Q.メイヤー
微生物叢由来の酢酸は、GPR43タイプ1インターフェロン応答を通じて呼吸器合胞体ウイルス感染から身を守る
Nat. Commun., 10 (1) (2019), pp.1-17
CrossRefGoogle Scholar
引用元: (0)
© 2023 The Authors. 発行:Elsevier Masson SAS.
エルゼビア社のロゴとワードマーク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供および強化、ならびにコンテンツや広告のカスタマイズのためにクッキーを使用しています。閲覧を継続することで、Cookieの使用に同意したものとみなされます。
Copyright © 2023 Elsevier B.V.またはそのライセンサー、コントリビューター。ScienceDirect® はElsevier B.V.の登録商標です。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
