異なる摂食状態における高温回避は独立したインスリンシグナル調節因子によって支配される
研究論文
異なる摂食状態における高温回避は独立したインスリンシグナル調節因子によって支配される
https://journals.plos.org/plosbiology/article?id=10.1371%2Fjournal.pbio.3002332&utm_source=dlvr.it&utm_medium=twitter

Meng-Hsuan Chiang, Yu-Chun Lin, Sheng-Fu Chen, Peng-Shiuan Lee, Tsai-Feng Fu, Tony Wu, Chia-Lin Wu
要旨
熱感知は動物の生存に不可欠である。しかし、栄養状態が体温感覚を調節するメカニズムは不明なままである。今回我々は、空腹状態のショウジョウバエが、摂食状態のショウジョウバエに比べて強い高温回避行動(HAB)を示すことを明らかにした。我々は、高温刺激がα′β′キノコ体ニューロン(MBns)の活性を上昇させ、その活性は飽食状態では弱く、空腹状態では強いことを同定した。さらに、α′β′MBnはmALT投射ニューロンからコリン作動性伝達を介して、飽食状態でも空腹状態でも同程度の高温入力を受けていることを示した。熱刺激後のα′β′MBn活性の食欲亢進状態と空腹状態との差は、ショウジョウバエのインスリン様ペプチド(Dilp)によって制御されている。Dilp2はインスリン産生細胞(IPC)から分泌され、満腹時のHABを制御するのに対し、Dilp6は脂肪体から分泌され、空腹時のHABを制御する。我々は、Dilp2がPI3K/AKTシグナルを誘導するのに対し、Dilp6はα′β′MBnにおいてRas/ERKシグナルを誘導し、異なる摂食条件下でHABを制御することを観察した。最後に、2つのα′β′関連MB出力ニューロン(MBON)、MBON-α′3とMBON-β′1が、α′β′MBnからの統合された高温回避情報の出力に必要であることを示した。この結果は、α′β′MBnに二重のインスリン調節経路が存在することを示すものであり、この経路はショウジョウバエの異なる摂食状態下での体温調節における適切な行動応答に重要である。
引用 Chiang M-H, Lin Y-C, Chen S-F, Lee P-S, Fu T-F, Wu T, et al. (2023) 異なる摂食状態下において、独立したインスリンシグナル調節因子が高温回避を支配する。PLoS Biol 21(10): e3002332.
学術編集者 アレックス・P・グールド、フランシス・クリック研究所、イギリス
受理された: 2023年4月16日受理: 受理:2023年4月16日; 受理:2023年9月11日; 掲載:2023年10月17日 発行:2023年10月17日
Copyright: © 2023 Chiang et al. 本論文は、Creative Commons Attribution Licenseの条項の下で配布されたオープンアクセス論文であり、原著者および出典のクレジットがある限り、いかなる媒体においても無制限の使用、配布、複製を許可する。
データの利用可能性: すべての関連データは論文およびそのSupporting Informationファイル内にある。
資金提供 本研究は、国家科学技術委員会(National Science and Technology Council)からの助成金(112-2311-B-182-002-MY3および109-2326-B-182-001-MY3)によりC-LWに、長庚記念病院(Chang Gung Memorial Hospital)からの助成金(CMRPD1M0301-3、CMRPD1M0761-3、BMRPC75)によりC-LWに提供された。資金提供者は、研究デザイン、データ収集および解析、発表の決定、原稿作成には関与しなかった。
競合利益: 著者らは、競合する利益は存在しないと宣言している。
略語 AC、前部細胞;AHL、成体ヘモリンパ様;Dilps、ショウジョウバエインスリン様ペプチド;HAB、高温回避行動;HC、高温細胞;IPC、インスリン産生細胞;lALT、側触角葉路;LH、側角;mALT、内側触角葉路;MBn、キノコ体ニューロン;MBON、キノコ体出力ニューロン; PAM、大脳前内側;PI、大脳間膜;PLP、大脳後外側;PPL、大脳後外側;PWM、パルス幅変調;ROI、関心領域;SEM、平均値の標準誤差;sNPF、短神経ペプチドF;t3ALT、横3触角葉路
はじめに
温度は体内の酵素反応や生殖など、いくつかの生物学的プロセスに直接影響する。好ましくない環境温度の回避は、小さなヒラムシから世界最大の魚類であるジンベエザメまで、すべての動物に生得的に備わっている行動である[1,2]。熱感知と温度回避行動は、極端に暑い環境や寒い環境を避け、体温を調節するために重要であり、どちらも生存に不可欠である[3]。ショウジョウバエは小型で、外気温に非常に敏感である。ミバエは周囲温度(約25℃)を好み、棲息に適した環境を正確に感知することができる。ショウジョウバエの温度感覚は、アリスタの最後の触角節にある複数のクラスの温度受容体に依存している[4-6]。ショウジョウバエの温度受容体には、無害な熱に対する受容体、有害な熱に対する受容体、無害な寒さに対する受容体、有害な寒さに対する受容体など、少なくとも4つのクラスがある [4-6]。触角のアリスタにあるホットセル(HC)ニューロン [6]とハエの脳内にある前細胞(AC)ニューロン [5]は、主に無害な熱刺激のセンサーとして機能している。熱い刺激は、触角葉から内側触角葉路(mALT)を経由して、萼、側角(LH)、後外側原基(PLP)と呼ばれるキノコ小体(MB)の樹状突起領域を含む高次脳中枢に伝達される[7]。mALTに加え、外側触角葉路(lALT)と横3触角葉路(t3ALT)も触角葉からLHとPLPに熱い刺激を伝えるが、MBには伝わらない[7]。
空腹感とは、食物の欠乏による不安や苦痛の感覚である。空腹状態は、エネルギーや栄養の要求を満たすために、動物の様々な行動を誘発する。哺乳類では、空腹により体温が低下する [8]。インスリンは膵臓のβ細胞から分泌されるペプチドホルモンで、ヒトの血糖値を調節することにより、エネルギーの恒常性維持に大きな役割を果たしている [9] 。無脊椎動物では、進化的に保存されているインスリン様ペプチドが、代謝、成長、寿命の調節に重要な役割を果たしている。線虫では、約40種類のインスリン様ペプチドが同定されている。D. melanogasterでは、8種類のインスリン様ペプチド(Dilps)と1種類のDilpレセプター(InR)が同定されている [11]。異なるDilpは異なる発生段階や成体段階で異なる細胞タイプや組織によって産生される [11]。ハエの成体脳では、14個のインスリン産生細胞(IPC)が大脳皮質間葉(PI)に存在し、Dilp2、Dilp3、Dilp5を発現している。Dilp2の分泌は栄養状態に依存しており、さらに栄養不足はIPCによるDilp2の分泌を阻害する [16,17]。Dilp6は成体の脂肪体で産生され、dilp6のmRNAレベルは飢餓時に増加する。脂肪体からのDilp6の分泌は、飢餓による選好温度(Tp)の低下に関与している [18]。さらに、脂肪体におけるDilp6の過剰発現は、脳におけるDilp2とDilp5のmRNA発現を抑制し、Dilp2の分泌を減少させる[19]。
MBは、各脳半球にケニオン細胞と呼ばれる約2,000個のMBニューロン(MBns)からなる巨大な脳構造であり、軸索の分布によってさらにαβ、γ、α′β′MBnに分類される[20]。研究により、MBnがドーパミンとcAMPシグナルを介してショウジョウバエの温度選好行動に関与していることが示されている[21-23]。また、MBnが満腹シグナルと空腹シグナルを統合して、食物を求める行動を制御していることも示されている[24,25]。しかし、満腹シグナルと空腹シグナルがハエの温度感覚や温度嗜好に影響を与えるかどうかは、まだ不明である。ここで我々は、空腹状態のハエは、飽食状態のハエに比べて強い高温回避行動(HAB)を示すことを示した。しかし、空腹時と飽食時では低温回避行動に違いは見られなかった。我々は、高温シグナルがコリン作動性mALT投射ニューロンによって伝達され、その軸索はα′β′MBnの樹状突起領域と機能的に結合していることを示した。また、高温刺激は、空腹時と空腹時でmALT投射ニューロンに同程度のカルシウム応答を引き起こすことも明らかにした。われわれの行動データは、MBの活性がHABに必要であり、α′β′MBnが飽食状態でも空腹状態でも重要な役割を果たしていることを示唆している。脳のライブイメージングにより、α′β′MBnでは特に空腹状態において、高温刺激に対するカルシウム応答が強いことが示された。InRの構成的活性型をα′β′MBnに遺伝的に発現させると、高温刺激に対するカルシウム応答が抑制され、その結果HABが減少した。さらに、α′β′MBnでInRのドミナントネガティブ型を発現させると、逆の効果が生じた。このことは、α′β′MBnにおけるインスリンシグナル伝達が高温感覚を負に制御していることを示唆している。dilp2転写産物は、IPCに存在する全dilp転写産物の約80%を占めることが示されている[26]。IPCにおけるdilp2のRNAiを介したサイレンシングは、HABとα′β′MBn活性を飽和状態でのみ増加させた。興味深いことに、脂肪体におけるdilp6のサイレンシングは、特に空腹状態においてHABとα′β′MBn活性を増加させた。さらに我々は、α′β′MBnのPI3K/AKTシグナルが空腹時のHABを仲介するのに対し、α′β′MBnのRas/ERKシグナルが空腹時のHABを仲介することを示した。最後に、2つのα′β′MBn下流回路、MB出力ニューロン(MBON)-α′3とMBON-β′1を同定し、そこではHABの実行にニューロン活性が必要であることを明らかにした。この結果は、ショウジョウバエの異なる摂食状態において、異なるDilpシグナルが適切なHABのためのα′β′MBn活性を媒介することを示している。
結果
MB活性はHABを制御する
D. melanogasterは体温が周囲の温度に近い小型の外温動物である。ショウジョウバエは極端に暑かったり寒かったりする環境を避け、適切な周囲の温度(約25℃)を選んで生息する[4-6]。我々は、内部摂食状態がハエの適切な周囲温度の選択に影響するかどうかを調べた。温度選好行動解析にはサーモエレクトリック装置を用いた(図1A、S1A-S1C、S1 Video)。サーモエレクトリック装置の精度と安定性を検証するため、温度センサーを用いてプレートの各四分円の温度を25℃で1時間、さまざまな試験温度(15℃、17℃、19℃、21℃、23℃、27℃、29℃、31℃、33℃、35℃)で測定した。各アルミニウムプレートの誤差は、すべての試験温度設定において1℃未満(約0.5℃)であった(S1D Fig)。このサーモエレクトリック装置を用いて二者択一アッセイを行ったところ[6,7]、空腹のハエは周囲温度25℃よりもむしろ約23℃にいることを好むことがわかった(図1B)。興味深いことに、飢餓状態のハエは摂食状態のハエに比べて高温回避行動が増加することが観察されたが、低温回避行動には違いは見られなかった(図1B)。mALT投射ニューロンが暑熱刺激を触角葉からMBの萼に伝えることが示されており[7]、また最近の研究では、空腹/満腹シグナルがMB回路を調節することが示唆されている[25]ので、MBが暑熱シグナルと空腹/満腹シグナルの統合センターであることが示唆される。次に、MBn活性のサイレンシングや活性化がHABに影響するかどうかを調べた。VT30559-GAL4を介して内向き整流カリウムチャネルKir2.1を発現させることにより、MBn活性を恒常的にサイレンシングすると、空腹状態でも満腹状態でもHABが減少した(S2AおよびS3A図)。構成的なKir2.1発現が神経細胞の発達に及ぼす影響を回避するために、MBnの時間的サイレンシングまたは活性化のための光遺伝学的ツールを用いた。青色光ゲートアニオンチャネルGtACR2 [27]によるMBn活性の時間的サイレンシングは、HABを減少させた(図1C)。一方、赤色光ゲートカチオンチャネルCsChrimson [28]によるMBnの時間的活性化は、空腹状態でも充血状態でもHABを増加させた(図1D)。青色光または赤色光を3分間照射しても、サーモエレクトリック・デバイスのアルミニウム・プレートの設定温度は変化しなかった(S1EおよびS1F図)。その結果、青色または赤色の光を一時的に照射すると、光を照射しない場合のHAB(図1B)と比較して、HABがわずかにシフトした(S2BおよびS2C図)。しかし、青色または赤色光処理条件下でも、満腹時と空腹時のHABの差は依然として存在した(S2BおよびS2C図)。これらの結果から、MBn活性はショウジョウバエの空腹時と飽食時のHABと正の相関があることが確認された。
拡大サムネイル
図1.α′β′MBnは空腹・飽食状態の両方でHABに必要である。
(A)二者択一アッセイ実験の説明図。(B)満腹時(黒)と空腹時(赤)の15-35℃の温度に対する嫌悪。空腹時のハエは、満腹時のハエに比べて27-33℃の温度に対する嫌悪感が有意に増加し、23℃の温度を好んだ(P値: 左から0.7333、0.3746、0.3269、0.1795、0.0066、0.8651、0.0134、0.0034、0.0297、0.0029、0.2309)。(C)GtACR2によるMBn活性のオプトジェニックサイレンシングは、両方の摂食状態においてHABを抑制する(満腹感: P値: 左から0.0032、0.0002、0.0119、<0.0001: P値: 左から0.0002、0.0244、<0.0001、<0.0001)。(D)CsChrimsonによるMBn活性の光遺伝学的活性化は、満腹状態でも空腹状態でもHABを増加させる(満腹状態:P値:0,0002、空腹状態:P値:0,0244、空腹状態:0,0001): P値: 左から0.0092、0.0023、0.049、0.0683。空腹: P値: 左から0.0025、0.0024、0.0232、0.1536)。(E)γMBn活性をオプトジェネティックにサイレンシングすると、満腹状態ではHABが抑制されたが、空腹状態では抑制されなかった(満腹状態:P値:0.0025、0.0024、0.0232、0.1536): P値: <左から0.0001未満、0.0002未満、0.0001未満、0.001未満: P値: 左から0.4572、0.3521、0.8352、0.855)。(F)αβMBn活性をオプトジェネティックにサイレンシングすると、満腹状態ではHABが抑制されたが、空腹状態では抑制されなかった: P値: < 左から0.0001、0.0003、0.0002、0.0019: P値: 左から0.3912、0.7685、0.8361、0.4902)。(G)α′β′MBn活性のオプトジェニックサイレンシングは、両方の状態においてHABを抑制した(満腹: P値: 左から順に<0.0001、0.0034、<0.0001、0.0019;空腹: P値: <0.0001、0.0027、<0.0001、0.0002(左から右へ)。(H)高温刺激は満腹時にγMBnのカルシウム応答を誘導したが、空腹時には高温応答は減少した(P = 0.0002)。MBγ葉のGCaMP強度変化(ΔF/F0)を記録し、解析した。(I)高温刺激は、空腹状態ではαβMBnにカルシウム応答を誘導したが、空腹状態ではこの高温応答は減弱した(P = 0.005)。MB β葉のGCaMP強度変化(ΔF/F0)を記録し、解析した。(J)高温刺激は満腹時にα′β′MBnのカルシウム応答を誘導したが、空腹時にはこの高温応答が増強した(P = 0.0373)。MB β′葉のGCaMP強度変化(ΔF/F0)を記録し、解析した。各カルシウム応答曲線の下の矢印は、温熱刺激が加えられた時点を示す。各Nは、行動アッセイで一緒に分析した15匹のハエのグループ(B-G)、またはライブ脳カルシウムイメージング実験で分析した1匹のハエ(H-J)を示す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析にTukeyの検定を加えたもの(C-G)、または対応のない両側t検定(B, H-J)で分析した。*P < 0.05. HABは高温回避行動、MBnはキノコ体ニューロン、SEMは平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g001
詳細 "
α′β′MBnは高温刺激に応答し、HABに必要である
MBnはさらにγ、αβ、α′β′ニューロンに分類されるため、HABの制御における各MBnサブタイプの役割をさらに調べた。餌を食べたハエでは、GtACR2を介して各MBnサブタイプを時間的にサイレンシングすると、HABが抑制された(図1E-1G、S2D-S2F、S3B-S3G)。空腹状態では、GtACR2を介したα′β′MBn活性のサイレンシングはHABを抑制したが(図1GとS2F)、αβまたはγMBn活性のサイレンシングは効果がなかった(図1E、1F、S2DとS2E)。次に、高温刺激がMBnサブタイプの活性に影響を与えるかどうかを調べた。神経細胞活動を可視化するため、各MBnにGCaMP7sを遺伝子発現させ、高温刺激の前後でカルシウム応答を記録した。その結果、γ、αβ、α′β′MBnでは、高温刺激後にカルシウム応答が有意に増加した(図1H-1J)。興味深いことに、空腹状態のハエでは、γおよびαβMBnのカルシウム応答は有意に低かったが、α′β′MBnのカルシウム応答は空腹状態のハエに比べて有意に高かった(図1H-1J)。室温刺激ではγ、αβ、α′β′MBnに有意なカルシウム応答は誘導されなかったことから、これらのカルシウム応答は高温刺激によって実際に誘導されたものであり、脳のライブイメージング操作による運動アーチファクトではないことが示唆された(S2H Fig)。MBnの時間的活性化はハエにおけるHABを増加させた(図1D)ので、α′β′MBnを活性化すると空腹状態と満腹状態の両方でHABが特異的に増加するかどうかを検討した。CsChrimson遺伝子を発現するハエでα′β′MBnを光遺伝学的に活性化すると、両方の摂食状態でHABが増加した(S2G Fig)。これらの結果は、α′β′MBn活性のみが飽食および空腹時のHABに必要であることを示したわれわれの行動研究の結果と一致する(図1G)。
InRはα′β′MBn活性を阻害することによって高温反応を媒介する。
Dilpは満腹/空腹調節に関与していることから[16]、Dilpシグナル伝達が異なる摂食状態下で高温応答に影響を与えるかどうかを検討した。ショウジョウバエには8つのDilpがあるが、InRは1つしかないことから[11]、まずHABのMBnにおけるInRの役割を調べた。InRのドミナントネガティブ型(InRDN)をMBnで遺伝的に発現させるとHABが増加し(図2A)、一方InRの構成的活性型(InRCA)をMBnで発現させるとHABが減少した(図2B)。したがって、MBにおけるDilp誘導性InRシグナルは、どちらの摂食状態においてもHABを抑制する可能性がある。このような行動の変化は、InRDNとInRCAをα′β′MBnで特異的に発現させた場合(図2C、2D、S4AおよびS5A)にも観察され(S4B-S4E図)、γおよびαβMBnでは観察されなかったことから、HABにはα′β′MBnに特異的なインスリンシグナル伝達が必要であることが示された。InRDNやInRCAを導入したハエでは、α′β′MBnの肉眼的形態は影響を受けなかった(S5D Fig)ことから、InRDNやInRCAの発現はα′β′MBnの発生に影響を与えないことが示唆された。InRDNとInRCAの発現による発生への影響を完全に排除するために、InRDNとInRCAの発現を急性に制御するtub-GAL80tsトランスジーンを共発現させた。同様の行動表現型が、α′β′MBnでInRDNまたはInRCAを急性発現させたハエで観察された(図2E、2F、S4FおよびS5B)。さらに、α′β′MBnにおけるInRDNまたはInRCAの急性発現は寒冷回避行動に影響を与えなかったことから、MBにおけるDilpシグナル伝達は高温応答を媒介するが、低温応答は媒介しないことが示唆された(図2G、2H、S4G、S4HおよびS5C)。脳のライブイメージングデータから、InRDNトランスジーン発現は高温刺激によるカルシウム応答を増強するのに対し、InRCA発現はα′β′MBnのカルシウム応答を、飽食時(図2I)と空腹時(図2J)の両方で減少させることが示された。これらのデータを総合すると、InRはα′β′MBn活性を負に制御し、これが飽食状態でも空腹状態でもHABに寄与していることが示唆される。
拡大サムネイル
図2. α′β′MBnにおけるインスリンシグナルはHABに重要である。
(A)MBnにおけるInRのドミナントネガティブ型(InRDN)の遺伝的発現は、満腹状態でも空腹状態でもHABを増加させた(Satiety: P値: 左から<0.0001、<0.0001、<0.0001、0.0055;空腹: P値: <0.0001、<0.0001、0.0026、0.0291(左から右へ)。(B)MBnにおけるInRの構成的活性型(InRCA)の遺伝子発現は、満腹状態および空腹状態の両方でHABを減少させた(満腹状態:P値:<0.0001、空腹状態:P値:<0.0026、空腹状態:P値:<0.0291): P値: 左から順に<0.0001、0.0035、<0.0001、0.485;空腹状態: P値: <0.0001、<0.0001、0.0005、0.0022(左から右へ)。(C)α′β′MBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態の両方でHABを増加させた(満腹状態: P値: 左から<0.0001、<0.0001、<0.0001、0.0506;空腹: P値: 左から0.0016、<0.0001、0.0309、0.0562)。(D)α′β′MBnにおけるInRCAの遺伝子発現は、満腹状態および空腹状態の両方でHABを減少させた(満腹状態: P値: 左から<0.0001、0.0002、0.0004、0.0138;空腹: P値: 左から0.0003、0.0043、0.0003、0.4695)。(E)α′β′MBnにおけるInRDNの成人期特異的発現は、満腹状態および空腹状態の両方においてHABを増加させた(満腹状態: P値: <左から順に<0.0001、0.0012、<0.0001、0.2074;空腹: P値: <0.0001、0.0002、0.0418、0.0035(左から右へ)。(F)α′β′MBnにおけるInRCAの成人期特異的発現は、満腹状態および空腹状態の両方においてHABを減少させた(満腹状態:P値:<0001、0.0002、0.0418、0.0035): P値: 左から0.0013、0.0379、0.008、0.0198;空腹状態: P値: 左から0.0094、0.0051、0.0246、0.0155)。(G)α′β′MBnにおけるInRDNの成体段階特異的発現は、満腹状態および空腹状態のいずれにおいても寒冷回避行動に影響を与えなかった(満腹状態: P値: 左から0.7397、0.9641、0.8158、0.7703;空腹状態: P値: 左から0.803、0.7378、0.9292、0.8924)。(H)α′β′MBnにおけるInRCAの成体段階特異的発現は、満腹状態および空腹状態のいずれにおいても寒冷回避行動に影響を与えなかった(満腹状態: P値: 左から0.908、0.7472、0.8053、0.6225;空腹状態: P値: 左から0.8746、0.8515、0.9402、0.2481)。(I, J) InRCAの遺伝的発現は高温誘導性カルシウム応答を減少させたが、InRDNの発現はα′β′MBnの高温誘導性カルシウム応答を、満腹(I)および空腹(J)のハエにおける対照群と比較して増加させた(満腹ではP = 0.0145および0.0102、空腹ではP = 0.0004および0.0168)。各カルシウム反応曲線の下の矢印は、熱い刺激を加えた時点を示す。MBβ′葉のGCaMP強度変化(ΔF/F0)を記録し、各カルシウムイメージングデータで解析した。各Nは、行動アッセイで一緒に解析した15匹のハエのグループ(A-H)またはカルシウムイメージング実験で解析した1匹のハエ(I, J)を表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析(one-way ANOVA)、Tukeyの検定(A-H)、または対応のない両側t検定(I, J)で分析した。*P < 0.05. HABは高温回避行動、MBnはキノコ体ニューロン、SEMは平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g002
詳細 "
Dilp2はPI3K/ACTシグナルを介して満腹時のHABに必要なα′β′MBn活性を媒介する
ハエの脳では、満腹時にDilp2、Dilp3、Dilp5がIPCから放出される。そこで、Dilp変異ハエのHABを調べた。行動学的スクリーニングの結果、満腹状態のdilp2変異体ハエではHABが有意に増加したが、dilp3およびdilp5変異体ハエでは見られなかった(図3AおよびS6A)。α′β′MBnは高温反応に重要であるので、Dilp2の欠損が高温刺激に対するα′β′MBn反応に影響するかどうかを調べた。脳のライブイメージングデータの結果、dilp2変異体のα′β′MBnでは、高温刺激に対するカルシウム応答が増加していた(図3B、左パネル)。しかしながら、α′β′MBnにおけるカルシウム反応の増加は、空腹状態のdilp2突然変異体ハエでは観察されなかったことから、Dilp2は満腹時にのみ高温反応を媒介することがさらに示唆された(図3B、右パネル)。Dilp2は脳のIPCから分泌されるので、IPC特異的なdilp2ノックダウン・フライでHABを調べた(S6B Fig)。IPC特異的なDilp2発現の減少による発達の影響を除外するため、成虫期特異的にIPCのDilp2をサイレンシングするtub-GAL80tsトランスジーンを共発現させたところ、満腹時のHABは増加したが、空腹時のHABは増加しなかった(図3CおよびS6C)。このことから、IPCから分泌されるDilp2は満腹時にのみHABを抑制することが示唆された。また、免疫組織化学のデータからも、空腹時にIPCにDilp2が豊富に蓄積していることが示された(S6D図)。これは、ショウジョウバエの幼虫[16]や成虫[17]を用いた先行研究の結果と一致している。IPCによるDilp2分泌が満腹感を表すのか、それともホットシグナルなのかを調べるために、脳のライブイメージングを行った。脳のライブイメージングデータから、IPCは高温刺激に反応しないことが示された。このことは、Dilp2分泌が高温シグナルではなく、満腹状態を表していることを示している(S6E Fig)。
拡大サムネイル
図3. IPCから分泌されるDilp2は、満腹時のHABに対するAKTシグナルを制御する。
(A)dilp2変異体ハエは満腹時にHABの増加を示したが、空腹時には見られなかった(Satiety: P値: 左から0.0013、0.0187、0.01、0.0412;空腹時: P値: 左から0.9355、0.8074、0.5071、0.8233)。(B)α′β′MBnはdilp2変異体において、空腹時ではなく満腹時に特異的に高温応答を増加させた(満腹時:P = 0.0394、空腹時:P = 0.9146)。(C) 成人期特異的IPCにおけるdilp2のノックダウンは、満腹時のHABを増加させたが、空腹時のHABは増加させなかった(満腹時:P = 0.0394、空腹時:P = 0.9146): P値: <左から0.0001、0.0001、0.0026、0.0115;空腹時: P値: 左から0.4499、0.9351、0.695、0.4026)。(D)IPCにおけるdilp2の遺伝子ノックダウンは、α′β′MBnの満腹時に特異的に高温反応を増強した(満腹時のP = 0.0057、空腹時のP = 0.8046)。(E)IPCにおけるdilp2の成人期特異的発現は、満腹時と空腹時の両方でHABを減少させる(満腹時: P値: 左から0.0006、0.0005、<0.0001、<0.0001;空腹時: P値: <0.0001、左から0.0134、0.0286、0.0039)。(F)IPCにおけるdilp2の遺伝子発現は、満腹時と空腹時の両方でα′β′MBnの高温応答を減少させた(満腹時のP = 0.0238、空腹時のP = 0.0005)。(G)α′β′MBnにおけるAKTの成人期特異的ノックダウンは、満腹時のHABを増加させた(満腹時: P値: 左から順に<0.0001、<0.0001、<0.0001、0.0766;空腹時: P値: 左から0.5511、0.8163、0.5558、0.3186)。(H)α′β′MBnにおけるAKTの遺伝的ノックダウンは、満腹時のα′β′MBnの高温応答を増加させたが、空腹時には増加させなかった(満腹時のP = 0.0001、空腹時のP = 0.7126)。(I)α′β′MBnのAKT過剰発現は、満腹時と空腹時の両方でHABを減少させた(満腹時:P=0.0001、空腹時:P=0.7126): P値: <左から0.0001、0.0004、0.0057、0.0004;空腹: P値: <0.0001、左から0.0164、0.0161、0.0117)。(J)α′β′MBnにおけるAKTの過剰発現は、満腹状態と空腹状態の両方においてα′β′MBnの高温応答を減少させた(満腹ではP = 0.0453、空腹ではP = 0.0035)。各カルシウム応答曲線の下の矢印は、熱い刺激を加えた時点を示す。MBβ′葉のGCaMP強度変化(ΔF/F0)を記録し、各カルシウムイメージングデータで解析した。各Nは、行動アッセイで一緒に解析した15匹のハエのグループ(A、C、E、G、I)、またはカルシウムイメージング実験で解析した1匹のハエ(B、D、F、H、J)を表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1データにある。データは、一元配置分散分析にTukeyの検定を加えたもの(C, E, G, I)、または対応のない両側t検定(A, B, D, F, H, J)で分析した。*P<0.05;nsは有意ではない。HAB、高温回避行動;IPC、インスリン産生細胞;MBn、キノコ体ニューロン;SEM、平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g003
詳細 "
IPCが産生するDilp2がα′β′MBnの高温応答を抑制するかどうかを評価するために、IPCのdilp2を遺伝的にサイレンシングし、高温刺激前後のα′β′MBnのカルシウム応答を記録した。その結果、IPCのdilp2をサイレンシングすると、空腹時ではなく、飽食時のα′β′MBnの高温刺激に対するカルシウム応答が有意に増加した(図3D)。さらに、IPCにおけるdilp2の過剰発現はHABを抑制し(図3EおよびS6F)、脳のライブイメージングデータもα′β′MBnにおける高温刺激に対するカルシウム応答の減少を示した(図3F)。これらの結果は、IPCから分泌されたDilp2がα′β′MBnの活性を阻害することにより、高温反応とHABを抑制するという考えを支持するものである。Dilps-InR相互作用はPI3K/AKTおよびRas/ERK経路を含む複数のシグナル伝達経路を誘導する[29-31]。次に、HABに必要なα′β′MBnのInRの下流成分の可能性を調べた。その結果、α′β′MBnではドミナントネガティブPI3K(PI3KDN)の構成的発現(S7AおよびS7B図)またはAKTのRNAiによるノックダウン(S7CおよびS7D図)がHABを増加させることがわかった。これらの操作による発達の潜在的影響を除外するために、tub-Gal80tsトランスジーンを導入し、α′β′MBnにおけるPI3KDNの成体期特異的発現(S7EおよびS7F図)またはAKTのノックダウン(図3GおよびS7G)が、飽食状態でのHABを増加させたが、空腹状態でのHABは増加させなかった。さらに、α′β′MBnでAKTをノックダウンすると、空腹状態での高温刺激に対するカルシウム応答が増加した(図3H)。これらの結果は、IPCから分泌されたDilp2がα′β′MBnにおいてPI3K/AKTシグナルを誘導し、満腹時のHABと高温応答に寄与していることを示唆している。我々の結果は、α′β′MBnにおけるAKTの構成的発現(S7H図)または成体期特異的AKT発現(図3IおよびS7I)がHABを減少させることを示した。脳のライブイメージングデータは、α′β′MBnにおけるAKT過剰発現が高温反応を減少させることを示した(図3J)。以上より、PI3K/AKTシグナルは、高温刺激によって誘導されるα′β′MBn活性を抑制することによって、HABと高温反応を抑制することが示唆された。
Dilp6はRas/ERKシグナルを介してハングリーフライのHABに対するα′β′MBn活性を調節する。
IPCにおけるdilp2の遺伝的サイレンシング、あるいはα′β′MBnにおけるPI3K/ACTシグナルの阻害は、食欲のあるハエではHABを増加させたが、空腹のハエでは増加させなかった(図3C、3G、S6B、S6CおよびS7A-S7G)。しかし、MBのInR発現を操作すると、飽食状態でも空腹状態でもHABに影響を与えることから(図2)、空腹状態でのHAB調節にはDilp2以外のシグナルが存在することが示唆された。Dilp6が飢餓時に脂肪体から分泌されることが示されていることから[19]、Dilp6の発現を操作することがHABに影響を与えるかどうかを調べた。その結果、Dilp6欠損変異体(Dilp6LOF)は空腹時にはHABが増加したが、満腹時にはHABが増加しなかった(図4A)。さらに、α′β′MBnの高温刺激に対するカルシウム応答は、空腹時のDilp6 LOFハエでのみ有意に増加した(図4B)。cg-GAL4で脂肪体中のdilp6を恒常的にノックダウンすると、空腹時のHABは増加したが、満腹時のHABは増加しなかった(S8A図)。さらに、脂肪体におけるdilp6の成虫期特異的ノックダウンは、α′β′MBnにおいて、特に空腹時のHABを増加させ(図4CおよびS8B)、高温応答を増強した(図4D)。逆に、脂肪体におけるdilp6の成虫期特異的過剰発現は空腹時のHABを減少させ(図4EおよびS8C)、ライブカルシウムイメージングのデータも、dilp6が空腹時のα′β′MBnの高温応答を減少させ、満腹時の高温応答を減少させないという考えを支持した(図4F)。Dilp2は飽食状態においてα′β′MBnの活性を強く阻害するため、Dilp6を過剰発現してもこの状態における神経細胞活性をさらに低下させることができなかったのかもしれない(図1J、3F、4F)。
拡大サムネイル
図4. 脂肪体から産生されるDilp6は空腹状態においてHABのERKを制御する。
(A)dilp6欠損変異体ハエ(dilp6LOF)は空腹時にHABの増加を示した(Satiety: P値: 左から0.6176、0.4785、0.8634、0.7292;空腹時: P値: 左から0.0003、0.0029、0.0222、0.4018)。(B)α′β′MBnは、dilp6LOF変異体バックグラウンドにおいて、空腹時に特異的に高温応答を示したが、満腹時には示さなかった(満腹時のP = 0.2043、空腹時のP = 0.0002)。(C)脂肪体におけるdilp6の成虫期特異的ノックダウンは、空腹時のHABを増加させたが、飽食時のHABは増加させなかった(満腹時:P = 0.2043、空腹時:P = 0.0002): P値: 左から0.7112、0.4332、0.748、0.4753;空腹: P値: 左から0.0006、0.0002、0.0332、0.0732)。(D)脂肪体におけるdilp6の遺伝的ノックダウンは、空腹状態において特にα′β′MBnの高温応答を増加させた(満腹についてはP = 0.8682、空腹についてはP = 0.0328)。(E)脂肪体におけるdilp6の成人期特異的発現は、空腹状態におけるHABを減少させた(満腹: P値: 左から0.2437、0.2066、0.3148、0.2978;空腹: P値: <0.0001、<0.0001、<0.0001、左から0.0194)。(F)脂肪体におけるdilp6の遺伝的発現は、空腹状態におけるα′β′MBnの高温応答を減少させた(満腹についてはP = 0.5214、空腹についてはP = 0.002)。(G)α′β′MBnにおけるErkの成体段階特異的ノックダウンは空腹時のHABを増加させた(満腹時: P値: 左から0.9053、0.6805、0.4785、0.2593;空腹時: P値: <左から0.0001、0.0011、0.0026、0.108)。(H)α′β′MBnにおけるErkの遺伝的ノックダウンは、空腹時のα′β′MBnの高温応答を増加させたが、満腹時には増加させなかった(満腹時のP = 0.2155、空腹時のP = 0.0361)。(I)α′β′MBnにおけるErkの成体段階特異的発現は空腹状態のHABを減少させた(満腹: P値: 左から0.6868、0.7727、0.7495、0.0552;空腹: P値: 左から0.001、0.0003、0.0002、0.0121)。(J)α′β′MBnにおけるErkの遺伝子発現は、空腹状態におけるα′β′MBnの熱い反応を減少させた(満腹のP = 0.4394、空腹のP = 0.0003)。各カルシウム反応曲線の下の矢印は、熱い刺激が加えられた時点を示す。各Nは、行動アッセイ(A、C、E、G、I)またはカルシウムイメージング実験(B、D、F、H、J)で一緒に分析した15匹のハエのグループのいずれかを示す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1データにある。データは、一元配置分散分析にTukeyの検定を加えたもの(C, E, G, I)、または対応のない両側t検定(A, B, D, F, H, J)で分析した。*P<0.05;nsは有意ではない。HAB、高温回避行動;MBn、キノコ体ニューロン;SEM、平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g004
詳細 "
α′β′MBnのPI3K/ACTシグナルを遮断すると、飽食時のHABが増加したが、空腹時のHABには影響がなかった(図3GおよびS7A-S7G)。InRによって活性化されうる2つの主要な細胞内シグナル伝達経路、PI3K/AKT経路とRas/ERK経路がある[29-31]。我々は、他のDilp-InRシグナルが飢餓状態のHABとα′β′MBn活性を制御しているかどうかを調べた。興味深いことに、α′β′MBnのRas、Raf、ErkをRNAiでノックダウンすると、空腹状態でのみ強いHABが誘導されたが、満腹状態では誘導されなかった(S9A-S9F図)。同様に、α′β′MBnにおけるRas、RafまたはErkの成体期特異的ノックダウンも、特に空腹状態において強いHABを誘導した(図4GおよびS9G-S9K)。この表現型は、dilp6欠損変異体(図4A)や脂肪体でdilp6をノックダウンしたハエ(図4C)で観察されたものと類似している。ライブカルシウムイメージングのデータも、α′β′MBnにおけるRNAiを介したErkノックダウンが、空腹時のみ高温反応を増加させ、飽食時では増加させないという考えを支持した(図4H)。α′β′MBnにおけるErkの抑制的発現または成虫期特異的発現は、空腹状態のハエにおけるHAB(図4I、S9LおよびS9M)とα′β′MBnの高温応答(図4J)を減少させた。このことは、Dilp6/Erkシグナル伝達が空腹状態において特異的に高温刺激誘導α′β′MBn活性を阻害するという考えを支持する。
AKTおよびERKのリン酸化はPI3K/AKTおよびRas/ERKシグナル伝達経路の活性を表すことを考慮し[30,32]、我々は空腹時のα′β′MBnにおけるリン酸化AKT(pAKT)およびリン酸化ERK(pERK)の発現が空腹時と異なるかどうかを検討した。免疫組織化学的解析の結果、飽食状態ではpAKTの発現レベルが高く(図5A)、空腹状態ではpERKの発現レベルが高いことが観察された(図5B)。しかし、α′β′MBnでInRDNを遺伝子発現させると、飽食状態のハエと空腹状態のハエでそれぞれpAKTとpERKの発現レベルの上昇が改善された(図5Cと5D)。IPCにおけるdilp2の遺伝子サイレンシングもまた、飽食時のpAKTレベルを抑制した(図5E)。一方、脂肪体におけるdilp6のサイレンシングは、空腹時のpERKレベルを抑制した(図5F)。全体として、この結果は、IPCによる満腹に誘導されたDilp2分泌がα′β′MBnの細胞内シグナル伝達を引き起こすことを示唆しており、これは空腹に誘導された脂肪体からのDilp6分泌とは異なる。これらの2つの異なるInR依存性の細胞内シグナルは、ショウジョウバエの両方の摂食状態における適切なHABに寄与している。
拡大サムネイル
図5. Dilp2はpAKTを増加させ、Dilp6は満腹時と空腹時にα′β′MBnのpERKレベルを増加させる。
(A) VT30604-GAL4 > UAS-mCD8::GFPハエにおけるpAKT抗体による免疫染色。満腹時と空腹時のα′β′MBnにおける抗pAKT免疫陽性シグナルの定量(右パネル)(P = 0.0014)。(B)VT30604-GAL4>UAS-mCD8::GFPハエにおけるpERK抗体による免疫染色。飽食状態および空腹状態のα′β′MBnにおける抗pERK免疫陽性シグナルの定量化(右パネル)(P = 0.0083)。(C)VT30604-GAL4>UAS-InRDNおよびVT30604-GAL4>+ハエにおけるpAKT抗体による免疫染色。左からP = 0.8402、0.0047、0.0031)。(D)VT30604-GAL4>UAS-InRDNハエおよびVT30604-GAL4>+ハエにおけるpERK抗体による免疫染色。飽食状態および空腹状態のα′β′MBnにおける抗pERK免疫陽性シグナルの定量化(右パネル)(左からP = 0.8662、0.0066、0.0006)。(E) dilp2-GAL4 > UAS-dilp2RNAiおよびdilp2-GAL4 > +ハエにおけるpAKT抗体による免疫染色。左からP = 0.6434、0.0158、0.0109)。(F) cg-GAL4 > UAS-dilp6RNAiおよびcg-GAL4 > +ハエにおけるpERK抗体による免疫染色。鎮静状態および空腹状態のα′β′MBnにおける抗pERK免疫陽性シグナルの定量化(右パネル)(左からP = 0.4332、0.0002、<0.0001)。各Nは抗pAKTまたは抗pERK免疫染色実験における1匹のハエを表す。α′β′MBnにおける抗pAKTおよび抗pERK免疫染色シグナルはすべて、食道下神経節におけるシグナルに対して正規化した。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは対応のない両側t検定(A-F)または一元配置分散分析にTukeyの検定を加えたもの(C-F)で分析した。*P<0.05;nsは有意ではない。MBn, キノコ体ニューロン; SEM, 平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g005
詳細 "
mALTはコリン作動性伝達を介してα′β′MBnにホットシグナルを伝える
mALT投射ニューロンは触角葉からの熱刺激をハエの脳のMB、LH、PLP領域に伝える[7]。我々は、熱刺激に対するα′β′MBn応答がmALTを介して伝達されるかどうか、またこの過程に関与する神経伝達物質について調べた。これに取り組むため、VT40053-GAL4を使ってmALTニューロンを標識した(図6A)[7]。これらのニューロンの軸索は、萼片としても知られるMBの樹状突起領域を支配している(図6B)。抗コリンアセチルトランスフェラーゼ(抗ChAT)抗体を用いた免疫染色では、mALT軸索に陽性シグナルが見られ、これらのニューロンが神経伝達にアセチルコリンを使っていることが示唆された(図6CおよびS10A)[33]。さらに、mALTニューロンにおけるkir2.1トランスジーンの発現は、飽食状態と空腹状態の両方でHABを減少させたことから、正常なHABにはmALTニューロンの活性が必要であることが示唆された(S10B図)。神経細胞におけるkir2.1トランスジーン発現の発達的影響を回避するため、mALTニューロンでGtACR2トランスジーンを発現させ、青色光照射によって神経細胞活動を時間的にサイレンシングした。ここでも、mALT神経細胞の活動を時間的にサイレンシングすることで、HABが減少することが示された(図6D)。RNAiを介したmALTニューロンのChATノックダウンもHABを減少させ(S10C図)、ChATの成体期特異的ノックダウンも同様の効果を示した(図6EおよびS10D)。ライブカルシウムイメージングにより、mALTニューロンにおけるホット応答は、飽食状態でも空腹状態でも同じレベルであったことから(図6F)、mALTニューロンからのホット入力は摂食状態の違いによって影響を受けないことが示唆された。次に、α′β′MBnが本当にmALTニューロンからの入力を受けているかどうかを調べた。VT40053-GAL4>UAS-CsChrimsonを介してmALTニューロンでCsChrimsonを遺伝子発現させ、R35B12-lexA>lexAop-GCaMP7sを介してα′β′MBnでGCaMP7sを発現させた。脳のライブイメージングでは、赤色光照射中のカルシウム応答が、コントロールのハエに比べてトランスジェニックバエで有意に増加した(図6G)。さらに、kir2.1導入遺伝子の異所性発現によってmALTニューロン活性が抑制されると、α′β′MBnでは高温刺激によるカルシウム応答が誘導されなかった(S10E図)。
拡大サムネイル
図6. コリン作動性mALTニューロンは高温情報をα′β′MBnに伝える。
(A)ハエの脳におけるmALTニューロンの形態。脳は抗DLG抗体で対比染色されている。(B)MB萼部におけるmALTのシナプスブトン様構造(矢印)。脳は抗DLG抗体でカウンター染色されている。(C)抗ChAT免疫染色シグナル(マゼンタ)とmALT軸索(緑)の共局在(矢印)。(D)GtACR2を介したmALT活性のオプトジェニックサイレンシングにより、空腹状態および満腹状態の両方でHABが抑制された(満腹状態: P値: 左から0.0003、<0.0001、0.0001、0.0271;空腹: P値: 左から0.0001、0.001、0.0103、0.001)。(E)mALTにおけるChATの成体期特異的ノックダウンは、両方の摂食状態においてHABを阻害した(満腹: P値: 左から順に<0.0001、<0.0001、0.0029、<0.0001;空腹時: P値: <0.0001、0.0005、<0.001、<0.0001(左から右へ)。(F)熱い刺激はmALTの熱い糸球体のカルシウム応答を誘発し、このカルシウム応答は飽食(黒)と空腹(赤)のハエ間で有意差はなかった(P = 0.7554)。mALT樹状突起におけるGCaMP強度変化(ΔF/F0)を記録し、解析した。(G)CsChrimsonを介したmALTの光遺伝学的活性化は、R35B12-lexA/CsChrimson; VT40053/lexAop-GCaMP7を持つハエ(緑)ではα′β′MBnのカルシウム応答を誘発したが、R35B12-lexA/CsChrimson; +/lexAop-GCaMP7を持つハエ(黒)では誘発しなかった(P < 0. 0001:満腹感;P < 0.0001:空腹感)。(H)α′β′MBnでInRDNトランスジーンを発現させた場合、高温刺激に対するカルシウム応答は、満腹(黒)と空腹(赤)のハエ間で有意差はなかった(P = 0.6093)。(I)α′β′MBnにおける高温刺激に対するカルシウム応答は、飽食(黒)と空腹(赤)のdilp2-/-およびdilp6LOF二重変異ハエの間で有意差はない(P = 0.4850)。MB β′葉のGCaMP強度変化(ΔF/F0)を記録し、解析した。各カルシウム応答曲線の下の矢印は、高温刺激が加えられた時点を示す。各Nは、行動アッセイで一緒に解析した15匹のハエのグループ(D, E)、またはカルシウムイメージング実験で解析した1匹のハエ(F-I)を示す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1データにある。データは一元配置分散分析にTukeyの検定を加えたもの(D, E)、または対応のない両側t検定(F-I)で分析した。*P<0.05;nsは有意ではない。HABは高温回避行動、mALTは内側触角葉路、MBnはキノコ体ニューロン、SEMは平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g006
詳細 "
次に、InRシグナルを抑制した場合、α′β′MBnは空腹状態と満腹状態で同様の高温応答を示すかどうかを検討した。我々は、α′β′MBnにVT30604-GAL4を介してInRDNを遺伝子発現させ、ライブカルシウム脳イメージングを行った。その結果、高温刺激に対するカルシウム応答は、どちらの摂食状態でも有意な差は見られなかった(図6H)。さらに、dilp2-/-およびdilp6LOF二重変異体ハエにおける高温刺激に対するα′β′MBn応答も調べた。その結果、高温刺激に対するカルシウム応答はどちらの摂食状態でも有意差がないことがわかった(図6I)。全体として、これらの結果は、コリン作動性mALTニューロンが、空腹時だけでなく飽食時においてもα′β′MBnの高温刺激に対する主要な入力であり、Dilp2とDilp6はそれぞれ、飽食時と空腹時のα′β′MBn活性の抑制にのみ関与していることを示している(図2-6)。
MBON-α′3とMBON-β′1はHABの実行に必須である。
ホットインプットはコリン作動性mALTによってα′β′MBnに伝えられ(図6)、一方Dilp2とDilp6はそれぞれ、飽食状態と空腹状態においてα′β′MBnの活性を制御する(図3-5)ので、HABに重要な出力ニューロンを調べた。MBに存在する情報は特定のMBONによって読み出され、その樹状突起はMB葉の異なる領域に限定されている[34]。MBONのシナプス後領域は高い可塑性を持っており、異なるMBONは異なる固有値をコードしていることが報告されている。したがって、MBONの価を要約することは、適切な行動出力を得るために重要かもしれない[34,35]。少なくとも9種類のMBONがあり、その樹状突起はα′β′葉の異なるサブドメインに制限されている[34,36](S3H-S3P図)。我々は、GtACRを介した神経細胞活動のサイレンシングによって、これらのα′β′関連MBONのHAB制御への関与を個別に検証した(図7A、7BおよびS11)。その結果、行動アッセイ中にMBON-α′3(図7A)またはMBON-β′1(図7B)の活性を一過性に阻害すると、満腹状態でも空腹状態でもHABが阻害されることが示された。さらに、脳のライブイメージングにより、MBON-α′3およびMBON-β′1が両方の摂食状態において高温刺激に反応することも示された(図7Cおよび7D)。これらの結果は、α′β′MBnからの統合情報がMBON-α′3およびMBON-β′1を介して伝達され、飽食および空腹状態のハエがHABを適切に実行することを示唆している。
拡大サムネイル
図7. MBON-α′3および-β′1はα′β′MBnから収束した情報を出力する。
(A)MBON-α′3(MB027B-GAL4で標識)活性の光遺伝学的サイレンシングは、両方の摂食状態(満腹: P値: <左から順に<0.0001、<0.0001、<0.0109、空腹: P値: 左から0.0008、0.0016、0.0026、0.1663)。(B)MBON-β′1(MB057B-GAL4で標識)活性のオプトジェニックサイレンシングは、両方の摂食状態においてHABを抑制した(満腹: P値: 満腹:P値:左から<0.0001、<0.0001、0.0136、0.0053;空腹: P値: 左から0.0004、0.0001、<0.0001、0.0056)。(C)暑熱刺激は、飽食のハエ(黒)ではMBON-α′3のカルシウム応答を誘導したが、空腹ハエ(赤)では暑熱応答の増加が観察された(P = 0.0353)。MBON-α′3樹状突起のGCaMP強度変化(ΔF/F0)を記録し、解析した。(D)暑熱刺激は、空腹ハエ(赤)では暑熱反応の増加が観察されたのに対し、飽食ハエ(黒)ではMBON-β′1のカルシウム応答を誘導した(P = 0.0134)。MBON-β′1樹状突起のGCaMP強度変化(ΔF/F0)を記録し、解析した。各カルシウム応答曲線の下の矢印は、高温刺激が加えられた時点を示す。各Nは、行動アッセイで一緒に分析した15匹のハエのグループ(A, B)、またはカルシウムイメージング実験における1匹のハエの反応(C, D)を示す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析(one-way ANOVA)、Tukeyの検定(A, B)、または対応のない両側t検定(C, D)で分析した。*P < 0.05. HABは高温回避行動、MBnはキノコ体ニューロン、MBONはキノコ体出力ニューロン、SEMは平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g007
詳細 "
考察
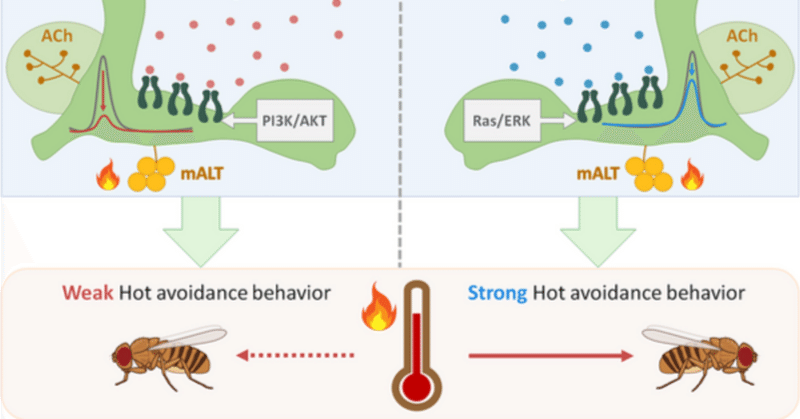
マウスにおいて、インスリンが視床下部の温感ニューロンの活動を直接阻害することが報告されており、インスリンが熱い刺激の感覚を抑制していることが示唆されている [37] 。現在、熱ストレスに対する生理的反応に対するインスリンシグナルの影響が検討されている。本研究では、ショウジョウバエの異なる摂食条件下で、高温を感知するためのインスリンシグナルの制御の根底にある細胞メカニズムを明らかにした。ハエは摂食状態で比較的高い温度にいることを好む(図1B)。高温刺激に対するこのような差のある反応は、α′β′MBnに異なるレベルの抑制をもたらす異なるインスリンシグナルによって厳密に制御されている(図2)。われわれは、ハエは空腹状態の方が飽食状態よりも強いHABを示すことを示した。我々のデータは、空腹状態ではIPCから分泌されるDilp2が満腹情報をα′β′MBnに伝達し、PI3K/ACTシグナルを誘導することによってα′β′MBnの活性を抑制することを示唆している(図3)。一方、空腹状態では、Dilp6が脂肪体から放出され、空腹シグナルをα′β′MBnに伝え、Ras/ERKシグナルを誘導することによりα′β′MBnの活性を抑制する(図4)。我々の免疫組織化学的データもまた、α′β′MBnのpAKTとpERKのレベルが、それぞれ飽食状態と空腹状態で上昇するという考えを支持している(図5)。我々の結果はさらに、Dilp2がpAKTレベルを増加させる一方、Dilp6がα′β′MBnの空腹時および飽食時のpERKレベルを増加させることを示唆している(図5Eおよび5F)。しかしながら、α′β′MBnではDilp2もpERKレベルを増加させ、Dilp6もpAKTレベルを増加させる可能性を完全に否定することはできない。ここで我々は、異なる摂食状態下でDilp2とDilp6によって誘導される異なる細胞内シグナルが、いずれもα′β′MBnの高温応答を抑制していることを提唱する(図8)。
拡大サムネイル
図8. ショウジョウバエにおける摂食状態に依存した高温回避の神経細胞機構。
高温刺激はコリン作動性mALTニューロンを介してα′β′MBn(緑色)に伝えられ、α′β′MBnの活性はHABと正の相関がある。食餌飽和状態では、IPCからDilp2が分泌され、PI3K/ACTシグナルを誘導することでα′β′MBnの高温応答を抑制し、弱いHABを引き起こす。一方、空腹状態ではIPCからDilp2はもはや放出されない。代わりに脂肪体からDilp6が放出され、Ras/ERKシグナルを誘導することによってα′β′MBnの高温応答を抑制する。空腹状態におけるRas/ERKの抑制効率はPI3K/AKTシグナルほど強くないため、ハエはα′β′MBnに強い高温応答を示し、それが強いHABに寄与し、その結果、空腹状態でエネルギーを節約するために代謝を低下させるハエの高温回避行動が増加する。HAB、高温回避行動、IPC、インスリン産生細胞、mALT、内側触角葉路、MBn、キノコ体ニューロン、SEM、平均値の標準誤差。
doi:10.1371/journal.pbio.3002332.g008
詳細 "
以前の研究で、成体脂肪体でDilp6を過剰発現させると、IPCにおけるDilp2とDilp5の発現が抑制され、Dilp2の血液リンパへの分泌が抑制されることが示された[19]。我々の抗Dilp2免疫染色のデータからも、脂肪体におけるdilp6の遺伝子ノックダウンがIPCにおけるDilp2の発現を増加させることが示された。対照的に、脂肪体におけるdilp6の過剰発現は、満腹状態と空腹状態の両方において、IPCにおけるDilp2の発現を減少させた(S12図)。脂肪体におけるDilp6の発現は、脳におけるshort neuropeptide F(sNPF)の発現を減少させることが示されている。このsNPFの減少は、IPCにおけるDilp2の抑制と関連している可能性がある [19,38]。循環するDilp2を減少させることは、寿命の延長と、それに相関する糖質/脂質の貯蔵と酸化ストレス抵抗性の変化に寄与する可能性がある。我々は、飢餓状態の脂肪体におけるDilp6の分泌が、IPCにおけるDilp2の発現を抑制するだけでなく、α′β′MBnにおけるRas/ERKシグナルを誘導し、飢餓状態に依存したHABに寄与していると推測している(図4)。
Dilp2、Dilp3、Dilp5とは対照的に、Dilp1はIPC、特に蛹と成虫の初期に一過性に発現することが示されている[39,40]。Dilp1の免疫組織化学的データから、Dilp1は羽化したばかりの成虫で発現し、1週間後には劇的に減少することが示された[39]。しかし、成虫のIPCにおけるDilp1の発現は6週間以上持続し、休止状態では7週間後にわずかに減少するのみであった[39,41]。成虫の初期段階における一時的なDilp1の発現は、通常の条件下における蛹から成虫への代謝的移行に関連している可能性が提唱されている。dilp1の変異は蛹化期の体重を減少させるが、dilp1の過剰発現は体重を増加させる[40]。飢餓時の生存率は、開腹したばかりのメスハエでは著しく低下するが、6~7日齢のdilp1変異体メスハエでは低下しない。さらに、dilp1変異雄ハエでは飢餓抵抗性は影響を受けない[40]。したがって、本研究では7〜10日齢の成虫を実験に用いたので、Dilp1がHABのα′β′MBnニューロン活性を制御しているとは考えにくい。
以前の研究で、Dilp6が飢餓時のACニューロン活性を制御することが示された[18]が、これは飢餓によるTpの減少につながり、空腹のハエは25℃よりも23℃にとどまることを好むので、今回の結果と一致する(図1B)。α′β′MBnでInR発現を操作しても寒冷回避とTpには影響がなかったことから、このシグナル伝達はHABにのみ関与していることが示唆された(図2G、2H、S4GおよびS4H)。飢餓により脂肪体から誘導されたDilp6の分泌は、ACニューロンとα′β′MBnの両方を制御し、飢餓状態におけるTpとHABの変化に寄与している。D.melanogasterでは8種類のDilpが発現しているが、ハエには単一のInRしか存在しないことから、Dilp2とDilp6はα′β′MBnの同じInRに結合するが、異なる摂食条件下では異なるシグナル伝達経路を引き起こし、異なるレベルの高温反応とHABに寄与することが示唆された。先行研究では、Dilp2とDilp5がショウジョウバエS2細胞におけるpAKTのシグナル伝達動態を異なって調節し、Dilp2がAKTの急性で一過性のリン酸化を誘導するのに対し、Dilp5は持続的なAKTリン酸化を誘導することが示された[42]。これらの結果は、異なるDilpリガンドが1 InRを介して異なる細胞内伝達動態を引き起こす可能性があるという考えを支持している。しかしながら、α′β′MBnの同じInRに結合したDilpが、異なる摂食状態下でどのように異なる細胞内シグナル伝達を引き起こすかは、依然として不明である。
我々の結果は、αβおよびγMBnのインスリン受容体はHABに関与しないことを明らかにした(S4B-S4E図)。しかしながら、αβあるいはγMBnの活性を時間的にサイレンシングすると、飽食状態でのHABが減少した(図1Eおよび1F)。このことは、αβおよびγMBnが他のメカニズムでHABを制御していることを示唆している。ドーパミンは中枢および末梢神経系で産生される必須神経伝達物質であり、神経調節に重要な役割を果たしている[43]。いくつかの研究で、ドーパミンが体温調節に関与していることが示されている。視床下部のドーパミン作動性経路は、高い体温に対する耐性を改善し、人体の体温上昇速度を遅らせるのに役立っている。ラットでは、視索前野と視床下部前部のドーパミン分解過程が活発で、運動中の体温調節に一役買っている [45] 。ハエでは、大脳後外側原基(PPL)クラスターと大脳前内側原基(PAM)クラスターを含む2種類のドーパミン作動性ニューロンの軸索がMB葉を神経支配し、寒冷信号をMBnに伝達している[23,46]。PPL1-α3/α′3、PPL1-α2α′2、PPL1-γ2α′1、PPL1-γ1pedc、PAM-β2、PAM-β′2が寒冷刺激に反応することが示されており、寒冷信号をMB葉に伝える生理学的役割が示唆されている[23,46,47]。
温度感覚以外にも、ドーパミン作動性ニューロンはショウジョウバエの摂食状態とMBn活性を制御している。以前の研究では、ドーパミン作動性ニューロンは匂い/味覚の価をコードし、特定のMB葉コンパートメントにおける内部生理を制御することが示された [48]。他の研究では、ドーパミン作動性PPL1-α′2α2ニューロンは満腹シグナルのみを受け取るのに対し、PAM-β2β′2aとPPL1-γ2α′1ニューロンは満腹シグナルと空腹シグナルの両方を受け取ることが示されている[25,49]。さらに、栄養価の高い砂糖の摂食は、ドーパミン作動性PAM-γ3ニューロンの活性を即座に抑制し、砂糖による報酬記憶形成のための正の強化シグナルを提供する [50]。これらを合わせると、HABに関与するαβおよびγMBnの活性は、ショウジョウバエの飽食状態におけるドーパミン作動性の調節によって制御されている可能性がある。
ショウジョウバエでは、高温感覚は最後の触角節であるアリスタの温度受容器に依存している [4-6]。高温信号は触角葉から、高温に反応するmALT投射ニューロンを介して、MB萼片、LH、PLPを含む高次脳中枢に伝達される[7](図6A)。われわれの脳画像データは、mALT軸索とMB樹状突起に共局在シグナルを示し、mALTとMBnのシナプス結合を示唆した(図6B)。さらに、免疫組織化学のデータからも、mALTはアセチルコリンをMBnに伝達するコリン作動性ニューロンであることが示唆された(図6CとS10A)。mALT神経細胞活性をサイレンシングするか、mALTのChATをノックダウンすると、飽食時と空腹時のHABが減少したことから、mALTはコリン作動性伝達を介して、両方の摂食状態でホットシグナルを伝えていることが示唆された(図6Dと6E)。CsChrimsonを介したmALTの光遺伝学的活性化は、α′β′MBnにおいて有意なカルシウム応答を誘導したが、mALT活性をサイレンシングすると、両方の摂食状態においてα′β′MBnのホット応答が消失した(図6GおよびS10E)。これらの結果は、α′β′MBnがmALTニューロンの下流にあり、mALTから高温入力を受けていることを示している。興味深いことに、われわれのライブカルシウム脳イメージングデータは、両方の摂食状態下でmALTニューロンにおけるホット応答レベルが同じであることを明らかにし、満腹および空腹シグナルがmALTのホット応答に影響を及ぼさないことを示した(図6F)。インスリンシグナルはα′β′MBnの活性を抑制しただけで、高温刺激にさらされた上流のmALTの活性は抑制しなかった(図2-6)。
これまでの研究で、強化ドパミン作動性ニューロンの人為的な活性化と対になったMBn活性化により、MBn-MBONシナプスにおけるシナプス強度がコンパートメント特異的に変化することが示されており、MBからの統合情報が特定のMBONに伝達されることが示唆されている[34,35,51,52]。ハエの脳では少なくとも9種類のα′β′関連MBONが報告されており、そのいくつかはショウジョウバエの嗅覚記憶、視覚記憶、睡眠調節に重要な役割を果たしている[34,36,53-55]。ここで、それぞれのα′β′関連MBONのHABへの関与を個別に検証したところ、MBON-α′3とMBON-β′1の活性が、飽食状態と空腹状態でのHABに必要であることが明らかになった(図7Aと7B)。空腹状態のハエでは高温刺激に応答してα′β′MBnの活性が上昇したので(図1J)、これらのハエでは高温刺激に対するMBON-α′3およびMBON-β′1のカルシウム応答も上昇した(図7Cおよび7D)。MBON-α′3は、嫌悪的嗅覚条件付け後、抑制された短時間の記憶痕跡を形成し、その活性が15分間の記憶に必要であることが示されている[56]。さらに、MBON-β′1活性は、ポリアミンの匂い嗜好性とメスのハエの交尾行動に重要である[57]。我々の結果は、ショウジョウバエにおいて高温刺激に応答し、HABの実行を制御するMBON-α′3とMBON-β′1の生理的役割を示した(図7)。
飢餓状態のハエと比較して、食欲のあるハエが比較的高い温度で留まることを好む理由はまだわかっていない。ひとつの仮説として、飢餓状態ではハエは行動を変化させ、高温刺激に敏感になることでエネルギーを節約しようとする。対照的に、摂食後のハエは高温刺激に対する感受性が低下し、代謝率を上げるために比較的高温に近づくHABが減少する。栄養状態がショウジョウバエの温度感知行動にどのように影響するのか、その詳細なメカニズムは未知のままであり、今後の研究課題として興味深い。
材料と方法
ハエ株
W1118ハエを野生型コントロールとして用いた。本研究では以下のハエ系統を用いた: VT30559-GAL4 (Vienna Drosophila Resource Center, VDRC: 206077), VT44966-GAL4 (VDRC: 203571), VT49246-GAL4 (Ann-Shyn Chiang's Lab), VT30604-GAL4 (VDRC: 200228), R16A06-GAL4 (Bloomington Drosophila Stock Center, BDSC: 48709), C739-GAL4 (BDSC: 7362), VT57244-GAL4 (VDRC: 200970), dilp2-GAL4 (BDSC: 37516), C305a-GAL4 (BDSC: 30829), cg-GAL4 (BDSC: 7011), VT40053-GAL4 (VDRC: 201352), MB011B-GAL4 (BDSC: 68294), MB027B-GAL4 (BDSC: 68301)、C305a-GAL4(BDSC:68301)、MB050B-GAL4(BDSC:68365)、MB051B-GAL4(BDSC:68275)、MB057B-GAL4(BDSC: 68277), MB083C-GAL4(BDSC: 68287), MB091C-GAL4(Ann-Shyn Chiang's Lab), VT0765-GAL4(Ann-Shyn Chiang's Lab), VT41043-GAL4(VDRC: 200099)、MB247-lexA(Ann-Shyn Chiangの研究室)、R35B12-lexA(BDSC:52735)、dilp2-/-(BDSC:30881)、dilp3-/-(BDSC:30882)、dilp5-/-(BDSC:30884)、dilp6LOF(BDSC:30885)、tublin-Gal80ts(Chr. 2)(BDSC:7019)、tublin-Gal80ts(Chr.3)(BDSC:7017)、UAS-GCaMP7s(Chr.2)(BDSC:80905)、UAS-GCaMP7s(Chr. 3)(BDSC:79032)、lexAop-GCaMP7s(BDSC:80913)、UAS-GtACR2(Suewei Lin's Lab)、UAS-kir2.1::eGFP(Suewei Lin's Lab)、UAS-mCD8:GFP(Chr.2)(BDSC:5137)、UAS-mCD8:GFP(Chr. 3)(BDSC:5130)、UAS-CsChrimson(BDSC:82181)、UAS-InRDN(Pei-Yu Wangの研究室)、UAS-InRCA(Pei-Yu Wangの研究室)、UAS-dilp2RNAi(VDRC:102158)、UAS-dilp2(BDSC:80936)、UAS-PI3KDN(BDSC:8288)、UAS-AKTRNAi(VDRC: 103703)、UAS-AKT(Horng-Dar Wangの研究室)、UAS-dilp6RNAi(VDRC:102465)、UAS-dilp6(Igor Vuillezの研究室)、UAS-RasRNAi(VDRC: 106642)、UAS-RafRNAi(VDRC:107766)、UAS-ErkRNAi(VDRC:109108)、UAS-Erk(BDSC:36270)、およびUAS-ChATRNAi(BDSC:25856)。ハエは標準的なコーンミール餌と12時間:12時間の明:暗サイクルで飼育した。特に断りのない限り、すべてのハエは24℃、湿度50%~60%で飼育した。飢餓を誘発するために、希望する群から約300匹のハエを、6cm×3cmの水に浸したろ紙を用い、24℃で22~26時間飢餓状態にした。光遺伝学実験では、行動アッセイとカルシウムイメージングアッセイの前に、400 mMのオールトランスレチナールを含む標準的なコーンミールフードでハエを4日間飼育した。
温度回避行動アッセイ
温度回避行動の解析に使用した装置は、以前に記述したように準備した[6,8]。装置の各象限には、アルミニウム板(6cm×6cm)を用いた熱電冷却チップ、温度センサー、ヒートスプレッダー、マイクロコントローラーの4つのコンポーネントが含まれていた。第1象限と第3象限の温度は25℃に設定され、第2象限と第4象限は実験温度(15~35℃)に設定された。パルス幅変調(PWM)は、サーモエレクトリック冷却モジュールの動作電圧を制御するためにサーモエレクトリック装置に使用され、異なる温度範囲に応じてヒートスプレッダの冷却ファンの電源をオンにするかどうかを決定する。マイクロコントローラは、熱電冷却モジュールの特性に応じて、異なる温度範囲で異なるPWMパラメータを設定します。マイコンは、アルミニウム板の温度値と冷却ファンの電力状態の情報をコンピュータに送信し、リアルタイムの温度制御状態を監視する。各試験の間、ハエが装置から逃げないようにRainXを塗布したガラスで装置を覆い、各試験温度に対する回避指数を算出した。アッセイは24℃、湿度50~60%に保たれた室内で行った。7~10日齢の雌雄15匹のハエ群を98% CO2で鎮圧し、アリーナにランダムに配置した。ハエはアルミ板上を自由に移動し、その動きを3分間記録した。回避指数は(25℃でのハエ数-試験温度でのハエ数)/ハエ総数で定義した。回避指数は、対応のないt検定(2群)または分散分析(ANOVA)(3群)を用いて比較した。
成虫期特異的遺伝子ノックダウンまたは成虫期特異的遺伝子発現実験では、tub-GAL80tsトランスジーンを導入し、GAL4の発現を時間的に抑制した。実験群のハエは発生期間中18℃で飼育した。脱胚後、ハエは5日間30℃に移され、行動アッセイの前に12時間24℃に戻された。我々のヒートショックプロトコルでは、24℃で飼育したハエと比較してHABは変化しなかった(S13図)。対照群のハエは発育中ずっと18℃に保たれていた。食後、行動アッセイを実施する前に、5.5日間24℃に移した。行動アッセイはすべて24℃で行った。
GtACR2を介した神経細胞サイレンシング実験では、約2.4mW/cm2の強度の青色光(468nm)照射下で3分間、温度回避行動を記録した。CsChrimsonを介した神経細胞活性化実験では、赤色光(625 nm)を約11.2 mW/cm2の強度で3分間照射し、温度回避行動を記録した。実験中、ハエには青色光または赤色光を3分間照射した。
免疫組織化学と共焦点イメージング
ハエの脳を PBS で解剖し、氷上で 4%パラホルムアルデヒドで固定し、マイクロ波照射 (2,450 MHz; 1,100 ワット) を 60 秒間、連続回転させながら 3 回繰り返した。次に、脳サンプルをブロッキングバッファー(10%正常ヤギ血清と2%Triton X-100を含むPBS)中でインキュベートし、真空チャンバー中で脱気(270mmHgまで減圧し、10分間保持)を6サイクル行った。次に、脳をブロッキングバッファーでブロックし、25℃で2時間透過処理した。ハエの脳をマウス4F3抗ディスクラージ(DLG)モノクローナル抗体(1:10; AB-528203, Developmental Studies Hybridoma Bank, University of Iowa)、マウス抗ChAT(1: 200; ChAT4B1, Developmental Studies Hybridoma Bank, University of Iowa)、ウサギ抗Dilp2(1:200; Takashi Nishimura's lab)、ウサギ抗pAKT(1:200; #9271 , Cell Signaling Technology)、またはウサギ抗pERK(1:200; #4376 , Cell Signaling Technology)。PBS-Tで3回集中的に洗浄した後、ビオチン化ヤギ抗マウスIgG(1:200; B-2763, Thermo Fisher Scientific)またはヤギ抗ウサギIgG(1:200; B-2770, Thermo Fisher Scientific)と共に25℃で24時間インキュベートした。次に、サンプルを洗浄し、Alexa Fluor 633 streptavidin(1:500、Invitrogen)と共に25℃でさらに24時間インキュベートした。洗浄後、サンプルをクリアし、FocusClear(FC-101、CelExplorer)を用いてマウントした。サンプルをカバースリップで覆い、Zeiss LSM 700共焦点顕微鏡を用い、63×グリセリン浸漬対物レンズ(N.A.=1.4、作動距離170μm)または40×C-アポクロマット水浸漬対物レンズ(N.A.=1.2、作動距離220μm)で撮像した。ピンホール(光学部)は、63×対物レンズで撮影した場合は1.5μm、40×対物レンズで撮影した場合は2μmに設定した。すべての画像はZENまたはImageJソフトウェアを用いて処理した。
脳カルシウムイメージング
脳カルシウムのライブイメージング実験は、我々の以前の研究[23]に記載されているように行った。ハエ脳内の高温刺激に対する細胞内カルシウムイオンの変化をモニターするため、GCaMP7を発現するハエを250μlのピペットチップを用いて固定化した。細いピンセットを用いて頭部カプセルに小さな開口部を作り、脳の脱水を防ぐために成体血液リンパ様(AHL)生理食塩水(108 mM NaCl、5 mM KCl、2 mM CaCl2、8.2 mM MgCl2、4 mM NaHCO3、1 mM NaH2PO4、5 mM トレハロース、10 mM ショ糖、5 mM HEPES(pH7.5)、265 mOsm)を直ちに滴下した。ピペットチップをハエとともに、24℃で400μlのAHL溶液を入れた灌流チャンバーに取り付けた。55℃でさらに200μlのAHL溶液を加えて温刺激を与えた。溶液の最終温度(約31℃)は温度計を用いてモニターした。高温刺激前後のGCaMP強度のタイムラプス記録は、40×Achroplan IRレンズを装着したZeiss LSM700顕微鏡を用いて行った。タイムラプス記録には、488nmの励起レーザーと555nmのショートパスフィルターを通過した発光の検出器を用いた。解像度が512×512ピクセルの光学スライスを、2フレーム/秒の速度で75秒間連続的にモニターした。光遺伝学実験では、ハエを400 mMのオールトランスレチナール(R2500、SIGMA)を含む培地で4日間飼育した後、上述のようにカルシウムイメージングアッセイを行った。625nmのLEDを光源としてCsChrimson発現ニューロンを活性化し、Zeiss LSM700顕微鏡を用いてGCaMPシグナルを記録した。関心領域(ROI)は、解剖学的に異なる神経乳頭またはソーマ領域に手動で割り当て、各図の凡例に詳述した。F0は、温度刺激前の蛍光強度の20フレームの平均として定義した。ΔFは温度刺激後の蛍光強度変化と定義し、刺激後の蛍光強度からF0を引いたものである。温度による強度変化をΔF/F0として計算し、ImageJソフトウェアを用いて強度マップを作成した。最大(max)強度(8ビット2進数、255)は赤色で、最小強度(8ビット2進数、0)は青色で表示した。
統計解析
生データはPrism 6.0ソフトウェア(GraphPad)を用いてパラメトリックに解析した。2群の生データは、対応のない両側t検定を用いて評価した。3群の未加工データは、一元配置分散分析(ANOVA)およびTukeyの多重比較検定を用いて評価した。P値<0.05を統計的に有意とみなした。各実験のN値は図中に示した。すべてのデータは平均値±平均値の標準誤差(SEM)で示した。
参考情報
S1 図. サーモエレクトリックデバイスの導入。
(A, B)熱電デバイスの上面図(A)と側面図(B)。熱電デバイスには、マイクロコントローラーシステム、温度センサー、アルミニウムプレート、冷却チップ、ヒートスプレッダー、ガラスカバーの6つの部品が含まれている。パルス幅変調(PWM)は、熱電冷却モジュールの動作電圧の制御に使用されます。サーモエレクトリック冷却モジュールは、15℃から35℃の範囲でアルミニウムプレートの温度を制御するために使用される。各熱電冷却モジュール上に6×6cmのアルミ板を設置し、伝導速度を高めています。放熱のために、各冷却チップの下にアルミニウム製のヒートスプレッダーを設置しました。4つの熱電冷却モジュールを並べてアリーナを形成し、各熱電冷却モジュールに温度センサーを追加した。(C)二者択一アッセイ実験におけるサーモエレクトリック装置上のハエの分布。(D)サーモエレクトリック装置の精度と安定性を示す。2'(明赤色領域)と4'(暗赤色領域)の四分円はそれぞれ異なる試験温度(15、17、19、21、23、27、29、31、33、35℃)に設定した。1'(暗緑色領域)と3'(明緑色領域)のクワドラントは25℃に設定された。各4象限プレートの温度は3,600秒間記録された。各アルミニウムプレートの誤差は、すべての試験温度設定において1℃以下(約0.5℃)であった。(E、F)3分間の青色光または赤色光の照射では、熱電素子のアルミニウムプレートの設定温度に変化は見られなかった。2'(明赤色領域)と4'(暗赤色領域)の四分円は、異なる試験温度(27、29、31、33℃)に設定された。1'(暗緑色領域)と3'(明緑色領域)は25℃に設定された。青色光(E)と赤色光(F)の照射条件において、各アルミニウム板の誤差は1℃以下であった。この図の基礎となるデータはS1 Dataにある。
doi:10.1371/journal.pbio.3002332.s001
(TIF)
S2 図. MBn活性はHABに重要である。
(A)VT30559-GAL4>UAS-kir2.1を介してMBn活性をサイレンシングすると、満腹状態と空腹状態の両方でHABが減少した(満腹状態: P値: 左から0.033、<0.0001、0.0073、0.1177;空腹: P値: 左から0.0002、0.0097、0.0002、0.4309)。(B)空腹のハエは、青色光照射下で、飽食のハエよりも有意に高いHABを示した(P値: 左から0.0832、0.3191、0.2438、0.202、0.0006、0.7372、0.0003、0.0124、0.0058、0.0387、0.0569)。(C)赤色光照射下では、空腹ハエは飽食ハエよりも有意に高いHABを示した。P値 左から0.7901、0.9453、0.8403、0.6582、0.0015、0.4891、0.002、0.0231、0.0004、0.0101、0.0962)。(D)R16A06-GAL4>UAS-GtACR2を介してγMBn活性をサイレンシングすると、満腹状態(Satiety: P値: <左から0.0001、0.0005、0.0024、0.1123: P値: 左から0.5773、0.7602、0.1986、0.9307)。(E)C739-GAL4>UAS-GtACR2を介してαβMBn活性をサイレンシングすると、満腹状態のHABが減少した(Satiety: P値: 左から0.0002、0.0001、0.0002、<0.0001: P値: 左から0.8762、0.7292、0.684、0.422)。(F)VT57244-GAL4>UAS-GtACR2を介してα′β′MBn活性をサイレンシングすると、満腹時と空腹時のHABが減少した(満腹時: P値: 左から<0.0001、0.0009、<0.0001、<0.0001;空腹: P値: 左から0.0009、0.0111、<0.0001、0.0001)。(G)VT30604-GAL4>UAS-CsChrimsonを介したα′β′MBn活性化はHABを増加させた(満腹感: P値: <左から0.0001、0.0058、0.0005、0.1063;空腹感: P値: 左から0.0082、0.0116、0.0011、0.4237)。(H)室温刺激は、γ、αβおよびα′β′MBnにおいて有意なカルシウム応答を誘導しなかった。γ、αβおよびα′β′MBn水平葉におけるGCaMP強度変化(ΔF/F0)を記録し、解析した。室温刺激の前後でγ、αβ、α′β′MBnのGCaMP強度に有意差はなかった(P値:左から0.9902、0.298、0.2444)。各カルシウム応答曲線の下の矢印は、室温刺激(24℃)を加えた時点を示す。各Nは、行動アッセイで一緒に分析した15匹のハエのグループ(A-G)またはカルシウムイメージング実験で分析した1匹のハエ(H)を表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析(one-way ANOVA)、Tukeyの検定(A, D, E-G)、または対応のない両側t検定(B, C, H)で分析した。
doi:10.1371/journal.pbio.3002332.s002
(TIF)
S3 図. 異なるGAL4ドライバーを用いたハエのGFP発現パターン。
(A)VT30559-GAL4を発現させたMBn。(B)VT44966-GAL4を発現させたγMBn。(C)VT49246-GAL4を発現させたαβMBn。(D)VT30604-GAL4を発現させたα′β′MBn。(E)R16A06-GAL4を発現させたγMBn。(F)C739-GAL4を発現させたαβMBn。(G)VT57244-GAL4を発現させたα′β′MBn。(H)MB011B-GAL4を発現させたMBON-γ5β′2a。(I)MB027B-GAL4を発現させたMBON-α′3。(J)MB050B-GAL4を発現させたMBON-α′1。(K)MB051B-GAL4を発現させたMBON-γ2α′1。(L)MB057B-GAL4を発現させたMBON-β′1。(M)MB083C-GAL4を発現させたMBON-γ3β′1。(N)MB091C-GAL4を発現させたMBON-α′2。(O)VT0765-GAL4を発現させたMBON-β2β′2a。(P)VT41043-GAL4を発現させたMBON-β′2。各GAL4系統をUAS-mCD8::GFP; UAS-mCD8::GFPレポーター系統と交配し、子孫について共焦点脳イメージングを行った。脳神経乳頭は抗DLG抗体(マゼンタ)で対比染色した。スケールバーは50μm。
doi:10.1371/journal.pbio.3002332.s003
(TIF)。
S4 図:α′β′MBnにおけるInR操作はHABに影響する。
(A)VT57244-GAL4>UAS-InRDNを介したα′β′MBnにおけるInRDNの遺伝子発現は、満腹状態と空腹状態の両方でHABを増加させた(満腹度: P値: 左から0.0003、<0.0001、<0.0001、0.0003;空腹: P値: <0.0001、<0.0001、<0.0001、左から0.0002)。(B)VT44966-GAL4>UAS-InRDNを介したγMBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態: P値 左から0.3221、0.9858、0.6006、0.8822;空腹状態: P値: 左から0.9897、0.6707、0.8446、0.5868)。(C)R16A06-GAL4>UAS-InRDNを介したγMBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態:P値:0.9897、空腹状態:P値:0.6707、空腹状態:P値:0.586): P値 左から0.3765、0.8375、0.9045、0.9183: P値: 左から0.5816、0.8305、0.8359、0.7554)。(D)VT49246-GAL4>UAS-InRDNを介したαβMBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態:P値:0.5816、空腹状態:P値:0.8305、空腹状態:P値:0.7554): P値 左から0.9815、0.4656、0.9837、0.9286: P値: 左から0.9478、0.9479、0.9743、0.9928)。(E)C739-GAL4>UAS-InRDNを介したαβMBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態:P値:0.9478、空腹状態:P値:0.9743、空腹状態:P値:0.9928): P値 左から0.9846、0.7737、0.7182、0.7518;空腹状態: P値: 左から0.5773、0.6921、0.853、0.4112)。(F)図2Eの許容温度制御。許容温度では、飽食状態および空腹状態において、tub-GAL80ts; VT30604-GAL4 > InRDN、tub-GAL80ts; VT30604-GAL4 >+、およびUAS-InRDN >+のハエ間でHABに有意差は見られなかった(Satiety: P値: 左から0.4415、0.7193、0.7097、0.9129;空腹: P値: 左から0.9994、0.7927、0.9944、0.3847)。(G)VT30604-GAL4>UAS-InRDNを介したα′β′MBnにおけるInRDNの遺伝子発現は、満腹および空腹状態における寒冷回避行動に影響を及ぼさなかった(満腹: P値 左から0.4082、0.9822、0.9626、0.7241;空腹: P値: 左から0.5038、0.9253、0.7114、0.6802)。(H)VT57244-GAL4>UAS-InRDNを介したα′β′MBnにおけるInRDNの遺伝子発現は、満腹状態および空腹状態のいずれにおいても寒冷回避行動に影響を及ぼさなかった(満腹状態: P値 左から0.6194、0.7396、0.8875、0.8173;空腹: P値: 左から0.5038、0.5851、0.6177、0.7691)。各Nは行動アッセイで一緒に分析した15匹のハエのグループを表す。この図の基礎となるデータはS1 Dataにある。データは平均値±SEMで表し、ドットは個々の値を表し、一元配置分散分析(one-way ANOVA)後、Tukeyの検定で分析した。
doi:10.1371/journal.pbio.3002332.s004
(TIF)
S5 図:α′β′MBnにおけるInR操作の追加実験。
(A)α′β′MBnにおけるVT57244-GAL4>UAS-InRCAを介したInRCAの遺伝子発現は、満腹状態と空腹状態の両方でHABを減少させた(満腹度: P値 左から0.0006、<0.0001、<0.0001、<0.0001;空腹: P値: 左から0.0002、<0.0001、0.0039、0.8281)。(B)図2Fの許容温度制御。許容温度では、飽食状態と空腹状態の両方において、tub-GAL80ts; VT30604-GAL4 > InRCA、tub-GAL80ts; VT30604-GAL4 >+、およびUAS-InRCA >+のハエ間でHABに有意差は見られなかった(Satiety: P値: 左から0.919、0.503、0.5766、0.6841;空腹: P値: 左から0.2961、0.8591、0.7777、0.9495)。(C)α′β′MBnにおけるInRCAの遺伝子発現は、満腹状態および空腹状態のいずれにおいても寒冷回避行動に影響を与えなかった(満腹状態: P値: 左から0.9561、0.8529、0.2998、0.655;空腹状態: P値: 左から0.7102、0.9054、0.843、0.2119)。(D)GFP(緑)で標識されたα′β′MBnの形態は、UAS-mCD8::GFP/UAS-InRDN; VT30604-GAL4/+またはUAS-mCD8::GFP/UAS-InRCA; VT30604-GAL4/+を持つハエでは影響を受けなかった。各Nは行動アッセイ(A-C)で一緒に分析した15匹のハエのグループを表す。この図の基礎となるデータはS1 Dataにある。データは平均値±SEMで表し、ドットは個々の値を表し、一元配置分散分析(one-way ANOVA)後、Tukeyの検定で分析した。
doi:10.1371/journal.pbio.3002332.s005
(TIF)
S6 図:IPCにおけるdilp2の操作は、鎮静状態におけるHABに影響を与える。
(A)dilp3変異体(dilp3-/-)およびdilp5変異体(dilp5-/-)では、HABは影響を受けなかった(満腹状態: P値: 左から0.6672、0.4866、0.8345、0.4314;空腹: P値: 左から0.1133、0.2915、0.718、0.426)。(B)dilp2-GAL4>UAS-dilp2RNAiハエは、満腹状態においてHABの増加を示した(Satiety: P値: 左から<0.0001、<0.0001、<0.0001、<0.0001;空腹: P値: 左から0.6612、0.7088、0.2353、0.8943)。(C)図3Cの許容温度制御。許容温度では、dilp2-GAL4; tub-GAL80ts > UAS-dilp2RNAi、dilp2-GAL4; tub-GAL80ts > +、およびUAS-dilp2RNAi > +のハエ間で、飽食状態におけるHABに有意差は見られなかった(飽食:P値:左から0.8918、0.7176、0.5073、および0.7762)。(D) dilp2-GAL4 > UAS-mCD8::GFPハエにおける抗Dilp2抗体による免疫染色(左パネル)。満腹時と空腹時のGFP陽性IPCにおける抗Dilp2抗体免疫染色強度の定量化(右パネル)。IPCの抗Dilp2免疫染色シグナルは扇形体のシグナルに対して正規化した(P <0.0001)。スケールバー、20μm。(E)熱い刺激は、両方の摂食状態においてIPCのカルシウム応答を誘導しなかった。IPCのソーマを記録し、解析した。熱い刺激の前後でIPCのGCaMP強度に有意差はなかった(P値:0.8381)。カルシウム応答曲線下の矢印は、温熱刺激を加えた時点を示す。(F)図3Eの許容温度制御。許容温度では、飽食状態および空腹状態において、dilp2-GAL4; tub-GAL80ts > UAS-dilp2、dilp2-GAL4; tub-GAL80ts > +、およびUAS-dilp2 > +のハエ間でHABに有意差は見られなかった(Satiety: P値: 満腹状態:P値:左から0.5363、0.3002、0.8416、0.7235;空腹状態: P値: 左から0.3413、0.8279、0.9225、0.4409)。各Nは、行動アッセイ(A、B、C、F)で一緒に分析した15匹のハエのグループか、Dilp2免疫染色実験(D)およびカルシウムイメージング実験(E)で分析した1匹のハエを表す。この図の基礎となるデータはS1 Dataにある。データは平均値±SEMで表し、ドットは個々の値を表し、一元配置分散分析にTukeyの検定を加えたもの(A, B, C, F)、または対にしない両側t検定(D, E)で分析した。*P<0.05;nsは有意ではない。
doi:10.1371/journal.pbio.3002332.s006
(TIF)
S7 図:α′β′MBnにおけるPI3K/ACTシグナルの操作は、飽和状態のHABに影響する。
(A)VT30604-GAL4>UAS-PI3KDNを介したα′β′MBnにおけるPI3KDNの遺伝子発現は、満腹状態(Satiety: P値 左から0.0055、0.0072、0.0341、0.2073;空腹: P値: 左から0.6698、0.7836、0.6583、0.5004)。(B)VT57244-GAL4>UAS-PI3KDNを介したα′β′MBnにおけるPI3KDNの遺伝子発現は、満腹状態におけるHABを増加させた(満腹度: P値: 左から0.0002、<0.0001、<0.0001、0.002;空腹: P値: 左から0.4156、0.3309、0.6178、0.5198)。(C)VT30604-GAL4>UAS-AKTRNAiを介してα′β′MBnのAKTをRNAiでノックダウンすると、満腹状態のHABが増加した(Satiety: P値: <左から順に<0.0001、<0.0001、0.002、0.0018;空腹: P値: 左から0.9554、0.6714、0.9494、0.1951)。(D)VT57244-GAL4>UAS-AKTRNAiを介してα′β′MBnのAKTをRNAiでノックダウンすると、満腹状態のHABが増加した(Satiety: P値: 左から<0.0001、<0.0001、<0.0001、<0.0001;空腹: P値: 左から0.6866、0.3042、0.5841、0.588)。(E)α′β′MBnにおけるtub-GAL80tsを介したPI3KDNの成体段階特異的発現;VT30604-GAL4>UAS-PI3KDNは、満腹状態におけるHABを増加させた(満腹度: P値: <左から順に<0.0001、<0.0001、0.0003、0.2743;空腹: P値: 左から0.9187、0.9098、0.268、0.1859)。(F)許容温度では、飽食状態において、tub-GAL80ts; VT30604-GAL4 > UAS-PI3KDN, tub-GAL80ts; VT30604-GAL4 > +, UAS-PI3KDN > +のハエ間でHABに有意差は見られなかった(満腹:P値:左から0.9063, 0.7536, 0.7213, 0.5989)。(G)図3Gの許容温度制御。許容温度では、飽食状態におけるHABに、tub-GAL80ts; VT30604-GAL4 > UAS-AKTRNAi, tub-GAL80ts; VT30604-GAL4 > +, およびUAS-AKTRNAi > +のハエ間で有意差は見られなかった(Satiety: P値: 左から0.5946, 0.1219, 0.4254, および0.3847)。(H)VT30604-GAL4>UAS-AKTを介したα′β′MBnにおけるAKTの遺伝子発現は、飽食状態および空腹状態の両方においてHABを減少させた(Satiety: P値: 左から<0.0001、0.0054、0.0006、0.0918;空腹: P値: <左から0.0001、0.0005、0.0001、0.0588)。(I)図3Iの許容温度制御。許容温度では、飽食状態および空腹状態の両方において、tub-GAL80ts; VT30604-GAL4 > UAS-AKT, tub-GAL80ts; VT30604-GAL4 > +およびUAS-AKT > +のハエの間でHABに有意差は見られなかった(Satiety: P値: 左から0.3167、0.2275、0.9931、0.7261;空腹: P値: 左から0.6118、0.8815、0.7386、0.3188)。各Nは行動アッセイで分析した15匹のハエのグループを表す。この図の基礎となるデータはS1 Dataにある。データは平均値±SEMで表し、ドットは個々の値を表す。データは一元配置分散分析(one-way ANOVA)後、Tukeyの検定で分析した。*P < 0.05.
doi:10.1371/journal.pbio.3002332.s007
(TIF)
S8 図:脂肪体におけるdilp6の操作は空腹時のHABに影響する。
(A)cg-GAL4>UAS-dilp6RNAiによる脂肪体中のdilp6の遺伝的ノックダウンは、空腹状態におけるHABを増加させた(Satiety: P値: 左から0.746、0.8274、0.8812、0.5568;空腹: P値: <0.0001、0.0007、<0.0001、0.0338(左から右へ)。(B)図4Cの許容温度制御。許容温度では、ハングリー状態においてcg-GAL4; tub-GAL80ts > UAS-dilp6RNAi, cg-GAL4; tub-GAL80ts >+, UAS-dilp6RNAi > +のハエ間でHABに有意差は見られなかった(ハンガー:P値:左から0.9535, 0.8192, 0.305, 0.576)。(C)図4Eの許容温度制御。許容温度では、ハングリー状態の間、cg-GAL4; tub-GAL80ts > UAS-dilp6、cg-GAL4; tub-GAL80ts >+、およびUAS-dilp6 > +のハエ間でHABに有意差は見られなかった(ハンガー:P値:左から0.3979、0.6643、0.475、および0.3847)。各Nは行動アッセイで一緒に分析した15匹のハエのグループを表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析(one-way ANOVA)後、Tukeyの検定で分析した。*P < 0.05.
doi:10.1371/journal.pbio.3002332.s008
(TIF)
S9 図:α′β′MBnにおけるRas/ERK操作の追加実験。
(A)VT30604-GAL4>UAS-RasRNAiによるα′β′MBnのRasの遺伝的ノックダウンは、空腹状態におけるHABを増加させた(Satiety: P値 左から0.1516、0.2869、0.4018、0.8412;空腹: P値: <0.0001、<0.0001、0.0107、0.0599(左から右へ)。(B)VT57244-GAL4>UAS-RasRNAiによるα′β′MBnのRasの遺伝的ノックダウンは、空腹状態でのHABを増加させた(満腹度: P値 左から0.7096、0.7749、0.7044、0.8978;空腹: P値: <左から0.0001、0.0002、0.0006、0.0031)。(C)VT30604-GAL4>UAS-RafRNAiによるα′β′MBnのRafの遺伝的ノックダウンは空腹状態のHABを増加させた(Satiety: P値 左から0.7734、0.2772、0.197、0.6603;空腹: P値: 左から0.0002、<0.0001、0.0001、0.0356)。(D)VT57244-GAL4>UAS-RafRNAiによるα′β′MBnのRafの遺伝的ノックダウンは空腹状態のHABを増加させた(Satiety: P値 左から0.4945、0.7428、0.5287、0.5035;空腹: P値: 左から0.0099、<0.0001、<0.0001、0.0111)。(E)VT30604-GAL4>UAS-ErkRNAiによるα′β′MBnのErkの遺伝的ノックダウンは、空腹状態でのHABを増加させた(満腹度: P値 左から0.3408、0.8722、0.3893、0.8622;空腹: P値: <左から0.0001、0.0003、0.0298、0.0081)。(F)VT57244-GAL4>UAS-ErkRNAiによるα′β′MBnのErkの遺伝的ノックダウンは、空腹状態でのHABを増加させた(満腹度: P値 左から0.845、0.9818、0.9571、0.5833;空腹: P値: 左から0.0133、<0.0001、0.0064、0.0386)。(G) α′β′ MBnにおけるtub-GAL80ts; VT30604-GAL4 > UAS-RasRNAiを介したRasの成体期特異的ノックダウンは、空腹状態におけるHABを増加させた(Satiety: P値 左から0.4816、0.8399、0.8754、0.2618;空腹: P値: <0.0001、0.0058、0.0011、0.0091(左から右へ)。(H)許容温度では、空腹状態において、tub-GAL80ts; VT30604-GAL4 > UAS-RasRNAi、tub-GAL80ts; VT30604-GAL4 > +、UAS-RasRNAi > +のハエ間でHABに有意差は見られなかった(空腹:P値:左から0.4564、0.6483、0.7827、0.9778)。(I) tub-GAL80ts; VT30604-GAL4 > UAS-RafRNAiを介したα′β′MBnの成虫期特異的なRafのノックダウンは、空腹状態におけるHABを増加させた(Satiety: P値 左から0.2939、0.1489、0.3362、0.0771;空腹: P値: <0.0001、0.0003、0.0243、0.1183(左から右へ)。(J)許容温度では、空腹状態において、tub-GAL80ts; VT30604-GAL4 > UAS-RafRNAi、tub-GAL80ts; VT30604-GAL4 > +、UAS-RafRNAi > +のハエ間でHABに有意差は見られなかった(空腹:P値:左から0.4823、0.6508、0.6992、0.4289)。(K)図4Gの許容温度制御。許容温度では、空腹状態におけるHABに、tub-GAL80ts; VT30604-GAL4 > UAS-ErkRNAi, tub-GAL80ts; VT30604-GAL4 > +, UAS-ErkRNAi > +のハエ間で有意差は見られなかった(ハンガー:P値:左から0.3866, 0.8864, 0.5685, 0.6205)。(L)VT30604-GAL4>UAS-Erkを介したα′β′MBnにおけるErkの遺伝子発現は、空腹状態におけるHABを減少させた(Satiety: P値: 左から0.5993、0.617、0.5746、0.7076;空腹: P値: <左から0.0001、0.0005、0.0002、0.0561)。(M)図4Iの許容温度制御。許容温度では、ハングリー状態の間、tub-GAL80ts; VT30604-GAL4 > UAS-Erk、tub-GAL80ts; VT30604-GAL4 > +、およびUAS-Erk > +のハエ間でHABに有意差は見られなかった(ハンガー:P値:左から0.7216、0.6452、0.1392、および0.4289)。各Nは行動アッセイで一緒に分析した15匹のハエのグループを表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは一元配置分散分析(one-way ANOVA)後、Tukeyの検定で分析した。*P < 0.05.
doi:10.1371/journal.pbio.3002332.s009
(TIF)
S10 図:mALTにおける神経細胞活性の阻害またはChATのサイレンシングはHABを減少させる。
(A) UAS-mCD8::GFP; VT40053-GAL4 > + (VT40053 > +)およびUAS-mCD8::GFP; VT40053-GAL4 > UAS-ChATRNAi (VT40053 > ChATRNAi)ハエにおけるChAT抗体による免疫染色(左パネル)。萼片のGFP陽性シグナルにおける抗ChAT抗体免疫染色強度の定量化(右パネル)。萼片の抗ChAT免疫染色シグナルは、脚部のシグナルに対して正規化した(P < 0.0001)。スケールバー、10μm。(B)Kir2.1発現(VT40053-GAL4>UAS-kir2.1)を介してmALTニューロン活性をサイレンシングすると、満腹状態と空腹状態の両方でHABが減少した(満腹状態: P値 左から0.0063、0.0008、<0.0001、<0.0001;空腹: P値: 左から<0.0001、<0.0001、<0.0001、<0.0001)。(C)mALTニューロンにおけるChATの遺伝的ノックダウン(VT40053-GAL4 > UAS-ChATRNAi)は、満腹状態と空腹状態の両方でHABを減少させた(満腹状態: P値: 左から<0.0001、0.0015、0.0059、<0.0001;空腹: P値: 左から0.0091、<0.0001、0.0037、0.0222)。(D)図6Eの許容温度制御。許容温度では、いずれの摂食状態においても、tub-GAL80ts; VT40053-GAL4 > UAS-ChATRNAi, tub-GAL80ts; VT40053-GAL4 > +およびUAS-ChATRNAi > +のハエ間でHABに有意差は見られなかった(Satiety: P値: 満腹:P値:左から0.0676、0.4831、0.524、1;空腹: P値: 左から0.1797、0.9068、0.1219、0.3847)。(E)熱い刺激はα′β′MBn(黒)においてカルシウム応答を誘導したが、Kir2.1発現を介してmALT活性をサイレンシングすると、α′β′MBn(赤)において熱い刺激によるカルシウム応答が抑制された(満腹についてはP = 0.0002、空腹についてはP = 0.0101)。MB β′葉のGCaMP強度変化(ΔF/F0)を記録し、解析した。各カルシウム応答曲線の下の矢印は、高温刺激が加えられた時点を示す。各Nは、ChAT免疫染色実験(A)およびカルシウムイメージング実験(E)では1匹のハエ、行動アッセイ(B-D)では15匹のハエをまとめて解析したグループを示す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1データにある。データは対応のない両側t検定(A, E)または一元配置分散分析にTukeyの検定を加えたもの(B-D)で分析した。*P<0.05;nsは有意ではない。
doi:10.1371/journal.pbio.3002332.s010
(TIF)
S11 図:HABの実行に必要なMBONの同定。
(A)GtACR2発現(MB011B-GAL4 > UAS-GtACR2)を介したMBON-γ5β′2a活性のオプトジェニックサイレンシングは、満腹時と空腹時のHABに影響を与えなかった(Satiety: P値 左から0.7164、0.971、0.6755、0.9396;空腹状態: P値: 左から0.9746、0.9884、0.9782、0.867)。(B)GtACR2発現を介したMBON-α′1活性のオプトジェニックサイレンシング(MB050B-GAL4>UAS-GtACR2)は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態: P値 左から0.6302、0.6589、0.4405、0.7501;空腹状態: P値: 左から0.6951、0.5973、0.9209、0.7727)。(C)GtACR2発現を介したMBON-γ2α′1活性のオプトジェニックサイレンシング(MB051B-GAL4>UAS-GtACR2)は、満腹時および空腹時のHABに影響を及ぼさなかった(満腹時:P値:0.695、空腹時:P値:0.5973、空腹時:P値:0.7727): P値 左から0.4358、0.6369、0.2102、0.5801;空腹: P値: 左から0.7697、0.903、0.8262、0.9061)。(D)GtACR2発現を介したMBON-γ3β′1活性のオプトジェニックサイレンシング(MB083C-GAL4>UAS-GtACR2)は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態: P値 左から0.657、0.2801、0.4716、0.1395;空腹状態: P値: 左から0.9009、0.6699、0.7454、0.9781)。(E)GtACR2発現を介したMBON-α′2活性のオプトジェニックサイレンシング(MB091C-GAL4>UAS-GtACR2)は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態: P値 左から0.4278、0.7957、0.8411、0.6193;空腹: P値: 左から0.0823、0.5552、0.1326、0.602)。(F)GtACR2発現を介したMBON-β2β′2a活性のオプトジェニックサイレンシング(VT0765-GAL4 > UAS-GtACR2)は、満腹状態および空腹状態の両方においてHABに影響を及ぼさなかった(満腹状態: P値 左から0.8509、0.8318、0.9641、0.1453;空腹: P値: 左から0.9756、0.7681、0.2891、0.5207)。(G)GtACR2発現を介したMBON-β′2活性のオプトジェニックサイレンシング(VT41043-GAL4 > UAS-GtACR2)は、満腹状態および空腹状態のいずれにおいてもHABに影響を及ぼさなかった(満腹状態: P値 左から0.759、0.684、0.1537、0.3021;空腹: P値: 左から0.6198、0.4244、0.4526、0.7793)。各Nは行動アッセイで一緒に分析した15匹のハエのグループを表す。この図の基礎となるデータはS1 Dataにある。データは平均値±SEMで表し、ドットは個々の値を表し、一元配置分散分析により解析した。
doi:10.1371/journal.pbio.3002332.s011
(TIF)
S12 図:脂肪体におけるdilp6の操作はIPCにおけるDilp2の発現に影響する。
cg-GAL4 > UAS-dilp6RNAi(dilp6RNAi)、cg-GAL4 > +(Control)、およびcg-GAL4 > UAS-dilp6(dilp6)ハエにおける抗Dilp2抗体による免疫染色(左パネル)。満腹時と空腹時のIPCにおける抗Dilp2免疫陽性シグナルの定量化(右パネル)。IPCにおける抗Dilp2免疫染色シグナルを扇形体におけるシグナルに対して正規化した(満腹度: P値: <左から0.0001未満、0.0077未満;空腹: P値: <左から0.0001未満、0.0002未満)。スケールバー、20μm。各NはDilp2免疫染色実験における1匹のハエを表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは対応のない両側t検定で分析した。*P < 0.05.
doi:10.1371/journal.pbio.3002332.s012
(TIF)
S13 図:慢性的な温度シフト後の正常なHAB。
野生型ハエは、胚・幼虫発生期に24℃(非ヒートショック)または18℃のいずれかの一定温度下で飼育され、成虫脱出後5日間30℃に移された後、HABアッセイを行う前に12時間24℃に戻された(ヒートショック)。いずれの摂食状態においても、非ヒートショック群とヒートショック群の間でHABに有意差は見られなかった(満腹感: P値 左から0.9241、0.8008、0.7063、0.5931;空腹感: P値: 左から0.3508、0.7399、0.2583、0.6540)。各Nは行動アッセイで一緒に分析した15匹のハエのグループを表す。データは平均値±SEMで表し、ドットは個々の値を表す。この図の基礎となるデータはS1 Dataにある。データは対にしない両側t検定で分析した。
doi:10.1371/journal.pbio.3002332.s013
(TIF)
S1 動画。ミバエの高温回避行動。
doi:10.1371/journal.pbio.3002332.s014
(MP4)
S1 データ。本論文のグラフの元データ。
doi:10.1371/journal.pbio.3002332.s015
(XLSX)
謝辞
参考文献
1.井上哲也、山下貴史、阿形和彦:TRPMによる温度感覚シグナルは、脳内セロトニン作動性ニューロンによって処理され、プラナリアの体温運動を引き起こす。J Neurosci. 2014;34(47):15701-15714. doi: 10.1523/JNEUROSCI.5379-13.2014. pmid:25411498.
2.Robinson DP, Jaidah MY, Bach SS, Rohner CA, Jabado RW, Ormond R, et al. Some likes it hot: ジンベエザメは極端な自然環境の中で回遊と定住を繰り返す。PLoS ONE. 2017;12(9).doi:10.1371/journal.pone.0185360.pmid:28934371。
3.Dell AI, Pawar S, Savage VM. 生理学的・生態学的形質の温度依存性における系統的変異。Proc Natl Acad Sci U S A. 2011;108(26):10591-10596. doi: 10.1073/pnas.1015178108.
4.Tracey WD, Wilson RI, Laurent G, Benzer S. 痛覚受容に必須なショウジョウバエ遺伝子painless. Cell. 2003;113(2):261-273. doi: 10.1016/S0092-8674(03)00272-1.
5.Hamada FN, Rosenzweig M, Kang K, Pulver SR, Ghezzi A, Jegla TJ, et al. ショウジョウバエの温度嗜好性を制御する体内温度センサー。Nature. 2008;454(7201):217-U55. doi: 10.1038/nature07001.
6.Gallio M, Ofstad TA, Macpherson LJ, Wang JW, Zuker CS. ショウジョウバエの脳における温度のコード化。Cell. 2011;144(4):614-624. doi: 10.1016/j.cell.2011.01.028.
7.Frank DD, Jouandet GC, Kearney PJ, Macpherson LJ, Gallio M. ショウジョウバエの脳における温度表現。Nature. 2015;519(7543):358-361. doi: 10.1038/nature14284.
8.Piccione G, Caola G, Refinetti R. Circadian modulation of starvation-induced hypothermia in sheep and goats. 2002;19(3):531-541.doi:10.1081/cbi-120004225.pmid:12069036。
9.Saltiel AR, Kahn CR. インスリンシグナルとグルコースおよび脂質代謝の調節。Nature. 2001;414(6865):799-806. doi: 10.1038/414799a. pmid:11742412
10.Pierce SB, Costa M, Wisotzkey R, Devadhar S, Homburger SA, Buchman AR, et al. ヒトインスリンおよび線虫インスリン遺伝子ファミリーの異常に大きく多様なメンバーであるins-1によるDAF-2受容体シグナルの制御。Gene Dev. 2001;15(6):672-686. doi: 10.1101/gad.867301.
11.Nassel DR, Kubrak OI, Liu YT, Luo JN, Lushchak OV. ショウジョウバエにおけるインスリン産生細胞とその出力を制御する因子。2013;4.doi:10.3389/fphys.2013.00252.pmid:24062693.Front生理学.
12.Brogiolo W, Stocker H, Ikeya T, Rintelen F, Fernandez R, Hafen E. Drosophila insulin receptor and insulin-like peptides in growth control. 2001;11(4):213-221.doi:10.1016/S0960-9822(01)00068-9.pmid:11250149
13.Cao C, Brown MR. 2種類のハエの脳におけるインスリン様ペプチドの局在。細胞組織研究 2001;304(2):317-321.
14.Ikeya T, Galic M, Belawat P, Nairz K, Hafen E. Nutrient-dependent expression of insulin-like peptides from the neuroendocrine cells in the CNS, contributes to growth regulation in Drosophila. このような研究は、生物学的に重要である。
15.Rulifson EJ, Kim SK, Nusse R. ハエにおけるインスリン産生ニューロンの切除: 成長と糖尿病の表現型。Science. 2002;296(5570):1118-1120. doi: 10.1126/science.1070058.
16.Geminard C, Rulifson EJ, Leopold P. ショウジョウバエの脂肪細胞によるインスリン分泌の遠隔制御。Cell Metab. 2009;10(3):199-207.doi:10.1016/j.cmet.2009.08.002.pmid:19723496.
17.Sudhakar SR, Pathak H, Rehman N, Fernandes J, Vishnu S, Varghese J. Drosophilaにおいてインスリンシグナルは空腹による摂食を誘発する。この論文では、インスリンシグナルがショウジョウバエの飢餓誘導摂食を誘発することを明らかにした。
18.Umezaki Y, Hayley SE, Chu ML, Seo HW, Shah P, Hamada FN. Feeding-state-dependent modulation of temperature preference requires insulin signaling in Drosophila warm-sensing neurons. Curr Biol. 2018;28(5):779-787. doi: 10.1016/j.cub.2018.01.060. pmid:29478858.
19.Bai H, Kang P, Tatar M. Drosophila insulin-like peptide-6 (dilp6) expression from fat body extend lifespan and repressiones secretion of Drosophila insulin-like peptide-2 from the brain. Aging Cell. 2012;11(6):978-985. doi: 10.1111/acel.12000.
20.Aso Y, Grubel K, Busch S, Friedrich AB, Siwanowicz I, Tanimoto H. GAL4ドライバーによって特徴づけられるショウジョウバエ成虫のキノコ体。J Neurogenet. 2009;23(1-2):156-172. doi: 10.1080/01677060802471718.
21.Hong ST, Bang S, Hyun S, Kang JK, Jeong K, Paik D, et al. キノコ体におけるcAMPシグナルはショウジョウバエの温度選好行動を調節する。Nature. 2008;454(7205):771-775. doi: 10.1038/nature07090.
22.Bang S, Hyun S, Hong ST, Kang J, Jeong K, Park JJ, et al. キノコ体におけるドーパミンシグナルはショウジョウバエの温度選好行動を制御する。PLoS Genet. 2011;7(3). doi: 10.1371/journal.pgen.1001346.
23.Shih HW, Wu CL, Chang SW, Liu TH, Sih-Yu Lai J, Fu TF, et al. 並列回路がショウジョウバエの加齢に伴う温度選好を制御する。Nat Commun. 2015;6:7775. doi: 10.1038/ncomms8775.
24.Bracker LB, Siju KP, Varela N, Aso Y, Zhang M, Hein I, et al. Drosophilaにおける文脈依存的CO2回避におけるキノコ体の重要な役割。2013;23(13):1228-1234.doi:10.1016/j.cub.2013.05.029.pmid:23770186.Curr Biol.
25.Tsao CH, Chen CC, Lin CH, Yang HY, Lin SW. Drosophila mushroom bodies integrate hunger and satiety signals to control innate food-seeking behavior. Elife. 2018;7. doi: 10.7554/eLife.35264. pmid:29547121.
26.Buch S, Melcher C, Bauer M, Katzenberger J, Pankratz MJ. 食餌性タンパク質と糖の相反する作用は、ショウジョウバエのインスリン様ペプチドシグナル伝達の転写標的を制御する。Cell Metab. 2008;7(4):321-332. doi: 10.1016/j.cmet.2008.02.012.
27.Mohammad F, Stewart JC, Ott S, Chlebikova K, Chua JY, Koh TW, et al. アニオンチャネルロドプシンを用いた光遺伝学的行動抑制。Nat Methods. 2017;14(3):271-274.doi:10.1038/nmeth.4148.pmid:28114289。
28.Klapoetke NC, Murata Y, Kim SS, Pulver SR, Birdsey-Benson A, Cho YK, et al. Independent optical excitation of distinct neural populations. Nat Methods. 2014;11(3):338-346.doi:10.1038/nmeth.2836.pmid:24509633。
29.Garofalo RS. ショウジョウバエにおけるインスリンシグナルの遺伝学的解析。Trends Endocrin Met. 2002;13(4):156-162. doi: 10.1016/s1043-2760(01)00548-3.
30.Semaniuk U, Piskovatska V, Strilbytska O, Strutynska T, Burdyliuk N, Vaiserman A, et al. ショウジョウバエのインスリン様ペプチド:発現から機能まで-総説。Entomol Exp Appl. 2021;169(2):195-208. doi: 10.1111/eea.12981.
31.Chiu SL, Cline HT. 神経細胞の構造と機能の発達におけるインスリン受容体シグナル。Neural Dev. 2010;5. doi: 10.1186/1749-8104-5-7. pmid:20230616
32.Shaul YD, Seger R. MEK/ERKカスケード:シグナル特異性から多様な機能まで。Biochim Biophys Acta. 2007;1773(8):1213-1226.doi:10.1016/j.bbamcr.2006.10.005.pmid:17112607.
33.Tanaka NK, Endo K, Ito K. Drosophila melanogaster成体脳における触角葉関連ニューロンの組織化. J Comp Neurol. 2012;520(18):4067-4130. doi: 10.1002/cne.23142.
34.Aso Y, Sitaraman D, Ichinose T, Kaun KR, Vogt K, Belliart-Guerin G, et al. ショウジョウバエのキノコ体出力ニューロンは、価を符号化し、記憶に基づく行動選択を導く。Elife. 2014;3. doi: 10.7554/eLife.04580.
35.Hige T, Aso Y, Modi MN, Rubin GM, Turner GC. ショウジョウバエの嫌悪的嗅覚学習はヘテロシナプス可塑性によって支えられている。Neuron. 2015;88(5):985-998. doi: 10.1016/j.neuron.2015.11.003. pmid:26637800.
36.Lee WP, Chiang MH, Chang LY, Shyu WH, Chiu TH, Fu TF, et al. セロトニンシグナルはショウジョウバエの水報酬長期記憶を維持するためにキノコ体出力ニューロンを調節する。このような研究は、生物学的に重要である。
37.Sanchez-Alavez M, Tabarean IV, Osborn O, Mitsukawa K, Schaefer J, Dubins J, et al. Insulin causes hyperthermia by direct inhibition of warm-sensitive neurons. Diabetes. 2010;59(1):43-50. doi: 10.2337/db09-1128. pmid:19846801
38.Lee KS, Kwon OY, Lee JH, Kwon K, Min KJ, Jung SA, et al. Drosophila short neuropeptide F signalling regulates growth by ERK-mediated insulin signalling. Nat Cell Biol. 2008;10(4):468-475. doi: 10.1038/ncb1710.
39.Liu YT, Liao SF, Veenstra JA, Nassel DR. Drosophila insulin-like peptide 1 (DILP1) is transiently expression during non-feeding stages and reproductive dormancy. Sci Rep. 2016;6. doi: 10.1038/srep26620.
40.Liao SF, Post S, Lehmann P, Veenstra JA, Tatar M, Nassel DR. ショウジョウバエのインスリン様ペプチド1(DILP1)の代謝における制御的役割は、蛹期と成虫期で異なる。Front Endocrinol. 2020;11. doi: 10.3389/fendo.2020.00180.
41.Kubrak OI, Kucerova L, Theopold U, Nassel DR. 眠れる森の美女: Drosophila melanogasterにおける生殖休止期のホルモンシグナル伝達、代謝、免疫応答、体細胞維持への影響。PLoS ONE. 2014;9(11).doi:10.1371/journal.pone.0113051.pmid:25393614
42.Post S, Karashchuk G, Wade JD, Sajid W, De Meyts P, Tatar M. Drosophila insulin-like peptides DILP2 and DILP5 differentially stimulating cell signaling and glycogen phosphorylase to regulate longevity. Front Endocrinol. 2018;9. doi: 10.3389/fendo.2018.00245. pmid:29892262.
43.Klein MO, Battagello DS, Cardoso AR, Hauser DN, Bittencourt JC, Correa RG. Dopamine: functions, signaling, and association with neurological diseases. Cell Mol Neurobiol. 2019;39(1):31-59. doi: 10.1007/s10571-018-0632-3. pmid:30446950.
44.Bridge MW, Weller AS, Rayson M, Jones DA. 暑熱下での運動に対する反応と視床下部のセロトニン作動性およびドーパミン作動性機能の測定との関連。Eur J Appl Physiol. 2003;89(5):451-459. doi: 10.1007/s00421-003-0800-z.
45.Hasegawa H, Yazawa T, Yasumatsu M, Otokawa M, Aihara Y. Alteration in dopamine metabolism in the thermalgulatory center of exercising rat. 神経科学雑誌 2000;289(3):161-164.
46.Tomchik SM. ドパミン作動性ニューロンは、ショウジョウバエにおける温度の分散的、非対称的表現をコードする。J Neurosci. 2013;33(5):2166-2176.doi:10.1523/JNEUROSCI.3933-12.2013.pmid:23365252.
47.Siju KP, De Backer JF, Grunwald Kadow IC. ハエにおける感覚処理と適応行動のドーパミン調節。
48.Siju KP, Stih V, Aimon S, Gjorgjieva J, Portugues R, Grunwald Kadow IC. (注1)この論文では、「錐体外路における錐体外路の機能」、「錐体外路における錐体外路の機能」、「錐体外路における錐体外路の機能」の3つをテーマとしている。このような研究成果は、日本学術振興会科学研究費補助金(基盤研究(CB))、日本学術振興会科学研究費補助金(基盤研究(CB)、日本学術振興会科学研究費補助金(基盤研究(CB)、日本学術振興会科学研究費補助金(基盤研究(CB)、日本学術振興会科学研究費補助金(基盤研究(CB)、日本学術振興会科学研究費補助金(基盤研究(CB
49.Lin SW, Senapati B, Tsao CH. ショウジョウバエにおける空腹駆動行動の神経基盤。Open Biol. 2019;9(3). doi: 10.1098/rsob.180259.
50.Yamagata N, Hiroi M, Kondo S, Abe A, Tanimoto H. Suppression of dopamine neurons mediates reward. PLoS Biol. 2016;14(12):e1002586. doi: 10.1371/journal.pbio.1002586. pmid:27997541.
51.Cohn R, Morantte I, Ruta V. Drosophilaにおける協調的かつコンパートメント化された神経調節が感覚処理を形成する。Cell. 2015;163(7):1742-1755.doi:10.1016/j.cell.2015.11.019.pmid:26687359.
52.Owald D, Waddell S. Olfactory learning skews mushroom body output pathways to steer behavioral choice in Drosophila. Curr Opin Neurobiol. 2015;35:178-184.doi:10.1016/j.conb.2015.10.002.pmid:26496148.
53.Wu JK, Tai CY, Feng KL, Chen SL, Chen CC, Chiang AS. 長期記憶には、ショウジョウバエのキノコ体出力ニューロンの3つのサブセットにおける逐次的なタンパク質合成が必要である。Sci Rep. 2017;7. doi: 10.1038/s41598-017-07600-2. pmid:28769066
54.Barnstedt O, Owald D, Felsenberg J, Brain R, Moszynski JP, Talbot CB, et al. Memory-relevant mushroom body output synapses are cholinergic. Neuron. 2016;89(6):1237-1247.doi:10.1016/j.neuron.2016.02.015.pmid:26948892.
55.Owald D, Felsenberg J, Talbot CB, Das G, Perisse E, Huetteroth W, et al. Drosophilaにおける学習された嗅覚行動の根底には、定義されたキノコ体出力ニューロンの活動がある。Neuron. 2015;86(2):417-427.doi:10.1016/j.neuron.2015.03.025.pmid:25864636.
56.Zhang XF, Noyes NC, Zeng JZ, Li YL, Davis RL. Aversive training induces both presynaptic and postsynaptic suppression in Drosophila. J Neurosci. 2019;39(46):9164-9172. doi: 10.1523/JNEUROSCI.1420-19.2019. pmid:31558620.
57.Boehm AC, Friedrich AB, Hunt S, Bandow P, Siju KP, De Backer JF, et al. ショウジョウバエの雌における生殖状態依存的な匂い選好を支えるドーパミンゲート学習回路。Elife. 2022;11. doi: 10.7554/eLife.77643.
図を見る (8)
読者コメントを見る
著者について
指標を見る
メディア掲載
ピアレビューを見る
記事をダウンロード(pdf)
引用のダウンロード
この記事をメールで送る
PLOSジャーナル
PLOSブログ
トップに戻る
トップに戻る
PLOS
PLOSについて
フルサイト
フィードバック
連絡先
プライバシーポリシー
利用規約
メディアお問い合わせ
PLOSは非営利の501(c)(3)法人(#C2354500)で、米国カリフォルニア州サンフランシスコを拠点としています。
この記事が気に入ったらサポートをしてみませんか?
