腸内原生生物Tritrichomonas arnoldは、食餌性抗原提示樹状細胞を調節することにより、ウイルスが介在する経口耐性の喪失を抑制する
本文へスキップ記事へスキップ
エルゼビアのロゴ
免疫
56巻 8号 2023年8月8日 1862-1875.e9ページ
論文
腸内原生生物Tritrichomonas arnoldは、食餌性抗原提示樹状細胞を調節することにより、ウイルスが介在する経口耐性の喪失を抑制する
https://www.sciencedirect.com/science/article/abs/pii/S1074761323002790

著者リンク オーバーレイパネルを開くLuzmariel Medina Sanchez 1 2 16, Magdalena Siller 1 16, Yanlin Zeng 1 3 16, Pamela H. Brigleb 2 4 5, Kishan A. Sangani 6 7, Ariadna S. Soto 1, Clarisse Engl 1, Colin R. Laughlin 1, Mohit Rana 1, Lauren Van Der Kraak 1, Surya P. Pandey 1. パンディ 1、マッケンジー・J・ベンダー 1、ブリトニー・フィッツジェラルド 1、リー・ヘデン 1、ケイ・フィスク 5 8、グウェン・M・テイラー 5 8、オースティン・P・ライト 9、イシャ・D・メータ 1、シード・A・ラフマン 1 10、ヘザー・J・ガリポー 11...ラインハルト・ヒンターライトナー 1 5 15 17
もっと見る
シェア
引用
https://doi.org/10.1016/j.immuni.2023.06.022
権利と内容の取得
要約
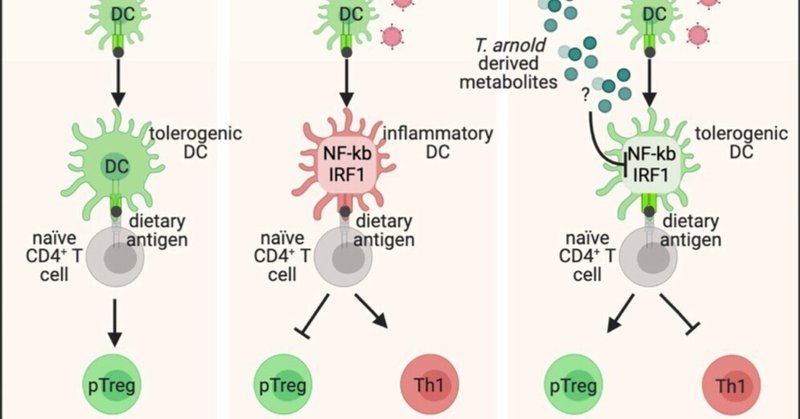
グルテンに対する経口耐性の喪失(LOT)は、グルテン特異的Tヘルパー1(Th1)細胞免疫応答の樹状細胞(DC)プライミングによって引き起こされ、セリアック病(CeD)の特徴である。ある種の常在菌が、ウイルスを介したLOTを緩和することができるかどうかは、いまだ不明である。我々は、ウイルス介在性LOTのマウスモデルを用いて、腸内常在性原生生物Tritrichomonas(T.)arnoldが、微生物叢とは無関係に、経口耐性を促進し、レオウイルスおよびマウスノロウイルス介在性LOTを防御することを見いだした。防御は、抗ウイルス宿主応答やT. arnoldが介在する自然免疫2型には起因しなかった。メカニズム的には、T. arnoldは食餌性抗原提示DCの炎症促進プログラムを直接抑制し、Th1を制限し、制御性T細胞応答を促進した。最後に、糞便中のマイクロバイオームを解析した結果、T. arnoldに関連するParabasalid株は、ヒトCeD患者には少ないことが示された。これらの知見を総合すると、CeDやその他の免疫介在性食物過敏症における、口腔内寛容を促進する原生生物についてのさらなる研究の動機付けとなるであろう。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(193KB)
ダウンロード フルサイズ画像のダウンロード
はじめに
セリアック病(Celiac disease:CeD)は、ヒト白血球抗原(HLA)DQ2またはDQ8分子を発現する遺伝的感受性の高い人が、小麦、大麦、ライ麦に含まれる食事性グルテンに対して炎症性Tヘルパー1(Th1)細胞免疫反応を示す免疫疾患であり、その結果、グルテンに対する経口耐性(LOT)を失う1,2,3。一般人口における高い有病率(1%~2%)、グルテンフリー食(GFD)を維持することの難しさ、CeD患者の40%~60%におけるGFDの有効性の低さ、他の自己免疫疾患や癌に関連するリスクなど、CeDは疾患や障害の重大な原因となっている4,5。グルテンに対するHLA-DQ2またはDQ8に制限されたTh1細胞応答がCeDの病因を引き起こし、細胞傷害性上皮内CD8+リンパ球を介した組織破壊が絨毛の萎縮をもたらすことが特徴である6,7。恒常性維持過程において、寛容をもたらす樹状細胞は、腸管内腔から食事性抗原を採取し、経口寛容の誘導部位である腸間膜リンパ節(mLN)に移動する。CeDでは、グルテン特異的免疫の抑制が障害され、炎症性DC応答が特徴的で、その結果、グルテンに対するTreg応答が減弱し、炎症性Th1細胞応答が亢進する。
ヒトの約30%がHLA DQ2またはDQ8を保有しているにもかかわらず、CeDを発症するのはわずか1%である1。ウイルスが、CeD発症の環境的誘因となる可能性が示唆されている。メカニズム的には、ヒトのレオウイルス分離株である1型ラング(T1L)は、食餌性抗原提示DCにmLNにおける炎症促進特性を付与することにより、LOTを媒介する。15,16 我々は、レオウイルスとマウスノロウイルス株の両方を用いて、経口抗原に対する寛容を破壊するウイルスの能力は、そのウイルスファミリーによって決まるのではなく、むしろmLNにおけるインターフェロン調節因子1(IRF1)依存性炎症経路を誘発する可能性によって決まることを示した。
17,18,19。哺乳類の腸内細菌叢には、細菌、古細菌、ウイルス、真菌、原生生物などが含まれ、これらすべてが健康状態や疾患における腸管免疫に大きな影響を与えている。原生生物は、哺乳類の腸内に一般的に生息する単細胞生物である20。既知でよく研究されている腸内原生生物の大半は、ヒト21,22やその他の哺乳類に対して病原性を示す23。しかし、腸内常在性原生生物がCeDの粘膜免疫にどのような影響を与え、その結果、CeDの病因にどのような影響を及ぼすのかについては謎のままである。
われわれが以前に定義したレオウイルス介在性LOT CeDモデル15を用いて、腸内常在性原生生物Tritrichomonas arnold(T.arnold)が経口耐性を促進し、ウイルス介在性LOTを予防することを示した。その結果、T. arnoldが食事中の抗原提示DCを調節してTreg細胞を促進し、ウイルスが誘導する炎症性IRF1/核因子κB(NF-κB)プログラムを抑制することで、Th1細胞応答を制限することが明らかになった。T.アーノルドが介在するウイルス誘発LOTからの防御は、T1Lに特異的ではなく、マウスノロウイルス株CW3でも観察された。CeD患者と健常対照者のコホートから採取した便サンプルを解析したところ、CeD患者では健常対照者に比べて放線菌が少ないことが明らかになった。
セクションの抜粋
T1L誘発LOTの抑制は、飼育下マウスにおけるTritrichomonasの存在と関連している
食餌性抗原に対するレオウイルスT1Lを介した炎症反応に関する研究の過程で15、我々はJackson Laboratories (JAX)から市販されているC57BL/6マウスを用いて我々の知見を再現した。しかし、経口負荷試験法を用いて、年齢と性別が一致したC57BL/6マウス(元々JAXから入手した "in-housed "マウス)を我々の動物園で飼育しても、食餌性抗原に対するT1L介在性の炎症反応は観察されなかった(図1A-1CおよびS1A-S1D)。T1L媒介CD4+ Th1細胞免疫応答
考察
CeDの発症には、HLA DQ2またはDQ8が必要であることに加え、さらなる遺伝的・環境的要因が必要である。
主要リソース表
試薬またはリソースソースの識別子
抗体
抗マウス CD45.1 モノクローナル抗体 (Rat, Clone A20), Brilliant Violet 480 conjugated BD Biosciences Cat# 746666; RRID:AB_2743938
抗マウス CD4 モノクローナル抗体 (Rat, Clone GK1.5), Brilliant Violet 650 conjugated BD Biosciences Cat# 563232; RRID:AB_2738083
抗 マウス CD8a モノクローナル抗体 (ラット、クローン 53-6.7), Brilliant Violet 570 conjugated BioLegend Cat# 100740; RRID:AB_2563055
抗マウス IFN-γモノクローナル抗体(ラット、クローン XMG1.2)、Brilliant Violet 570 コンジュゲート BioLegend Cat# 100740; RRID:AB_253055
謝辞
フローサイトメトリー解析およびソーティングにご協力いただいたピッツバーグ大学免疫学部のUnified Flow Core、Gnotobiotic Core Facility、およびピッツバーグ大学のHealth Sciences Mass Spectrometry Coreに感謝する。マクマスター大学の臨床チームに感謝する。モデル図はBioRenderで作成した。DC RNA-seq、cDNA生成、ライブラリー調製、シークエンシングはピッツバーグ大学健康科学シークエンシングが行った。
参考文献(59)
P.H. Green et al.
セリアック病
ランセット
(2003)
E.M. Nilsen et al.
セリアック病患者において、グルテンはインターフェロンガンマに強く支配された腸内サイトカイン応答を誘導する。
消化器病学
(1998)
M. ラーキ(Ráki)ら。
特異な樹状細胞サブセットがセリアック病変に集積し、グルテン反応性T細胞を効率的に活性化する。
消化器病学
(2006)
L. Plot et al.
セリアック病の感染関連
Autoimmun. Rev.
(2009)
R. Bouziat et al.
マウスノロウイルス感染による食餌抗原に対するTH1炎症反応の誘導
細胞 宿主 微生物
(2018)
M. Siller et al.
微生物はトレグを増強して食物過敏症を抑制できるか?
Trends Immunol.
(2020)
M. Constante et al.
セリアック病における腸内細菌叢の生物地理学的変異と機能経路
消化器病学
(2022)
M.S.Nadjsombatiほか
腸房細胞によるコハク酸の検出が2型自然免疫回路を誘発する
免疫学
(2018)
A. Chudnovskiy et al.
宿主と原虫の相互作用は、インフラマソームの活性化を通じて粘膜感染を防御する
細胞
(2016)
C. Schneider et al.
代謝産物をトリガーとする房細胞-ILC2回路が小腸リモデリングを駆動する
細胞
(2018)
参考文献をもっと見る
引用文献 (2)
セリアック病:メカニズムと新たな治療法
2023年、薬理科学の動向
抄録を表示
食物耐性を保護する原生生物
2023年、免疫学の動向
抄録を表示
16
これらの著者は同等に貢献した
17
代表連絡先
全文を見る
© 2023 Elsevier Inc.
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイト上のすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条項が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
