原発性胆汁性胆管炎の治療における腸内細菌群の標的化: ベンチからベッドサイドへ
原発性胆汁性胆管炎の治療における腸内細菌群の標的化: ベンチからベッドサイドへ
https://www.xiahepublishing.com/2310-8819/JCTH-2022-00408
リー・チャン(Li Zhang)、
リン・ヤン(Ling Yang)と
朱慧可(チュウ・ホイクアン
著者情報
Journal of Clinical and Translational Hepatology 2023年版
doi: 10.14218/JCTH.2022.00408
アブストラクト
原発性胆汁性胆管炎(PBC)は、病因が解明されていない複雑な胆汁性肝疾患である。腸内細菌叢は、細菌、古細菌、真菌、ウイルスのダイナミックなコミュニティで構成され、栄養、免疫、宿主防御反応に関連する生理的プロセスに重要な役割を担っています。最近の多くの研究で、PBC患者の腸内細菌叢の組成が著しく変化していることが明らかになり、肝臓と腸の密接な相互作用により、PBC発症時に腸内細菌異常症が生じる可能性が報告されています。本総説では、このテーマへの関心の高まりに鑑み、PBCの腸内細菌叢の変化の特徴、PBCの病態と腸内細菌叢の相関、プロバイオティクスや便中細菌叢移植など変化した腸内細菌叢を標的とした前向きな治療法について解説することを目的とする。
グラフィカルアブストラクト
キーワード
原発性胆汁性胆管炎、腸内細菌叢、リポポリサッカライド、胆汁酸、プロバイオティクス、糞便性微生物移植
はじめに
原発性胆汁性胆管炎(PBC)は、慢性の非支給性破壊性リンパ球性胆管炎、特異的な抗ミトコンドリア抗体(AMA)、女性優位性を特徴とする胆汁性肝臓疾患です1。世界のほとんどの地域で見られ、その発生率と普及率は世界的に上昇しています2。PBCの病態は通常ゆっくりと進行しますが、患者さんの全身状態に悪影響を及ぼし、肝線維化、最終的には肝硬変を引き起こします。3 今日まで、PBCの病態生理はまだ十分に解明されていません。PBCの発症には、遺伝的素因、免疫異常、環境リスク因子が複合的に作用していると考えられている4。腸-肝軸に着目した数多くの研究5-13により、腸内細菌叢異常がPBCの病態生理に関連していることが報告されている。
腸内細菌叢は、細菌、古細菌、真菌、ウイルスのダイナミックな集合体であり、消化、代謝、病原体感染への抵抗、免疫の成熟など、数多くの宿主生理機能で活躍している15。したがって、腸内細菌叢がわずかに変化しても、さまざまなレベルで生物の健康にマイナスの影響を与える可能性がある。当然のことながら、腸内細菌異常症は、原発性硬化性胆管炎(PSC)やPBCなどの自己免疫性肝疾患の病態形成に大きく関与していることが指摘されています16。
現在、PBC治療の第一選択薬は、ウルソデオキシコール酸(UDCA)です。しかし、患者の約40%は反応性が低い。1 研究5-13,16の増加により、PBCの病態は腸内細菌叢に大きく依存しており、腸内細菌叢はPBCの新規診断・治療ターゲットとして有望であることが立証されています。したがって、PBCに対する腸内細菌叢の具体的な影響、関連する病態メカニズム、潜在的な治療法のさらなる探求に重点を置く必要がある。我々は、レビューの目的で、PubMedを通じてMEDLINE文献データベースを、「腸内細菌叢」「微生物叢」「腸」「PBC」「原発性胆汁性胆管炎」「胆汁性肝疾患」などのキーワードを入力し検索しました。
腸-肝臓軸
門脈と胆汁酸の肝循環によって、腸-肝軸の双方向のコミュニケーションが確立され、肝臓は腸由来の産物を直接受け取ることになる。20 健康な状態では、肝臓の自然免疫系は強固で、腸由来の抗原に対する免疫寛容を維持できる。しかし、腸内細菌異常症や腸管漏出があると、肝臓に移行した病原性細菌や代謝物が対応する免疫反応を引き起こし、その結果、肝障害につながる。22 腸-肝臓軸は肝胆膵疾患の発生と発症の主要な要因として注目されているため、その理解を深めることは、腸内細菌異常症のPBCへの影響に関連するプロセスを明らかにすることにつながる。
腸内細菌叢とPBCの関連性
尿路感染症(UTI)を繰り返す患者はPBCを発症しやすいことから、PBCは腸内細菌叢と大きな関連がある23,24。慢性的に細菌に曝露する動物モデルでは、自己抗体産生とPBC様の組織的特徴が誘導されることが示された25。また、PBCのトランスジェニックマウスモデルである雌のdnTGFβRIIマウスは、雄マウスよりも重度の表現型を示し、それらは抗生物質の経口投与によって回復することができた26。前述のデータは、PBCの病因と腸内細菌叢との間に強い関連があることを示唆しています。
さらに、いくつかの研究5-13により、健康なコントロールと比較して、PBC患者および動物モデルにおいて、細菌の多様性が低下し、腸内細菌叢全体の組成が著しく変化していることが示されています(表1)5,7-13 全体として、PBCでは有益細菌の存在量が減少し、日和見病原体の存在量が増加しました。門レベルでは、PBCではファーミキューテス類とプロテオバクテリア類が過剰に存在し、バクテロイデーテス類は有意に減少していました5,11,13。属レベルでは、健常対照者と比較して、PBC患者はSphingomonas、Haemophilus、Veillonella、Clostridium、Lactobacillus、Streptococcus、Bifidobacterium、Pseudomonas、Curvibacter、Klebsiella、Enterobacteriaceae、g、Carnobacterium、Megasphaera micronuciformis、Anaeroglobus geminatus、γ-Proteobacteria、Spirochaetaceaeを多く保有している、 Actinobacillus pleuropneumoniae、Paraprevotella clara、Methylobacterium、Acinetobacter、Clostridiaceaeが減少し、Leptotrichia、Bacteroides、Atopobium、Sutterellaの存在量が減少しました、 Bulleidia、Oscillospira、Faecalibacterium、Acidobacteria、Lachnobacterium、Bacteroides eggerthii、Ruminococcus bromii、Morganella、Lautropia、Mogibacterium、Eikenella、Paludibacter、F16、g。 7 -しかし、線維化が進行した PBC 患者と進行していない PBC 患者の糞便微生物を分類学的に解析したところ、線維化が進行した PBC 患者では、線維化が進行していない患者と比較して、α多様性の減少、Weissella の増加、独自の微生物叢組成が明らかになりました10。PBC患者の糞便および粘膜サンプルの分類学的分析に加えて、尿路結石の再発歴のある患者はPBCを発症しやすいということも重要です23。さらに、大腸菌は尿路結石患者から最も多く分離された病原菌でした24。また、AMAの生成につながる主要因子であり27、PBCの病因におけるその役割を強調しています。
表1
PBCに関連する腸内細菌叢の変化について
参加者サンプルの由来比較対象腸内細菌叢の変化
方法文献増加減少dnTGFβRIIマウス;WTマウス糞便PBC対健常者ファーミキューテス;ラクリスピラ科;バクテロイデス科;S24-7;ルミノコックス科;リケネル科;ポルフィロン科16SrRNA;454 Genome Sequencer FLX Titanium platformMa et al.5 PBC患者(n=42);健常者(n=30)糞便 PBC vs. 健常者 健康γ-プロテオバクテリア;スピロヘータ科;腸内細菌科;ベヨネラ科;ナイセリア科;Enterobacter asburiae;Streptococcus;Enterobacterasburiae;Actinobacillus pleuropneumoniae;Anaeroglobus geminatus;ヘモフィルス・パラインフルエンザ;Megasphaera micronuciformis;パラプレボテラClara; Klebsiella;アシドバクテリア;Lachnobacterium sp. Bacteroides eggerthii; Ruminococcus bromii16SrRNA; Illumina MiSeqLv et al.13 PBC患者(n=79);健常者(n=114)糞便 PBC vs. 健常者 腸内細菌科; Prevotella; Sneathia; Veillonella; Fusobacterium; Haemophilus; Streptococcus; Pseudomonas; f-Clostridiaceae; Citrobacter; Lactobacillus; Salmonella; Clostridium; Klebsiella; Bacteroides; f-Mogibacteriaceae、Blautia、f-Christensenellaceae、Butyricimonas、Akkermansia、Odoribacter、Dialister、f-S24-7、f-Rikenellaceae、Oscillospira、Faecalibacterium、Sutterella16SrRNA、 Illumina MiSeqChen et al. 12 PBC患者(n=60);健常対照(n=80)糞便PBC vs. 健常菌; タンパク質; ヘモフィルス; ベイロネラ; クレブシエラ; クロストリジウム; ラクトバシラス; ストレプトコックス; シュードモナス; 腸炎菌;バクテロイデス属; スッテラ; オスシロスピラ; Faecalibacterium16SrRNA;イルミナ MiSeqTangら11名 PBC患者(n=23)糞便PBC患者の線維化が進行したもの(15)対線維化が進行していないもの(8)Weissella16SRRNA、Illumina MiSeqLammert et al.10 PBC患者(n=34);健常者(n=21)回腸粘膜PBC vs.健常者スフィンゴモナス;シュードモナス;メチロバクテリウム;カルノバクテリウム;アシネトバクター;クルビバクター;クロストリジウム;レプトトリキア;モルガネラ;エイケネラ;ラウトロピア;ブレイディア;アトポビウム;パルディバクター;モギバクテリウム;TM7_3クラスに属する不明属;F16、g(F16科の不明属)16SrRNA;イルミナ MiSeq北畑ほか.9 PBC患者(n=76);健常対照(n=23)糞便PBC vs. 健常Streptococcus;Lactobacillus;Bifidobacterium;Enterococcus;Lachnospiraceae;Ruminococcaceae16SrRNA;Illumina MiSeqFurukawa et al.8 PBC患者(n=39)、健常者(n=15)糞便、唾液PBC vs. 健常者糞便中の乳酸菌、唾液中のEubacteriumとVeillonella、糞便中のClostridium subcluster XIVa、唾液中のFusobacterium、16SrRNA、末端制限断片長多型Abe et al.7
条件A対条件Bの比較: ↑PBC, primary biliary cholangitis; WT, wild type.
いくつかの特定の微生物相は、PBCとおそらく関連していると報告された。例えば、上皮への細菌侵入の増加は、腸内細菌科のEnterobacterとKlebsiellaの2属の存在量の上昇に起因している11。さらに、いくつかの変化した微生物群は、PBC患者の肝機能や血清サイトカインと正の相関を示した。例えば、Veillonellaはインターロイキン(IL)-18およびIL16と、Megasphaera micronuciformisおよびEnterobacter asburiaeはIL18、KlebsiellaはIL2Aおよび総ビリルビン、Eggerthella spは直接ビリルビンである。このような相関関係は、微生物が疾患状態と関連している可能性を示している。さらに、一部の微生物群は、トリプトファンの分解によって腸内細菌が産生し、内皮機能障害や白血球の活性化を誘発するインドールアクリレートなどの代謝物を調節することによって、PBC患者において間接的に作用する可能性があります13。PBC患者の尿や糞便に濃縮されるインドールアクリル酸は、PBCにおけるNeisseriaceae属やKlebsiella属の濃縮度と正の相関があることが判明しており13、この2属はインドールアクリル酸関連のシグナル伝達経路に関連しPBC発症に共同で作用する可能性を示唆している。しかし、今後の研究において、正しい方法で明示的に証明する必要がある。
まとめると、PBC患者は細菌の多様性が低下し、腸内細菌叢の組成が著しく異なっている。特に、腸内細菌叢のいくつかの特異的な変化は、PBCの出現と密接な関連性を持っている。
PBCにおける腸内細菌叢に影響を与える可能性のあるメカニズム
代謝物の生産
腸内細菌叢は、「新しい重要な代謝器官」とも呼ばれ、人間の健康維持に不可欠です28。したがって、腸内細菌叢に何らかの障害が生じた場合、身体に悪影響を及ぼすことは避けられません。例えば、リポポリサッカライド(LPS)などの微生物産物の肝臓への蓄積は、不適切な炎症性免疫反応の引き金となって組織障害を引き起こし、微生物の胆汁酸代謝障害は、胆汁うっ滞や肝障害を引き起こす。これら2つの代謝物、LPSと胆汁酸のPBCの病因における潜在的な役割について、以下に要約する。
LPS
LPSは、グラム陰性菌外膜の主要な要素であり、脂質A、コア多糖、O-抗原からなり、脂質Aはグラム陰性菌感染症の病原性に関連している29。低用量のLPSは非特異的な抗菌・抗ウイルス防御を構築するが、高用量では不適切または過剰な免疫活性化を誘導し、細胞傷害や多臓器障害につながる29。健康な状態では、肝臓のTLR4発現量が少なく、TLR4シグナルの制御がネガティブであるため、肝臓は免疫反応の兆候を示さない33。
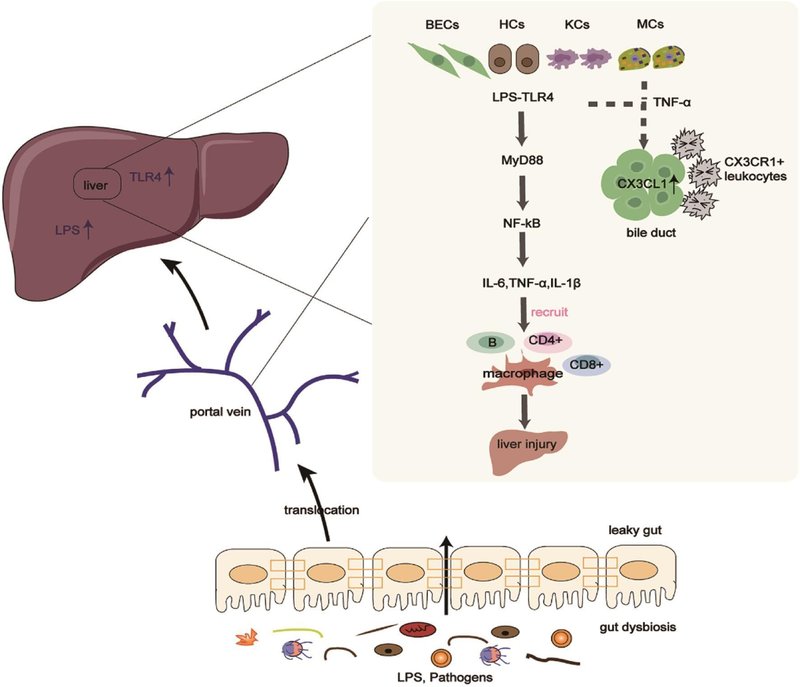
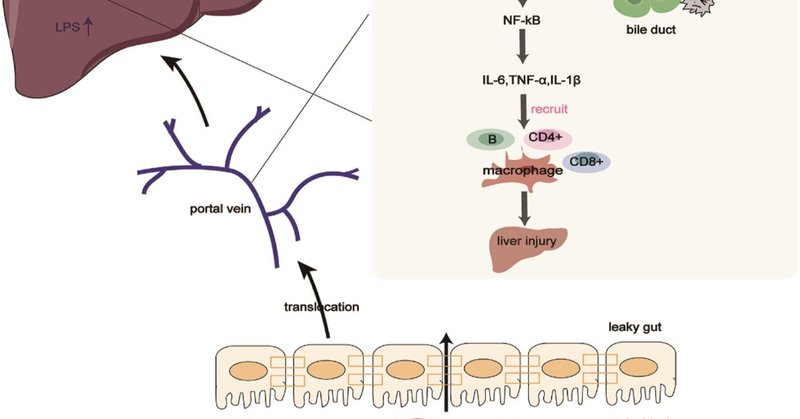
図1 腸内細菌叢はLPS/TLR4シグナル伝達経路を通じてPBCの病態に寄与している。
腸内細菌叢の異常と腸管透過性の亢進は、病原体や代謝物の肝臓への移行を促進し、LPS/TLR4シグナル経路を通じて肝障害に寄与する。また、感作単球やTNF-αはBECを刺激してCX3CL1をアップレギュレートし、CX3CR1+白血球と相互作用することで胆管炎を引き起こす。BEC、胆管上皮細胞、HC、肝細胞、IL、インターロイキン、KC、クッパー細胞、LPS、リポポリサッカライド、MC、単球、MyD88、ミエロイド分化因子88、NF- κB、核因子カッパB、TLR4、Toll様受容体4、TNF-α、腫瘍壊死因子-α.
健康なコントロールと比較して、血清LPSレベルはPBC患者で上昇し、血清アルカリホスファターゼ、総ビリルビン、γ-グルタミルトランスフェラーゼレベルと正の関係があることが示された36。LPSとTLR4の増加は、PBC患者の傷ついた胆道上皮細胞(BEC)、肝細胞、浸潤炎症細胞においても報告されている34,36,37。LPSの増加によりTLR4が活性化され、骨髄分化因子88(MyD88)の動員、炎症性核因子κB(NF- κB)経路の活性化、炎症性因子IL1β、IL6、腫瘍壊死因子α(TNF-α)の放出を促進し肝障害に寄与し、PBC患者の門脈へのエフェクターリンパ球CD4+TおよびCD8+Tの動員を容易にしました36、38。 -40 さらに、PBC患者の末梢血単核細胞(PBMC)もLPSに対して高い感受性を持っている。健常対照と比較して、PBC患者から分離されたPBMCは、LPS刺激後にIL1β、IL6、IL8、TNF-αを高濃度に産生した36,41 さらに、感作単球とTNF-αは、BECを刺激して化学物質付着分子CX3CL1をアップレギュレートした。損傷した胆管におけるCX3CL1のアップレギュレーションは、CD4+TおよびCD8+T細胞を引き寄せ、CX3CR1+白血球と相互作用して胆管炎を引き起こす42。要約すると、LPSとTLR4の相互作用および肝臓におけるCX3CL1のアップレギュレーションは、炎症免疫応答を促進し、局所免疫耐性の崩壊と肝臓損傷を引き起こす。
胆汁酸
胆汁の主要な機能要素である胆汁酸は、古典的および非従来型の経路を経て、肝臓でコレステロールから合成される43。食後、胆汁酸は小腸に放出され、食事脂質の消化・吸収を促す44。胆汁酸の約95%は、門脈循環によって積極的に再吸収され、肝臓に戻される45。残りの5%の胆汁酸は、さまざまな細菌による変換によって修飾され、一部は受動的に肝臓に再吸収され、残りは糞便中に失われる46。一部の胆汁酸は、生物にとって有害である。例えば、疎水性の胆汁酸は肝毒性であると考えられており、ミトコンドリアの酸化ストレスとERストレスを誘導し、ミトコンドリアの透過性を高めることで不可逆的な肝細胞死をもたらす43,47。逆に、胆汁酸はよく知られた抗菌性を持ち、その後腸内微生物の組成に影響を与える46,48。二次胆汁酸の喪失は病原体感染への感受性と関連しており、二次胆汁酸プールを回復させることで回復した49。これらを総合すると、胆汁酸と腸内微生物の相互調節が胆汁酸代謝と微生物叢構成に重要であり、摂動は宿主の病態生理過程に影響を与える可能性があるという証拠がある。
特に、UDCAを投与していないPBC患者では、共役/非共役胆汁酸の比率が増加し、二次/一次胆汁酸の比率が減少しており、微生物の胆汁酸代謝異常を示す証拠が示されている(図2)。重要なことは、PBC患者の胆汁酸プールの変動が、腸内細菌異常と関連していたことである。例えば、二次胆汁酸のレベルは、PBCで濃縮された属(Veillonella、Klebsiella)と負の相関があり、コントロールで濃縮された属(Bacillus spp、Oscillatory spp)と正の相関があった12。腸内に残った胆汁酸の変換が主に微生物酵素の活性に依存していることは広く認められている50、51。例えば、Bacteroides、乳酸菌、ビフィズス菌、Clostridiumなどのヒト腸内主要細菌に存在する胆汁酸ヒドロラーゼ(BSHs)は、胆汁酸を非共役型に脱共役してさらに修飾し、腸内での胆汁酸代謝の第1段階となる52。したがって、胆汁酸の変化は、PBCにおける腸内細菌叢の組成の変化の結果であると考えられ、その後、担当する微生物酵素の機能不全が胆汁酸の変換不足をもたらすと考えられています。逆に、胆汁酸には抗菌作用があるため、PBCにおける胆汁酸の変化は微生物構成に大きな影響を与える可能性があると考えられる。実際、コレスチラミン投与は、PBC患者の内因性胆汁酸を調節し、腸内細菌叢とその代謝物の変化と関連した利益をもたらした53。
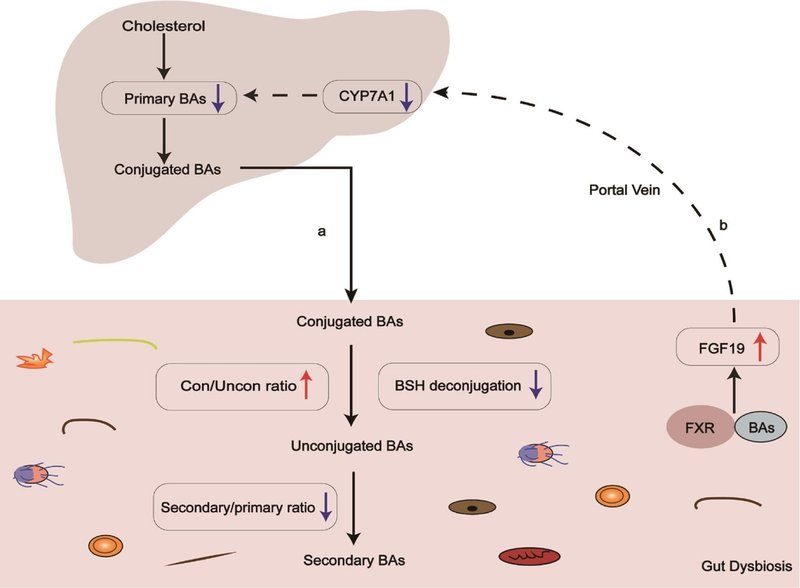
図2 PBC患者では胆汁酸-微生物叢の相互作用が損なわれている。
(A)腸内細菌の異常とBSH脱共役の低下により、微生物による胆汁酸代謝が障害され、特に共役/非共役胆汁酸の比率が増加し、二次/一次胆汁酸の比率が減少する。(B)血清FGF19はPBC患者において上昇し、CYP7A1の転写と胆汁酸合成をさらに阻害する。BAs、胆汁酸、BSH、胆汁酸塩ヒドロラーゼ、CYP7A1、コレステロール7α-ヒドロキシラーゼ、FGF19、線維芽細胞成長因子19、FXR、ファルネソイドX受容体。
腸内細菌叢は、上記の微生物による胆汁酸代謝の異常に加えて、胆汁酸受容体ファルネソイドX受容体(FXR)を制御することによっても胆汁酸合成を抑制しています。FXRは胆汁酸センサーであり、その下流のエフェクターである線維芽細胞増殖因子(FGF)15/19とともに胆汁酸合成と恒常性を調節する働きをする54。最近の研究では、従来飼育のマウスでは、回腸FXR阻害が緩和されるため胆汁酸合成が阻害されることが示された55。腸内細菌叢の存在により、無菌(GF)マウスと比較して胆嚢内の胆汁酸レベルは劇的に低下し、特にFXRアンタゴニストであるタウリン抱合β-ムリコール酸(TβMCA)レベルが低下した。別の研究では、FXR拮抗薬は腸内細菌なしでは代謝されないことが報告されている56。このことから、腸内細菌は胆汁酸組成を変化させ、FXR-FGF15/19負のフィードバックシステムを制御することにより、胆汁酸生合成を調節していると考えられる。さらに、PBC患者では血清FGF19濃度が上昇しており、胆汁酸プール組成が変化していることが示唆され、PBCにおける微生物による胆汁酸代謝障害と一致した12。要約すると、腸内細菌叢と胆汁酸は互いに調節し合う。腸内細菌叢と胆汁酸に何らかの摂動があれば、生体の病態生理プロセスに重大な影響を与える可能性がある。PBC患者における腸内細菌叢の組成の著しい変化と微生物による胆汁酸代謝の障害は、胆汁うっ滞などの疾患の結果を説明することができる。
その他のメカニズム
分子ミミクリー
PBCは、主にミトコンドリアPDC-E2複合体を標的とする特異性の高いAMAを有する自己免疫性肝疾患であるが、この自己免疫機構の引き金となるものは不明である57,58。PBCの病因における分子模倣の関与が提案されており、宿主細胞が外来細菌やウイルスのエピトープを認識すると、その後AMA生産と自身のタンパク質に対するエフェクターT細胞応答を引き起こすとされている59,60。さらに、PBC患者の血清中のAMAは、Escherichia coliやNovosphingobium aromaticivoransの細菌タンパク質にも交差反応することがわかった。したがって、PBCの仮説は、腸内細菌叢が腸からの細菌分子や副産物の転流によって抗PDC-E2反応や胆道損傷を誘導するという「リーキーガット概念」に基づいている。大腸菌、マイコプラズマ、乳酸菌、ピロリ菌、Novosphingobium aromaticivoransなど、PBCにおける微生物の分子模倣の詳細については、他の文献で広く紹介されており、いくつかのもっともらしいメカニズムが提案されています64-68。
腸管透過性の制御
PBC患者では腸管透過性が亢進していることが研究で明らかになっている69,70が、その原因についてはまだ十分に解明されていない。腸内常在菌がムチン、抗菌ペプチド、免疫グロブリンとともに病原体の感染に抵抗する自然免疫バリアとして働くことはよく知られている22,71。RuminococcaceaeやEubacteriumなどの腸内常在菌は、タイトジャンクションと粘液生成を刺激する酪酸を生成することで腸バリア機能に影響を与えている72。また、微生物自身もタイトジャンクションタンパク質の産生を制御することで腸のバリア機能に影響を与えている73。このように、腸内細菌叢の異常はタイトジャンクションを破壊し、それによって腸の透過性を高める可能性がある。さらに、腸内細菌叢の構成に寄与し、腸の恒常性維持に不可欠な分泌型免疫グロブリンA(IgA)74は、PBC患者の腸管上皮で異常値を示した75。また、腸内細菌の存在は、胆汁分泌不全時の腸の透過性を高めることがある76。腸管バリア機能の低下により、腸由来の抗原は腸間膜リンパ節、腸管外臓器、全身循環に移行する。前述のように、移行した産物はPBC患者の肝臓でLPS/TLR4経路を通じて炎症性免疫反応を引き起こしたり、分子模倣による自己抗体産生を誘導し、肝障害を悪化させる可能性がある。
PBCと腸管粘膜の免疫活性化
腸管粘膜免疫は、病原体の感染に抵抗し、腸のホメオスタシスを維持するために不可欠である。腸管粘膜免疫の成熟には腸内細菌叢が必要であり、81 GFマウスでは腸内細菌叢の欠如により免疫系が欠損する。82-84 したがって、腸内細菌の異常が腸管粘膜免疫バランスに影響を与えることは不思議ではない。例えば、腸内細菌異常症は、活性細菌産物によって改善される異常な免疫反応を誘導することにより、炎症性腸疾患(IBD)の炎症を増加させます。85-88 プレバイオティクス投与は、マウスモデルの腸間膜リンパ節における炎症性因子のレベルを低下させました。89 また、IL17産生Tヘルパー(Th17)細胞は炎症性疾患と関連していて肝臓と腸に豊富に存在します90。腸内では、Th17細胞は常在菌によって維持され、Th17特異的なIL17Aの発現に必要な因子である血清アミロイドAの分泌を誘導し91、白血球の動員を介して炎症を促進します92 実際、Th17細胞はPBCと関連しています93。腸管粘膜免疫における腸内細菌叢の重要性を考えると、腸内細菌異常と粘膜免疫のアンバランスがPBCの進行に寄与しているという仮説はもっともであり、新しい証拠の出現を正当化するものであると思われる。
治療法
PBCの進行における腸内細菌叢異常の重要性を考えると、プロバイオティクスの投与、糞便微生物叢移植(FMT)、機構的経路の介入など、腸内細菌叢の回復を目的とした治療がPBC患者に利益をもたらすかもしれない。また、UDCAなどの既存のPBC治療薬は、胆汁酸代謝の調節と腸内細菌叢の組成の調節の両方によって病気を治療しています。
プロバイオティクス
プロバイオティクスは生きた有益な微生物であり、腸内細菌叢のバランスを促進し、代謝プロファイルを改善し、腸管バリア機能障害を修復することにより、様々な疾患に効果がある94。 -96 例えば、プロバイオティクスであるVSL#3をマウスに、またBSH活性のあるLactobacillus reuteri NCIMB 30242をヒトに投与すると、腸内細菌叢において主にLactobacillusとBifidobacteriaのBSH保持種の充実を促進し、微生物の胆汁酸代謝を改善することが示されました97、98。さらに、ヨーグルトのようなプロバイオティクスを豊富に含む食品の毎日の摂取は、非アルコール性脂肪性肝疾患(NAFLD)患者において肯定的な結果をもたらした99。これらのことから、プロバイオティクス治療は、発表された証拠がないにもかかわらずPBC患者にとって有益であることは妥当で、さらなる研究の必要性があると考えられる。
FMT
FMTは、健康なドナーの糞便懸濁液を患者の消化器官に移植することにより、健康な微生物叢を回復させる方法として注目されている。100 再発性のクロストリジウム・ディフィシル感染症の治療に加え、FMTはPSCなどの自己免疫疾患に有益であることが分かっている101-103 FMTはPSC患者において腸微生物叢の多様性を回復し生化学指標も改善するが、大規模研究コホートで検証する必要がある。PBC患者におけるFMT治療の研究はまだ行われていないが、今後の研究でそれを試みることは興味深いことである。
病態における介入経路
PBCでは微生物による胆汁酸代謝の欠陥と異常な免疫応答が見つかっているため、乱れた微生物による胆汁酸代謝の再確立、異常な免疫応答の抑制、または免疫寛容の維持が焦点となっている1。PBCの治療薬としてUDCAとオベチコール酸(OCA)以外の薬は、まだ実験段階または臨床段階だ。現在、FXRアゴニスト、アピカルナトリウム依存性胆汁酸トランスポーター(ASBT)阻害剤、ペルオキシソーム増殖剤活性化受容体(PPAR)アゴニストなどの胆汁酸代謝を標的とする薬剤は、細胞毒性と炎症を減少させることで病気の進行を遅らせている104。さらに、腸の免疫反応を不適切にしないために傷ついた腸のバリアを修復する必要がある。IBD105で腸管透過性を回復させるために提案された食事療法や抗TNF-α薬は、将来的にPBCでも評価されるかもしれない。免疫抑制療法、長期のグルココルチコイド治療、古典的な免疫抑制剤は、PBC患者に大きな利益をもたらすことができなかった106。B細胞、T細胞、サイトカイン/ケモカインを標的とした治療法の開発が加速している。さらに、自己免疫疾患の治療を最適化するためのナノメディカルの使用も開発中であり、現在の免疫抑制療法の欠点の多くを克服する可能性を秘めている107。これらの薬剤の特定のメカニズムについては、他の場所で詳細に説明されている104。
ユーディーシーエー
現在のPBC患者の第一選択治療はUDCAであり、胆汁酸プールの親水性向上、免疫調節、抗炎症特性、抗線維化特性など、いくつかのメカニズムによって肝機能と無移植生存率を改善する108,109。研究によると、UDCAを6ヶ月間投与したPBC患者では、腸内細菌の異常が部分的に回復し、UDCAを投与していないPBC患者で豊富であったヘモフィルス属、レンサ球菌属、シュードモナス属の存在感が減少しました。また、UDCAは健常対照で濃縮されていたBacteroidetes spp、Oscillospira spp、Sutterella sppを増加させました。さらに、タウリンを代謝する細菌Bilophila sppがUDCA投与後の患者で上昇し、タウリン共役胆汁酸および共役/非共役比が低下し、肝酵素レベルの低下と関連しました11。さらに、UDCAは、妊娠中の肝内胆汁酸症患者において、微生物の胆汁酸代謝に重要なBSHを発現する腸内Bacteroidesの存在量を増加させた111。これらの証拠は、UDCA治療が腸内細菌叢組成を修正することによりPBCを改善する可能性を示唆しているが、UDCAによるホストの腸内細菌叢への作用メカニズムの詳細は十分に分かっておらず、今後の研究において探求する必要がある。
結論
PBCは、病因が不明な胆汁うっ滞性肝疾患である。PBCの進行には、腸と肝臓のクロストークが重要であることを示す証拠が増えてきています。PBC患者と健常者の間には、腸内細菌叢の構成や微生物の代謝物レベルにおいて、全体として大きな違いがある。腸内細菌異常症は、腸粘膜免疫バランスへの影響、腸管透過性の向上による細菌の移動促進、LPS/TLR4シグナル伝達経路や分子模倣メカニズムによる異常な免疫活性化の誘導、胆汁酸の微生物代謝抑制など、いくつかのメカニズムによってPBC患者の肝胆道系障害を促進します。UDCA/OCA治療に効果的でない患者には、プロバイオティクス、FMT、および腸内細菌関連経路を標的とするいくつかの薬理学的薬剤などの新規治療法が、腸内細菌叢組成の回復と免疫応答の調節によるPBC改善の新しい道筋となります。さらに、栄養状態、地理的な場所、薬物など、数多くの追加変数がヒト腸内細菌のメタ分類学的解析に影響を与えることも強調すべき点である。したがって、個人間のばらつきにも注目する必要がある。
しかし、既存のマイクロバイオーム研究には、今後取り組むべきいくつかの限界がある。第一に、研究数が少なすぎるため、微生物叢の構成と疾患の重症度との間に意味のある関連性を推測したり、食事、薬物、環境などの交絡因子をコントロールしたりすることができない。第二に、ほとんどの糞便サンプルは、粘膜コミュニティのプロファイルを完全に反映していない。最後に、真菌やウイルスは、腸内細菌叢のごく一部に過ぎないが、考慮する必要がある。PBC患者における腸内細菌異常の全体的な理解が深まれば、PBCの病理学的メカニズムについてより深く理解することができるようになるであろう。
略号
AMA
抗ミトコンドリア抗体
ASBT:
頂部ナトリウム依存性胆汁酸トランスポーター
BEC(ベック):
胆管上皮細胞
BSH:
胆汁酸塩ヒドロラーゼ
CYP7A1です:
コレステロール7-α-ヒドロキシラーゼ
FXRのこと:
ファルネソイドX受容体
FGFのこと:
繊維芽細胞増殖因子
FMTのこと
糞便微生物移植術
GFです:
ジャームフリー
IL:
インターロイキン
IgA(アイジーエー):
免疫グロブリンA
IBDのことです:
えんしょうせいちょうしっかん
LPSのこと:
リポポリサッカライド
MyD88:
ミエロイド分化因子88
NF-κBのこと:
核因子κB
NAFLDのこと:
非アルコール性脂肪性肝疾患
OCA
オベチコール酸
PBCのことです:
原発性胆汁性胆管炎
PSC.
原発性硬化性胆管炎
PBMCのこと:
末梢血単核球
PPARのこと:
ペルオキシソーム増殖剤活性化受容体
TLR4:
トール様受容体4
TNF-α:
腫瘍壊死因子α
TβMCAです:
タウリン共役β-ムリコール酸
Th:
Tヘルパー
UDCAです:
ウルソデオキシコール酸
UTIのことです:
尿路感染症
宣言文
謝辞
論文の言語と文法の研磨に協力してくれたYixin Zhuに感謝する。
資金提供について
本研究は、中国国家自然科学基金(HCに82000561号、LYに81974078号、81570530号、81370550号)、湖北省自然科学基金(LYに2019ACA133号)、組合病院科学基金(HCに2021xhyn005号)の支援を受けた。
利益相反について
著者らは、この出版に関連する利益相反はない。
著者の貢献
文献収集と原稿作成(LZ)、原稿の批判的修正(LY)、コンセプト設計と原稿の最終修正(HC)を行った(HC)。すべての著者が最終版の原稿を読み、承認した。
参考文献
1Gulamhusein AF, Hirschfield GM. 原発性胆汁性胆管炎:病態と治療の可能性。Nat Rev Gastroenterol Hepatol 2020;17(2):93-110 記事を見る PubMed/NCBI
2Griffiths L, Dyson JK, Jones DE. 原発性胆汁性肝硬変の新しい疫学。Semin Liver Dis 2014;34(3):318-328 記事を見る PubMed/NCBI
3Kaplan MM、Gershwin ME。原発性胆汁性肝硬変。N Engl J Med 2005;353(12):1261-1273 記事を見る PubMed/NCBI
4Mattner J. Primary Biliary Cirrhosis (PBC) and Primary Sclerosing Cholangitis (PSC) の病態に及ぼす微生物の影響. Int J Mol Sci 2016;17(11):1864 記事を見る PubMed/NCBI
5Ma HD, Zhao ZB, Ma WT, Liu QZ, Gao CY, Li L, et al. 腸内細菌叢トランスロケーションは自己免疫性胆管炎を促進する。J Autoimmun 2018;95:47-57 記事を見る PubMed/NCBI
6Chen Y, Ji F, Guo J, Shi D, Fang D, Li L. Dysbiosis of small intestinal microbiota in liver cirrhosis and its association with etiology. Sci Rep 2016;6:34055 記事を見る PubMed/NCBI
7Abe K, Takahashi A, Fujita M, Imaizumi H, Hayashi M, Okai K, et al. 自己免疫性肝疾患における口腔内細菌叢のディスバイオシスと唾液免疫学バイオマーカーとの関連. PLoS One 2018;13(7):e0198757 記事を表示する PubMed/NCBI
8古川真理、守屋和彦、中山淳一、井上貴之、百田倫也、河原谷浩、他 原発性胆汁性胆管炎患者の臨床予後と関連する腸内細菌異状症.Hepatol Res 2020;50(7):840-852 記事を表示する PubMed/NCBI
9北畑 聡、山本 祐子、吉田 修、徳本 祐子、川村 崇、古川 聡、他 原発性胆汁性胆管炎の発症に関連する回腸粘膜関連微生物群の過剰増殖. Sci Rep 2021;11(1):19705 記事を見る PubMed/NCBI
10Lammert C, Shin A, Xu H, Hemmerich C, O'Connell TM, Chalasani N. Short-chain fatty acid and fecal microbiota profiles are linked to fibrosis in primary biliary cholangitis. FEMS Microbiol Lett 2021;368(6):fnab038 記事を見る PubMed/NCBI
11Tang R, Wei Y, Li Y, Chen W, Chen H, Wang Q, et al. 腸内細菌プロファイルは原発性胆汁性胆管炎で変化し、UDCA療法後に一部回復している。Gut 2018;67(3):534-541 記事を見る PubMed/NCBI
12Chen W, Wei Y, Xiong A, Li Y, Guan H, Wang Q, et al. Primary Biliary Cholangitisにおける血清・便中胆汁酸プロファイルと腸内細菌叢との相互作用の包括的解析. Clin Rev Allergy Immunol 2020;58(1):25-38 記事を見る PubMed/NCBI
13Lv LX, Fang DQ, Shi D, Chen DY, Yan R, Zhu YX, et al. 原発性胆汁性肝硬変患者における腸内細菌叢、代謝、免疫の変化と相関関係。Environ Microbiol 2016;18(7):2272-2286 記事を表示する PubMed/NCBI
14Kho ZY, Lal SK. The Human Gut Microbiome - A Potential Controller of Wellness and Disease. Front Microbiol 2018;9:1835 記事を見る PubMed/NCBI
15Adak A, Khan MR. 腸内細菌叢とその機能性についての考察。Cell Mol Life Sci 2019;76(3):473-493 記事を見る PubMed/NCBI
16Kummen M, Hov JR. 胆汁性肝疾患に対する腸内細菌の影響.Liver Int 2019;39(7):1186-1196 記事を見る PubMed/NCBI
17Volta U, Bonazzi C, Bianchi FB, Baldoni AM, Zoli M, Pisi E. 肝硬変における食事由来抗原に対するIgA抗体。Ric Clin Lab 1987;17(3):235-242 記事を表示する PubMed/NCBI
18Pereira SP, Rhodes JM, Campbell BJ, Kumar D, Bain IM, Murphy GM, et al. Biliary lactoferrin concentrations are increased in active inflammatory bowel disease: a factor in the pathogenesis of primary sclerosing cholangitis? Clin Sci (Lond) 1998;95(5):637-644 記事を見る PubMed/NCBI
19Albillos A, de Gottardi A, Rescigno M. 肝疾患における腸-肝軸: 治療のための病態生理学的基礎。J Hepatol 2020;72(3):558-577 記事を見る PubMed/NCBI
20Gao B, Jeong WI, Tian Z. Liver: 自然免疫優位の臓器。Hepatology 2008;47(2):729-736 記事を表示する PubMed/NCBI
21Ma HD、Wang YH、Chang C、Gershwin ME、Lian ZX. 肝臓の腸内細菌叢と微小環境.Autoimmun Rev 2015;14(3):183-191 記事を見る PubMed/NCBI
22Tripathi A, Debelius J, Brenner DA, Karin M, Loomba R, Schnabl B, et al. 腸-肝臓軸とマイクロバイオームとの交差点. Nat Rev Gastroenterol Hepatol 2018;15(7):397-411 記事を表示する PubMed/NCBI
23Corpechot C, Chretien Y, Chazouilleres O, Poupon R. Demographic, lifestyle, medical and familial factors associated with primary biliary cirrhosis. J Hepatol 2010;53(1):162-169 記事を表示する PubMed/NCBI
24Burroughs AK, Rosenstein IJ, Epstein O, Hamilton-Miller JM, Brumfitt W, Sherlock S. Bacteriuria and primary biliary cirrhosis. Gut 1984;25(2):133-137 記事を見る PubMed/NCBI
25Haruta I, Kikuchi K, Hashimoto E, Nakamura M, Miyakawa H, Hirota K, et al. 長期間の細菌曝露は多巣性上皮炎を伴う非サプリメント性破壊性胆管炎を誘発しうる。Lab Invest 2010;90(4):577-588 記事を表示する PubMed/NCBI
26Huang MX, Yang SY, Luo PY, Long J, Liu QZ, Wang J, et al. Gut microbiota contributes to sexual dimorphism in murine autoimmune cholangitis. J Leukoc Biol 2021;110(6):1121-1130 記事を表示する PubMed/NCBI
27Floreani A、Leung PS、Gershwin ME. 自己免疫の環境的基盤(Environmental Basis of Autoimmunity). Clin Rev Allergy Immunol 2016;50(3):287-300 記事を見る PubMed/NCBI
28Jandhyala SM、Talukdar R、Subramanyam C、Vuyyuru H、Sasikala M、Nageshwar Reddy D. 正常な腸内細菌叢の役割。World J Gastroenterol 2015;21(29):8787-8803 記事を見る PubMed/NCBI
29Wang X, Quinn PJ. リポポリサッカライド: 生合成経路と構造修飾。Prog Lipid Res 2010;49(2):97-107 記事を表示する PubMed/NCBI
30Ciesielska A, Matyjek M, Kwiatkowska K. TLR4とCD14のトラフィッキングとLPS誘発炎症性シグナルへの影響. Cell Mol Life Sci 2021;78(4):1233-1261 記事を見る PubMed/NCBI
31Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell 2006;124(4):783-801 記事を見る PubMed/NCBI
32秋良聡、武田和彦:Toll様受容体のシグナル伝達。Nat Rev Immunol 2004;4(7):499-511 記事を表示する PubMed/NCBI
33Pimentel-Nunes P, Soares JB, Roncon-Albuquerque R, Dinis-Ribeiro M, Leite-Moreira AF. 消化器疾患における治療標的としてのToll様受容体。Expert Opin Ther Targets 2010;14(4):347-368 記事を表示する PubMed/NCBI
34Sasatomi K, Noguchi K, Sakisaka S, Sata M, Tanikawa K. Primary biliary cirrhosis and primary sclerosing cholangitisにおける胆道上皮細胞へのエンドトキシンの異常蓄積。J Hepatol 1998;29(3):409-416 記事を表示する PubMed/NCBI
35Lu YC, Yeh WC, Ohashi PS. LPS/TLR4シグナル伝達経路。Cytokine 2008;42(2):145-151 記事を見る PubMed/NCBI
36Zhao J, Zhao S, Zhou G, Liang L, Guo X, Mao P, et al. Primary biliary cirrhosis patientにおけるTLRリガンドとしてのリポポリサッカライドに対する胆道上皮細胞および単球の応答の変化. Scand J Gastroenterol 2011;46(4):485-494 記事を見る PubMed/NCBI
37Wang AP, Migita K, Ito M, Takii Y, Daikoku M, Yokoyama T, et al. Primary biliary cirrhosisにおけるtoll-like receptor 4の肝内発現。J Autoimmun 2005;25(1):85-91 記事を表示する PubMed/NCBI
38本田由美子、山際聡、松田祐樹、高村光太郎、市田忠義、青柳雄一.原発性胆汁性肝硬変患者におけるLPSに過敏な単球でのTLRホモログRP105の発現変化。J Hepatol 2007;47(3):404-411 記事を表示する PubMed/NCBI
39Yokoyama T, Komori A, Nakamura M, Takii Y, Kamihira T, Shimoda S, et al. Human intrahepatic biliary epithelial cells function in innate immunity by producing IL-6 and IL-8 via the TLR4-NF-kappaB and -MAPK signaling pathways. Liver Int 2006;26(4):467-476 記事を表示する PubMed/NCBI
40原田和彦、伊勢和彦、中沼雄一郎:インターフェロンガンマはToll様受容体とリガンドの相互作用によって誘導される胆道上皮細胞のNF-κB活性化を促進する。J Clin Pathol 2006;59(2):184-190 記事を表示する PubMed/NCBI
41Mao TK, Lian ZX, Selmi C, Ichiki Y, Ashwood P, Ansari AA, et al. Primary biliary cirrhosis patients in defined TLR ligandsに対する単球の反応の変化. Hepatology 2005;42(4):802-808 記事を表示する PubMed/NCBI
CX3CL1(フラクタルカイン):原発性胆汁性肝硬変における胆汁性炎症のサインポスト. Hepatology 2010;51(2):567-575 記事を表示する PubMed/NCBI
43Li Y, Tang R, Leung PSC, Gershwin ME, Ma X. Bile acids and intestinal microbiota in autoimmune cholestatic liver diseases. Autoimmun Rev 2017;16(9):885-896 記事を見る PubMed/NCBI
44Ticho AL, Malhotra P, Dudeja PK, Gill RK, Alrefai WA. 健康と病気における胆汁酸の腸内吸収。Compr Physiol 2019;10(1):21-56 記事を見る PubMed/NCBI
45Chiang JY. 胆汁酸:合成の調節。J Lipid Res 2009;50(10):1955-1966 記事を表示する PubMed/NCBI
46Wahlström A, Sayin SI, Marschall HU, Bäckhed F. Intestinal Crosstalk between Bile Acids and Microbiota and Its Impact on Host Metabolism. Cell Metab 2016;24(1):41-50 記事を見る PubMed/NCBI
47Liu HX、Keane R、Sheng L、Wan YJ. 肝損傷と再生における微生物叢と胆汁酸の意義。J Hepatol 2015;63(6):1502-1510 記事を見る PubMed/NCBI
48Hofmann AF, Eckmann L. How bile acids confer gut mucosal protection against bacteria. Proc Natl Acad Sci U S A 2006;103(12):4333-4334 記事を表示する PubMed/NCBI
49Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, et al. Microbiota transplantation restores normal fecal bile acid composition in recurrent Clostridium difficile infection. Am J Physiol Gastrointest Liver Physiol 2014;306(4):G310-319 記事を見る PubMed/NCBI
50David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, et al. Diet rapidly and reproducibly alters the human gut microbiome. Nature 2014;505(7484):559-563 記事を見る PubMed/NCBI
51Joyce SA, Gahan CG. 微生物と宿主の境界における胆汁酸の修飾: 宿主の健康における栄養補助食品および医薬品の介入の可能性.Annu Rev Food Sci Technol 2016;7:313-333 記事を表示する PubMed/NCBI
52Jones H、Alpini G、Francis H. 胆汁酸シグナルと胆道機能 Acta Pharm Sin B 2015;5(2):123-128 記事を表示する PubMed/NCBI
53Li B, Zhang J, Chen Y, Wang Q, Yan L, Wang R, et al. Alterations in microbiota and their metabolites are associated with beneficial effects of bile acid sequestrant on icteric primary biliary Cholangitis. Gut Microbes 2021;13(1):1946366 記事を表示する PubMed/NCBI
54Kliewer SA, Mangelsdorf DJ. ホルモンとしての胆汁酸: FXR-FGF15/19 Pathway. Dig Dis 2015;33(3):327-331 記事を見る PubMed/NCBI
55Sayin SI, Wahlström A, Felin J, Jäntti S, Marschall HU, Bamberg K, et al. Gut microbiota regulates bile acid metabolism by reducing levels of tauro-beta-muricholic acid, a natural occurring FXR antagonist. Cell Metab 2013;17(2):225-235 記事を見る PubMed/NCBI
56Kim I, Ahn SH, Inagaki T, Choi M, Ito S, Guo GL, et al. 肝臓と腸におけるファルネソイドX受容体による胆汁酸恒常性の異なる制御。J Lipid Res 2007;48(12):2664-2672 記事を表示する PubMed/NCBI
57Invernizzi P, Lleo A, Podda M. Interpreting serological tests in diagnosing autoimmune liver diseases. Semin Liver Dis 2007;27(2):161-172 記事を表示する PubMed/NCBI
58Lleo A, Selmi C, Invernizzi P, Podda M, Coppel RL, Mackay IR, et al. Apotopes and the biliary specificity of primary biliary cirrhosis. Hepatology 2009;49(3):871-879 記事を表示する PubMed/NCBI
59Bogdanos DP, Baum H, Grasso A, Okamoto M, Butler P, Ma Y, et al. Primary biliary cirrhosisにおけるヒトピルビン酸脱水素酵素との交差反応性の主要ターゲットは微生物模倣物である。J Hepatol 2004;40(1):31-39 記事を表示する PubMed/NCBI
60Bogdanos DP, Choudhuri K, Vergani D. Molecular mimicry and autoimmune liver disease: virtuous intention, malign consequences. 肝臓 2001;21(4):225-232 記事を見る PubMed/NCBI
61Mattner J, Savage PB, Leung P, Oertelt SS, Wang V, Trivedi O, et al. ナチュラルキラーT細胞の微生物活性化により引き起こされる肝臓自己免疫。Cell Host Microbe 2008;3(5):304-315 記事を表示する PubMed/NCBI
62Selmi C, Balkwill DL, Invernizzi P, Ansari AA, Coppel RL, Podda M, et al. Primary biliary cirrhosis Patients react against aubiquitous xenobiotic-metabolizing bacterium. Hepatology 2003;38(5):1250-1257 記事を表示する PubMed/NCBI
63Fussey SP, Ali ST, Guest JR, James OF, Bassendine MF, Yeaman SJ. 原発性胆汁性肝硬変血清と大腸菌ジヒドロリポアミドアセチルトランスフェラーゼ(E2p)との反応性:主要免疫原性領域の特性化 Proc Natl Acad Sci U S A 1990;87(10):3987-3991 記事を表示する PubMed/NCBI
64Olafsson S, Gudjonsson H, Selmi C, Amano K, Invernizzi P, Podda M, et al. アイスランド人の原発性胆汁性肝硬変患者とその親族における抗ミトコンドリア抗体と N. aromaticivorans蛋白への反応性。Am J Gastroenterol 2004;99(11):2143-2146 記事を見る PubMed/NCBI
65Vilagut L, Parés A, Viñas O, Vila J, Jiménez de Anta MT, Rodés J. マイコバクテリア65kD熱ショック蛋白に対する抗体は原発性胆汁性肝硬変患者の主要ミトコンドリア抗原と交差反応する。Eur J Clin Invest 1997;27(8):667-672 記事を表示する PubMed/NCBI
66Bogdanos DP, Baum H, Okamoto M, Montalto P, Sharma UC, Rigopoulou EI, et al. Primary biliary Cirrhosis is characterized by IgG3 antibodies crossactive with the major mitochondrial autoepitope and its Lactobacillus mimic. Hepatology 2005;42(2):458-465 記事を表示する PubMed/NCBI
67Bogdanos DP, Baum H, Gunsar F, Arioli D, Polymeros D, Ma Y, et al. Primary biliary cirrhosis と Helicobacter pylori の主要免疫優位ミトコンドリア抗原間の広範囲な相同性は、免疫学的交差反応につながらない。Scand J Gastroenterol 2004;39(10):981-987 記事を見る PubMed/NCBI
68Hopf U, Möller B, Stemerowicz R, Lobeck H, Rodloff A, Freudenberg M, et al. 腸内の大腸菌R(rough)フォーム、肝臓の脂質A、および原発性胆汁性肝硬変との関係。Lancet 1989;2(8677):1419-1422 記事を見る PubMed/NCBI
69Feld JJ、Meddings J、Heathcote EJ. 原発性胆汁性肝硬変における腸管透過性の異常。Dig Dis Sci 2006;51(9):1607-1613 記事を見る PubMed/NCBI
70Di Leo V, Venturi C, Baragiotta A, Martines D, Floreani A. 原発性胆汁性肝硬変における胃十二指腸および腸管透過性。Eur J Gastroenterol Hepatol 2003;15(9):967-973 記事を見る PubMed/NCBI
71Turner JR. 健康と病気における腸管粘膜バリア機能。Nat Rev Immunol 2009;9(11):799-809 記事を見る PubMed/NCBI
72大平裕之、筒井和彦、藤岡由美子 腸内細菌叢の短鎖脂肪酸は炎症と動脈硬化のディフェンスプレイヤーか. J Atheroscler Thromb 2017;24(7):660-672 記事を表示する PubMed/NCBI
73Allam-Ndoul B, Castonguay-Paradis S, Veilleux A. 腸内細菌叢と腸管経上皮透過性(Gut Microbiota and Intestinal Trans-Epithelial Permeability). Int J Mol Sci 2020;21(17):6402 記事を表示する PubMed/NCBI
74Inamine T, Schnabl B. Immunoglobulin Aと肝疾患. J Gastroenterol 2018;53(6):691-700 記事を見る PubMed/NCBI
75Floreani A, Baragiotta A, Pizzuti D, Martines D, Cecchetto A, Chiarelli S. Mucosal IgA defect in primary biliary cirrhosis. Am J Gastroenterol 2002;97(2):508-510 記事を表示する PubMed/NCBI
76Isaacs-Ten A, Echeandia M, Moreno-Gonzalez M, Brion A, Goldson A, Philo M, et al. Intestinal Microbiome-Macrophage Crosstalk Contributes to Cholestatic Liver Disease by Promoting Intestinal Permeability in Mice. Hepatology 2020;72(6):2090-2108 記事を見る PubMed/NCBI
77福井裕之.肝硬変における腸肝軸:リーキーガットと内毒素血症をどう管理するか.World J Hepatol 2015;7(3):425-442 記事を表示する PubMed/NCBI
78Li B, Selmi C, Tang R, Gershwin ME, Ma X. The microbiome and autoimmunity: a paradigm from the gut-liver axis. Cell Mol Immunol 2018;15(6):595-609 記事を見る PubMed/NCBI
79Kabat AM、Srinivasan N、Maloy KJ. 腸内細菌叢による免疫の発達と機能の調節.Trends Immunol 2014;35(11):507-517 記事を見る PubMed/NCBI
80Sommer F, Bäckhed F. The gut microbiota-masters of host development and physiology. Nat Rev Microbiol 2013;11(4):227-238 記事を表示する PubMed/NCBI
81Kau AL, Ahern PP, Griffin NW, Goodman AL, Gordon JI. ヒトの栄養、腸内細菌叢、免疫系。Nature 2011;474(7351):327-336 記事を見る PubMed/NCBI
82Hooper LV, Stappenbeck TS, Hong CV, Gordon JI. アンジオジェニン:自然免疫に関与する新しいクラスの殺微生物性タンパク質。Nat Immunol 2003;4(3):269-273 記事を表示する PubMed/NCBI
83Ostman S, Rask C, Wold AE, Hultkrantz S, Telemo E. Impaired regulatory T cell function in germ-free mouse. Eur J Immunol 2006;36(9):2336-2346 記事を表示する PubMed/NCBI
84Crabbé PA, Bazin H, Eyssen H, Heremans JF. 腸内でIgAを合成する形質細胞の増殖に主要な刺激となる正常な微生物叢。無菌腸管。Int Arch Allergy Appl Immunol 1968;34(4):362-375 記事を表示する PubMed/NCBI
85Seksik P, Rigottier-Gois L, Gramet G, Sutren M, Pochart P, Marteau P, et al. 大腸クローン病患者における優勢糞便細菌群の変化。Gut 2003;52(2):237-242 記事を見る PubMed/NCBI
86Gophna U, Sommerfeld K, Gophna S, Doolittle WF, Veldhuyzen van Zanten SJ. クローン病と潰瘍性大腸炎患者の組織関連腸内細菌叢の違い。J Clin Microbiol 2006;44(11):4136-4141 記事を見る PubMed/NCBI
87Maslowski KM, Vieira AT, Ng A, Kranich J, Sierro F, Yu D, et al. 腸内細菌叢と化学誘引性受容体GPR43による炎症反応の制御。Nature 2009;461(7268):1282-1286 記事を見る PubMed/NCBI
88Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly YM, et al. 微生物代謝物である短鎖脂肪酸が大腸Treg細胞の恒常性を制御する。Science 2013;341(6145):569-573 記事を見る PubMed/NCBI
89Carasi P、Racedo SM、Jacquot C、Romanin DE、Serradell MA、Urdaci MC. ケフィア由来のLactobacillus kefiriが粘膜免疫反応と腸内細菌叢に与える影響。J Immunol Res 2015;2015:361604 記事を見る PubMed/NCBI
90Esplugues E, Huber S, Gagliani N, Hauser AE, Town T, Wan YY, et al. TH17細胞の制御は小腸で起こる。Nature 2011;475(7357):514-518 記事を見る PubMed/NCBI
91Sano T, Huang W, Hall JA, Yang Y, Chen A, Gavzy SJ, et al. An IL-23R/IL-22 Circuit Regulates Epithelial Serum Amyloid A to Promote Local Effector Th17 Responses. Cell 2015;163(2):381-393 記事を見る PubMed/NCBI
92Zenewicz LA, Yancopoulos GD, Valenzuela DM, Murphy AJ, Stevens S, Flavell RA. 自然および適応的なインターロイキン-22は、マウスを炎症性腸疾患から保護する。Immunity 2008;29(6):947-957 記事を表示する PubMed/NCBI
93原田和彦、下田聡、佐藤雄一、伊勢和彦、池田浩、中沼佑介:胆道自然免疫と関連した胆管周囲インターロイキン17産生が原発性胆汁性肝硬変の胆管症発症に寄与している。Clin Exp Immunol 2009;157(2):261-270 記事を表示する PubMed/NCBI
94Chang CJ, Lin TL, Tsai YL, Wu TR, Lai WF, Lu CC, et al. 疾患改善における次世代プロバイオティクス. J Food Drug Anal 2019;27(3):615-622 記事を表示する PubMed/NCBI
95Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol 2014;11(8):506-514 記事を見る PubMed/NCBI
96Li C, Niu Z, Zou M, Liu S, Wang M, Gu X, et al. プロバイオティクス、プレバイオティクス、シンバイオティクスは腸内細菌叢を異なる形で調節し、特定の腸内微生物の相対量を回復させます。J Dairy Sci 2020;103(7):5816-5829 記事を表示する PubMed/NCBI
97Degirolamo C, Rainaldi S, Bovenga F, Murzilli S, Moschetta A. プロバイオティクスによる微生物相の改変は、マウスにおけるFxr-Fgf15軸のダウンレギュレーションを介して肝胆汁酸合成を誘導します。セルレップ 2014;7(1):12-18 記事を見る PubMed/NCBI
98Martoni CJ, Labbé A, Ganopolsky JG, Prakash S, Jones ML. 胆汁酸ヒドロラーゼ活性L. reuteri NCIMB 30242に対する胆汁酸、FGF-19およびステロール吸収の変化。Gut Microbes 2015;6(1):57-65 記事を見る PubMed/NCBI
99Ebrahimi-Mousavi S, Alavian SM, Sohrabpour AA, Dashti F, Djafarian K, Esmaillzadeh A. The effect of daily consumption of probiotic yogurt on liver enzymes, steatosis and fibrosis in patients with nonalcoholic fatty liver disease (NAFLD): study protocol for a randomized clinical trial. BMC Gastroenterol 2022;22(1):102 記事を見る PubMed/NCBI
100Gupta A, Khanna S. 糞便微生物叢の移植. Jama 2017;318(1):102 記事を見る PubMed/NCBI
101Hvas CL、Dahl Jørgensen SM、Jørgensen SP、Storgaard M、Lemming L、Hansen MM、他 再発性Clostridium difficile感染症の治療に対する糞便微生物移植はFidaxomicinより優れる。Gastroenterology 2019;156(5):1324-1332.e1323 記事を見る PubMed/NCBI
102Wang Y, Wiesnoski DH, Helmink BA, Gopalakrishnan V, Choi K, DuPont HL, et al. 難治性の免疫チェックポイント阻害薬関連大腸炎に対する糞便微生物叢移植。Nat Med 2018;24(12):1804-1808 記事を見る PubMed/NCBI
103Allegretti JR, Kassam Z, Carrellas M, Mullish BH, Marchesi JR, Pechlivanis A, et al. Primary Sclerosing Cholangitis患者における糞便微生物叢移植: パイロット臨床試験。Am J Gastroenterol 2019;114(7):1071-1079 記事を見る PubMed/NCBI
104Gao L, Wang L, Woo E, He X, Yang G, Bowlus C, et al. Primary Biliary Cholangitisの臨床管理-戦略と進化するトレンド. Clin Rev Allergy Immunol 2020;59(2):175-194 記事を見る PubMed/NCBI
105Michielan A, D'Incà R. Inflammatory Bowel DiseaseにおけるIntestinal Permeability: リーキーガットの病態解明、臨床評価、治療法。Mediators Inflamm 2015;2015:628157 記事を見る PubMed/NCBI
106Carbone M, Invernizzi P. Treatment of PBC-A step forward. Liver Int 2017;37(4):503-505 記事を表示する PubMed/NCBI
107Gharagozloo M, Majewski S, Foldvari M. Therapeutic applications of nanomedicine in autoimmune diseases: from immunosuppression to tolerance induction. Nanomedicine 2015;11(4):1003-1018 記事を表示する PubMed/NCBI
108Ridlon JM, Bajaj JS. ヒト腸管ステロールバイオーム:胆汁酸-マイクロバイオーム内分泌の側面と治療薬。Acta Pharm Sin B 2015;5(2):99-105 記事を表示する PubMed/NCBI
109Lee JY, Arai H, Nakamura Y, Fukiya S, Wada M, Yokota A. Ruminococcus gnavus N53由来7β-hydroxysteroid dehydrogenaseのヒト大腸におけるウルソデオキシコール酸生成への寄与。J Lipid Res 2013;54(11):3062-3069 記事を表示する PubMed/NCBI
110Laue H, Denger K, Cook AM. Bilophila wadsworthia RZATAUの嫌気性呼吸におけるタウリンの還元。Appl Environ Microbiol 1997;63(5):2016-2021 記事を見る PubMed/NCBI
111Ovadia C, Perdones-Montero A, Fan HM, Mullish BH, McDonald JAK, Papacleovoulou G, et al. Ursodeoxycholic acid enriches intestinal bile salt hydrolase-expressing Bacteroidetes in cholestatic pregnancy. Sci Rep 2020;10(1):3895 記事を見る PubMed/NCBI
Copyright © 2023 Authors. 本論文は、Creative Commons Attribution-Noncommercial 4.0 License (CC BY-NC 4.0) の条件の下で配布されたオープンアクセス論文であり、原著を適切に引用することを条件に、いかなる媒体においてもすべての非営利的な使用、配布、複製が許可される。
関連記事
自己免疫性胆汁性肝疾患におけるInter-α-inhibitor Heavy Chain 4(ITIH4)の高濃度増加について
Tea LundBossen Laursenら、Journal of Clinical and Translational Hepatology、2022年。
原発性胆汁性胆管炎に対する新たな治療戦略
Abigail Medfordら、Journal of Clinical and Translational Hepatology誌、2023年。
中国人の原発性胆汁性胆管炎患者における症状負担と健康関連QOLの推移
YanshengTian Liuら、Journal of Clinical and Translational Hepatology、2021年。
原発性胆汁性肝硬変と原発性硬化性胆管炎:ウィメンズヘルスの視点を取り入れたレビュー
Renée M Marchioni Beeryら、Journal of Clinical and Translational Hepatology、2014年
原発性胆汁性胆管炎の臨床的最新情報: トレンド、疫学、診断法、新しい治療アプローチ
Galoosianら、Journal of Clinical and Translational Hepatology、2020年。
コレステロール排出の心筋保護作用の可能性を探る
出典はこちら DiscoverCholesterolEfflux.com|CMD-MY-0033 I 2022年11月号
AMI後90日のハイリスク期間において、CVイベントの再発が及ぼす影響を明らかにする。
出典はこちら DiscoverCholesterolEfflux.com|CMD-MY-0033 I 2022年11月号
コレステロール排出の重要性を発見する
出典はこちら DiscoverCholesterolEfflux.com|CMD-MY-0033 I 2022年11月号
コレステロールの流入と排出のアンバランスと、なぜそれが重要なのか?
出典はこちら 発見コレステロールエフラックス.com|CMD-MY-0033 I 2022年11月号
コレステロール排出量の低下と心血管転帰における潜在的役割との関連性を理解する。
出典はこちら DiscoverCholesterolEfflux.com|CMD-MY-0033 I 2022年11月号
Powered by
Journal of Clinical and Translational Hepatology(臨床・トランスレーショナル肝臓学)」。
pISSN 2225-0719
eISSN 2310-8819
記事オプション
PDF57ビュー
記事全文252ビュー
ハイライト
COIフォーム
目次
アブストラクト
はじめに
腸-肝臓軸
腸内細菌叢とPBCの関連性
PBCにおける腸内細菌叢に影響を与えるメカニズムの可能性
その他のメカニズム
PBCと腸管粘膜の免疫活性化
セラピー
結論
略語の説明
宣言文
参考文献
論文史
受領しました:
2022年8月23日
改定されました:
2022年10月8日
受理されました:
2022年11月20日
掲載されました:
2023年3月1日
メトリックス
引用
Zhang L, Yang L, Chu H. 原発性胆汁性胆管炎の治療における腸内細菌叢の標的化: From Bench to Bedside. J Clin Transl Hepatol. オンライン公開: 2023年3月1日公開。doi: 10.14218/JCTH.2022.00408.
リプリントを注文する
この記事を共有する
XHPについて
会社情報
パブリッシャーニュース
利益相反に関する声明
エシックス
著作権について
パブリッシングサービス
苦情の手続き
お問い合わせ
著者リソース
原稿の提出
ジャーナルを見る
オープンアクセス
記事加工料
著者への指示
XHPでパブリッシュする理由
サブスクライブ
レビュアー資料
レビューアへの指示
編集方針
メンバーシップ
クロスリファレンス
パブリッシャーリソース
リソースセンター
リプリントとオフプリント
プライバシーポリシー
広告ポリシー
フィードバック
よくあるご質問
© 2023 Xia & He Publishing Inc.
総アクセス数:1019450
本日の訪問者数:47名
この記事が気に入ったらサポートをしてみませんか?
