微小重力環境が腸内細菌叢と血管新生に及ぼす影響
ライフ(バーゼル)。2021 Oct; 11(10): 1008.
オンライン公開 2021 Sep 24. doi: 10.3390/life11101008
PMCID: PMC8541308
PMID: 34685381
微小重力環境が腸内細菌叢と血管新生に及ぼす影響
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8541308/

Ruqaiyyah Siddiqui,1 Rizwan Qaisar,2 Nandu Goswami,3,4 Naveed Ahmed Khan,2,* and Adel Elmoselhi2,*.
Fathi Karouia、アカデミックエディター
著者情報 論文ノート 著作権およびライセンス情報 免責事項
関連データ
データの利用可能性に関する声明
移動する
要旨
微小重力環境は、宇宙飛行士に様々なストレスを与えることが知られている。近年、宇宙飛行士の腸内細菌叢の組成が宇宙旅行後に変化することが明らかになっており、これは人間の健康における腸内細菌叢の重要な役割を考えると重要である。宇宙飛行士に観察されるその他の変化としては、筋力の低下や骨の脆弱化、視覚障害、内皮機能障害、代謝の変化、疲労やストレスによる行動の変化、精神的な幸福への影響などが挙げられます。しかし、微小重力が血管新生に及ぼす影響や、腸内細菌叢との関連性については、まだ十分に解明されていない。ここでは、血管新生と視覚障害、骨格筋、腸内細菌叢との関連性の可能性を提案し、探求している。さらに、血管新生のエフェクターとなる代謝物について、腸内細菌代謝物との関連とともに考察する。腸内細菌叢を標的とし調整することは、宇宙飛行士の健康に大きな影響を与える可能性があり、人間の健康全般に影響を与えることから、太陽系での人類の活動が増加する可能性や、将来のミッションで火星に行く決意があることから、正当化される。
キーワード:腸内細菌叢、マイクロバイオーム、血管新生、微小重力、宇宙旅行
に移動する:
はじめに
微小重力環境は、宇宙飛行士に多くのストレス要因を与えることが知られている [1,2,3] 。これらのストレス因子は腸内細菌叢の組成に影響を与え、宇宙飛行士の健康に悪影響を及ぼす可能性がある。20の国家宇宙機関を包含する国際宇宙探査調整グループが、太陽系における人類の活動を増加させる戦略や、2030年までに火星の表面に足を踏み入れるという野心的な目標を掲げた世界探査ロードマップの第3版 [4] を発行したことを考えると、宇宙飛行士の健康を改善し保護する戦略を考案することが不可欠である。宇宙飛行と微小重力環境に関連する宇宙飛行士の健康に対する主なリスクには、筋力の低下や骨の脆弱化などの筋骨格系の変化、「血管新生」と呼ばれる既存の血管から新しい毛細血管を形成する身体の能力などがあります。また、視覚障害、内皮機能障害、代謝の変化、疲労やストレスによる行動の変化、精神的な健康への影響、DNAの損傷など放射線による変化など、さまざまなリスクがあることが、NASA(アメリカ航空宇宙局)が行った最近の研究「NASA双子研究」に示されています。この研究は、一卵性双生児の宇宙飛行士を対象に、宇宙飛行の影響を調べたもので、一人は国際宇宙ステーションに約1年間滞在し、もう一人は研究期間中ずっと地上にいた地上管制官でした [5]。
多くの研究が、人間の健康における腸内細菌叢の深い役割を示しています [6,7,8]。腸内細菌叢は、免疫系やエネルギー代謝など、人間の健康のいくつかの分野に影響を与えることが示されており、神経、内分泌、免疫経路を介して中枢神経系にも影響を与え [9]、神経発達障害から保護するとも考えられています [3] 。宇宙飛行士が直面する問題に焦点を当て、特別に設計されたプロバイオティクスや食物繊維で腸内細菌叢をターゲットにすることで、様々な問題を軽減できる可能性があります。プロバイオティクスのサプリメントは、人間の健康に有益な影響を与えることが示されています。腸内細菌叢の組成は、化学療法や免疫療法に対する反応、食品に対する血糖値の反応に影響し、食事のパーソナライズ化に活用できる可能性があります。また、食物繊維の摂取は腸内細菌叢の組成に影響を与え、より良い健康状態に関連します[11]。研究により、国際宇宙ステーション(ISS)へのミッション中とその後に、宇宙飛行士の腸内細菌の多様性に変化が観察されたことが明らかになりました[12]。したがって、宇宙飛行士の全体的な健康を改善するために、宇宙飛行士の腸内細菌叢を調節することは有益であり、宇宙飛行士に見られる宇宙飛行後の有害な変化から保護することが保証されている通常の環境と比較して、微小重力環境下で腸内細菌叢とその代謝物がどのように生成されるかを理解することは、有益である。
最近のマウスを用いた研究では、腸内細菌の異常が腸管透過性の上昇と慢性的な低悪性度炎症を引き起こし、最終的に視力に影響を与える病的な血管新生を引き起こすことが明らかになり、血管新生と視力の両方における腸内細菌叢の役割が示唆されました。この研究では、脂肪分の多い食事は腸内細菌叢を変化させ、全身性の炎症を増加させ、病的な脈絡膜新生血管を高めることが明らかになりました[13]。これは、視覚障害が宇宙飛行士に影響を与えるリスクの1つであることから、注目されます[14,15]。さらに、宇宙飛行中および宇宙飛行後の宇宙飛行士の神経眼球の変化について、幅広いスペクトルを記録した研究があり、これは宇宙飛行関連神経眼症候群(SANS)という用語で表現されています。血管新生とは、既存の血管系から新しい血管が形成されることです [16] 興味深いことに、眼における病的な血管新生は重度の視覚障害につながることがあり、血管新生と視覚障害の関連を指摘しています [17] 一方、筋骨格の変化や筋力の低下、骨の脆弱性も宇宙飛行士で観察されており懸念されています [18]. さらに、血管新生は、筋肉の適応と骨格筋の発達の寄与の両方に関与することが知られている[19]。したがって、ここでは、微小重力が血管新生に及ぼす影響の理解、ならびに腸内細菌叢との関係、および微小重力環境による宇宙飛行士の健康への影響について考察する。さらに、血管新生と視覚障害、骨格筋、腸内細菌叢との関連性を提案・探求する。さらに、血管新生のエフェクターとしての代謝物を検討し、腸内細菌の代謝物と関連付けることで、その効果を理解し、おそらく宇宙飛行士の健康を改善するためにこれらを調整することを視野に入れている。
次へ宇宙飛行士の健康における腸内細菌叢の役割
多くの研究が、宇宙飛行が宇宙飛行士の腸内細菌叢組成に顕著な影響を与えることを示唆している[3,20]。前述のように、腸内細菌叢は、宿主の免疫を調節することによって宿主の生理的状態を維持する上で基本的な役割を果たすことがよく知られている。腸内細菌は、推定100兆個の微生物(主に細菌、および原生動物、真菌、ウイルス)を包含し、300万個を超える遺伝子をコードし、数千の代謝物を生成し、宿主の健康全般に影響を与える多くの機能を有しています [8,21]。マイクロバイオームが代謝性疾患、炎症性腸疾患、アレルギー性疾患などの疾患に対する保護をもたらすことが複数の報告で示されています。一方、腸内細菌の異常は、免疫系に影響を及ぼすだけでなく、疾患の発症につながる可能性があります[22, 23, 24]。腸内細菌叢は短鎖脂肪酸を産生し、それが腸管上皮を通過して粘膜免疫反応に直接影響を与える可能性があります [25]。腸内に存在する2つの注目すべき細菌種は、ファーミキューテスとバクテロイデーテスであり、これらの種間のバランスのとれた比率は、宿主の恒常性の維持に不可欠である [26].ファーミキューテス属はグラム陽性で、短鎖脂肪酸の合成を介して宿主の代謝と栄養、空腹と満腹の調節に関与しています。一方、バクテロイデーテスはグラム陰性で、免疫調節に関与し、その成分は細胞受容体と相互作用し、サイトカインの合成を通じて免疫反応を増大させる[26]。腸内細菌とその代謝物は、腸管神経系を刺激する可能性があります。さらに、腸内細菌とその代謝物は、循環系の恒常性を司る組織や器官、例えば、血管壁、血液細胞、心臓の機能に影響を与える可能性がある[27]。微小重力環境は、血管生理学だけでなく、腸内細菌叢の組成にも影響を及ぼすが、これは、宇宙環境における様々な環境影響、特に長期の宇宙飛行旅行による影響である。この点については、宇宙旅行中のマイクロバイオームの変化を明らかにすることを目的として、宇宙飛行士のマイクロバイオームを研究する「宇宙飛行士マイクロバイオームプロジェクト」と呼ばれる大規模な研究が実施されている[28]。例えば、長期間の放射線被曝は、腸内細菌叢の組成を大きく変化させ、腸内ホメオスタシスの変化を促すと考えられています。宇宙旅行が宇宙飛行士とその周囲の腸内細菌叢に与える影響、および宇宙飛行士の健康への影響を明らかにすることが期待されます。現在、これらのデータから、宇宙飛行士のマイクロバイオーム組成が多様性を失ったことが描かれています[12]。実際、この研究では、酪酸産生菌として有益なFaecalibacteriumが増加していることが明らかになりました。一方、Parasutterellaの増加が観察され、これらの種は慢性的な腸の炎症と関連しています。さらに、抗炎症作用に関連するAkkermansia属の量が減少していることが観察された。したがって、慢性的な炎症反応に関連する疾患の可能性を低減するAkkermansiaを含むプレバイオティクスが示唆されている[12,20]。
例えば、「MARS500研究」では、6人の宇宙飛行士が520日間に渡って火星表面のアナログな居住空間に閉じ込められた[20]。この研究では、閉じ込められる前の期間と通常の生活に戻った後の6ヶ月間を含む、ミッション全体にわたって宇宙飛行士の腸内細菌叢を調査しました。その結果、ミッションの前半にBacteroides属の存在量が増加し、Faecalibacterium prausnitziiの存在量の減少が観察されたことが明らかになりました。これらのデータは、1970年代に実施された「スカイラブ医学実験高度試験」として知られる56日間の閉じ込め環境での別の研究で得られたものと同様であり、バクテロイデス属とファーミキューテス属の比率の変化も明らかになった[29、30、31]。これは大規模な研究であり、宇宙居住区と軌道実験室という場所で、長期間の宇宙飛行に対する居住性と生理学的適応を調査する機会を提供した [29,30,31] 。興味深いことに、MARS500の研究では、腸内細菌叢の酪酸産生メンバー、すなわちF. prausnitziiの変化がすべての被験者で観察され、短鎖脂肪酸産生の重要性を示唆し、被験者のマイクロバイオームの維持に影響を与える可能性があることがわかりました。この研究では、Faecalibacterium prausnitziiが監禁後約1年で最低値に達したことが明らかになりました。心理学的データからは、ストレスの多い環境であった可能性があり、唾液中のコルチゾールの強度が高く、免疫反応の上昇が示唆されました。しかし、他の短鎖脂肪酸生産者、例えばDoreaは影響を受けなかった。しかし、全体的な分析では、宇宙飛行士の腸内細菌叢に大きな変化は見られませんでした[20]。
最近、MARS500プロジェクトのデータは、改良された16S rRNA遺伝子アンプリコンバイオインフォマティクス技術を使って再評価されました[32]。研究の初期(7-45日目)と後期(420-520日目)の糞便サンプルデータが再解析され、408個の正確な配列変異(ESV)が特定されました。その結果、ESVのうち32個が経時的に有意かつ異なる発現量であることが判明しました。その結果、Ruminococcus bromii、Faecalibacterium prausnitzii、Lactobacillus rogosae Anaerostipes hadrus、Blautia luti、Roseburia faecisなどのレジスタントスターチ分解、インスリン感受性関連、抗炎症などの主要な種や、未培養の細菌が減少しているなどの異なるESVsが存在しました。再解析の結果、腸内細菌叢は研究期間中、実際に有意に変化しており、宿主の炎症とグルコースホメオスタシスを誘導する種が含まれていることが判明しました[32]。最近では、ショットガン・メタゲノミック・シーケンスやマイクロアレイを用いた研究もありますが、以前の研究では16S rRNAベースのシーケンスが用いられていました [33,34] 。この研究では、宇宙飛行士の口、皮膚、鼻、耳、唾液から採取したスワブの微生物プロファイルを、宇宙飛行前と地球帰還後の両方で調査しています[33]。さらに、ISSの居住空間から様々な環境サンプルも収集した。その結果、ISSの表面環境のマイクロバイオームは、宇宙飛行士の皮膚のマイクロバイオームと類似していることが指摘された[33]。別の最近の研究では、ISSでの宇宙飛行前、飛行中、飛行後の4人の宇宙飛行士のマイクロバイオームを調べるために、ショットガンメタゲノム配列と並行して微生物検出アレイが達成されました [34]。この研究では、宇宙飛行士のマイクロバイオーム組成は宇宙飛行中に変化したが、地球への帰還後は正常に戻ることが確認された。さらに、一部の宇宙飛行士は、分類学的存在量と多様性に大きな変化が見られましたが、ある宇宙飛行士はそうではありませんでした。特に、唾液サンプル中のプレボテラ菌の量が2人の宇宙飛行士で増加したことが示された。興味深いことに、唾液サンプル中の抗菌剤耐性遺伝子の存在が観察されました。すなわち、elfamycin耐性遺伝子は4人の宇宙飛行士すべてで有意に増加しましたが、地球への帰還後は元に戻りました[34]。以前、微小重力環境を模擬したin vitroでの大腸菌の研究が行われた[35]。この研究では、大腸菌を1000世代以上培養し、微小重力に適応した株が適応していない株に容易に勝てることがわかり、ゲノムの配列決定により微小重力条件下で16の変異が発見されました。しかし、その重要な変化についてはまだわかっていない。この研究では、抗生物質耐性は報告されていない[35]。注目すべきは、この研究に続く別の研究で、大腸菌を100世代以上培養し、クロラムフェニコール、セファロチン、セフロキシムアクセチル、セフォキシチン、セフロキシム、テトラサイクリンに対する耐性が認められ、クロラムフェニコールとセファロチンに対する耐性は110世代以上持続しています(36)。
宇宙飛行士を対象とした研究と並行して、in vitroおよびin vivoの研究が微小重力環境および模擬微小重力環境で実施され、腸内細菌叢の多様性に影響があることが示され、模擬微小重力が有益微生物に及ぼす影響も検討されています [37,38].微小重力環境を模擬した後肢免荷マウスモデルでは、Citrobacter rodentium感染に対する炎症性サイトカインを介した腸管免疫が低下し、腸内細菌叢の乱れが誘導されることが明らかになった[37]。注目すべきは、これらの表現型は、8種の生きた凍結乾燥菌からなる高濃度プロバイオティクスを導入することでほぼ修正できることであり、宇宙飛行士の栄養補助食品としての可能性を示している。今後のミッションでは、短鎖脂肪酸産生菌など炎症を誘発する細菌種の研究が必要であり、宇宙飛行士に不足している細菌種に基づくプロ/プレバイオティクスの開発が必要である[20]。また、病原性遺伝子、代謝遺伝子、抗生物質耐性遺伝子の調査など、マイクロバイオームの機能的側面をさらに分析することも、宇宙飛行士と環境の微生物的関係を理解するために必要であり、統計的有意性を高めるためにより多くの宇宙飛行士に対する今後の研究と相まって必要である[39]。さらに、微小重力環境に対するバクテリアの長期的な反応を理解することも必要である。
に進む:血管新生と微小重力の影響
血管新生とは、既存の血管系から新しい血管が形成されることである[16]。成人の血管新生は、骨修復や創傷治癒などのプロセスにおいて重要であり、血管新生促進分子と抗血管新生分子の両方の微妙なバランスによって制御されている。このバランスは、網膜症、関節リウマチ、心血管系および脳血管障害、そしておそらく腫瘍や癌の発生といった様々な疾患において損なわれる可能性があることが、いくつかの研究で示されている [27].血管の内側を覆う内皮細胞は、血流などの様々な生理的プロセスを制御するため、血管の完全性と組織の恒常性の維持において重要な役割を担っています。したがって、内皮細胞は、血管新生、すなわち既存の血管から新しい毛細血管を形成する局面に基本的に関与している [40] 。微小重力が内皮細胞の機能に影響を与える可能性があるメカニズムについて、様々な研究が行われています。いくつかの研究は、内皮細胞が微小重力の影響を受け、様々な生化学的、機能的、形態的変化を起こすことを示している。しかし、これらの研究はすべて、ほとんどが模擬微小重力条件下、またはISSに搭載された試験管内の様々な細胞株で行われたものである[41,42,43]。これは、宇宙船や宇宙実験室で実際の微小重力環境で実験を行う機会が、高額な費用と限られたミッション数のために限られているためである。したがって、これらの研究のほとんどは、クリノスタットやランダムポジショニングマシンのような「地上施設」で実施された[44]。しかし、ラットの腓骨骨切りモデルにおける血管チャネルの発達は、宇宙旅行後に抑制されたことから、微小重力条件下では骨の治癒が損なわれる可能性があることが示唆されている[45]。また、別の先行研究では、宇宙飛行後にウズラの絨毛膜の小血管の密度が著しく低下することが明らかになった[46]。さらに、軌道上の宇宙飛行がラットの創傷治癒能力を低下させ、血管新生が創傷治癒に重要な役割を果たすことが判明した[47]。しかし、制限はあるものの、宇宙旅行から帰還した宇宙飛行士は、内皮の傷害に起因すると思われる心筋萎縮、低血圧、起立性不耐性などの心血管系の問題を抱える可能性があるため、これらの研究は必要である [48,49]。実際、これまでの研究で、内皮細胞は分泌機能の変化だけでなく、アポトーシス、増殖、細胞骨格組織、成長、細胞内シグナル伝達機構、成長挙動といった様々なプロセスの変調を示すことが明らかになっている[44]。さらに、血管内皮増殖因子(VEGF)で増強することで、内皮細胞の細胞保護作用が明らかになった[51]。さらなる研究が必要であり、宇宙飛行士の心血管系の問題を予防するための可能な対策の開発に役立つであろう。
に行く:腸内細菌、血管新生、視覚障害との関連性
すでに述べたように、腸内細菌は宿主のさまざまな問題に影響を与えることが知られています。腸内細菌叢の組成に異常がある場合、腸管上皮バリアに影響を与え、宿主の免疫系に挑戦することができます[3]。神経眼症候群(SANS)と呼ばれる視覚障害は、宇宙飛行士、特に長期の宇宙飛行において大きな問題の一つである[52]。微小重力環境での6ヶ月のミッションの後、宇宙飛行士の37-51%がSANSの眼球変化に悩まされると報告されています。SANSは、視覚機能と眼球構造の変化と説明されています。SANSの眼球変化には、視床浮腫、脈絡膜襞、綿毛斑、網膜神経線維層肥厚、近見視力低下、視神経シート径(ONSD)増加、眼球扁平化などがあります。SANSの主な原因として、微小重力による頭側への体液移動などが報告されている[15]。しかし、SANSの正確な病態生理やメカニズムは完全には解明されておらず、効果的な対策法も明らかにされていない。最近の研究では、模擬微小重力により、成人の網膜色素上皮細胞の細胞骨格タンパク質に著しい変化が生じ、細胞の構造、成長、形状、移動、接着、血管新生に関わる細胞の挙動、成長、遺伝子発現パターンに変化が生じることが描かれました。この研究により、模擬微小重力環境下では、網膜細胞の内部および外部の細胞構造に弱体化が見られ、網膜層の機能に影響を及ぼす可能性が示唆された。しかし、最近、ヒトの神経幹細胞が宇宙空間で増殖し、特定のマーカーを発現することが報告された[53]。神経幹細胞は、中枢神経系の機能維持に不可欠な細胞である。さらに、この細胞は、地上でのコントロールと比較して、酸素消費量と解糖度が高いことが明らかになりました。これらの細胞は、若い神経細胞になる能力も維持していた[53]。このことは、別の研究でも裏付けられ、ヒトの神経幹細胞は、地上での対照と比較して、宇宙では7倍も増殖することが明らかにされた[54]。しかし、長期の宇宙飛行に参加する宇宙飛行士に観察される眼球の変化が同様であるかどうかを判断するためには、さらなる研究が必要である[55]。
腸内細菌が遠位眼球/網膜免疫系に影響を及ぼす可能性を示唆した最初の研究は、自己免疫性ぶどう膜炎のマウスモデルで、網膜特異的T細胞が微生物叢由来の抗原によって活性化し、自己免疫の引き金となったものです [56]. さらに、別の最近の研究では、肥満マウスの微生物叢が、炎症性メディエーターの産生を介して、病的な血管新生につながる網膜自然免疫系を活性化することが示された [13,57].この研究では、高脂肪食と体重増加により、マウスが実験的レーザー誘発性脈絡膜新生血管形成に対してより感受性が高くなることが描かれた。高脂肪食を与えた動物に非腸管透過性の抗生物質を経口投与したところ、脈絡膜新生血管が阻止されたことは注目に値し、腸内細菌叢と眼血管新生との関連性を示している [13,52]. さらに、健常マウスの糞便微生物叢を経口投与で肥満マウスに移植する実験を行ったところ、病的な血管新生が顕著に抑制されたことから、腸内細菌叢の異常がキープレーヤーであることが明らかになった[13,52]。また、この研究では、脂肪を多く含む食事が腸の透過性を高め、これが引き金となって、眼球脈絡膜で検出されたインターロイキン-1b(IL-1β)、インターロイキン-6(IL-6)、腫瘍壊死因子(TNF)からなる強力な炎症性メディエーターの放出や、血管新生の促進因子である血管内皮増殖因子a(VEGFa)の存在が明らかになったと報告しています [13,52]. この研究は、全身および局所的な免疫プロセスを介して媒介される腸内細菌叢と眼球血管新生との間の革新的な接続を提供しました。宇宙飛行中および飛行後の宇宙飛行士の神経・眼球の変化、すなわちSANSの状態についていくつかの研究が記録していることから、宇宙飛行士における腸内細菌叢と視覚障害との関連性を研究することが正当化される。食事介入によって、微小重力環境下の宇宙飛行士に観察される腸内細菌異常症を抑制できるかどうか、また、視覚障害の必要性につながる血管新生への影響についての調査が必要である。実際、腸内細菌叢を調節することは、食物繊維が豊富なプレバイオティクスや特別に処方されたプロバイオティクスを取り入れることと同様に、宇宙飛行士の新規治療オプションとなりうるかもしれない。
次へ血管新生と骨格筋
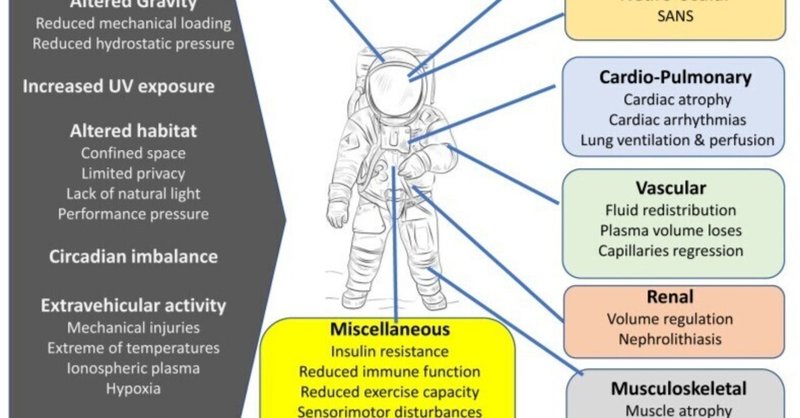
宇宙飛行士が微小重力環境に長期間滞在することで生じる顕著な影響として、体重を支える骨や骨格筋で生じる筋萎縮や骨量の減少が挙げられる。宇宙での筋骨格系損失の主な要因は機械的な除荷であるが、いくつかの要因や生理学的な変化が宇宙での骨や筋肉の損失に潜在的に寄与している可能性がある(図1)[58]。
図1
宇宙飛行に関連する危険と様々な身体システムへの影響。宇宙飛行では、人体の神経系、心臓系、血管系、筋骨格系、その他のシステムに複数の変化が生じます。
骨格筋は体内で最も大きな器官であり、体格の約40%を占めている。骨格筋は、従来、運動という観点から研究されてきたが、代謝機能にも特化しており、グルコースや脂肪の貯蔵を担っている。したがって、高インスリン血症や運動などの条件下では[59,60]、グルコースの貯蔵と分解に関与する主要な器官の1つである。また、筋は非常に可塑性の高い器官であり、いくつかの生理的および病理的な状態において、構造的および機能的な要求の変化に適応することができます [61]。筋の適応過程には、筋サイズや筋力、繊維型の変化、代謝や収縮特性の変化が含まれます。筋微小循環は、骨格筋と全身循環の間でガス、栄養、代謝物を交換するための重要なインターフェイスである。様々な生理的、病理的条件下で、微小循環が骨格筋と並行して変化することを示唆する証拠は山ほどある [19] 。この適応には、骨格筋の代謝需要の変化に応じて毛細血管が形成されたり退行したりすることが含まれます。長年にわたり、様々な生理的・病理的状態における筋毛細血管の変化を促す分子メカニズムに対する理解が大きく進展してきました。筋の毛細血管形成に関与するいくつかの特徴的な分子候補が同定されている。しかし、これらの病態における毛細血管形成に関連する分子機構は、これまでほとんど注目されてこなかった。筋適応における血管新生の重要な役割と、機能的・代謝的健康に対する骨格筋の貢献から、微小重力条件下での筋血管新生を詳細に理解する必要がある。
既存の血管から新しい毛細血管が形成されることは血管新生と呼ばれ、運動や創傷治癒に反応して起こる。骨格筋では、2種類の血管新生が認められている:分裂と発芽である [19] 。分裂型血管新生は、低強度、高容量の運動により毛細血管の内腔にかかる大きなストレスに反応して起こり、内皮細胞の増殖は伴わないかもしれない [62]. 萌芽的血管新生は、過負荷運動後の血管の機械的伸張に反応して起こる。新規および既存の毛細血管は、一般に筋との接触面積を増やすために、蛇行しながら筋繊維と平行に走る [62]. 約10~20本の毛細血管が終末細動脈に接続し、血管運動によって筋の灌流を制御している[63]。激しい収縮時には、毛細血管床を流れる血流が100倍に上昇し、筋の酸素需要の上昇に対応することができる [64]。筋繊維表面の毛細血管の分布は繊維の大きさによって異なり、酸化的な小繊維では解糖的な高速繊維に比べてより均質な分布をしている [62]. 酸化力の弱い繊維ではミトコンドリア密度が高いため、毛細血管の間隔は、働くミトコンドリアに最適な酸素を供給するように設計されているようです。この酸素供給の最適化の証拠は、筋疲労抵抗が毛細血管密度と直接的な相関を持つという観察から得られている。これと一致するように、持久力の高い筋肉は、訓練されていない疲労に敏感な筋肉と比較して、高い毛細血管密度を示す [65]. 筋の毛細血管密度は、骨格筋におけるグルコースの取り込みと貯蔵の能力も規定する。先に述べたように、骨格筋はグルコースの主要な貯蔵器官の1つである。食後のインスリンレベルの上昇は、骨格筋への血流を増加させ、骨格筋繊維へのグルコースの取り込みを促進する[63]。これと一致して、持久走選手のように骨格筋の毛細血管密度が高いことは、インスリン感受性と耐糖能に関連している[66]。逆に、座りっぱなしや高齢者の毛細血管密度の低下は、耐糖能異常やインスリン抵抗性に寄与する[67]。現在の研究では、腸内細菌が骨生理学の制御に関与する重要な因子である可能性が示唆されている[68]。腸内細菌異常症の結果は、ビタミンやミネラルの腸管吸収の変化、炎症および免疫の制御をもたらす複雑なメカニズムに関与していると思われる。最近、腸内細菌とその代謝物による炎症が、骨におけるTNFαと破骨細胞形成因子RANKL(receptor activator of nuclear factor kappa-B ligand)の産生を介し、骨量減少をもたらすことが描かれた。さらに、腸内代謝物の骨への影響は、NOD受容体による細菌のペプチドグリカンの感知に依存している。マウスを用いたいくつかのin vivo研究では、骨格筋量および筋力と乳酸菌種との間に潜在的な関連があることが報告されており、特に宇宙飛行士を用いたさらなる実験が必要である [69] 。
に行く:血管新生のメタボライトドライバーと腸内細菌叢
血管新生の分子基盤を解明するための研究は、1970年代前半に開始された。最近では、過去10年ほどの間に、内皮細胞の代謝に関する研究が増えてきた。これらの研究により、血管新生におけるいくつかの代謝経路と酵素の役割が理解されるようになった [70] 。血管内皮増殖因子(VEGF)や線維芽細胞増殖因子(FGF2)などの血管新生促進分子やその他の増殖因子が、血管の萌芽を誘導するためには下流の代謝適応に依存していることが研究で示され、多くの研究が内皮細胞の代謝経路を標的とする可能性を示している[71]。最近、ヒト胎児の臓器(心臓、肝臓、肺、腎臓)から分離した培養内皮細胞のトランスクリプトーム解析により、内皮細胞が最も高い酸素消費率と解糖率を示し、代謝制御に関連するアップレギュレーション遺伝子に支えられていることが示された。このことから、代謝物が、内皮の器官特異的血管系への分化制御に関与している可能性を示唆している[72]。
別の最近の研究では、低酸素組織から放出される代謝物が血管新生作用を持つことが観察されたが、血管内皮増殖因子(VEGF)などの遺伝子のアップレギュレーションにおけるその役割はまだ解明されていない。本研究では、様々な代謝物と血管新生におけるその役割を明らかにした。すなわち、乳酸、リンゴ酸、ピルビン酸、アデノシンは、真皮由来の線維芽細胞を培養したヒト臍帯静脈内皮細胞(HUVECs)においてin vitroで検討した。さらに、エタノールについても試験を行った。この研究により、エタノールの代謝により、リンゴ酸および乳酸の濃度が高くなることが明らかになった。全体として、本研究により、リンゴ酸、乳酸、エタノールおよびアデノシンは、ある濃度で顕著な血管新生反応を生じることが明らかになった。さらに、この血管新生反応は、中和抗VEGF抗体の存在下で消失した。この研究のデータから、代謝物の血管新生作用は、VEGFの発現量増加と関連していることが示された [73].
腸内細菌の代謝産物は、腸管免疫の恒常性維持に不可欠であり、腸内細菌叢によって生合成され、腸管上皮細胞の調節に関与している。食物繊維内の複雑な多糖類の細菌による嫌気性発酵、および大腸内の嫌気性菌類に由来する酢酸、プロピオン酸、酪酸などの短鎖脂肪酸は、最も研究されている代謝物の一つである[74,75]。興味深いことに、MARS500の研究とNASAの双子の研究では、腸内細菌叢の酪酸産生メンバー、すなわちF. prausnitziiは、すべての乗組員で変化し、枯渇することが観察されたため、これらの細菌とその代謝物の重要性を示す[20]。F. prausnitziiは、酢酸を消費して酪酸を生成する細菌であり、腸内環境において抗炎症作用を持つ酪酸などの代謝物を生成することにより、抗炎症作用を示す[76,77]。また、上記のように、これらの代謝物は血管新生にも関与している[73]。さらに、短鎖脂肪酸が様々な腸管免疫細胞に影響を与え、様々なメカニズムで炎症を抑制することが研究で報告されています[78]。最近の研究では、腸内微生物の代謝物の影響と、その影響が腸脳軸など消化管の外にまで及ぶことが解明されているのみである[79]。宇宙飛行士の健康への影響を理解し、宇宙飛行士の腸内細菌を適宜調節できるようにするためには、上記の代謝物や他のどの腸内細菌代謝物が血管新生や微小重力環境と関連しているかを調べる研究が必要である(図2)。
図2
微小重力環境下における腸内細菌と血管新生には、乳酸、リンゴ酸、ピルビン酸、アデノシンなどの共通代謝物が認められることから、予防策を合理的に開発することが期待されます。
に進む:プロバイオティクス、プレバイオティクス、ポストバイオティクスの活用
明らかなように、腸内細菌叢は宿主の健康に大きく影響します。宇宙飛行中に食事やサプリメントとして添加されるプロバイオティクスは、宇宙飛行士が直面する調節障害を改善するために有望であり、その原因は腸内細菌の異常である可能性があり、また血管新生に影響を与える可能性があります。最近の研究では、微小重力条件下でプロバイオティクスまたはプレバイオティクスの有効性が判定された [80] 。プロバイオティクス菌株であるL. acidophilusの微小重力環境での有効性が解明され、生存と成長に明らかな差がないことが判明し、この菌株は宇宙旅行中もその効果を維持できることが示唆されました [80]。この研究に続いて、宇宙飛行士のために凍結乾燥させたプロバイオティクスを開発する研究が行われました。このプロバイオティクスは、ISSの船上で1ヶ月間保管され、安定性が確認されました。その結果、プロバイオティクスは、地上のコントロールと比較して、同様の生存細胞を有していることが明らかになり、宇宙旅行での使用の可能性を示唆するものとなりました[81]。これらの実験は非常に心強いものですが、それにもかかわらず、特に宇宙でのプロバイオティクスの利点を直接検証するためには、微小重力や模擬宇宙環境下でのメカニズム研究をさらに行う必要があります。さらに、ポストバイオティクス、つまり腸内細菌が分泌・放出する代謝産物は、宿主にとって有益である[82]。さらに、MARS500の研究でこれらの代謝物の変化が明らかになったように、短鎖脂肪酸の添加は潜在的な可能性がある。宇宙飛行士マイクロバイオームプロジェクト」として知られる注目すべき研究では、抗炎症作用に関連するアッカーマンシアの減少が描かれています。したがって、炎症による疾患を予防するために、アッカーマンシアを含むプレバイオティクスが今後の研究で利用されるかもしれません [12,20]. 有益な細菌株が特定・選択された時点で、その可能性を検証するために、宇宙旅行者を対象とした介入研究や臨床試験が保証されます。さらに、さらなるプロバイオティクス、特に骨格筋と骨密度を維持するための血管新生を標的としたプロバイオティクス、宇宙飛行士の視覚障害の予防とその全体的な健康やウェルビーイングを特定するためのさらなる研究が必要である。
に行く:結論
腸内細菌叢が宿主の健康全般を調節する上で重要な役割を果たすことは明らかである。同様に、腸内細菌叢は宇宙旅行中の宇宙飛行士の健康を調節する上で重要な役割を果たすことは、数多くの研究によって証明されている。腸内細菌叢は、免疫系、代謝の健康、神経の健康、さらには筋肉や骨の生理機能の維持を調節し、遠位眼球/網膜免疫系に影響を与えることが示されており、これらはすべて宇宙飛行中の宇宙飛行士に潜在的に影響を与える問題である。このように、腸内細菌叢の制御は、宇宙への長期滞在を成功させ、計画する上で最も重要である。特に、食物繊維の摂取と短鎖脂肪酸の生成を可能にするために、宇宙飛行士の食事を最適化し、プレバイオティクス、生物活性化合物、プロバイオティクスを併用し、効果を高めることが必要であろう。また、宇宙飛行士の糞便微生物叢からの移植も検討すべき選択肢である。これは、宇宙飛行士の便からプロバイオティクスカプセルを作成し、地球上で微生物相が健全である旅行前に移植する方法です。これにより、宇宙飛行士は、自分たちのマイクロバイオームを多様な微生物の集合で多様化できる可能性があります[28]。さらに、微小重力環境および模擬微小重力環境下での血管新生の影響と腸内細菌叢との関連性を探る研究が、宇宙飛行士の臨床研究と相まって必要である、現在の研究のほとんどはin vitroであるためである。特に、MARS500試験で変化が認められた短鎖脂肪酸の産生や、血管新生に影響を及ぼす他の腸内代謝物に関する今後の研究が必要であり、将来の宇宙ミッションの成功に不可欠である。
次へ
謝辞
この研究は、シャルジャ大学医学部から支援を受けている。
に移動する:
著者による寄稿
A.E.とN.A.K.が発案した。R.S.、R.Q.、N.A.K.は文献を調査し、原稿の第一稿を作成した。N.G.、R.S.、A.E.は原稿を修正・訂正した。すべての著者は、出版された原稿を読み、同意した。
に行く:
資金提供
RSは、空軍科学研究局(AFOSR)の助成金を受けています: FA 8655-20-1-7004; NAKはUniversity of Sharjah, R. 438/2021; AEはUniversity of Sharjah 16010901012-Pから資金提供を受けている。
にアクセスしてください:
インスティテューショナル・レビュー・ボード声明
この記事には、ヒトや動物を用いた研究は含まれていません。
こちらへどうぞ:
インフォームド・コンセントの記述
この記事には、人間を対象とした研究は含まれていません。
に移動します:
データ利用可能性ステートメント
この研究で発表されたデータは、対応する著者からのリクエストにより入手可能です。
に移動します:
利益相反
利益相反は存在しない。
このページをご覧ください:
脚注
出版社からのコメント:MDPIは、出版された地図や機関名における管轄権の主張に関して中立を保っています。
このページのトップへ戻る
参考文献Goswami N., White O., Blaber A., Evans J., van Loon J.J., Clement G. Human physiology adaptation to altered gravity environments. Acta Astronaut. 2021;189:216-221. doi: 10.1016/j.actaastro.2021.08.023. [CrossRef] [Google Scholar].
Goswami N., Van Loon J.J.W.A., Roessler A., Blaber A.P., White O. Editorial: 重力生理学、加齢と医学。Front. Physiol. 2019;10:1338. doi: 10.3389/fphys.2019.01338. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Siddiqui R., Akbar N., Khan N.A. Gut microbiome and human health under the space environment. J. Appl. Microbiol. 2020;130:14-24. doi: 10.1111/jam.14789. [PubMed] [CrossRef] [Google Scholar].
Laurini K., Piedboeuf J.C., Schade B., Matsumoto K., Spiero F., Lorenzoni A., The Global Exploration Roadmap IAC-11 B. 2018. (2021年8月20日にアクセス)]. オンラインで入手可能: https://www.globalspaceexploration.org/wordpress/wp-content/uploads/IAC62/ISECG Global Exploration Roadmap.pdf
Garrett-Bakelman F.E., Darshi M., Green S.J., Gur R.C., Lin L., Macias B.R., McKenna M.J., Meydan C., Mishra T., Nasrini J., et al. The NASA Twins Study: 1年間の有人宇宙飛行を多角的に分析したもの。Science. 2019;364:eaau8650. doi: 10.1126/science.aau8650. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kinross J.M., Darzi A.W., Nicholson J.K. Gut microbiome-host interactions in health and disease. Genome Med. 2011;3:1-12. doi: 10.1186/gm228. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mohajeri M.H., Brummer R.J.M., Rastall R.A., Weersma R.K., Harmsen H.J.M., Faas M., Eggersdorfer M. The role of the microbiome for human health: 基礎科学から臨床応用まで。Eur. J. Nutr. 2018;57:1-14. doi: 10.1007/s00394-018-1703-4. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Valdes A., Walter J., Segal E., Spector T.D. Role of the gut microbiota in nutrition and health. BMJ. 2018;361:k2179. doi: 10.1136/bmj.k2179. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sampson T.R., Mazmanian S.K. Control of Brain Development, Function, and Behavior by the Microbiome. Cell Host Microbe. 2015;17:565-576. doi: 10.1016/j.chom.2015.04.011. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Zeevi D., Korem T., Zmora N., Israeli D., Rothschild D., Weinberger A., Ben-Yacov O., Lador D., Avnit-Sagi T., Lotan-Pompan M., et al. Glycemic Responsesの予測によるパーソナライズ栄養学. Cell. 2015;163:1079-1094. doi: 10.1016/j.cell.2015.11.001. [PubMed] [CrossRef] [Google Scholar].
Veronese N., Solmi M., Caruso M.G., Giannelli G., Osella A.R., Evangelou E., Maggi S., Fontana L., Stubbs B., Tzoulaki I. Dietary fiber and health outcomes: システマティックレビューとメタアナリシスのアンブレラレビュー。Am. J. Clin. Nutr. 2018;107:436-444. doi: 10.1093/ajcn/nqx082. [PubMed] [CrossRef] [Google Scholar].
Voorhies A.A., Ott C.M., Mehta S., Pierson D.L., Crucian B.E., Feiveson A., Oubre C.M., Torralba M., Moncera K., Zhang Y., et al. 国際宇宙ステーションでの長期宇宙ミッションが宇宙飛行士のマイクロバイオームに及ぼす影響に関する研究(Study of the impact of long-duration space mission at the International Space Station on the astronaut microbiome. Sci. Rep. 2019;9:9911. doi: 10.1038/s41598-019-46303-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Andriessen E.M., Wilson A.M., Mawambo G., Dejda A., Miloudi K., Sennlaub F., Sapieha P. Gut microbiota influences pathological angiogenesis in obesity-driven choroidal neovascularization. EMBO Mol. Med. 2016;8:1366-1379. doi: 10.15252/emmm.201606531. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Mader T.H., Gibson C.R., Otto C.A., Sargsyan A.E., Miller N.R., Subramanian P.S., Hart S.F., Lipsky W., Patel N.B., Lee A.G. Persistent Asymmetric Optic Disc Swelling After Long-Duration Space Flight: Implications for Pathogenesis. J. Neuro-Ophthalmol. 2017;37:133-139. doi: 10.1097/WNO.000000000467. [PubMed] [CrossRef] [Google Scholar].
Lee A.G., Mader T.H., Gibson C.R., Brunstetter T.J., Tarver W.J. Space Flight-associated neuro-ocular syndrome (SANS) Eye. 2018;32:1164-1167. doi: 10.1038/s41433-018-0070-y. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Adair T.H., Montani J.P. Colloquium Series on Integrated Systems Physiology: 分子レベルから機能レベルまで。Morgan & Claypool Life Sciences; San Rafael, CA, USA: 2010. Angiogenesis. [Google Scholar】を参照してください。]
Cabral T., Mello L.G.M., Lima L.H., Polido J., Regatieri C.V., Belfort R., Jr., Mahajan V.B. Retinal and choroidal angiogenesis: 新しいターゲットのレビュー。Int. J. Retin. Vitr. 2017;3:1-13. doi: 10.1186/s40942-017-0084-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Vico L., Hargens A. Skeletal changes during and after spaceflight. Nat. Rev. Rheumatol. 2018;14:229-245. doi: 10.1038/nrrheum.2018.37. [PubMed] [CrossRef] [Google Scholar].
Baum O., Olfert I.M., Egginton S., Hellsten Y. Advances and challenges in skeletal muscle angiogenesis. Am. J. Physiol.-Heart Circ. Physiol. 2016;310:H326-H336. doi: 10.7892/boris.75246. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Turroni S., Rampelli S., Biagi E., Consolandi C., Severgnini M., Peano C., Quercia S., Soverini M., Carbonero F.G., Bianconi G., et al. Temporal dynamics of the gut microbiota in people sharing a confined environment, a 520-day ground-based space simulation, MARS5. Microbiome. 2017;5:1-11. doi: 10.1186/s40168-017-0256-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Bull M.J., Plummer N.T. Part 1: The Human Gut Microbiome in Health and Disease. Integr. Med. (Encinitas Calif.) 2014;13:17-22. [PMC free article] [PubMed] [Google Scholar].
Kang D.-W., Adams J.B., Gregory A.C., Borody T., Chittick L., Fasano A., Khoruts A., Geis E., Maldonado J., McDonough-Means S., et al. Microbiota Transfer Therapy alters gut ecosystem and improve gastrointestinal and autism symptoms, and others: 非盲検試験。Microbiome. 2017;5:1-16. doi: 10.1186/s40168-016-0225-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Kelly J., Minuto C., Cryan J.F., Clarke G., Dinan T.G. Cross Talk: 微生物叢と神経発達障害. Front. Neurosci. 2017;11:490. doi: 10.3389/fnins.2017.00490. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Ghoshal U.C., Shukla R., Ghoshal U., Gwee K.-A., Ng S.C., Quigley E.M.M. The Gut Microbiota and Irritable Bowel Syndrome: 敵か味方か?Int. J. Inflamm. 2012;2012:151085. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Koh A., De Vadder F., Kovatcheva-Datchary P., Bäckhed F. 食物繊維から宿主生理へ: 食物繊維から宿主生理へ:主要な細菌代謝産物としての短鎖脂肪酸。Cell. 2016;165:1332-1345. doi: 10.1016/j.cell.2016.05.041. [PubMed] [CrossRef] [Google Scholar].
Stojanov S., Berlec A., Štrukelj B. 肥満と炎症性腸疾患の治療におけるプロバイオティクスのファーミキューテス/バクテロイデテス比への影響. Microorganisms. 2020;8:1715. doi: 10.3390/microorganisms8111715. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Amedei A., Morbidelli L. Circulating Metabolites Originating from Gut Microbiota Control Endothelial Cell Function. Molecules. 2019;24:3992. doi: 10.3390/molecules24213992. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Voorhies A.A., Lorenzi H.A. The Challenge of Maintaining a Healthy Microbiome during Long-Duration Space Missions. Front. Astron. Space Sci. 2016;3:23. doi: 10.3389/fspas.2016.00023. [クロスリーフ] [グーグル スカラー]。
Dietlein L.F. Skylab: A Beginning. [(2021年8月20日アクセス)];1977 Available online: https://ntrs.nasa.gov/api/citations/19860011667/downloads/19860011667.pdf?attachment=true
56日間の軌道上模擬飛行中の乗組員の菌学的プロファイル。Mycopathologia. 1978;63:131-144. doi: 10.1007/BF00490928. [PubMed] [CrossRef] [Google Scholar].
Nicogossian A.E., Doarn C.R., Hu Y.. 宇宙生理学と医学。Springer; New York, NY, USA: 2016. Evolution of Human Capabilities and Space Medicine; pp.3-57. [Google Scholar】。]
Brereton N., Pitre F., Gonzalez E. Reanalysis of the Mars500 experiment reveals common gut microbiome alterations in astronauts induced by long-duration confinement. Comput. Struct. Biotechnol. J. 2021;19:2223-2235. doi: 10.1016/j.csbj.2021.03.040. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Avila-Herrera、Thissen J.、Urbaniak C.、Be N.A.、Smith D.J., Karouia F., Mehta S., Venkateswaran K., Jaing C. Crewmember microbiome may influence micro composition of ISS habitable surfaces. PLoS ONE. 2020;15:e0231838. doi: 10.1371/journal.pone.0231838. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Morrison M.D., Thissen J.B., Karouia F., Mehta S., Urbaniak C., Venkateswaran K., Smith D.J., Jaing C. Investigation of Spaceflight Induced Changes to Astronaut Microbiomes. Front. Microbiol. 2021;12:1368. doi: 10.3389/fmicb.2021.659179. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tirumalai M.R., Karouia F., Tran Q., Stepanov V.G., Bruce R.J., Ott C.M., Pierson D.L., Fox G.E. The adaptation of Escherichia coli cells grown in simulated Microgravity for an extended period is both phenotypic and genomic. npj Microgravity. 2017;3:1-9. doi: 10.1038/s41526-017-0020-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Tirumalai M.R., Karouia F., Tran Q., Stepanov V.G., Bruce R.J., Ott C.M., Pierson D.L., Fox G.E. Evaluation of Acquired Antibiotic Resistance in Escherichia coli Exposed to Long-Term Low-Shear Modeled Microgravity and Background Antibiotic Exposure. MBio. 2019;10:e02637-18. doi: 10.1128/mBio.02637-18. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wang J., Han C., Lu Z., Ge P., Cui Y., Zhao D., Yang X., Wu B., Qiang L., Zhang Y., et al. Simulated microgravity suppresses MAPK pathway-mediated innate immune response to bacterial infection and induces gut microbiota dysbiosis. FASEB J. 2020;34:14631-14644. doi: 10.1096/fj.202001428R. [PubMed] [CrossRef] [Google Scholar].
Vroom M.M., Rodriguez-Ocasio Y., Lynch J.B., Ruby E.G., Foster J.S. Modeled microgravity alters lipopolysaccharide and outer membrane vesicle production of the beneficial symbiont Vibrio fischeri. npj Microgravity. 2021;7:1-10. doi: 10.1038/s41526-021-00138-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Goswami N., Roma P.G., De Boever P., Clément G., Hargens A.R., Loeppky J.A., Evans J.M., Peter Stein T., Blaber A.P., Van Loon J.J.W.A., et al. Using the Moon as a high-fidelity analogue environment to study biological and behaviour effects of long-duration space exploration. Planet Space Sci. 2012;74:111-120. doi: 10.1016/j.pss.2012.07.030. [CrossRef] [Google Scholar].
Maier J.A.M., Cialdai F., Monici M., Morbidelli L. The Impact of Microgravity and Hypergravity on Endothelial Cells. BioMed Res. Int. 2015;2015:434803. doi: 10.1155/2015/434803. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cotrupi S., Ranzani D., Maier J.A. Impact of modeled microgravity on microvascular endothelial cells. Biochim. Biophys. アクタ(BBA)-Bioenerg. 2005;1746:163-168. doi: 10.1016/j.bbamcr.2005.10.002. [PubMed] [CrossRef] [Google Scholar].
Versari S., Villa A., Bradamante S., Maier J.A. Alterations of the actin cytoskeleton and increased nitric oxide synthesis are common features in human primary endothelial cell response to change in gravity. Biochim. Biophys. アクタ(BBA)-Bioenerg. 2007;1773:1645-1652. doi: 10.1016/j.bbamcr.2007.05.014. [PubMed] [CrossRef] [Google Scholar].
Morbidelli、Monici、Marziliano、Cogoli、Fusi、Waltenberger、J、Ziche M. Simulated hypogravity impairs the angiogenic response of endothelium by up-regulating apoptotic signal. Biochem. Biophys. Res. Commun. 2005;334:491-499. doi: 10.1016/j.bbrc.2005.06.124. [PubMed] [CrossRef] [Google Scholar].
Krüger M., Pietsch J., Bauer J., Kopp S., Carvalho D.T.O., Baatout S., Moreels M., Melnik D., Wehland M., Egli M., et al. Endothelial Cells growth of Space and in Simulated Microgravity-A Comparison on the Secretory Level. Cell. Physiol. Biochem. 2019;52:1039-1060. [PubMed][Google Scholar]。
Kirchen M.E., O'Connor K.M., Gruber H.E., Sweeney J.R., Fras I.A., Stover S.J., Sarmiento A., Marshall G.J. Effects of microgravity on bone healing in a rat fibular osteotomy model. Clin. Orthop. Relat. Res.1995;318:231-242。[PubMed] [Google Scholar].
Henry M.K., Unsworth B.R., Sychev V., Guryeva T.S., Dadasheva O.A., Piert S.J., Lagel K.E., Dubrovin L.C., Jahns G.C., Boda K., et al. Launch conditions might affect the blood vessel in the chorioallantoic membrane(ウズラの腸管膜に血管が形成されるか). Folia Vet. 1998;42:s25-s31. [PubMed] [Google Scholar].
Davidson、Aquino、Woodward、Wilfinger、W.W.持続的微小重力はラットの内在性創傷治癒と成長因子応答を減少させる。FASEB J. 1999;13:325-329. doi: 10.1096/fasebj.13.2.325. [PubMed] [CrossRef] [Google Scholar].
Goswami N. Falls and Fall-Prevention in Older Persons: Geriatrics Meets Spaceflight(老年医学と宇宙飛行の出会い)!Front Physiol. 2017;8:603. doi: 10.3389/fphys.2017.00603. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Goswami N., Batzel J.J., Clément G., Stein T.P., Hargens A., Sharp M.K., Blaber A.P., Roma P.G., Hinghofer-Szalkay H.G. 宇宙データ資源から情報を最大化する: 研究分野横断的な統合を拡大するためのケース。Graefe's Arch. Clin. Exp. Ophthalmol. 2012;113:1645-1654. doi: 10.1007/s00421-012-2507-5. [PubMed] [CrossRef] [Google Scholar].
Delp M.D., Charvat J.M., Limoli C.L., Globus R.K., Ghosh P. Apollo Lunar Astronauts Show Higher Cardiovascular Disease Mortality: 血管内皮に対する深宇宙放射線の影響の可能性。Sci. Rep. 2016;6:29901. doi: 10.1038/srep29901. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Infanger M., Kossmehl P., Shakibaei M., Baatout S., Witzing A., Grosse J., Bauer J., Cogoli A., Faramarzi S., Derradji H., et al. 模擬微小重力によるヒト内皮細胞の三次元集合とアポトーシス上昇の誘導: 血管内皮増殖因子の影響。Apoptosis. 2006;11:749-764. doi: 10.1007/s10495-006-5697-7. [PubMed] [CrossRef] [Google Scholar].
Mader T.H., Gibson C.R., Miller N.R., Subramanian P.S., Patel N.B., Lee A.G. An overview of spaceflight-associated neuro-ocular syndrome (SANS) Neurol. India. 2019;67:206-S211. doi: 10.4103/0028-3886.259126. [PubMed] [CrossRef] [Google Scholar].
Cepeda C., Vergnes L., Carpo N., Schibler M.J., Bentolila L.A., Karouia F., Espinosa-Jeffrey A. Human Neural Stem Cells Flown into Space Proliferate and Generating Young Neurons. Appl. Sci. 2019;9:4042. doi: 10.3390/app9194042. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Shaka S., Carpo N., Tran V., Ma Y.Y., Karouia F. Human Neural Stem Cells in Space Proliferate more than Ground Control Cells: 宇宙でのヒト神経幹細胞は地上対照細胞よりも増殖する:長期間の宇宙旅行への示唆。J. Stem Cell Res. Dev. Ther. 2021;7:69. [Google Scholar】を参照。]
Corydon T.J., Mann V., Slumstrup L., Kopp S., Sahana J., Askou A.L., Magnusson N.E., Echegoyen D., Bek T., Sundaresan A., et al. Simulated Microgravityにさらされたヒト成人網膜色素上皮細胞における細胞骨格および細胞外マトリックスの遺伝子発現低下. Cell. Physiol. Biochem. 2016;40:1-17. doi: 10.1159/000452520. [PubMed] [CrossRef] [Google Scholar].
蓬莱玲子、Zárate-Bladés C.、Dillenburg-Pilla P.、Chen J.、Kielczewski J.L., Silver P.B., Jittayasothorn Y., Chan C.-C., Yamane H., Honda K., et al. Microbiota-Dependent Activation of an Autoreactive T Cell Receptor Provokes Auto Immunity in an Immunologically Privileged Site. Immunity. 2015;43:343-353. doi: 10.1016/j.immuni.2015.07.014. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Scholz R., Langmann T. 腸内フローラは、肥満を眼の病的血管新生と結びつけている。EMBO Mol. Med. 2016;8:1361-1363. doi: 10.15252/emmm.201607165. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Smith S.M., McCoy T., Gazda D., Morgan J., Heer M., Zwart S.R. Space Flight Calcium: Implications for Astronaut Health, Spacecraft Operations, and Earth. Nutrients. 2012;4:2047-2068. doi: 10.3390/nu4122047. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
骨格筋、脂肪組織、肝臓におけるインスリン刺激によるグルコース取り込み: Positron Emission Tomographyの研究。Eur. J. Endocrinol. 2018;178:523-531. doi: 10.1530/EJE-17-0882. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Martinez-Huenchullan S.F., Tam C.S., Ban L.A., Ehrenfeld-Slater P., Mclennan S.V., Twigg S.M. Skeletal muscle adiponectin induction in obesity and exercice. Metabolism. 2019;102:154008. doi: 10.1016/j.metabol.2019.154008. [PubMed] [CrossRef] [Google Scholar].
Judge A.R., Powers S.K., Ferreira L.F., Bamman M.M. Meeting Synopsis: Advances in Skeletal Muscle Biology in Health and Disease (Gainesville, Florida, February 22nd to 24th 2012)-Day 1: "Cell Signaling Mechanisms Mediating Muscle Atrophy and Hypertrophy" and "muscle Force, Calcium Handling, and Stress Response" Front. Physiol. 2012;3:200. [PMC free article] [PubMed] [Google Scholar].
Hendrickse P., Degens H. The role of the microcirculation in muscle function and plasticity(筋機能と可塑性における微小循環の役割). J. Muscle Res. Cell Motil. 2019;40:127-140. doi: 10.1007/s10974-019-09520-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Wagenmakers A.J.M., Strauss J., Shepherd S.O., Keske M., Cocks M. 食事の摂取と運動によって誘発される筋血液供給と経内皮栄養・インスリン輸送の増加: 肥満と加齢の影響。J. Physiol. 2015;594:2207-2222. doi: 10.1113/jphysiol.2014.284513. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Poole D.C., Copp S.W., Hirai D.M., Musch T.I. Dynamics of muscle microcirculatory and blood-myocyte O2 flux during contractions. Acta Physiol. 2010;202:293-310. doi: 10.1111/j.1748-1716.2010.02246.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Laughlin M., Roseguini B. Mechanisms for exercise training-induced increases in skeletal muscle blood flow capacity: インターバル・スプリント・トレーニングと有酸素性持久力トレーニングの違い。J. Physiol. Pharmacol. Off. J. Pol. Physiol. Soc. 2008;59:71-88. [PMC free article] [PubMed] [Google Scholar].
Vincent M.A., Clerk L.H., Lindner J.R., Price W.J., Jahn L.A., Leong-Poi H., Barrett E.J. Mixed meal and light exercise each recruit muscle capillaries in healthy humans. Am. J. Physiol. Metab. 2006;290:E1191-E1197. doi: 10.1152/ajpendo.00497.2005. [PubMed] [CrossRef] [Google Scholar].
Groen B.B.L., Hamer H.M., Snijders T., Van Kranenburg J., Frijns D., Vink H., van Loon L.J. Skeletal muscle capillary density and microvascular function are compromised with aging and type 2 diabetes. J. Appl. Physiol. 2014;116:998-1005. doi: 10.1152/japplphysiol.00919.2013. [PubMed] [CrossRef] [Google Scholar]を参照。
Turroni S., Magnani M., Kc P., Lesnik P., Vidal H., Heer M. Gut Microbiome and Space Travelers' Health: 腸内細菌と宇宙旅行者の健康:長期宇宙ミッションのための技術の現状と可能なプロ/プレバイオティクス戦略。Front. Physiol. 2020;11:1135. doi: 10.3389/fphys.2020.553929. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Chen Y.-M., Wei L., Chiu Y.-S., Hsu Y.-J., Tsai T.-Y., Wang M.-F., Huang C.-C. Lactobacillus plantarum TWK10 Supplementation Improves Exercise Performance and Increases Muscle Mass in Mice. Nutrients. 2016;8:205. doi: 10.3390/nu8040205. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Cruys B., Wong B., Kuchnio A., Verdegem D., Cantelmo A.R., Conradi L.-C., Vandekeere S., Bouché A., Cornelissen I., Vinckier S., et al. Glycolytic regulation of cell rearrangement in angiogenesis. Nat. Commun. 2016;7:12240. doi: 10.1038/ncomms12240. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Li X., Sun X., Carmeliet P. Hallmarks of Endothelial Cell Metabolism in Health and Disease. Cell Metab. 2019;30:414-433. doi: 10.1016/j.cmet.2019.08.011. [PubMed] [CrossRef] [Google Scholar].
Marcu R., Choi Y.J., Xue J., Fortin C.L., Wang Y., Nagao R.J., Xu J., MacDonald J.W., Bammler T.K., Murry C.E., et al. Human Organ-Specific Endothelial Cell Heterogeneity.iScience. 2018;4:20-35. doi: 10.1016/j.isci.2018.05.003. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Burns P., Wilson D. Angiogenesis is dependent on vascular endothelial growth factor (VEGF) Angiogenesis.代謝産物によって媒介される血管新生。2003;6:73-77. doi: 10.1023/A:1025862731653. [PubMed] [CrossRef] [Google Scholar].
Scupham A.J., Presley L.L., Wei B., Bent E., Griffith N., McPherson M., Zhu F., Oluwadara O., Rao N., Braun J., et al. Abundant and Diverse Fungal Microbiota in the Murine Intestine. Appl. Environ. Microbiol. 2006;72:793-801. doi: 10.1128/AEM.72.1.793-801.2006. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Nicolas G.R., Chang P.V. Deciphering the Chemical Lexicon of Host-Gut Microbiota Interactions. Trends Pharmacol. Sci. 2019;40:430-445. doi: 10.1016/j.tips.2019.04.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Sokol H., Pigneur B., Watterlot L., Lakhdari O., Humaran L.G.B., Gratadoux J.-J., Blugeon S., Bridonneau C., Furet J.-P., Corthier G., et al. Faecalibacterium prausnitzii is an anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn diseases patients. Proc. Natl. Acad. Sci. USA. 2008;105:16731-16736. doi: 10.1073/pnas.0804812105. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Scott、Fu、Chang P.V. 微生物のトリプトファン代謝物は、アリールハイドロカーボン受容体を介して腸のバリア機能を制御しています。Proc. Natl. Acad. Sci. USA. 2020;117:19376-19387. doi: 10.1073/pnas.2000047117. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
ZhangZ.、TangH.、Chen P.、Xie H.、Tao Y. Demystifying the manipulation of host immunity, metabolism, and extraintestinal tumors by the gut microbiome. Signal Transduct. Target. Ther. 2019;4:1-34. doi: 10.1038/s41392-019-0074-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Carabotti M., Scirocco A., Maselli M.A., Severi C. The gut-brain axis: 腸-脳軸:腸内細菌叢、中枢および腸神経系間の相互作用。Ann. Gastroenterol. 2015;28:203-209. [PMC free article] [PubMed] [Google Scholar].
Castro-Wallace S., Stahl S., Voorhies A., Lorenzi H., Douglas G.L. Response of Lactobacillus acidophilus ATCC 4356 to low-shear modeled microgravity. Acta Astronaut. 2017;139:463-468. doi: 10.1016/j.actaastro.2017.07.033. [CrossRef] [Google Scholar].
プロバイオティクスを宇宙へ: カプセル化された凍結乾燥プロバイオティクスの国際宇宙ステーションでの1ヶ月間の保存における実現可能性評価。Sci. Rep. 2018;8:10687. doi: 10.1038/s41598-018-29094-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
Aguilar-Toalá J.E., Varela R.G., Garcia H., Mata-Haro V., González-Córdova A., Vallejo-Cordoba B., Hernández-Mendoza A. Postbiotics: 機能性食品分野での進化する用語。トレンドフードサイ.テクノル. 2018;75:105-114. doi: 10.1016/j.tifs.2018.03.009. [CrossRef] [Google Scholar].
Lifeの記事は、Multidisciplinary Digital Publishing Institute (MDPI)の提供でここに提供されます。
AMA APA MLA NLM
NCBIをフォローする
NLMとつながる
国立医学図書館
8600 Rockville Pike
ベセスダ、MD 20894
ウェブポリシー
FOIA
HHS 脆弱性の開示
ヘルプ
アクセシビリティ
採用情報
NLM
NIH
米国保健省
USA.gov
この記事が気に入ったらサポートをしてみませんか?
