体内時計にまつわる脂質代謝
本文へスキップ記事へスキップ
エルゼビアロゴ
脂質研究の進展
第91巻 2023年7月, 101235
総説
体内時計にまつわる脂質代謝
https://www.sciencedirect.com/science/article/pii/S0163782723000255

著者リンク オーバーレイパネルを開くVolodymyr Petrenko a b c d 1, Flore Sinturel a b c d 1, Howard Riezman e, Charna Dibner a b c d
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.plipres.2023.101235
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
要旨
脂質は、生体膜構造、シグナル伝達、その他の機能の多様な側面とともに、エネルギー代謝において重要な役割を果たしている。脂質代謝の障害は、メタボリックシンドローム、肥満、2型糖尿病を含む様々な病態の発症に関与している。蓄積された証拠から、私たちの身体のほとんどの細胞で作動している概日振動子が、脂質の恒常性の時間的側面を調整していることが示唆される。本総説では、脂質の消化、吸収、輸送、生合成、異化、貯蔵の概日制御に関する現在の知見を要約する。特に、コレステロール、脂肪酸、トリアシルグリセロール、グリセロリン脂質、スフィンゴ糖脂質、スフィンゴミエリンからなる主要な脂質クラスの、機能的時計機構と生合成経路との間の分子的相互作用に焦点を当てる。現代社会で一般的な社会的要因による概日リズムのズレと、代謝異常の罹患率の増加とを関連付ける疫学的研究は増えているが、脂質代謝リズムの乱れとの関連は最近になって明らかにされたばかりである。ここでは、細胞内分子時計、脂質恒常性、代謝性疾患発症のメカニズム的関連性を解明する最近の研究を、時計の乱れの動物モデルやヒトを対象とした革新的なトランスレーショナル研究に基づいて紹介する。また、ヒト患者における代謝異常の予防と管理のための強力なアプローチとなりうる概日振動子の操作の展望についても述べる。
前の記事へ次の記事へ
キーワード
概日時計脂質代謝代謝疾患2型糖尿病組織特異的概日制御概日リピドミクス
はじめに:哺乳類概日時計の分子機構
概日時計システムは、ほとんどの生物において、日々の物理的な時間の変化を予測し、行動と生理の周期的振動を駆動する基本的な適応機構として発達してきた。哺乳類では、このシステムは、視床下部の視交叉上核(SCN)に位置するマスターまたはセントラルペースメーカーと、臓器に位置するスレーブまたはペリフェラルオシレーターの階層構造で組織された、相互に接続された無数のオシレーターを含んでいる [1,2]。SCNの時計は、明暗周期を中心とした環境的な手がかり(Zeitgeber)によって1日単位で同期される。SCNから発せられる神経とホルモンのリズムは、摂食、体温、酸素、代謝物レベルとともに、全身の末梢時計を同期させている [3,4]。概日振動子の基本的な性質は、細胞の自律性である [5]。SCNニューロンで作動する分子発振器がニューロン間で位相のコヒーレンスを保っているのに対し、末梢時計は、組織によって結合の強さは異なるものの、臓器内では結合の程度が弱い [6]。実際、膵島の隣接するα細胞とβ細胞で働く分子振動子は、それぞれ異なる位相を示す [7,8]。SCNニューロンでも末梢組織でも、概日振動を駆動するコアメカニズムの分子構造は、コアクロック遺伝子の発現に関する転写-翻訳(TTFL)と転写後のフィードバックループに依存している(図1に要約)。分子時計の2つの中心的な構成要素は、転写因子であるCircadian Locomoter Output Cycles Kaput Protein (CLOCK)とBrain and Muscle Aryl hydrocarbon receptor nuclear translocator-like 1 (BMAL1)であり、これらはヘテロ二量体複合体を形成し、コアクロック機構以外の多くの「時計制御遺伝子」(ccgs)のリズム発現を引き起こす。一次フィードバックループにおいて、BMAL1は4つのコアプレッシャータンパク質PER1、PER2、CRY1、CRY2をコードするPeriod(Per)遺伝子とCryptochrome(Cry)遺伝子の転写を活性化する[10]。十分な濃度になると、PERとCRY1の転写因子はヘテロ二量体化し、CLOCK-BMAL1複合体の活性を阻害する [11,12]。その結果、CLOCK-BMAL1活性化因子が不足すると、PERとCRYタンパク質のレベルが低下し、もはや転写を阻止できなくなる。その結果、PERとCRYタンパク質の蓄積の新たなサイクルが始まる。二次的なフィードバックループにおいて、CLOCK-BMAL1複合体は、REV-ERBs核内ホルモン受容体(REV-ERBαとREV-ERBβ)とRORα(神経細胞ではRORβ)をコードする遺伝子のリズミカルな発現を制御する。その結果、REV-ERBαとRORαは、ClockとBmal1のプロモーター領域内の同じROR DNA結合エレメント(RORE)を競合し、それぞれClockとBmal1の転写を抑制または活性化する(図1)。リン酸化、アセチル化、ユビキチン化/分解など、時計の核となるタンパク質の翻訳後修飾は、分子時計機構にさらなるレベルの制御を与える[14]。特にPERとCRYの安定性は、カゼインキナーゼ1ε/δ(CK1ε/δ)によって制御されている。PERとCRYタンパク質のリン酸化は、E3ユビキチンリガーゼ複合体によるポリユビキチン化を誘発し、タンパク質のプロテアソーム分解を促進する。
図1
ダウンロード 高解像度画像ダウンロード(673KB)
ダウンロード フルサイズ画像のダウンロード
図1. 哺乳類概日時計の分子構造と下流の脂質関連シグナル伝達。
哺乳類の時計は、相互に連結した転写-翻訳のフィードバックループで構成されている。CLOCK-BMAL1複合体は、遺伝子Per1/2/3やCry1/2を含む遺伝子プロモーター上のE-boxドメインに結合する。PERとCRYは集合し、自身の転写を抑制する。主ループはREV-ERBα/βとRORα/β/γからなる補助ループによって安定化される。RORタンパク質はREV-ERBsタンパク質と競合してBmal1遺伝子プロモーター上のROREエレメントに結合し、Bmal1とクロックの転写を正(ROR)と負(REV-ERB)の両方から制御している。転写後レベルでは、PERとCRYタンパク質の安定性はキナーゼ(カゼインキナーゼ1ε/δ(CK1ε/δ)とAMPキナーゼ(AMPK))によって制御されている。PERとCRYタンパク質のリン酸化は、E3ユビキチンリガーゼ複合体によるポリユビキチン化を促進し、E3ユビキチンリガーゼはプロテアソームによる分解のためにPERとCRYタンパク質にタグをつける。さらに、コア時計タンパク質は、概日フィードバックループの下流で数百の遺伝子の発現を制御している。これらの時計出力標的は、脂質代謝を含む広範な生理過程に関与している。これらの概日制御分子のうち、胆汁酸およびコレステロール代謝、脂肪生成、脂肪酸酸化、および脂質輸送に関与する重要な因子をコードする遺伝子が描かれている。詳細は本文を参照。
脂質代謝の概日機構
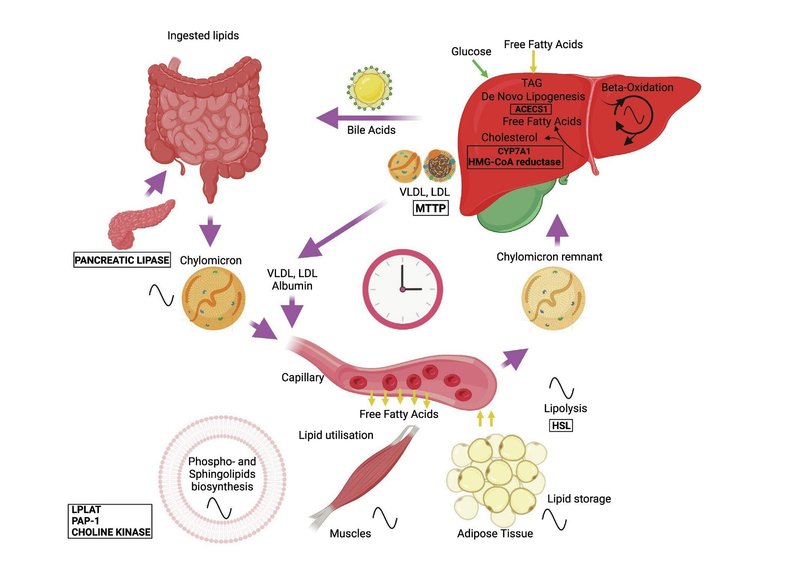
分子時計が、腸における脂質の消化・吸収、輸送、細胞内脂質代謝、蓄積など、脂質代謝のさまざまな側面の時間的構成を調整していることを示す証拠が増えつつある(図2参照)。本章では、脂質代謝のさまざまなステップの概日制御に関する現在の知見と、病理学におけるその役割についてまとめる(図3参照)。
図2
ダウンロード 高解像度画像ダウンロード(311KB)
ダウンロード フルサイズ画像のダウンロード
図2. 脂質代謝の概日機構。
細胞自律性の概日時計は、脂質代謝のさまざまなステップを制御している。摂取された脂質は、胆汁酸の助けを借りて乳化され、腸管内腔で分解され、小腸の腸細胞によって取り込まれる。トリグリセリドとコレステロールはカイロミクロンに再包装され、循環系に移動する。内皮リポ蛋白リパーゼによって加水分解されたトリグリセリドは遊離脂肪酸を放出し、代謝組織に取り込まれる。残ったカイロミクロンは肝臓で除去される。カイロミクロン残渣に由来するコレステロールと遊離脂肪酸は、低比重リポ蛋白と超低比重リポ蛋白(LDLとVLDL)に再包装されるか、あるいは循環グルコースと同様に肝臓でのde novo脂肪新生に利用される。アルブミン関連脂肪酸、LDLおよびVLDL粒子は、代謝組織にとっての遊離脂肪酸の主要な循環供給源である。遊離脂肪酸は細胞内に入ると、β酸化によりエネルギー産生に利用されるか、トリアシルグリセロール(TAG)の形で貯蔵される。細胞は遊離脂肪酸またはグルコースを用いて、細胞内シグナル伝達に重要な役割を果たし、細胞膜の主要構成成分であるリン脂質やスフィンゴ脂質を生合成する。中央の時計(図では時計のイメージで示されている)は、脂質代謝の重要なステップの時間的構成を確実にするために、細胞自律発振器のネットワークを編成している(洞サイン)。主要な脂質代謝酵素をコードする遺伝子の転写の概日制御(図1参照)以外にも、マウスやヒトにおけるいくつかの酵素(四角で示す)の生物活性の概日制御が最近報告されている。これらの酵素には、膵リパーゼ、GLPリモデリング酵素リゾリン脂質アシルトランスフェラーゼ(LPLAT)、GLP合成酵素ホスファチジン酸ホスホヒドロラーゼ1(PAP-1)、コリンキナーゼ、ホルモン感受性リパーゼ(HSL)などがある; 細胞質アセチル-CoA合成酵素(ACECS1)、コレステロール-7α-水酸化酵素(CYP7A1)、β-ヒドロキシβ-メチルグルタリル-コエンザイムA還元酵素(HMG-CoA還元酵素)、ミクロソームトリグリセリド転移タンパク質(MTTP)。
2.1. 脂質消化・吸収のサーカディアン制御
腸管内腔で起こる食餌性脂質の消化と吸収は、全身の脂質代謝の初期段階である。この段階において、生体は脂質の疎水性に対処しなければならず、胆汁酸塩による乳化と、胆汁酸塩を含むミセルの形成が必要となる。胆汁の主要成分である胆汁酸は、コアクロック遺伝子REV-erbαの厳密な制御により、肝臓で概日的に産生される。実際、核内受容体REV-ERBαは、周期的に産生されるオキシステロールによる肝臓X受容体(LXR)の刺激を介して、コレステロールを胆汁酸に変換する経路の律速酵素であるコレステロール-7α-ヒドロキシラーゼ(CYP7A1)のリズミカルな発現を駆動する[15,16]。マウスでは、Cyp7a1の発現のピークは活動期に入る前の昼夜交代期に現れ、Rev-erbαを欠損した動物は合成速度が低下するだけでなく、胆汁酸の胆汁中や糞中への排泄も障害される [17]。さらに、コレステロール/コール酸を摂取した時計遺伝子変異マウスの肝臓では、Cyp7a1の発現が低下しているため、コレステロールの蓄積量が多い[18]。さらに、肝核因子4α(HNF4α)やファルネソイドX受容体(FXR)のような、肝臓でリズミカルに発現する他の核内受容体は、胆汁酸の代謝に関与する遺伝子の転写を調整するのに重要である[[19]、[20]、[21]、[22]]。これらの研究を総合すると、胆汁の形成と脂質の乳化の制御における概日時計の役割が示唆される。
乳化された脂質の消化は、十二指腸に分泌される膵リパーゼによって達成される。先駆的な生理学的研究により、膵リパーゼ活性の概日変動が明らかにされた。膵ホモジネートで測定したところ、自由摂取のラットでは午後9時にピークを示し、夜間(夜行性動物にとっては活動期/摂食期)に餌へのアクセスを制限した動物でもピークを示した[23]。マウスでは、膵リパーゼの日内mRNA発現のピークは、ラットで先に述べた酵素活性のピークに先行して昼間に出現し、体内時計変異マウスでは著しく減弱する[24]。マウスの膵外分泌系では自律的な分子時計が同定されているが [25,26]、膵酵素の産生と分泌におけるその制御的役割はまだ確立されていない。
乳化された脂質の吸収は、腸管細胞でリズミカルに行われる。加水分解されたモノアシルグリセロールと遊離脂肪酸は、腸管細胞によって腸管内腔から取り込まれ、トリアシルグリセロール(TAG)のデノボ合成が行われた後、リポタンパク質の輸送複合体であるカイロミクロンにパッケージングされる。腸管細胞は、迷走神経刺激とは無関係に、SCNと食物摂取によって同期する機能的な細胞自律時計を持っている [25] 。腸細胞の細胞時計が自律的であることは、マウスやヒトの腸上皮から採取した培養オルガノイドを用いてin vitroで証明されている [25,28]。Hongらによる最近のエレガントな研究では、マウスとヒトの腸管オルガノイドにおいて、細胞自律時計が機能していることを示す説得力のある証拠が示されている。この時計は、腸細胞のトランスクリプトームの最大10%を制御し、生物特異的で概日リズム位相依存的な壊死細胞死応答を制御している [29]。これらの時計は、ミクロソーム・トリグリセリド転移タンパク質(Mttp)、アポリポタンパク質A IV(ApoA4)、アポリポタンパク質B(ApoA4)などの脂質代謝の主要な制御因子をコードする遺伝子が発現する腸細胞の転写風景を制御している、 アポリポタンパク質B(ApoB)、ジアシルグリセロールO-アシルトランスフェラーゼ2(Dgat2)、脂肪酸合成酵素(Fasn)、ステアロイル-CoAデサチュラーゼ-1(Scd-1)といった脂質代謝の主要な制御因子をコードする遺伝子は、概日リズム発現を示した[[30]、[31]、[32]](Fig. 1). 空腸に直接標識コレステロールを注入できるin situ loop法を用いることで、マウスでは脂質とコレステロールの吸収速度が日内リズムを示し、活動期に最も高い速度が生じることが証明されている [30]。最近の研究では、コアクロック成分であるBmal1を腸上皮のみで欠損させたマウスにおいて、腸内時計が脂肪吸収に必要であり、腸内Bmal1が肥満、高脂血症、肝臓での脂肪酸蓄積の発症を予防することが示唆されている[33]。具体的には、BMAL1はトリアシルグリセロール合成と食餌性脂肪吸収に必須な酵素をコードするDgat2遺伝子のE-box依存的なトランス活性化を誘導した。この所見と一致するように、Bmal1の転写抑制因子であるRev-erbα(図1)の腸内欠損は、食餌性脂肪の吸収を亢進させ、肥満の可能性を増大させる[33]。これらのデータを総合すると、腸管細胞で働く細胞自律時計が、げっ歯類の脂質吸収に重要な役割を果たしていることが明らかになった。
2.2. 脂質輸送と脂質代謝のサーカディアン結合
血漿中の脂質濃度は概日リズムを示し、コレステロールとトリグリセリドはげっ歯類 [31,34]やヒト [20]で夜間にピークを持つ概日振動を示す。さらに、Bmal1 KOマウスやClock変異マウスで分子時計を遺伝的に破壊すると、トリグリセリドの日周振動が消失した[30,34]。血漿サンプルの概日性メタボローム解析を行ったところ、マウス[35,36]やヒト[37,38]では、検出された全循環代謝物の約15~20%、特に脂肪酸が概日リズムを示すことが明らかになった。実際、マウス血漿のMSALLリピドミクスを2日周期で詳細に行ったところ、867種類の脂質が検出されたが、その79%に有意な日内変動が認められた[11]。SCNの両側病変は、ラットの血漿遊離脂肪酸濃度の日内変動を消失させ、このリズム性における中枢時計の役割を示唆している [39]。
水不溶性である脂質が血液中を循環するには、担体が必要である。この目的のために、脂肪酸はアルブミンを利用する。初期の研究では、血清アルブミン濃度の概日リズムが明らかにされており [40,41]、これは肝臓によるアルブミンの概日分泌に由来する [42]。さらに、摂食リズムはこのリズムを維持するのに不可欠であり、不整脈を起こすCry1/Cry2ダブルノックアウトマウスでも十分に維持できる [42]。ヒトでは、一定のルーチン条件、すなわち同調の手がかりを与えない環境(薄暗い中で一定に起床し、1時間ごとに同じ等カロリーの食事を摂る)に置かれた被験者の半数以上の血液サンプルで、アルブミンの有意な日内振動が観察された [20]。
コレステロールとトリグリセリドは、タンパク質と結合し、腸、肝臓、その他の末梢臓器間の脂質輸送に重要な役割を果たすリポタンパク質粒子を形成しながら循環輸送される。この交換は、大きさ、脂質組成、アポリポタンパク含量が異なる5つの主要なクラスのリポタンパク質によって媒介される。これらは密度によって、カイロミクロン、超低比重リポ蛋白(VLDL)、中比重リポ蛋白(IDL)、低比重リポ蛋白(LDL)、高比重リポ蛋白(HDL)と区別される。輸送される脂質の概日振動には、輸送体の共同調節が必要である。実際、ラットの血漿中LDL濃度は24時間にわたって変動し、肝臓のLDLレセプター発現と逆位相で、暗くなり始めたときに最低濃度が観察される [43] 。ヒトでは、LDL-コレステロールとHDL-コレステロールの血中濃度は、一定のルーチン・プロトコルで健康なボランティアの50%以上で概日リズムを示した [20] 。マウスを用いた最近の研究では、肝臓におけるホスファチジルエタノールアミン(PE)のメチル化の結果、22:6および18:6含有ホスファチジルコリン(PC)の産生が概日性であり、それぞれVLDLおよびHDL粒子の産生と連動していることが示された [11]。アポリポ蛋白Bは、カイロミクロン、VLDL、HDL、LDLの主要なコア成分である。アポリポタンパク質Bは肝臓と腸で産生され、MTTPの助けを借りて小胞体と相互作用する。Mttp転写産物の発現は腸細胞でも肝細胞でもリズミカルであり、その概日リズムは血漿トリグリセリドの概日リズムと一致する[31,32](図1)。BMAL1:CLOCK複合体は、肝細胞におけるMttpの抑制を担う小さなヘテロ二量体パートナー(Shp)のリズミカルな発現を直接活性化することが示されている[32]。もう一つのアポリポタンパク質(APOA4)は、リポタンパク質粒子の膨張に関与していると提唱された [44]。最近のメカニズム研究では、BMAL1がサイクリックAMP応答性エレメント結合タンパク質H(Crebh)の発現を、そのプロモーターへの直接結合によって、あるいはRev-erbαの制御を介して間接的に制御していることが示唆されている[45]。その結果、CREBHは、より大きなサイズのVLDLを形成するのに必要なApoA4の概日転写を促進する [45]。全身不整脈マウスで行われたこれらの研究を総合すると、分子時計が始原リポ蛋白の合成と、より大きな粒子へのパッケージングの両方を調節していることが示唆される。注目すべきことに、腸細胞に特異的にBmal1タンパク質を欠損させたマウスでは、Mttpおよびカイロミクロン包装の他の構成要素をコードする遺伝子(Gpat3、Mogat2、Dgat1、Fasn、Cd36、Plin3、PparαおよびApoB)の発現は影響を受けないことから [33]、MTTP依存的な始原リポタンパク質産生の概日制御は組織特異的である可能性が示された。
2.3. 細胞内脂質生合成と異化の概日制御
脂質の生合成と分解が概日制御下にあることを示唆する証拠が蓄積されている。これらの研究を主な脂質クラス別に以下に要約する。
2.3.1. コレステロール
げっ歯類では、肝臓におけるコレステロール生合成の概日制御がかなり前に示唆されており、その値は夜間に最も高く、昼間に最も低くなる[[46]、[47]、[48]]。さらに、体内コレステロール合成の循環マーカーであるラトステロールの24時間評価では、標準的な食事を摂っている8人のヒトボランティアにおいて、血中濃度が深夜にピークに達するという明確な概日プロフィールが示された[49]。げっ歯類を用いた実験的研究から、肝臓における[1-14C]酢酸と3H2Oのコレステロールへの変換は概日リズムを示し、HMG-CoAをメバロン酸に不可逆的に変換するコレステロール生合成の律速酵素であるβ-ヒドロキシβ-メチルグルタリルコエンザイムA還元酵素(HMG-CoA還元酵素)[46,47]の日内活性と相関することが明らかになった(図2)。このリズム性は、mRNAレベルでのHMGCR遺伝子発現の概日制御から生じており [50]、Rev-erbα KOマウスでは消失している [51]。げっ歯類では、コレステロールの異化は胆汁酸の産生と密接に結びついており、上述のCyp7a1の概日発現に依存している。げっ歯類の研究とは異なり、ヒトにおける胆汁酸産生の日内変動は、コレステロール生合成の位相とは無関係であり[49]、コレステロール代謝の時間的制御における種間差の可能性が提起されている。
2.3.2. 脂肪酸
脂肪酸の合成および分解経路もまた、概日制御の対象である。パルミチン酸生合成と脂肪酸鎖伸長の両方の主要基質であるアセチル-CoAの濃度は、マウス胚線維芽細胞の細胞質とマウス肝臓で概日変動を示す[52]。これらの変動は、NAD+依存性のサーチュイン-1(SIRT1)-脱アセチル化酵素によるリズミカルな脱アセチル化を介した、細胞質アセチル-CoA合成酵素(AceCS1)の酵素活性の変化によって駆動される[52](図2)。脂肪酸合成反応を触媒する多酵素複合体をコードする遺伝子である脂肪酸合成酵素(Fasn)の概日制御は、脂肪酸の合成を転写レベルで制御する新たなメカニズムを示している [51]。実際、摂食の合図に加え、Fasnの発現はステロール制御結合タンパク質(SREBP)のリズミカルな結合によって駆動され、このSREBPは摂食レジメンとは無関係に、REV-ERBαの蓄積によって制御される[51]。細胞は、ミトコンドリアで行われるβ酸化経路を通じて、脂肪酸をエネルギー源として利用する。長鎖脂肪酸の酸化における律速段階は、細胞質からミトコンドリアへのさらなる輸送に必要なアシルカルニチンの形成である。アシルカルニチンの形成を触媒する酵素であるカルニチンパルミトイル転移酵素1(CPT1)の濃度は、mRNAとタンパク質の両方のレベルで概日パターンに従うことが示された [19] 。さらに、単離されたミトコンドリアの概日プロテオミクスによって、アシル-CoAデヒドロゲナーゼ(ACAD)ファミリーメンバー(ACAD11とACAD9)およびヒドロキシアシル-CoAデヒドロゲナーゼ三機能酵素サブユニットα(HADHa)を含む、脂肪酸酸化に関与するいくつかの酵素の濃度がリズミカルであることが明らかになった。重要なことは、特に長鎖脂肪酸を基質とする酵素であるACAD11の蓄積の日変化と、パルミトイルカルニチン存在下でのミトコンドリア呼吸によってモニターされる脂肪酸酸化の振動とが相関していることである。このACAD11の蓄積と脂肪酸酸化の生理的リズムは、高脂肪食(HFD)を与えた動物や不整脈を起こしたPer1/Per2欠損マウスでは失われていた[19]。驚くべきことに、Per1/Per2欠損マウスでは、活動期に餌を与えるとリズムが回復した。このことは、分子時計と摂食の合図が、脂肪酸のβ酸化の2つの絡み合った制御機構であることを示唆している。非生理的条件下では、食事誘発性肥満(DIO)は肝臓の概日エンハンサーリモデリングを促進し、脂肪酸生合成とβ酸化の概日振動を相乗的に高める。この2つのプロセスはSREBPを介してリンクしており、SREBPはde novo脂肪生成を直接制御し、脂質異化に必要な転写因子PPARαの活性を促進する[53]。DIOに伴うde novo脂肪生成遺伝子の肝臓転写リプログラミングは、腸内細菌叢におけるPPARγのHFD誘発性リズミカル発現によっても直接媒介される [21,22]。
2.3.3. トリアシルグリセロール
マウス肝臓の時間的リピドミクス解析から、多くのTAG種が概日リズムで蓄積することが明らかになった [11,54]。これと同様に、TAG生合成に関与する複数の酵素の発現レベルは概日周期で振動しており、これには律速酵素であるグリセロール-3-リン酸アシルトランスフェラーゼ(GPAT)、それに続く酵素である1-アシルグリセロール-3-リン酸アシルトランスフェラーゼ(AGPAT)、ジアシルグリセロールアシルトランスフェラーゼ(DGAT)が含まれる [54]。並行して、TAG異化経路は肝臓と白色脂肪組織(WAT)で概日制御の対象となっている。実際、主要な肝リパーゼをコードする2つの遺伝子であるpatatin-like phospholipase domain containing 3 (Pnpla3)とリソソーム酸性リパーゼ(Lipa)の発現レベルは、自由食を与えたマウスにおいて概日振動を示す[54]。WATでは、TAGの概日動員は、時計制御の一対の脂肪分解酵素によって媒介される: TAGリパーゼとホルモン感受性リパーゼである。
2.3.4. リン脂質とスフィンゴ脂質
グリセロリン脂質(GPL)とスフィンゴ脂質(SL)は、細胞膜の2つの主要な構成成分であり、いくつかの種はシグナル伝達のセカンドメッセンジャーとして機能している。マウスの肝臓における大規模な概日性リピドミクス解析により、全GPLの32%とSL種の約2%が概日振動を示すことが明らかになった[11]。次のGPLクラスが概日性の種に最も濃縮されていた:ホスファチジルイノシトール(PI、5.8%)、ホスファチジルコリン(PC、5.5%)、ホスファチジルエタノールアミン(PE、3.9%)[11]。組織抽出物中のリズミカルな脂質種の数は、臓器内、さらには細胞内における空間的な不均一性により、過小評価される可能性がある。実際、肝細胞から単離した核とミトコンドリアに別々にサーカディアンリピドミクス解析を適用したところ、異なる脂質種のリズミカルな蓄積は、これら2つのオルガネラ間で一致しなかった[19]。
ヒトの筋肉生検におけるサーカディアンリピドミクス解析では、ほとんどの振動脂質種がGPLとSLの脂質クラスに属することが明らかになった [9,10]。注目すべきは、in vitroで分化したヒト骨格筋管においても脂質代謝産物のリズム性が持続しており、検出された全脂質種の最大18%に達していたことである [9]。ヒト骨格筋組織とin vitroで分化した初代筋管細胞との間の脂質状況の大きな違いは、ミトコンドリアにのみ存在するGPLの一種であるカルジオリピン(CL)で観察された。CLは筋生検では濃縮されていたが、一次筋管では最も豊富なCL72:8_C18:2は検出されなかった[9]。マウスの肝臓ミトコンドリアでは、CLは概日リズム種の7.5%を占め、野生型(WT)では活動期に制限された摂食時には25%に達するが、不整脈を起こすPer1/Per2欠損マウスではそうではなく、摂食の合図をミトコンドリアが予測する際にコアクロック機構が関与していることが示唆された [19]。試験管内で同調させたヒト膵島における最近の概日リズムリピドミクス研究では、検出された脂質種のうち概日リズムを示すのはわずか5%程度であり、主にPIとSLクラスであることが明らかになった [56]。ヒトにおける異なる報告間で、振動する脂質種の割合に食い違いがあるのは、組織特異的な脂質組成を反映しているか、あるいはドナー間のばらつきが大きいことに起因しているのかもしれない。実際、異なる被験者の血漿中および骨格筋中で検出された脂質種の代謝クラスター化を適用すると、一般集団には異なる概日代謝表現型が存在することが示唆される[9,57]。
いくつかの研究は、リン脂質代謝の制御における機能的な細胞自律時計の役割を示唆した。試験管内で同期させた培養NIH3T3マウス線維芽細胞における放射性標識前駆体の取り込みによって評価したリン脂質の生合成は、Per1振動と逆相性の概日リズムを示した [58,59]。このリズムは、Clockのダウンレギュレーションによって概日時計の機能が低下した細胞では消失したことから、培養細胞におけるリン脂質の概日リズムの生合成は、内因性の分子時計機構に依存していることが示唆された [58]。これと同様に、培養ヒト筋管では、時計が欠失すると振動するGPLとSL種の数が激減し、振動する脂質種のリズムが変化した [9]。さらに、培養線維芽細胞では、GPLの合成は概日リズムを示し、GLP合成酵素ホスファチジン酸ホスホヒドロラーゼ1(PAP-1)とGLPリモデリング酵素リゾリン脂質アシルトランスフェラーゼ(LPLAT)の概日活性と一致していた(図2)。興味深いことに、これら2つの酵素は抗脂肪性プロファイルを示した [59]。すべての真核細胞における基本的なGLPであるPCの生合成も、in vivoとin vitroの両方で概日振動を示した [59,60]。PC生合成の一連のケネディ経路反応の初期酵素であるコリンキナーゼ[60]の概日活性は、Bmal1-Rev-erbα-Chkα軸を介して分子時計によって直接制御されていることが示された[60](図2)。
スフィンガニンとスフィンゴシンの誘導体であるSLは、シグナル伝達と細胞間相互作用において重要な役割を果たしている。このクラスにはセラミドが含まれ、スフィンゴミエリンとスフィンゴ糖脂質の前駆体として機能する。SL種の概日的蓄積と同様に、SLの生合成に関与する酵素をコードする遺伝子の発現は、ヒトの骨格筋と膵島で概日リズムのプロファイルを示し[9,56,61]、スフィンゴ脂質代謝のリズミカルな組織化を示唆している。さらに、CLOCKの枯渇は、CERK、SGPL1 [62]、UGCG [9,56,63]の発現をアップレギュレートすることから、分子時計とセラミド合成の制御との関連が示唆される。実際、マウスを使った研究では、ZT9とZT21における肝臓のセラミド濃度の2つのピーク高振幅振動が明らかになったが、Per1/Per2欠損マウスでは完全に消失していた[64]。さらに、Per1/Per2欠損マウスでは、WTマウスで検出されたセラミド合成酵素をコードするCerS2の二相性発現や、スフィンゴミエリンの加水分解に関与する酵素をコードする中性スフィンゴミエリナーゼと酸性スフィンゴミエリナーゼ(それぞれnSMaseとaSMase)の概日振動が障害された[64]。分子時計とSLの相互作用は双方向的であるようで、ミリオシン処理によるSLレベルの低下は、ヒトの膵島において概日周期の長さの短縮と位相の前進をもたらした [56]。さらに、ミリオシンまたはUGCG阻害剤PDMPによるSL代謝の阻害は、ヒト膵島細胞の膜流動性を低下させ、インスリン分泌を障害した。マトリックス支援レーザー脱離イオン化質量分析イメージング(MALDI-MSI)技術を単一細胞リピドミクス解析に応用した最近の研究から、異なるSL組成がヒト皮膚線維芽細胞の異なる機能状態を制御していることが明らかになり [65]、外因性の合図に対する協調的な応答と細胞間コミュニケーションを可能にしている。実際、トリヘキソシルセラミド合成酵素(GM3S)またはグロボシド合成酵素(Gb4S)のいずれかを過剰発現させると、ヒト皮膚線維芽細胞は、単細胞RNAシークエンシングによって測定されたように、それぞれ乳頭状または網状状態に明確に機能的に分離した。[65]. これらの研究を総合すると、SL代謝はin vivoおよびin vitroで概日時計のような機構によって制御されており、SLが概日リズムを制御している可能性が示唆される。時計機構とSL代謝経路の相互作用の複雑さを解明するには、さらなる研究が必要であろう。
概日性脂質と代謝異常の相互作用
肥満と2型糖尿病(T2D)の罹患率は、現代社会において過去数十年の間に急激に増加している。多くの疫学的研究が、24時間365日体制の現代社会を象徴する概日リズムのズレと呼ばれる、体内の概日リズムと外部からの合図との非同期現象と、代謝異常の増加との関連を報告している(総説は[66]、[67]、[68]、[69]、[70]、[71]にあり、図3に要約されている)。さらに、最近の研究では、肥満やT2Dに伴って、ヒトの様々な組織で時計の機能が破壊されることが示された[72], [73], [74], [75], [76]。その結果、遺伝子マウスによる時計破壊モデルと、新たに開発されたヒト初代培養細胞における時計擾乱の研究アプローチが、細胞内分子時計と代謝性疾患発症のメカニズム的関連性を解明する道を開いた。
図3
ダウンロード 高解像度画像ダウンロード(782KB)
ダウンロード フルサイズ画像のダウンロード
図3. 概日リズムの乱れがヒトの脂質代謝に及ぼす影響。
概日リズムの乱れは、様々な末梢臓器における脂質代謝の変化と関連している。ここでは、in vivoでの概日リズムのずれやin vitroでのCLOCKの減少が脂質代謝-関連経路に及ぼす影響について、ヒトを対象とした研究で得られた主な知見を報告する。報告されたヒトの時間的脂質動態の変化は、肥満、T2D、アテローム性動脈硬化症、脂肪肝炎、その他の心代謝性疾患の発症に関与している可能性がある。
3.1. 時計機能障害の遺伝モデルからの教訓
すでに述べたように、概日時計、特に代謝の活発な組織で作動する概日時計は、脂質の恒常性の時間的調節において極めて重要な役割を果たしている。驚くことではないが、様々な全身時計変異マウスモデルにおいて、概日リズムの破綻は脂質異常症、脂肪肝炎、肥満と関連している [34,77,78]。最近では、時計の乱れと非アルコール性脂肪性肝疾患(NAFLD)の発症との間に、メカニズム的な関連性が確立されている [79]。一方では、クロック変異体(ClkΔ19/Δ19)動物では、低酸素誘導因子1α(HIF1α)タンパク質のレベルの上昇を介して脂肪酸の取り込みが増加する。一方、CLOCK KOマウスは、白色脂肪組織における脂肪形成と増殖マーカーの時間的発現の変化を示す [80]。また、核内受容体REV-ERBαおよびREV-ERBβの機能喪失は、WATの脂肪生成の調節障害、肝臓のTAGの著しい増加、および重度の肝脂肪症を含む脂質代謝の重大な欠陥となる[[81]、[82]、[83]]。さらに、Bmal1を脂肪細胞特異的に欠失させたマウスは、野生型と比較して脂肪組織量が増加し、主に休息期(マウスにとっては昼間)の摂食量が多いために肥満を発症した [84]。マウスの脂肪細胞前駆細胞では、BMAL1はPER3とともに、脂肪形成促進遺伝子Kruppel-Like factor 15(Klf15)の直接制御を介して脂肪形成の重要な制御因子として同定された[24]。対照的に、Bmal1の腸特異的欠失は食餌性脂肪の吸収を制限し、DIOおよび高脂血症の発症からマウスを保護した [33]。同様に、脂肪細胞におけるRev-erbαの特異的な欠失は、脂質合成および貯蔵プログラムの調節障害をもたらさなかった[85]。最後に、時計の中心的な構成要素であるRORαまたはCry1の全身欠失は、DIOから保護された[86,87]。
ショウジョウバエでは、時計遺伝子periodの機能喪失がDAGとアシルカルニチンのレベルに影響を与え、WTのハエではアシルカルニチンが日内振動を示す [88] 。これらの研究を総合すると、機能的な分子概日時計は、異なる生物種間や生物体内の組織間で、適切な脂質代謝機能に必要であることを示している。
3.2. マウス研究における摂食周期の変化と栄養課題
摂食パターンが体内概日時計と同期していない場合、すなわち通常の休息期に食物が消費される場合、概日エネルギー代謝は変化する。実際、活動期に食餌を制限する(マウスでは夜間給餌)ことで、脂肪を多く含む食餌(HFD)を与えた場合でも、自由摂取や昼間に給餌したマウスと比較して、代謝異常の発症から動物を保護することが示されている[[89]、[90]、[91]、[92]、[93]]。J.Bassグループの最近のデータによると、活動期の時間制限給餌によるDIOからの保護は、脂肪細胞の熱産生を促進することによって媒介されることが示された [93]。対照的に、マウスの食餌逆転は、代謝器官における時計遺伝子発現の概日リズムをSCNリズムから切り離し[94,95]、代謝調節に関与する時計制御遺伝子の時間的発現プロファイルの乱れにつながり、これらの動物では休息-活動周期のリズムと不調和である[96], [97], [98], [99], [100]。さらに、最近の研究では、睡眠期(ZT0-ZT12)のみ、結石形成を促進することが知られているリソジェニック食(1.25%のコレステロールと0.5%のコール酸)を与えたマウスは、胆嚢容積の増加、高ビリルビン血症、概日性コレステロール代謝障害を示し、その結果、胆石形成の発生率が増加した [28]。
概日リズムと摂食の関係は相互関係にある。実際、脂肪強化食(HFD)は、それ自体で摂食や運動活動、ホルモン分泌の日内リズムを減衰させ、同時に末梢臓器(肝臓やWATなど)におけるコアクロック遺伝子発現の概日振幅の減少や周期の延長を引き起こす [101,102]。24時間体制で行われたマウス肝臓のトランスクリプトーム解析から、HFDが概日時計遺伝子発現振動に有意な影響を与えることが明らかになった[22]。興味深いことに、マウスWATのmRNAとタンパク質の解析から、HFDを与えたマウスではClock遺伝子の転写リズムが失われ、一方Clockタンパク質レベルは概日リズムを保っていることが同定され [103]、後者の表現型は低脂肪食(LFD)によって逆転した。この系統では、マウスの寿命を延ばすことで知られるカロリー制限(CR)は、加齢に伴う遺伝子発現の概日的振幅の減少を防ぐ[25,26]。しかし、高橋グループは最近、活動期に食物を摂取した場合に寿命延長の程度が最も高くなることを示した[25]。老齢動物では、Apoa4、Hmgcr、Lepr、Lpin1など、脂質代謝に関連するいくつかの主要遺伝子の発現が異常であった[25,27]。興味深いことに、加齢に伴って自由食となったマウスでは発現量が増加した特定の遺伝子の発現量は、CRを行った動物の肝臓では、給餌時間にかかわらず低いままであった [25]。
3.3. 慢性的な概日リズムのずれがヒトの脂質代謝に及ぼす影響
交代勤務や社会的時差ぼけによる概日リズムの乱れは、代謝異常の一因となるが、このような連動による脂質代謝リズムの乱れについては、最近になってようやく取り上げられるようになった(図3)。Patrick Schrauwenらによるヒトを対象とした対照的な実験室研究では、12時間の昼夜交代制勤務を3日間連続で短期間行っただけでも、中核となる分子時計がずれ、骨格筋のインスリン感受性が低下し、脂肪代謝の変化や血漿遊離脂肪酸濃度の上昇を伴うことが報告されている[104]。その後の研究で、著者らは概日リズムのずれが骨格筋リピドームに及ぼす影響を調査し、TAGがずれに伴って変化する最も豊富な脂質種であることを発見した [105]。さらに、筋カルジオリピン(CL)では日中とは無関係に減少が観察されたが、PCでは朝夕のパターンが維持され、アライメントと同程度であった。これらの知見は、模擬交代勤務がヒト骨格筋リピドームの概日構成を脂質クラス特異的に再配列することを浮き彫りにした。このような概日リズムのズレに伴う脂質代謝の時間的編成の乱れは、インスリン抵抗性の発症に関与している可能性がある。
同様の研究デザインを用いた、血漿サンプルのアンターゲット・リピドミクス解析によると、夜勤のシミュレーションを3日間行っただけで、日勤に比べて平均TAG濃度が上昇した [106]。さらに、16:0や14:0のような心血管リスクの上昇と関連する飽和脂肪酸を含むTAGは、日勤条件と比較して夜勤後に概日リズムの減衰を示した[[2]、[3]、[4]、[5]]。対照的に、このプロトコールでは、グリセロリン脂質の平均存在量と位相の進みが減少した [106]。飽和および一価不飽和グリセロリン脂質は心血管死と負の関連があることから[[6]、[7]、[8]]、この研究は、夜勤労働者において疫学的に見出されている、体内概日リズムの乱れと心血管系リスクの上昇との関連を強化するものである[107]。
Kent博士らは、16人の健康なボランティアのコホートにおいて、循環脂質リズムと肝機能の臨床マーカーに対する光と食物の複合刺激の位相リセット効果を調べた [20] 。彼らは、肝臓の脂質とタンパク質のリズムが位相反応曲線に従ってシフトしていることを観察したが、シフトの大きさと方向は、中枢制御のメラトニンリズムとは異なっていた。別の最近の研究では、食事のタイミング(午前と午後)と組成(炭水化物リッチと脂肪リッチ)が血漿脂質代謝物の日内変動に及ぼす重要性を解明しようとした [108]。脂質パターンは、時間帯と食事組成の両方によって複雑に制御されていた。分析された脂質代謝物のうち、3分の1の種が午前と午後で異なる食後反応を示した。これと同様に、先行研究では、夜間の食事は昼間の食事に比べて食後のグルコース、インスリン、TAGレベルが上昇することが提唱されている [109,110]。これに関連して、最近行われた2つのクロスオーバー無作為化試験では、朝食を抜いた場合 [111]、または同等のカロリーを摂取しながら高カロリー摂取を朝から晩にシフトした場合 [112]、被験者の空腹感が増加することが提案された。Vujovićらは、遅い時間の食事摂取がなぜ24時間グレリン:レプチン比を増加させるのかを理解するために、試験参加者のサブセットでWATの遺伝子発現を測定した [111]。彼らは、遅い時間の食事が、脂質の異化を減少させ、脂質の合成を増加させることによって、脂質代謝経路を変化させることを観察した [111]。この関連性を確認するためにはさらなる研究が必要であるが、このような知見は、安静時の概日リズムでの食事が概日時計の調節障害につながるだけでなく、一般的な代謝リズムの乱れ、特に脂質の恒常性の乱れにもつながることを強く示唆している。
このことから、食事パターンを概日睡眠覚醒サイクルと一致させることは、代謝性疾患の発生を克服するための強力な戦略となりうる [91,113,114]。クロスオーバー試験において、過体重/肥満男性の血清および骨格筋の日周期メタボロームが、時間制限食(TRE)介入と延長摂食との反応について調べられた [115] 。著者らは、TREが、筋コアクロック遺伝子発現を変化させることなく、振動する血清および骨格筋代謝物の数を増加させることを観察した。興味深いことに、測定されたリズミカルな血清代謝物の大部分は脂質であり、TREにより脂肪酸代謝物が濃縮された。17のTREランダム化比較試験のメタアナリシスでは、TREは過体重の参加者の脂質スペクトルに有益な効果をもたらし、特にTAG、総コレステロール、LDLのレベルが低下すると結論づけられている [116] 。しかし、採用された間欠的絶食プロトコール、介入期間、患者のベースライン脂質レベル、または間欠的絶食試験を通じて採血された血液サンプルのタイミングにばらつきが大きいためと思われる。
3.4. 代謝性疾患におけるヒト概日性リピドームの変化
代謝性疾患、免疫疾患、心血管系疾患、がんなど、ヒトの様々な病態において、転写産物やタンパク質の概日的構成の変化が報告されている[[117]、[118]、[119]]。しかしながら、代謝性疾患の発症と脂質ホメオスタシスの概日性組織における変化との関連は、ヒトではまだ十分に検討されていない。
T2D患者および非糖尿病対照者において、従来の方法で測定し、24時間にわたる7つの時点で収集した総LDLおよびHDL-コレステロール/TAG血清濃度は、いずれの群においても日中の有意な変動を示さなかった[120]。対照的に、同様のコホート(T2D、過体重/肥満の非糖尿病患者、および除脂肪体重の非糖尿病対照者)において、標的LC-MSメタボロミクスにより血漿中の個々の代謝物の日内変動を評価したところ、すべての研究群において有意な代謝物の時間的変化が観察され [121]、総リポタンパク質およびコレステロール含量ではなく、個々の脂質代謝物を測定することの重要性がさらに強調された [122]。逆に、パルミチン酸で処理したヒト筋管を用いて試験管内で実験的に行った脂質過負荷の影響では、脂質代謝に関与する概日性の遺伝子や経路が再プログラミングされた [123]。興味深いことに、有意な概日リズムを示した代謝物のほとんどは、T2Dの発症や進行に関連する生物学的経路に関与していた。その結果、T2Dに関連した血清脂質の変化には、リゾリン脂質、ジアシルリン脂質、エーテルリン脂質が含まれた [124] 。これらのリズミカルな代謝物のほとんどは、高BMIまたはT2Dによって蓄積ピークが有意に変化することはなかったが、ジアシル-およびリゾ-PCを含む6つの代謝物が、強固な24時間リズムとT2D群と対照群との間の有意な濃度差を有することが同定された [121]。このような時間的な違いは、診断や研究目的において、採血の時間帯をコントロールすることの重要性を浮き彫りにしている。
末梢臓器におけるヒトの概日性リピドームの研究は、反復的な組織サンプリングが必要であるため、非常に困難であり、病的条件下ではさらに複雑になる。しかし、我々は最近、非糖尿病およびT2Dドナー由来のヒト膵島の時間的リピドミクスプロファイリングを初めて報告することができた[56]。この解析により、T2D膵島における細胞膜流動性の低下と関連するリン脂質とスフィンゴ脂質の全体的および時間的変化が明らかになった[56]。重要なことは、siRNAを介した時計摂動を用いて非糖尿病膵島の時計を人工的に破壊したところ、T2D膵島で観察された膜流動性とインスリン分泌の欠損を再現できたことであり、T2Dの病態生理学において、脂質ホメオスタシスの障害に関して膵島の時計が重要な役割を果たしていることが示唆された [56]。興味深いことに、概日時計の障害は、慢性膵炎発症中の膵星状細胞(PSCs)の病理学的変化を特徴づける細胞質脂質喪失と最近関連していた [125]。
結論と展望
複雑な概日時計系で組織化された細胞内振動子は、脂質の恒常性を含む、私たちの身体代謝のほぼすべての側面を制御している。この論文では、脂質の消化、吸収、輸送、生合成、異化、蓄積における概日調節機構の関与を強調した。コレステロール、脂肪酸、トリアシルグリセロール、スフィンゴ糖脂質、スフィンゴミエリンの細胞内代謝調節における細胞自律時計成分の役割についてまとめている。その結果、スフィンゴミエリン [56] などの脂質種が概日時計を調節し、この相互作用を双方向的なものにしている可能性がある。さらに、概日リズムの機能障害は、メタボリックシンドローム、肥満、T2Dなどの代謝異常の発症要因として認識されている。最近、ヒトの膵島 [56,75]、骨格筋 [72,73]、白色脂肪組織 [74]、皮膚線維芽細胞 [76] において、T2Dや肥満に伴う分子時計機能の変化が確認されている。したがって、分子振動子は、適時の運動、光照射、食事のタイミング、あるいは時計モジュレーターによって、このような疾患の予防や治療のための新規治療標的として考えられる。
メタボロミクスとリピドミクスアプローチの技術的進歩により、多くの脂質種の日内振動に関する新たな情報が得られ、マウスやヒトの様々な組織における概日性メタボロームとリピドームのデータベースが構築された。主要な代謝酵素をコードする遺伝子の概日制御だけでなく、脂質代謝の概日制御の重要な側面である機能的酵素複合体の日周活性を明らかにするデータも蓄積されている[1,68](図2)。これらのデータは、様々な代謝異常の新規診断および予後予測用脂質バイオマーカーの開発に関するトランスレーショナルリサーチのために考慮されるべきである。注目すべきは、時間的な脂質組成は、異なる組織間[11]や細胞内コンパートメント[19]だけでなく、個人間でも変化する可能性があることで、一般集団における異なる概日代謝表現型の概念が台頭している[9,57]。大規模な概日プロテオミクスやトランスクリプトミクス解析とともに、日周メタボロミクスやリピドミクスは個別化医療への道を開くものである。さらに、サーカディアン生物学は、薬物効率を向上させ、薬物毒性を減少させるための重要なパラメータになりつつある [126]。重要なことは、異なるシグナルに対する時計の臓器特異的、さらには細胞特異的な反応 [127,128]、そしておそらくは薬剤に対する反応によって、臓器間の概日時計のずれが生じ、脂質の代謝を含む全身の代謝に変化をもたらす可能性があるということである。
謝辞
資金提供 本研究は、スイス国立科学財団の助成金310030_184708/1(CD)/310030_184949、NCCR Chemical Biology、Leducq Foundation(HR)、Vontobel Foundation、Novartis Consumer Health Foundation、EFSD/Novo Nordisk Programme for Diabetes Research in Europe、Swiss Life Foundation、Olga Mayenfisch Foundation; The Fondation pour l'innovation sur le cancer et la biologie; Ligue Pulmonaire Genevoise; Swiss Cancer League; Velux Foundation; Leenaards Foundation (CD); the Bo and Kerstin Hjelt Foundation for diabetes type 2 (VP); the Gertrude von Meissner (VP, CD); and Young Independent Investigator Grant SGED/SSED (VP, FS). 図はBioRender.comで作成した。
参考文献
[1]
K. Thurley, et al.
代謝経路の概日オーケストレーションの原理
Proc Natl Acad Sci U S A, 114 (7) (2017), pp.
CrossRefView in ScopusGoogle Scholar
[2]
M. ペルナ、S.ヒューリングス
飽和脂肪酸鎖長と心血管疾患リスク:システマティックレビュー
栄養素, 15 (1) (2022)
Google Scholar
[3]
Z. Li, et al.
飽和脂肪酸バイオマーカーと心代謝性疾患のリスク:前向き研究のメタアナリシス
Front Nutr, 9 (2022), p. 963471
スコープで見るGoogle Scholar
[4]
G. Zong, et al.
米国人男女における個々の飽和脂肪酸の摂取と冠動脈性心疾患リスク:2つの前向き縦断コホート研究
Bmj, 355 (2016), p. i5796
CrossRefGoogle Scholar
[5]
Y. Wang, et al.
飽和パルミチン酸はTLR4アクセサリータンパク質MD2への直接結合を介して心筋炎症傷害を誘導する
Nat Commun, 8 (2017), p. 13997
スコープで見るGoogle Scholar
[6]
A. Sigruener, et al.
グリセロリン脂質およびスフィンゴ脂質種と死亡率:ルートヴィヒスハーフェンリスクと心血管健康(LURIC)研究
PloS One, 9 (1) (2014), p. e85724
CrossRefスコープで見るGoogle Scholar
[7]
N. Timmerman, et al.
血漿細胞外小胞のセラミドおよびリン脂質は、頸動脈内膜剥離術後の主要な心血管イベントの高リスクと関連する。
Sci Rep, 12 (1) (2022), p. 5521
スコープで見るGoogle Scholar
[8]
I.M. Rivas Serna, et al.
リピドミクスのプロファイリングから心血管系の健康状態の悪さを示すシグニチャーが同定された。
Metabolites, 11 (11) (2021)
Google Scholar
[9]
U. Loizides-Mangold, et al.
Lipidomics reveals diurnal lipid oscillations in human skeletal muscle persisting in cellular myotubes 培養in vitro
Proc Natl Acad Sci U S A, 114 (41) (2017), pp.E8565-E8574
スコープで見るGoogle Scholar
[10]
N.M. Held, et al.
健常人の骨格筋は脂質代謝において昼夜のリズムを示す
Mol Metab, 37 (2020), p. 100989
PDFを見る記事を見るScopusGoogle Scholarで見る
[11]
R.R. Sprenger, et al.
脂質分子タイムラインプロファイリングから明らかになった肝臓と循環の日周クロストーク
Cell Rep, 34 (5) (2021), p. 108710
PDFを見る記事を見るScopusで見るGoogle Scholar
[12]
K.A. Dyar, et al.
概日代謝のアトラスから、時計間のシステム全体の連携とコミュニケーションが明らかになった
Cell, 174 (6) (2018), pp.
e11
ScopusGoogle Scholarで見る
[13]
M. Lange, et al.
AdipoAtlas:ヒト白色脂肪組織の参照リピドーム
Cell Rep Med, 2 (10) (2021), p. 100407
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
[14]
N.M. Kettner, et al.
肝代謝の概日ホメオスタシスは肝発癌を抑制する
がん細胞, 30 (6) (2016), 909-924頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[15]
S.S. Geiger, et al.
急性致死性敗血症に対する摂食誘導抵抗性は肝BMAL1とFXRシグナルに依存する
Nat Commun, 12 (1) (2021), p. 2745
スコープで見るGoogle Scholar
[16]
M. Qu, et al.
HNF4Aは、BMAL1::CLOCKのクロマチン結合をビーコン化し、リズムクロマチンランドスケープを形成することで、組織特異的な概日リズムを定義する
Nat Commun, 12 (1) (2021), p. 6350
スコープで見るGoogle Scholar
[17]
H.M. Hassan, et al.
ファルネソイドX受容体によるクロマチンアクセシビリティの制御は、生体内での概日性と胆汁酸の恒常性に必須である
がん(バーゼル), 14 (24) (2022)
Google Scholar
[18]
D.E.ジョージ、E.リーベンタール、M.ランディス
ラットにおける膵酵素の概日リズム:小腸二糖分解酵素との関係
Nutr Res, 5 (6) (1985), 651-662頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[19]
A. Neufeld-Cohen, et al.
PERIODタンパク質によるミトコンドリア律速酵素の振動と栄養利用の概日制御
Proc Natl Acad Sci U S A, 113 (12) (2016), pp.E1673-E1682
ScopusGoogle Scholarで見る
[20]
B.A. Kent, et al.
サーカディアン脂質および肝タンパク質のリズムは、メラトニンとは異なる位相反応曲線でシフトする
Nat Commun, 13 (1) (2022), p. 681
スコープで見るGoogle Scholar
[21]
M. 村上、他。
腸内細菌叢は、栄養チャレンジによる肝臓概日時計のPPARγ駆動リプログラミングを指示する
EMBO Rep, 17 (9) (2016), pp.
CrossRefView in ScopusGoogle Scholar
[22]
K.L. Eckel-Mahan, et al.
栄養チャレンジによる概日時計のリプログラミング
Cell, 155 (7) (2013), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[23]
A. Ribas-Latre, et al.
出版社訂正:細胞および生理学的概日メカニズムが白色脂肪組織の日周性の細胞増殖と拡大を駆動する
Nat Commun, 12 (1) (2021), p. 4528
スコープで見るGoogle Scholar
[24]
A. Aggarwal, et al.
概日時計はKlf15に対するPer3クロストーク経路によって脂肪形成を制御する
Cell Rep, 21 (9) (2017), pp.2367-2375
PDFで記事を見るScopusで記事を見るGoogle Scholar
[25]
V. Acosta-Rodríguez, et al.
早発カロリー制限のサーカディアンアラインメントは雄C57BL/6Jマウスの長寿を促進する
Science, 376 (6598) (2022), pp.
CrossRefView in ScopusGoogle Scholar
[26]
H.H. Pak, et al.
断食はマウスのカロリー制限食の代謝、分子、生殖保護効果を促進する
Nat Metab, 3 (10) (2021), pp.1327-1341
CrossRefView in ScopusGoogle Scholar
[27]
M.A. Aon, et al.
マウスを用いたマルチオミクスアプローチによる健康増進と寿命延長の決定因子の解明
Cell Metab, 32 (1) (2020), pp.
e4
ScopusGoogle Scholarで見る
[28]
C. He, et al.
概日リズムの乱れはマウスの肝脂質代謝、腸内細菌叢に影響を与え、コレステロール胆石形成を促進した
Front Endocrinol (Lausanne), 12 (2021), p. 723918
スコープで見るGoogle Scholar
[29]
A.E. Rosselot, et al.
腸オルガノイドにおける概日時計の発生と機能
EMBO J, 41 (2) (2022), p. e106973
スコープで見るGoogle Scholar
[30]
X. パン、M.M.フサイン
マウスにおける多量栄養素吸収の食餌および概日制御には時計が重要である
J Lipid Res, 50 (9) (2009), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[31]
X. パン、M.M.フサイン
マイクロソーム・トリグリセリド・トランスファー・タンパク質と血漿脂質濃度の日内調節機構
J Biol Chem, 282 (34) (2007), pp.24707-24719
PDFを見る記事を見るGoogle Scholar
[32]
X. Pan, et al.
CLOCKによるMTPと血漿トリグリセリドの日内調節はSHPによって媒介される
Cell Metab, 12 (2) (2010), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[33]
F. Yu, et al.
腸管Bmal1の欠損は高脂肪食による肥満を防ぐ
Nat Commun, 12 (1) (2021), p. 5323
スコープで見るGoogle Scholar
[34]
R.D. Rudic, et al.
BMAL1とCLOCKは、概日時計の2つの重要な構成要素であり、グルコースのホメオスタシスに関与する
PLoS Biol, 2 (11) (2004), p. e377
Google Scholar
[35]
S. Abbondante, et al.
比較概日メタボロミクスにより、血清と肝臓における栄養チャレンジの影響の違いが明らかになった
J Biol Chem, 291 (6) (2016), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[36]
Y. 南 祐子、他。
血液メタボロミクスによる体内時間の計測
Proc Natl Acad Sci U S A, 106 (24) (2009), pp.
CrossRefView in ScopusGoogle Scholar
[37]
R. Dallmann, et al.
ヒト概日メタボローム
Proc Natl Acad Sci U S A, 109 (7) (2012), pp.
CrossRefView in ScopusGoogle Scholar
[38]
L. Kervezee、N. Cermakian、D.B. Boivin
ヒトにおける模擬夜勤中の概日リズムのズレを示すメタボロームシグネチャー
PLoS Biol, 17 (6) (2019), p. e3000303
CrossRefView in ScopusGoogle Scholar
[39]
H. 山本浩二、永井健一郎、中川博之
血漿グルコース、FFA、インスリンおよびグルカゴンの日内リズムにおけるSCNの役割
Chronobiol Int, 4 (4) (1987), pp.
CrossRefView in ScopusGoogle Scholar
[40]
L.E.シェービング、J.E.ポーリー、T.H.ツァイ
ラットの血漿タンパク質の概日変動
Am J Physiol, 215 (5) (1968), pp.
CrossRefView in ScopusGoogle Scholar
[41]
W. Jubiz, et al.
ヒトにおける血清副甲状腺ホルモン濃度の概日リズム:血清カルシウム、リン酸、アルブミンおよび成長ホルモン濃度との相関性
J Clin Invest, 51 (8) (1972), pp.
スコープで見るGoogle Scholar
[42]
D. Mauvoisin, et al.
マウス肝臓における概日時計依存性および非依存性リズムプロテオームは、それぞれ異なる日内機能を実装する
Proc Natl Acad Sci U S A, 111 (1) (2014), pp.
CrossRefView in ScopusGoogle Scholar
[43]
S. バラスブラマニアム、A.サント、P.D.ローチ
肝低比重リポ蛋白(LDL)受容体発現と血漿中LDL濃度における概日リズム
生化学雑誌, 298 (Pt 1) (1994), pp.39-43
CrossRefScopusで見るGoogle Scholarで見る
[44]
R.B. Weinberg, et al.
ApoA-IVはアポBの分泌輸送とトリグリセリドリッチリポ蛋白のサイズを調節する
J Lipid Res, 53 (4) (2012), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[45]
X. パン、M.M.フサイン
Bmal1はcAMP応答性エレメント結合タンパク質Hとアポリポタンパク質AIVを調節することにより、より大きなリポタンパク質の産生を制御する
肝臓学, 76 (1) (2022), 78-93頁
CrossRefView in ScopusGoogle Scholar
[46]
P.A.エドワーズ、室谷博之、R.G.グールド
ラットの肝臓と腸におけるコレステロール生合成の概日リズムのin vivo実証
脂質研究, 13 (3) (1972), 396-401頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[47]
D.J.シャピロ、V.W.ロドウェル
肝HMG-CoA還元酵素活性の日内変動とコレステロール調節機構
生化学生物物理学雑誌, 37 (5) (1969), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
[48]
P. バック、B.ハンプレヒト、F.ライネン
ラット肝臓におけるコレステロール生合成の制御:活性の日内変化と胆汁酸の影響
Arch Biochem Biophys, 133 (1) (1969), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[49]
C. ガルマン、B.アンジェリン、M.ルドリング
ヒトにおける胆汁酸合成はコレステロール合成と非同期の急速な日内変動がある。
Gastroenterology, 129 (5) (2005), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[50]
H. Jurevics, et al.
コレステロール合成の日内および食事誘発性の変化は、HMG-CoA還元酵素のmRNAレベルと相関する。
J Lipid Res, 41 (7) (2000), pp.
スコープで見るGoogle Scholar
[51]
G. Le Martelot, et al.
REV-ERBαは概日SREBPシグナルと胆汁酸ホメオスタシスに関与する
PLoS Biol, 7 (9) (2009), p. e1000181
CrossRefScopusで見るGoogle Scholar
[52]
S. Sahar, et al.
SIRT1タンパク質を介したアセチル・コエンザイムA合成酵素1の脱アセチル化による脂肪酸伸長の概日制御
J Biol Chem, 289 (9) (2014), pp.6091-6097
PDFを見る記事を見るCrossRef Scopusで見るGoogle Scholar
[53]
D. Guan, et al.
食事誘発性概日エンハンサーリモデリングは、相反する肝脂質代謝プロセスを同期させる
Cell, 174 (4) (2018), pp.831-842 e12
PDFで記事を見るScopusで記事を見るGoogle Scholar
[54]
Y. Adamovich, et al.
概日時計と摂食時間は肝トリグリセリドの振動とレベルを制御する
Cell Metab, 19 (2) (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[55]
A. ショスタック、J.マイヤー-コバチ、H.オスター
白色脂肪組織における脂質動員の概日制御
糖尿病, 62 (7) (2013), 2195-2203頁
CrossRefScopusで見るGoogle Scholarで見る
[56]
V. Petrenko, et al.
2型糖尿病は、ヒト膵島における脂質代謝と膜流動性の概日制御を破綻させる
PLoS Biol, 20 (8) (2022), p. e3001725
CrossRefView in ScopusGoogle Scholar
[57]
E.C. Chua, et al.
血漿脂質の概日制御における広範な多様性とヒトにおける異なる概日代謝表現型の証拠
Proc Natl Acad Sci U S A, 110 (35) (2013), pp.
CrossRefスコープで見るGoogle Scholar
[58]
S. Marquez, et al.
線維芽細胞の培養においてリン脂質の代謝はリズミカルに振動し、時計タンパク質PERIOD 1によって制御されている。
FASEB J, 18 (3) (2004), pp.
スコープで見るGoogle Scholar
[59]
V.A. Acosta-Rodriguez, et al.
線維芽細胞培養におけるグリセロリン脂質合成の日内リズムには、酵素の寄与の差が関与している。
J Lipid Res, 54 (7) (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[60]
A. Grechez-Cassiau, et al.
肝の概日時計はBMAL1-REV-ERBα軸を介してコリンキナーゼα遺伝子を制御する
Chronobiol Int, 32 (6) (2015), pp.
CrossRefView in ScopusGoogle Scholar
[61]
M. Perelis, et al.
膵β細胞エンハンサーはインスリン分泌制御遺伝子のリズム転写を制御する
Science, 350 (6261) (2015), p. aac4250
Google Scholar
[62]
C. Saini, et al.
ヒト膵島細胞による適切なインスリン分泌には機能的な概日時計が必要である
Diabetes Obes Metab, 18 (4) (2016), 355-365ページ
CrossRefView in ScopusGoogle Scholar
[63]
L. Perrin, et al.
トランスクリプトーム解析により、ヒト骨格筋におけるリズムおよびCLOCK駆動経路が明らかになった
Elife (2018), p. 7
CrossRefGoogle Scholar
[64]
Y.S. Jang, et al.
野生型およびmPer1/mPer2ダブルノックアウトマウスにおけるセラミドおよびセラミド関連遺伝子の時間的発現プロファイル
Mol Biol Rep, 39 (4) (2012), pp.
CrossRefView in ScopusGoogle Scholar
[65]
L. Capolupo, et al.
スフィンゴ脂質は真皮線維芽細胞の不均一性を制御する
Science, 376 (6590) (2022), p. eabh1623
ScopusGoogle Scholarで見る
[66]
E. モーリー、H.K.ホン、J.バス
メタボリックシンドロームの発症における概日リズムの乱れ
Diabetes Metab, 40 (5) (2014), 338-346ページ
PDFを見る記事を見るScopusで見るGoogle Scholar
[67]
C. ディブナー、U.シブラー
動物モデルとヒトにおける代謝の概日リズム
J Intern Med, 277 (5) (2015), pp.
CrossRefView in ScopusGoogle Scholar
[68]
F. Gachon, et al.
グルコースホメオスタシス:げっ歯類とヒトにおける末梢概日時計による制御
Endocrinology, 158 (5) (2017), pp.
CrossRefView in ScopusGoogle Scholar
[69]
F. シンチュレル、W.スパレニアク、C.ディブナー
脂質代謝の概日リズム
生化学会誌, 50 (3) (2022), 1191-1204頁
CrossRefView in ScopusGoogle Scholar
[70]
C. ディブナー
リズミカルであることの重要性:体内時計と調和した生活
Acta Physiol (Oxf), 228 (1) (2020), p. e13281
ScopusGoogle Scholarで見る
[71]
B. レマー、H.オスター
糖尿病およびメタボリックシンドロームの高血圧における概日リズムの役割
Curr Hypertens Rep, 20 (5) (2018), p. 43
ScopusGoogle Scholarで見る
[72]
B.M. Gabriel, et al.
2型糖尿病における概日振動の乱れは、骨格筋におけるミトコンドリア代謝のリズムの変化に関連している
Sci Adv, 7 (43) (2021), p. eabi9654
スコープで見るGoogle Scholar
[73]
J. Wefers, et al.
骨格筋代謝の昼夜リズムは、高齢で代謝が低下した人では乱れている
Mol Metab, 41 (2020), p. 101050
PDFを見る記事を見るScopusで見るGoogle Scholar
[74]
E. モーリー、B.ナベス、S.M.ブリシャール
ヒトの卵巣脂肪における概日時計の機能障害は、肥満と代謝性炎症に関連する
Nat Commun, 12 (1) (2021), p. 2388
スコープで見るGoogle Scholar
[75]
V. Petrenko, et al.
2型糖尿病患者の膵島では、概日振動子の減衰によりインスリンとグルカゴンのエキソサイトーシスが減少している。
Proc Natl Acad Sci U S A, 117 (5) (2020), pp.
CrossRefView in ScopusGoogle Scholar
[76]
F. Sinturel, et al.
細胞概日周期の長さは2型糖尿病患者のHbA1c値と逆相関する
Diabetologia, 62 (8) (2019), pp.1453-1462
CrossRefView in ScopusGoogle Scholar
[77]
F.W. Turek, et al.
概日時計変異マウスにおける肥満とメタボリックシンドローム
サイエンス, 308 (5724) (2005), pp.
CrossRefView in ScopusGoogle Scholar
[78]
S. Shimba, et al.
時計遺伝子Brain and muscle Arnt-like protein-1(BMAL1)の欠損は脂質異常症と異所性脂肪形成を引き起こす
PloS One, 6 (9) (2011), p. e25231
CrossRefScopusで見るGoogle Scholarで見る
[79]
X. パン、J.ケイロス、M.M.フサイン
CLOCK変異マウスにおける非アルコール性脂肪性肝疾患
J Clin Invest, 130 (8) (2020), pp.
スコープで見るGoogle Scholar
[80]
A. Ribas-Latre, et al.
細胞および生理的概日メカニズムが白色脂肪組織の日周性細胞増殖および拡大を駆動する
Nat Commun, 12 (1) (2021), p. 3482
スコープで見るGoogle Scholar
[81]
H. Cho, et al.
REV-ERBαおよびREV-ERB-βによる概日行動と代謝の制御
Nature, 485 (7396) (2012), pp.
CrossRefScopusで見るGoogle Scholarで見る
[82]
A. Bugge, et al.
Rev-erbalphaとRev-erbbetaは概日時計と正常な代謝機能を協調的に保護する
Genes Dev, 26 (7) (2012), 657-667ページ
CrossRefスコープで見るGoogle Scholar
[83]
Y. Zhang, et al.
遺伝子制御。核内受容体Rev-erbalphaの個別の機能が代謝と時計を結びつける
Science, 348 (6242) (2015), pp.
CrossRefView in ScopusGoogle Scholar
[84]
G.K. Paschos, et al.
時計成分Arntlの脂肪細胞特異的欠失マウスにおける肥満
Nat Med, 18 (12) (2012), pp.
CrossRefスコープで見るGoogle Scholar
[85]
A.L. Hunter, et al.
脂肪細胞NR1D1が肥満時の脂肪組織拡大を規定する
エライフ (2021), p. 10
Google Scholar
[86]
P. Lau, et al.
オーファン核内受容体RORαは脂質代謝を制御する遺伝子発現を制御する:スタッガー(SG/SG)マウスは食事誘発肥満に抵抗性である
J Biol Chem, 283 (26) (2008), pp.
PDFを見るCrossRefを見るGoogle Scholarを見る
[87]
G. Griebel, et al.
クリプトクロム1欠損マウス(cry1(-/-))は、高脂肪食によって誘導される肥満に抵抗性を示す
Front Endocrinol (Lausanne), 5 (2014), p. 49
グーグル・スカラー
[88]
S. Schabler, et al.
ショウジョウバエ時計遺伝子periodの機能喪失は、中間脂質代謝の変化と飢餓感受性の上昇をもたらす
Cell Mol Life Sci, 77 (23) (2020), 4939-4956頁
CrossRefView in ScopusGoogle Scholar
[89]
D.M. Arble, et al.
食事摂取の概日リズムは体重増加に寄与する
肥満(シルバースプリング), 17 (11) (2009), pp.
CrossRefScopus で表示Google Scholar
[90]
M. Hatori, et al.
高脂肪食を与えたマウスにおいて、カロリー摂取量を減らさずに時間制限食を与えると代謝性疾患が予防される
Cell Metab, 15 (6) (2012), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[91]
A. Chaix, et al.
時間制限摂食は概日時計欠損マウスの肥満とメタボリックシンドロームを予防する
Cell Metab, 29 (2) (2019), pp.303-319 e4
PDFで記事を見るScopusで記事を見るGoogle Scholar
[92]
A. Chaix, et al.
時間制限摂食は多様な栄養課題に対する予防的・治療的介入である
Cell Metab, 20 (6) (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[93]
C. Hepler, et al.
時間制限摂食は脂肪細胞熱産生を介して肥満を緩和する
サイエンス, 378 (6617) (2022), 276-284頁
CrossRefView in ScopusGoogle Scholar
[94]
F. Damiola, et al.
摂食制限により末梢組織の概日振動子が視交叉上核の中心ペースメーカーから切り離される
Genes Dev, 14 (23) (2000), pp.
CrossRefView in ScopusGoogle Scholar
[95]
K.A. Stokkan, et al.
摂食による肝臓の概日時計の同調
Science, 291 (5503) (2001), pp.
ScopusGoogle Scholarで見る
[96]
A. Mukherji, et al.
摂食を概日休息期にシフトさせると、末梢の時計とSCNのマスター時計がずれてしまい、メタボリックシンドロームを引き起こす。
Proc Natl Acad Sci U S A, 112 (48) (2015), pp.E6691-E6698
スコープで見るGoogle Scholar
[97]
J. Reznick, et al.
ラットの肝臓と筋肉における摂食の変化による概日リズムとエネルギー代謝の制御の違い
Biochim Biophys Acta, 1832 (1) (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[98]
Y. 鶴留洋一、他
マウスの長期休息期制限摂食における肝脂質蓄積の潜在的メカニズム
Chronobiol Int, 39 (8) (2022), pp.
CrossRefView in ScopusGoogle Scholar
[99]
P. Honzlova, et al.
誤った摂食スケジュールは、内分泌膵臓時計と外分泌膵臓時計で異なる概日リズムの再編成を引き起こす
Cell Mol Life Sci, 79 (6) (2022), p. 318
スコープで見るGoogle Scholar
[100]
F. Sinturel, et al.
肝臓の質量と細胞サイズの日内振動はリボソームの組み立てサイクルに伴う
Cell, 169 (4) (2017), pp.651-663.e14
PDFで記事を見るScopusで記事を見るGoogle Scholar
[101]
A. Kohsaka, et al.
高脂肪食はマウスの行動および分子概日リズムを破壊する
Cell Metab, 6 (5) (2007), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[102]
A. Martchenko, et al.
ノビレチンは高脂肪誘発性のグルカゴン様ペプチド-1分泌リズムの乱れを改善する
Sci Rep, 12 (1) (2022), p. 7271
スコープで見るGoogle Scholar
[103]
H. Xin, et al.
食事誘発性肥満における脂肪組織の概日シグネチャー
Front Physiol, 13 (2022), p. 953237
スコープで見るGoogle Scholar
[104]
J. Wefers, et al.
サーカディアンのズレは脂肪酸代謝遺伝子プロファイルを誘導し、ヒト骨格筋におけるインスリン感受性を損なう
Proc Natl Acad Sci U S A, 115 (30) (2018), pp.7789-7794
CrossRefView in ScopusGoogle Scholar
[105]
J.F. Harmsen, et al.
サーカディアンのズレは健康な若い男性の骨格筋リピドームを乱す
FASEB J, 35 (6) (2021), p. e21611
スコープで見るGoogle Scholar
[106]
J.E. Kyle, et al.
模擬夜勤スケジュールが血漿リピドームを破壊し、心血管疾患リスクの初期マーカーを明らかにする
Nat Sci Sleep, 14 (2022), pp.
CrossRefScopusで見るGoogle Scholar
[107]
S. Crnko, et al.
心血管生物学と疾患における概日リズムと分子時計
Nat Rev Cardiol, 16 (7) (2019), 437-447頁
CrossRefView in ScopusGoogle Scholar
[108]
K. Kessler, et al.
ショットガン・リピドミクスにより、非糖尿病男性におけるインスリン感受性に関連する脂質代謝の日内変動が発見された。
J Clin Endocrinol Metab, 105 (5) (2020)
Google Scholar
[109]
S.M. Hampton, et al.
模擬交代勤務における食後ホルモンおよび代謝反応
J Endocrinol, 151 (2) (1996), pp.259-267
CrossRefView in ScopusGoogle Scholar
[110]
Y. Esquirol, et al.
シフト勤務とメタボリックシンドローム:業務負担、身体活動、食事リズムのそれぞれの影響
Chronobiol Int, 26 (3) (2009), pp.
CrossRefScopusで見るGoogle Scholarで見る
[111]
N. Vujovic, et al.
過体重および肥満の成人において、遅めの等カロリー食は空腹感を増加させ、エネルギー消費量を減少させ、代謝経路を変化させる。
Cell Metab, 34 (10) (2022), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[112]
L.C. Ruddick-Collins、他。
1日のカロリー負荷のタイミングは、健康な肥満被験者のエネルギー代謝に変化を与えることなく、食欲と空腹感に影響を与える
Cell Metab, 34 (10) (2022), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[113]
S. Cienfuegos, et al.
2型糖尿病予防のための時間制限食
J Physiol, 600 (5) (2022), pp.
CrossRefView in ScopusGoogle Scholar
[114]
K.A. Varady, et al.
減量のための間欠的絶食の臨床応用:進歩と今後の方向性
Nat Rev Endocrinol, 18 (5) (2022), 309-321頁
CrossRefScopusで表示Google Scholar
[115]
L.S. Lundell, et al.
時間制限摂食は時計遺伝子の発現を乱すことなく脂質とアミノ酸代謝物のリズムを変化させる
Nat Commun, 11 (1) (2020), p. 4643
スコープで見るGoogle Scholar
[116]
L. Liu, et al.
成人における時間制限食の代謝効果:ランダム化比較試験のシステマティックレビューとメタアナリシス
J Clin Endocrinol Metab, 107 (12) (2022), pp.3428-3441
CrossRefScopusで表示Google Scholar
[117]
F. シンチュレル、V.ペトレンコ、C.ディブナー
概日時計が代謝を動かす
J Mol Biol, 432 (12) (2020), 3680-3699頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[118]
S. ヘルゲンハン、S.ホルトカンプ、C.シャイアーマン
概日時計と免疫系の分子間相互作用
J Mol Biol, 432 (12) (2020), 3700-3713頁
PDFを見る記事を見るScopusで見るGoogle Scholar
[119]
Z. Zhang, et al.
概日時計:がんにおける免疫の制御因子
Cell Commun Signal, 19 (1) (2021), p. 37
PDFを見る記事を見るGoogle Scholar
[120]
T. 林、他。
健常人および2型糖尿病患者における低比重リポ蛋白質コレステロールおよび高比重リポ蛋白質コレステロールの亜種の概日リズム
J Atheroscler Thromb, 30 (1) (2023), pp.
CrossRefScopusで表示Google Scholar
[121]
C.M. Isherwood, et al.
循環代謝産物の24時間リズム性:体格と2型糖尿病の影響
FASEB J, 31 (12) (2017), pp.5557-5567
スコープで見るGoogle Scholar
[122]
U. ロイジデス=マンゴールド、V.ペトレンコ、C.ディブナー
サーカディアンリピドミクス:24時間周期の脂質代謝物の解析
Methods Mol Biol, 2130 (2021), pp.169-183
CrossRefScopusで表示Google Scholarで表示
[123]
N.J. Pillon, et al.
パルミチン酸はエンハンサーのヒストン修飾を通じて筋肉細胞の概日トランスクリプトミクスを損なう
ライフサイ・アライアンス, 6 (1) (2023)
Google Scholar
[124]
J.T. Hannich, et al.
エーテル脂質、スフィンゴ脂質および毒性1-デオキシセラミドによる痩せ型および肥満型2型糖尿病患者の特徴
Acta Physiol (Oxf), 232 (1) (2021), p. e13610
スコープで見るGoogle Scholar
[125]
W. Jiang, et al.
膵時計は膵線維症の進行と膵外分泌機能不全の重要な決定因子である。
Sci Transl Med, 14 (664) (2022), p. eabn3586
Google Scholar
[126]
C.R. Cederroth, et al.
四次元の医学
Cell Metab, 30 (2) (2019), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[127]
V. ペトレンコ、C.ディブナー
グルカゴン、グルカゴン様ペプチド1およびソマトスタチンによるマウス膵島細胞時計の細胞特異的リセット
Acta Physiol (Oxf), 222 (4) (2018), p. e13021
CrossRefView in ScopusGoogle Scholar
[128]
G. Manella, et al.
低酸素は、組織間の概日時計のずれを誘発する時間および組織特異的応答を誘導する
Proc Natl Acad Sci U S A, 117 (1) (2020), pp.
CrossRefScopusで見るGoogle Scholarで見る
引用元: (1)
脂質代謝の新たなマネージャーとしてのセラストロール機能: そのメカニズムと治療の可能性
2023, 生物医学と薬物療法
抄録を表示
1
これらの著者は本研究に等しく貢献した
© 2023 The Authors. エルゼビア社発行。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
Copyright © 2023 Elsevier B.V. or its licensors or contributors. ScienceDirect®はElsevier B.V.の登録商標です。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
