プラスミドにコードされた毒素防御が、微生物の相互作用を媒介する
本文へスキップ
ネイチャー微生物学
検索
ログイン
コンテンツ
Natureについて
掲載
記事
PDFダウンロード
記事
オープンアクセス
出版:2023年12月27日
プラスミドにコードされた毒素防御が、微生物の相互作用を媒介する
https://www.nature.com/articles/s41564-023-01521-9

サラ・モライス、マイケル・マゾー、...イツァーク・ミズラヒ 著者一覧を見る
Nature Microbiology (2023)この記事を引用する
4671 アクセス
92 Altmetric
指標詳細
概要
腸内環境には、プラスミドが広く分布する高密度の微生物生態系が存在する。プラスミドは微生物間の遺伝物質の交換を促進すると同時に、多様な付属機能の移転を可能にする。しかし、プラスミドが微生物群集の構成や機能に及ぼす正確な影響については、まだほとんど解明されていない。我々は、乳酸菌と腸球菌の相互作用を媒介する、一般的な細菌毒素とプラスミドにコードされた耐性機構を同定した。このプラスミドは、ルーメンやヒトの腸内細菌叢を含む生態系全体に広く存在している。このプラスミドの生化学的特性解析から、リモシラクトバチルス・ロイテリ(Limosilactobacillus reuteri)などの様々な腸内微生物が産生する毒素であるロイテリンに対する防御機構が明らかになった。標的メタボローム解析アプローチを用いて、ロイテリンはルーメン生態系全体に広く存在し、微生物群集構造に影響を与えていることがわかった。保護プラスミドを持つ腸球菌株を分離し、毒素産生菌であるL. reuteriとの相互作用をin vitroで調べた。興味深いことに、ロイテリンに対する耐性を付与することで、プラスミドが防御微生物種と攻撃微生物種の代謝交換を仲介し、有益な関係あるいは相互作用をもたらすことがわかった。したがって、プラスミドにコードされた防御システムが、有益な相互作用を媒介する生態学的役割を果たすことが明らかになった。
他の人が見ている類似コンテンツ
栄養不良の子どものための微生物指向型食品に含まれる生物活性糖鎖
論文オープンアクセス13 12月2023
マシュー・C・ヒバード、ダニエル・M・ウェバー、...ジェフリー・I・ゴードン
乳幼児と成人における抗生物質曝露に対する腸内細菌叢とレジストームの異なる反応
論文公開 2023年12月22日
Xuanji Li, Asker Brejnrod, ... Søren Johannes Sørensen
種および株レベルのマイクロバイオーム解析のための16S rRNA遺伝子シーケンスの評価
論文 オープンアクセス 2019年11月06日
ジェスロ・S・ジョンソン、ダニエル・J・スパコヴィッチ、...ジョージ・M・ワインストック
主な内容
プラスミドは、細菌宿主内に存在する自己複製する環状の二本鎖DNA分子である1。プラスミドは微生物染色体間の遺伝子交換の重要なベクターとして認識されてきた。さまざまな生息環境から採取された微生物集団に豊富に存在することから、プラスミドが生態学的に重要な役割を担っていることがわかる2。自然界におけるプラスミドの重要性は明らかであるにもかかわらず、微生物群集におけるプラスミドの役割は十分に理解されていない。なぜなら、プラスミドは通常、特定の宿主内の個々の存在として研究され、環境や群集の背景は無視されているからである。
プラスミドは、特定の宿主内でのプラスミドの維持と他の微生物宿主間での移行に重要な複製遺伝子と動員遺伝子を含む、保存されたDNAバックボーンから構成されている。プラスミドはまた、宿主の表現型の多様性にしばしば寄与する、様々な種類のアクセサリー遺伝子も持っている。さまざまな環境から分離されたプラスミドは、抗生物質耐性から窒素固定まで、多彩なアクセサリー機能をコードしている3,4。このようなプラスミドが持つ機能は、宿主の局所的な環境において、宿主に優位性を与える可能性があり、宿主生物にとって、プラスミドを運ぶことの負担を価値あるものにしている2,5,6,7,8,9。
プラスミドの生物学とプラスミドによって動員される機能に関する知識は、個々の微生物種や複雑な微生物群集における遺伝的相互作用や、プラスミドが果たす生態学的役割に関する洞察をもたらす。一般に、プラスミドは個々の微生物種で研究されているが、異なる系統の微生物個体間に密接な近接性が存在するような密な微生物群集では、プラスミドの役割はさらに大きくなる可能性がある10。このような密集した群集では、プラスミドがアクセサリー遺伝子キャリアーとして果たす生態学的役割が、ニッチの拡大に役立つ可能性がある。なぜなら、プラスミドは資源利用に関連する潜在的機能だけでなく、武器や防御機構の獲得を可能にし、それによってニッチ空間を拡大するからである10,11。
ルーメンの微生物生態系は、農業にとっての重要性、繊維分解原理を解明する可能性、炭素循環やバイオエネルギーへの貢献、環境問題(特に温室効果)との関連性などから、最も研究が進んでいる複雑な微生物環境のひとつである12,13。この複雑な微生物群集は、1011ml-1を超える密度で共存する多数の異なる微生物種から構成されており、この生態系は微生物群集生態学におけるプラスミドの役割を研究するのに理想的である。われわれは、自然環境におけるプラスミドの生態学的役割についてさらなる洞察を得るために、この系に注目した。この目的のために、我々は、代謝アクセサリー遺伝子をコードする占有率の高いプラスミドが、プラスミドを介した生態を解明するための洞察を提供する可能性があるという基本的な仮定をもとに、広く普及している天然のプラスミド候補を同定した。
これまでのプラスミドームの探索14,15において、移動性遺伝子のプールには、生態学的関連性が高い可能性のある、非常に多様なアクセサリー遺伝子が存在することを報告してきた。今回の研究では、ルーメンプラスミドームのアクセサリー遺伝子について、複数の生態系で高い占有率を示す繰り返し機能と、その中での重要性を探索した。その結果、ルーメンとヒト腸管系において、毒素に対する耐性を提供し、毒素産生微生物とプラスミドを保持する防御微生物との相互関係を促進するプラスミドアクセサリー機能が広く存在していることが明らかになり、高次の微生物相互作用を組織化する上でプラスミドが極めて重要な役割を果たしていることが示唆された。
研究結果
腸球菌プラスミドが媒介する1,3-プロパンジオールデヒドロゲナーゼ(1,3-PD)はルーメンに広く存在する。
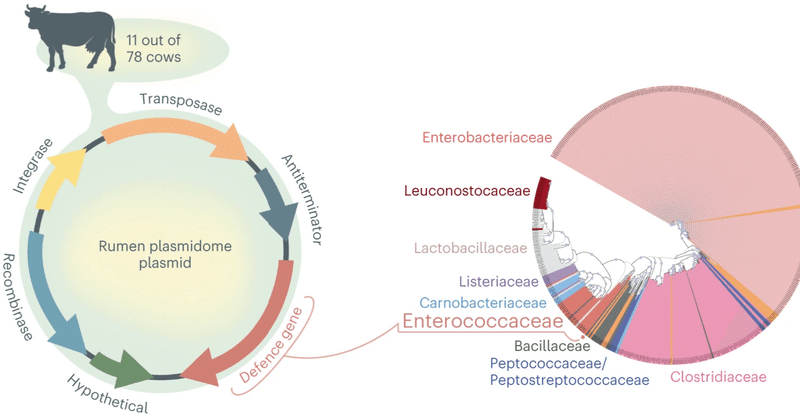
我々はこれまでに、環境中のプラスミドに搭載される従来とは異なるアクセサリー機能を数多く同定してきた14,15。ここでは、そのような推定機能の一つである1,3-PD遺伝子をコードするプラスミドが、ルーメンプラスミドーム内で高存在していることを発見し、その潜在的な生態学的役割を探ることを目的とした14,15。この推定機能は、我々の以前の研究16で78のメタゲノム中、11のサンプルから得られたプラスミドにコードされていることが判明した。これらのメタゲノムからアセンブルされたルーメンプラスミドは、以前の研究15,18,19で記述されたように、Recyclerアルゴリズム17を介してアセンブルされ、メタゲノミックリードまたは抽出されたプラスミドームのシーケンスから抽出された。この発見は、この推定遺伝子が移動性遺伝プールに繰り返し出現することから、生態学的関連性が高い可能性があるという仮説を提起した。すべての場合において、推定(1,3-PD)遺伝子は5,326bpのプラスミド中に同定されたが、プラスミド伝達性をコードする動員遺伝子は含まれていなかった(補足表1)。このことは、このプラスミドが宿主細菌に拘束されているか、あるいは非共役的な機構で移行していることを示唆している20。プラスミドにはさらに、リコンビナーゼ、インテグラーゼ、トランスポザーゼ、アンチターミネーター機能とアノテーションされた推定遺伝子が含まれている。
次に、NR NCBIデータベースから相同遺伝子を検索し、PhyloGenieパイプラインを使用して1,3-PD遺伝子を系統分類することにより、プラスミド1,3-PD遺伝子の系統を決定するために遺伝子ツリーアプローチを適用した21。この解析により、1,3-PD遺伝子をコードするプラスミドが腸球菌科クレード内に位置づけられ、そのメンバーがこれらのプラスミドの宿主微生物であることが示唆された(図1)。
図1:ルーメンプラスミドームから、生態学的関連性を持つ可能性のあるルーメンプラスミドを同定した。
図1
左:78頭コホートのルーメン微生物群から回収した1,3-PDプラスミドのプラスミドマップ。右:PhyloGenie21によってNR NCBIデータベースから検索された1,3-PD遺伝子の系統樹。Bacillaceae, Clostridiaceae, Enterobacteriaceae, Enterococcaceae, Lactobacillaceae, LeuconostocaceaeおよびListeriaceaeのファミリーは色分けされ、ツリー上に表示されている。Carnobacteriaceae ファミリーに割り当てられたタンパク質は水色、Peptococcaceae/Peptostreptococcaceae ファミリーは濃い青色、その他の系統は薄いオレンジ色で表示されている(Planococcaceae ファミリー、Pseudomonadaceae ファミリー、Thermoactinomycetaceae ファミリー、Yersiniaceae ファミリー、Fusobacteriaceae ファミリー、Moraxellaceae ファミリー、Morganellaceae ファミリーを含む)。赤い星と四角は1,3-PDルーメンプラスミド遺伝子の位置を示す。0.9以上のブートストラップは青丸で示す。
出典データ
フルサイズ画像
1,3-PDプラスミドはロイテリン毒素を防御する疑いがある
1,3-PD酵素は、プロピオン酸へのグリセロール発酵をコードする染色体オペロンの一部であることが報告された22。1,3-PD推定遺伝子のみがルーメンプラスミド上にコードされていることから、グリセロール発酵とは異なる生態学的役割を担っている可能性が示唆された。プラスミド上に存在する遺伝子は、染色体上に存在する遺伝子よりも高いレベルで発現することが研究で示されている。この高発現は、防御遺伝子を持つプラスミドを持つ細菌に選択的優位性を与え、環境中の資源をめぐって他の細菌種とよりよく競争できるようにする可能性がある23。文献検索の結果、ロイテリンとも呼ばれる3-ヒドロキシプロピオンアルデヒド分子は抗菌活性を持ち、腸内細菌、特にリモシラクトバチルス・ロイテリ(図2a挿入図)24,25によってしばしば産生されることが判明した。そこで、ルーメンプラスミドと推定される遺伝子が、ロイテリンの抗菌活性に対する防御機構として機能している可能性を検討した。ルーメンプラスミド1,3-PD遺伝子バリアントのNRデータベースに対する基本的なローカルアラインメント検索ツール(Blast)により、Clostridium butyricum22由来の以前に特徴付けられた1,3-PDと74%のアミノ酸配列同一性と82%の類似性が示され、このファミリーの他の以前に特徴付けられた酵素と高い類似性を示した(拡張データ図1)22,26,27,28。このことから、このプラスミドコード酵素はロイテリンを1,3-プロパンジオールに変換し、無毒化することが示唆された。
図2:1,3-PD防御遺伝子の生化学的特性解析と細菌宿主内での機能活性。
図2
a, 1,3-プロパンジオールを基質とした1,3-PD酵素の経時的酵素活性。 b,c,NAD+(b)または1,3-プロパンジオール(c)の濃度を増加させたときの1,3-PD活性のミカエリス-メンテン解析。測定はテクニカルトリプリケートで行われ、実際のデータが示されている。実線の曲線は、酵素によるNAD+と1,3-プロパンジオールの非協同的結合を仮定し、Michaelis-Menten方程式をデータに当てはめて作成した。 d, 大腸菌における1,3-PD発現のロイテリンに対する保護効果。プラスミドpBR322から1,3-PDを構成的に発現しているER2566株を、200μlのLB培地中で、濃度の増加するロイテリン(最終濃度0〜1mM)中で培養した(培養物の量は、滅菌水を用いてサンプル間でホモジナイズした)。37℃で24時間培養後、濁度を600nmで測定した。対照株には空のベクターを導入した。測定は生物学的3連複で行い、実データ、平均値、標準偏差を示した。
ソースデータ
フルサイズ画像
1,3-PD遺伝子はin vitroで活性を示し、抗菌性ロイテリンを無毒化する
我々は、1,3-PDがロイテリンを無毒化できるかどうかを、遺伝子をクローニングし、大腸菌で酵素を過剰発現させることによって試験した。精製した酵素は、ロイテリンではなく、市販の1,3-プロパンジオールのNAD+による酸化を測定し、生成したNADHの340 nmでの吸光度をモニターすることにより、明らかに活性があることがわかった(図2a)。次に、酵素の基質に対する親和性を評価しようとした。そこで、NAD+または1,3-プロパンジオールの濃度を上げてNAD+の還元速度を測定する滴定実験を行った。その結果、古典的なミカエリス-メンテン曲線が得られ、NAD+のKmは0.25±0.04 mM(図2bおよび拡張データ図2)、1,3-プロパンジオールのKmは17±6 mM(図2cおよび拡張データ図2)であった。1,3-プロパンジオールの滴定は飽和に近いNAD+濃度で行われたため、得られたデータ(図2c)から抽出されたVmax値(酵素1分子あたり11±1分-1)は、酵素触媒速度定数(kcat)とほぼ一致した。これらの速度論的パラメーターは、Klebsiella pneumoniae27,29由来の相同酵素について以前に報告された値に酷似しており、ロイテリンの不活性化がルーメン内でのプラスミドコード酵素の役割である可能性を示唆している。
プラスミドコード化1,3-PDはロイテリン毒素から細菌細胞を守る
プラスミドにコードされた1,3-PD防御遺伝子は、完全なオペロンの一部ではなく、プラスミド上の独立した遺伝子であったので、次に細菌細胞にロイテリン耐性を与えるかどうかをテストした。この目的のために、我々はこの遺伝子をβ-ラクタマーゼ・プロモーターの下で大腸菌プラスミドpBR322にクローニングし、形質転換後、対照と比較してロイテリンの濃度を増加させながら(最終濃度0から1mM)細菌を増殖させた。この実験の結果、すべてのロイテリン濃度において、1,3-PD防御遺伝子を持つ株は、この遺伝子を欠く対照株よりも有意に高い生存率を示し、後者は0.125 mM以上のロイテリンでは明らかな増殖を示さなかったことから、ロイテリンに対する1,3-PD防御酵素の防御効果が示された(図2d)。酵素の防御効果は、ロイテリン濃度が0.5mMと1mMと高くなるにつれて低下し、両菌株とも増殖が見られなくなった。
ロイテリンはルーメンの生態系に広く存在し、影響を与えている
我々の発見は、ロイテリンが細菌細胞に影響を及ぼすこと、そして1,3-PD防御遺伝子を持つプラスミドが細菌細胞にロイテリン耐性を付与する可能性があることを示しているので、我々はまず、ロイテリンが自然のルーメン生態系に存在するかどうかを調べた。この目的のため、LC-MSターゲットメタボロミクスアプローチを用いて、ウシのルーメンサンプル20個中のロイテリン濃度を測定した。その結果、20サンプル中10サンプルのルーメン中にロイテリンが0.07~0.89 mMの濃度で確かに存在することがわかった(図3a)。
図3:ルーメン微生物組成と宿主細菌の分離に対するロイテリンの影響。
図3
a, 20 頭の牛のルーメンサンプルで検出されたロイテリンの濃度(mM)を表す分布図。 b, ロイテリン添加の有無に関わらず連続継代後の培養微生物ルーメン群集の属レベルでの系統解析。棒グラフは属の存在量を正規化したもの。Adlercreutzia属、Bacteroides属、Bifidobacterium属、Blautia属、Butyricicoccus属、Butyrivibrio属、Dialister属、Peptococcus属、Prevotella属、Roseburia属、Sediminibacterium属など、対照群で存在量の少ない属は表されていない: 1,3-PD遺伝子の一部のPCR(予想産物長560bp)、5株のプラスミド精製画分から増幅。下のゲル: リバースプライマーを用いた1,3-PD遺伝子をコードするプラスミド全体のPCR(予想産物長〜5,300 bp)。両方のゲルにおいて、プラスミドpBR322:1,3-PDをポジティブコントロール鋳型として使用した。どちらのゲルも、2つの異なる実験で再現性があった。d,1,3-PD防御プラスミド遺伝子(上)またはGroEL染色体遺伝子(下)に対する特異的プローブを用いたCARD-FISHによって標識されたE. faecalis MM1細胞のSTORMおよび広視野(挿入)イメージング。白い破線は細菌の細胞壁を示す。e, 1,3-PD防御遺伝子を持つルーメンプラスミドで形質転換したE. faecalis MM1プラスミド保有株とE. faecalis DSM 8630 pMM1のロイテリンに対する耐性とE. faecalis DSM 8630 ∅(1,3-PD防御遺伝子を持たない空のプラスミドバックボーンを持つ)の耐性比較。これらの菌株は、1,000μlの基礎培地中で、ロイテリン濃度を0~0.9mMに増加させながら培養し、37℃で24時間培養した(培養液の量は、滅菌水を用いてサンプル全体でホモジナイズした)。ロイテリンに対する1,3-PD防御遺伝子の防御率を測定するために、600nmでの濁度測定を行った。y軸は、ロイテリン無添加の同菌株の増殖と比較した、特定菌株の増殖%を示す。測定は生物学的3連複で行われ、実際のデータ、平均値、標準偏差が示されている。
出典データ
フルサイズ画像
ルーメン生態系のメンバーに対するロイテリンと防御システムの影響を調べるため、プラスミドがバイオインフォマティクス的に検出されたルーメンのミクロコズムを選んでロイテリンに暴露した。16Sリボソーム(r)RNA遺伝子の分類学的解析の結果、ロイテリンを添加しなかった場合と比べて、ロイテリンを処理したマイクロコズムでは、エンテロコッカス属の相対存在量が有意に増加した(7%から96%へ)。ロイテリンの広範な増殖阻害は、今回観察された多くのルーメン細菌に影響を及ぼし、ロイテリンが試験した腸内細菌の大半の増殖を変化させたことを示した以前の研究と一致している30。さらに、Enterococcus属菌量の増加は、qPCRを用いた総16S rRNAコピー数で測定したバイオマスの全体的な増加を伴っていた(Extended Data Fig.) これらの結果から、ロイテリン処理したマイクロコズムでは、多様性の低い細菌群集間の競争が減少し、腸球菌の増殖が可能になったことが示唆される。
E. faecalis分離株中の1,3-PDプラスミドがロイテリン耐性を与える
ロイテリン処理したルーメンサンプルに腸球菌科が濃縮されていることを明らかにした上述の結果に続いて、ロイテリンを使って1,3-PD防御遺伝子を持つプラスミドを持つ微生物を濃縮・分離できるかどうかをテストした。ロイテリン耐性の濃縮微生物群を、ロイテリン含有寒天プレート上での選択に用いた。高濃度のロイテリンを含むプレートでは、特定のタイプのコロニー形態が増加した。16S rRNA遺伝子のサンガー配列決定によるこれらのコロニーの分類学的同定は、バイオインフォマティクス解析で予測された通り、腸球菌科のメンバー、特にE. faecalis株と95%の同一性を示した。そこで、この分離株をE. faecalis MM1と命名した。さらに、PCR法(図3c)と、1,3-PD防御遺伝子をターゲットとするCARD-FISHプローブを用いた顕微鏡的アプローチ(ストキャスティック光再構成顕微鏡法(STORM))により、これらの分離株における1,3-PD防御遺伝子を持つプラスミドの存在を検証した(図3d)。両アプローチを用いた結果、単離されたE. faecalis MM1細胞でのみ排他的でユニークなシグナルが観察されたが、プラスミドを欠くE. faecalis DSM 8630株では観察されなかった(図3c,dおよびExtended Data Fig.4)。顕微鏡的アプローチでは、染色体上に局在するGroEL遺伝子を標的とする別のプローブを用いた場合には限局した局在が観察されたのに対し、1,3-PD特異的プローブで細胞を染色した場合には散在した局在が観察された。次に、分離株の1株とDSM株のE. faecalisの全ゲノム配列決定を行った。その結果、両株の平均塩基配列同一性は98.87%(文献31)であり、コンティグが広範囲に重複していた(Extended Data Fig.5)。次に、pMM1プラスミドを形質転換したE. faecalis DSM 8630株(E. faecalis DSM 8630 pMM1)および空のプラスミドバックボーンを形質転換したE. faecalis DSM 8630 ∅株に対する、E. faecalis MM1プラスミド保有株のロイテリン耐性を測定した(図3e)。その結果、E. faecalis MM1培養株とE. faecalis DSM 8630 pMM1は、E. faecalis DSM 8630 ∅と比較して、培地中のロイテリン濃度が上昇しても同様の高い耐性パターンを示し、ロイテリンに対する防御におけるプラスミドの重要性がさらに裏付けられた。
ライバル2種間の相互作用と代謝交換
1,3-PD防御遺伝子を持つプラスミドがルーメン生態系とE. faecalis株内に多く存在することから、1,3-PD防御プラスミドを持つ宿主細菌は、ロイテリン耐性以外の利点も享受しているのではないかという疑問が浮上した。自然界に存在する共生関係にヒントを得て32、ロイテリンは近接したときに武器として最も効果を発揮することから、防御プラスミドを保有することの潜在的な利点は近接依存性ではないかと推測した。実際、E. faecalisとL. reuteriを共培養したところ、単培養に比べて両菌種のバイオマスが増加し、有益な効果が確認された(図4a(i))。自然環境では、微生物の増殖はしばしば非同期的であり33 、ロイテリンは微生物の相互作用の間にすでに存在している可能性があることを考慮することは重要である。そこで、ルーメン環境や他の腸内環境34,35,36,37の測定で見られたように、ロイテリンが両細菌種の増殖中に広く存在するルーメン環境に近い制御された条件を作り出すため、実験にロイテリンを外部から添加した。我々の結果は、共培養において、L. reuteriの増殖に対する効果は、プラスミド上に1,3-PD遺伝子を持つE. faecalis株でのみ観察され、E. faecalisの増殖に対する効果は、1,3-PD遺伝子をコードするプラスミドで増強されることを示している(図4a(i))。実際に、プラスミド上の1,3-PD遺伝子が存在する場合にのみ、E. faecalis株とL. reuteri株のコロニー直径が増大し、2つの細菌コロニー間の距離が縮まることが観察され、菌株間の有益な相互作用が増大することがわかった(Extended Data Fig.6)。さらに、E. faecalis MM1をL. reuteriの使用済み増殖培地で培養したところ、L. reuteriの代謝産物に曝されたE. faecalisの生成時間が有意に増加することが確認された(図4a(ii))。驚くべきことに、L. reuteriはE. faecalisの代謝産物に暴露されたときにも顕著な体力の増加を示し(図4a(iii))、この相互作用が代謝産物交換に依存していることがさらに示唆された。
図4:ロイテリン生産者と分解者の代謝的相互作用。
図4
a(i)、各菌株に特異的なプライマーを用いた、4生物学的複製からのL. reuteri(オレンジ)と異なるE. faecalis株(青)の単独培養および共培養の定量的PCR分析(16S rRNA遺伝子)を表す棒グラフ。アスタリスクは両側t検定によるP値(左から0.005、0.027、0.021、0.003、0.001)。(ii),(iii), L. reuteri (iii)またはE. faecalis (ii)の増殖曲線を、E. faecalisまたはL. reuteriの使用済み培地を用いた場合と用いない場合の経時的な600nmで測定したODで表した。平均値+s.d. b, LC-MSで分析した、基礎培地で培養したL. reuteriまたはE. faecalisが消費した代謝物の倍数変化を表す棒グラフ。c(i)、各細菌種による消費代謝産物および/または産生代謝産物の倍数変化を示す棒グラフ。分析は、相互増殖させた2株から得た使用済み培地で培養したサンプルに対して行った。すべてのLC-MS測定(bとc)は生物学的3連複で行った。実際の値(点)、平均値±s.d.を示す。(ii)、市販のアクリルアミド(n = 8)またはソルビトール(n = 10)を、それぞれL. reuteriまたはE. faecalisを37℃で20時間培養する前に、唯一の炭素源として基礎培地に添加した補充アッセイを箱ひげ図に表した。すべてのポイントを表示し、平均値を線で表した。実際のOD600値を表示。P値は両側t検定で求めた。ボックスはデータの四分位範囲(IQR)中央半分を表し、ひげはデータの範囲、最小値から最大値を表し、個々の点はすべての測定値を表す。 d, in vivoにおける1,3-PD遺伝子、E. faecalisおよびL. reuteriの共起。(i), L. reuteri、E. faecalis、1,3-PD遺伝子量のSpearman相関と(ii)共起散布図。34個のルーメンサンプルについて、特異的プライマーを用いた定量的PCRで決定した。ii の x 軸と y 軸はそれぞれ E. faecalis と L. reuteri の 16S rRNA 遺伝子コピー数を表し、円の大きさは 1,3-PD 遺伝子コピー数を表す。
出典データ
フルサイズ画像
以上のことから、L. reuteriの使用済み培地におけるE. faecalis MM1の代謝産物産生-消費、およびその逆の代謝産物産生-消費について、アンターゲットのメタボローム解析を行った(補足表2)。その結果、代謝物消費に関して2つの微生物間で明確なニッチ分割パターンが検出されたが、1つの代謝物が両者で消費された以外は、2つの種が資源を奪い合っていないことが示唆された(図4b)。興味深いことに、E. faecalis MM1株は、L. reuteriが産生すると同定された52種類の代謝物のうち3種類を消費することができた。そのうちの2つは、あらかじめ培地中には存在せず、E. faecalis MM1によって完全に消費された。したがって、これらの代謝物は増殖制限物質である可能性があり、E. faecalis MM1による全代謝物の消費と枯渇により限界に達するまで、使用済み培地上での対数期におけるE. faecalis MM1の速い増殖を説明できる可能性がある。両微生物の共培養では、E. faecalis MM1は単培養に比べてより多くのバイオマスを産生した。E. faecalis MM1が産生した41種類の代謝物のうち、L. reuteriは5種類を消費したが、これは完全には消費されなかったため、共培養での生育に相当する使用済み培地で培養したこの微生物のバイオマスが高くなったことが説明できる(図4a(iii))。L. reuteriとE. faecalisの先行研究38,39,40,41,42で報告された代謝物も含まれる。L. reuteriが産生し、E. faecalisが消費した代謝物は、D-ソルビトール、D-グルカル酸、プリン代謝誘導体としてアノテーションされた。E. faecalisが産生し、L. reuteriが消費した5つの代謝物のうち4つは、L-システイン、リボースリン酸、アクリルアミド、ベタインと注釈された(図4c(i))。これらのアノテーションは、2つの細菌が特定の経路に集中せず、代謝の様々な経路に広がる代謝物を交換していることを示唆している。アクリルアミドとD-ソルビトールについては、市販の代謝物源を用いたLC-MS分析でアノテーションを確認した(Extended Data Fig.8)。さらに、L. reuteriとE. faecalisをそれぞれアクリルアミドとD-ソルビトールを唯一の炭素源として増殖実験を行い、これらの利用を確認した。その結果、両菌株ともこれらの化合物を効果的に利用することができ、その結果、菌の増殖に好影響を与えることが示された(図4c(ii))。以上の結果から、ロイテリンが環境中に存在する場合、1,3-PD防御遺伝子をコードする防御プラスミドが維持されることで、両菌種間の代謝範囲を超えた代謝交換が可能になることが示唆された(図5)。
図5:本研究で明らかになった知見の模式モデル。
図5
我々のデータは、L. ロイテリ菌(オレンジ色)が産生する抗菌性毒素ロイテリンは、E. faecalis(青色)のプラスミドにコードされた防御遺伝子(赤色)によって無毒化され、その結果、E. faecalisが生存し、L. ロイテリ菌が産生する代謝産物を利用してその体力を向上させることを示している。フェカリス菌が産生した代謝産物がロイテリ菌によって消費されると、この有益な効果は相互に作用し、ロイテリ菌のフィットネスも向上する。
フルサイズ画像
試験管内で観察されたL. reuteriとE. faecalisの有益な相互作用から、我々は生体内での両者の関係を調査することにした。我々は、34頭の牛のルーメンにおける両者の共存と1,3-PDプラスミド遺伝子の存在を調べた。定量的PCR分析により、2種の間に0.82のスピアマン相関が認められた(図4d(i))。また、L. reuteriとE. faecalisの両菌量は、1,3-PDプラスミド遺伝子の定量と相関しており、スピアマン相関はそれぞれ0.53と0. 54であった(図4d(i))。線形回帰モデルを当てはめると、R2は0.6176となり(Extended Data Fig.9)、試験管内で観察されたこれら2種の有益な相互作用は、自然環境でも起こることが示された(図4d(ii))。さらに、健常人の糞便311サンプルから得られたヒト腸内プラスミドームを解析したところ、サンプルの17%に推定1,3-PD遺伝子を持つプラスミドが含まれていた。この遺伝子は、ルーメンプラスミドが産生する1,3-PDタンパク質配列と44%のアミノ酸同一性と61%の類似性を有していた。さらに、この推定1,3-PDプラスミド媒介遺伝子はL. reuteriと共起していることが判明し(Fisher exact検定、P < 1 × 10-5)、L. reuteriが存在する腸内環境ではこの防御機構が広く存在していることが示された(補足表3)。これらの所見から、試験管内で観察された相互作用は、他の腸内環境でも同様である可能性が示唆される。
考察
腸内生態系や特にルーメン生態系のような高密度の微生物群集では、微生物の武器と防御機構が微生物間相互作用の確立と維持に重要な役割を果たす。このような相互作用は、ほとんどの場合、空間や栄養分などの資源を奪い合うことで成立する。細菌戦争に関する研究の大半は、武器や防御システムを使用することによる微生物集団への直接的な結果からの利益やコスト、あるいは攻撃からの生き残りや競争の勝利といった相互作用のタイプに焦点が当てられてきた。プラスミドは、このようなシステムの拡散や微生物群集への影響に役立っていると考えられている。とはいえ、このような機構が間接的に、群集内の抗争当事者間の相互作用の種類を確立したり変化させたりする効果をもたらした例は(あったとしても)ごくわずかである。
ここでは、プラスミド上にコードされた防御機構の実行に依存し、それを介するユニークで高次の有益な相互作用のタイプに注目する。このプラスミド・アクセサリー機能は、細菌宿主に、攻撃してくる微生物種と有益な関係を維持する能力を与える。我々の研究の目的は、アクセサリー遺伝子を含むプラスミドが、その生態系内の生態系にどのような影響を与えるかについて深い洞察を得ることである。ルーメンの生態系に焦点を当て、生態系全体で高い占有率を示す1,3-PDアクセサリー遺伝子を持つプラスミドを同定し、バイオインフォマティクス、生化学的、分子生物学的、細胞学的解析を含むトップダウン/ボトムアップの統合研究を行った。その結果、このプラスミドを保有することで、試験管内でロイテリンの毒性作用に抵抗する手段が得られ、E. faecalisは毒素産生菌であるL. reuteriと相互扶助的な代謝相互作用を維持することができ、それによって双方のフィットネスに貢献することがわかった。ロイテリン産生菌とロイテリン分解菌の両方が、相手の産生した代謝産物を消費することができ、これはこれらの交差摂食細菌種間の互恵性を示唆している。プラスミドの宿主細菌だけに特異的な利点を与えることは、プラスミド上に移動性遺伝子が存在しないことの説明にもなり、プラスミドを介した防御システムの有益な効果に排他性を与えることになる。
これらの生態学的意味に加えて、プラスミド上にロイテリン防御系が多く存在することは、ロイテリンをルーメン生態系や他の動物種の腸内生態系において顕著な生態学的意義と関連性を持つ抗菌性毒素として指定することになると思われる。我々はこの考えを支持する状況証拠を発見した。というのも、天然のルーメンサンプル中にこのプラスミド遺伝子が存在し、E. faecalisとL. reuteriの双方に正の相関が見られたからである。さらに、L. reuteriが存在するヒトの腸内環境においても、相同プラスミドの1,3-PD遺伝子が広く存在していることがわかり、ヒトの腸内細菌叢においてもこのような相互作用が起こる可能性が示された。とはいえ、このような相関関係は、これらの生物種間のin vivoでの相互作用を確認するためにさらに調査されるべきである。したがって、我々の主要な知見を強化し、相互作用相手の空間的な構成に焦点を当てながら、生体内でのこのような相互作用の重要性を解読するための今後の研究が必要である。L.ロイテリ菌とE.フェカリス菌における毒素と防御遺伝子の進化は、おそらくこれらの種間の相互作用を可能にする役割によってもたらされたものではない。ロイテリンの産生は、その広域スペクトル毒素の特性から、主に競争的メカニズムとして進化したのであろう。E.フェカリスによるプラスミドの獲得は、その防御活性の向上とともに偶然に起こったのかもしれない。時系列的な順序はともかく、防御システムの存在によって、ニッチ分割を行うこの2つの非競合種は、競合相手を排除しながら共存し、互いをサポートすることができる。
まとめると、今回の発見は、プラスミドにコードされた形質が、細菌の戦争や相互作用に役立つ重要な生態学的役割を持つことを示している。また、微生物種間の相互作用を促進するプラスミドの潜在的な役割を強調し、プラスミドが群集の動態や相互作用のドライバーとして重要であることを強調している。私たちの結果は、微生物の戦争と平和における概念的なパラダイムを提示するものであり、それはおそらく人間社会における軍拡競争に類似している。つまり、一方のパートナーが他方の武器システムに対する防御システムを保有することで、平和と繁栄の現状を維持することが可能になるのである。
方法
1,3-PD関連プラスミドのバイオインフォマティクス解析
78頭のホルスタイン乳牛のプラスミドームを、Recyclerアルゴリズム17を用いて、配列決定されたメタゲノム16の生リードから検索した。1,3-PD遺伝子を含むプラスミドをローカルBlast43を用いて検索した。プラスミドは、McSyFinderのConjScan44とMOBscan45を用いて、結合系とリラクサーゼの存在を解析した。プロジェクトSRP100518の311個の健常人糞便サンプルの生リードをTrim Galore46でトリミングし、Megahit47でコンティグにアセンブルし、SCAPP48でプラスミドを回収した。次に、ルーメンプラスミドームの1,3-PD遺伝子のアミノ酸配列をこれらのプラスミドに対してブラストした結果、ルーメンプラスミドームの1,3-PDタンパク質配列と44%のアミノ酸同一性と61%の類似性を持つ推定1,3-PD遺伝子をコードするプラスミドが回収された。最後に、311の各サンプルの生のリードをBBmap49を用いてこのプラスミドにマッピングし、SAMtools mpileup50で計算したリードカバレッジが70%以上の場合、そのプラスミドがサンプルに存在するとみなした。
1,3-PD遺伝子のクローニングとタンパク質の精製
1,3-PDをコードする遺伝子を合成し、発現タンパク質がN末端にポリヒスチジンタグを持つようにプラスミドpSH21にクローニングした(補足表4)。得られたプラスミドを大腸菌ER2566コンピテントセルに挿入し、100μg ml-1アンピシリン存在下、T7プロモーターの転写制御下で遺伝子を発現させた。このタンパク質は、最初にNi-NTAビーズを用いて精製し、続いて50mM HEPES pH7.5と100mM NaClで平衡化したGE Healthcare 16/60 Superdex 75カラムを用いてサイズ排除クロマトグラフィーを行った。精製したタンパク質はグリセロールを加えずに-80℃で保存した。
1,3-PDの酵素活性
推定酵素は、1,3-PD + NAD+->NADH + ロイテリン、およびその逆の反応を行う。精製ロイテリンは市販されていないので、1,3-プロパンジオールとNAD+を基質として酵素活性を測定した。酵素活性(1 µM)を測定するために、1 mMのNAD+存在下、2 mMの1,3-プロパンジオールを基質として用いた。340nmの吸光度を用いてNADHの生成量を測定した。反応は37℃で15分間行った。ミカエリス・メンテンモデルをデータに当てはめ、滴定実験により速度論的パラメーターを決定した。
L. reuteriによるロイテリン生産
ロイテリン生産菌であるL. reuteriは、グルコースの存在下でグリセロールをロイテリンに変換するため、グリセロールからロイテリンを生産するために使用した24。L. reuteri ATCC 6475株をMRS培地(Difco)上で嫌気条件下、37℃で24時間培養した。その後、嫌気条件下、5,000gで3分間遠心分離した。上清を捨て、細胞を生理食塩水で素早く洗浄し、0.1%グルコースを加えた250mMグリセロール1mlに懸濁し、嫌気条件下37℃で2時間培養した。その後、12,000 gで5分間遠心した後、生成したロイテリンを含む水性上清を濾過し、4℃で保存した。50μlの上清または0~70nM濃度のアクロレイン(Sigma-Aldrich)、あるいは二重蒸留水(陰性対照)のアリコートを、37.5μlのトリプトファン(0.05M HCl中の0.01M溶液)に加え、150μlの濃塩酸とともに1.5mlのチューブに入れ、溶液を37℃で30分間インキュベートした。560nmで測定した吸光度を用いて、L. reuteriが産生したロイテリンの濃度を算出した。
ロイテリンに対する1,3-PDベースの防御
1,3-PDをコードする遺伝子を、特異的プライマー(補足表4)を用いて、ギブソンアセンブリー法を用いてpBR322にクローニングし、pBR322:1,3-PDを形成した。このプラスミドを100μg ml-1アンピシリン存在下で大腸菌ER2566細胞に形質転換した。プラスミドpBR322は、1,3-PD遺伝子の構成的発現を可能にする。pBR322を単独で含む野生型株ER2566と、pBR322:1,3-PDを含むER2566株を、200μlのロイテリン(0〜1mM)の濃度を増加させながら96ウェルプレートで増殖させ、37℃で24時間インキュベートした(培養物の量は、滅菌水を用いてサンプル全体でホモジナイズした)。培養期間後の光学密度(OD)600nmの測定値を用いて、1,3-PDによるロイテリン化合物に対する防御を決定した。同様に、E. faecalis MM1、DSM 8630 pMM1およびDSM 8630 ∅を、1,000 μlの基礎培地(培養液の量は滅菌水を用いてサンプル間でホモジナイズした)中で、濃度の増加するロイテリン(0~0.9 mM溶液)で増殖させ、37℃で24時間培養し、OD600を測定した。
ロイテリン標準物質の調製
上記のようにL. reuteriによって産生されたロイテリンを3ml採取し、前述のようにシリカゲルカラムで精製してロイテリン標準物質を調製した51。溶出は、シリカゲル60薄層クロマトグラフィープレート(Merck)上に溶出液の液滴を加え、それを直ちに1M NaOH中の2%(w/v)Purpald試薬溶液(Aldrich)に浸すことによってモニターした。ロイテリンを含むフラクションを合わせ、溶媒を減圧下で蒸発させた。乾燥残渣を秤量し、直ちに2mg ml-1になるように二重蒸留水に再溶解した。得られた溶液は、標準曲線を作成するまで-20℃で保存した。
ロイテリンの測定
以前に発表された牛のコホート16 から採取した多数のルーメンサンプル 20 個を、LC-MS を用いてロイテリン濃度を分析した。ロイテリンは前述52 のように誘導体化し、Acquity I-class UPLC システム(Waters)と、エレクトロスプレーイオン源を装備した Xevo TQ-S トリプル四重極質量分析計(Waters)から成る LC-MS/MS 装置を用いて分析した。データの取得および解析には、MassLynxおよびTargetLynxソフトウェア(v.4.2、Waters)を使用した。クロマトグラフィー分離は、50 mm×2.1 mm内径、1.7 μm UPLC BEH C18 カラム(Waters Acquity)を用い、移動相Aとして0.1%ギ酸、移動相Bとしてメタノールを用い、流速0.3 ml min-1、カラム温度35 °Cで行った。Bを0.1%から0.2%まで0-1.5分間かけてわずかに直線的に増加させ、次にBを50%まで5分間かけて直線的に増加させ、Bを50%で0.5分間保持し、0.5分以内にBを0.1%に戻し、Bを0.1%で2分間平衡化する。注入量は3μlであった。
ロイテリン耐性菌の濃縮
プラスミドが検出された牛のサンプルを、揮発性脂肪酸を含むM10培地で培養し、液体培地で5 g l-1のフルクトースを添加し、継代培養により7日間培養して、チューブでの増殖から生じる典型的なリッチネス減少に到達させた。細菌群集はさらに、同じ培地(1 ml容量で、25 μlのロイテリン(最終濃度0.25 mM、ロイテリンが存在するサンプルで検出された平均ロイテリン濃度にほぼ相当)または25 μlの二重蒸留水を添加)で増殖させ、7日間継代培養した。DADA2およびQIIME54,55を用いて正確な配列変異表を作成した。
プラスミド含有細菌の単離
上記の濃縮培養の上清液(群集が排泄した様々な代謝物を含む)を20μm孔フィルターでろ過し、揮発性脂肪酸を含み、5 g l-1フルクトースを添加したM10寒天プレートの濃縮に使用した。さらに、プラスミド含有細菌を濃縮するために、0.1 mMロイテリンを添加した。得られたコロニーを個々に増殖させ、ミニプレップ調製に供した(RBC miniprep kit)。1,3-PD遺伝子に特異的なプライマー(補足表1)を用い、Phusionポリメラーゼ(NEB)を用いて、精製したプラスミドに対してPCRを行った。陽性コロニーは16Sサンガー配列決定のために送られた。PCR産物の環状性を確実にするため、特異的1,3-PDプライマーの逆相補体を用いて全周PCRを行った。その後、プラスミドの配列を完全に検証するために、サンガー配列決定と遺伝子ウォーキングを行った。
ゲノム比較
E. faecalis DSM 8630株およびMM1株のゲノムDNAをフェノール-クロロホルム法56で抽出し、イルミナシーケンスNovaSeq S1を用いて塩基配列を決定した。配列はSPAdes57でアセンブルし、GenBankに寄託した(アクセッション番号JAMKBU000000000およびJAMKBV000000000)。
Mauve58を用いて両菌株のDNA含量を比較し、Proteinortho59を用いて両菌株のオルソログ群を比較した。オーソロググループのヒートマップはRのSuperheat (https://rlbarter.github.io/superheat/)を用いて作成した。
CARD-FISH
標準的なCARD-FISHを行うために、1,3-PDおよびGroEL遺伝子に対して長いプローブ(~300塩基)を設計した(補足表4)。PCRはEx Taqポリメラーゼ(TaKaRa)を用い、製造元のプロトコールに従い、dTTP量の90%をDig-11-dUTP(Merck)に置き換えて行った。
プラスミドはDNA CARD-FISHを用いて染色した。遠心分離はすべて5,000 g、室温、5分間で行った。E. faecalis MM1株またはDSM 8630株を脳心筋注入培地(Difco)で37℃で一晩培養し、1ml培養のペレットを4%パラホルムアルデヒドで15分間固定した。固定した細胞を遠心分離し、0.05 M EDTA pH8、0.1 M Tris-HCl pH8、PBS中3 mg ml-1のリゾチーム(Merck)を含む溶解バッファーで透過処理した。溶解は4℃で15分間行った。細胞を遠心分離した後、ハイブリダイゼーションバッファー(20%デキストラン硫酸、20mM Tris-HCl、0.1% SDS、0.8M NaCl、1%ブロッキング試薬、35%ホルムアミド)に再懸濁した。反応を42℃で30分間インキュベートし、5μMのプローブを反応に加えた。その後、細胞を95℃で10分間、42℃で一晩インキュベートし、ホルムアミドとデキストラン硫酸を欠くハイブリダイゼーションバッファーで2回洗浄した。その後、細胞を抗体結合液(PBS中の1% Western blocking reagent、0.1% Pluronic F-68 reagent添加)に再懸濁し、非特異的結合をブロックするために回転させながら45分間インキュベートした。その後、2μlの抗ジゴキシゲニン-POD Fabフラグメント(Roche)を加え、さらに1.5時間インキュベートした。その後、細胞ペレットを100μlの増幅溶液(PBS中、5M NaCl、20%硫酸デキストラン、0.05%ウエスタンブロッキング試薬溶液)に再懸濁した。その後、1μlの0.15% H2O2と0.1μlのAlexa Fluor 647 Tyramide試薬(ThermoFisher)を混合液に加え、細胞を暗所で37℃で45分間インキュベートし、その後1mlのPBSを加え、細胞を遠心分離した。最後に、細胞をPBSで2回洗浄し、DAPI(1μg ml-1)でカウンター染色した。画像は、横河W1モジュールとPrime 95B sCMOSカメラを搭載した3i Marianasスピニングディスク共焦点顕微鏡を用いて取得した。励起レーザー(吸光度637 nm、発光フィルター672-712 nm)は、100倍のZeiss Plan-Apochromat 1.4 NA DICオイル対物レンズを使用した。
ストーム
染色したE. faecalis MM1細胞(20μl)をポリ-L-リジン処理したSTORM high glass-bottom 35 mm μ-Dish (ibidi, 81158)上に固定化し、直接STORMでイメージングした。Alexa647色素の光スイッチングはSTORM緩衝液で誘導した: 7 μMグルコースオキシダーゼ(Sigma)、56 nMカタラーゼ(Sigma)、5 mMシステアミン(Sigma)、50 mM Tris、10 mM NaCl、10%グルコース(pH 8)60。画像取得とデータ再構成は、Elyra PS1システム(100倍対物レンズ)とZenソフトウェア(Zeiss)を用いて行った。
遺伝子操作
E. faecalis MM1の全長プラスミドをpAM401(参考文献61)のXbaIおよびSal制限部位にクローニングし、エレクトロポレーション62によってE. faecalis DSM 8630コンピテントセルに形質転換し、E. faecalis DSM 8630 pMM1を作製した。並行してpAM401のみをE. faecalis DSM 8630コンピテントセルに形質転換し、ネガティブコントロールとした(E. faecalis DSM 8630 ∅)。
増殖曲線
E. faecalis MM1またはL. reuteriを、0.2 mlの基礎培地中37℃で、96ウェルプレート中、嫌気条件下、ODプレートリーダー(800TS吸光度リーダー、Biotek社製)で20時間培養した。基礎培地は、補足表5に記載したように調製した。アミノ酸(FORMEDIUM)を除き、すべての化学物質はSigma-Aldrich社から取り寄せた。
単培養および共培養は、100μlの新鮮な培養液を8ml容のハンゲートチューブに接種し、0.25mMのロイテリンを添加し、37℃で20時間培養することにより行った。L.ロイテリは定常期後期にロイテリンを産生することから、実験中ロイテリンを添加することで、自然環境とルーメン内のロイテリン濃度に近い条件を模倣することを目指した。
L.ロイテリ菌またはE.フェカリス菌を37℃で20時間培養する前に、0.2 g l-1のアクリルアミドまたはソルビトールをグルコース無添加の基礎培地に添加することにより、サプリメントアッセイを行った。アクリルアミド添加アッセイは、アクリルアミドの蒸発を避けるため、ハンゲートチューブで行った。
定量的PCR
定量的PCR法を用いて、単独培養および共培養におけるE. faecalis株およびL. reuteri株のコピー数を測定した。ml 培養液のペレットを 4,000 g で 5 分間遠心し、ゲノム DNA を抽出した。56で行われたように、最初の濾過ステップを除いてゲノムDNAを抽出した。10倍希釈液2μlを後述の反応ミックスに使用した。
エンテロコッカス特異的およびL. reuteri 16S rRNA遺伝子の定量に適した標準曲線は、各フラグメントの増幅により得られた、定量されたゲル抽出PCR産物の連続10倍希釈液を増幅することにより作成した(プライマーは補足表4に記載)。標準曲線は 8 希釈点を用いて求め、Rotorgene 6000 シリーズソフトウェア(Qiagen)を用いて算出した。リアルタイムPCRは、5μlのAbsolute blue SYBR greenマスターミックス(Thermo Scientific)、0.5μlの各プライマー(10mM)、および2μlのDNA鋳型を含む10μlの反応混合物で行った。
定量的 PCR はまた、34 頭の牛のコホート16 から抽出したメタゲノム DNA 中の E. faecalis、L. reuteri、1,3-PD 遺伝子のコピー数を測定するためにも使用した。各遺伝子のコピー数は、Qubit dsDNA High Sensitivity Assay Kit(Invitrogen社製)を用いて測定した各サンプルのDNA濃度に対して正規化した。得られたプラスミド量は Recycler の予測を確認し、追加サンプルでの検出レベルを増加させた。線形回帰を用いて、これらのサンプル中のL. reuteriとE. faecalisの絶対量の関係を測定した。データは、R(v.4.2.1)のlm関数で線形モデルをフィッティングする前にlog10変換した。
プロキシミティ・アッセイ
プロキシミティ・アッセイは、0.25mMロイテリンを添加した1.5%寒天培地を含む基底培地を含む1ウェルプレートで行った。プレートは、細菌の塗抹を避けるため、室温で24時間プレインキュベートした。E. faecalis株とL. reuteri株を、それぞれ2.5 μlずつ1 cmの間隔でプレート上にスポットし、嫌気条件下、37℃で48時間培養した。E. faecalis MM1、DSM 8630 pMM1、DSM 8630 ∅のいずれかを用いてアッセイを行った。
培養後、L. reuteriとE. faecalisのコロニー間の距離と各コロニーの直径を測定した。
メタボロームの非標的LC-MS分析
E. faecalis MM1は、基礎培地のみ、またはL. reuteri ATCC 6475の使用済み培地と等量混合して培養した(96ウェルプレートに0.2 mlずつ分注)。同様に、L. reuteri ATCC 6475を、基礎培地単独、またはE. faecalis MM1の使用済み培地と等量混合し、37℃で24時間培養した。すべての培養の上清液は、その後の LC-MS 分析のためにフィルター滅菌した。
代謝物抽出のため、各上清画分100μlをあらかじめ冷却したメタボローム抽出混合液(2.5μg ml-1アンピシリンを含むメタノール)1mlと混合した。チューブをオービタルシェーカーで 10 分間インキュベートした後、全速力で 10 分間遠心した。
極性代謝物分析のために、LC-MSグレードの水で抽出した代謝物または標準物質150μlをガラスバイアルに移し、使用するまで-20℃で保存した。各サンプル5 μlをWaters Acquity UPLCシステムを用いてC18 100 mm × 2.1 mm × 1.7 μm逆相カラム(Waters)に注入した。移動相は0.1%ギ酸(A)、0.1%ギ酸添加アセトニトリル(B)(UPLC MSグレード、BioSolve)。代謝物は、以下の割合のAを用いて、400μl min-1の流速で溶出した: 99%から95%への1分間のグラジエント、95%から1%への7分間のグラジエント、1%での2.9分間、1%から5%への0.1分間のグラジエント、5%から99%への2分間のグラジエント、カラムの洗浄と再平衡化のための99%での2分間(合計15分間の実行時間)。質量スペクトルは、Exactive質量分析計(ThermoFisher)を用いて取得した。スペクトルは、100-1,500 m/zの質量範囲をカバーするフルスキャンモードと全イオンフラグメンテーションスキャンモードの両方を用いて記録した。分解能は70,000に設定し、毎秒10回のスキャンを行い、Orbitrapのロード時間を最大100msに制限し、ターゲット値は1×105イオンとした。キャピラリー電圧は3.5 kV、シースガスフローは60、補助ガスフローは20に設定した。キャピラリー温度は275℃に設定し、加熱エレクトロスプレーソースの乾燥ガスは300℃に設定した。クロマトグラムの処理、ピーク検出、積分は MZmine 2 を使用し、S/N 比は 5 に設定した(MZmine 2.41.2)63。代謝産物の生成は、「増殖後の代謝産物/増殖前の代謝産物」の比が2.5以上と定義した。代謝産物の消費は、同じ比率で0.4以上と定義した。厳格さを増すため、3つの生物学的複製で代謝物が産生または消費された場合は、代謝物の産生または消費をさらに確認した。E. faecalisまたはL. reuteriで生産も消費もされなかった代謝物は無視した。代謝物のアノテーションは、市販の Mass Spectrometry Metabolite Library of Standards (MSMLS, Iroa Technologies) を実行して得られた質量と保持時間を照合することで行った。追加のアノテーションは、GNPS64 を使用した Molecular Networking、Compound Discoverer v.3.3(Thermo Scientific)の使用、細菌の KEGG ゲノム40,65 に存在する代謝物の抽出、および MetaboAnalyst66 の使用によって行った。後者のツールは、さまざまなイオン化で同じ化合物に対応するピークを検出するために使用した。これらの代謝物については、より良好に検出されたイオン化化合物を代表ピークとして選択した。
市販のアクリルアミドとD-ソルビトールを購入し(Merck)、上述のワークフローを使用してアノテーションを検証した。
統計と再現性
サンプルサイズを事前に決定するための統計的手法は用いなかった。解析から除外したデータはない。実験は無作為化しなかった。データの分布は正規分布と仮定されたが、正式には検証されなかった(個々のデータポイントは図に示されている)。治験責任医師は実験中および結果評価中の割り付けについて盲検化されていなかった。
報告概要
研究デザインの詳細については、本論文にリンクされているNature Portfolio Reporting Summaryを参照されたい。
データの利用可能性
E. faecalis MM1およびDSM 8630のゲノム配列および16S rRNA配列はGenBankに寄託されている(JAMKBV000000000、JAMKBU000000000、OR513053およびOR513080)。メタボロミクスデータはMetaboLights67にMTBLS7248 (https://www.ebi.ac.uk/metabolights/editor/MTBLS7248/descriptors)という識別子で寄託されている。ソースデータは本論文に添付されている。
参考文献
Kado, C. I. プラスミドの起源と進化。Antonie Van Leeuwenhoek 73, 117-126 (1998).
論文
CAS
PubMed
Google Scholar
ホイヤー、H.、アブド、Z.およびスモーラ、K. 細菌集団における柔軟な遺伝要素のパッチ的分布は、環境の不確実性に対する頑健性を媒介する。FEMS Microbiol. Ecol. 65, 361-371 (2008).
論文
論文
パブコメ
Google Scholar
Nuti, M. P., Lepidi, A. A., Prakash, R. K., Hooykaas, P. J. J. & Schilperoort, R. A. in Molecular Biology of Plant Tumors (eds Kahl, G. & Schell, J. S.) 561-588 (Academic Press, 1982).
Zwanzig, M. プラスミドにコードされた抗生物質耐性の生態学:実験的研究とモデリングのための基本的枠組み。Comput. Struct. Biotechnol. J. 19, 586-599 (2021).
論文
CAS
パブコメ
Google Scholar
フロスト、L. S. 、レプレー、R. 、サマーズ、A. O. &トゥーサン、A. 移動遺伝要素:オープンソース進化のエージェント。Nat. Rev. Microbiol. 3, 722-732 (2005).
論文
論文
パブコメ
Google Scholar
遺伝子の移動と細菌毒素:黄色ブドウ球菌の超抗原をコードする病原性アイランド. プラスミド 49, 93-105 (2003).
論文
論文
パブコメ
Google Scholar
Crossman、L. C. Rhizobiumのプラスミドレプリコン。日本農芸化学会誌Biochem. Soc. Trans. 33, 157-158 (2005).
論文
論文
パブコメ
Google Scholar
ゲノムアイランドと細菌の異化経路の進化。Curr. Opin. Biotechnol. 14, 248-254 (2003).
論文
PubMed
グーグル奨学生
Gil, R., Sabater-Muñoz, B., Perez-Brocal, V., Silva, F. J. & Latorre, A. アブラムシ内共生生物Buchnera aphidicolaにおける最小ゲノムを持つプラスミド。不可解な進化の物語。Gene 370, 17-25 (2006).
論文
論文
PubMed
Google Scholar
遺伝子の水平移動のための坩堝としての動物の腸。Can. J. Microbiol. 61, 603-605 (2015).
論文
CAS
PubMed
Google Scholar
細菌戦の進化と生態。Curr. Biol. 29, R521-R537 (2019).
論文
CAS
PubMed
Google Scholar
Morais, S. & Mizrahi, I. Island in the stream: from individual to communal fiber degradation in the rumen ecosystem. FEMS Rev. Microbiol. 43, 362-379 (2019).
論文
CAS
グーグル・スカラー
Mizrahi, I., Wallace, R. J. & Moraïs, S. The rumen microbiome: Balancing food security and environmental impacts. Nat. Rev. Microbiol. 19, 553-566 (2021).
論文
論文
パブコメ
Google Scholar
Kav, A. B. et al. ウシのルーメンプラスミドームに関する洞察。Proc. Natl Acad. USA 109, 5452-5457 (2012).
論文
論文
PubMedセントラル
Google Scholar
プラスミドームの分布と宿主微生物群との相互作用の解明。Environ. Microbiol. 22, 32-44 (2020).
論文
PubMed
グーグル奨学生
Shabat, S. K. B. et al. 反芻動物のエネルギー収穫効率は微生物に依存する特異的なメカニズムに支えられている。ISME J. 10, 2958-2972 (2016).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Rozov, R. et al. Recycler: an algorithm for detecting plasmids from de novo assembly graphs. Bioinformatics 33, 475-482 (2017).
論文
論文
PubMed
Google Scholar
Shapiro, J. T. et al. プラスミド遺伝的類似性の多層ネットワークから、遺伝子伝達の潜在的経路が明らかになった。(2023年).
論文
論文
PubMed
パブメドセントラル
Google Scholar
メタゲノムおよびディープシーケンシングアプローチのための高品質・高収率プラスミドDNA精製法。J. Microbiol. Methods 95, 272-279 (2013).
論文
論文
パブコメ
Google Scholar
ブドウ球菌のファージと病原性アイランドがプラスミドの進化を促進する。Nat. Commun. 12, 5845 (2021).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
Frickey, T. & Lupas, A. N. PhyloGenie: 自動化されたファイローム生成と解析。Nucleic Acids Res. 32, 5231-5238 (2004).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
クロストリジウム・ブチリカムの1,3-プロパンジオール(1,3-PD)オペロンの分子生物学的特徴。Proc. Natl Acad. Sci. USA 100, 5010-5015 (2003).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Smillie, C., Garcillán-Barcia, M. P., Francia, M. V., Rocha Eduardo, P. C. & de la Cruz, F. プラスミドの移動性。Microbiol. Mol. Biol. Rev. 74, 434-452 (2010).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
ラクトバチルス・ロイテリ(Lactobacillus reuteri)が産生する増殖阻害剤ロイテリンの生産と単離。Antimicrob. Agents Chemother. 32, 1854-1858 (1988).
論文
論文
PubMed
パブメドセントラル
Google Scholar
ビタミンB12は腸内細菌生態の調節因子である。Cell Metab. 20, 769-778 (2014).
論文
論文
PubMed
パブメドセントラル
Google Scholar
シトロバクター・フロウンディ(Citrobacter freundii)由来の1,3-プロパンジオールデヒドロゲナーゼの精製、大腸菌における対応遺伝子のクローニング、配列決定および過剰発現。J. Bacteriol. 177, 2151-2156 (1995).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Klebsiella pneumoniae由来1,3-プロパンジオールデヒドロゲナーゼ:10量体4元構造とサブユニットの協同性の可能性。J. Bacteriol. 191, 1143-1151 (2009).
論文
PubMed
Google Scholar
Clostridium pasteurianumによるグリセロールから1,3-プロパンジオールへの変換:1,3-プロパンジオールデヒドロゲナーゼをコードする遺伝子のクローニングと発現。FEMS Microbiol. Lett. 154, 337-345 (1997).
論文
論文
パブコメ
Google Scholar
肺炎桿菌1,3-プロパンジオール:NAD+オキシドレダクターゼ。J. Bacteriol. 169, 2050-2054 (1987).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Cleusix、V.、Lacroix、C.、Vollenweider、S.、Duboux、M.& Le Blay、G.腸内細菌に対するラクトバチルス・ロイテリ菌が産生するロイテリンの阻害活性スペクトル。BMC Microbiol. 7, 101 (2007).
論文
PubMed
パブメドセントラル
Google Scholar
DNA-DNAハイブリダイゼーション値と全ゲノム配列の類似性との関係。Int. J. Syst. Evol. Microbiol. 57, 81-91 (2007).
論文
CAS
パブコメ
Google Scholar
クマノミの共生:知られていることと知られていないこと. Symbiosis 10, 23-46 (1991).
Google Scholar
Korem, T. et al. 単一メタゲノムサンプルから推測される、健康と病気における腸内細菌叢の増殖ダイナミクス。Science 349, 1101-1106 (2015).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Castellani, C. et al. ロイテリンの生産、保存安定性、感受性試験、およびマウス糞便マイクロバイオームと揮発性有機化合物プロファイルへの影響。Front. Microbiol. 12, 699858 (2021).
論文
PubMed
パブメッドセントラル
Google Scholar
Zhang, J., Sturla, S., Lacroix, C. & Schwab, C. 腸内微生物による内因性アクロレイン源としてのグリセロール代謝。
論文
CAS
PubMed
パブメドセントラル
Google Scholar
アクロレインはロイテリンの抗菌活性および複素環アミン変換活性に強く寄与する。Sci. Rep. 6, 36246 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Lactobacillus reuteriとLactobacillus fermentumの比較ゲノム解析から、ロイテリンとコバラミン産生のゲノムアイランドが明らかになった。DNA Res. 15, 151-161 (2008).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Keogh, D. et al. 腸球菌の代謝産物キューは、種間ニッチ調節と多細菌感染を促進する。Cell Host Microbe 20, 493-503 (2016).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Ryu, H. W. & Wee, Y. J. アルギン酸固定化Enterococcus faecalis RKY1によるフマル酸からコハク酸へのバイオコンバージョンの特性化。Appl. Biochem. Biotechnol. 91-93, 525-535 (2001).
論文
PubMed
グーグル奨学生
マウス人工腸コンソーシアムにおけるNとCの相互摂食ネットワークの違い。
論文
PubMed
Google Scholar
乳酸菌によるクエン酸および関連酸からのコハク酸生産. Appl. Environ. Microbiol. 54, 3053-3056 (1988).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Kristjansdottir, T. et al. Lactobacillus reuteri JCM 1112の代謝再構築と細胞工場としての可能性の解析。Microb. Cell Fact. 18, 186 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Gapped BLASTとPSI-BLAST:新世代のタンパク質データベース検索プログラム。Nucleic Acids Res. 25, 3389-3402 (1997).
論文
論文
パブコメ
PubMedセントラル
Google Scholar
Cury, J., Abby, S. S., Doppelt-Azeroual, O., Néron, B. & Rocha, E. P. C. CONJscanによる結合プラスミドと統合的結合エレメントの同定。Methods Mol. Biol. 2075, 265-283 (2020).
論文
論文
パブコメ
Google Scholar
MOBscan:MOBリラクサーゼの自動アノテーション。Methods Mol. Biol. 2075, 295-308 (2020).
論文
PubMed
Google Scholar
Krueger, F. et al. FelixKrueger/TrimGalore: v0.6.10 - デフォルトの解凍パスを追加(0.6.10)。Zenodo https://doi.org/10.5281/zenodo.7598955 (2023).
MEGAHIT:超高速解凍システム。MEGAHIT: 簡潔なde Bruijnグラフによる大規模かつ複雑なメタゲノム解析のための超高速シングルノードソリューション。Bioinformatics 31, 1674-1676 (2015).
論文
論文
PubMed
Google Scholar
メタゲノムにおけるプラスミドアセンブリを改善するためのアルゴリズム。Microbiome 9, 144 (2021).
論文
論文
パブメドセントラル
Google Scholar
Bushnell, B. BBMap: 高速、高精度、スプライスを考慮したアライナー。No. LBNL-7065E (Ernest Orlando Lawrence Berkeley National Laboratory, 2014).
Li, H. et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics 25, 2078-2079 (2009).
論文
パブコメ
パブメドセントラル
Googleスカラー
3-ヒドロキシプロピオンアルデヒドおよびその誘導体の精製と構造解析。J. Agric. Food Chem. 51, 3287-3293 (2003).
論文
CAS
PubMed
Google Scholar
COPDにおけるアクロレインと酸化ストレスの関係:全身血漿中および肺局所組織中。Int. J. Chron. Obstruct. Pulmon. Dis. 14, 1527-1537 (2019).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Furman, O. et al. 食餌と年齢による決定論的効果に制約された確率性が、ルーメン微生物叢の集合ダイナミクスを駆動している。Nat. Commun. 11, 1904 (2020).
Caporaso, J. G. et al. QIIMEによる高スループットコミュニティシーケンスデータの解析。Nat. Methods 7, 335-336 (2010).
論文
論文
パブコメ
パブメッドセントラル
Google Scholar
Callahan, B. J. et al. DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat. Methods 13, 581-583 (2016).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Stevenson, D. M. & Weimer, P. J. 相対定量リアルタイムPCR法により明らかになったウシルーメンにおけるPrevotellaの優勢と古典的なルーメン細菌種の低存在。Appl. Microbiol. Biotechnol. 75, 165-174 (2007).
論文
論文
パブコメ
Google Scholar
SPAdes:新しいゲノムアセンブリーアルゴリズムとシングルセルシーケンスへの応用。J. Comput. Biol. 19, 455-477 (2012).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
ダーリン, A. C. E., マウ, B., ブラットナー, F. R. & ペルナ, N. T. モーヴ:再配列を伴う保存ゲノム配列のマルチプルアラインメント。Genome Res. 14, 1394-1403 (2004).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
Proteinortho:大規模解析における(co)オルソログの検出. BMC Bioinformatics 12, 124 (2011).
論文
PubMed
パブメドセントラル
Google Scholar
Goliand, I. et al. 3D STORMを用いた分裂細胞の細胞間ブリッジにおけるESCRT-IIIスパイラルの解明。Cell Rep. 24, 1756-1764 (2018).
論文
CAS
PubMed
Google Scholar
エンテロコッカス・フェカリス(Enterococcus faecalis)から直接プロモーターレス遺伝子の過剰発現とタグ融合タンパク質の一段階精製を可能にするpAM401ベースのシャトルベクター. Appl. Environ. Microbiol. 67, 1262-1267 (2001).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Holo, H. & Nes, I. F. 浸透圧安定化培地でグリシンを添加して培養したLactococcus lactis subsp. Appl. Environ. Microbiol. 55, 3119-3123 (1989).
論文
論文
PubMed
パブメドセントラル
Google Scholar
MZmine 2: 質量分析ベースの分子プロファイルデータの処理、可視化、解析のためのモジュラーフレームワーク。BMC Bioinformatics 11, 395 (2010).
論文
論文
パブメドセントラル
Google Scholar
Wang, M. et al. Global Natural Products Social Molecular Networkingによる質量分析データの共有とコミュニティ・キュレーション。Nat. Biotechnol. 34, 828-837 (2016).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Vieira-Silva, S. et al. 種と機能の関係がヒト腸内細菌叢の生態学的特性を形成している。Nat. Microbiol. 1, 16088 (2016).
論文
論文
PubMed
Google Scholar
Pang, Z. et al. MetaboAnalyst 5.0を用いたLC-HRMSスペクトル処理、マルチオミクス統合、グローバルメタボロミクスデータの共変量調整。Nat. Protoc. 17, 1735-1761 (2022).
論文
論文
パブコメ
Google Scholar
MetaboLights: 科学界のニーズに応えて進化するリソース。Nucleic Acids Res. 48, D440-D444 (2020).
CAS
PubMed
Google Scholar
参考文献のダウンロード
謝辞
本研究は、DIP (2476/2 -1)およびERC (866530)からI.M.に資金提供された。また、ISF (1947/19)からもI.M.およびS.M.に資金提供された。Jami(Agricultural Research Organization、イスラエル)には原稿の批評的な校正を、D. Perlmanには美しいアートワークを、I. Amitには技術的な作業を、U. Hadadの指導の下、Ilse Katz Institute for Nanoscale Science and Technology Shared Resource Facilityにはスピニングディスク共焦点顕微鏡による画像取得をお願いした。
著者情報
著者および所属
ネゲブ国立生物工学研究所、ネゲブ・ベングリオン大学、ベエル・シェバ、イスラエル
サラ・モライス、マイケル・マゾール、オマール・トヴァル=ヘレラ、タマル・ゼハヴィ、アルヴァ・ゾレア、モリヤ・イフラク、ダヴィド・ボグミル、ナタリー・エリア、エヤル・グル、イツァク・ミズラヒ
イスラエル、ベエル・シェバ、ネゲヴ・ベングリオン大学生命科学部
サラ・モライス、マイケル・マゾル、オマール・トヴァル・ヘレラ、タマル・ゼハヴィ、アルヴァ・ゾレア、デヴィッド・ボグミル、ナタリー・エリア、エヤル・ガー、イツァク・ミズラヒ
ネゲヴ・ベングリオン大学ゴールドマン・ゾンネンフェルト・サステイナビリティ・気候変動スクール(イスラエル、ベエル・シェヴァ
サラ・モライス、マイケル・マゾール、オマール・トヴァル=ヘレラ、タマル・ゼハヴィ、アルヴァ・ゾレア、デヴィッド・ボグミル、イツァク・ミズラヒ
ワイツマン科学研究所生命科学コア施設、レホボット、イスラエル
アレクサンダー・ブランディス
アイルランド、コーク、コーク大学医学部
イェンス・ウォルター
貢献
S.M.とI.M.は共同で実験を計画し、データを分析し、論文を執筆した。A.Z.とD.B.はプラスミドームのバイオインフォマティクス解析を行った。M.I.とE.G.は1,3-PD遺伝子の生化学的解析を行った。J.W.はロイテリン生産に関する専門知識を提供し、論文を批判的に読んだ。O.T.-H.およびT.Z.はメタボロームデータ解析に貢献した。A.B.はルーメンサンプルのターゲットLC-MSを実施した。N.E.はSTORM実験を実施し、データを解析した。I.M.は資金を確保し、研究を監督し、結果をまとめた。
責任著者
Itzhak Mizrahiまで。
倫理申告
競合利益
著者らは競合する利益はないと宣言している。
査読
査読情報
Nature Microbiology誌は、本研究の査読に貢献いただいた匿名査読者に感謝する。
追加情報
出版社注:Springer Natureは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
拡張データ
Extended Data 図1 1,3-PD遺伝子の多重配列アラインメント。
推定ルーメンプラスミド1,3-PD遺伝子変異体のアミノ酸配列アラインメントは、このファミリーの他の既知の酵素と高い類似性を示す。
Extended Data 図2 1-3 PDキネティクスの測定結果。
各グラフは、NAD+または1,3-PDの濃度を増加させながら、340 nmの吸光度を経時的に測定した代表的な複製を示す。
出典データ
Extended Data 図3 ルーメン・マイクロコズムのバイオマスに対するロイテリンの効果。
マイクロコズムの 16S rRNA コピーは、3 生物学的三連複について示した(実際の値を示す)。アスタリスクは、多重比較の調整なしの両側t検定によるP値0.009を示す。
出典データ
Extended Data 図4 E. faecalis株のプラスミド標識。
特異的1,3-PDプローブを用いたE. faecalis DSM 8630(陰性対照)とE. faecalis MM1のCARD-FISH。スケールバーを示す。
出典データ
Extended Data 図5 E. faecalis MM1株とDSM 8630株のゲノムおよび予測プロテオームの類似性。
DSM 8630株とMM1株のDNAコンティグの類似性。コンティグはMauveゲノムアライメントソフトウェア67を用いてアライメントした。
Extended Data 図6 L. reuteri株とE. faecalis株の近縁性アッセイ。
左図、棒グラフは培地中にロイテリンを添加したL. reuteriコロニーに対するE. faecalisコロニーの丸めた距離を示す。星印は、両側t検定のP値0.017()または0.00027()による統計的有意性を示す。右図、棒グラフは培地中にロイテリンを添加したE. faecalis株とL. reuteri株の丸みを帯びたコロニー径を示す。両パネルとも、アッセイは8生物学的3連複で行い、その実測値と中央値を示した。星印は、両側t検定によるp値<0.01 ()および<0.05 (*)の統計的有意性を示し、多重比較の調整は行わない(P値は左から0.0075、0.0031、0.0089、0.04)。
出典データ
Extended Data 図7 L. reuteriとE. faecalisによる代謝物の産生。
基礎培地(ブランク培地と比較)および互いの使用済み培地(最初に接種した菌株の使用済み培地と比較)で培養したL. reuteriおよびE. faecalisが産生した代謝物のLC-MS分析結果を、産生代謝物の倍数変化([増殖後の代謝物/増殖前の代謝物]の比が2.5以上と定義される産生倍数変化)のグラフで表したもの。すべてのLC-MS測定は生物学的3連測定で行われ、実測値、平均値、標準偏差が示されている。Y軸は代謝物の質量(m/z)、または可能な場合は注釈を示す。
ソースデータ
図8 市販の標準物質を用いたLC-MSによる交換代謝物の検証。
実験サンプルおよび標準溶液中のD-ソルビトール(A)およびアクリルアミド(B)の質量電荷比および保持時間のクロマトグラムを示す。
Extended Data 図 9 34 個のルーメンサンプル中の L. reuteri と E. faecalis の存在量間の線形回帰モデル。
データはR(バージョン4.2.1)のlm関数で線形モデルをフィッティングする前にlog10変換した。統計検定には単純線形回帰モデルを使用し、多重比較の補正は行わず、P 値は両側とした。グレーの網掛け部分は信頼区間(95%)を表す。円の大きさは1,3-PD遺伝子コピー数を表す。
出典データ
補足情報
報告の概要
補足表
補足表1. E. faecalis MM1プラスミドおよびヒト腸関連プラスミドームで同定されたプラスミドの塩基配列。表2. メタボローム生データ。表3. 健常人の糞便311検体から得られたヒト腸内プラスミドームを解析した結果、検体の17%に推定1,3-PD遺伝子を持つプラスミドが含まれていた。推定1,3-PDプラスミドを持つ遺伝子は、L. reuteriと共起している(Fisher exact検定、P < 1 × 10-5)。表4. 研究に使用したプライマー。表5. 基礎培地の調製。
ソースデータ
ソースデータ Fig.
ニューイックツリー。
ソースデータ Fig.
ソースデータ。
ソースデータ Fig.
ソースデータ。
ソースデータ Fig.
ソースデータ
ソース・データ 拡張データ Fig.
ソースデータ
ソースデータ 拡張データ Fig.
ソースデータ。
ソースデータ 拡張データ 図4
ソース画像。
ソースデータ拡張データ Fig.
ソースデータ。
ソースデータ拡張データ。
ソースデータ。
ソースデータ 拡張データ 図9
ソース・データ
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表示で別段の指示がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。素材が記事のクリエイティブ・コモンズ・ライセンスに含まれておらず、あなたの意図する利用が法的規制によって許可されていない場合、または許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートの確認 CrossMarkを経由して通貨と真正性を確認する
この記事を引用する
Moraïs,S.、Mazor,M.、Tovar-Herrera,O.他。プラスミドにコードされた毒素防御は、微生物の相互作用を媒介する。Nat Microbiol (2023). https://doi.org/10.1038/s41564-023-01521-9
引用文献のダウンロード
受領
2022年7月18日
受理
2023年10月11日
発行
2023年12月27日
DOI
https://doi.org/10.1038/s41564-023-01521-9
この記事を共有する
以下のリンクを共有すると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
細菌毒素
微生物生態学
Nature Microbiology (Nat Microbiol) ISSN 2058-5276 (オンライン)
サイトマップ
Natureポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
プロフェッショナル育成
ネイチャー・キャリア
ネイチャーコンファレンス
地域ウェブサイト
ネイチャー・アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー・イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーの選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2024 シュプリンガー・ネイチャー
この記事が気に入ったらサポートをしてみませんか?
