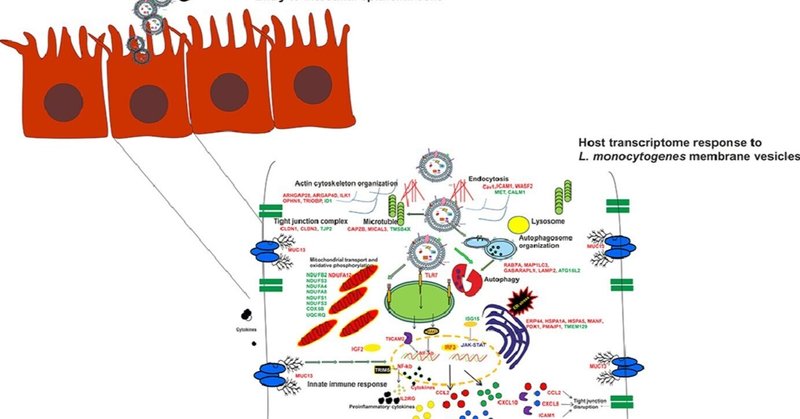
Listeria monocytogenesの膜ベシクルによって誘導される腸管上皮細胞のトランスクリプトーム反応
微生物科学における現在の研究
第4巻、2023年、100185号
Listeria monocytogenesの膜ベシクルによって誘導される腸管上皮細胞のトランスクリプトーム反応
https://www.sciencedirect.com/science/article/pii/S2666517423000068

著者リンク オーバーレイパネルを開くRaman Karthikeyan a, Pratapa Gayathri b, Subbiah Ramasamy c, Vemparthan Suvekbala d, Medicharla V. Jagannadham b, Jeyaprakash Rajendhran a
もっと見る
概要
シェア
引用元
https://doi.org/10.1016/j.crmicr.2023.100185Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
L.monocytogenesの膜小胞と相互作用したCaco-2細胞のトランスクリプトームプロファイリングを報告する。
腸管上皮細胞への膜小胞の暴露は、宿主のトランスクリプトームを広範囲に変化させた。
MVが免疫シグナル伝達経路の誘導に大きく関与していることがパスウェイ解析で確認された。
L.monocytogenesの持続に不可欠な宿主遺伝子発現の初期操作に関与する可能性のあるいくつかのノンコーディングRNA(ncRNA)を同定した。
L.monocytogenes感染時の宿主-病原体相互作用における膜小胞の役割について、より詳細な研究への道が開かれたことになる。
概要
膜小胞(MV)は、いくつかの病原性細菌において必須の病原性因子として機能している。Listeria monocytogenesによるMVの放出は最近認識されたばかりであるが、病原体形成におけるMVの謎めいた役割はまだ確立されていない。我々は、MVとL. monocytogenesに暴露されたCaco-2細胞のトランスクリプトーム応答を報告し、MV暴露の初期段階でオートファジー関連遺伝子の発現が上昇することを確認した。炎症性サイトカインの転写は、曝露4時間目にピークに達する。発現量の異なる遺伝子の配列は、アクチン細胞骨格の再配列、オートファジー、細胞周期停止、酸化ストレスの誘導と関連していた。さらに後の時点では、MVとの相互作用により、抗炎症性遺伝子の発現を調節することで、自然免疫シグナルを回避する転写プログラムが生成される。KEGGパスウェイ解析により、MVが免疫シグナル伝達経路の誘導に主に関与していることが確認された。さらに、MVは細胞周期制御遺伝子の発現を誘導し、宿主細胞の生存期間を延長させ、L. monocytogenesの複製ニッチを保護する機能を担っていると考えられる。さらに、L. monocytogenesの生存に不可欠な宿主遺伝子発現の初期制御に関与している可能性のあるノンコーディングRNA(ncRNA)を複数同定したことも特筆される。
図解抄録
ダウンロード 高解像度画像ダウンロード(218KB)
ダウンロード フルサイズ画像のダウンロード
前の記事
次の記事へ
キーワード
リステリア菌(Listeria monocytogenes
膜小胞
Caco-2細胞
RNA-seq法
シグナル伝達経路
はじめに
膜小胞(MV)は、リン脂質、タンパク質、リポ多糖(LPS)、核酸などの高分子からなる20~500 nmの二層構造である(Pathirana et al.、2016)。MVは、外側のバルジがペリプラズム膜を含む球状の芽を作り、ペプチドグリカン断片を蓄積することで排出されるプロテオリポソームです(Reviewed in Toyofuku et al.、2019)。MVは外膜(OM)由来の単一膜で構成され、OMタンパク質、リポ多糖(LPS)、その他の脂質を含み、小胞内腔は主にペリプラズムタンパク質を含む(Ellis et al, TN 2010). MVの放出は微生物に利益をもたらし、ヒト宿主との相互作用や細菌群集内の相互作用を媒介します(Bomberger et al., 2009; A Kulp and Kuehn, 2010)。細菌によるMVの合成と放出は、普遍的で広範な現象です(Toyofuku et al., 2019)。
一般に、細菌は膜をブリービングすることでMVを放出する。グラム陰性菌が産生するMVは、広く研究されている。しかし、グラム陽性菌には外膜がなく、ペプチドグリカンに富む細胞壁の剛性が小胞のブリービングを許さないという印象から、グラム陽性菌由来のMVは何十年も見過ごされてきた(Lee et al., 2009)。グラム陰性菌由来のMVは外膜小胞(OMV)と呼ばれ、グラム陽性菌由来のMVは膜小胞(MV)と呼ばれている(Avila-Calderón et al.、2015)。グラム陽性菌におけるMVの生合成を実証した報告もいくつかある(Brown et al., 2015; Toyofuku et al., 2019)。MVの細胞外環境への分泌・放出は、グラム陰性菌とグラム陽性菌で同様と思われる(Deatheragea and Cooksona, 2012)。
近年、Staphylococcus aureus、Bacillus spp.、Streptococcus spp.、Clostridium perfringens、Listeria monocytogenesなどのいくつかのグラム陽性細菌が、in vitro培養および/またはin vivoマウス感染中にMVを生成することが判明した(Thay et al., 2013; Rivera et al, 2010; Resch et al, 2016; Jiang et al, 2014; Lee et al, 2013). さらに、MVの産生は、蓄積された損傷DNAやタンパク質を除去することで、ストレス条件下で細菌を保護する働きもあります(McBroom et al., AJ 2007)。
MVに帰属する多様な機能には、病原性、バイオフィルム形成、シグナル伝達、ストレス応答、細胞毒性、および宿主病理の促進が含まれる(S Liaoら、2014;Mondalら、2016;Karthikeyanら、2020)。L. monocytogenesは、生理的ストレス下でMVを分泌する。MVの放出は、宿主との相互作用や細菌群集内での相互作用を強化することにより、病原体に利益をもたらす可能性がある[Kulp A, Kuehn MJ A 2010; Bomberger et al., 2009]。さらに、MVは、宿主の病理を変調させることができる様々なカーゴ分子を含む(Jung et al.,2016; Bielaszewska et al.,2017; Finethy et al.,2017).したがって、MVは、病原体が宿主の免疫応答を緩衝し、侵入して感染を成功裏に確立するのを助ける[Jung et al., 2016; Bielaszewska et al., 2017; Finethy et al.]
リステリア症の病因であるL. monocytogenesは、主に高い死亡率と相まって汚染された食品に関連し、依然として深刻な公衆衛生上の懸念である(Swaminathanら、B 2007; Allerbergerら、2010)。L. monocytogenesは、宿主の免疫防御機構を乗っ取って体内に取り込むことができるため、おそらくMVを利用して、この病原体をユニークな存在にしています。L. monocytogenesは、細胞感染時に1つまたは複数のステップで作用する一連の病原性エフェクターを使用します(Camejo et al.、2011)。
L.monocytogenesのMVは、病原性因子を宿主細胞に送り込むためのカーゴとして機能する可能性があります。このように、MVは病原体と宿主細胞の直接的な相互作用なしに、細菌の病原体形成に不可欠な機能を果たしている(Bielaszewska et al., 2017; Elluri et al., 2014)。我々は以前、L. monocytogenes MTCC 1143 (Serotype 4b)のプロテオーム解析を報告しました(Karthikeyan et al., 2019)。我々は以前、L. monocytogenes serotype 4bのMVがCaco-2細胞と相互作用し、その後、細胞病理学的効果を引き起こすことを証明した。本研究では、L. monocytogenes血清型1/2aのMVに曝露した際のCaco-2細胞のトランスクリプトーム応答を報告し、L. monocytogenesに感染したCaco-2細胞との応答を比較しました。
L. monocytogenesの感染に対する宿主細胞の反応を説明する研究は広く行われています(Witte et al.、2012)。我々の知る限り、L. monocytogenes由来のMVの含有量に対する宿主応答のトランスクリプトームに対応する免疫病態生理に関する発表データはない。L. monocytogenes由来のMVの役割を理解することは、この病原体の能力を実現するために不可欠である。そこで、感染中のグローバルな遺伝子応答を研究するための強固なアプローチであるRNA-Seq技術(Nie et al., 2012; Srikumar et al., 2015)を用いて、L. monocytogenes strain 10403SのMVに対するホスト細胞(Caco-2細胞)の応答を報告します。RNA-Seqは、何百万ものRNA転写物の同時配列決定を可能にするため、異なる条件下でのグローバルな遺伝子発現を特定することができます(Morozova et al., O 2008; Wang et al., 2009)。そこで、我々はRNA-Seqを用いて、MVsとの相互作用時における宿主のトランスクリプトームの変化をグローバルにマッピングしました。遺伝子発現の差分解析により、時間経過に伴う遺伝子発現の変調を明らかにし、パスウェイおよび遺伝子オントロジー解析により、相互作用中のプロセスに関する新たな知見を得ることができました。
我々は、感染の確立に不可欠な相互作用の初期段階における宿主細胞の反応に注目した。その結果、MVが誘導するシグナル伝達経路、微小管の調節障害、宿主細胞における細胞骨格ネットワークの乱れなどを認識することができた。また、L. monocytogenes感染症のバイオマーカーとなりうる新規の低分子核酸RNA(snoRNA)、マイクロRNA(miRNA)、低分子カハール体特異的RNA(scaRNA)が同定された。また、MVとの相互作用によりCaco-2細胞で発現が低下する経路をマッピングし、細胞接着、細胞骨格制御、アポトーシス、細胞外マトリックス合成を含む経路を明らかにしました。これは、L. monocytogenesのMVと腸管上皮の動的相互作用に関する初めてのトランスクリプトーム解析であり、MVに依存するL. monocytogenesの病原体に関する新しい知見を提供する。
材料と方法
細菌株と培養増殖
L. monocytogenes 10403S株(Gifted by Daniel Portney, University of California, Berkeley, USA)は、brain heart infusion agar (BHI) (Himedia; Mumbai India) を用いて37℃で定期的に培養した。
MVの単離と精製
L. monocytogenesを新鮮なBHIブロスに植え付け、37℃で一晩培養した。一晩培養した10mlを1Lの培地に移し、37℃で振盪しながら600nmの光学密度(OD600)が1.0になるまで増殖させた。6000×g、20分間、4℃での遠心分離を2回用いて細胞をペレット化した。上清を回収し、0.2μmメンブランフィルター(Millipore, Billerica, USA)で濾過した。得られた濾液をベックマン超遠心機Type45 Tiにて1,42,032×g、4℃、2時間の超遠心分離を行った。その後、ペレットを100μlのPBSに再懸濁させると、MVが沈降した。MVは、先に記載したように、スクロース密度勾配遠心分離によってさらに精製された(Kulkarniら、2014年)。簡単に言うと、等容量の70%、60%、20%のスクロースの層をポリアロマー管内で下から上に加え、MVs懸濁液を層の上部に加えました。異なるフラクションを集め、50mMリン酸緩衝液(pH7.4)で希釈し、動的光散乱(ナノパーティクルアナライザー、堀場製作所、日本からZ-100を入手)でMVsの存在を検出した。MVを含むフラクションをプールし、再びBeckman Type 60 Tiで4℃、250,000 x gで90分間超遠心分離することにより精製した。こうして得られたペレットを50mMリン酸緩衝液(pH7.4)に再構成し、さらに使用するまで-80℃で保存した。
粒径特性評価または動的光散乱(DLS)
精製したMVをPBSで希釈し、最終タンパク質濃度を0.06 µg/mlとした。サイズ分布分析を行い、波長632nmのレーザーを用いて90゜角で記録した。データは堀場製作所のソフトウェアで解析し、平均流体力学的半径を求めた。測定は25℃で各サンプル40〜50回行い、平均強度加重直径を算出した。平均直径は、3つの独立したバッチから分離されたMVについて得られたものである。
L.monocytogenesおよびMVのCaco-2細胞への曝露とRNA抽出
ヒト結腸腺がん細胞株であるCaco-2の増殖および維持は、先に記載したように行った(Karthikeyan et al.、2019)。細菌感染のために、抗生物質を含まない細胞培養液中のCaco-2細胞を、1×105細胞の濃度で6ウェルプレート(Hi-media)に播種した。次に、細胞を、感染多重度(MOI)10でL. monocytogenes 10403Sの3技術複製で感染させ、37℃、5%CO2でインキュベートした。1時間の感染期間後、感染したモノレイヤーを1mlの滅菌PBSで1回洗浄し、その時点でゲンタマイシンを添加した(50μg/ml)。さらに、37℃、5%CO2で異なる時間帯(4時間および8時間)インキュベートした。
同様に、MVの暴露については、Caco-2細胞を3つの技術的複製であるMV(10μg)で処理し、37℃、5%CO2で4時間および8時間インキュベートした。未処理の細胞はコントロールとして使用した。各時点で、細胞を洗浄し、穏やかに削り取った。次に、製造者の指示に従い、Qiagen RNeasy miniキットを用いてCaco-2細胞から全RNAを抽出した。抽出したRNAの濃度と品質は、Agilent 2100バイオアナライザーを用いて評価し、-80 ℃で保存した。
ライブラリー調製、RNA配列決定、およびデータ解析
イルミナNextSeq RNA Sample Prep Kit(バージョン3)を、RNA-Seqサンプル調製のための製造者の説明書に従って使用しました。ポリ(A)濃縮cDNAライブラリーは、Illumina NextSeqサンプル調製キット(San Diego, CA)を用いて作成し、Bioanalyzerを用いて品質と量を確認した。ペアエンドリードは、Illumina NexSeq 500プラットフォームを使用して取得した。Trimmomaticを使用して、リードから残存するイルミナアダプター配列を除去し、品質スコアが閾値を下回った場合にリードの開始または終了から塩基をトリミングした(Bolger et al.、2014)。配列品質メトリクスは、FastQCを使用して評価した。リードは、HISAT (v 2.0.10) (Kim et al., 2015) を用いて、UCSCゲノムブラウザ (http://genome.ucsc.edu) から得られたHomo sapiensゲノム (GRCh38/hg38) に独立してアライメントされました。hg38へのリードマッピング後、SAMtools(http://www.htslib.org/)を用いて、ユニークにマッピングされたリードのBAMファイルをフィルタリングした。得られたBAMファイルは、それ以降のすべてのダウンストリーム解析に使用された。
注釈付き遺伝子にアライメントされたリードは、UCSCゲノムブラウザ(Y Liao et al., 2014)からの遺伝子注釈を使用して、特徴量カウントプログラムSubreadで定量化された。一意にマッピングされたリードは、標準的な正規化手順(Love et al.、2014)に従って、条件間で有意に異なる発現を示した遺伝子の同定および定量化のためにDEseq2-Bioconductor Rパッケージに供された。FPKM(100万マッピングリードあたりの最大キロベース転写長あたりのフラグメント)の値は、生のリードカウントから各ライブラリについて計算された。正規化したカウントをrlog値に変換し、ヒートマップを作成した。DESeq2で決定された差次発現遺伝子(DEG)のリストは、保守的な絶対log2倍変化カットオフと補正p値(p<0.05)でフィルタリングされました。ヒートマップは、Heatmapper (Babicki et al., 2016)を使用して生成した。BoxplotはBoxPlotR (Spitzer et al., 2014)を用いて生成された。差次的に発現した遺伝子のリストは、さらにConsensusPathDB(Kamburovら、2013)、BionetDB(Mudunuriら、2009)、および京都遺伝子百科事典(KEGG、http://www.genome.jp/kegg/)を用いたパスウェイ情報で注釈した。
ジーンオントロジー(GO)エンリッチメント解析
DEGsリストで濃縮されたGOカテゴリは、ConsensusPathDBとDAVID (Huang et al., 2009)を用いて特定した。各比較において、アップレギュレートおよびダウンレギュレートされた遺伝子セットをConsensusPathDBおよびDAVIDに供した。p値カットオフ0.01を使用した。
KEGGパスウェイとネットワーク解析
ConsensusPathDB-Homo'sapiensを用いたKEGGパスウェイ解析により、発現差のある遺伝子リストに多く含まれるシグナル伝達経路と代謝経路を特定した。各KEGGパスウェイについて、超幾何学的検定を用いてp値を算出し、0.01をカットオフ値として、濃縮KEGGパスウェイを特定した。各時点で感染していないコントロールに対して感染細胞で2倍以上の変化があった遺伝子は、アップレギュレーションとダウンレギュレーションの遺伝子を別々に考慮して入力として使用された。
ノンコーディングRNA解析
非コードRNAとマイクロRNAは、lncRNome (http://genome.igib.res.in /lncRNome/), LNCipedia (www.lncipedia.org), miRBase (www. mirbase.org) データベースから予測した。
結果
L. monocytogenes 10403S株からのMVの精製
L. monocytogenes 10403S株をBHIブロスで37℃に培養し、培養上清から超遠心分離によりMVを単離した。電子顕微鏡写真から、L. monocytogenesのMVは球状の大きさであることが判明した。DLSで測定したところ、小胞の平均流体力学的半径は192.3 nmの大きさであった。以降の実験はすべて、この精製MVを使用して行った。
腸管上皮細胞へのMVの曝露は、宿主のトランスクリプトームを広範囲に変化させた
Caco-2細胞をMVで処理し、チャレンジ後4時間および8時間インキュベートし、生物学的に独立した3つの実験において、同じ時間帯に実施した。すべての実験のRNAの完全性を調べ、そのデータを補足図S1に示した。4時間培養後、L. monocytogenesのMVへの曝露により、合計1189の転写物が有意に変化した(>1.5倍の調節、p値<0.05、p-adj<0.05);これらのうち669がアップレギュレーション、520がダウンレギュレーションであった。8時間後、989の遺伝子が有意に変化した。そのうち、360個は発現量が増加し、629個は発現量が減少した(1.5倍以上の発現、p-value<0.05, p-adj<0.05)...。すべてのデータセットについて、MAプロットを作成し、図1に示した。FPKMの値を計算することで、未処理細胞と比較した処理細胞におけるDEGを特定した。上位50のアップレギュレーションおよびダウンレギュレーション遺伝子をSupplementary Table 1に示す。ConsensusDBおよびDAVIDを用いた遺伝子セット濃縮解析により、MVs曝露により変化する機能群が有意に濃縮された。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図1. L. monocytogenesとそのMVによる感染に対する宿主の転写応答。(A) MVを4時間曝露したCaco-2細胞における、コントロールと比較した遺伝子の差分発現を示すBland-Alman (MA) プロット。(B)MVで8時間曝露した場合(C)L. monocytogenesで4時間感染した場合(D)L. monocytogenesで8時間感染した場合。プロットはDESeq Rパッケージで作成した。
MVとの相互作用に対する上皮の反応
即時型遺伝子と遅延型遺伝子を含む一次応答遺伝子は、分化、増殖、生存、ストレス、自然および適応免疫応答、グルコース代謝など、幅広い生物学的プロセスにおいて極めて重要な役割を担っています。4時間後には、エンドサイトーシス、オートファジー、アクチン-細胞骨格再編成、細胞周期、炎症性サイトカインに属する多くの遺伝子がアップレギュレートされた。遺伝子は、生物学的機能と正規のパスウェイに従って分類された。各カテゴリーで濃縮された上位のGOタームをp値とともに図2に示す。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図2. MV曝露によりCaco-2細胞で差次的に制御される遺伝子のGene Ontology Enriched Terms。(A) MVに4時間暴露した腸管上皮Caco-2細胞で有意に制御されたパスウェイ (B) MVに8時間暴露した腸管上皮Caco-2細胞で有意に制御されたパスウェイおよびプロセス。用語はP値に従ってソートされた。
生物学的プロセスにおけるGO濃縮解析は、MVと宿主の相互作用のユニークな特徴を明らかにした。最も濃縮された初期アップレギュレーションクラスターは、エンドサイトーシス、防御反応、炎症反応などであった。一方、初期に最も濃縮されたダウンレギュレートグループは、代謝経路の制御に関与している。宿主細胞がMVに暴露されると、細胞内経路の遺伝子発現が顕著に変化する。KEGGパスウェイアノテーションによると、影響を受けたパスウェイの大部分は自然免疫応答に不可欠である(P < 0.05, Wilcox検定、Benjamini and Hochberg多重検定補正による)(図3)。侵入した微生物病原体は、Toll様受容体(TLR)、NOD様受容体(NLR)、RIG-I様受容体(RLR)などの宿主PRRによって感知され、PRRと病原体関連分子パターン(PAMPs)と呼ばれるリガンドの結合によって、微生物感染に対する宿主免疫応答の活性化が起こる。TLRおよびNLRシグナル伝達経路、ならびにサイトカイン-サイトカイン受容体相互作用およびケモカインシグナル伝達経路のDEGは、有意に濃縮されていた(表1)。自然免疫応答に関連する経路のほとんどがアップレギュレートされたのに対し、基礎的な細胞代謝経路に関わる経路は概してダウンレギュレートされた。
ダウンロード 高解像度画像ダウンロード(386KB)
ダウンロード フルサイズ画像のダウンロード
図3. MV曝露によりCaco-2細胞で制御された遺伝子のKEGGパスウェイ濃縮解析。(A)4時間で有意に制御されたパスウェイ(B)8時間で有意に制御されたパスウェイ。エンリッチメントパスウェイはq値に基づいてソートされ、有意性はウィルコックス検定で評価された。
表1. MVに曝露された宿主細胞で濃縮されたKEGGパスウェイ。
KEGG用語
説明
遺伝子
P値
hsa04668
TNFシグナル伝達経路
CXCL10、CFLAR、CXCL5、CXCL2、CXCL3、PIK3CA、CCL2、JUN、PTGS2、Creb3L1、mmp14、ICAM1、NFKBIA
0.00024414hsa04621
NOD様受容体シグナル伝達経路
CXCL2、GBP1、GBP2、CCL2、JUN、BRCC3、NFKBIA、TICAM1、CXCL3、CXCL8、NFKBIB、GABARAPL10.000488hsa04657
IL-17シグナル伝達経路
mmp13、CXCL10、CXCL5、CXCL2、CXCL3、CXL2. jun, ptgs2, hsp90b1, mmp1, cxcl8, nfkbia
0.000488
hsa04062
ケモカインシグナル伝達経路
CXCL10、CXCL5、CXCL2、CXCL3、PIK3CA、CCL2、CXCL16、NFKB、INGG5、CXCL8、NFKBIB、SOS1、SOS2
0.001709hsa05164
インフルエンザ ATMPRSS13、DDX58、CXCL10、HSPA1A、TMPRSS4、PIK3CA、CCL2、JUN、NFKBIA、NXT1、TLR7、TICAM1、ICAM1、CXCL8、NFKBIB、HSPA2
0.002686
hsa04064
NF-κBシグナル伝達経路
CSNK2A3, CFLAR, CXCL2, DDX58. ptgs2、NFKBIA、TICAM1、ICAM1、CXCL8
0.003906hsa05160
肝炎 CDDX58, EGFR, PIK3CA, NFKBIA, CLDN, CLDN3, TICAM1, CXCL8, EIF3E, SOS1, SOS2
0.004883hsa05200
がんにおけるパスウェイ
TXNRD1、MYC、TPR、MET、JUN、HSP90B1、IGF2、CALM1、EGFR、PIK3CA、RALBP1、NFKBIA、Shh、LAMC1、E2F1、LAMC2、MP1、CCDC6、GNG5、IL2RG、ptgs2、PMAIP1、CXCL8、RBX1、Cdk4、SS1、SOS2
0.006998hsa05134
レジオネラ症
HSPA1A、CXCL2、CXCL3、HSPA2、C3、NFKBIA、CXCL8、EEF1A1、EEF1A2
0.007813hsa04010
MAPKシグナル伝達経路
MYC、EGFR、HSPA1A、MET、HSPA2、JUN、CACNG8、CACNG4、EREG、AREG、Dusp5、Dusp6、IGF2、NF1、SOS1、SOS2
0.009186hsa04926
リラキシンシグナル伝達経路
mmp13, gng5, egfr, pik3ca, nfkbia, jun, creb3l1, mmp1, sos1, sos2
0.009766
hsa00230
プリン体代謝
Rrm1、Aprt、Polr2j2、Polr2、Gpole4、Polr3k、Prim1、Atic、Polr2c、Polr2d、Gart、Enpp4、Ntpcr、Polr1c、Polr2、Ipolr2j
0.005157hsa04723
逆行性エンドカンナビノイドシグナル伝達機構
NDUFA9, NDUFB2, NDUFB7, NDUFS1,NDUFS3, PLCB4, NDUFA3, NDUFA4, MapK1, NDUFA80.005859
hsa04060
サイトカイン受容体相互作用CCL2、EGFR、EDA、IL2RG、CXCL10、LIF TNFRSF11B、XCL2
0.007813HSA03050
プロテアソーム
psmb10, psmc2, pomp, psma2, psma, psmb1, psmb4, psmd14
0.007813
hsa00190
酸化的リン酸化ATP5PB、ATP6V1A、COX6B2、NDUFA3、ATP6V0D1、ATP5PO、COX5B、COX6B1、COX7B、COX8A、UQCRQ、UQCRC1、NDUFA4、UQCRFS1、NDUFA8、UQCR11、NDUFA9、NDUFB2、NDUFB7、NDUFS1、NDUFS3、ATP5F1B0. 000256
エンドサイトーシスとオートファジーの反応
MVの上皮表面への最初の付着と結合は、エンドサイトーシス経路とオートファジーへの応答を含む機能グループのGO濃縮によって観察されるように、動的なホスト応答を引き起こした。4時間後、CAV1遺伝子は非常に高い発現量(55倍)を示し、MVがカベオリンを介したエンドサイトーシスによって内在化された可能性を示唆した。宿主細胞のトランスクリプトームシグネチャーは、細胞間結合タンパク質、特に、傍細胞バリアを形成するタイトジャンクションのシール成分として機能するクローディン3(CLDN3)およびクローディン8(CLDN8)の変調も示し、寄生虫によるMVの侵入を浮き彫りにする。また、オートファジーに関与する転写産物も4時間後に有意に発現が上昇した。重要なのは、GABARAPL1、FEZ1、MAPILC3B、RAB7A、ATP6V1G1 (GO:0,006,914) が有意にアップレギュレートされたことである。8時間後の時点では、オートファジー関連遺伝子はあまり制御されておらず、オートファジーはMVsとの相互作用における宿主応答の初期段階のメカニズムである可能性が示唆された。また、オートファジー関連遺伝子の発現が停止していることから、オートファジーはMVsとの相互作用時における宿主の一次免疫反応である可能性が示唆された。
炎症性パスウェイ
遺伝子セット濃縮解析(GSEA)により、炎症、インフラマソームシグナル(Nod様受容体とTLR7を含む)、サイトカインシグナル(炎症と細胞死IL-17シグナル経路(hsa04657))を含む自然免疫反応遺伝子の発現が上昇することがわかった。発現量の多い遺伝子としては、CC motif chemokine ligand 2 (CCL2) (FC-59. 7)、C-X-Cモチーフケモカインリガンド5(CXCL5)、C-X-Cモチーフケモカインリガンド2(CXCL2)、C-X-Cモチーフケモカインリガンド3(CXCL3)、C-X-Cモチーフケモカインリガンド8(CXCL8)、C-X-Cモチーフケモカインリガンド16(CXCL16)、C-X-Cモチーフケモカインリガンド10(CXCL10)。同様に、炎症性サイトカインをコードする遺伝子の転写レベルは4時間でピークに達した。KEGGパスウェイに濃縮された発現増加遺伝子は、「サイトカイン-サイトカイン相互作用経路」(hsa04060)、NF-κBシグナル経路(hsa04064)「TNFシグナル経路」(hsa04668)とIL-17シグナル経路を含む(テーブル1)。パターン認識受容体であるTLRの発現は、宿主の免疫反応の活性化に不可欠な役割を担っています。TLR7遺伝子は、4時間の時点で明確にアップレギュレートされていることが判明した。また、8時間後には、補体系の活性化抑制に関連する遺伝子(CD55、補体崩壊促進因子)、EGFR、CCL2、XCL2(GO:0,006,954)のアップレギュレーションが観察された。腫瘍壊死因子受容体タイプ1デスドメイン(TRADD)の発現量は低下し、いくつかのサイトカイン遺伝子は初期反応と比較して有意な制御が見られなかった。
表2. MVに曝露された宿主細胞で有意に発現した生存促進経路遺伝子のリスト。
関連GO用語説明遺伝子名倍率変化P値GO:0,032,956
アクチン細胞骨格の再配列
ARF6
ARHGAP28
ARHGAP40
OPHN1
TMSB4X
TRIOBP
CAPZB
TPM3
TACSTD2
MICAL3
2.3
11.4
17.8
41.7
0.47
17.4
12.8
2.3
1.7
23.60.002523
0.00474
0.000297
0.000301
0.003534
0.003334
0.045622
0.041
0.039126
0.005866
GO:0,006,914
オートファジーGABARAPL1
MAP1LC3B
RAB7A
FEZ1
LRSAM1
TICAM1
TRIM5
PIK3CA
11.3474
2.1
9.1
29.4
10.092
3.54946
23.5817
2.34366
0.000154
0.004651
3.45E-08
8.21E-06
0.001255
0.00028
0.001425
0.005209
GO:0,045,087
免疫回避のシグナル伝達プロセスCCL2
CD55
RPS27A
SAMHD1
XCL2
TRIM15
MSRB1
RBCK141.1639
20.2412
0.363462
0.430985
5.22208
40.5199
0.374091
45.030.001415
0.032958
0.028371
0.013921
0.020581
0.003208
0.004295
0.000856
GO:0,007,049
GO:0,000,077件
GO:2,001,022
細胞周期・DNA損傷応答制御
SYF2
TRIAP1
NABP1
NUDC
NUP43
MAD2L1
MRE11
CDCA5
MNS1
MRNIP
EGFR
SMCHD114.1682
0.3893
0.257413
0.100511
8.52728
0.398981
0.285434
0.38159
10.2083
7.66825
7.72826
6.49.93E-09
0.000309
1.95E-05
0.005435
0.000821
0.000124
0.005237
0.00069
3.21E-07
0.001941
1.09E-11
4.25E-06
MVによる酸化ストレスへの応答と代謝過程
宿主細胞による活性酸素種の誘導は、細胞内病原体に対する防御の第一線となる。4時間後のCaco-2細胞のトランスクリプトームは、チオレドキシン還元酵素1(TXNRD1)、EGFR、MMP14、CFLAR、NDUFA12、ATP2A2の誘導を示した(GO:0,006,979)。一方、酸化的リン酸化にコードされる遺伝子は、ダウンレギュレーション(GO:0,006,119)ATP5PO、NDUFB2、COX5B、NDUFS1、UQCRQ、NDUFS3、NDUFA4、NDUFA8が確認された。
シグナル伝達経路に関与する遺伝子の発現の違い
KEGGアノテーションによると、シグナル伝達経路に関与するいくつかの遺伝子の発現の差(P < 0.05, Wilcox test)が観察された。特に、TNFシグナル経路、NOD様受容体シグナル経路、IL-17シグナル経路、NF-κBシグナル経路、マイトジェン活性化タンパク質キナーゼ(MAPK)シグナル経路、リラキシンシグナル経路、PI3K-Aktシグナル経路が観察された(表1)。
ノンコーディングRNA
MVに曝露したCaco-2細胞のRNAシーケンシングにより、有意に制御されたいくつかのlincRNA、microRNA、snoRNA、snRNAが明らかになりました(図4)。また、157個の宿主snoRNAが差次的に制御されていることが確認されました(補足表S2)。これらのsnoRNAは、53 H/ACAボックスタイプ(SNORD)と104 H/ACAボックスタイプ(SNORA)のグループに分類された。両タイプのsnoRNAは、MVとの相互作用により有意に発現が低下した。さらに、長鎖間非タンパク質コードRNA(lincRNA)(n = 10)、マイクロRNA(miRNA)(n = 6)、アンチセンスRNA(n = 16)、小核RNA(snRNA)(n = 13)、小カジャル体特異的RNA(SCARNA1)(n = 8)は4時間の相互作用中に有意に制御された。同様に、lincRNA(n = 4)、microRNA(n = 1)、snoRNA(n = 64)、snRNA(n = 8)は、8時間後に有意に制御された。
ダウンロード 高解像度画像ダウンロード(257KB)
ダウンロード フルサイズ画像のダウンロード
図4. MVに曝露したCaco-2細胞におけるノンコーディングRNAの制御。(A)MV感染4時間後に制御される非コードRNAの種類 (B)8時間後に制御される非コードRNAの差分。
L. monocytogenesとそのMVによって引き起こされる同様の宿主応答
L.monocytogenesに感染したCaco-2細胞では、未処理の細胞と比較して、4時間後の時点で2888遺伝子(1375個がアップレギュレート、1531個がダウンレギュレート)が差次的に発現していたが、MVに曝露したCaco-2細胞では1189(669個がアップレート、520個がダウンレート)していた(図5A)。同様に、明らかになった8時間の時点では、合計2216個の遺伝子が有意に制御された。これらのうち、727個がアップレギュレートされ、1489個がダウンレギュレートされた(>1.5倍の調節、p値<0.05、p-adj<0.05)。一方、989個の遺伝子は、MVs曝露細胞で有意に調節された。このうち、360個がアップレギュレートされ、629個がダウンレギュレートされた(>1.5倍の調節、P-value<0.05, P-adj<0.05)(Fig.5B). 全体として、560の遺伝子が4時間の時点で両方のセットで共通して制御され、一方、523の遺伝子が8時間の時点で両方のセットで共通して制御された(図5A-B)。さらに、両処理によって調節された遺伝子の明確なサブセットを用いて、パスウェイ解析を行った。その結果、MVとL. monocytogenesの両方の相互作用によってCaco-2細胞で調節される遺伝子は、共通のGO用語の濃縮を示すことが判明した。L. monocytogenesとそのMVの暴露により共通に変化した発現差遺伝子を解析したところ(補足表S3)、炎症反応、腫瘍壊死因子(TNF)に対する細胞反応、免疫反応、アポトーシス細胞シグナル、ERストレスなどに関わる遺伝子が濃縮されていた。共通するDEGは、TNFシグナル、TLRシグナル経路、核内因子-kB(NF-κB)、ケモカインシグナル、サイトカイン-サイトカイン受容体相互作用などのいくつかの正規経路に分類することができる(図6A)。結論として、これらの結果は、L. monocytogenesとそのMVの両方が、宿主細胞(Caco-2細胞)において同様の遺伝子セットと経路の発現を調節し得ることを示唆しています。
ダウンロード 高解像度画像ダウンロード(199KB)
ダウンロード フルサイズ画像のダウンロード
図5. L. monocytogenesとそのMVに感染したCaco-2細胞における遺伝子発現パターンの比較。4時間(A)および8時間(B)における共通の差次的発現遺伝子の数と分布を描いたベン図。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. L. monocytogenesとそのMVを4時間感染させたCaco-2細胞における遺伝子発現の差異を示すヒートマップ。自然免疫反応(A)、ミトコンドリア(B)、アポトーシス(C)、ノンコーディングRNA(D)のジーンオントロジー(GO)群。
L. monocytogenesとそのMVに対する異種の宿主応答
4時間後の時点で、ミトコンドリアを介した輸送、アポトーシス、免疫応答、miRNAに関連するいくつかの遺伝子は、L. monocytogenesおよびそのMVによって異なる制御を受けた。例えば、MRPL22、MRPS6、MPZL2、NDUFS3、COX5Bなどのミトコンドリアを介した輸送遺伝子は、MVへの曝露によって発現が上昇したが、これらの遺伝子はL. monocytogenesに反応して有意に発現が減少した(図6B)。同様に、CXCL2、CXCL8、ICAM1、MUC13、C13、NECTIN2、GATA6、ARF3、TIMP3、NDUF3、MSX2、NFKBIA、RPS27Aなどの自然免疫応答およびアポトーシス関連遺伝子が差動制御された(図6AおよびC)。また、いくつかのlincRNA、microRNA、snoRNA、およびsnRNAは、L. monocytogenesと比較して、MVに応答して有意にダウンレギュレートされた(図6D)。
8時間後には、NFKBIA、HIST1H2BG、HIST1H2BE、ID2などの自然免疫応答遺伝子が差次的に制御された(図7A)。同様に、細胞骨格と微小管関連遺伝子も差次的に制御されていた(図7B)。MCM6、MYC、CCNB1などの細胞周期関連遺伝子は、MV曝露に反応して発現が上昇し、L. monocytogenesで発現が低下するものが少なかった(図7C)。同様に、ミトコンドリアを介した輸送遺伝子や、いくつかのlincRNA、microRNA、snoRNA、snRNAは、差次的に制御されていた(図7D-E)。
ダウンロード 高解像度画像ダウンロード(855KB)
ダウンロード フルサイズ画像のダウンロード
図7. L. monocytogenesとそのMVを8時間感染させたCaco-2細胞における遺伝子発現の差異を示すヒートマップ。自然免疫反応(A)、アクチン-細胞骨格(B)、細胞周期(C)、ミトコンドリア(D)、ノンコーディングRNA(E)の遺伝子オントロジー(GO)群。
全体として、597個の遺伝子が、L. monocytogenes単独では発現しなかったが、MVs曝露に応答してCaco-2細胞で差次的に発現した。これらの遺伝子は、炎症反応、エンドサイトーシス、アポトーシスの正の制御を示すとともに、負の制御を示した。MVsで制御された遺伝子は、PI3k-Aktシグナル経路、MAPKシグナル経路、NOD様受容体シグナル経路、cAMPシグナル経路、TNF、NF-κBシグナル経路などの経路に分類することができる。
MVは宿主細胞の生存促進経路を調節した(表2)。
(i)
宿主細胞におけるアクチン細胞骨格の再配列
アクチン細胞骨格の再配列に関連するいくつかの遺伝子がアップレギュレートおよびダウンレギュレートされた。エンリッチメント解析により、MVが細胞骨格の破壊と再構築を誘導することが示唆された。特に、アクチンフィラメント組織化(GO:0,007,015)、アクチンフィラメントの制御(GO:0,030,832)、アクチン重合または脱重合の制御(GO:0,008,064)はGO分析により濃縮カテゴリーに含まれていました。アクチン細胞骨格の再配列に関連する遺伝子のサブセットは、MVとの相互作用によって一貫して発現が上昇した(図8)。重要なことは、アクチン細胞骨格の再配列に関連するプロセスが、アップレギュレートされた遺伝子の中で最も濃縮されていたことである。特に、ARHGAP28、ARHGAP40、ARF、TRIOBP、およびOPHN1は4時間で、CAPZB、TPM3、TRIOBP、TACSTD2、TMSB4X、およびMICAL3は8時間の時間帯でそれぞれアップレギュレーションされた。
(i)
オートファジーとゼノファジーの反応
ダウンロード 高解像度画像ダウンロード(378KB)
ダウンロード フルサイズ画像のダウンロード
図8. MV曝露に応答して、アクチン-細胞骨格再編成(GO:0,032,956)に属する発現差のある遺伝子。左パネル (A) ARF (B) ARHGAP28 (C) OPHN1(D) WASF2。赤い切り欠きは未感染コントロール、緑はテストを示す。右のパネル。MVs曝露に応答してオートファジー(GO:0,006,914)に属する差次的発現遺伝子。(a) gabarapl1 (b) fez1 (c) map1lc3b (d) rab7a。赤のノッチボックスは未感染コントロール、緑はテストを示す。
GOターム解析の結果、オートファジー関連遺伝子はMVの初期反応時に有意にアップレギュレートされ、L. monocytogenesによってダウンレギュレートされることがわかった。GABARAPL1、FEZ1、MAP1LC3B、RAB7などのオートファジーおよびゼノファジー(マクロオートファジー)関連遺伝子は、MVによる初期反応時に有意にアップレギュレーションされた(図8)。8時間後には、GABARAPL1遺伝子のみが異なる発現を示し、他のオートファジー遺伝子は有意に制御されなかったことから、MVとの相互作用に伴い、オートファゴソーム形成が劇的にリモデリングされることが示唆された。このことから、MVはL. monocytogenesの細胞内生存を促進するために、宿主細胞のオートファジーを抑制または回避することに関与している可能性が示唆された。
(i)
免疫回避シグナル
4時間後、多くのサイトカイン関連遺伝子が有意に発現していた(Fig.9 )。8時間後にはTRIM15とRBCK1の過剰発現が観察され、RBCK1の過剰発現はTAB2/3とTNFによるNF-κB活性化をネガティブに制御することができる。また、RBCK1の過剰発現は、炎症性シグナルカスケードを抑制することができる。
(i)
細胞周期とDNA損傷応答の制御
ダウンロード 高解像度画像ダウンロード(309KB)
ダウンロード フルサイズ画像のダウンロード
図9. MVs曝露に応答して発現が異なる炎症反応遺伝子。上位の発現量は、CCモチーフケモカインリガンド2(CCL2)、C-X-Cモチーフケモカインリガンド5(CXCL5)、C-X-Cモチーフケモカインリガンド2(CXCL2)、C-X-Cモチーフケモカインリガンド3(CXCL3)、C-X-Cモチーフケモカインリガンド8(CXCL8)、C-X-Cモチーフケモカインリガンド16(CXCL16)、C-X-Cモチーフケモカインリガンド10(CXCL10)のコード遺伝子だった。赤のノッチボックスは未感染のコントロール、緑はテストを示す。
MVは、SYF2、TRIAP1、NABP1、NUDC、NUP43、MAD2L1といった宿主細胞の細胞周期関連遺伝子を異なる形で制御した(図10)。チェックポイント遺伝子であるMRE11は、曝露初期に有意にダウンレギュレートされ(図10A)、細胞周期をポジティブに制御していることが示唆された。また、MRNIP、MNS1、EGFR、SMCHD1などのDNA損傷応答遺伝子は、MVs曝露時に有意にアップレギュレートされ、DNA損傷に対する劇的な応答が示唆されました。
ダウンロード 高解像度画像ダウンロード(462KB)
ダウンロード フルサイズ画像のダウンロード
図10. 細胞周期およびDNA損傷応答の制御に属する差次発現遺伝子 (GO:0,007,049), (GO:0,000,077), GO:2,001,022: (A) MRE1, (B) SYSF2 (C) CDCA5 (D) TRIAP1 (E) NABP1 (F) MAD2L1 (G) MRNIP, (H) MNS. 赤いノッチは未感染コントロール、緑はテストを示す。
ディスカション
MVの分泌は、グラム陽性菌とグラム陰性菌の両方にとって基本的なプロセスである。これらのMVは、主にDNA、タンパク質、細胞間シグナル伝達、バイオフィルム形成、ストレス応答、宿主細胞への毒素の送達、宿主細胞間の相互作用に役立っている(Bielaszewska et al.、2017)。グラム陰性菌のMVとその病原性における役割は、よく特徴付けられている(Mondal et al., 2016; Jung et al., 2016; Bielaszewska et al., 2017)。最近のデータでは、グラム陽性菌の小胞がビルレンスと関連していることが示されています。グラム陽性菌由来のMVは、グラム陰性菌由来のMVと同様に、細菌の病原性において極めて重要な役割を果たす可能性があります(Mondalら、2016;Jungら、2016;Bielaszewskaら、2017;Liuら、2018)。
グラム陽性菌によるMVの産生を証明する研究は数多くありますが、L. monocytogenesのMVの機能的特性に関する知見はまだ不足しています(Jiang et al., 2014; Kamburov et al., 2013; Karthikeyan et al., 2020)。先の研究では、L. monocytogenesが生物学的に活性なMVを分泌し、Caco-2細胞と相互作用できることを明らかにしました。また、L. monocytogenes血清型4b株のプロテオームを報告した。本研究では、L. monocytogenes血清型1/2a株からMVを精製したことを報告する。両株とも、MVは直径200 nmから300 nmの球状であった。両株のMVには、LLO、inlB、PI-PLCA、オートライシン、フラジェリンなどの主要なビルレンスファクターが観察された。我々は、MVがCaco-2細胞と相互作用し、細胞病理学的効果をもたらすことを以前に明らかにしている。そこで、L. monocytogenesのMVに暴露されると、Caco-2細胞のトランスクリプトームが徹底的に影響される可能性があると考えられました。その延長として、L. monocytogenesのMVに曝露した際の宿主細胞(Caco-2細胞)のトランスクリプトーム応答を調べ、L. monocytogenes細胞に感染したCaco-2細胞のトランスクリプトーム応答と比較しました。MVが病原体形成時に宿主の遺伝子転写の発現をどのように制御するかについては、大きな知識ギャップがあります。この問題に対処するため、我々は、MVおよび全菌体への曝露に伴う宿主の転写反応を理解するためのエビデンスを確立するために、トランスクリプトームプロファイリングを実施した。本研究では、L. monocytogenesのMVに暴露されたCaco-2細胞における遺伝子発現の変調を、病原性の正確なメカニズムとして強調した。
ヒト上皮細胞株であるCaco-2細胞は、L. monocytogenesをはじめとする細菌の病原性を調べるための感染モデルとして成功しているため、この細胞を使用しました。最近、私たちのグループは、MVとCaco-2細胞との相互作用を特徴付け、MVがアクチンを介したエンドサイトーシスを介して内在化することを実証しました(Karthikeyan et al.、2019)。生物学的プロセスにおけるGO濃縮解析により、MVsの相互作用の特徴的な特徴が明らかになった。濃縮クラスターの大部分は、エンドサイトーシス、防御応答、および炎症性応答に参加する転写物からなる。これらの転写産物は、MVsに曝露された初期段階で有意に発現が上昇した。一方、初期に最も濃縮されたダウンレギュレーショングループは、代謝経路の調節に関与していた。
MVとCaco-2細胞との相互作用の中で起こる重要な事象をトランスクリプトーム解析で同定することができた。GO濃縮解析で明らかになったように、MVsはアクチン細胞骨格ネットワークに関連する遺伝子の発現を実質的に制御していることがわかった。細胞骨格の完全性の喪失と上皮の透過性の増大は、通常、炎症の特徴である。細胞骨格の再配列や完全性の喪失は、病原体が生き残り、宿主細胞に拡散するための数多くの有益な事象につながる(Colonne et al.、2016)。さらに、オートファジー関連遺伝子は、MVとの初期の相互作用に反応して有意に発現が上昇し、曝露の後期には発現しなかった。このように、L. monocytogenesのMVは相互作用中にオートファジーを調節することに関与している可能性があるという以前の報告(Vdovikova et al.、2017)と、分子的証拠は一致している。
宿主細胞による感染因子の認識は、感染に取り組むための転写プログラムの変調をもたらす(Asrat et al.、2015)。しかし、L. monocytogenesの感染に対するPRRによる自然免疫の活性化については、まだ十分に解明されていません。また、MVの認識を媒介するパターン認識受容体も未だ不明である。本研究では、パターン認識に関与するTLR7が、MVとの相互作用によって発現が上昇することを確認した。一般に、TLRファミリーは、様々なカテゴリーの病原体関連分子を認識する。L. monocytogenesのペプチドグリカンはTLR2によって認識され(Takeda et al., 2003)、主要な病原性因子であるリステリオリジンOはTLR4のリガンドである(Jin et al., 2004)。近年、L. monocytogenesの感染に伴い、上皮細胞だけでなくマクロファージでもTLR10が制御されることが明らかになりました(Regan et al., 2013)。本研究では、L. monocytogenesのMVに応答してTLR7がアップレギュレートされることを確認した。しかし、MVからのリガンドの可能性は不明である。マウスTLR7タンパク質(ヒトのオルソログ、TLR7/8)は、樹状細胞において、ウイルス性一本鎖RNA(ssRNA)、および連鎖球菌性細菌RNAに反応することが示されている(Eigenbrodら、2015; Diebold 2008)。MVにパッケージされたRNAは、TLR7を介して宿主のシグナル伝達カスケードを活性化する可能性がある。
全体として、597個の遺伝子が、L. monocytogenes単独では発現しなかったが、MVs曝露に応答してCaco-2細胞で差次的に発現した。これらの遺伝子は、炎症反応、エンドサイトーシス、アポトーシスのポジティブな制御とネガティブな制御を示した。このような宿主細胞の発現の違いは、いくつかの理由によるものと考えられ、正確なメカニズムはまだ解明されていない。MVは、細菌の病原性を促進し、炎症反応を誘導するために、病原性因子を宿主細胞に送達するカーゴとして機能する。私たちの以前の研究では、L. monocytogenesとそのMVのグローバルプロテオーム解析により、様々な共通タンパク質が重なり合うことが示されました。また、L. monocytogenesの毒素タンパク質であるリステリオライシンO、inlB、PI-PLCAを含む多くの病原性因子がMVに濃縮されており、細菌細胞とMVにおける遺伝子発現の違いがさらに強調されていた。
同時に、LLOはMVに非常に濃縮されており、これはL. monocytogenesの病原の主要な決定要因である。LLOはアポトーシスを誘導し、高濃度は宿主細胞の急速な溶解を引き起こす可能性がある(Carrero et al., J.A. 2008; Seveau, 2014)。LLO単独で細胞を刺激すると、宿主細胞に大きな変化が生じる(Hamon et al.、2012年)。同様に、Vdokovaら(2017)の以前の報告では、L. monocytogenes由来のMVのLLOが宿主のオートファジーに必須であり、したがって宿主細胞内での細菌の生存に寄与することが示された。同様に、病原性タンパク質が濃縮されたMVは、菌体全体からの発現とは無関係に、宿主細胞の改変を引き起こす可能性があります。しかし、L. monocytogenes由来のMVも、全菌と比較して様々な細胞株で有意差を引き起こすかどうかについては、さらなる研究が必要である。L. monocytogenes由来のMVは、病原体のように宿主細胞との相互作用に必要なカーゴを備えている」。
自然免疫反応と適応免疫反応に関わる数多くの遺伝子が、MVsとの相互作用に応答して制御された。CCL2、CXCL8、CXCL5、CXCL16といった自然免疫応答の構成要素は、最も上昇した遺伝子の中にあり、炎症に関連する現象であるT細胞やマクロファージの動員を強調していた(Sokol et al., 2015)。しかし、8時間後には、これらの遺伝子は有意に制御されず、おそらく過剰な炎症を回避するためと考えられる。宿主における免疫シグナルの調節は、成功した病原体が宿主の反応を覆し、免疫反応を低反応状態に切り替えるために開発した必須戦略であることが実証されている(Gogos et al.、2000)。また、Caco-2細胞では、MVとの相互作用により、TLR、TNFR、NF-κB、Aktシグナル経路などの異なるシグナル伝達カスケードに関連する遺伝子発現の制御が確認されており、MVが様々なレベルで自然免疫系成分を調節し、宿主の反応を回避・転覆させている可能性を示しています。これまでの研究で、Caco-2細胞におけるL. monocytogenes感染に応答して、自然免疫制御遺伝子が活性化することが示されている(Baldwin et al., 2003)。また、最近の研究では、WT-L. monocytogenes感染に応答して、いくつかのサイトカインおよびケモカイン遺伝子が、gnotobioticマウスの腸内で広範囲にアップレギュレートされたことが報告されている(Lecuit et al.、2007)。本研究は、L. monocytogenesのMVが宿主細胞における免疫シグナルを誘発または活性化することを強く証明するものである。
細胞内病原体が感染時にニッチを確立するために開発した戦略は、宿主細胞の損傷と細胞周期を有利に制御する能力である。MVは、細胞サイクリンやCDKなどの細胞周期制御遺伝子の発現を増加させ、L. monocytogenesの宿主細胞の生存率を高めると考えられる。また、DNA損傷応答遺伝子MRE11の発現低下も観察された。これらの結果は、リステリオライシンOがmre11を分解し、細菌の複製を促進することを示した過去の報告(Samba-Louaka et al.、2014)と裏付けられます。したがって、MVに濃縮されたリステリオライシンOは、宿主細胞と相互作用してDNA損傷応答の調節不全を促進すると考えられる。同様に、MVsとの相互作用に応じた細胞周期関連遺伝子のアップレギュレーションは、宿主細胞の生存を促進し、ひいてはL. monocytogenesの複製ニッチを保持するための戦略である可能性もある。
また、MVとの相互作用により、lincRNA、microRNA、snoRNA、snRNAが制御されることも重要な観察結果である。宿主細胞における細胞内病原体の生存は、宿主の遺伝子発現を制御することによるいくつかの細胞機能の変調に依存する(Mumtaz et al.、2017)。宿主のトランスクリプトームの操作は、病原体の細胞内ライフサイクルに対する選択的優位性として機能する。我々の知見は、MVが細胞機能に干渉するように見えるだけでなく、感染後期の宿主細胞機能に広範な影響を与える可能性のあるいくつかの転写および転写後調節要素の変化を促進することを示唆しています。そのような例として、生理的および病理的反応において制御的役割に関与するいくつかのノンコーディングRNAの発現差が挙げられる(Kaakoush et al.、2015)。MVとの相互作用に伴ういくつかのncRNAのダウンレギュレーションは、MVとの相互作用におけるこのクラスのRNAの役割について興味深い疑問を投げかける。ncRNAに関するいくつかの報告では、細胞内病原体が使用する制御RNAが、免疫応答を生き延び、回避することを助ける可能性が示唆された(Kaakoush et al., 2015; Bayer-Santos et al., 2017)。総じて、L. monocytogenesのMV内に取り込まれたペプチド/タンパク質は、宿主の免疫応答を調節するための主要な責任因子であると言えます。
結論として、本研究では、L. monocytogenesのMVと相互作用したCaco-2細胞のトランスクリプトームプロファイリングを採用しました。RNA-Seqデータは、相互作用中の宿主免疫細胞経路の動的変化を確認し、MVsを介した宿主応答を理解するための手がかりを与えている。さらに、MVは細胞周期制御遺伝子の発現を誘導し、その結果、宿主細胞の生存期間を延長させ、L. monocytogenesの複製ニッチを豊かにする可能性があります。また、いくつかのノンコーディングRNA(ncRNA)の発現が有意に低下していることから、MVによって宿主の遺伝子発現が早期に操作されることが示唆されました。この結果は、宿主と病原体の相互作用におけるMVの独占的な役割を理解するための、より詳細な研究の道を開くものであった。
CRediTの著者による貢献声明
Raman Karthikeyan:概念化、方法論、形式的分析、検証、執筆(原案)。Pratapa Gayathri:方法論、形式的解析。Subbiah Ramasamy: 方法論、形式分析。Vemparthan Suvekbala: 形式的分析、執筆-レビューと編集。Medicharla V. Jagannadham: 概念化、執筆-レビューと編集。ジェヤプラカシュ・ラジェンドラン 概念化、調査、執筆 - 査読と編集。
競合する利害関係の宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的な関係がないことを宣言するものである。
謝辞
著者らは、財政的支援(UGC-MRP 41-1143/2012(SR))を提供したUniversity Grants Commission, New Delhi, Indiaに感謝する。RKはUGC-BSRからUGC-Meritorious Fellowshipを授与されたことに感謝する。RKは、RNA-Seqデータ解析に協力してくれたT.Elanthendral氏に感謝する。RKは、原稿の編集に協力してくれたNIHのThirupugal Govindarajan博士に感謝したい。CCMB、ハイデラバードの機器設備に感謝する。また、マドゥライ・カマラージ大学生物科学部のUGCNRCBS、DST-FIST、DST-PURSE、MKU-RUSAプログラムにも感謝します。
付録 補足資料
すべての補足資料をダウンロードする
これは何ですか?
ダウンロード: スプレッドシートのダウンロード (20KB)
ダウンロード スプレッドシートのダウンロード (31KB)
ダウンロード 表計算ソフトのダウンロード(130KB)
おすすめ記事
データ提供について
データはリクエストに応じて提供します。
参考文献
アラーベルガーとワグナー, 2010
F. アラーバーガー、M.ワグナー
リステリア症:復活した食品由来感染症
Clin. Microbiol. Infect., 16 (2010), pp.16-23, 10.1111/j.1469-0691.2009.03109.x
PDFを見る記事を見るScopusGoogle Scholarで見る
アスラットら、2015
S. アスラット、K.M.デイビス、R.R.イズバーグ
転移してきた細菌タンパク質による宿主の自然免疫・炎症反応の変調
セル. Microbiol., 17 (2015), pp.785-795, 10.1111/cmi.12445
Scopusで見るGoogle Scholar
アビラ=カルデロンら、2015年
E.D. Avila-Calderón, M.G. Araiza-Villanueva, J.C. Cancino-Diaz, E.O. LópezVillegas, N. Sriranganathan, S.M. Boyle, A. Contreras-Rodríguez
細菌膜小胞の役割
Arch. Microbiol., 197 (1) (2015), pp.1-10, 10.1007/s00203-014-1042-7
グーグル・スカラー
ボールドウィンら、2003
D.N. Baldwin, V. Vanchinathan, P.O. Brown, J.A. Theriot
Listeria monocytogenes感染に対する培養腸管上皮細胞の自然免疫応答を反映した遺伝子発現プログラム
ゲノムバイオロジー, 4 (2003), p. R2
ScopusGoogleスカラーで見る
ボンバーガーら, 2009
J.M. Bomberger, D.P. MacEachran, B.A. Coutermarsh, S. Ye, G.A. O'Toole, B.A. Stanton
緑膿菌外膜ベシクルによる病原性因子の長距離輸送
PLoS Pathog., 5 (2009), p. 4, 10.1371/journal.ppat.1000382
グーグル・スカラー
ブラウンら、2015
L. ブラウン、J.M.ウルフ、R.プラドス-ロサレス、A.カサデヴァル
壁を通して:グラム陽性菌、マイコバクテリア、真菌の細胞外小胞
Nat. Rev. Microbiol., 13 (2015), pp. 620-630, 10.1038/nrmicro3480
スコープスで見るGoogle Scholar
ビエラシェフカら、2017年
M. ビエラシェフスカ、C.リューター、A.バウエンス、L.グリューネ、K.A.ヤロッシュ、D.シュタイル、W.チャン、X.ヘ、R.ルルーベス、A.フルート、キム・ケイス、M.A.シュミット、ウ・ドゥブリント、A.メルン、ヒル・カーチ
腸管出血性大腸菌O157の外膜小胞関連病原因子の宿主細胞間相互作用:細胞内送達、トラフィッキングおよび細胞傷害の機構
PLoS Pathog., 13 (2017), Article e1006159, 10.1371/journal.ppat.1006159
ScopusGoogleスカラーで見る
ボルジャーら、2014
A.M.ボルジャー、M.ローゼ、B.ウサデル
Trimmomatic:イルミナ配列データ用の柔軟なトリマー
バイオインフォマティクス, 30 (2014), pp.2114-2120, 10.1093/bioinformatics/btu170
Scopusで見るGoogle Scholar
バビッキら、2016
S. バビッキ、D. アーント、A. マルク、Y. リャン、J.R. グラント、A. マキジェフスキ、D.S. ウィシャート
Heatmapper:すべての人のためのウェブ対応ヒートマッピング
Nucleic Acids Res., 11 (2016), p.121, 10.1093/nar/gkw419
グーグル・スカラー
バイエル・サントスら、2017年
E. バイエル=サントス、M.M.マリーニ、J.F.ダ・シルヴェイラ
宿主と病原体の相互作用におけるノンコーディングRNA:原虫寄生虫による哺乳類細胞機能の転覆
Front. Microbiol., 8 (2017), p. 474, 10.3389/fmicb.2017.00474
Scopusで見るGoogle Scholar
カレロら、2008
Carrero, J.A., Vivanco-Cid, H., Unanue, E.R., 2008. リステリオライシンOによるT細胞のアポトーシスは、グランザイムによって急速に進行する。J. Immunol. https://doi.org/181/2/1365 [pii].
Google Scholar
カメホら、2011
A. カメホ、F.カルバーリョ、O.レイス、E.レイタン、S.ソウザ、D.カバネス
Listeria monocytogenesが細胞感染サイクルを促進するために展開する病原性因子のアーセナル(武器)。
Virulence, 5 (2011), pp.379-394, 10.4161/viru.2.5.17703
Scopusで見るGoogle Scholar
コロンヌら、2016
P.M.コロンヌ、C.G.ウィンチェル、D.E.ヴォート
宿主細胞のハイウェイを乗っ取る:偏性細胞内細菌病原体による宿主のアクチン細胞骨格の操り方
Front. Cell. Infect. Microbiol., 6 (2016), p. 107, 10.3389/fcimb.2016.00107
スコープスで見るGoogle Scholar
デアテラギアとクックソナ、2012年
B.L.デアテラギア、B.T.クックソナ
細菌、真核生物、古細菌における膜小胞放出:微生物生活の保存されているが過小評価されている側面
Infect. Immun. (2012), 10.1128/iai.06014-11
Google Scholar
ディボルド、2008
S.S. Diebold
Toll様受容体によるウイルス性一本鎖RNAの認識
Adv. Drug Deliv. Rev., 60 (2008), pp. 813-823, 10.1016/j.addr.2007.11.004
PDFを見る記事を見るScopusGoogle Scholarで見る
エリスとキューン, 2010
T.N. エリス, M.J. キューン
細菌外膜小胞の病原性と免疫調節の役割
Microbiol. Mol. Biol. Rev., 74 (2010), pp. 81-94, 10.1128/mmbr.00031-09
ScopusGoogleスカラーで見る
アイゲンブロッドら、2015年
T. アイゲンブロッド、K.ペルカ、E.ラッツ、B.クライケマイヤー、A.H.ダルプケ
TLR8はヒト単球の細菌性RNAを感知し、Streptococcus pyogenesの認識に対して非冗長な役割を果たす
J. Immunol., 195 (2015), pp.1092-1099, 10.4049/jimmunol.1403173
スコープスで見るGoogle Scholar
エルリら、2014
S. エルリ、C.エノウ、S.ヴドヴィコヴァ、P.K.ロンプクンタール、M.ドングル、S.カールソン、A.パル、B.E.ウリン、S.N.ワイアウ
外膜小胞がコレラ菌の生物学的に活性なVibrio cholerae cytolysin(VCC)の輸送を媒介する。
PLoS ONE, 9 (2014), Article e106731, 10.1371/journal.pone.0106731
Scopusで見るGoogle Scholar
フィネティら、2017年
R. Finethy、S. Luoma、N. Orench-Rivera、E.M. Feeley、A.K. Haldar、M. Yamamoto、T. D. Kanneganti、M. J. Kuehn、 J. Coers
細菌外膜小胞によるインフラマソーム活性化にはグアニル酸結合タンパク質が必要である
MBio, 8 (2017), p.5, 10.1128/mBio.01188-17
グーグル・スカラー
ゴゴスら、2000
C.A.ゴゴス、E.ドロソウ、H.P.バサリス、A.スクーテリス
重症敗血症患者における炎症性サイトカイン・プロファイル:予後および将来の治療オプションの指標となる。
J. Infect. Dis., 181 (2000), pp.176-180, 10.1086/315214
Scopusで見るGoogle Scholar
ハモンら、2012
M.A. ハモン、D. リベ、F. スタヴル、P. コサール
リステリオライシンO:リステリア菌のスイスアーミーナイフ
トレンドマイクロバイオル, 20 (8) (2012), pp.360-368
PDFを見る記事を見るScopusGoogle Scholarで見る
ホアンら、2009
D.W. Huang, B.T. Sherman, R.A. Lempicki
DAVIDバイオインフォマティクスリソースを用いた大規模遺伝子リストの系統的・統合的解析
Nat. プロトコール, 4 (2009), p.44, 10.1038/nprot.2008.211
スコープスで見るGoogle Scholar
ジアンら、2014
Y. ジアン、Q. コン、K.L. ローランド、R. カーティス
クロストリジウム・ペルフリンゲンスA型株の膜小胞は自然免疫と適応免疫を誘導する
Int. J. Med. Microbiol., 304 (2014), pp.431-443, 10.1016/j.ijmm.2014.02.006
PDFを見る記事を見るScopusGoogle Scholarで見る
ユングら、2016
A.L.ユング、C.ストイバー、C.E.ヘルクト、C.シュルツ、W.ベルトラムス、B.シュメック
Legionella pneumophila由来の外膜小胞はマクロファージでの細菌複製を促進する
PLoS Pathog, 12 (2016), Article e1005592, 10.1371/journal.ppat.1005592
Scopusで見るGoogle Scholar
ジンら、2004
M.P. Jin, V.H. Ng, S. Maeda, R.F. Rest, M. Karin.
アントロイシンOおよび他のグラム陽性サイトリジンはtoll-like receptor 4アゴニストである。
J. Exp. Med., 20 (2004), pp. 1647-1655, 10.1084/jem.20041215
Scopusで見るGoogle Scholar
クルカルニら、2014年
H.M. Kulkarni、C.V.B. Swamy、M.V. Jagannadham
南極細菌Pseudomonas syringaeの外膜小胞の分子特性および機能解析は、環境条件への応答の可能性を示唆する
J. Proteome Res., 13 (2014), pp.1345-1358, 10.1021/pr4009223
Scopusで見るGoogle Scholar
カンブーロフら、2013
A. カンブーロフ、U.シュテルツル、H.レーラッハ、R.ハーウィグ
ConsensusPathDB相互作用データベース:2013年最新版
Nucleic Acids Res., 41 (2013), pp. D793-D800, 10.1093/nar/gks1055
スコープスで見るGoogle Scholar
キムら、2015
D. キム、B. ラングミード、S.L. サルツバーグ
HISAT: 低メモリ要件の高速スプライシングアライナー
Nat. メソッズ, 12 (2015), p.357, 10.1038/nmeth.3317
Scopusで見るGoogle Scholar
カアコウシュら、2015
N.O. Kaakoush, N.P. Deshpande, S.M. Man, J.A. Burgos-Portugal, F.A. Khattak, M.J. Raftery, M.R. Wilkins, H.M. Mitchell
トランスクリプトームおよびプロテオーム解析により、消化管病原体Campylobacter concisusに対する宿主応答における主要な自然免疫シグネチャーが明らかになった。
Infect. Immun., 83 (2015), pp.832-845, 10.1128/IAI.03012-14
スコープスで見るGoogle Scholar
カーティケヤンら、2020年
R. カーティケヤン、P・ガヤトリ、P・グナセカラン、M・V・ジャガンナダム、J・ラジェンドラン
Listeria monocytogenesの膜小胞の機能解析から、病原性と生理的ストレス応答における役割の可能性が示唆される
Microb. Pathog., 142 (2020), Article 104076
PDFを見る記事を見るScopusGoogle Scholarで見る
カーティケヤンら、2019年
R. カーティケヤン、P・ガヤトリ、P・グナセカラン、M・V・ジャガンナダム、J・ラジェンドラン
Listeria monocytogenes serotype 4bの膜小胞の包括的プロテオーム解析と病原性の役割から、病原性に関連するタンパク質と宿主との相互作用の可能性が明らかになった
Int. J. Med. Microbiol., 309 (2019), pp.199-212, 10.1016/j.ijmm.2019.03.008
PDFを見る記事を見るScopusGoogle Scholarで見る
クルプとキューン、2010年
A. クルプ、M.J.キューン
分泌型細菌外膜ベシクルの生物学的機能と生合成
Annu. Rev. Microbiol., 64 (2010), pp. 163-184, 10.1146/annurev.micro.091208.073413
Scopusで見るGoogle Scholar
レキュイら、2007
M. ルキュイ、J.L.ソネンブルグ、P.コサール、J.I.ゴードン
ヒト化したグノトビオティックマウスモデルにおける食中毒菌に対する腸の反応に関する機能ゲノム学的研究
J. Biol. Chem., 282 (2007), pp.15065-15072, 10.1074/jbc.M610926200
PDFを見る記事を見るScopusGoogle Scholarで見る
リューら、2018
Y. リュー、K.A.Y.デフォーニー、E.J.スミッド、T.アビー
グラム陽性菌の細胞外小胞と健康・病気への影響
Front. Microbiol., 9 (2018), p. 1502, 10.3389/fmicb.2018.01502
Scopusで見るGoogle Scholar
リーら、2009
E.Y. Lee, D.Y. Choi, D.K. Kim, J.W. Kim, J.O. Park, S. Kim, S.H. Kim, D.M. Desiderio, Y.K. Kim, K.P. Kim, Y.S.Gho
グラム陽性菌は膜小胞を産生する:Staphylococcus aureus由来膜小胞のプロテオミクスに基づく特徴づけ
プロテオミクス, 9 (2009), pp.5425-5436, 10.1002/pmic.200900338
Scopusで見るGoogle Scholar
リャオら、2014a
Y. リャオ、G.K.スマイス、W.シー
FeatureCounts: ゲノムの特徴にシーケンスリードを割り当てるための効率的な一般目的プログラム
バイオインフォマティクス, 30 (2014), pp.923-930, 10.1093/bioinformatics/btt656
Scopusで見るGoogle Scholar
ラブら、2014
M.I.ラブ、W.フーバー、S.アンダース
DESeq2によるRNA-seqデータのフォールドチェンジと分散のモデレート推定
ゲノムバイオロジー, 15 (2014), p.550, 10.1186/s13059-014-0550-8
Scopusで見るGoogle Scholar
リーら、2013
J.H. Lee, C.W. Choi, T. Lee, S.I. Kim, J.C. Lee, J.H. Shin.
転写因子σBはListeria monocytogenesの細胞外膜由来ベシクルの生産に重要な役割を果たす
PLoS ONE, 8 (2013), p. e73196, 10.1371/journal.pone.0073196
Scopusで見るGoogle Scholar
リャオら、2014b
S. リャオ、M.I.クライン、K.P.ハイム、Y.ファン、J.P.ビトゥーン、S.J.アーン、R.A.バーネ、H.クー、L.J.ブラディ、Z.T.ウエン
Streptococcus mutansの細胞外DNAはバイオフィルムでの増殖中にアップレギュレートされ、膜小胞を介して活発に放出され、タンパク質分泌装置の構成要素によって影響を受ける。
J. Bacteriol.、196 (2014), pp.2355-2366, 10.1128/JB.01493-14
スコープスで見るGoogle Scholar
マクブルームとキューン, 2007
A.J.マクブルーム、M.J.キューン
グラム陰性菌による外膜小胞の放出は、新規のエンベロープストレス応答である
Mol. Microbiol., 63 (2007), pp.545-558, 10.1111/j.1365-2958.2006.05522.x.6
スコープスで見るGoogle Scholar
モンダルら、2016
A. モンダル、R.タペーダー、N.S.チャタジー、A.ゴーシュ、R.シンハ、H.コーリー、D.R.サハ、M.K.チャクラバルティ、S.N.ワイ、A.パール
Vibrio choleraeの外膜小胞に結合した生物学的活性プロテアーゼが引き起こす細胞毒性および炎症性反応
Infect. Immun., 84 (2016), pp.1478-1490, 10.1128/IAI.01365-15
スコープスで見るGoogle Scholar
モロゾワとマーラ、2008
O. モロゾワ、M.A.マッラ
機能性ゲノミクスにおける次世代シーケンサー技術の応用
ゲノミクス, 92 (2008), pp.255-264, 10.1016/j.ygeno.2008.07.001
PDFを見る記事を見るScopusGoogle Scholarで見る
ムムタズら、2017
P.T. Mumtaz, S.A. Bhat, S.M. Ahmad, M.A. Dar, R. Ahmed, U. Urwat, A. Ayaz, D. Shrivastava, R. A. Shah, N. A. Ganai
LncRNAと免疫:宿主病原体相互作用の監視役
Biol. Proced. オンライン., 19 (2017), p.3, 10.1186/s12575-017-0052-7
Scopusで見るGoogle Scholar
ムドゥヌリら、2009年
U. ムドゥヌリ、A.チェ、M.イ、R.Mスティーブンズ
bioDBnet: 生物学的データベースネットワーク
バイオインフォマティクス, 25 (2009), pp.555-556, 10.1093/bioinformatics/btn654
Scopusで見るGoogle Scholar
Nieら、2012
Q. Nie, E.E. Sandford, X. Zhang, L.K. Nolan, S.J. Lamont
鳥類病原性大腸菌(APEC)感染に反応した鶏脾臓のディープシーケンスに基づくトランスクリプトーム解析
PLoS ONE, 7 (2012), p. e41645, 10.1371/journal.pone.0041645
Scopusで見るGoogle Scholar
パティラナとカパラキス-リアスコス、2016年
R.D.パティラナ、M.カパラキス-リアスコス
細菌膜小胞:生合成、免疫制御、病原性
セル. Microbiol., 18 (2016), pp.1518-1524, 10.1111/cmi.12658
スコープスで見るGoogle Scholar
リーガンら、2013年
T. リーガン、K. ナリー、R. カーモディ、A. ヒューストン、F. シャナハン、J. マクシャリー、E. ブリント
腸管上皮細胞およびマクロファージにおけるリステリア菌に対する炎症反応の主要メディエーターとしてのTLR10の同定
J. Immunol., 191 (2013), pp. 6084-6092, 10.4049/jimmunol.1203245
Scopusで見るGoogle Scholar
リベラら、2010年
J. リベラ、R.J.B. コルデロ、A.S. ナコウジ、S. フラセス、A. ニコラ、A. カサデバール
炭疽菌は生物学的に活性な毒素を含む膜由来小胞を産生する
Proc. Natl. Acad. Sci. U. S. A., 107 (2010), pp. 19002-19007, 10.1073/pnas.1008843107
スコープスで見るGoogle Scholar
レッシュら、2016
U. レッシュ、J.A.ツァザロニス、A.ルラン、G.シュトゥビガー、M.ローデ、S.カスバンディク、S.ホルツマイスター、Pティンネフェルト、S.N.ワイ、Eシャルペンティア
A群連鎖球菌の細胞外膜由来ベシクル産生に影響を与える2成分制御システム
MBio, 7 (2016), pp.e00207-e00216, 10.1128/mbio.00207-16
グーグル・スカラー
スワミナサン、2007年
B. スワミナサン
ゲルナー・スミット・P. ヒトリステリア症の疫学
Microbes Infect., 10 (2007), pp.1236-1243, 10.1016/j.micinf.2007.05.011
PDFを見る記事を見るScopusGoogle Scholarで見る
スリックマールら、2015
S. Srikumar, C. Kröger, M. Hébrard, A. Colgan, S.V. Owen, S.K. Sivasankaran, A.D.S. Cameron, K. Hokamp, J.C.D. Hinton
RNA-seqによりSalmonella Typhimuriumのマクロファージ内トランスクリプトームに新たな知見がもたらされる
PLoS Pathog, 1 (2015), Article e1005262, 10.1371/journal.ppat.1005262
Scopusで見るGoogle Scholar
スピッツァーら、2014年
M. スピッツァー、J.ヴィルデンハイン、J.ラプシルバー、M.タイアーズ
BoxPlotR: 箱型プロット生成のためのウェブツール
Nat. メソッズ, 11 (2014), p.121, 10.1038/nmeth.2811
Scopusで見るGoogle Scholar
ソコルおよびラスター、2015
C.L.ソコル、A.D.ラスター
自然免疫におけるケモカイン系
コールドスプリングハーブ Perspect. Biol., 7 (2015), Article a016303, 10.1101/cshperspect.a016303
グーグル・スカラー
サンバ・ルアカら、2014年
A. サンバ=ルアカ、J.M.ペレイラ、M.A.ナホリ、V.ヴィリエ、L.デリアーノ、M.A.ハモン、P.コサルト
リステリア菌はDNA損傷応答を減衰させる
PLoS Pathog, 10 (2014), Article e1004470, 10.1371/journal.ppat.1004470
グーグル・スカラー
セヴォー、2014年
S. セヴォー(Seveau
Listeria monocytogenesのコレステロール依存性サイトリジンであるリステリオライシンOの多面的な活性について
サブセル.Biochem. (2014), 10.1007/978-94-017-8881-6_9
グーグル・スカラー
武田ら、2003
K. タケダ、カイショウ、アキラ、S.
トールライク受容体
Annu. Rev. Immunol., 21 (2003), pp. 335-376, 10.1146/annurev.immunol.21.120601.141126
Scopusで見るGoogle Scholar
テイら、2013
B. テイ、S.N.ワイ、J.オスカルソン
黄色ブドウ球菌α-毒素依存的な膜由来ベシクルによる宿主細胞死の誘導
PLoS ONE, 8 (2013), p. 1, 10.1371/journal.pone.0054661
グーグル・スカラー
豊福ら、2019
M. 豊福、野村直樹、L.エバール
細菌膜小胞の種類と起源
Nat. Rev. Microbiol., 17 (2019), pp. 13-24, 10.1038/s41579-018-0112-2
Scopusで見るGoogle Scholar
ヴドヴィコヴァら、2017年
S. ヴドヴィコヴァ、M.ルアー、P.ザライ、L.N.スカルマン、M.K.フランシス、R.ルンドマーク、N.エンゲダル、ワイSNヨハンソン
オートファジーの阻害と細胞死におけるリステリア菌膜小胞の新たな役割
Front. Cell. Infect. Microbiol., 7 (2017), p.154, 10.3389/fcimb.2017.00154
スコープスで見るGoogle Scholar
ウィッテら、2012
C.E. Witte, K.A. Archer, C.S. Rae, J.D. Sauer, J.J. Woodward, D.A. Portnoy
リステリア菌が引き起こす自然免疫経路と細胞媒介免疫の誘導におけるその役割
アドバンスト・イムノル, 113 (2012), pp.135-156, 10.1016/B978-0-12-394590-7.00002-6
PDFを見る記事を見るScopusGoogle Scholarで見る
Wangら、2009年
Z. ワン、M.ガースタイン、M.スナイダー
RNA-Seq:トランスクリプトミクスのための革命的ツール
Nat. Rev. Genet., 10 (2009), p. 57, 10.1038/nrg2484
Google Scholar
引用者: (0)
© 2023 The Authors. 発行:エルゼビアB.V.
ScienceDirectについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、Cookieの使用に同意することになります。
Copyright © 2023 Elsevier B.V.またはそのライセンサーもしくは寄稿者。ScienceDirect® はElsevier B.V.の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
