胃内細菌叢の異常とヘリコバクター・ピロリ感染症
0total views
記事を見る インパクト
MINI REVIEWの記事
Front. マイクロビオール、2023年3月30日
第2回 脊椎動物の消化器官における微生物について
第14巻~2023年|https://doi.org/10.3389/fmicb.2023.1153269
この記事は、「研究テーマ」の一部です。
胃内細菌叢の異常と胃疾患
すべての記事を見る
胃内細菌叢の異常とヘリコバクター・ピロリ感染症


張玲、趙明*、傅祥生*の各氏。
成都医科大学第一付属病院臨床医科大学消化器科(中国四川省成都市
ヘリコバクター・ピロリ(H. pylori)感染は、胃疾患の最も一般的な原因の1つである。世界中で抗生物質耐性が持続的に増加しているため、ピロリ菌の除菌は臨床医にとって困難なものとなっています。胃は無菌状態であり、独特のニッチを持つのが特徴である。胃内の微生物間のコミュニケーションは、多様な微生物のフィットネス、集団動態、機能的能力をもたらし、それはポジティブ、ネガティブ、またはニュートラルである可能性がある。ここでは、胃のミクロ生態学とそのアンバランス、そして胃の病気について概説する。さらに、ピロリ菌と非ピロリ菌、真菌、ウイルスなどの胃内マイクロエコロジーとの関係、プロバイオティクス、プレバイオティクス、ポストバイオティクス、シンバイオティクス、マイクロバイオータ移植などの胃内マイクロエコロジー調節によるピロリ菌除菌を促進する可能性をまとめる。
はじめに
胃は、その酸性pHと蠕動運動から、歴史的に無菌の臓器であると考えられていた。しかし、ヘリコバクター・ピロリ(H. pylori)が発見され、この仮定は修正されました。H. pyloriは、主に人間の胃に定着するグラム陰性細菌です(Marshall and Warren, 1984)。H.ピロリ感染者の大部分は無症状のままですが、慢性感染は慢性胃炎、消化性潰瘍疾患、胃がん(GC)、粘膜関連リンパ組織リンパ腫と強い相関があります(Peek and Blaser, 2002; Tsai and Hsu, 2010; Wang et al., 2014)。また、H. pylori感染は、自己免疫疾患、特発性血小板減少性紫斑病、鉄欠乏性貧血、心血管・脳血管疾患などの消化管外(GI)疾患と関連しています(Santos et al.、2020)。H. pyloriのコロニー形成と病原性は、ウレアーゼ、アドヘシン、外膜タンパク質、好中球活性化タンパク質A、細胞毒素関連遺伝子A(CagA)、液胞細胞毒素A(VacA)、IV型分泌系(T4SS)などの複数の要因によって影響を受けます(Kronsteiner et al.,2016) 。除菌レジメンの成功と衛生環境の改善により、H. pyloriの有病率は世界的に、特に先進国で減少しています(Burucoa and Axon, 2017; Hooi et al.、2017)。しかし、抗生物質耐性の増加により、ピロリ菌の治療効果の大幅な低下が指摘されており、新たな治療戦略の開発が重要となっています(Megraud et al., 2021; Tshibangu-Kabamba and Yamaoka, 2021)。
マイクロバイオームは、人体の生息環境に存在する細菌、真菌、ウイルスからなる複雑な微生物群集であり、強いニッチ特殊性を持っています(Human Microbiome Project Consortium, 2012)。全ゲノム16SリボソームRNA(rRNA)配列決定やメタゲノミクス、トランスクリプトミクス、プロテオミクス、メタボロミクス研究(Barra et al., 2021)などの分子技術により、胃の微環境の理解が進んでいます。胃ニッチは、食事、抗生物質、ヒスタミン2型(H2)拮抗薬、プロトンポンプ阻害薬(PPI)、プロバイオティクス、ピロリ菌感染など、さまざまな要因によって調節されています(Sterbini et al., 2016; Brawner et al., 2017)。H.ピロリ菌と他の微生物群集は、特有の胃の微小生態環境内で複雑な相互作用を有している。本レビューでは、H. pyloriと他の微生物の関係に焦点を当てます。胃のマイクロエコロジー形成
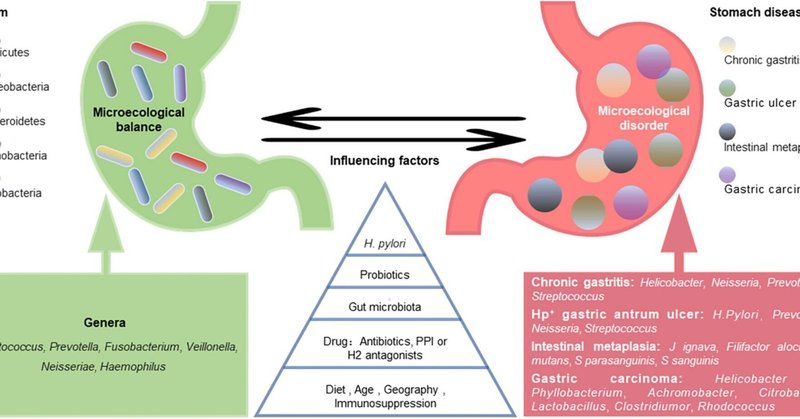
健康な胃は、多様な微生物叢によってコロニー形成されている。胃内細菌叢の組成には個人間で大きな差があることが観察されている。健康な胃の細菌群集は、広範に特徴づけられていません。しかし、胃粘膜では、ファーミキューテス、プロテオバクテリア、バクテロイデーテス、アクチノバクテリア、およびフソバクテリアが最も顕著な門派であることが研究で明らかになっている(Bik et al、 2006)、Streptococcus、Prevotella、Fusobacterium、Veillonella、Neisseria、Haemophilusが最も多い属である(Bik et al., 2006; Li et al., 2009; Delgado et al., 2013; Engstrand and Lindberg, 2013; Ndegwa et al., 2020; Figure 1)。胃粘膜のものと比較して、胃液ではH. pyloriとProteobacteriaのレベルが比較的低下し、Actinobacteria、Bacteroidetes、Firmicutesが増加した(Sung et al.、2016)。胃液サンプルは胃粘膜サンプルよりも高い多様性を示したことに留意する必要がある。ただし、胃は口腔からの細菌流入や十二指腸を介した逆流にさらされているため、胃液中の細菌は一過性のものかもしれない(Nardone and Compare, 2015)。
図1
図1. 胃のミクロエコロジーのアンバランスと胃の病気。個人差はあるものの、健康な胃には5つの支配的な細菌群があり、その共通支配細菌属がまとめられている(緑)。胃内細菌叢は、ヘリコバクター・ピロリ感染、プロバイオティクス、腸内細菌叢、薬剤、食事、年齢など多くの要因によって動的にバランスをとり、影響を受けている。それらの因果関係は不明であるが、胃のミクロエコロジーのアンバランスは様々な胃疾患と関連しており(赤字)、いくつかの微生物関連疾患が挙げられている。
胃内細菌叢組成は、ピロリ菌感染、抗生物質曝露、プロバイオティクス摂取、PPIやH2拮抗薬使用、食習慣、年齢、ビタミン補給(特にD3)、免疫抑制、そして潜在的に地理的条件や腸内細菌叢によって変化し、非常に動的である(Espinozaら、2018;図 1).萎縮性胃炎と腸管形質転換(IM)のないH.ピロリ陰性者の長期追跡調査では、年齢とともに微生物の多様性とFirmicutesおよびFusobacteriaの存在量が減少し、Proteobacteria門の存在量は増加することが示されました(Shin et al., 2020)。しかし、別の研究では、年齢と性別は胃の細菌組成に大きな影響を与えないことが示されました(Li et al.、2017)。民族によっては、特異的な微生物叢のプロフィールがあります。例えば、Micrococcus luteusとSphingomonas yabuuchiaeは、それぞれティモール民族とパプア民族に有意に関連していた(Miftahussurur et al.、2020)。ベトナムの少数民族に焦点を当てた横断研究では、ピロリ菌感染の有病率は、ラオカイよりもダクラクに住むヌンで有意に高いことが示された(Binh et al.、2018)。Dasら(2017)は、米国とコロンビアのサンプルの微生物叢は似ているが、インドと中国のものはより近く見えることを発見した。民族や地域が異なる人の胃内フローラの違いは、食習慣と一部関係があるのかもしれません。中国は塩分摂取量が多い国であり、WHOが推奨する値の2倍である(Zhang et al.、2020)。高塩分食は主に、門レベルでBacteroidetesとProteobacteriaの相対存在量を減らし、属レベルでUnclassified_S24-7とLactobacillusの相対存在量を減らすことによって、胃の微生物叢の組成を変化させます(Li Y. et al., 2020)。
胃のマイクロエコロジーの確立と安定は、粘液バリア、生物学的バリア、免疫系に起因している。粘液層はpH勾配を確立し、胃内腔のpHは1~2、粘膜表面は6~7である(Bhaskar et al.、1992)。胃液由来の細菌とそのDNAは、ほとんどの細菌のコロニー形成を弱めるバリアを展開し、粘膜に付着した細菌はコロニー形成に適した環境を作り出します(Hunt et al.、2015)。胃の自然免疫応答と適応免疫応答は、免疫ホメオスタシス機構を通じて微生物のバランスを維持します。最近のエビデンスでは、2型自然リンパ球(ILC2s)と胃の常在細菌叢の相互作用が、微生物環境の恒常性を維持することが示されています(Satoh-Takayama et al.、2020年)。胃のマイクロエコロジーのアンバランスと胃の病気
胃内細菌叢の組成や機能の変化は胃内生態系障害とされ、様々な環境因子によって誘発される。ミクロ生態学的障害は、胃の免疫機能障害を引き起こし、優性菌を減少させ、病原性微生物の存在量と病原性を増加させ、病原性細菌の侵入と関連疾患を引き起こす可能性があります(図1)。H. pyloriに感染した無菌(GF)INS-GASマウスと比較して、H. pyloriに感染した特定病原体(SPF)INS-GASマウスはより重度の胃病変を起こし、GI上皮内新生物を早期に発症しました(Lofgren et al., 2011)。この知見は、胃の微生物叢がピロリ菌感染後の胃の病気に寄与している可能性があるという見解を支持するものである。
低塩素酸血症患者には、ピロリ菌以外にも、Actinomyces、Corynebacterium、Haemophilus、Streptococcus、Staphylococcusといった多くのウレアーゼ陽性菌がいる(Brandi et al., 2006)。LactobacillusとEnterococcusは健康な胃の中の常在菌で、その存在率はそれぞれ30%と51%までです。しかし、これらを超えるとGCのリスクとなると考えられている(Gantuya et al.、2020)。
H. pylori陽性の胃肛門潰瘍における優勢な細菌フィラは、Proteobacteria、Bacteroidetes、およびFirmicutesであった。属レベルではH. pyloriが優勢で、Prevotella、Neisseria、Streptococcusがそれに続いた(Chen et al., 2018)。胃IM患者では、健常対照者と比較してJohnsonella ignavaとFilifactor alocisが濃縮され、Streptococcus mutans、Streptococcus parasanguinis、Streptococcus sanguinisは枯渇していました。また、IM患者では腸内細菌叢の糖分解経路が枯渇しており、リポ多糖とユビキノール生合成経路が多くなっていた(Wu et al.、2022)。
Ferreiraら(2018)は、慢性胃炎の患者ではHelicobacter、Neisseria、Prevotella、Streptococcusがより豊富であることを発見した。胃がんではヘリコバクターが有意に減少し、フィロバクテリウム属、アクロモバクター属、シトロバクター属、ラクトバチルス属、クロストリジウム属、ロドコッカス属がより多く存在していました(Ferreira et al., 2018)。GC進行中の細菌多様性の変化は、研究によって一貫性がありません。胃炎から癌に至るまで、微生物の多様性が徐々に低下することを示した研究もあれば(Aviles-Jimenez et al., 2014)、この過程で細菌の多様性が増加することを示した研究もある(Eun et al., 2014)。これらの違いは、研究間で使用された微生物叢特性評価プラットフォームや研究集団の違いを反映している可能性があります。ピロリ菌を含む胃内微生物の病原性メカニズムには、炎症反応の誘発、腫瘍微小環境における免疫細胞の機能への影響、N-ニトロソ化合物などの有害な代謝物の産生などが考えられる(Li and Yu, 2020)。
胃のマイクロエコロジーは、薬物の使用にも影響される。例えば、バンコマイシンは、ActinobacteriaとBacteroidetes phylaの存在量を減少させた(Satoh-Takayama et al.、2020年)。また、PPI治療患者は、正常な胃粘膜の患者(Parsons et al., 2017)やPPI治療を行わない消化不良患者(Sterbini et al., 2016)に比べて、Streptococcusが多くみられた。胃のミクロエコロジーとピロリ菌感染症
4.1. ピロリ菌感染は胃のミクロエコロジーに影響を与える
ヘリコバクター・ピロリ感染は胃内細菌多様性を変調させることが報告されている(Das et al.、2017)。H.ピロリ+/CagA+サンプルは、健常者またはH.ピロリ+/CagA-サンプルと比較して、胃内細菌叢の多様性とRoseburia存在量が低いものの、Helicobacter属とHaemophilus属の存在量は高いことが示されました(Zhao et al., 2019)。Actinobacteria、Bacteroidetes、Firmicutes、Fusobacteria、Gemmatimonadetes、Verrucomicrobiaを含むフィラの相対存在量は、H. pylori-小児と比較してH. pylori+小児で著しく減少していました。H.ピロリ+の子供とH.ピロリの子供では、Helicobacter、Achromobacter、Devosia、Halomonas、Mycobacterium、Pseudomonas、Serratia、Shingopyxis、Stenotrophomonasなど9属で存在量に差があった(Zheng et al., 2021)。
ヘリコバクター・ピロリは、尿素を二酸化炭素とアンモニアに変換するウレアーゼを産生し、胃の酸性環境を中和してコロニー形成を促進する働きをします(Weeks et al.、2000)。急性感染では低塩素酸血症になり、解剖学的に異なる部位での慢性感染では低塩素酸血症または高塩素酸血症になることがある。ピロリ菌による酸分泌の変化は、摂取した微生物が胃を通過して生き延びることを可能にするかもしれません(Smolka and Schubert, 2017)。急性ピロリ菌感染時の胃pH低下はコロニー形成につながるが、慢性ピロリ菌感染時の胃pH上昇は、ピロリ菌の増殖をさらに抑制する微生物ブルームにつながるという仮説がある(Das et al.、2017)。
4.2. 胃のマイクロエコロジーはピロリ菌に対する宿主の反応に影響する
4.2.1. 細菌類
ピロリ菌感染に対する宿主の反応の多様性は、胃内細菌の多様性と存在量に起因していると考えられる(表1)。細菌量のファミリーレベルの分析では、Jackson Laboratory(Jax)のC57BL/6マウスとTaconic Sciences(Tac)のC57BL/6マウスの間に明らかな違いがあり、ピロリ菌感染に対する反応の違いが伴っていた。ピロリ菌感染Jaxマウスは、ピロリ菌のコロニー形成レベルと胃のIL-1βとIL-17Aの転写が高く、ピロリ菌感染Tacマウスは、胃粘膜のメタプラズマがより深刻で、ピロリ菌に対するTh1関連IgG2c反応がより強い。また、Jaxマウスの胃に存在する微生物叢では、エネルギー代謝、アミノ酸、二次代謝産物の生合成経路がアップレギュレートされていた。一方、Tacマウスの胃では、脂質、補酵素、ビタミン代謝、ゼノバイオティック生分解が上昇した。胃内細菌群集構造の違いは、潜在的に異なる経路を制御し、胃の生理学に影響を与え、異なるピロリ菌感染反応につながる可能性があります(Ge et al., 2018)。
表1
表1. 胃のマイクロエコロジーは、ピロリ菌に対する宿主の反応に影響を与える。
ヘリコバクター・ピロリ感染は、Tヘルパー17(Th17)細胞の抑制や制御性T(Treg)細胞の誘導など、宿主免疫系を深く変調させる(Lehours and Ferrero, 2019)。共存する胃微生物またはその代謝物は、宿主の免疫応答を調節することにより、ピロリ菌が胃に定着する能力、およびその病原性と発がん性に影響を与える(Espinoza et al.、2018)。非H.ピロリ菌の存在は、持続的に抗原刺激として作用するか、H.ピロリとのパートナーシップを確立してその後の炎症を強化するかもしれません(Rook et al.、2017年)。胃由来のウレアーゼ陽性Staphylococcus epidermidisとStreptococcus salivariusを、ピロリ菌のいるGF INS-GASマウスに独立して接種した。後者の胃病理は、ピロリ菌にのみ感染したマウスに比べ、有意に高いものであった。一方、前者の炎症性サイトカイン応答(IL-1β、IL-22、IFN-γ、TNF-α)は、H. pyloriにのみ感染したマウスのそれよりも有意に低かった(Shen et al.) 研究により、感染児ではIL-17AとFOXP3のmRNA比がピロリ菌の存在量と逆相関していることが判明した。さらに、胃の微生物コミュニティは、そのα-リノレン酸とアラキドン酸の代謝を有意にアップレギュレートしました。そこで、Zhengら(2021)は、Treg細胞とTh17細胞のバランスが細菌の持続に有利なTreg細胞に偏り、胃微生物叢が短鎖脂肪酸(SCFA)や低分子を生成してH. pylori感染児の粘膜Treg反応を調節しているのではないかとの仮説を立てた。また、Satoh-Takayamaら(2020)は、IL-7とIL-33の誘導を通じて局所常在菌コミュニティによって制御されるILC2が胃の優勢なILCサブセットであり、B細胞活性化とIgA産生を通じてピロリ菌感染から保護することを示しています。
4.2.2. 真菌類
Candida albicansは、人体で最も一般的な真菌の一つである。Karczewskaら(2009)は、胃潰瘍患者においてピロリ菌とカンジダ菌の共存を報告し、疾患発症における両者の相乗効果を示唆しました。ピロリ菌は通性細胞内細菌であり、C. albicans細胞に侵入することで環境ストレスから身を守り、侵入したピロリ菌がその後のC. albicans世代に伝達されることがあります(Siavoshi and Saniee, 2014; Siavoshi et al., 2019)。Siavoshiら(2019)は、酵母の液胞がピロリ菌の洗練されたニッチとして機能し、液胞内の隔離が潜在的に細菌の生存率を高めることを発見した。なお、酸性環境では、細菌を保有する酵母細胞の割合が、中性環境の約2倍であった。しかし、pHが4未満になると、細菌が侵入した酵母細胞の数は急激に減少する(Sanchez-Alonzo et al.、2020)。さらに、温度、嫌気環境、栄養状態、薬剤(アンフォテリシンBなど)が、カンジダ細胞におけるH. pyloriの出入りに影響を与える可能性がある(Sanchez-Alonzo et al., 2021a,c, 2022; Tavakolian et al., 2018)。H. pyloriは膣内酵母細胞に侵入し、出産時の垂直感染を引き起こすことが報告されています(Sanchez-Alonzo et al.、2021b)。また、ピロリ菌を保有するC. albicansは、ミツバチ、蜂蜜、花、天然果実にも多く含まれています(Siavoshi et al., 2018)。これらの結果は、真菌の介入によってピロリ菌の感染を低減または予防できることを示唆しています。
4.2.3. ウイルス(Virus
Helicobacter pyloriとEpstein-Barr virus(EBV)は、それぞれ単独で感染するよりも、協力してより重症の胃炎を誘発することが報告されています。それらの複合感染は、発がん性タンパク質であるガンキーリンの宿主発現とヒト胃腺がん細胞(AGS)の発がん性を促進します(Cárdenas-Mondragónら、2013;Kashyapら、2021)。H. pyloriとEBVを共感染させたサンプルでは、EBV単独と比較して、12時間および24時間で潜在性EBV核抗原1および3C(ebna1およびebna3c)遺伝子の高い発現が観察されました。同様に、H.ピロリ関連遺伝子16S rRNA、CagA、および血球群抗原結合アドヒシン(babA)の発現レベルは、ピロリ単独で感染した細胞よりもコイン感染した細胞で高かった(Kashyap et al.、2021)。Pandeyら(2018)は、ピロリ菌のCagAタンパク質が、EBVを介したコイン感染細胞の増殖を促進することを示した。EBVは、その宿主アンタゴニストの1つであるSrc homology region 2 domain-containing phosphatase-1をダウンレギュレートすることにより、H. pylori CagA活性を増強しました(Saju et al., 2016)。ピロリ菌除菌と胃のマイクロエコロジー
根本的なピロリ菌治療レジメンには、PPI3剤併用療法、ビスマス含有4剤併用療法、修正レジメン(修正ビスマス含有4剤併用療法、高用量2剤併用療法、vonoprazan含有レジメン)、併用療法、ハイブリッド療法、逐次療法があります(Liu et al., 2021)。ピロリ菌の除菌は胃の微生物組成と機能に影響を与えるが、ピロリ菌の除菌が胃の微生物叢を感染していない状態に戻すかどうかは、依然として議論の余地がある(Guo et al.、2022)。ピロリ菌除菌後の胃の微生物学的回復に影響を与える予測可能な要因としては、基礎状態での萎縮/メタプラスティアの増加、コーパスでの好中球浸潤の増加、ペプシノーゲン(PG)I/II比の低下、相対アシネトバクター存在度の増加などが考えられる(Shin et al.、2020)。最近のメタアナリシスでは、4剤併用療法または3剤併用療法後に胃の微生物組成が大きく変化し、相対的なH. pylori関連分類群(Proteobacteria phylumおよびHelicobacter genus)の存在量が異なる程度に減少することが示されました。一方、ピロリ菌除菌後は、通常優勢な胃内常在菌(ファーミキューテス、バクテロイデス、アクチノバクテリアなど)が豊富になった(Guo et al.、2022)。ピロリ菌除菌後の胃内細菌叢機能の変化を探る研究では、胃内細菌叢において、細菌繁殖関連経路(鞭毛集合、走化性、ヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体シグナルなど)がダウンレギュレーションされていることがわかりました。一方、胃酸分泌、タンパク質の消化吸収、アミノ酸代謝などの正常な胃機能関連経路はアップレギュレートされていた(He et al., 2019; Guo et al., 2020; Sung et al.)
抗生物質治療は、細菌群集構造の広範な破壊につながる。抗生物質治療後のヒトのマイクロバイオームの再構成は、通常、遅く、不完全です(Suez et al., 2018)。抗生物質耐性が高まる中、ガイドラインでは第一選択治療としてビスマス4剤併用療法が推奨されています(Fallone et al.、2019)。高いピロリ菌除菌率はラクトバチルス、ロドコッカス、スフィンゴモナスと関連していることから、ビスマス含有4剤式ピロリ菌除菌療法の有効性は胃の微生物叢に依存するという証拠がある(Niu et al.、2021)。胃のマイクロエコロジー調節によるH.ピロリ除菌
6.1. プロバイオティクス
プロバイオティクスは、適切な量を投与することで宿主に利益をもたらす生きた微生物です(Hill et al.、2014)。マウスでは、炎症浸潤や前がん病変の発生が抑制され、ピロリ菌による胃の病理を軽減することが示されています(He et al.、2022)。また、ヒトにおけるH.ピロリ除菌率を高め、副作用を軽減します(Zhang et al., 2015; McFarland et al., 2016; Fang et al., 2019; Viazis et al., 2022)。Yuanら(2021)は、プロバイオティクスを補充した四重療法の胃のマイクロエコロジーに対する効果を探りました。ビフィドバクテリウムとラクトバチルスは、4剤併用療法群と比較して、プロバイオティクス補充群の胃粘膜と胃液でそれぞれ濃縮されていました。一方、フソバクテリウムやカンピロバクターなどの潜在的な病原性細菌のレベルは低下していた。微生物の多様性は、プロバイオティクスを補充した除菌治療後のピロリ菌陰性者のものに近づいた(Yuan et al.、2021)。
現在、ピロリ菌感染に対する潜在的な活性を有するプロバイオティクスは、ファーミキューテス(EnterococcusおよびLactobacillus)およびアクチノバクテリア(Bifidobacterium属)門とSaccharomyces boulardiiに属する(Keikha and Karbalaei, 2021)。プロバイオティクス効果の基礎となるメカニズムとして、病原体の抑制、有用な代謝物や酵素の産生、免疫の調節などが最もよく提案されています。また、クオラムセンシングは、プロバイオティクスが胃内細菌叢の回復を制御するメカニズムの1つであると考えられている。プロバイオティクスは、これらの経路の1つ以上を通じて有益な効果を発揮する可能性があります(表2)。
表2
表2. ピロリ菌に対するプロバイオティクスの可能なメカニズム
6.1.1. 病原体の抑制
Lactobacillus reuteriは胃上皮のガングリオテトラオシルセラミド(asialo-GM1)とスルファチドに競合的に結合してピロリ菌の付着を阻害する(Mukai et al., 2002)。S. boulardiiは、α(2-3)-結合シアル酸に選択的なノイラミニダーゼを産生し、H. pylori adhesin ligandsを除去して、H. pyloriの宿主細胞への接着を阻害する(Sakarya and Gunay, 2014)。Doら(2021a,b)は、細胞モデルを用いて、Lactobacillus rhamnosus JB3(LR-JB3)がAGS細胞において、H. pylori VacA、Sialic Ac-binding adhesin(Saba)、fucosyltransferase(FucT)を減少させ、ルイス(Le)x抗原、toll-like receptor 4(TLR4)とα5β1インテグリンの発現を減少することを示していました。したがって、脂質ラフトのクラスタリングをさらに抑制し、ルイス抗原依存的な接着、T4SSを介した細胞接触、脂質ラフトを介した宿主細胞へのVacA侵入を減弱させた(Do et al., 2021a,b)。
6.1.2. バクテリアの代謝産物
プロバイオティクス由来の代謝物は、ピロリ菌の除菌において広く研究されている。無細胞乳酸菌培養上清は、ピロリ菌の増殖、ウレアーゼ活性、鞭毛を介した運動性、およびピロリ菌が誘発する宿主IL-8分泌を減少させた(Whitesideら、2021)。プロバイオティクスは、H. pyloriの増殖に拮抗し得るLacticins A164およびBH5などのバクテリオシンを産生した(Kim et al., 2003)。Lactobacillus brevis BK11とEnterococcus faecalis BK61は、H. pyloriのウレアーゼ活性と培養ヒト胃腺がん上皮細胞への接着を減少させた(Lim, 2015)。さらに、Boyanovaら(2017)は、Lactobacillus delbrueckii subsp. bulgaricus株のバクテリオシン様阻害物質が、抗生物質感受性および抗生物質耐性H. pyloriを殺菌することを発見した。
プロバイオティクスは、胃内細菌叢の構造を再構築することができる。プロバイオティクスを投与すると、ピロリ菌感染マウスの胃の中で、バクテロイデス、アロプレボテラ、オセリバクターなどの有益なSCFA産生菌の割合が増加した(He et al., 2022)。代表的なSCFAの一つである酪酸ナトリウムは、H. pyloriの増殖やCagA、VacAの発現を抑制するだけでなく、宿主細胞におけるtoll様受容体の発現を低下させてTNF-αやIL-8の産生を減少させ、宿主NF-κB経路を阻害した(Huang et al.,2021).しかし、別の細菌代謝物であるトリメチルアミンN-オキシド(TMAO)は、H. pyloriの生存率と病原性を高め、H. pyloriが誘発する炎症を悪化させた(Wu et al., 2020)。ピロリ菌とTMAOの相乗効果により、胃上皮におけるIL-6、C-X-Cモチーフケモカインリガンド1および2(CXCL1、CXCL2)、FOS、補体C3などの炎症関連遺伝子発現が増強されました(Wu et al., 2017)。トリメチルアミン(TMA)は、TMAO前駆体である。主にファーミキューテス(Staphylococcusなど)で産生され、バクテロイデーテスでは比較的まれである(Fennema et al.、2016)。全体として、プロバイオティクスは、有益な代謝産物産生菌の割合を増加させ、および/または有害な代謝産物産生菌の割合を減少させると考えられる。
6.1.3. 免疫の調節
ピロリ菌感染動物モデルにおいて、免疫調節におけるプロバイオティクスの役割を示唆するエビデンスが増えてきている。プロバイオティクスであるLactobacillus salivariusとLactobacillus rhamnosusの併用投与は、H. pylori感染マウスにおいて、NF-κB、IL-17、TNF-αなどの炎症経路を減衰させた(He et al., 2022)。いくつかのLactobacillus属の単離株は、H. pylori感染AGS細胞によるIL-8分泌を減少させることが報告されている。これらには、Cag分泌系機能の低下(Ryanら、2009)、SMADファミリーメンバー7(Smad7)およびNF-κB経路の不活性化(Yangら、2012)、およびc-Jun活性化の抑制(Thiraworawongら、2014)などがある。L. salivarius B37株は、胃上皮におけるIL-8産生の免疫調節因子として多糖類を産生した。また、L. salivarius B60株が分泌する多糖類、脂質、タンパク質の混合物は、IL-8産生の媒介に関与していた(Panpetch et al., 2016)。さらに、Lactobacillus fermentum P2、Lactobacillus casei L21、LR-JB3、またはそれらの組み合わせを投与した動物は、胃のH. pylori特異的IgAおよびIgMレベル、血清のIFN-γおよびIL-1βレベルが減少した(Lin et al., 2020)。
6.1.4. 微生物間のコミュニケーション:クォーラムセンシング
クオラムセンシング(QS)システムは、細菌間コミュニケーションによる分子シグナル伝達機構で、増殖、病原性、病原性などの挙動を制御する(Wu et al.、2021)。ピロリ菌のS-リボシルホモシステインリアーゼ(LuxS)遺伝子にコードされるタンパク質は、QSの主要分子であるオートインデューサー2(AI-2)を合成する(Forsyth and Cover, 2000)。AI-2は、バイオフィルム形成(Anderson et al., 2015)や運動性(Rader et al., 2007)など、ピロリ菌の活性を制御することが報告されています。また、CagAの発現や細菌の接着を抑え、胃上皮細胞におけるH. pylori誘発炎症反応を減弱させることも報告されています(Wen et al.、2021)。さらに、AI-2はオーファン応答制御因子HP1021をダウンレギュレートすることにより、ピロリ菌のウレアーゼ発現を誘導し、菌密度が上昇した際の酸馴化を促進する可能性があります(Yang et al.、2022)。
QSは、腸内細菌叢と宿主の間のバランスに関与している。多くの研究が、異なる細菌集団間のQSを介した相互作用に徐々に焦点を当ててきた(Wu et al.、2021)。最近、Doら(2021a)は、LR-JB3がH. pyloriのLuxS発現を阻害することを発見した。LR-JB3によって分泌される未知の生理活性シグナルは、AI-2シグナルアンタゴニストとして働き、AI-2の効果を減衰させ、ピロリ菌のAGS細胞への結合能力に影響を与える(Do et al.、2021a)。
6.2. プレバイオティクス、ポストバイオティクス、シンバイオティクス
シンバイオティクスは、生きた微生物の混合物である(Swanson et al.、2020)。プレバイオティクスは、宿主の健康増進微生物が選択的に使用する基質である(Gibson et al.、2017)。ポストバイオティクスは、宿主に健康上の利益を与える無生物微生物およびその成分である(Salminen et al.、2021)。ヒトにおいて最も広く記録されている食事性プレバイオティクスは、難消化性オリゴ糖のフルクタンとガラクタンです(Gibson et al.、2017)。現在のポストバイオティクス微生物成分には、無細胞上清、細菌溶解物、細胞壁断片、外多糖、酵素、代謝物(SCFA、ビタミン、フェノール由来代謝物、芳香族アミノ酸)などがあります(Zolkiewicz et al.、2020)。
母子間コホート研究により、圧倒的な母乳育児が初期のピロリ菌のコロニー形成を防ぐ可能性が示された(Shah et al.、2022)。ヒト乳特有のヒト乳オリゴ糖(HMO)は、ビフィズス菌のメンバーによるコロニー形成を促進し(Hill et al., 2021)、ビフィズス菌と酪酸菌Anaerostipes caccaeなどの他属間の交配をサポートするプレバイオティック・ビフィズス因子であることが明らかになりました(Cia et al., 2021)。乳酸(Arena et al., 2016)やバクテリオシン(Kim et al., 2003)などのポストバイオティクス分子は、直接的な抗菌活性を有するかもしれない。しかし、ポストバイオティクスは、QSやクオラムクエンチング分子を運ぶことで、間接的に微生物叢を調節する可能性もある(Grandclément et al.、2016)。6つのランダム化比較試験のメタアナリシスでは、シンバイオティクスがピロリ菌の除菌率を改善し、副作用を軽減する可能性が示唆された(Ustundag et al.、2017)。
6.3. 微生物叢の移植
糞便微生物叢移植(FMT)は、クロストリジウム・ディフィシル感染症や炎症性腸疾患などのGI疾患を治療するために、GI微生物叢を効果的に復元するために使用されている(Allegretti et al., 2019).洗浄微生物叢移植(WMT)は、洗浄した製剤を使用する修正FMT法である。胃、空腸、または右半規管の送達経路でWMTを適用すると、32人のピロリ菌感染患者のコホートで全体のピロリ菌除菌率が40.6%となり、これはWMT前のPG比の上昇と有意に関連しました。なお、治癒効果、性別、送達経路(上部、中部、下部消化管)の関係については、さらなる検討が必要である(Ye et al.、2020)。
健康な成人では、細菌群集は個人差だけでなく、同一人物の異なるGI領域でも異なっている。したがって、糞便マイクロバイオームは粘膜マイクロバイオームを代表するものではありません(Vasapolli et al.、2019)。最近の研究では、IMまたはGC患者の胃粘膜組織とジュースを与えたGFマウスが、特定のヒト胃微生物によってコロニー形成されることが判明しました。さらに、前悪性度変化の主要な病理組織学的特徴を再現した(Kwon et al.、2022)。胃のILC2の総数は、GFマウスではSPFマウスよりも少なかった。しかし、SPFマウスからGFマウスへの胃内容物および粘膜掻把の経口投与による胃内細菌叢移植後にILC2数とIL-5レベルが上昇し、Bacteroidales family S24-7の相対存在量の上昇と相関していた(Satoh-Takayama et al., 2020)。ピロリ菌除菌における胃内細菌叢移植(GMT)の研究は不足しているが、幅広い展望があると思われる。期待すること
胃疾患における非ピロリ菌の重要性は、綿密な胃のミクロ生態学研究によって強調されているが、ピロリ菌の役割を無視することはできない。一部の学者は、炎症性腸疾患などの一部の疾患に対するピロリ菌の潜在的な保護効果を真剣に考慮する必要があると考えており(Engler et al., 2015)、ピロリ菌は単なる日和見病原体ではなく、常在菌とさえ考えられるべきである(Reshetnyak et al., 2021)。同様に、プロバイオティクスとして使用される多くの乳酸菌は、病原体感染の予防、炎症の軽減、微生物叢の調節などの役割を担っています。しかし、ラクトバチルスは上皮細胞の炎症性損傷を誘導することもでき、GCと関連していた(Vinasco et al., 2019)。その有益な効果と有害な効果のバランスが、特定の細菌種または存在量に関連しているかどうかは、さらなる研究に値する。特定の細菌の役割ではなく、胃のマイクロエコロジー(細菌、真菌、ウイルスなど)のバランスを考慮することで、胃の病気を予防・治療するための新しいアプローチが得られるかもしれません(図2)。図2
図2. 健康な胃の微生物叢を個別に再構築することは、微生物叢異常症に関連する胃の病気を管理するための有望な戦略である。胃の微生物叢の組成と存在量、および胃の微生物叢(ヘリコバクター・ピロリ菌と非ピロリ菌、真菌、ウイルスを含む)間の相互作用は、胃のマイクロエコロジー恒常性において重要な役割を担っています。微生物叢を調節すること(プロバイオティクス、プレバイオティクス、ポストバイオティクス、シンバイオティクス、FMT/GMT)は、胃の微生物叢のバランスを改善・回復させると期待されています。しかし、菌種やドナーの選択、デリバリーパス、開始・終了時間など、個々に合わせた治療法の検討が必要である。FMT、糞便微生物叢移植、GMT、胃微生物叢移植。
胃の微生物生態を制御することは、ピロリ菌の除菌に重要な役割を果たすかもしれない。経口微生物投与は、胃の強酸性環境のため、常に生存率の大幅な低下を招く(Li S. et al.、2020)。プロバイオティクスのコロニー形成と有効性に影響を与える宿主の要因には、食事、年齢、抗生物質の使用、基礎疾患、ベースラインのマイクロバイオームの組成と機能などがあります(Suez et al.、2020年)。さらに、プロバイオティクスコロニー化耐性は、部分的に常在の腸内細菌叢に起因することが研究で明らかになっています(Zmora et al.、2018)。健康な人での抗生物質療法は、恒常的なマイクロバイオームによるプロバイオティクスコロニー化抵抗を部分的に克服し、枯渇した腸粘膜層でのプロバイオティクスコロニー化を改善します(Suez et al., 2018)。したがって、ピロリ菌に対するプロバイオティクスの臨床的有効性については、より大きなサンプルとより長時間の観察が必要であり、個別化した治療計画をさらに開発する必要がある(図2)。
さらに、マイクロバイオーム移植は、抗生物質治療後に迅速かつほぼ完全な腸内細菌叢の再構成を誘導するものであった。したがって、構造的に単一のプロバイオティクスと比較して、腸管粘膜マイクロバイオームの直下期に抗生物質後の迅速な保護を提供するようです(Suez et al., 2018)。GMTは、正常な胃の微生物叢を回復するための有望な戦略であり、さらなる調査が必要です(図2)。
著者による寄稿
LZは予備原稿を作成した。MZとXFは最終原稿を推敲し、承認した。すべての著者がこの論文に貢献し、提出されたバージョンを承認した。
資金提供
この研究は、XFに付与された中国国家自然科学基金(No.81972315)の支援を受けています。
謝辞
XFの研究室のメンバーには、有益なアドバイスとディスカッションをいただき、感謝いたします。
利益相反について
著者らは、本研究が、潜在的な利益相反と解釈されうる商業的または金銭的関係がない状態で行われたことを宣言する。
出版社からのコメント
本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
参考文献
Allegretti, J. R., Mullish, B. H., Kelly, C., and Fischer, M. (2019). 糞便微生物移植の使用の進化と新たな治療適応症。Lancet 394, 420-431. doi: 10.1016/S0140-6736(19)31266-8.
PubMed Abstract|CrossRef Full Text|Google Scholar
アンダーソン、J.、ホアン、J.、ウレデン、C.、スウィーニー、E.、ゴアーズ、J.、レミントン、S.、その他(2015)。クォーラムシグナルであるオートインデューサー-2からのケモレパルジョンがヘリコバクター・ピロリのバイオフィルム分散を促進する. mBio 6:e00379. doi: 10.1128/mBio.00379-15
PubMed Abstract|CrossRef Full Text|Google Scholar
Arena, M. P., Silvain, A., Normanno, G., Grieco, F., Drider, D., Spano, G., et al. (2016). 食品媒介病原微生物に対するバイオコントロール戦略としてのラクトバチルス・プランタラム株の使用。Front. Microbiol. 7:464. doi: 10.3389/fmicb.2016.00464.
PubMed Abstract|CrossRef Full Text|Google Scholar
Aviles-Jimenez, F., Vazquez-Jimenez, F., Medrano-Guzman, R., Mantilla, A., and Torres, J. (2014). 胃の微生物叢の組成は、非萎縮性胃炎の患者と腸型胃癌の患者で異なる。サイ・レップ 4:4202. doi: 10.1038/srep04202.
PubMed Abstract|CrossRef Full Text|Google Scholar
Barra, W. F., Sarquis, D. P., Khayat, A. S., Khayat, B. C., Demachki, S., Anaissi, A. K., et al. (2021). 胃がんマイクロバイオーム。病理生物学 88, 156-169. doi: 10.1159/000512833
PubMed Abstract|CrossRef Full Text|Google Scholar
Bhaskar, K. R., Garik, P., Turner, B. S., Bradley, J. D., Bansil, R., Stanley, H. E., et al. (1992). 胃ムチンを介したHClの粘性フィンガリング。Nature 360, 458-461.
PubMed Abstract|CrossRef Full Text|Google Scholar
Bik, E. M., Eckburg, P. B., Gill, S. R., Nelson, K. E., Purdom, E. A., Francois, F., et al. (2006). ヒト胃の細菌性微生物叢の分子生物学的解析。Proc. Natl. Acad. Sci. U.S.A. 103, 732-737. doi: 10.1073/pnas.0506655103
PubMed Abstract|CrossRef Full Text|Google Scholar
Binh, T., Tuan, V., Dung, H., Tung, P., Tri, T., et al. (2018). ベトナムのマイナー民族におけるヘリコバクター・ピロリ感染症の分子疫学: 多民族の集団ベースの研究。Int. J. Mol. Sci. 19:708. doi: 10.3390/ijms19030708
PubMed Abstract|CrossRef Full Text|Google Scholar
Boyanova, L., Gergova, G., Markovska, R., Yordanov, D., and Mitov, I. (2017). 抗生物質感受性および耐性ヘリコバクター・ピロリ株に対するラクトバチルス・デルブルエキイ・サブスピーズ・ブルガリクス7株のバクテリオシン様阻害活性. Lett. Appl.Microbiol. 65, 469-474. doi: 10.1111/lam.12807
PubMed Abstract|CrossRef Full Text|Google Scholar
Brandi, G., Biavati, B., Calabrese, C., Granata, M., Nannetti, A., Mattarelli, P., et al. (2006). ヒト胃液および粘膜におけるHelicobacter pylori以外のウレアーゼ陽性菌。Am. J. Gastroenterol. 101, 1756-1761. doi: 10.1111/j.1572-0241.2006.00698.x
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Brawner, K. M., Kumar, R., Serrano, C. A., Ptacek, T., Lefkowitz, E., Morrow, C. D., et al. (2017). ヘリコバクター・ピロリ感染は、小児における胃の微生物叢の変化と関連している。Mucosal Immunol. 10, 1169-1177. doi: 10.1038/mi.2016.131.
PubMed Abstract|CrossRef Full Text|Google Scholar
ブルコア,C.,アクソン,A.(2017).ヘリコバクター・ピロリ感染症の疫学. ヘリコバクター 22(Suppl 1):e12403. doi: 10.1111/hel.12403
PubMed Abstract|CrossRef Full Text|Google Scholar
Cárdenas-Mondragón, M. G., Carreón-Talavera, R., Camorlinga-Ponce, M., Gomez-Delgado, A., Torres, J., and Fuentes-Panan, E. M. (2013). エプスタインバーウイルスとヘリコバクターピロリの共感染は、小児患者における重症胃炎と正の相関がある。PLoS One 8:e62850. doi: 10.1371/journal.pone.0062850.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chen, X., Xia, C., Li, Q., Jin, L., Zheng, L., and Wu, Z. (2018). comparisons between bacterial communities in mucosa in patients with gastric antrumulcer and a duodenal Ucer. Front. Cell Infect. Microbiol. 8:126. doi: 10.3389/fcimb.2018.00126
PubMed Abstract|CrossRef Full Text|Google Scholar
Chia, L. W., Mank, M., Blijenberg, B., Bongers, R. S., Limpt, K v, Wopereis, H., et al. (2021). 乳糖と人乳オリゴ糖を用いたBifidobacterium infantisとAnaerostipes caccaeの交配食。ベネフィット。Microbes 12, 69-83. doi: 10.3920/BM2020.0005.
PubMed Abstract|CrossRef Full Text|Google Scholar
Das, A., Pereira, V., Saxena, S., Ghosh, T. S., Anbumani, D., Bag, S., etc. (2017). ヘリコバクター・ピロリ感染インド人患者の胃内細菌叢、およびその相互作用ネットワーク. サイ・レップ 7:15438. doi: 10.1038/s41598-017-15510-6
PubMed Abstract|CrossRef Full Text|Google Scholar
Delgado, S., Cabrera-Rubio, R., Mira, A., Suárez, A., and Mayo, B. (2013). 培養法とパイロシークエンス法を用いたヒト胃の生態系の微生物学的調査。Microb. Ecol. 65, 763-772. doi: 10.1007/s00248-013-0192-5
PubMed Abstract|CrossRef Full Text|Google Scholar
Do, A., Chang, C., Su, C., and Hsu, Y. (2021a). Lactobacillus rhamnosus JB3は、複数の分子作用によりHelicobacter pylori感染を阻害する。ヘリコバクター 26:e12806. doi: 10.1111/hel.12806.
PubMed Abstract|CrossRef Full Text|Google Scholar
Do, A., Su, C., and Hsu, Y. (2021b). Lactobacillus rhamnosus JB3の脂質ラフト形成によるHelicobacter pylori感染に対する拮抗活性.Front. Immunol. 12:796177. doi: 10.3389/fimmu.2021.796177.
PubMed Abstract|CrossRef Full Text|Google Scholar
Engler, D. B., Leonardi, I., Hartung, M. L., Kyburz, A., Spath, S., Becher, B., et al. (2015). 炎症性腸疾患に対するヘリコバクター・ピロリ特異的な保護には、NLRP3インフラマソームとIL-18が必要です。炎症性腸疾患に対するInflamm. Bowel Dis. 21, 854-861. doi: 10.1097/MIB.000000000318
PubMed Abstract|CrossRef Full Text|Google Scholar
Engstrand, L., and Lindberg, M. (2013). ヘリコバクター・ピロリと胃の微生物叢. ベストプラクティス。Res. Clin. Gastroenterol. 27, 39-45. doi: 10.1016/j.bpg.2013.03.016
PubMed Abstract|CrossRef Full Text|Google Scholar
Espinoza, J. L., Matsumoto, A., Tanaka, H., and Matsumura, I. (2018). 胃内細菌叢(Gastric microbiota): Helicobacter pylori誘発胃悪性腫瘍における新たなプレイヤー。キャンサーレット(Cancer Lett. 414, 147-152. doi: 10.1016/j.canlet.2017.11.009
PubMed Abstract|CrossRef Full Text|Google Scholar
Eun, C. S., Kim, B. K., Han, D. S., Kim, S. Y., Kim, K. M., Choi, B. Y., et al. (2014). パイロシーケンス法を用いた慢性胃炎、腸管形質転換、胃がん患者における胃粘膜微生物相のプロファイリングの違い。ヘリコバクター 19, 407-416. doi: 10.1111/hel.12145
PubMed Abstract|CrossRef Full Text|Google Scholar
ファローン、C.、モス、S.、マルファータイナー、P. (2019). 抗生物質への耐性が高まる中での最近のヘリコバクター・ピロリ治療ガイドラインの整合性。胃腸病学 157, 44-53. doi: 10.1053/j.gastro.2019.04.011
PubMed Abstract|CrossRef Full Text|Google Scholar
Fang, H., Zhang, G., Cheng, J., and Li, Z. (2019). 小児のヘリコバクター・ピロリ感染症に対する乳酸菌補充3剤併用療法の有効性: ランダム化比較試験のメタアナリシス(A meta-analysis of randomized controlled trials)。Eur. J. Pediatr. 178, 7-16. doi: 10.1007/s00431-018-3282-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Fennema, D., Phillips, I., and Shephard, E. (2016). トリメチルアミンとトリメチルアミンN-オキシド、健康と疾患に関与するフラビン含有モノオキシゲナーゼ3(FMO3)-mediated host-microbiome metabolic axis. ドラッグ・メタブ.Dispos. 44, 1839-1850. doi: 10.1124/dmd.116.070615
PubMed Abstract|CrossRef Full Text|Google Scholar
Ferreira, R. M., Pereira-Marques, J., Pinto-Ribeiro, I., Costa, J. L., Carneiro, F., Machado, J. C., et al. (2018). 胃の微生物群集プロファイリングにより、dysbiotic cancer-associated microbiotaが明らかになった。ガット 67, 226-236. doi: 10.1136/gutjnl-2017-314205
PubMed Abstract|CrossRef Full Text|Google Scholar
Forsyth, M., and Cover, T. (2000). Helicobacter pyloriの細胞間コミュニケーション:luxSは細胞外シグナル分子の産生に必須である。Infect. Immun. 68, 3193-3199. doi: 10.1128/IAI.68.6.3193-3199.2000
PubMed Abstract|CrossRef Full Text|Google Scholar
Gantuya, B., Serag, H. B., Matsumoto, T., Ajami, N. J., Uchida, T., Oyuntsetseg, K., et al. (2020). 胃がんおよび前駆症状のあるモンゴル人集団における胃粘膜微生物叢. Aliment. ファーマコル.Ther. 51, 770-780. doi: 10.1111/apt.15675.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ge, Z., Sheh, A., Feng, Y., Muthupalani, S., Ge, L., Wang, C., et al. (2018). 異なる胃腸微生物叢を持つヘリコバクター・ピロリ感染C57BL/6マウスは、胃病理、微生物および宿主免疫応答が対照的である。サイ・レプ 8:8014. doi: 10.1038/s41598-018-25927-2
PubMed Abstract|CrossRef Full Text|Google Scholar
ギブソン、G. R.、ハトキンス、R.、サンダース、M. E.、プレスコット、S. L.、ライマー、R. A.、サルミネン、S. J., 他 (2017). 専門家による合意文書: プレバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)コンセンサスステートメント。Nat. Rev. Gastroenterol. Hepatol. 14, 491-502. doi: 10.1038/nrgastro.2017.75
PubMed Abstract|CrossRef Full Text|Google Scholar
Grandclément, C., Tannières, M., Moréra, S., Dessaux, Y., and Faure, D. (2016). クォーラムクエンチング:自然界における役割と応用展開. FEMS Microbiol. Rev. 40, 86-116. doi: 10.1093/femsre/fuv038
PubMed Abstract|CrossRef Full Text|Google Scholar
Guo, Y., Cao, X., Guo, G., Zhou, M., and Yu, B. (2022). ヘリコバクター・ピロリ除菌がヒトの胃内細菌叢に与える影響: システマティックレビューとメタアナリシス。Front. Cell Infect. Microbiol. 12:899248. doi: 10.3389/fcimb.2022.899248.
PubMed Abstract|CrossRef Full Text|Google Scholar
Guo, Y., Zhang, Y., Gerhard, M., Gao, J., Mejias-Luque, R., Zhang, L., et al. (2020). ヘリコバクター・ピロリの胃腸内細菌叢への影響: 胃がんの高リスク地域であるLinquにおける集団ベースの研究。Gut 69, 1598-1607. doi: 10.1136/gutjnl-2019-319696.
PubMed Abstract|CrossRef Full Text|Google Scholar
He, C., Peng, C., Wang, H., Ouyang, Y., Zhu, Z., Shu, X., et al. (2019). ヘリコバクター・ピロリの除菌は、無症状の若年成人において、胃腸の微生物相を乱すのではなく、回復させる。ヘリコバクター 24:e12590. doi: 10.1111/hel.12590.
PubMed Abstract|CrossRef Full Text|Google Scholar
He, C., Peng, C., Xu, X., Li, N., Ouyang, Y., Zhu, Y., et al. (2022). プロバイオティクスは、INS-GASマウスにおけるヘリコバクター・ピロリ誘発の胃の炎症と前がん病変を、胃腸の微生物叢の調節によって緩和する。ヘリコバクター 27:e12898. doi: 10.1111/hel.12898.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hill, C., Guarner, F., Reid, G., Gibson, G. R., Merenstein, D. J., Pot, B., et al. (2014). 専門家による合意文書。The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev. Gastroenterol. Hepatol. 11, 506-514. doi: 10.1038/nrgastro.2014.66
PubMed Abstract|CrossRef Full Text|Google Scholar
Hill, D., Chow, J., and Buck, R. (2021). 蔓延するHMOの多機能的な利点: 乳児の健康への示唆。ニュートリエンツ 13:3364. doi: 10.3390/nu13103364
PubMed Abstract|CrossRef Full Text|Google Scholar
Hooi, J. K., Lai, W. Y., Ng, W. K., Suen, M. M., Underwood, F. E., Tanyingoh, D., et al (2017). ヘリコバクター・ピロリ感染の世界的な有病率: システマティックレビューとメタアナリシス(Systematic Review and Meta-analysis).消化器病学 153, 420-429. doi: 10.1053/j.gastro.2017.04.022.
PubMed Abstract|CrossRef Full Text|Google Scholar
Huang, Y., Ding, Y., Xu, H., Shen, C., Chen, X., and Li, C. (2021). ヘリコバクター・ピロリ感染マウスの炎症、腸内細菌叢、短鎖脂肪酸に対する酪酸ナトリウムの補給の効果。ヘリコバクター 26:e12785. doi: 10.1111/hel.12785.
PubMed Abstract|CrossRef Full Text|Google Scholar
ヒトマイクロバイオームプロジェクトコンソーシアム(2012).健康なヒトのマイクロバイオームの構造、機能、多様性。ネイチャー486, 207-214.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hunt, R. H., Camilleri, M., Crowe, S. E., El-Omar, E. M., Fox, J. G., Kuipers, E. J., et al. (2015). 健康と病気における胃。ガット 64, 1650-1668. doi: 10.1136/gutjnl-2014-307595
PubMed Abstract|CrossRef Full Text|Google Scholar
Karczewska, E., Wojtas, I., Sito, E., Trojanowska, D., Budak, A., Zwolinska-Wcislo, M., et al. (2009). 上部消化管の疾患におけるHelicobacter pyloriとCandida fungiの共存の評価。J. Physiol. Pharmacol. 60(Suppl. 6), 33-39.
PubMed Abstract|Google Scholar
Kashyap, D., Baral, B., Jakhmola, S., Singh, A., and Jha, H. (2021). ヘリコバクター・ピロリとエプスタイン・バー・ウイルスの同時感染は、ガンキーリンの制御を通じて胃癌の攻撃性を刺激する。 mSphere 6:e0075121. doi: 10.1128/mSphere.00751-21.
PubMed Abstract|CrossRef Full Text|Google Scholar
Keikha, M., and Karbalaei, M. (2021). ヘリコバクター・ピロリ胃感染症に対する生きたミクロの戦闘機としてのプロバイオティクス。BMC Gastroenterol. 21:388. doi: 10.1186/s12876-021-01977-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Kim, T., Hur, J., Yu, M., Cheigh, C., Kim, K., Hwang, J., et al. (2003). 乳酸菌のバクテリオシンによるHelicobacter pyloriの拮抗作用. J. Food Prot. 66, 3-12. doi: 10.4315/0362-028X-66.1.3.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kronsteiner, B., Bassaganya-Riera, J., Philipson, C., Viladomiu, M., Carbo, A., Abedi, V., et al. (2016). 病原性と共生の接点におけるヘリコバクター・ピロリに対する粘膜免疫応答のシステムワイドな解析。腸内細菌 7, 3-21. doi: 10.1080/19490976.2015.1116673.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kwon, S., Park, J. C., Kim, K. H., Yoon, J., Cho, Y., Lee, B., et al. (2022). ヒト胃内細菌叢の移植は無菌マウスの前がん病変を再現する。Gut 71, 1266-1276. doi: 10.1136/gutjnl-2021-324489
PubMed Abstract|CrossRef Full Text|Google Scholar
Lehours,P.、Ferrero,R. (2019). レビュー ヘリコバクター: 炎症、免疫学、ワクチン。ヘリコバクター 24(Suppl. 1):e12644. doi: 10.1111/hel.12644.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, Q., and Yu, H. (2020). 胃がん発症における非H.ピロリ菌の役割.Am. J. Cancer Res. 10, 2271-2281.
グーグル・スカラー
Li, Y., Li, W., Wang, X., Ding, C., Liu, J., Li, Y., et al. (2020). C57BL/6マウスの高塩分食誘発性胃炎は、微生物のディスバイオシスと関連し、ソバ食によって緩和される。モル. Nutr. Food Res. 64:e1900965. doi: 10.1002/mnfr.201900965.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, S., Jiang, W., Zheng, C., Shao, D., Liu, Y., Huang, S., et al. (2020). 細菌の経口投与: 基本原理と生物医学的応用。J. Control Release 327, 801-833. doi: 10.1016/j.jconrel.2020.09.011.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, T. H., Qin, Y., Sham, P. C., Lau, K. S., Chu, K., and Leung, W. K. (2017). H. Pylori除菌後の胃内細菌叢の変化と胃がん発症の異なる組織学的段階における変化。サイ・レップ 7:44935. doi: 10.1038/srep44935.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, X., Wong, G., To, K., Wong, V., Lai, L., Chow, D., et al. (2009). ヘリコバクター・ピロリ感染や非ステロイド性抗炎症薬の使用を伴わない胃炎における細菌性微生物叢プロファイリング(Bacterial Microbiota Profiling in gastritis without Helicobacter pylori infection or non-steroidal anti-inflammatory drug use. PLoS One 4:e7985. doi: 10.1371/journal.pone.0007985.
PubMed Abstract|CrossRef Full Text|Google Scholar
リム、E. (2015). 抗ヘリコバクター・ピロリ活性を示すLactobacillus brevis BK11とEnterococcus faecalis BK61からの2つのバクテリオシンの精製と特徴づけ。J. Korean Soc. Appl. Biol. Chem. 58, 703-714. doi: 10.1007/s13765-015-0094-y
CrossRef Full Text|Google Scholar
Lin, C., Huang, W., Su, C., Lin, W., Wu, W., Yu, B., et al. (2020). ヘリコバクター・ピロリ感染マウスの免疫反応と代謝バランスに対するマルチストレイン・プロバイオティクスの影響。ニュートリエンツ12:2476. doi: 10.3390/nu12082476.
PubMed Abstract|CrossRef Full Text|Google Scholar
Liu, C., Wang, Y., Shi, J., Zhang, C., Nie, J., Li, S., et al. (2021). ヘリコバクター・ピロリ感染症に対する第一選択治療の現状と進歩: A review. Ther. Adv. Gastroenterol. 14:1756284821989177. doi: 10.1177/1756284821989177
PubMed Abstract|CrossRef Full Text|Google Scholar
Lofgren, J. L., Whary, M. T., Ge, Z., Muthupalani, S., Taylor, N. S., Mobley, M., etc. (2011). ヘリコバクター・ピロリ感染INS-GASマウスにおける常在菌叢の欠如は胃炎を軽減し、上皮内新生物を遅らせる。Gastroenterology 140, 210-220. doi: 10.1053/j.gastro.2010.09.048
PubMed Abstract|CrossRef Full Text|Google Scholar
Marshall, B., and Warren, J. (1984). 胃炎および消化性潰瘍の患者の胃における未確認の曲がった桿菌。Lancet 1, 1311-1315. doi: 10.1016/S0140-6736(84)91816-6
PubMed Abstract|CrossRef Full Text|Google Scholar
McFarland, L. V., Huang, Y., Wang, L., and Malfertheiner, P. (2016). 系統的レビューとメタアナリシス: ヘリコバクター・ピロリ除菌と有害事象予防のための補助療法としての多菌種プロバイオティクス。ユナイテッドEur. Gastroenterol. J. 4, 546-561. doi: 10.1177/2050640615617358.
PubMed Abstract|CrossRef Full Text|Google Scholar
Megraud, F., Bruyndonckx, R., Coenen, S., Wittkop, L., Huang, T., Hoebeke, M., et al. (2021). 2018年のヨーロッパにおける抗生物質に対するヘリコバクター・ピロリ耐性と、コミュニティにおける抗生物質消費量との関連。ガット 70, 1815-1822. doi: 10.1136/gutjnl-2021-324032
PubMed Abstract|CrossRef Full Text|Google Scholar
Miftahussurur, M., Waskito, L. A., El-Serag, H. B., Ajami, N. J., Nusi, I. A., Syam, A. F., et al. (2020). インドネシア人集団における胃内細菌叢とヘリコバクター・ピロリ。ヘリコバクター 25:e12695. doi: 10.1111/hel.12695.
PubMed Abstract|CrossRef Full Text|Google Scholar
向井 毅、浅坂 毅、佐藤 英夫、森 浩二、松本 昌彦、大堀 浩之(2002).プロバイオティクスLactobacillus reuteriによるHelicobacter pyloriの糖脂質受容体への結合の阻害. FEMS Immunol. Med. Microbiol. 32, 105-110. doi: 10.1111/j.1574-695X.2002.tb00541.x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナルドン,G.,コンペア,D.(2015).ヒトの胃内細菌叢:胃疾患の病態を再考する時が来たか?ユナイテッドEur. Gastroenterol. J. 3, 255-260. doi: 10.1177/2050640614566846.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ndegwa, N., Ploner, A., Andersson, A. F., Zagai, U., Andreasson, A., Vieth, M., et al. (2020). ヘリコバクター・ピロリ有病率の低い一般集団における胃内細菌叢と胃病変との関連性。Clin. Transl. Gastroenterol. 11:e00191. doi: 10.14309/ctg.000000000191
PubMed Abstract|CrossRef Full Text|Google Scholar
Niu, Z., Li, S., Shi, Y., and Xue, Y. (2021). ビスマスを含むヘリコバクター・ピロリ4種除菌療法に対する胃内細菌叢の影響.ワールドJ.ガストロエンテロール. 27, 3913-3924. doi: 10.3748/wjg.v27.i25.3913
PubMed Abstract|CrossRef Full Text|Google Scholar
パンデイ、S、ジャ、H、シュクラ、S、シャーリー、M、ロバートソン、E. (2018). ヘリコバクター・ピロリによる腫瘍抑制因子のエピジェネティックな制御は、EBVによる胃上皮細胞の増殖を促進する。 mBio 9:e00649-18. doi: 10.1128/mBio.00649-18.
PubMed Abstract|CrossRef Full Text|Google Scholar
Panpetch, W., Spinler, J. K., Versalovic, J., and Tumwasorn, S. (2016). ヘリコバクター・ピロリ刺激胃上皮細胞におけるIL-8産生を抑制することができるラクトバチルス・サリバリウス株B37およびB60の特徴づけ。BMC Microbiol. 16:242. doi: 10.1186/s12866-016-0861-x
PubMed Abstract|CrossRef Full Text|Google Scholar
Parsons, B. N., Ijaz, U. Z., Amore, R., Burkitt, M. D., Eccles, R., Lenzi, L., et al. (2017). ヘリコバクター・ピロリ誘発萎縮性胃炎、自己免疫性萎縮性胃炎、プロトンポンプ阻害薬使用の結果として生じる低塩基性状態におけるヒト胃微生物叢の比較。PLoS Pathog. 13:e1006653. doi: 10.1371/journal.ppat.1006653.
PubMed Abstract|CrossRef Full Text|Google Scholar
Peek, R., and Blaser, M. (2002). Helicobacter pyloriと胃腸腺がん。Nat. Rev. Cancer 2, 28-37. doi: 10.1038/nrc703
PubMed Abstract|CrossRef Full Text|Google Scholar
Rader, B. A., Campagna, S. R., Semmelhack, M. F., Bassler, B. L., and Guillemin, K. (2007). クオラムセンシング分子オートインデューサー2は、Helicobacter pyloriの運動性と旗頭形態形成を制御している。J. Bacteriol. 189, 6109-6117. doi: 10.1128/JB.00246-07.
PubMed Abstract|CrossRef Full Text|Google Scholar
Reshetnyak, V., Burmistrov, A., and Maev, I. (2021). ヘリコバクター・ピロリ: Commensal, symbiont or pathogen? ワールドJ.ガストロエンテロール。27, 545-560. doi: 10.3748/wjg.v27.i7.545
PubMed Abstract|CrossRef Full Text|Google Scholar
Rook, G., Bäckhed, F., Levin, B. R., McFall-Ngai, M. J., and McLean, A. R. (2017). 進化、ヒトと微生物の相互作用、および生活史の可塑性。Lancet 390, 521-530. doi: 10.1016/S0140-6736(17)30566-4.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ryan, K. A., Hara, A. M., Pijkeren, J v, Douillard, F. P., and Toole, P. W. (2009). Lactobacillus salivariusは、Helicobacter pyloriのサイトカイン誘導とビルレンスファクター遺伝子発現を調節する。J. Med. Microbiol. 58, 996-1005. doi: 10.1099/jmm.0.009407-0
PubMed Abstract|CrossRef Full Text|Google Scholar
Saju, P., Murata-Kamiya, N., Hayashi, T., Senda, Y., Nagase, L., Noda, S., et al. (2016). 宿主SHP1ホスファターゼはヘリコバクター・ピロリCagAに拮抗し、エプスタイン・バーウイルスによってダウンレギュレーションされうる。Nat. Microbiol. 1:16026. doi: 10.1038/nmicrobiol.2016.26
PubMed Abstract|CrossRef Full Text|Google Scholar
Sakarya, S., and Gunay, N. (2014). Saccharomyces boulardiiは、宿主細胞へのヘリコバクター・ピロリの接着を低下させるα2,3-結合シアル酸に選択的なノイラミニダーゼ活性を発現する。APMIS 122, 941-950. doi: 10.1111/apm.12237.
PubMed Abstract|CrossRef Full Text|Google Scholar
Salminen, S., Collado, M. C., Endo, A., Hill, C., Lebeer, S., Quigley, E. M., et al. (2021). ポストバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)コンセンサスステートメント。Nat. Rev. Gastroenterol. Hepatol. 18, 649-667. doi: 10.1038/s41575-021-00440-6
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez-Alonzo, K., Arellano-Arriagada, L., Bernasconi, H., Parra-Sepúlveda, C., Campos, V., Silva-Mieres, F., et al. (2022). 嫌気性環境がキャンディダ酵母細胞内のヘリコバクター・ピロリの保菌を促進する。Biology (Basel) 11:738. doi: 10.3390/biology11050738.
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez-Alonzo, K., Arellano-Arriagada, L., Castro-Seriche, S., Parra-Sepúlveda, C., Bernasconi, H., Benavidez-Hernández, H., et al. (2021a). ヘリコバクター・ピロリにとって最適な範囲外の温度は、カンジダ酵母細胞内でのその保有を増加させる。バイオロジー(バーゼル)10:915. doi: 10.3390/biology10090915
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez-Alonzo, K., Silva-Mieres, F., Arellano-Arriagada, L., Parra-Sepúlveda, C., Bernasconi, H., Smith, C., et al. (2021c). 栄養不足は、ヘリコバクター・ピロリ細胞のカンジダ酵母細胞への侵入を促進する。バイオロジー(バーゼル)10:426. doi: 10.3390/biology10050426
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez-Alonzo, K., Matamala-Valdes, L., Parra-Sepulveda, C., Bernasconi, H., Campos, V., Smith, C., et al. (2021b). 期妊婦の膣内酵母内に存在するヘリコバクター・ピロリおよびその病原性関連遺伝子型の細胞内存在。Microorganisms 9:131. doi: 10.3390/microorganisms9010131
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez-Alonzo, K., Parra-Sepulveda, C., Vega, S., Bernasconi, H., Campos, V., Smith, C., et al. (2020). 酸性pHストレスによるヘリコバクター・ピロリのキャンディダ・アルビカンスへのインビトロでの組み込み。Pathogens 9:489. doi: 10.3390/pathogens9060489.
PubMed Abstract|CrossRef Full Text|Google Scholar
Santos, M. L., Brito, B. B., Silva, F. A., Sampaio, M. M., Marques, H. S., Silva, N. O., et al. (2020). ヘリコバクター・ピロリ感染症: 胃の症状を超えて。ワールドJ.ガストロエンテロール。26, 4076-4093. doi: 10.3748/wjg.v26.i28.4076
PubMed Abstract|CrossRef Full Text|Google Scholar
佐藤・高山・加藤・本村・影山・田口・明石・木下・大徳・他(2020).胃の細菌誘導性第2群自然リンパ球はIgAの誘導により免疫防御を行う。Immunity 52, 635-649.e4. doi: 10.1016/j.immuni.2020.03.002.
PubMed Abstract|CrossRef Full Text|Google Scholar
Shah、S.、Tarassishin、L.、Eisele、C.、Rendon、A.、Debebe、A.、Hawkins、K.、他(2022).母乳育児は、赤ちゃんのヘリコバクター・ピロリのコロニー形成の可能性が低いことと関連する、米国の前向きな母子コホートに基づいて。ディグ.Dis. Sci. 67, 5149-5157. doi: 10.1007/s10620-021-07371-x
PubMed Abstract|CrossRef Full Text|Google Scholar
Shen, Z., Dzink-Fox, J., Feng, Y., Muthupalani, S., Mannion, A., Sheh, A., et al. (2022). 胃非ヘリコバクター・ピロリ ウレアーゼ陽性Staphylococcus epidermidisおよびヒトから分離されたStreptococcus salivariusは、胃癌のマウスモデルにおいてH. pylori関連胃病理および宿主免疫応答に対して対照的な効果を有する。 mSphere 7:e0077221. doi: 10.1128/msphere.00772-21
PubMed Abstract|CrossRef Full Text|Google Scholar
Shin, C. M., Kim, N., Park, J. H., and Lee, D. H. (2020). 加齢とヘリコバクター・ピロリ除菌後の胃体部微生物叢の変化: 長期フォローアップ研究。Front. Microbiol. 11:621879. doi: 10.3389/fmicb.2020.621879.
PubMed Abstract|CrossRef Full Text|Google Scholar
Siavoshi, F., and Saniee, P. (2014). ヘリコバクター・ピロリに特化したニッチとしてのキャンディダ酵母のバキュオール.ワールドJ.ガストロエンテロール. 20, 5263-5273. doi: 10.3748/wjg.v20.i18.5263
PubMed Abstract|CrossRef Full Text|Google Scholar
Siavoshi, F., Heydari, S., Shafiee, M., Ahmadi, S., Saniee, P., Sarrafnejad, A., et al. (2019). 酵母の液胞内への隔離は、ストレスの多い条件に対してヘリコバクター・ピロリの生存を高める可能性がある。Infect. Genet. Evol. 69, 127-133. doi: 10.1016/j.meegid.2019.01.029.
PubMed Abstract|CrossRef Full Text|Google Scholar
Siavoshi, F., Sahraee, M., Ebrahimi, H., Sarrafnejad, A., and Saniee, P. (2018). 天然の果物、花、蜂蜜、ミツバチはヘリコバクター・ピロリ陽性酵母を保菌している。ヘリコバクター 23:e12471. doi: 10.1111/hel.12471.
PubMed Abstract|CrossRef Full Text|Google Scholar
スモルカ、A.、シューベルト、M.(2017)。ヘリコバクター・ピロリによる胃酸分泌の変化と上部消化管疾患. Curr. トップ(Top. Microbiol. Immunol. 400, 227-252. doi: 10.1007/978-3-319-50520-6_10
PubMed Abstract|CrossRef Full Text|Google Scholar
Sterbini, F. P., Palladini, A., Masucci, L., Cannistraci, C. V., Pastorino, R., Ianiro, G., et al. (2016). 消化不良患者における胃粘膜関連微生物叢に対するプロトンポンプ阻害剤の影響。Appl. Environ. Microbiol. 82, 6633-6644. doi: 10.1128/AEM.01437-16
PubMed Abstract|CrossRef Full Text|Google Scholar
Suez, J., Zmora, N., and Elinav, E. (2020). 次世代シーケンサー時代のプロバイオティクス。腸内細菌 11, 77-93. doi: 10.1080/19490976.2019.1586039
PubMed Abstract|CrossRef Full Text|Google Scholar
Suez, J., Zmora, N., Zilberman-Schapira, G., Mor, U., Dori-Bachash, M., Bashiardes, S., et al. (2018). 抗生物質投与後の腸粘膜マイクロバイオーム再構成は、プロバイオティクスによって損なわれ、自家用FMTによって改善される。セル 174, 1406-1423.e16. doi: 10.1016/j.cell.2018.08.047
PubMed Abstract|CrossRef Full Text|Google Scholar
Sung, J. J., Coker, O. O., Chu, E., Szeto, C. H., Luk, S. T., Lau, H. C., et al. (2020). ヘリコバクター・ピロリ除菌1年後の胃の炎症、萎縮、腸管形質転換と関連する胃微生物。ガット 69, 1572-1580. doi: 10.1136/gutjnl-2019-319826
PubMed Abstract|CrossRef Full Text|Google Scholar
Sung, J., Kim, N., Kim, J., Jo, H. J., Park, J. H., Nam, R. H., et al. (2016). 次世代シーケンサー法による胃液と粘膜の胃内細菌叢の比較. J. Cancer Prev. 21, 60-65. doi: 10.15430/JCP.2016.21.1.60
PubMed Abstract|CrossRef Full Text|Google Scholar
Swanson, K. S., Gibson, G. R., Hutkins, R., Reimer, R. A., Reid, G., Verbeke, K., et al. (2020). シンバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)コンセンサスステートメント。Nat. Rev. Gastroenterol. Hepatol. 17, 687-701. doi: 10.1038/s41575-020-0344-2
PubMed Abstract|CrossRef Full Text|Google Scholar
Tavakolian, A., Siavoshi, F., and Eftekhar, F. (2018). Candida albicansは、アムホテリシンBで治療すると細胞内細菌を放出する。 Arch. Iran. Med. 21, 191-198.
PubMed Abstract|Google Scholar
Thiraworawong, T., Spinler, J. K., Werawatganon, D., Klaikeaw, N., Venable, S. F., Versalovic, J., et al. (2014). ヘリコバクター・ピロリ感染に伴う胃由来ラクトバチルス・プランタラムXB7の抗炎症特性。ヘリコバクター 19, 144-155. doi: 10.1111/hel.12105.
PubMed Abstract|CrossRef Full Text|Google Scholar
Tsai, H., and Hsu, P. (2010). 胃の炎症と粘膜病理の免疫病態におけるHelicobacter pyloriと免疫細胞の相互作用。Cell Mol. Immunol. 7, 255-259. doi: 10.1038/cmi.2010.2
PubMed Abstract|CrossRef Full Text|Google Scholar
Tshibangu-Kabamba, E., and Yamaoka, Y. (2021). ヘリコバクター・ピロリ感染と抗生物質耐性-生物学から臨床的意義まで-. Nat. Rev. Gastroenterol. Hepatol. 18, 613-629. doi: 10.1038/s41575-021-00449-x
PubMed Abstract|CrossRef Full Text|Google Scholar
Ustundag, G. H., Altuntas, H., Soysal, Y. D., and Kokturk, F. (2017). 小児におけるヘリコバクター・ピロリ除菌の標準3剤併用療法に対するシンバイオティクス「ビフィドバクテリウム・ラクティスB94+イヌリン」添加の影響。キャン. J. Gastroenterol. Hepatol. 2017:8130596. doi: 10.1155/2017/8130596
PubMed Abstract|CrossRef Full Text|Google Scholar
Vasapolli, R., Schütte, K., Schulz, C., Vital, M., Schomburg, D., Pieper, D. H., et al. (2019). 健康な人の胃腸管全体における転写活性細菌の解析。胃腸病学 157, 1081-1092.e3. doi: 10.1053/j.gastro.2019.05.068
PubMed Abstract|CrossRef Full Text|Google Scholar
Viazis, N., Argyriou, K., Kotzampassi, K., Christodoulou, D., Apostolopoulos, P., Georgopoulos, S., et al. (2022). 標準的なヘリコバクター・ピロリ除菌治療と組み合わせた4つのプロバイオティクスレジメンは、副作用を軽減し、除菌率を高める。ニュートリエンツ 14:632. doi: 10.3390/nu14030632
PubMed Abstract|CrossRef Full Text|Google Scholar
Vinasco, K., Mitchell, H. M., Kaakoush, N. O., and Castaño-Rodríguez, N. (2019). 微生物による発がん: 胃がんにおける乳酸菌(Lactic acid bacteria in gastric cancer). Biochim. Biophys. Acta Rev. Cancer 1872:188309. doi: 10.1016/j.bbcan.2019.07.004.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang, F., Meng, W., Wang, B., and Qiao, L. (2014). ヘリコバクター・ピロリによる胃の炎症と胃がん. キャンサーレット(Cancer Lett. 345, 196-202. doi: 10.1016/j.canlet.2013.08.016
PubMed Abstract|CrossRef Full Text|Google Scholar
ウィークス、D.L.、エスカンダリ、S.、スコット、D.R.、およびサックス、G.(2000)。H+ゲート型尿素チャネル: ヘリコバクター・ピロリのウレアーゼと胃のコロニー形成の関連性。Science 287, 482-485. doi: 10.1126/science.287.5452.482
PubMed Abstract|CrossRef Full Text|Google Scholar
Wen, Y., Huang, H., Tang, T., Yang, H., Wang, X., et al. (2021). AI-2はCagA発現と細菌接着を抑制し、ヘリコバクター・ピロリによる胃上皮細胞の炎症反応を減弱させる。ヘリコバクター 26:e12778. doi: 10.1111/hel.12778.
PubMed Abstract|CrossRef Full Text|Google Scholar
Whiteside, S., Mohiuddin, M., Shlimon, S., Chahal, J., MacPherson, C., Jass, J., et al. (2021). 抗生物質の代替となる乳酸菌分泌物の抗ヘリコバクター・ピロリ能を評価するためのin vitroフレームワーク。Int. J. Mol. Sci. 22:5650. doi: 10.3390/ijms22115650.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, D., Cao, M., Li, N., Zhang, A., Yu, Z., Cheng, J., et al. (2020). ヘリコバクター・ピロリ感染マウスの炎症と腸内細菌叢に対するトリメチルアミンN-オキサイドの効果。Int. Immunopharmacol. 81:106026. doi: 10.1016/j.intimp.2019.106026.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, D., Cao, M., Peng, J., Li, N., Yi, S., Song, L., et al. (2017). 胃上皮細胞におけるヘリコバクター・ピロリ誘発の免疫炎症遺伝子発現変化に対するトリメチルアミンN-オキサイドの効果.Int. Immunopharmacol. 43, 172-178. doi: 10.1016/j.intimp.2016.11.032
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, F., Yang, L., Hao, Y., Zhou, B., Hu, J., Yang, Y., et al. (2022). 胃腸管形質転換に関連する口腔および胃のマイクロバイオーム。Int. J. Cancer 150, 928-940. doi: 10.1002/ijc.33848.
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu, S., Xu, C., Liu, J., and Qiao, J. (2021). 垂直・水平クオラムセンシングに基づく多細胞コミュニケーション。トレンド・マイクロバイオル(Trends Microbiol. 29, 1130-1142. doi: 10.1016/j.tim.2021.04.006
PubMed Abstract|CrossRef Full Text|Google Scholar
Yang, H., Huang, X., Zhang, X., Xu, X., She, F., et al. (2022). ヘリコバクター・ピロリにおいてAI-2はオーファン応答制御因子HP1021のダウンレギュレーションを通じてウレアーゼ発現を誘導する。Front. Med. (Lausanne) 9:790994. doi: 10.3389/fmed.2022.790994.
PubMed Abstract|CrossRef Full Text|Google Scholar
Yang, Y., Chuang, C., Yang, H., Lu, C., and Sheu, B. (2012). Lactobacillus acidophilusは、Smad7およびNFkappaB経路を不活性化することにより、H. pylori誘発胃の炎症を改善する。BMC Microbiol. 12:38. doi: 10.1186/1471-2180-12-38.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ye, Z., Xia, H. H., Zhang, R., Li, L., Wu, L., Liu, X., et al. (2020). ヘリコバクター・ピロリ除菌に対する洗浄微生物叢移植の有効性: パイロットスタディ。Gastroenterol. Res. Pract. 2020:8825189. doi: 10.1155/2020/8825189.
PubMed Abstract|CrossRef Full Text|Google Scholar
Yuan, Z., Xiao, S., Li, S., Suo, B., Wang, Y., Meng, L., et al. (2021). 若年成人におけるヘリコバクター・ピロリ感染、除菌療法、プロバイオティクス介入による胃内細菌叢への影響。ヘリコバクター 26:e12848. doi: 10.1111/hel.12848.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, M., Qian, W., Qin, Y., He, J., and Zhou, Y. (2015). ヘリコバクター・ピロリ除菌療法におけるプロバイオティクス: A systematic review and meta-analysis. ワールドJ.ガストロエンテロール。21, 4345-4357. doi: 10.3748/wjg.v21.i14.4345
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, P., He, F. J., Li, Y., Li, C., Wu, J., Ma, J., et al. (2020). Action on Salt China」(ASC)による中国での塩分摂取量の削減: キャンペーンとランダム化比較試験のためのプロトコル。JMIR Res.Protoc. 9:e15933. doi: 10.2196/15933.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhao, Y., Gao, X., Guo, J., Yu, D., Xiao, Y., Wang, H., et al. (2019). ヘリコバクター・ピロリ感染は胃および舌苔の微生物群集を変化させる。ヘリコバクター 24:e12567. doi: 10.1111/hel.12567.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zheng, W., Miao, J., Luo, L., Long, G., Chen, B., Shu, X., et al. (2021). ヘリコバクター・ピロリ感染が小児の胃粘膜に関連する微生物叢と免疫因子に与える影響。Front. Immunol. 12:625586. doi: 10.3389/fimmu.2021.625586.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zmora, N., Zilberman-Schapira, G., Suez, J., Mor, U., Dori-Bachash, M., Bashiardes, S., et al. (2018). 経験的プロバイオティクスに対するパーソナライズされた腸粘膜コロニー形成抵抗性は、ユニークなホストおよびマイクロバイオームの特徴と関連している。セル 174, 1388-1405.e21. doi: 10.1016/j.cell.2018.08.041
PubMed Abstract|CrossRef Full Text|Google Scholar
Zolkiewicz, J., Marzec, A., Ruszczynski, M., and Feleszko, W. (2020). ポストバイオティクス-プレバイオティクスとプロバイオティクスを超える一歩。ニュートリエンツ 12:2189. doi: 10.3390/nu12082189
PubMed Abstract|CrossRef Full Text|Google Scholar
キーワード:胃のミクロ生態学、胃疾患、ピロリ菌除菌、細菌間相互作用、微生物叢移植
引用元:日本経済新聞 Zhang L, Zhao M and Fu X (2023) Gastric microbiota dysbiosis and Helicobacter pylori infection. Front. Microbiol. 14:1153269. doi: 10.3389/fmicb.2023.1153269.
受理された: 2023年1月29日、受理された: 2023年3月14日
発行:2023年3月30日
編集者
オザン・グンドゥ(ロンドン大学、イギリス
レビューした人
Norma Velazquez-Guadarrama, Federico Gómez Children's Hospital of México, メキシコ
キャサリン・ヘイリー(グランドバレー州立大学、アメリカ)Kathryn Haley
Copyright © 2023 Zhang, Zhao and Fu. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、学術的に認められた慣行に従って、他のフォーラムでの使用、配布、複製が許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Ming Zhao, zhaoming24@126.com; Xiangsheng Fu, drfuxs@gmail.com
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または支持されるものではありません。
こんな人も見ています
デオキシコール酸による胃腸管形質転換ラットの胃内細菌叢とトランスクリプトームの変化
Zijing Xu, Ling Xiao, Shuaishuai Wang, Yuqin Cheng, Jianping Wu, Yufen Meng, Kaifan Bao, Junfeng Zhang および Chun Cheng
Campylobacter jejuni由来リンゴ酸:キノン酸化還元酵素の強力な阻害剤としてのフェルレノールおよびエンベリンの生化学的特性評価と同定
Augustin Tshibaka Kabongo、Rajib Acharjee、Takaya Sakura、Gloria Mavinga Bundutidi、Endah Dwi Hartuti、Cadi Davies、Ozan Gundogdu、北 潔、柴 智生、Daniel Ken Inaoka
SARS-CoV-2 Omicron変種に感染した回復期の成人患者の臨床特性に対するワクチンの効果: レトロスペクティブスタディ
王金玉、董河南、趙傑、李天寧、王孟、周春雷、穆洪
TaqManベースのデュプレックス・リアルタイムPCRによるカモTembusuウイルスおよびガチョウAstrovirusの迅速な診断
Haiqin Li, Chunhe Wan, Zhangzhang Wang, Jia Tan, Meifang Tan, Yanbing Zeng, Jiangnan Huang, Yu Huang, Qi Su, Zhaofeng Kang および Xiaoquan Guo
水系アウトブレイクから分離されたCampylobacter jejuniのゲノムおよび表現型の特性評価
エマ・デイビス、マリット・エベセン、セシリア・ヨハンソン、ルネ・カデン、ヒルピ・ラウテリン
フッター
ガイドライン
エクスプロア
アウトリーチ
接続
フォローする
© 2023 Frontiers Media S.A. All rights reserved.
プライバシーポリシー|ご利用規約
この記事が気に入ったらサポートをしてみませんか?
