炎症性腸疾患における腸管バリアーの維持における微生物叢、食事、T制御細胞の相互作用
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
187
総閲覧数
5
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 微生物学、2023年12月01日
システム微生物学
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1291724
この論文は次の研究テーマの一部です
腸内細菌叢と宿主免疫系の制御における栄養戦略の役割
全19論文を見る
炎症性腸疾患における腸管バリアーの維持における微生物叢、食事、T制御細胞の相互作用
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1291724/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit

Kathryn Prame Kumar* Joshua D. Ooi Rimma Goldberg
炎症性疾患センター、モナシュヘルス臨床科学部、医学部、モナシュメディカルセンター、モナシュ大学、クレイトン、VIC、オーストラリア
炎症性腸疾患(IBD)は、食事に関連した微生物異常、遺伝、ライフスタイルの変化により、欧米で一般的になりつつある。腸管透過性の発症はIBDに先行している可能性があり、腸管バリアの障害が続くと細菌抗原が免疫系に曝露されやすくなり、慢性炎症が持続する。現在、承認されているIBD治療薬のほとんどは、個々の炎症性サイトカインや経路を標的としている。しかし、冗長な炎症性免疫応答を克服することができないため、患者の約50%で治療効果が得られていない。炎症を抑制し、腸内細菌に対する寛容を促進し、粘膜バリアの治癒を促進し、さらに標的治療のために遺伝子操作できることから、炎症性疾患におけるT制御細胞(Treg)の治療可能性に関心が高まっている。腸内Treg集団は、食事分子や腸内細菌叢由来の代謝産物によって本質的に形成される。従って、これらの分子がTregを介した腸管バリアの維持にどのような影響を与えるかを理解することは、免疫寛容を介した粘膜の恒常性維持に関する知見を提供することになる。本総説では、大腸炎の進行を抑制する腸管バリア機能に影響を及ぼす食事、腸内細菌叢、免疫系の相互作用を包括的に探求する。
炎症性腸疾患
炎症性腸疾患(IBD)は、消化管に影響を及ぼす慢性炎症性疾患である。IBDの病因には、遺伝的感受性、環境因子、調節不全に陥った免疫反応などが複雑に絡み合っている(Baumgart and Carding, 2007)。特に、腸管透過性の亢進は、1型糖尿病、多発性硬化症、関節リウマチなど様々な疾患に関与する潜在的な病態である(Kinashi and Hase, 2021)。IBDでは、患者の腸透過性が亢進している症例があり、微生物によるディスバイオシス、慢性炎症の発生と同時に起こる(Hollanderら、1986;Hollander、1988;Adenisら、1992;Söderholmら、1999;Gitterら、2001;Tamboliら、2004;Pochardら、2018)。粘膜バリアの完全性が損なわれることで、細菌性物質がその下の組織に移行し、免疫系が誘発される。炎症性メディエーターの過剰産生は、IBDにおける細胞アポトーシス、びらん、潰瘍を伝播することにより、腸バリアに直接的な有害作用を及ぼす(Kucharzikら、2001;Hellerら、2005;Hansberryら、2017;Vespaら、2022)。IBDの管理には通常、コルチコステロイドを用いた生物学的製剤や低分子の短期投与、またはアミノサリチル酸塩の長期投与が行われる(Gomollón et al.) しかし、かなりの割合の患者が副作用を経験したり、非反応性を示したりするため、外科的介入を検討する必要があり、1年、5年、10年の経過で手術を必要とする患者の割合は、潰瘍性大腸炎(UC)患者でそれぞれ4、8.8、13.3%、クローン病(CD)患者で18.7、28.0、39.5%である(Tsai et al.) 臨床における生物学的製剤の出現は、より標的を絞った効果的な免疫調節を提供するようになり、その中で最も一般的なものは、インフリキシマブやアダリムマブなどの腫瘍壊死因子(TNF)-α遮断薬である(Rawla et al.) これらの生物学的製剤は、亢進した免疫系を抑制するように設計されているが、治療に対する抵抗性や合併症のために生物学的製剤を使用できない患者は30%にも上る(Papamichaelら、2016;Moss、2022)。排他的経腸栄養と部分的経腸栄養は、IBDにおいて確立された治療法である(Yamamoto and Shimoyama, 2023)。したがって、食事療法がIBDの炎症を操作するメカニズムについて詳しく知ることは、標的を絞ったより安全な治療法の開発を促進する可能性がある。
IBDに関連した粘膜透過性は、炎症の一次的事象なのか、それとも結果なのかという疑問がある。腸管透過性の異常と腸管バリアの乱れがCDを発症しやすくすることを示した前向き研究(Turpinら、2020年)が示唆するように、腸管透過性の亢進はIBDの発症に先行する可能性がある。しかし、IBDは腸管透過性の亢進のみから生じるのではなく、遺伝、腸内細菌叢、食事、免疫系、環境など複数の危険因子の相互作用から生じることに注意することが重要である(Tamburiniら、2022;Nobleら、2023)。この半世紀の間に、「欧米化」した食生活の影響がIBDに関わる大きな懸念となっている。都市化により、高糖分・高脂肪、抗生物質の頻用、汚染への曝露の増加などを特徴とする食事パターンが導入されたからである。明らかに、これらの要因は微生物の生物多様性を低下させ、IBDのリスクを高めることにつながる(Halfvarsonら、2017;Vich Vilaら、2018;Pittayanonら、2020;Pisaniら、2022;Adamら、2023)。腸管透過性の亢進がIBD発症に先行することが示されているが、慢性炎症が腸管バリア障害を悪化させる可能性があることに注意することが重要である。微生物叢の変化が炎症を誘発・維持し、疾患の慢性化につながると考えられている。その結果、炎症を抑えることができなくなり、組織の損傷や腸管透過性につながる(Yacyshyn and Meddings, 1995; Suenaert et al., 2002)。炎症が治まれば腸管透過性が緩和されるだけでなく、大腸炎も改善されるという考えを支持する有力な証拠がある(Suenaertら、2002;Mariniら、2003;Arrietaら、2009)。このように、腸管透過性亢進を治療するためには、腸管炎症を引き起こすメカニズムに対処することが不可欠である。
消化管の構造とバリアー
消化管は口腔、食道、胃、小腸、大腸、肛門からなる。これらの腔を覆っているのは、環境因子と宿主組織とを隔てる厚い粘膜バリアである(Vancamelbeke and Vermeire, 2017)。この半透膜バリアは、栄養の吸収を調整すると同時に、有害物質の組織への侵入を制限している。腸管バリアの機能は、食事分子、微生物、免疫細胞、組織細胞、分泌粘液や抗菌剤などの細胞成分、化学成分によって制御されている(Okumura and Takeda, 2018)。腸内細菌叢、免疫系、腸管細胞間の相互作用は粘膜バリア界面で起こり、これが後に宿主の健康と病気を形成する。
腸管内腔には10兆個以上の微生物が存在し、栄養素の分解に不可欠である(Joller et al.) これらの微生物は、生活習慣や食事など様々な外的要因の影響を受け、複雑な生化学的ニッチを形成している。潜在的な危害から身を守るため、腸管上皮細胞(IEC)は厚い粘液層からなる粘膜バリアを確立し、宿主の免疫細胞と腸内微生物叢を分離している(Beck et al.、2006)。微生物に対する宿主のもう一つの防御ラインは、樹状細胞、マクロファージ、ナチュラルキラー細胞、B細胞、T細胞などの腸管免疫細胞であり、これらは粘膜表面、固有層、免疫濃縮濾胞に存在する(Lord et al.、2010;Gibney et al.、2015)。上皮バリアの健康状態は、食事分子、マイクロバイオーム、炎症など、いくつかの要因に支配されている。これらの因子は相互に依存しているため、これらのシステムのいずれかが乱れると、腸管バリアの完全性が損なわれる可能性がある。T制御細胞(Tregs)は粘膜層に豊富に存在し、上皮表面での免疫-細菌相互作用によって引き起こされる炎症を制御している(Atarashi et al.) これらの細胞は、適応免疫細胞や自然免疫細胞の分化、増殖、エフェクター機能を制限し、プログラムされた細胞死を引き起こすことにより、抑制効果を発揮する(Sojka et al.) 炎症が上皮バリアの完全性に重大な影響を及ぼすことを考えると、Tregは食事、腸内細菌叢、宿主のバリア完全性をつなぐ重要な役割を担っている(Arpaia et al., 2013)。
IBDにおける免疫調節異常
体内の免疫集団の約70-80%は消化管内に局在している(Johnson, 1987; Furness et al., 2014)。粘膜と固有層には、樹状細胞(DC)、自然リンパ球細胞(ILC)、上皮内リンパ球(IEL)、マクロファージ、T細胞、B細胞など、さまざまなタイプの免疫細胞が集中して集まっている(Leeら、1985;Yuan and Walker、2004;Zhengら、2020)。腸管免疫細胞は総体として、腸管バリアの完全性と透過性を制御することにより、細菌の侵入に対する高度に機能的かつ効率的な免疫学的バリアを形成している。腸管免疫細胞は腸内細菌叢と密接に関与しており、共に進化して宿主を外部の危険から守っている。その一例がサイトカインを介した粘膜バリアの強化であり、常在微生物が自然リンパ球を刺激してIL-22を産生させる。これにより、上皮細胞による脂質吸収が増加し、バリア機能が改善する(Talbotら、2020年)。しかし、IBDの初期段階では、腸管バリアが損なわれているため、微生物抗原が組織内に過剰に侵入する。これらの抗原は好中球、DC、マクロファージなどの自然免疫細胞の活性化を引き起こす。しかし、免疫活性化が長期化し、細菌クリアランスが損なわれると、IBD患者の組織内に好中球が過剰に蓄積することになる(Vespaら、2022)。このような現象は、IBD患者で観察されるオートファジーの遺伝的障害に起因すると考えられ、オートファジーの障害は、パネス細胞や杯細胞の機能や形態、マクロファージによるサイトカイン分泌、樹状細胞による抗原提示、上皮細胞のストレス応答を阻害する(Saitohら、2008;Cooneyら、2010;Kaser and Blumberg、2011;Lassenら、2014;Iidaら、2017)。その結果、細菌を排除するはずの炎症性メディエーターが産生されるが、結局は宿主の腸組織を傷つけ、細菌の侵入をさらに促進し、炎症反応を長引かせることになる。疾患の後期には、適応免疫細胞、特に従来型のTヘルパー(Th)1細胞とTh17細胞の顕著な活性化と拡大が見られるが、これは病原性細菌と闘うために極めて重要だからである(Fujino et al.) これらの細胞は主にインターロイキン(IL)-17とインターフェロン(IFN)-γを分泌し、炎症制御に重要な役割を果たしている。IBDの重要な特徴の一つは、抗炎症メカニズム、特にTregが明らかに失われていることである(Maulら、2005;Sarutaら、2007;Wangら、2011;Smidsら、2018)。トレグは、転写因子フォークヘッドボックスP3(Foxp3)、CD25の発現、およびCD127の低発現によって区別されるCD4+ T細胞の別個のサブセットを表す(Liuら、2006)。腸管トレグはさらに、Tr1(IL-10+ Foxp3+)トレグ、Tr17(レチノイン酸関連オーファン受容体-γt[RORγt]+Foxp3+)トレグ、ICOS+トレグ、ニューロピリン-1(Nrp1+GATA結合タンパク質3[GATA3]+Helios+)トレグ、CD8+トレグなどのサブセットに分類することができる(Figliuolo da Paz et al.) これらの細胞は、顆粒酵素、パーフォリン、IL-10、IL-35、トランスフォーミング増殖因子-β(TGFβ)などのサイトカインを分泌することにより、末梢寛容を維持する役割を担っている(Vignali et al.) T細胞は、IgとITIMドメインを持つT細胞免疫受容体(TIGIT)、細胞傷害性Tリンパ球関連タンパク質4(CTLA4)、プログラム細胞死タンパク質-1(PD-1)などの免疫制御タンパク質を構成的に発現しており、抗原提示細胞やTエフェクター細胞上に存在するコスティミュレイトリー分子とタンパク質が結合することで、エフェクターT細胞の不活化とアネルギーを引き起こす(Levin et al、 2011; Bin Dhubanら, 2015; Lord, 2015; Tanら, 2020; Hong and Maleki Vareki, 2022)。
多くの研究が、大腸炎の発症と進行におけるTregの重要な役割を強調している。動物でTregを枯渇させると、大腸炎が自然に誘発されることが観察されている(Rubtsovら、2008年)。Treg増殖に不可欠な因子であるIL-2の投与は、IBDの前臨床モデルにおいて有意な保護効果を示したが、患者においては控えめな結果であった(Goettel et al., 2019; Allegretti et al., 2021)。同様に、ラパマイシンを介したTregの優先的拡大は、マウスのCD4 T細胞移入モデルにおいて大腸炎の発症を予防した(Ogino et al., 2012)。Tregによって産生されるサイトカインIL-10、IL-35およびTGF-βは、IBDの進行を促進するCD4+Tエフェクター細胞の反応を制限するのに不可欠である。TregのIL-10を条件付きでノックアウトしても、全身的な自己免疫は起こらないが、肺と結腸で特異的に炎症が起こり、結腸で抑制されない免疫応答が自然大腸炎として現れる(Rubtsov et al., 2008)。同様に、TregのIL-35発現を欠損させたマウスは、大腸炎のT細胞移入モデルにおいて炎症を抑えることができない(Collison et al., 2007)。TregからのIL-10の作用は、Th1細胞やTh2細胞ではなく、Th17細胞を特異的に抑制することにより、大腸炎の発症を効果的に抑制する(Chaudhry et al., 2011)。一方、Tregが産生するTGF-βはTh1が介在する大腸炎を抑制することが示されている(Powrieら、1996年)。一方、IL-35の過剰発現はTh1とTh17の両方の応答を抑制し、大腸炎における粘膜治癒を促進する(Wirtzら、2011年)。TregによるTIGIT発現は、Th1およびTh17応答を選択的に阻害するが、Th2応答は阻害しないことが示されている(Jollerら、2014年)。一方、CTLA-4とPD-1の遮断を含む免疫療法は、腸炎の発症と関連している(Beckら、2006;Brahmerら、2010;Lordら、2010;Gibneyら、2015;Dahlら、2022)。このことは、Th細胞応答を制御し、大腸炎を予防する上でTregが重要であることを示している。
IBD患者におけるTreg集団とその機能をめぐっては、逆説的な所見もあり、これらの相違は病期や調査対象の特定のT細胞集団に起因している可能性がある。末梢循環において、Treg数は疾患活動期に減少し、寛解期にベースラインレベルに戻る傾向がある(Maulら、2005;Sarutaら、2007;Wangら、2011;Smidsら、2018)。IBD患者の粘膜組織に蓄積していることから明らかなように、末梢のTregは炎症を起こした腸に移動すると考えられる(Maulら、2005;Sarutaら、2007;Wangら、2011;Smidsら、2018)。IBD患者の炎症腸粘膜内のFoxp3+ Treg集団は、その活性化マーカーとCTLA4およびPD-1の発現を維持しているが、腸内を移動して再増殖する能力には欠陥がある(Maulら、2005;Goldbergら、2019)。活性化マーカーを保持していても、これらのTregはアレルギー性になり、IBDの炎症を十分に抑制できない(Sarutaら、2007;Lordら、2015)。IBDにおけるTregの機能不全のさらなる一因として、Tregによる抑制に対するTエフェクター細胞の抵抗性が考えられる(Fantini et al., 2009)。
当然のことながら、Tregによる自然免疫細胞および適応免疫細胞の抑制は、免疫病理の抑制に重要である。しかし、病原性感染症においては、Tエフェクター細胞はTregによる抑制を回避して病原体に対する有効な免疫応答を維持する一方で、自然免疫細胞は一般的に抑制されている(Freeman et al.) 感染症に罹患すると、T細胞上のToll様受容体(TLR)が活性化され、IL-6とTNF-αが産生され、Tregによる抑制に対する抵抗性が促進される(Pasare and Medzhitov, 2003)。T細胞によるこれらのサイトカインの産生だけでは、抑制に対する抵抗性を付与するには不十分であり、抑制に対する抵抗性を媒介する上で、細菌によるTLR活性化が重要であることを示している。このことは、宿主が十分な免疫応答を行えるようにするため、細菌感染の場合には重要であろう。しかし、IBDでは、腸関門の破壊により、微生物叢が炎症性T細胞に長時間さらされるため、Tエフェクター細胞の増殖と炎症性サイトカインの産生がさらに促進される。最近の研究では、代謝チェックポイント阻害によるTregの増殖と微生物特異的CD4+T細胞の活性化の排除が、大腸炎を予防した(Zhaoら、2020年)。このように、炎症性T細胞と抗炎症性T細胞のバランスを解消し、腸管バリアを修復することは、慢性炎症反応を抑制し、さらなる組織損傷を防ぐために不可欠である。
IBD後の微生物相の変化
腸内細菌叢は高度な適応性を示し、食事介入によって変化させることができるため、治療操作の可能性を提供する。しかし、この順応性はリスクでもあり、バランスの悪い食事や不健康な食事は微生物叢に有害な変化をもたらし、病気にかかりやすくなる。バクテロイデス・フラギリス(Bacteroides fragilis)、アッカーマンシア・ムチニフィラ(Akkermansia muciniphila)、ラクトバチルス・プランタラム(Lactobacillus plantarum)、バクテロイデス・テタイオタミクロン(Bacteroides thetaiotaomicron)、フェーカリバクテリウム・プラウスニッツィイ(Faecalibacterium prausnitzii)などの特定の細菌株は、腸管バリア機能を促進し、Treg活性化を介して炎症を抑制し、IECにおけるタイトジャンクションタンパク質の発現を増強することが確認されている(Lavasaniら、2010;Roundら、2011;Martínら、2015;Wangら、2018)。腸内微生物ディスバイオシスとして知られるこれらの微生物群集の乱れは、免疫系、代謝、腸内ホルモンの調節障害に関連している(Wu and Wu, 2012)。これらの調節異常は、最終的には大腸炎などの炎症性疾患や自己免疫疾患の発症につながる可能性がある(Royら、2017年)。
高繊維食の有益な効果は、IBDを管理するための潜在的な治療戦略として検討されてきた。食物繊維は、植物性食品に自然に含まれる難消化性の炭水化物である。ヒトの消化酵素では特定の炭水化物を分解することはできないが、腸内細菌叢によって発酵させることができる。最も広く研究されている代謝産物は、酢酸、プロピオン酸、酪酸を含む短鎖脂肪酸(SCFA)である(Dai and Chau, 2017)。高繊維食はIBDにおいて複数の有益な効果を示している。高繊維食は、有益な細菌の増殖を促進し、微生物の多様性を高め、腸管バリア機能を改善し、SCFAの産生を通じて抗炎症作用を発揮する(Yusuf et al.) IBDは、食物繊維の摂取量が減少し、糖分や脂肪の摂取量が増加することを特徴とする欧米化した食生活と関連している(Liら、2020年)。その結果、マイクロバイオームの組成が大きく変化し、大腸菌やフソバクテリウムが増殖し、A. muciniphilaや、特にクロストリジウムクラスターIVおよびXIVa内のF. prausnitzii、Roseburia種、Eubacterium rectaleなどの有益な細菌が減少する(Frank et al、 2007; Louis and Flint, 2009; Ohkusa et al., 2009; Sokol et al., 2009; Smith et al., 2013; Zhang et al., 2017; Zhu et al., 2018; Earley et al., 2019; Dubinsky et al., 2022; Liu et al., 2022a)。共に、腸内細菌叢と食物分子は、Treg上のTLR活性化、またはそのT細胞受容体を介した細菌抗原の認識などのメカニズムを通じて、腸管Tregの集団と機能の維持に重要な役割を果たしている(Lathropら、2011;Roundら、2011)。このように、微生物の多様性が大きく変化することは、個人の炎症解決能力に影響を及ぼす可能性がある。IBD後の腸管透過性亢進を引き起こすメカニズムに対処することで、細菌抗原への曝露、炎症、組織損傷を軽減することができる。
IBDにおける粘液バリアの破壊
他の臓器とは異なり、腸管免疫系は常に細菌や外来抗原にさらされている。ゴブレット細胞は、微生物が豊富な内腔を宿主組織や免疫細胞から隔てる物理的バリアとして機能する粘液の厚い層を産生する役割を担っている(Pelaseyed et al.) この粘液層は、分泌性免疫グロブリンA(IgA)および抗菌物質とともに、ムチン糖タンパク質MUC2から主に構成されている(Peterson et al.) 粘膜Tregは、自己抗原に対する炎症を抑制することでこのバリアの完全性を制御し、口腔寛容を促進する。実験的証拠から、粘液バリアと腸の炎症との間に双方向の関係があることが示されている(Van der Sluisら、2006;Gersemannら、2009;Shanら、2013;Allenspachら、2018;CuŽićら、2021)。Muc2を欠損させた遺伝子改変マウスは、緩い便、下痢、潜血などの大腸炎様症状を自発的に発症する(Van der Sluisら、2006)。これらのマウスはまた、Th1細胞とTh17細胞の上昇を示し、固有層におけるTregの減少を示す(Shan et al., 2013)。IBDの患者、げっ歯類およびイヌのモデルのいずれにおいても、腸組織の破壊は陰窩および杯細胞の細胞の喪失につながる(Gersemannら、2009;Allenspachら、2018;CuŽićら、2021)。慢性UC患者は、腸組織において分泌マーカーの発現増加とMUC2陽性杯状細胞の発現増加を示すにもかかわらず、これらの細胞は刺激によりムチンを産生することができなかった(van der Postら、2019;Singhら、2022)。これは、IBDでみられるムチンタンパク質のミスフォールディングが原因かもしれない(Heazlewoodら、2008)。このように、IBDの粘液層は薄くなるだけでなく、機能も変化しており、ムチンタンパク質のミスフォールディングはERストレスによる自然炎症にさらに寄与している(Pullanら、1994;Heazlewoodら、2008;Strugalaら、2008;Braunら、2009;van der Postら、2019;Kramerら、2023)。
また、UCおよびCD患者の腸粘膜では、ルミノコッカス・グナバス(Ruminococcus gnavus)やルミノコッカス・トークス(Ruminococcus torques)などの粘液溶解性細菌株がより拡大しており、粘液層の薄層化に寄与している可能性がある(Pngら、2010;Hallら、2017)。IBD患者の直腸生検では、健常人と比較して粘液層内に存在する細菌の数が多いことから(Schultszら、1999)、粘液バリアが薄くなることで、上皮組織が常在細菌にアクセスしやすくなる。このことは、免疫系への病原体関連分子パターン(PAMPs)の暴露の増加、慢性炎症、常在細菌に対する耐性の喪失につながる。IBD患者では、大腸菌、Pseudomonas fluorescens、Saccharomyces cerevisiae、好中球抗原に対する血清反応性抗体がみられた(Landers et al., 2002)。それに伴い、IBD患者の腸内細菌叢では、腸内細菌科、プロテオバクテリア科、S. cerevisiaeの相対量に変化がみられた(Kaakoushら、2012;Sokolら、2017;Khorsandら、2022)。IBDの治療法として抗原に対する経口耐性の使用を検討した実験的研究では、Treg数を増加させ、大腸炎を軽減させるという成功が示されているが、この有効性は臨床設定には反映されていない(Krausら、2004;Inoら、2016;Paiattoら、2017)。著者らは、IBD患者における経口耐性メカニズムの欠陥は、特定の新抗原ではなく、遺伝子異常に起因する可能性があると主張している(Krausら、2004)。
IBDにおける上皮バリアの破壊
粘液層の下には、特殊なIECからなる物理的バリアがある(Boudry et al., 2004)。管腔環境と体内とのインターフェイスとして機能するこのバリアは、消化中に刻々と変化する腸内環境に適応できなければならない。基底部陰窩に存在する腸管幹細胞は定期的に増殖し、絨毛先端を補充する特殊なIECへと分化する(Creamerら、1961;Umar、2010)。これらの特殊なIECには、抗微生物物質を産生する腸細胞、粘液を産生する杯細胞、分泌性のパネス細胞、消化中の腸の活動を監視・調節する腸内分泌細胞、リンパ組織に近接して外来抗原をサンプリングするM細胞などが含まれる(Hooper, 2015)。栄養交換は、細胞内を通過するか、細胞間を通過するかによって行われ、それぞれ経細胞輸送、傍細胞輸送と呼ばれている(Edelblum and Turner, 2015)。
傍細胞透過性は、タイトジャンクションタンパク質(TJP)、アドヘレンスタンパク質、ギャップジャンクションタンパク質の再配列によって制御される(Shah and Misra, 2011; Yu and Li, 2014)。TJPは内腔に最も近いところにあり、主にクローディン、オクルディン、ゾナ・オクルデンス(ZO)タンパク質で構成されている(Ulluwishewa et al.) その下には、カテニンやカドヘリンなどのアドヘレンスやギャップ結合があり、細胞内コミュニケーションや細胞間接着に関与している(Farquhar and Palade, 1963)。IBDでは、これらの細胞外輸送成分の再分布が観察される(Landy et al., 2016; CuŽić et al., 2021; Hu et al., 2021)。特発性IBDのイヌでは、クローディンおよびβ-カテニンタンパク質の発現に変化はないが、E-カドヘリンの発現は減少している(Ohta et al., 2014)。クローディン-2の分布はIBD患者の大腸腸管陰窩全体で様々であり、粘膜潰瘍、びらん、好中球浸潤部位に隣接してクローディンの発現低下がみられた(CuŽić et al., 2021)。TJPの再配列は上皮細胞の増殖と細胞分化の亢進を伴い、活動性UCでは三細胞性TJPであるトリセリンの消失もみられ、寛解期には回復していた(CuŽić et al., 2021; Hu et al., 2021)。大腸におけるクローディン発現の変化は、IBDのマウスモデルでも再現され、デキストラン硫酸ナトリウム(DSS)誘発性大腸炎後、IECではクローディン-8の発現が増加し、陰窩増殖領域ではクローディン-2の発現が増加した(CuŽićら、2021)。IBDにおけるTJPの消失は、炎症と免疫細胞の流入に対応するためのIECの再配列の結果であると考えられる。
粘液バリアに対するT制御細胞の影響
最近の証拠から、微生物による腸内環境の異常が粘膜DCの機能を破壊し、口腔内寛容を破壊することが示されている(Fukkayaら、2023)。IBDの場合、寛容原性DCからTregに提示されるのではなく、損傷した上皮によって管腔抗原が宿主組織に侵入し、免疫細胞を直接活性化させると主張することができる。このことは、粘膜免疫系に対する調節された抗原曝露の重要性と、粘液バリアの役割を浮き彫りにしている。無傷の粘液バリアーを欠くMuc2-/-マウスでは、経口耐性の誘導が困難であり、これはMUC2を体内に再導入して初めて回復した(Shanら、2013年)。MUC2でコーティングされた細菌をDCが摂取すると、炎症反応が緩和され、IL-10の産生が誘導される(Shanら、2013年)。これらの寛容化されたDCは、Th1とTh17細胞の増殖を抑制する一方で、Treg Foxp3の発現と拡大を促進した(Shanら、2013;Parrishら、2022)。その結果、Treg由来のIL-10は、IBDの組織破壊に寄与するIL-17産生細胞や薄層前膜リンパ球を抑制することで、粘膜免疫の恒常性を維持する(Chaudhryら、2011;Jamesら、2016;Globigら、2022)。Tregと杯細胞との直接的な相互作用もまた、IBDにおける粘膜の完全性の維持に重要な役割を果たしている可能性がある。IL-10を欠損した動物は、特徴的に自然大腸炎を発症し、これらの動物も杯細胞集団とムチン分泌の減少を示す(Xueら、2016;López Cauceら、2020;López-Cauceら、2023)。上述のように、IBD患者における粘液バリアの問題の一つは、ムチンタンパク質のミスフォールディング現象であり、自然発症大腸炎の動物モデルで行われた研究では、IL-10の投与により、ムチンタンパク質のフォールディングと杯細胞による粘液分泌が維持されることが明らかになった(Hasnainら、2013)。このように、粘膜Tregの強固な集団を確立することは、腸のバリア機能を回復させ、抗原提示を制御し、炎症を抑える上で鍵となる可能性がある。
上皮バリアに対するT制御細胞の影響
Tregは、腸上皮のバリア機能を維持するのに重要なタイトジャンクションの完全性を促進することが分かっている。Rag1 -/-マウスへのTregの養子移入は、ZO-1、オクルディン、クローディン1、クローディン2の発現の回復を通じて、実験的肝硬変における腸管透過性を防御した(Juanola et al.) 特発性IBDのイヌにおいて、ラクトバチルス、ビフィドバクテリウム、ストレプトコッカス・スルリバリウスを含むプロバイオティックカクテルの投与は、CD4+細胞浸潤を減少させ、Foxp3+トレグの集団を増加させ、腸粘膜組織におけるオクルディンとクローディン2の発現を増加させることにより、臨床症状を有意に軽減した(Rossiら、2014年)。ビフィズス菌、乳酸桿菌、腸球菌を含むプロバイオティクス混合物の投与は、実験的および臨床的IBDに対して成功を示し、これはTJP構造の回復、大腸Tregのアップレギュレーション、大腸TNF-α、IFN-γ、CD4+細胞の減少に起因している(Cuiら、2004;Zhaoら、2013;Zhangら、2018)。Tregが炎症を抑えるように作用することで、炎症が介在するTJPの再配列が緩和されると考えられる。
Foxp3+トレグは、上皮幹細胞の再生をサポートすることによって、IECのバランスと安定性を維持する。In vitroのオルガノイド研究では、Treg細胞がIL-10を産生して幹細胞の再生を促進することが実証されている(Biton et al.) 上述したように、TregによるIL-10産生は、大腸粘膜表面における組織病理学と炎症を制限する(Rubtsovら、2008年)。そのメカニズムの一つは、TNF-αやIFN-γなどの炎症性メディエーターや、Fas/Fasリガンドを介したT細胞媒介性アポトーシスに対するIECの感受性を低下させることである(Bharhaniら、2006)。生体内でのTreg枯渇は、腸管幹細胞の割合の減少やIEC分化率の上昇に関連している(Bitonら、2018年)。さらに、IL-10-/マウスでは、パネス細胞などの特殊化したIECの数が減少しており、IBDで観察されるこれらの細胞集団の減少は、病原体に対する宿主の抗微生物防御、栄養吸収を損ない、微生物組成を変化させる可能性がある(Schopfら、2002;Simmondsら、2014;Xueら、2016;Shimizuら、2020;Wehkamp and Stange、2020)。
IECから送られるシグナルもまた、Tregの集団と機能に影響を与える。TGF-βやレチノイン酸などのIEC由来因子は、DCに寛容表現型を誘導し、大腸炎を防御するTregを分化させる(Ilievら、2009年)。リンパ節内に存在するTregと比較して、上皮バリアに存在するFoxp3+ Tregは、生存するためのIL-2の必要性を失い、CD25の発現が減少し、CTLA4をアップレギュレートすることで、その抑制能力を高めている(Prakharら、2021年)。IECがアポトーシスするとFoxp3+ Treg細胞が失われるため、IEC集団の維持は不可欠である(Nakahashi-Odaら、2016)。このように、IBDにおける組織バリアの破壊とIECの減少は、必然的に腸管Treg集団と抗炎症性免疫応答に悪影響を及ぼす。
栄養、マイクロバイオーム、T制御細胞の相互作用
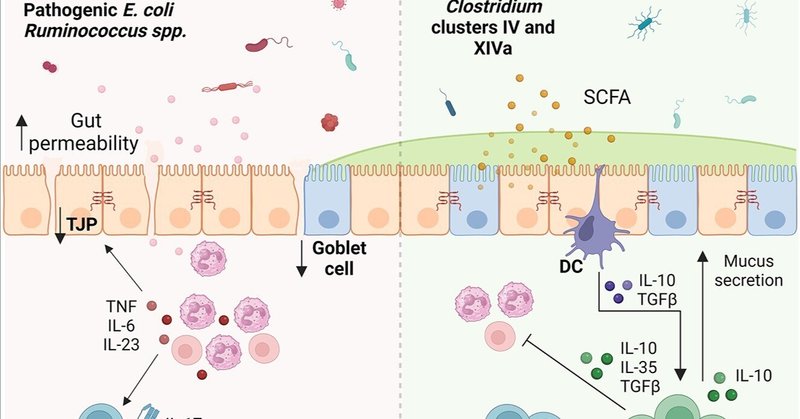
効果的なIBD治療は、微生物集団、腸管透過性、粘液バリア、Treg集団の破壊に同時に対処できる必要がある。微生物による腸内環境の異常と慢性腸炎との関連を考えると、食事療法が疾患の管理に重要な役割を果たすことが理解される。IBDに関する複数の臨床研究において、食物繊維の補給が炎症性サイトカイン、微生物ディスバイオシスの減少、寛解率の改善に役立つことが実証されている(Faghfooriら、2011、2014;Chibaら、2015;Fritschら、2021)。食物繊維には抗炎症作用があるため、患者には、耐えられる量を少しずつ食事に戻すことが推奨される。食事因子はTreg集団に直接影響するだけでなく、腸内細菌叢を通じて間接的な影響を及ぼす可能性もある(Smithら、2013;Geirnaertら、2014;Bitonら、2018;Nieら、2021;Yoshimatsuら、2022;Bourdeau-Julienら、2023)。その結果、Tregは、IBD治療のための食物繊維の抗炎症能を大幅に高めることができる(Gaudierら、2004;Pérez-Reytorら、2021)。食物繊維の分解を低下させるIBDに関連した微生物異常は、個体の炎症制御能力に大きく影響する可能性がある(Frankら、2007;LouisおよびFlint、2009;Sokolら、2009;Smithら、2013;Zhangら、2017;Zhuら、2018;Earleyら、2019;Liuら、2022a)。このように、腸関門を回復させるために、IBDにおけるTregの集団と機能を再形成する役割について、栄養の影響を探る必要がある(図1)。
図1
www.frontiersin.org
図1. 食物繊維が炎症性腸疾患(IBD)に及ぼす影響。IBDは食物繊維の少ない食事と相まって、微生物異常症を引き起こす。腸内環境に放出された微生物抗原は免疫細胞に認識され、免疫活性化とTヘルパー(Th)17細胞などのT細胞のリクルートメントにつながる。腫瘍壊死因子(TNF)、インターロイキン(IL)-6、IL-23、IL-17、インターフェロン(IFN)-γなどの炎症性サイトカインの過剰産生は、上皮バリアを損傷し、タイトジャンクションタンパク質(TJP)の損失、杯細胞の損失、粘液産生の低下、腸透過性の上昇をもたらす。腸管透過性の亢進は、微生物曝露と免疫活性化を永続させ、慢性炎症と組織損傷を引き起こす。逆に、食物繊維を摂取すると、クロストリジウム(Clostridium)クラスターIVおよびXIVaの短鎖脂肪酸(SCFA)産生菌が増殖する。SCFAは結腸細胞の燃料となり腸のバリアを強化し、樹状細胞(DC)を寛容化することで、IL-10やトランスフォーミング成長因子-β(TGFβ)などの抗炎症性サイトカインの産生につながる。これらのサイトカインは、炎症細胞を抑制し、杯細胞機能と粘液分泌を促進するT制御細胞(Tregs)の増殖を促進し、上皮バリア再構築の機会を提供する(BioRender.comで作成)。
食事パターンの短期的な変更は、腸内細菌叢の構成に影響を与える可能性がある。個人を対象とした研究では、極端な食事の変更後3日以内に、SCFA産生菌であるButyricicoccusおよびRoseburiaを含む細菌および代謝プロファイルが有意に変化することが実証されている(Geirnaertら、2014;Nieら、2021;Bourdeau-Julienら、2023)。腸内細菌叢は、Tregの分化、機能、生存を直接調節することができるが、それらが産生する代謝産物を介して間接的な影響を及ぼすこともある。注目すべきことに、大腸Tregは、G共役タンパク質受容体(GPR)、およびアリール炭化水素受容体(AhR)をコードする遺伝子を高発現している(Smithら、2013;Yeら、2017;RothhammerおよびQuintana、2019;JiangおよびWu、2022)。これにより、Tregは食事や微生物の代謝産物を効果的に感知し、反応することができる。しかし、CARD9感受性遺伝子のようなIBD患者の遺伝子欠損は、AhRアゴニストを産生する能力を損なう可能性がある(Lamasら、2016)。このことは、細菌の代謝産物に適切に反応する能力を阻害し、この疾患の発症に食事が大きく影響し、腸管バリアの障害と透過性が持続することの説明となりうる。研究により、AhRの刺激は、腸管幹細胞の増殖を促進する大腸Tregのリクルートを促進することが示されている(Bitonら、2018;Yoshimatsuら、2022)。具体的には、食生活の変化はB. thetaiotaomicron細菌種の集団を変化させ、その結果、B. thetaiotaomicron細菌種はAhRを活性化してTregの分化を促進することができる(Wegorzewskaら、2019;Liら、2021)。AhRリガンドによる治療は、IL-10を分泌するTregの集団を増加させることにより、TNBS大腸炎を緩和することが判明している(Goettel Jeremyら、2016年)。しかしながら、難治性UCを治療するためのAhRアゴニストの臨床使用は、肺動脈性肺高血圧症などの潜在的な副作用のため、広く推奨されていない(Naganumaら、2018;Yoshimatsuら、2019;Saikiら、2021)。
多様な有益な効果、食物繊維の入手のしやすさ、さらに重要な安全性プロファイルを考慮すると、食物繊維は上皮バリアの完全性とTreg機能の重要な貢献者として強調することができる。実際、SCFAsの補給は無菌マウスにおいて大腸Tregの拡大を促進し、その後のプロピオン酸チャレンジはこれらのTregにおけるFoxp3とIL-10の発現を有意に増加させる(Smithら、2013)。その結果、Treg治療は、細菌チャレンジ後に通常減少する腸内のSCFA濃度の維持を助けることができる(Juanola et al.) 恒常的な条件下では、ClostridiumクラスターXIVaの細菌種、Roseburia intestinalisおよびE. rectaleを含むムチン付着微生物叢は、上皮付近で酪酸を産生する(Van den Abbeele et al.) IBDにおいてこれらの微生物種が減少するのは、それらの微生物が付着する粘液が減少するためである可能性がある。その結果、IECに対するSCFAの生物学的利用能が低下し、腸管バリアの再生が損なわれることになる。SCFAは杯細胞やIECに直接作用して粘液分泌や上皮の健康状態を改善することが報告されているが、Tregの助けを借りずに腸の過剰な炎症状態を抑制するには不十分である(Gaudierら、2004;Pérez-Reytorら、2021)。カンジダ・アルビカンスによる腸炎症の動物モデルにおいて、Treg枯渇マウスにSCFAを投与しても単独では炎症は解消されなかったが、SCFAが粘膜炎症時の保護作用を媒介するFoxp3+ Tregを誘導することがわかった(Bhaskaranら、2018)。同様に、大腸炎のT細胞移入モデルにおいて、T細胞およびB細胞が欠損したマウスを、Tregが存在しない状態でSFCAミックスまたはプロピオン酸で処理した。しかし、大腸炎が治癒したのは、TregとSCFAを併用した場合のみであった(Smithら、2013年)。Sunらは、SCFAで処理したCD4+ T細胞がより多くのIL-10を産生し、大腸炎の重症度を軽減することを示した(Sunら、2018)。これらのSCFA媒介作用は、抗IL-10R抗体による治療後に減少し、IBD後の炎症の抑制における免疫関連機序の重要性がさらに強調された(Sunら、2018)。これらの知見は、細菌の代謝産物とTreg活性の間の重要な相互作用を強調している。
腸内細菌叢の変化は、個人の炎症制御能力に大きく影響する。IBDは、A. muciniphilaや、F. prausnitzii、Roseburia種、E. rectaleを含むClostridium種などのSCFA産生細菌の減少によって特徴づけられる(Frankら、2007;Louis and Flint、2009;Sokolら、2009;Smithら、2013;Zhangら、2017;Zhuら、2018;Earleyら、2019;Liuら、2022a)。SCFA産生微生物集団の枯渇は、炎症を制御する腸管免疫系の能力に有害な影響を及ぼす。これらのSCFA産生細菌株は、大腸炎に対する防御のために大腸Foxp3+ Tregの集団を維持する上で重要な役割を果たしている(Atarashi et al.) より具体的には、A. muciniphilaの補給は、RORγt+Foxp3+ T制御17細胞のアップレギュレーションを通じて、動物におけるCD4 T細胞移入モデルの大腸炎に対して有益であることが証明されている(Liuら、2022b)。これらのRORγt+Foxp3+ Tregはまた、免疫調節マーカーを発現し、腸の炎症を効果的に抑制することができる(Yangら、2016)。ClostridiumクラスターIVおよびXIVaの常在細菌種によるコロニー形成は、DSS誘発大腸炎マウスの粘膜組織におけるTregの分化と蓄積を促進する(Atarashi et al.) E. rectaleによるコロニー形成は、Tregの分化と機能を促進する(Islamら、2021年)。F. prausnitziiとR. intestinalisはともに、Treg集団を増加させ、動物における2,4,6-トリニトロベンゼンスルホン酸(TNBS)誘発性大腸炎を緩和する能力を実証している(Qiu et al.、2013;Zhu et al.、2018)。細菌はTregの個体数を増加させるだけでなく、その代謝産物を介してその機能も高める。酪酸で治療した個体からのTregはIL-10の分泌増加を示し、酪酸誘導Tregの養子移入はマウスの大腸炎を改善する能力を有することが示された(Furusawa et al.) Tregへの影響とは別に、細菌F. prausnitziiはヒト末梢血単核細胞(PBMC)によるIL-10およびTGF-βの分泌を促進することができ、一方、R. intestinalisはヒト結腸細胞によるLPS誘発IL-17産生を阻害する(Qiuら、2013;Zhuら、2018)。このように、IBDにおけるこれらの微生物種の損失は、過剰な炎症反応と、そのような炎症を抑制するTregの能力低下に寄与している可能性がある。
IBDの治療にTregを用いることを模索する現在の研究は、有望である。前臨床データでは、in vivoの大腸炎モデルを用いて、これらの細胞の有効性が実証されている(Ogino et al.、2012;Goettel et al.、2019)。低用量のTreg成長因子IL-2の注入を含む第1b/2a相臨床試験でも、同様の有益な所見が見られた(Allegrettiら、2021年)。Allegrettiら(2021)は、IL-2のいくつかの用量を試験し、最低用量で末梢Tregの拡大に成功したが、Tエフェクター細胞の活性化にも成功した。IL-2の投与量を増やし、Tregの集団を増やすと、患者の38%以上が臨床的奏効または寛解を得ることができた。CD患者を対象とした1/2a臨床試験では、自己Tregによる直接治療が試験され、この試験では、Treg治療は忍容性が高く、一過性ではあるが有益な効果が得られた(Desreumauxら、2012年)。これは、表現型の安定性や治療に用いる細胞の初期スクリーニングに問題があったためかもしれない。このように、Tregの増殖、ホーミング特性、部位特異的活性化、生存、表現型の安定性については、臨床的に評価すべき未解決の問題が残っている。これは、治療としてのTregの安全性と有効性を保証するために重要であろう。全体として、Tregに焦点を当てた治療はIBD治療の有望なアプローチとなりうるが、最適な治療プロトコールを決定するためにはさらなる研究が必要である。
結論
制御性T細胞は、腸管バリアの完全性を維持する上で中心的な役割を果たしている。経口耐性、粘液バリア、上皮細胞、制御された免疫応答の維持のために、宿主微生物叢、食事性分子、T制御細胞の間で相互作用が起こっている。これらの相互作用はIBDに特徴的な過剰な炎症を防ぎ、したがって腸管バリアを継続的な炎症性損傷から保護することができる。栄養、マイクロバイオーム、および腸管バリア制御のためのTregへの影響との相互作用を理解することで、IBD発症を促進するメカニズムによりよく対処することができる。
著者貢献
KP:構想、調査、執筆(原案)、執筆(校閲・編集)。JO:執筆-校閲・編集、資金獲得。RG:構想、調査、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明している。本研究はNHMRCの支援を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない中で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Adam, S. F., Kristine Højgaard, A., Aske, T. I., Manasi, A., Jeremiah, F., Jean-Frederic, C., et al. 年齢を超えた炎症性腸疾患の危険因子としての抗生物質使用:集団ベースのコホート研究。Gut. doi: 10.1136/gutjnl-2022-327845
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
Adenis, A., Colombel, J. F., Lecouffe, P., Wallaert, B., Hecquet, B., Marchandise, X., et al. クローン病における肺および腸管透過性の亢進。Gut. 33, 678.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Allegretti, J., Canavan, J., Mitsialis, V., Hamilton, M., Carrellas, M., Freer, K., et al. 中等度から重度の潰瘍性大腸炎の治療における低用量Il-2。Gastroenterology. doi: 10.1053/j.gastro.2021.01.053
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Allenspach, K. A., Mochel, J. P., Du, Y., Priestnall, S. L., Moore, F., Slayter, M., et al. 特発性炎症性腸疾患の犬における消化管病理組織学的変化と臨床的疾患活動性の相関。Vet. Pathol. 56, 435-443. doi: 10.1177/0300985818813090
パブコメ抄録|クロスリファレンス全文|Google Scholar
Arpaia, N., Campbell, C., Fan, X., Dikiy, S., van der Veeken, J., deRoos, P., et al. 常在細菌が産生する代謝産物は、末梢制御性T細胞の生成を促進する。Nature. 504, 451-455. doi: 10.1038/nature12726
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Arrieta, M. C., Madsen, K., Doyle, J., and Meddings, J. (2009). 小腸透過性の低下はIL10遺伝子欠損マウスにおける大腸炎を抑制する。Gut. 58, 41-48. doi: 10.1136/gut.2008.150888
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
アタラシ, K., タノウエ, T., シマ, T., イマオカ, A., クワハラ, T., モモセ, Y., et al. 土着クロストリジウム種による大腸制御性T細胞の誘導。Science. 331, 337-341.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Baumgart, D. C., and Carding, S. R. (2007). 炎症性腸疾患:その原因と免疫生物学。Lancet. doi: 10.1016/S0140-6736(07)60750-8
クロスレフ・フルテキスト|Google Scholar
Beck, K. E., Blansfield, J. A., Tran, K. Q., Feldman, A. L., Hughes, M. S., Royal, R. E., et al. 癌患者における細胞傷害性Tリンパ球関連抗原4の抗体遮断後の腸炎。J. Clin. Oncol. 24, 2283-2289. doi: 10.1200/JCO.2005.04.5716
パブコメ要旨|全文|Google Scholar
Bharhani, M. S., Borojevic, R., Basak, S., Ho, E., Zhou, P., Croitoru, K., et al. IL-10は、Fasの発現を調節し、カスパーゼ-8とFLIPの発現を変化させることにより、Fas誘導アポトーシスからマウス腸管上皮細胞を保護する。Am. J. Physiol. Gastroint. 肝臓生理学 291, G820-G9.
パブコメ抄録|全文|Google Scholar
Bhaskaran, N., Quigley, C., Paw, C., Butala, S., Schneider, E., Pandiyan, P., et al. 粘膜感染時のT(regs)と免疫病理の制御における短鎖脂肪酸の役割。Front. Microbiol. 9, 1995. doi: 10.3389/fmicb.2018.01995
PubMed Abstract|RefRef Full Text|Google Scholar
Bin Dhuban, K., d'Hennezel, E., Nashi, E., Bar-Or, A., Rieder, S., Shevach, E. M., et al. TIGITとFCRL3の共発現により、Helios+ヒト記憶制御性T細胞が同定される。J. Immunol. 194, 3687-3696. doi: 10.4049/jimmunol.1401803.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Biton, M., Haber, A. L., Rogel, N., Burgin, G., Beyaz, S., Schnell, A., et al. Tヘルパー細胞サイトカインは、腸管幹細胞の再生と分化を調節する。Cell. 175, 1307-20.e22. doi: 10.1016/j.cell.2018.10.008
PubMed Abstract|クロスリファレンス全文|Google Scholar
Boudry, G., Yang, P. C., and Perdue, M. H. (2004). 小腸、解剖学」、『消化器病学百科事典』、L. R. Johnson(ニューヨーク)編。doi:10.1016/B0-12-386860-2/00648-1。
クロスレフ・フルテキスト|Google Scholar
Bourdeau-Julien, I., Castonguay-Paradis, S., Rochefort, G., Perron, J., Lamarche, B., Flamand, N., et al. 健康な集団において、食事は腸内細菌叢と宿主脂質メディエーターに迅速かつ異なる影響を与える。マイクロバイオーム。11, 26. doi: 10.1186/s40168-023-01469-2
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Brahmer, J. R., Drake, C. G., Wollner, I., Powderly, J. D., Picus, J., Sharfman, W. H., et al. 難治性固形がんを対象とした抗プログラム死-1(MDX-1106)単剤の第I相試験:安全性、臨床活性、薬力学、および免疫学的相関。J. Clin. Oncol. 28, 3167-3175.
クロスレフ・フルテキスト|Google Scholar
Braun, A., Treede, I., Gotthardt, D., Tietje, A., Zahn, A., Ruhwald, R., et al. 潰瘍性大腸炎における腸管粘液バリアのリン脂質濃度と種の組成の変化:病因の手がかり。Inflamm. Bowel Dis. 15, 1705-1720.
パブコメ要旨|全文|Google Scholar
Cao, H., Diao, J., Liu, H., Liu, S., Liu, J., Yuan, J., et al. 炎症性腸疾患におけるTh1細胞とTh17細胞の病原性と相乗作用。Inflamm. Bowel Dis. 29, 818-829. doi: 10.1093/ibd/izac199
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chaudhry, A., Samstein, R. M., Treuting, P., Liang, Y., Pils, M. C., Heinrich, J. M., et al. 制御性T細胞におけるインターロイキン10シグナル伝達は、Th17細胞を介する炎症の抑制に必要である。Immunity. 34, 566-578. doi: 10.1016/j.immuni.2011.03.018.
パブコメ要旨|全文|Google Scholar
千葉正樹、辻哲夫、中根健次、小松正人(2015).食物繊維の多量摂取はクローン病に有害ではなく好ましい。Perm. 日本パーマ学会誌 19, 58-61.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Collison, L. W., Workman, C. J., Kuo, T. T., Boyd, K., Wang, Y., Vignali, K. M., et al. 抑制性サイトカインIL-35は制御性T細胞機能に寄与する。Nature. 450, 566-569. doi: 10.1038/nature06306
PubMed Abstract|全文|Google Scholar
Cooney, R., Baker, J., Brain, O., Danis, B., Pichulik, T., Allan, P., et al. NOD2刺激は樹状細胞においてオートファジーを誘導し、細菌の処理と抗原提示に影響を与える。Nat. Med. 16, 90-97.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cosovanu, C., and Neumann, C. (2020). 腸におけるFoxp3+制御性T細胞の多くの機能。Front. Immunol. 11. doi: 10.3389/fimmu.2020.600973
クロスレフ・フルテキスト|Google Scholar
Creamer, B., Shorter, R. G., and Bamforth, J. (1961). 上皮細胞のターンオーバーと脱落。Gut. 2, 110. doi: 10.1136/gut.2.2.110.
CrossRef 全文|Google Scholar
Cui, H. H., Chen, C. L., Wang, J. D., Yang, Y. J., Cun, Y., Wu, J. B., et al. 潰瘍性大腸炎患者の腸粘膜に対するプロバイオティクスの効果。World J. Gastroenterol. 10, 1521-1525. doi: 10.3748/wjg.v10.i10.1521
パブコメ抄録|クロスリファレンス全文|Google Scholar
CuŽić, S., Antolić, M., Ognjenović, A., Stupin-Polančec, D., Petrinić Grba, A., Hrvačić, B., et al. クローディン:ヒトIBDおよびマウスモデルにおけるタイトジャンクションを超えて。Front. Pharmacol. doi: 10.3389/fphar.2021.682614.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dahl, E. K., Abed, O. K., Kjeldsen, J., Donia, M., Svane, I. M., Dige, A., et al. チェックポイント阻害薬誘発大腸炎におけるインフリキシマブとコルチコステロイド療法の安全性と有効性。Aliment. Pharmacol. Ther. 56, 1370-1382.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dai, F. J., and Chau, C. F. (2017). 食物繊維の分類と規制の視点。J. Food Drug. Anal. 25, 37-42. doi: 10.1016/j.jfda.2016.09.006.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Desreumaux, P., Foussat, A., Allez, M., Beaugerie, L., Hébuterne, X., Bouhnik, Y., et al. 難治性クローン病患者に対する抗原特異的制御性T細胞療法の安全性と有効性。Gastroenterology. 143, 1207-17.e2. doi: 10.1053/j.gastro.2012.07.116
パブコメ抄録|クロスリーフフルテキスト|Google Scholar
Dubinsky、V.、Reshef、L.、Rabinowitz、K.、Wasserberg、N.、Dotan、I.、Gophna、U.ほか(2022年)。炎症性腸疾患患者由来の大腸菌株は疾患特異的ゲノム適応を有する。J. Crohn's Colit. 16, 1584-1597. doi: 10.1093/ecco-jcc/jjac071
PubMed Abstract|クロスリファレンス全文|Google Scholar
Earley, H., Lennon, G., Balfe, Á., Coffey, J. C., Winter, D. C., O'Connell, P. R., et al. 健康および潰瘍性大腸炎におけるAkkermansia muciniphilaの存在量と硫酸化大腸ムチンとの関係。Sci. Rep. 9, 15683. doi: 10.1038/s41598-019-51878-3.
パブコメ抄録|Ref 全文|Google Scholar
Edelblum, K. L., and Turner, J. R. (2015). "第12章 上皮細胞:構造、輸送、バリア機能" 粘膜免疫学(第4版), eds. J. Mestecky, W. Strober, M. W. Russell, B. L. Kelsall, H. Cheroutre, B. N. Lambrecht (Boston: Academic Press), 187-210.
Google Scholar
Faghfoori, Z., Navai, L., Shakerhosseini, R., Somi, M. H., Nikniaz, Z., Norouzi, M. F., et al. 潰瘍性大腸炎患者における血清腫瘍壊死因子-α、インターロイキン-6および-8に対する発芽大麦食品の経口補給の効果。Ann Clin. Biochem. 48, 233-237. doi: 10.1258/acb.2010.010093
パブコメ抄録|全文|Google Scholar
Faghfoori, Z., Shakerhosseini, R., Navai, L., Somi, M. H., Nikniaz, Z., Abadi, A., et al. 潰瘍性大腸炎患者の血清CRP値と臨床徴候に対する発芽大麦食品の経口補給の効果。Health Promot. Perspect. 4, 116-121.
PubMed Abstract|Google Scholar
Fantini, M. C., Rizzo, A., Fina, D., Caruso, R., Sarra, M., Stolfi, C., et al. Smad7は、制御性T細胞を介した抑制に対する結腸原性T細胞の抵抗性を制御する。Gastroenterology. 136, 1308-16.e1-3. doi: 10.1053/j.gastro.2008.12.053
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Farquhar, M. G., and Palade, G. E. (1963). 様々な上皮における接合複合体。J. Cell Biol. 17, 375-412.
クロスレフ・フルテキスト|Google Scholar
Figliuolo da Paz, V. R., Jamwal, D. R., and Kiela, P. R. (2021). 腸管制御性T細胞。Adv. Exp. Med. 生物学 1278, 141-190.
クロスレフ・フルテキスト|Google Scholar
Frank, D. N., St Amand, A. L., Feldman, R. A., Boedeker, E. C., Harpaz, N., and Pace, N. R. (2007). ヒト炎症性腸疾患における微生物群集の不均衡の分子系統学的特徴づけ。Proc. Nat. Acad. この論文では、ヒト炎症性腸疾患における微生物群集の不均衡を分子系統学的に明らかにした。
PubMedアブストラクト|全文|Google Scholar
Freeman, B. E., Meyer, C., and Slifka, M. K. (2014). 抗炎症性サイトカインは、生得的CD8+ T細胞の機能を直接阻害するが、適応的CD8+ T細胞の機能は阻害しない。J. Virol. 88, 7474-7484. doi: 10.1128/JVI.00658-14
パブコメ要旨|全文|Google Scholar
Fritsch、J.、Garces、L.、Quintero、M.A.、Pignac-Kobinger、J.、Santander、A.M.、Fernández、I.、他(2021)。低脂肪・高繊維食は、潰瘍性大腸炎患者において、炎症とディスバイオシスのマーカーを低下させ、QOLを改善する。Clin. Gastroenterol. Hepatol. 19, 1189-99.e30. doi: 10.1016/j.cgh.2020.05.026
PubMed Abstract|全文|Google Scholar
藤野 聡、安藤 敦、Bamba, S.、小川 敦、秦 浩一、荒木 靖之、他(2003)。炎症性腸疾患におけるインターロイキン17の発現亢進。Gut. 52, 65-70. doi: 10.1136/gut.52.1.65
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
深谷知之、宇都利彦、三苫慎太郎、高木秀明、西川祐子、富永正明、他(2023).腸内細菌異常症は、粘膜樹状細胞の機能障害を介した経口耐性の破綻を促進する。セルレップ42, 112431.
パブコメ要旨|全文|Google Scholar
Furness, J. B., Callaghan, B. P., Rivera, L. R., and Cho, H. J. (2014). "腸神経系と消化管神経支配:統合された局所制御と中枢制御", in Microbial Endocrinology: The Microbiota-Gut-Brain Axis in Health and Disease, eds. また、そのような病態は、腸内細菌によって引き起こされることが示唆されている。
パブコメ抄録|全文|Google Scholar
古澤靖彦、小畑由佳、福田聡志、遠藤忠明、中藤剛志、高橋大輔、他(2013)。腸内細菌由来の酪酸は大腸制御性T細胞の分化を誘導する。Nature. 504, 446-450. doi: 10.1038/nature12721
パブコメ要旨|全文|Google Scholar
Gaudier, E., Jarry, A., Blottière, H. M., de Coppet, P., Buisine, M. P., Aubert, J. P., et al. 酪酸は、グルコースを除去した腸管上皮杯細胞におけるMUC遺伝子発現を特異的に調節する。Am. J. Physiol. Gastroint. 肝臓生理学 287, G1168-G74.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Geirnaert, A., Steyaert, A., Eeckhaut, V., Debruyne, B., Arends, J. B. A., Van Immerseel, F., et al. プロバイオティクスの可能性を持つ酪酸産生菌Butyricicoccus pullicaecorumは、胃や小腸の状態に本質的に耐性がある。Anaerobe. 30, 70-74. doi: 10.1016/j.anaerobe.2014.08.010
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gersemann, M., Becker, S., Kübler, I., Koslowski, M., Wang, G., Herrlinger, K. R., et al. クローン病と潰瘍性大腸炎における杯細胞分化の違い。分化。77, 84-94.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gibney, G. T., Kudchadkar, R. R., DeConti, R. C., Thebeau, M. S., Czupryn, M. P., Tetteh, L., et al. 切除された高リスク転移性黒色腫におけるワクチン併用ニボルマブアジュバントの安全性、相関マーカー、および臨床成績。Clin. doi: 10.1158/1078-0432.CCR-14-2468.
PubMed Abstract|全文|Google Scholar
Gitter, A. H., Wullstein, F., Fromm, M., and Schulzke, J. D. (2001). 潰瘍性大腸炎における上皮バリア欠損: 電気生理学的イメージングによる特性化と定量化。Gastroenterology. doi: 10.1053/gast.2001.29694.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Globig, A. M., Hipp, A. V., Otto-Mora, P., Heeg, M., Mayer, L. S., Ehl, S., et al. 高次元プロファイリングにより、活動性クローン病におけるTc17細胞の濃縮が明らかになり、標的となりうるシグネチャーが同定された。Nat. Commun. 13, 3688. doi: 10.1038/s41467-022-31229-z
パブコメ抄録|全文|Google Scholar
Goettel Jeremy, A., Gandhi, R., Kenison Jessica, E., Yeste, A., Murugaiyan, G., Sambanthamoorthy, S., et al. AHR活性化は、ヒト化マウスにおいてT細胞によって駆動される大腸炎に対して保護的である。doi: 10.1016/j.celrep.2016.09.082.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Goettel, J. A., Kotlarz, D., Emani, R., Canavan, J. B., Konnikova, L., Illig, D., et al. 低用量インターロイキン2は、前臨床ヒト化マウスモデルにおいて大腸炎を改善する。Cell Mol. Gastroenterol. Hepatol. 8, 193-195. doi: 10.1016/j.jcmgh.2019.05.001
PubMed Abstract|クロスリファレンス全文|Google Scholar
Goldberg, R., Scotta, C., Cooper, D., Nissim-Eliraz, E., Nir, E., Tasker, S., et al. レチノイン酸受容体-b1の生体外ライゲーションによるクローナンド-2019病患者由来の欠損T調節細胞の補正。Gastroenterology. 156, 1775-1787. doi: 10.1053/j.gastro.2019.01.025
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gomollón, F., Dignass, A., Annese, V., Tilg, H., Van Assche, G., Lindsay, J. O., et al. 3rd European evidence-based consensus on the diagnosis and management of crohn's disease 2016: part 1: diagnosis and medical management. J. Crohn's Colit. 11, 3-25. doi: 10.1093/ecco-jcc/jjw168
PubMed Abstract | CrossRef Full Text | Google Scholar
Halfvarson, J., Brislawn, C. J., Lamendella, R., Vázquez-Baeza, Y., Walters, W. A., Bramer, L. M., et al. 炎症性腸疾患におけるヒト腸内細菌叢の動態。Nat. Microbiol. 2, 17004. doi: 10.1038/nmicrobiol.2017.4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hall, A. B., Yassour, M., Sauk, J., Garner, A., Jiang, X., Arthur, T., et al. 炎症性腸疾患患者に濃縮された新規Ruminococcus gnavusクレード。Genome Med. 9, 103. doi: 10.1186/s13073-017-0490-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hansberry, D. R., Shah, K., Agarwal, P., and Agarwal, N. (2017). 炎症性腸疾患のバイオマーカーとしての糞便ミエロペルオキシダーゼ。Cureus. 9, e1004. doi: 10.7759/cureus.1004.
PubMedアブストラクト|クロスリファレンス|Google Scholar
Hasnain, S. Z., Tauro, S., Das, I., Tong, H., Chen, A. C., Jeffery, P. L., et al. IL-10は、杯細胞におけるタンパク質のミスフォールディングと小胞体ストレスを抑制することにより、腸粘液の産生を促進する。Gastroenterology. 144, 357-68.e9. doi: 10.1053/j.gastro.2012.10.043
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Heazlewood, C. K., Cook, M. C., Eri, R., Price, G. R., Tauro, S. B., Taupin, D., et al. マウスにおける異常なムチンの集合は、小胞体ストレスと潰瘍性大腸炎に似た自然炎症を引き起こす。PLoS Med. 5, e54. doi: 10.1371/journal.pmed.0050054.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Heller, F., Florian, P., Bojarski, C., Richter, J., Christ, M., Hillenbrand, B., et al. インターロイキン13は、潰瘍性大腸炎における重要なエフェクターTh2サイトカインであり、上皮のタイトジャンクション、アポトーシス、細胞修復に影響を及ぼす。Gastroenterology. 129, 550-564. doi: 10.1016/j.gastro.2005.05.002
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hollander, D. (1988). クローン病はタイトジャンクションの透過性障害か?Gut. 29, 1621-1624.
PubMed Abstract|全文|Google Scholar
Hollander, D., Vadheim, C. M., Brettholz, E., Petersen, G. M., Delahunty, T., Rotter, J. I., et al. (1986). クローン病患者とその近親者における腸管透過性の亢進。考えられる病因。Ann. Intern. Med. 105, 883-885.
PubMed要旨|全文|Google Scholar
Hong, M. M. Y., and Maleki Vareki, S. (2022). 免疫療法の部屋の象に対処する:抗CTLA-4療法によるエフェクターT細胞のプライミングと制御性T細胞の枯渇の比較。Cancers. 14, 1580.
PubMed Abstract|全文|Google Scholar
Hooper, L. V. (2015). "第3章 - 上皮細胞の腸管免疫への寄与", Advances in Immunology, ed. doi: 10.1016/bs.ai.2014.11.003.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hu, J. C. E., Wei,ß, F., Bojarski, C., Branchi, F., Schulzke, J. D., Fromm, M., et al. 潰瘍性大腸炎の寛解において、三細胞タイトジャンクションタンパク質と傍細胞高分子バリアの発現が回復する。BMC Gastroenterol. 21, 141. doi: 10.1186/s12876-021-01723-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
飯田哲也、小野寺和彦、中瀬博之(2017).炎症性腸疾患の病態におけるオートファジーの役割. World J. Gastroenterol. 23, 1944-1953. doi: 10.3748/wjg.v23.i11.1944
クロスレフ・フルテキスト|Google Scholar
Iliev, I. D., Mileti, E., Matteoli, G., Chieppa, M., and Rescigno, M. (2009). 腸管上皮細胞は、樹状細胞コンディショニングを通じて、大腸炎を予防する制御性T細胞の分化を促進する。Mucosal Immunol. 2, 340-350.
PubMed Abstract|全文|Google Scholar
猪野 聡、晃田 慈、竹島 浩二、石川 浩司、野呂瀬 徹、矢持 徹、他(2016)。活性型デキストラン硫酸ナトリウム誘発大腸炎において経口耐性は誘導可能である。World J. Gastrointest. Pharmacol. Ther. 7, 242-253. doi: 10.4292/wjgpt.v7.i2.242
パブコメ抄録|全文|Google Scholar
Islam, S. M. S., Ryu, H. M., Sayeed, H. M., Byun, H. O., Jung, J. Y., Kim, H. A., et al. Eubacterium rectaleは、CD83を阻害することにより、HSV-1によるマウスの全身性炎症を抑制する。Front. Immunol. 12, 712312. doi: 10.3389/fimmu.2021.712312.
PubMedアブストラクト|CrossRefフルテキスト|Google Scholar
James, B. C., Cristiano, S., Anna, V., Rimma, G., Matthew, J. E., Irit, S., et al. クローン病に対する養子細胞療法としてのin vitro拡大CD45RAandlt;supandgt;+andlt;/supandgt;制御性T細胞の開発。Gut. 65, 584. doi: 10.1136/gutjnl-2014-306919
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jiang, Z., and Wu, C. (2022). 制御性T細胞と腸管上皮細胞の相互作用。Front. Immunol. 13, 951339.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヨハンソン, M. E. V., シェーバル, H., ハンソン, G. C. (2013). 健康と疾患における消化管粘液システム。Nat. Rev. Gastroenterol. Hepatol. 10, 352-361. doi: 10.1038/nrgastro.2013.35
パブコメ抄録|クロスリファレンス全文|Google Scholar
Johnson, L. R. (1987). 消化管の生理学。ニューヨーク: Raven Press 1699-728.
Google Scholar
Joller, N., Lozano, E., Burkett, P. R., Patel, B., Xiao, S., Zhu, C., et al. 共抑制分子TIGITを発現するTreg細胞は、炎症性Th1およびTh17細胞応答を選択的に抑制する。Immunity. 40, 569-581. doi: 10.1016/j.immuni.2014.02.012
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Juanola, O., Piñero, P., Gómez-Hurtado, I., Caparrós, E., García-Villalba, R., Marín, A., et al. 制御性T細胞は、実験的肝硬変において細菌抗原のトランスロケーションに対する透過性を制限し、短鎖脂肪酸を維持する。Hepatol. Commun. 2, 1610-1623. doi: 10.1002/hep4.1268.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Kaakoush, N. O., Day, A. S., Huinao, K. D., Leach, S. T., Lemberg, D. A., Dowd, S. E., et al. クローン病小児患者における微生物性ディスバイオーシス。J. Clin. Microbiol. 50, 3258-3266. doi: 10.1128/JCM.01396-12.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kaser, A., and Blumberg, R. S. (2011). 炎症性腸疾患におけるオートファジー、微生物感知、小胞体ストレス、および上皮機能。Gastroenterology. 140, 1738-1747. doi: 10.1053/j.gastro.2011.02.048.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Khorsand、B.、Asadzadeh Aghdaei、H.、Nazemalhosseini-Mojarad、E.、Nadalian、B.、Houri、H.ほか(2022年)。腸内細菌科と大腸菌の過剰発現がクローン病と潰瘍性大腸炎における主要な腸内マイクロバイオームの特徴である;IBDMDBデータセットの包括的メタゲノム解析。Front. Cell. Infect. Microbiol. 12, 1015890.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
木梨康博、長谷和彦(2021)。リーキーガット症候群のパートナー:腸内細菌異常症と自己免疫。Front. Immunol. 12, 673708.
パブコメ要旨|全文|Google Scholar
Kramer, C., Ziegler, J., Alzain, N., Schroeter, S., Almalla, A., Elomaa, L., et al. P020 クローン病患者における粘液の性状。J. Crohn's Colitis. 17, i190-i1. doi: 10.1093/ecco-jcc/jjac190.0150
CrossRef 全文|Google Scholar
Kraus, T. A., Toy, L., Chan, L., Childs, J., Cheifetz, A., Mayer, L., et al. クローン病および潰瘍性大腸炎患者における経口耐性の誘発失敗:遺伝的リスクの可能性。Ann. N Y. Acad. 1029、225-238。doi: 10.1196/annals.1309.054
PubMed Abstract|RefRef Full Text|Google Scholar
Kucharzik, T., Walsh, S. V., Chen, J., Parkos, C. A., and Nusrat, A. (2001). 炎症性腸疾患における好中球の遊走は、上皮細胞間接合タンパク質の発現の差と関連している。Am. J. Pathol. 159, 2001-2009. doi: 10.1016/S0002-9440(10)63051-9
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lamas, B., Richard, M. L., Leducq, V., Pham, H. P., Michel, M. L., Costa Da, G., et al. CARD9は、トリプトファンのアリール炭化水素受容体リガンドへの腸内細菌叢代謝を変化させることにより、大腸炎に影響を与える。Nat. Med. 22, 598-605.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Landers, C. J., Cohavy, O., Misra, R., Yang, H., Lin, Y. C., Braun, J., et al. 自己抗原および微生物抗原に対するクローン病関連免疫応答によって証明される選択的寛容喪失。Gastroenterology. 123, 689-699. doi: 10.1053/gast.2002.35379.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Landy, J., Ronde, E., English, N., Clark, S. K., Hart, A. L., Knight, S. C., et al. 炎症性腸疾患および炎症性腸疾患関連大腸癌におけるタイトジャンクション。World J. Gastroenterol. 22, 3117-3126. doi: 10.3748/wjg.v22.i11.3117
PubMed Abstract|クロスリファレンス全文|Google Scholar
Lassen, K. G., Kuballa, P., Conway, K. L., Patel, K. K., Becker, C. E., Peloquin, J. M., et al. Atg16L1 T300A変異体は選択的オートファジーを減少させ、その結果サイトカインシグナル伝達が変化し、抗菌防御が低下する。Proc. Natl. Acad. 米国)111, 7741-7746.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Lathrop, S. K., Bloom, S. M., Rao, S. M., Nutsch, K., Lio, C. W., Santacruz, N., et al. 大腸常在細菌叢による免疫系の末梢教育。Nature. 478, 250-254. doi: 10.1038/nature10434
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lavasani, S., Dzhambazov, B., Nouri, M., Fåk, F., Buske, S., Molin, G., et al. 新規プロバイオティクス混合物は、IL-10産生制御性T細胞を介する実験的自己免疫性脳脊髄炎に対して治療効果を発揮する。PLoS ONE. 5, e9009. doi: 10.1371/journal.pone.0009009.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lee, S. H., Starkey, P. M., and Gordon, S. (1985). 成体マウス組織における総マクロファージ量の定量的分析。モノクローナル抗体F4/80を用いた免疫化学的研究。J. Exper. Med. 161, 475-489. doi: 10.1084/jem.161.3.475.
パブコメ要旨|全文|Google Scholar
Levin, S. D., Taft, D. W., Brandt, C. S., Bucher, C., Howard, E. D., Chadwick, E. M., et al. Vstm3はCD28ファミリーのメンバーであり、T細胞機能の重要な調節因子である。Eur. J. Immunol. 41, 902-915. doi: 10.1002/eji.201041136.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li,K.、Hao,Z.、Du,J.、Gao,Y.、Yang,S.、Zhou,Y.、他(2021年)。バクテロイデス テタイオタオミクロンは、アリール炭化水素受容体を活性化し、CD4+T細胞のホメオスタシスを調節することにより、大腸の炎症を緩和する。Int. Immunopharmacol. 90, 107183.
パブコメ要旨|クロスリファレンス全文|Google Scholar
Li,T.、Qiu,Y.、Yang,H. S.、Li,M. Y.、Zhuang,X. J.、Zhang,S. H.、他(2020)。系統的レビューとメタ分析: 炎症性腸疾患の発症リスクと発症前の欧米型食事パターンとの関連。J. Dig. Dis. 21, 362-371. doi: 10.1111/1751-2980.12910.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu,M.J.、Yang,J.Y.、Yan,Z.H.、Hu,S.、Li,J.Q.、Xu,Z.X.、他(2022a)。アッカーマンシア(Akkermansia)ムチニフィラが制御する代謝の最新知見と腸疾患におけるその役割。Clin. (2022a)アッケマンソウのムチニフィラ代謝制御機構と腸疾患における役割に関する最近の知見。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Liu, W., Putnam, A. L., Xu-Yu, Z., Szot, G. L., Lee, M. R., Zhu, S., et al. CD127の発現は、FoxP3およびヒトCD4+ T reg細胞の抑制機能と逆相関する。J. Exp. Med. 203, 1701-1711. doi: 10.1084/jem.20060772.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Liu, Y., Yang, M., Tang, L., Wang, F., Huang, S., Liu, S., et al. TLR4は、Akkermansia muciniphilaとの相互作用を通じて、RORγt+制御性T細胞応答と大腸炎症感受性を制御する。Microbiome. 10, 98. doi: 10.1186/s40168-022-01296-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
López Cauce, B., Puerto, M., García, J. J., Miranda-Bautista, J., Vaquero, J., Bañares, R., et al. P011 IL-10欠損マウス(IL-10-/-)では、ディスバイオシスとゴブレット細胞の枯渇が、腸の炎症に先行する早期の腸管バリア機能不全を引き起こす。J. Crohn's Colitis. 14, S135-S. doi: 10.1093/ecco-jcc/jjz203.140
クロスレフ・フルテキスト|Google Scholar
López-Cauce, B., Puerto, M., García, J. J., Ponce-Alonso, M., Becerra-Aparicio, F., del Campo, R, et al. アッケマンシア欠乏症とムチン欠乏症は、インターロイキン10欠損マウスにおける炎症発症の初期段階として、腸管バリア機能不全に関与している。Front. Microbiol. 13, 1083884.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lord, J. D. (2015). 炎症性腸疾患における制御性T細胞の期待とパラドックス。World J. Gastroenterol. 21, 11236-11245. doi: 10.3748/wjg.v21.i40.11236
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lord, J. D., Hackman, R. C., Moklebust, A., Thompson, J. A., Higano, C. S., Chielens, D., et al. 抗CTLA4抗体療法後の難治性大腸炎:粘膜FOXP3+ T細胞の解析。Dig. Dis. Sci.55、1396-1405.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lord, J. D., Shows, D. M., Chen, J., and Thirlby, R. C. (2015). ヒト血中および粘膜制御性T細胞は、炎症性腸疾患において活性化マーカーおよび抑制性受容体を発現する。PLoS ONE. 10, e0136485. doi: 10.1371/journal.pone.0136485.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Louis, P., and Flint, H. J. (2009). ヒト大腸内酪酸産生菌の多様性、代謝および微生物生態。FEMS Microbiol. 酪酸産生菌の多様性、代謝および微生物生態を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mamontov, P., Neiman, E., Cao, T., Perrigoue, J., Friedman, J., Das, A., et al. ヒトTreg機能に対する短鎖脂肪酸およびGPR43刺激の効果(IRC5P.631)。J. Immunol. 194, 58.14. doi: 10.4049/jimmunol.194.Supp.58.14
クロスレフ・フルテキスト|Google Scholar
Marini, M., Bamias, G., Rivera-Nieves, J., Moskaluk, C. A., Hoang, S. B., Ross, W. G., et al. TNF-α中和は、腸上皮細胞のアポトーシスを抑制することにより、マウスクローン様回腸炎の重症度を改善する。Proc. Nat. Acad. この論文では、腸管上皮細胞のアポトーシスを抑制することにより、クローン病様回腸炎の重症化を抑制することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Martín, R., Miquel, S., Chain, F., Natividad, J. M., Jury, J., Lu, J., et al. 慢性低悪性度炎症マウスモデルにおいて、Faecalibacterium prausnitziiは生理的損傷を予防する。BMC Microbiol. doi: 10.1186/s12866-015-0400-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Maul, J., Loddenkemper, C., Mundt, P., Berg, E., Giese, T., Stallmach, A., et al. 炎症性腸疾患における末梢および腸管制御性CD4+ CD25(high)T細胞。Gastroenterology. 128, 1868-1878. doi: 10.1053/j.gastro.2005.03.043
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Meyer-Hoffert, U., Hornef, M. W., Henriques-Normark, B., Axelsson, L. G., Midtvedt, T., Pütsep, K., et al. 分泌された腸内抗菌活性は粘液表層に局在する。Gut. 57, 764.
パブコメ要旨|全文|Google Scholar
Moss, A. C. (2022). 炎症性腸疾患における治療失敗へのアプローチ。Gastroenterol. Hepatol. 18, 360-363.
PubMed Abstract|Google Scholar
長沼 昌彦、杉本 聡、光山 和彦、小林 崇、吉村 直樹、大井 浩之、他(2018).潰瘍性大腸炎患者を対象とした多施設ランダム化比較試験における藍ナチュラリスの有効性. Gastroenterology. 154, 935-947. doi: 10.1053/j.gastro.2017.11.024
PubMed Abstract|RefRef Full Text|Google Scholar
中橋-小田, C., Udayanga, K. G. S., Nakamura, Y., Nakazawa, Y., Totsuka, N., Miki, H., et al. アポトーシス上皮細胞は、バリア表面におけるTreg細胞の存在量を制御している。Nat. Immunol. 17, 441-450. doi: 10.1038/ni.3345
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nie,K.、Ma,K.、Luo,W.、Shen,Z.、Yang,Z.、Xiao,M.、他(2021年)。Roseburia intestinalis: 遺伝子と種の発見から見た有益な腸内細菌。Front. Cell. Infect. Microbiol. 11, 757718.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Noble, A. J., Nowak, J. K., Adams, A. T., Uhlig, H. H., and Satsangi, J. (2023). 炎症性腸疾患におけるゲノム、エピゲノム、環境の相互作用の解明:進展と展望。Gastroenterology. 165, 44-60.e2. doi: 10.1053/j.gastro.2023.03.238
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
荻野博之、中村和彦、岩佐隆一、井原英幸、秋保博之、本村洋一、他(2012).ラパマイシンによりin vitroで増殖した制御性T細胞は、実験的マウスモデルにおいて大腸炎を抑制する。J. Gastroenterol. 47, 366-376. doi: 10.1007/s00535-011-0502-y
PubMedアブストラクト|全文|Google Scholar
大草 崇, 吉田 崇, 佐藤 直, 渡辺 聡, 田尻 秀樹, 岡安 一郎, 他 (2009). 常在細菌は大腸上皮細胞に侵入し、炎症性サイトカインの分泌を誘導する:潰瘍性大腸炎の発症機序の可能性. J. Med. Microbiol. 58, 535-545. doi: 10.1099/jmm.0.005801-0
パブコメ抄録|全文|Google Scholar
太田裕之、Sunden, Y., Yokoyama, N., Osuga, T., Lim, S. Y., Tamura, Y., et al. 炎症性腸疾患の犬の十二指腸粘膜における先端接合複合体タンパク質の発現。Am. J. Vet. DOI: 10.2460/ajvr.75.8.746.
パブコメ抄録|全文|Google Scholar
奥村理恵子・武田和也(2018).粘膜バリアによる腸管恒常性維持.Inflamm. Regen. 38, 5. doi: 10.1186/s41232-018-0063-z
パブコメ抄録|全文|Google Scholar
Paiatto, L. N., Silva, F. G. D., Bier, J., Brochetto-Braga, M. R., Yamada, Á. T., Tamashiro, W. M. S. C., et al. OVA摂取により誘導される経口耐性は、TNBS誘発大腸炎を改善する。PLoS ONE. 12, e0170205. doi: 10.1371/journal.pone.0170205.
PubMedアブストラクト|全文|Google Scholar
Papamichael, K., Rivals-Lerebours, O., Billiet, T., Vande Casteele, N., Gils, A., Ferrante, M., et al. 潰瘍性大腸炎でインフリキシマブに一次非反応の患者の長期転帰。J. Crohn's Colit. 10, 1015-1023. doi: 10.1093/ecco-jcc/jjw067.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Parrish, A., Boudaud, M., Kuehn, A., Ollert, M., and Desai, M. S. (2022). 腸管粘液バリア:食物アレルギーにおけるパズルのピース。Trends Mol. Med. 28, 36-50. doi: 10.1016/j.molmed.2021.10.004.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pasare, C., and Medzhitov, R. (2003). 樹状細胞によるCD4+CD25+ T細胞介在性抑制のToll経路依存的遮断。Science. 299, 1033-1036.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Pelaseyed, T., Bergström, J. H., Gustafsson, J. K., Ermund, A., Birchenough, G. M., Schütte, A., et al. 杯細胞と腸細胞の粘液とムチンは、消化管の第一防御線を提供し、免疫系と相互作用する。Immunol. 免疫学, 260, 8-20.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pérez-Reytor, D., Puebla, C., Karahanian, E., and García, K. (2021). 細菌毒素の影響を受けた腸管上皮バリアの回復のための短鎖脂肪酸の使用。Front. Doi:10.3389/fphys.2021.650313。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Peterson, D. A., McNulty, N. P., Guruge, J. L., and Gordon, J. I. (2007). 腸内恒常性のメディエーターとしての共生細菌に対するIgA応答。Cell Host Microbe. 2, 328-339. doi: 10.1016/j.chom.2007.09.013.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pisani, A., Rausch, P., Bang, C., Ellul, S., Tabone, T., Marantidis Cordina, C., et al. 寛解期の炎症性腸疾患患者における腸内細菌叢のディスバイオーシス。Microbiol. Spectr. 10, e00616-e00622. doi: 10.1128/spectrum.00616-22.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pittayanon, R., Lau, J. T., Leontiadis, G. I., Tse, F., Yuan, Y., Surette, M., et al. 炎症性腸疾患患者とそうでない患者における腸内細菌叢の違い:系統的レビュー。Gastroenterology. 158, 930-46.e1. doi: 10.1053/j.gastro.2019.11.294
クロスレフフルテキスト|Google Scholar
Png, C. W., Lindén, S. K., Gilshenan, K. S., Zoetendal, E. G., McSweeney, C. S., Sly, L. I., et al. IBD粘膜における有病率の高い粘液溶解性細菌は、in vitroで他の細菌によるムチンの利用を増大させる。Am. J. Gastroenterol. 105, 2420-2428. doi: 10.1038/ajg.2010.281
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Pochard, C., Coquenlorge, S., Freyssinet, M., Naveilhan, P., Bourreille, A., Neunlist, M., et al. 炎症性腸グリア細胞の多面性:クローン病はグリオパシーか?Am. J. Physiol. Gastroint. 315, G1-G11. doi: 10.1152/ajpgi.00016.2018.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Powrie, F., Carlino, J., Leach, M. W., Mauze, S., and Coffman, R. L. (1996). CD45RB(low)CD4+T細胞によるTヘルパー1型介在性大腸炎の抑制において、インターロイキン4ではなくトランスフォーミング増殖因子βが重要な役割を果たすこと。J. Exp. Med. 183, 2669-2674. doi: 10.1084/jem.183.6.2669
パブコメ抄録|クロスリファレンス全文|Google Scholar
Prakhar, P., Alvarez-DelValle, J., Keller, H., Crossman, A., Tai, X., Park, Y. K., et al. 小腸上皮は、Foxp3+ Tregのホメオスタシスとエフェクター機能に対するIL-2要求を免除する。JCI Insight. 6, e149656. doi: 10.1172/jci.insight.149656.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pullan, R. D., Thomas, G. A., Rhodes, M., Newcombe, R. G., Williams, G. T., Allen, A., et al. ヒトの大腸粘膜上の付着粘液ゲルの厚さと大腸炎との関連性。Gut. 35, 353. doi: 10.1136/gut.35.3.353
パブコメ要旨|全文|Google Scholar
Qiu, X., Zhang, M., Yang, X., Hong, N., and Yu, C. (2013). TNBS誘発大腸炎の治療において、Faecalibacterium prausnitziiは制御性T細胞と抗炎症性サイトカインをアップレギュレートする。J. Crohn's Colitis. 7, e558-e68. doi: 10.1016/j.crohns.2013.04.002
パブコメ抄録|クロスリファレンス全文|Google Scholar
Rawla, P., Sunkara, T., and Raj, J. P. (2018). 炎症性腸疾患における生物製剤とバイオシミラーの役割:現在の動向と将来の展望。J. Inflamm. 11, 215-226. doi: 10.2147/JIR.S165330.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rossi, G., Pengo, G., Caldin, M., Palumbo Piccionello, A., Steiner, J. M., Cohen, N. D., et al. 特発性炎症性腸疾患の犬における、プレドニゾンとメトロニダゾールの併用療法またはプロバイオティクスVSL#3株の治療に対する微生物学的、組織学的、免疫調節パラメータの比較。PLoS ONE. 9, e94699. doi: 10.1371/journal.pone.0094699
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Rothhammer, V., and Quintana, F. J. (2019). The aryl hydrocarbon receptor: an environmental sensor integrating immune responses in health and disease. Nat. Rev. Immunol. 19, 184-197. doi: 10.1038/s41577-019-0125-8
PubMedアブストラクト|Ref 全文|Google Scholar
Round, J. L., Lee, S. M., Li, J., Tran, G., Jabri, B., Chatila, T. A., et al. Toll様受容体2経路は、ヒト微生物叢の常在菌によるコロニー形成を確立する。Science. (2011)Toll様受容体2経路はヒト微生物叢の常在菌によるコロニー形成を確立する。
パブコメ要旨|全文|Google Scholar
Roy, U., Gálvez, E. J. C., Iljazovic, A., Lesker, T. R., Błazejewski, A. J., Pils, M. C., et al. 異なる微生物群集が、自然免疫細胞または適応免疫細胞を介した腸管バリア損傷時に大腸炎発症の引き金となる。セルリップ 21, 994-1008. doi: 10.1016/j.celrep.2017.09.097
PubMed Abstract|クロスリファレンス全文|Google Scholar
Rubtsov, Y. P., Rasmussen, J. P., Chi, E. Y., Fontenot, J., Castelli, L., Ye, X., et al. 制御性T細胞由来のインターロイキン-10は、環境界面での炎症を制限する。Immunity. 28, 546-558. doi: 10.1016/j.immuni.2008.02.017.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
齋木, J. P., Andreasson, J. O., Grimes, K. V., Frumkin, L. R., Sanjines, E., Davidson, M. G., et al. インジゴ・ナチュラリスに反応する治療抵抗性潰瘍性大腸炎。BMJ Open Gastroenterol. 8, e000813. doi: 10.1136/bmjgast-2021-000813
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
齋藤知行、藤田直樹、Jang, M. H.、植松伸夫、Yang, B. G.、佐藤知行、他(2008)。オートファジータンパク質Atg16L1の欠損は、エンドトキシン誘導性IL-1β産生を増強する。Nature. 456、264-268。
パブコメ要旨|全文|Google Scholar
猿田真樹、Yu, Q. T., Fleshner, P. R., Mantel, P. Y., Schmidt-Weber, C. B., Banham, A. H., et al. クローン病におけるFOXP3+CD4+制御性T細胞の特性。Clin. Immunol. 125, 281-290. doi: 10.1016/j.clim.2007.08.003.
PubMedアブストラクト|全文|Google Scholar
Schopf, L. R., Hoffmann, K. F., Cheever, A. W., Urban, J. F., and Wynn, TA. (2002). IL-10は消化管蠕虫感染時の宿主抵抗性と生存に重要である。J. Immunol. 168, 2383-2392. doi: 10.4049/jimmunol.168.5.2383
パブコメ抄録|クロスリファレンス全文|Google Scholar
Schultsz, C., Van Den Berg, F. M., Ten Kate, F. W., Tytgat, G. N., and Dankert, J. (1999). 炎症性腸疾患患者の腸管粘液層には、対照群と比較して多くの細菌が存在している。Gastroenterology. 117、1089-1097。
PubMed要旨|全文|Google Scholar
Shah, T. R., and Misra, A. (2011). 「8 - プロテオミクス」(Challenges in Delivery of Therapeutic Genomics and Proteomics, ed. doi: 10.1016/B978-0-12-384964-9.00008-6.
CrossRef 全文|Google Scholar
Shan, M., Gentile, M., Yeiser, J. R., Walland, A. C., Bornstein, V. U., Chen, K., et al. 粘液は、免疫調節シグナルを伝達することにより、腸の恒常性と経口耐性を高める。Science. 342, 447-453. doi: 10.1126/science.1237910.
パブコメ抄録|全文|Google Scholar
清水洋一郎、中村和典、吉井明彦、横井裕之、菊地正樹、篠崎玲子、他(2020).パネス細胞α-ディフェンシンのミスフォールディングは、クローン病モデルマウスにおける腸内細菌異常症および回腸炎と相関する。Life Sci. Alliance. 3, e201900592. doi: 10.26508/lsa.201900592
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Simmonds, N., Furman, M., Karanika, E., Phillips, A., and Bates, A. W. H. (2014). 小児の新規診断炎症性腸疾患におけるパネス細胞形質転換。BMC Gastroenterol. 14, 93. doi: 10.1186/1471-230X-14-93
パブコメ要旨|全文|Google Scholar
Singh、V.、Johnson、K.、Yin、J.、Lee、S.、Lin、R.、Yu、H.、他(2022年)。潰瘍性大腸炎における慢性炎症は、杯細胞機能の長期的変化を引き起こす。Cell Mol. Gastroenterol. Hepatol. 13, 219-232. doi: 10.1016/j.jcmgh.2021.08.010.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Smids, C., Horjus Talabur Horje, C. S., Drylewicz, J., Roosenboom, B., Groenen, M. J. M., van Koolwijk, E., et al. 炎症性腸疾患における腸管T細胞プロファイリング:T細胞サブセットを疾患活動性と疾患経過に関連付ける。J. Crohn Colit. 12, 465-475. doi: 10.1093/ecco-jcc/jjx160
パブコメ抄録|クロスリファレンス全文|Google Scholar
Smith, P. M., Howitt, M. R., Panikov, N., Michaud, M., Gallini, C. A., Bohlooly, Y. M., et al. 微生物の代謝産物である短鎖脂肪酸は、大腸Treg細胞のホメオスタシスを制御する。Science. 341, 569-573.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Söderholm, J. D., Peterson, K. H., Olaison, G., Franzén, L. E., Weström, B., Magnusson, K. E., et al. クローン病の非炎症回腸におけるタンパク質に対する上皮透過性?Gastroenterology. 117、65-72。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sojka, D. K., Huang, Y. H., and Fowell, D. J. (2008). 制御性T細胞抑制のメカニズム-動く標的に対する多様な武器。Immunology. 124, 13-22. doi: 10.1111/j.1365-2567.2008.02813.x.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sokol, H., Leducq, V., Aschard, H., Pham, H. P., Jegou, S., Landman, C., et al. IBDにおける真菌性微生物叢異常症。Gut. 66, 1039-1048. doi: 10.1136/gutjnl-2015-310746
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sokol, H., Seksik, P., Furet, J. P., Firmesse, O., Nion-Larmurier, I., Beaugerie, L., et al. 大腸炎微生物叢におけるFaecalibacterium prausnitziiの低カウント。Inflamm. Bowel Dis. 15, 1183-1189.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Strugala, V., Dettmar, P. W., and Pearson, J. P. (2008). 潰瘍性大腸炎およびクローン病における付着性大腸粘液バリアの厚さと連続性。Int. J. Clin. Pract. 62, 762-769. doi: 10.1111/j.1742-1241.2007.01665.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Suenaert, P., Bulteel, V., Lemmens, L., Noman, M., Geypens, B., Assche, G. V., et al. 抗腫瘍壊死因子治療はクローン病における腸管バリアを回復させる。Am. J. Gastroenterol. 97, 2000-2004. doi: 10.1111/j.1572-0241.2002.05914.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sun,M.、Wu,W.、Chen,L.、Yang,W.、Huang,X.、Ma,C.、他(2018)。微生物叢由来の短鎖脂肪酸はTh1細胞のIL-10産生を促進し、腸の恒常性を維持する。Nat. Commun. 9, 3555. doi: 10.1038/s41467-018-05901-2
PubMedアブストラクト|全文|Google Scholar
Talbot, J., Hahn, P., Kroehling, L., Nguyen, H., Li, D., Littman, D. R., et al. 摂食依存的なVIPニューロン-ILC3回路は腸バリアを制御する。Nature. 579, 575-580. doi: 10.1038/s41586-020-2039-9
パブコメ抄録|全文|Google Scholar
Tamboli, C. P., Neut, C., Desreumaux, P., and Colombel, J. F. (2004). 炎症性腸疾患におけるディスバイオーシス。Gut. 53, 1-4. doi: 10.1136/gut.53.1.1
クロスレフ・フルテキスト|Google Scholar
Tamburini, B., La Manna, M. P., La Barbera, L., Mohammadnezhad, L., Badami, G. D., Shekarkar Azgomi, M., et al. 免疫と栄養:炎症性腸疾患における適切なバランス。細胞。11, 455. doi: 10.3390/cells11030455
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tan, C. L., Kuchroo, J. R., Sage, P. T., Liang, D., Francisco, L. M., Buck, J., et al. PD-1による制御性T細胞の抑制活性の抑制は、免疫寛容にとって重要である。J. Exp. Med. doi: 10.1084/jem.20182232.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tsai, L., Ma, C., Dulai, P. S., Prokop, L. J., Eisenstein, S., Ramamoorthy, S. L., et al. 潰瘍性大腸炎およびクローン病患者における現代の手術リスク:集団ベースのコホートのメタ解析。Clin. Gastroenterol. Hepatol. 19, 2031-45.e11. doi: 10.1016/j.cgh.2020.10.039
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Turpin, W., Lee, S. H., Raygoza Garay, J. A., Madsen, K. L., Meddings, J. B., Bedrani, L., et al. 腸管透過性の亢進はクローン病の晩期発症と関連する。Gastroenterology. 159, 2092-100.e5. doi: 10.1053/j.gastro.2020.08.005
PubMed Abstract|クロスリファレンス全文|Google Scholar
Ulluwishewa, D., Anderson, R. C., McNabb, W. C., Moughan, P. J., Wells, J. M., Roy, N. C., et al. 腸内細菌と食事成分によるタイトジャンクション透過性の制御。栄養学 141, 769-776.
パブコメ要旨|全文|Google Scholar
Umar, S. (2010). 腸管幹細胞。Curr. Gastroenterol. 文献12, 340-348.
クロスレフ・フルテキスト|Google Scholar
Van den Abbeele, P., Belzer, C., Goossens, M., Kleerebezem, M., De Vos, W. M., Thas, O., et al. 酪酸産生クロストリジウムクラスターXIVaは、in vitro腸内モデルにおいてムチンを特異的にコロニー形成する。酪酸産生性ClostridiumクラスターXIVaはin vitro腸管モデルにおいてムチンを特異的にコロニー形成する。
パブコメ抄録|全文|Google Scholar
van der Post, S., Jabbar, K. S., Birchenough, G., Arike, L., Akhtar, N., Sjovall, H., et al. 大腸粘液バリアの構造的弱体化は、潰瘍性大腸炎発症の初期イベントである。Gut. 68, 2142. doi: 10.1136/gutjnl-2018-317571
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Van der Sluis, M., De Koning, B. A., De Bruijn, A. C., Velcich, A., Meijerink, J. P., Van Goudoever, J. B., et al. Muc2欠損マウスは自然に大腸炎を発症し、MUC2が大腸保護に重要であることを示している。Gastroenterology. 131, 117-129. doi: 10.1053/j.gastro.2006.04.020
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Vancamelbeke, M., and Vermeire, S. (2017). 腸管バリア:健康と疾患における基本的役割。Expert. Rev. Gastroenterol. Hepatol. 11, 821-834. doi: 10.1080/17474124.2017.1343143
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Vespa,E.、D'Amico,F.、Sollai,M.、Allocca,M.、Furfaro,F.、Zilli,A.、他(2022)。炎症性腸疾患患者における組織学的スコア:技術の現状。J. Clin. Med. 11, 939. doi: 10.3390/jcm11040939
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vich Vila, A., Imhann, F., Collij, V., Jankipersadsing, S. A., Gurry, T., Mujagic, Z., et al. 炎症性腸疾患および過敏性腸症候群における腸内細菌叢組成と機能的変化。Sci. Transl. Med. 10, eaap8914. doi: 10.1126/scitranslmed.aap8914.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Vignali, D. A., Collison, L. W., and Workman, C. J. (2008). 制御性T細胞の働き Nat. Rev. Immunol. 8, 523-532.
クロスレフ・フルテキスト|Google Scholar
Wang, J., Ji, H., Wang, S., Liu, H., Zhang, W., Zhang, D., et al. プロバイオティクスLactobacillus plantarumは、上皮を強化し、腸内細菌叢を調節することにより、腸管バリア機能を促進する。Front. Microbiol. 9, 1953. doi: 10.3389/fmicb.2018.01953
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang, Y., Liu, X. P., Zhao, Z. B., Chen, J. H., and Yu, C. G. (2011). 炎症性腸疾患におけるCD4+フォークヘッドボックスP3(FOXP3)+制御性T細胞の発現。J. Dig. Dis. 12, 286-294. doi: 10.1111/j.1751-2980.2011.00505.x
パブコメ抄録|全文|Google Scholar
Wegorzewska, M. M., Glowacki, R. W. P., Hsieh, S. A., Donermeyer, D. L., Hickey, C. A., Horvath, S. C., et al. 食事は、Bacteroides thetaiotaomicron抗原の発現を制御することにより、大腸T細胞応答を調節する。Sci. Immunol. 4, eaau9079. doi: 10.1126/sciimmunol.aau9079.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wehkamp, J., and Stange, E. F. (2020). 回腸クローン病の鍵となるパネス細胞に関する最新レビュー。Front Immunol. 11, 646. doi: 10.3389/fimmu.2020.00646
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wirtz, S., Billmeier, U., McHedlidze, T., Blumberg, R. S., and Neurath, M. F. (2011). インターロイキン-35は、T細胞依存性大腸炎を防御する粘膜免疫応答を媒介する。Gastroenterology. 141, 1875-1886. doi: 10.1053/j.gastro.2011.07.040
PubMedアブストラクト|全文|Google Scholar
Wu, H. J., and Wu, E. (2012). 免疫恒常性と自己免疫における腸内細菌叢の役割。Gut Micr. 3, 4-14. doi: 10.4161/gmic.19320
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xue, Y., Zhang, H., Sun, X., and Zhu, M. J. (2016). メトホルミンはインターロイキン10欠損マウスにおいて回腸上皮バリア機能を改善する。PLoS ONE. 11, e0168670. doi: 10.1371/journal.pone.0168670.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yacyshyn, B. R., and Meddings, J. B. (1995). クローン病における循環CD19+ B細胞上のCD45RO発現は腸管透過性と相関する。Gastroenterology. 108、132-137. doi: 10.1016/0016-5085(95)90017-9
PubMed Abstract|全文|Google Scholar
山本高志・下山貴之(2023).炎症性腸疾患における栄養と食事。Curr. Opin. Gastroenterol. 39, 216-221. doi: 10.1097/MOG.000000000905
クロスレフ・フルテキスト|Google Scholar
Yang, B. H., Hagemann, S., Mamareli, P., Lauer, U., Hoffmann, U., Beckstette, M., et al. ROR'tを発現するFoxp3 T細胞は、腸炎症時に抑制能を増強する安定した制御性T細胞エフェクター系譜を代表する。Mucosal Immunol. 9, 444-457. doi: 10.1038/mi.2015.74
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ye, J., Qiu, J., Bostick, J. W., Ueda, A., Schjerven, H., Li, S., et al. アリール炭化水素受容体は、腸制御性T細胞を優先的にマークし、促進する。Cell Rep. 21, 2277-2290. doi: 10.1016/j.celrep.2017.10.114.
PubMed Abstract|クロスリファレンス全文|Google Scholar
吉松 靖、長沼 昌彦、杉本 聡、種本 聡、梅田 聡、福田 崇、他(2019).潰瘍性大腸炎患者の局所導入療法を目的とした藍ナチュラリス坐剤の開発. Gastroenterologia. 101, 492-498. doi: 10.1159/000501152.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
吉松康人、筋野哲也、宮本和彦、原田康夫、種本聡、小野和彦、他(2022)。上皮細胞におけるアリール炭化水素受容体シグナルは、腸におけるHelios+ Tregのリクルートと位置を支配する。セルリップ39, 110773.
PubMed Abstract|全文|Google Scholar
Yu, Y. B., and Li, Y. Q. (2014). 腸管グリア細胞と腸管上皮バリアにおけるその役割。World J. Gastroenterol. 20, 11273-11280. doi: 10.3748/wjg.v20.i32.11273
パブコメ抄録|クロスリファレンス全文|Google Scholar
Yuan, Q., and Walker, W. A. (2004). 腸の自然免疫:健康と疾患における粘膜防御。J. Pediatr. Gastroenterol. 栄養学 38, 463-473.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Yusuf, K., Saha, and Umar, S. (2022). 炎症性腸疾患の管理における食物繊維の健康上の利点。Biomedicines. 10, 1242. doi: 10.3390/biomedicines10061242
パブコメ要旨|全文|Google Scholar
Zhang, S. L., Wang, S. N., and Miao, C. Y. (2017). 潰瘍性大腸炎における腸管免疫系への微生物叢の影響とその介入。Front. Immunol. 8, 1674. doi: 10.3389/fimmu.2017.01674.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang, Y., Zhao, X., Zhu, Y., Ma, J., Ma, H., Zhang, H., et al. プロバイオティクス混合物は、タイトジャンクションタンパク質の発現を変化させ、tregsを増加させることにより、デキストラン硫酸ナトリウム誘発大腸炎を保護する。Mediat. Inflamm. 2018, 9416391. doi: 10.1155/2018/9416391
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhao, H. M., Huang, X. Y., Zuo, Z. Q., Pan, Q. H., Ao, M. Y., Zhou, F., et al. プロバイオティクスはT制御細胞を増加させ、マウスの実験的大腸炎の重症度を軽減する。World J. Gastroenterol. 19, 742-749. doi: 10.3748/wjg.v19.i5.742
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zhao, Q., Duck, L. W., Huang, F., Alexander, K. L., Maynard, C. L., Mannon, P. J., et al. CD4+T細胞の活性化とmTOR代謝阻害の併用は、微生物特異的メモリー細胞を破壊し、大腸炎を予防することができる。Sci. Immunol. 5, eabc6373. doi: 10.1126/sciimmunol.abc6373.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zheng, D., Liwinski, T., and Elinav, E. (2020). 健康および疾患における微生物叢と免疫の相互作用。細胞 Res. 30, 492-506.
クロスレフ・フルテキスト|Google Scholar
Zhu, C., Song, K., Shen, Z., Quan, Y., Tan, B., Luo, W., et al. Roseburia intestinalisは、インターロイキン-17の排泄を抑制し、大腸炎における制御性T細胞の分化を促進する。Mol. Med. 論文誌17, 7567-7574.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:炎症性腸疾患、T制御細胞、腸透過性、食事、微生物叢
引用 Prame Kumar K, Ooi JD and Goldberg R (2023) The interplay between the microbiota, diet and T regulatory cells in the preservation of the gut barrier in inflammatory bowel disease. Front. Microbiol. 14:1291724.
受理された: 2023年9月10日;受理された: 2023年11月06日;
発行:2023年12月01日
編集者
中国広東省農業科学院(GDAAS)Li Wang
査読者
Qiuhe Lu, クリーブランドクリニック, 米国
Yu Pi, 中国農業科学院, 中国
Copyright © 2023 Prame Kumar, Ooi and Goldberg. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責:キャサリン・プラメ・クマール キャサリン・プラメ・クマール Kathryn.pramekumar@monash.edu
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
人は以下にも注目している
クラスIIa HDACの低分子阻害剤TMP269はin vitroでRABVの複製を抑制する
Juanbin Yin, Shasha Wang, Shanhui Ren, Zhengji Liang, Junwei Ge, Yuefeng Sun, Xiangping Yin, Xiangwei Wang
グルジアにおける効果的なサーベイランスと狂犬病管理のための遺伝子タイピング法の比較
Rene E. Condori、Natia Kartskhia、Lasha Avaliani、Marina Donduashvili、Tinatin Elbakidze、Ana Kapanadze、Emily G. Pieracci、Giorgi Maghlakelidze、Ashutosh Wadhwa、Clint N. Morgan、Mary Reynolds、Yu Li、Lena Ninidze
微生物細胞生物学および環境微生物学におけるフーリエ変換赤外分光法の応用:進歩、課題、および将来の展望
ソニア・ティキア・アラシロ、シャオホア・リー、ケシャブ・ポクレル、アミン・カッセム、ラナ・アッバス、オリバー・コウチーニョ、ダイアナ・カスペレック、ハウラア・ナジャフ、ソミー・オパラ
多嚢胞性卵巣症候群の発症と治療におけるエクソソームの生理的機能と治療可能性
張正宏、石聡健、王正超
運動量の違いが青年期の学習バーンアウトに及ぼす影響: 自己効力感の媒介効果
傅文成、李燕、劉亜軍、李丹、王剛、劉永仙、張廷蘭、鄭雲峰
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
