IgE介在性アレルギー疾患におけるアレルゲン免疫療法に関するガイドライン
アレルゴギーセレクト
ダストリバーガー


IgE介在性アレルギー疾患におけるアレルゲン免疫療法に関するガイドライン
ドイツアレルギー・臨床免疫学会(DGAKI)、小児アレルギー・環境医学学会(GPA)、ドイツアレルギー学会(AeDA)、オーストリアアレルギー・免疫学会(ÖGAI)、スイスアレルギー・免疫学会(SSAI)、ドイツ皮膚科学会(DDG)、ドイツ音鼻・喉頭・首手術学会(DGHNO-KHC)によるS2K Guidelineです。ドイツ小児青少年医学会(DGKJ)、小児呼吸器学会(GPP)、ドイツ呼吸器学会(DGP)、ドイツ耳鼻咽喉科専門医会(BVHNO)、ドイツ小児青少年医療専門医会(BVKJ)、連邦肺・睡眠・呼吸器専門医会(BdP)、ドイツ皮膚科専門医会(BVDD)、ドイツ小児青少年学会(DGKJ)、ドイツ小児青少年学会(DGH)、ドイツ小児呼吸器学学会(GP)、ドイツ呼吸器専門医会(GP)、ドイツ小児呼吸器学学会(PAFK)、ドイツ小児青少年医学会(PAFIC-PKD)。
Oliver Pfaar, Tobias Ankermann, [...], and Anja Schwalfenberg
論文情報
要旨
不明
キーワード:アレルゲン免疫療法、減感作、ガイドライン、アレルゲン、アレルゲン抽出物、アレルギー疾患、アレルギー性鼻炎、アレルギー性鼻結膜炎、アレルギー性喘息
ステージ S2k
AWMF登録番号:061-004
完了 2022年6月30日
有効期限:2027年6月29日 2027年6月29日
ICD-10番号 J30.4、J30.1、J30.3、H10.1、H10.8、J45.0、R94.2、T63.4、T88.6、L50.0、Z51.6、Z91.0
ドイツ語版:www.doi.org/10.5414/ALX02331
略語について
略語集
略語の説明
第1章 ガイドラインの作成と目的
アレルゲン免疫療法(AIT)に関する本ガイドラインは,ドイツアレルギー・臨床免疫学会(DGAKI)の委託・出資により作成され,2014年に発表されたS2ガイドラインを置き換える[1]ものである.ドイツの「Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften(AWMF)」の標準的な手順に従い、S2kガイドラインとして考案された。AWMFの手順(Deutsches Leitlinien-Bewertungsinstrument(DELBI)基準1~7)に基づく詳細なガイドライン報告書は、AWMFのホームページ(https://www.awmf.org/leitlinien/detail/ll/061-004.html)に掲載されています。
以上,2018年のDGAKI理事会の合意により,corresponding authorはガイドラインの更新のコーディネートを委託され,2019年の第1回コンセンサス会議においてBettina Wediが共同コーディネータに任命された。DGAKIのメンバー(Oliver Pfaar, Matthias Augustin, Thilo Jakob, Jörg Kleine-Tebbe, Eckard Hamelmann, Susanne Lau, Wolfgang Pfützner, Bettina Wedi, Thomas Werfel, Margitta Worm)に加え、以下の組織の代表者がコンセンサスプロセスに参加した。ドイツアレルギー専門医協会(AeDA)(Randolf Brehler, Norbert Mülleneisen, Katja Nemat, Wolfgang Wehrmann)、小児アレルギー・環境医学学会(GPA)(Tobias Ankermann, Antje Schuster, Christoph Müller)、オーストリアアレルギー・免疫学会(ÖGAI)(Gunter Sturm.Zsolt Szeff)。Zsolt Szépfalusi, Stefan Wöhrl)、スイスアレルギー免疫学会(SGAI)(Peter Eng, Peter Schmid-Grendelmeier)、ドイツ皮膚科学会(DDG)(Joachim Saloga)、ドイツ耳鼻咽喉科・頭頸部外科学会(DGHNO-KHC)(Martin Wagenmann).ドイツ小児青少年医学会(DGKJ)(Michael Gerstlauer, Christian Vogelberg)、小児呼吸器学会(GPP)(Matthias Volkmar Kopp)、ドイツ呼吸器学会(DGP)(Christian Taube)、ドイツ専門耳鼻科学会(BVHNO)(Petra Bubel), ドイツ小児・思春期医療専門家協会(BVKJ)(Peter Fischer)、連邦肺・睡眠・呼吸器専門医協会(BdP)(Sebastian Böing)、ドイツ皮膚科専門医協会(BVDD)(Klaus Strömer)がガイドラインの更新プロセスに参加していました。ドイツの規制当局であるPaul-Ehrlich-Institut (PEI) (Susanne Kaul, Vera Mahler) とDeutscher Allergie- und Asthmabund (DAAB) (Anja Schwalfenberg) もアドバイザーとして合意のプロセスに関与していた。
ガイドラインは、数回のコンセンサス会議を通じて更新された。2021年12月6日、すべての共著者・代議員によって最終的なコンセンサスに達した。続いて、すべての学会と関係分野に提出され、承認と採用の推奨がなされた。この最終的な認可は、2022年6月30日までに正式に完了した。
本ガイドラインは、「アレルギー学」を専門とするすべての医師、およびAITを受ける可能性のあるアレルギー患者を治療および/またはケアする医師を対象としている。本ガイドラインは、アレルギー性喘息および吸入性アレルゲンに対するアレルギー性感作を伴う/伴わないアレルギー性鼻結膜炎(ARC)のすべての患者さんに適用されます。ハチ毒 AIT の場合の適応、禁忌、管理方法、治療期間の詳細については、AWMF の「ハチ・スズメバチ毒アレルギーの診断と治療」に関するガイドラインを参照する必要がある。
本ガイドラインは、発行後 5 年経過した時点で、その有効性を著者らが精査し、ガイドラインコー ディネーターがこの手続きを担当する。詳細は、別冊のガイドライン報告書に記載されている。
本ガイドラインは、アレルギー学会がその関連出版物機関およびAWMFガイドライン集に掲載し、普及させる。また、本ガイドラインは他の学会や関係分野での採用が推奨され、アレルギー疾患を中心とした専門誌に転載される予定である。
第2章. AITの免疫学的機序
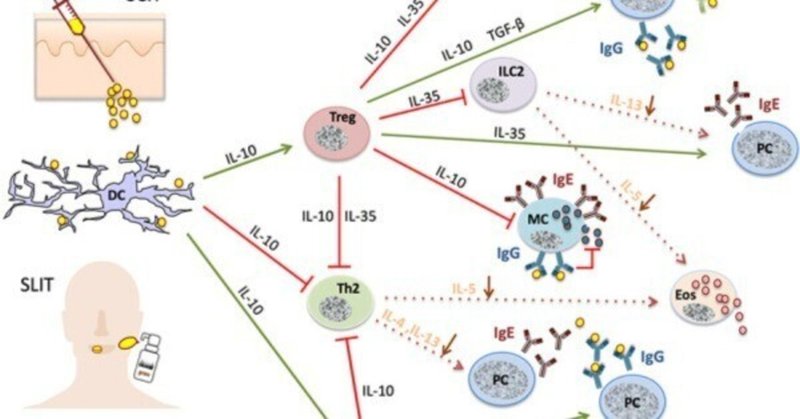
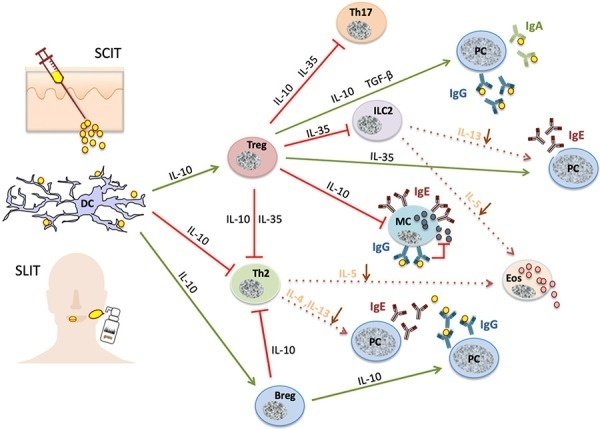
AIT は、複数の段階を経て、自然免疫系と適応免疫系の双方に影響を及ぼす分化型免疫調節を誘導する(図 1)。まず、アレルゲン刺激に対するIgE保有エフェクター細胞の反応性が一時的に低下する。その後、アレルゲン耐性が安定化し持続する兆候として、細胞性・体液性免疫の変化が起こる。
図1.
図1.
AITの免疫学的機序。AITは、制御性リンパ球やIgGおよびIgAを分泌するプラズマ細胞(PC)の活性化(緑線)を引き起こす一方、アレルゲンに特異的な異なる細胞集団の抑制(赤線)を引き起こす。
初期段階の免疫機構は、まだ広く研究されていない。組織マスト細胞は、負のフィードバック機構によって頻脈性またはアネルギー性を示すと考えられているが、その主な根拠は好塩基性顆粒球(末梢血中の同等の細胞)の研究から得られている。たとえば、アレルゲンの急速な反復増量(例:ウルトララッシュやクラスターAIT)において、エフェクター細胞は高濃度の炎症性メディエーター(例:ロイコトリエン、ヒスタミン)の反復放出により「疲弊」している可能性がある。その後、ヒスタミンがヒスタミン受容体2に結合することによる自己分泌抑制、あるいは現在議論されているIFN-γやIL-10などのサイトカインによるエフェクター細胞の抑制が起こるかもしれない[2, 3, 4]。
その後数ヶ月の間に免疫寛容が生じ、最初の徴候は1週間から数週間以内に現れるが、これはおそらく誘発スキーム(ハチミツ毒のウルトララッシュまたはラッシュAITのように維持量に素早く到達する早期寛容誘発、または航空アレルゲンで行われるように徐々に量を増やすことによる遅延)に依存する [3, 5, 6, 7, 8, 9]。耐容性の樹状細胞(DC)が形成され、適用されたアレルゲンを取り込み処理した後、それを局所リンパ節に運び、制御性T細胞(Treg)が刺激されるのです。インターロイキン(IL)-10は、主にT細胞によって合成されますが、B細胞やDCによっても合成され、ここで重要な役割を果たします[6]。特に、IL-10は肥満細胞を抑制し、アレルゲンをブロックするIgG4抗体(下記参照)の合成を増加させ、Th2だけでなくおそらくTh17リンパ球も含むアレルギー性Tエフェクター細胞を抑制する[10]。さらに重要な免疫調節サイトカインの例として、アレルゲン特異的IgA抗体の産生を促進するTGF-β [3, 11]、Th2細胞に相当する自然リンパ系細胞(ILC2)とIgE抗体産生を抑制するIL-35 [12] がある。AIT の後期には、Treg が減少し、アレルゲン特異的な Th2 細胞の損失が増加し、Th2 細胞に基づくアレルギー状態がアレルゲン耐性状態に転換します [8, 9, 12, 13]。これは、アレルギー性エフェクター臓器のサイトカインミリューの正常化によっても反映される。アネルギー、選択的欠失、Th2細胞のアポトーシスなどが、基礎的なメカニズムとして議論されています [13] 。
さらに、AIT は、さまざまな体液性および B 細胞の変化を引き起こします。最初に、IgE抗体の短期間の上昇と、アレルゲンブロッキングIgG(特にIgG4サブタイプ)および粘膜IgA抗体の合成がある [3, 8]。これらの免疫グロブリンは、IgEを介したアレルゲンのTヘルパー細胞への固定化および提示を防ぎ、したがってTh2リンパ球のさらなる活性化を防ぐ。アレルゲンが肥満細胞や好塩基球上のIgEに結合するのを阻害し、それらの刺激を防止する。IgG-アレルゲン複合体が抑制性IgGレセプターに固定されることによるアレルギー性エフェクター細胞の直接阻害も議論されている [7] 。アレルゲンの適用を継続すると、治療されたアレルギー患者の血清中のアレルゲン遮断活性が常に増加し、これらの抗体の親和性成熟が増加する [14] 。これらの変化は、ネイティブアレルゲン抽出物、アレルゴイド、エピトープ特異的アレルゲンペプチドを用いた場合にも同様に起こる [3, 8, 15, 16, 17]。Bリンパ球は、免疫調節サイトカイン(IL-10、IL-35、TGF-β)の分泌を通じて、AITにおいてさらなる役割を果たす [12, 18, 19]。
結論1:AITの主な免疫修飾は、i) 制御性免疫細胞(DCregs、Tregs、Bregs)の一時的誘導、ii) アレルゲン特異的自然免疫とTヘルパー細胞活性の低下、iii) アレルゲンブロッキングIgGおよびIgA抗体の形成、などである。最後に、臨床的アレルゲン耐性の免疫学的前提条件として、主にTh2優位のエンドタイプから「T細胞正常化」エンドタイプが出現する。
第3章 アレルゲン抽出物 アレルゲン抽出物、その評価と販売認可
3.1. アレルゲン抽出物の製造と組成
アレルゲン抽出物は、製造者固有の処理により、その組成やアレルゲン活性が異なる。そのため、同じアレルゲン供給源であっても、直接比較することはできない。ドイツの治療アレルゲン条例(TAO、"Therapieallergene-Verordnung")の対象となるアレルゲンについては、標準化されたエキスのみが販売可能です [20]。総アレルゲン活性は、in vitroの方法を用いて決定されます [21]。標準化され、検証された方法を用いた単一アレルゲン(通常は主要アレルゲン)の測定は、長年の悲願です [22]。
2 つの組換え主要アレルゲン、白樺花粉 (Betula verrucosa; http://crs.edqm.eu/db/4DCGI/View=Y0001565) の rBet v 1 およびチモシー草花粉 (Phleum pratense; http://crs.edqm.eu /db/4DCGI/View=Y0001566) の rPhl p 5a が 2012 年に欧州薬局方委員会によって標準物質として認められました。これらの標準物質は、アレルゲン製剤中のBet v 1またはPhl p 5a含有量を測定するための有効な標準物質の基礎を形成しています[23]。
バリデーションに成功した標準物質と関連する抗体ペアを用いたイムノアッセイ(ELISAシステム)は、すでに国際的に利用可能です(https://inbio.com/elisa-2.0/elisa-2.0-kits-pollen)。これらは多施設共同ラウンドロビン試験で検証された ELISA システムをベースにしている。これまでのところ、その使用は義務づけられていない。参照アレルゲンである Bet v 1 と Phl p 5a は、すでに欧州薬局方に収載されている。1) Bet v 1 と 2) Phl p 5a の ELISA 法が欧州薬局方の一般章に掲載され、その後アレルゲン・モノグラフが修正された後、将来的にカバノキ花粉またはイネ科植物花粉の単一エキス中のこれらの主要アレルゲン含有量は基準 ELISA に基づいて申告しなければならないでしょう。
これまでは、異なる製剤のアレルゲン濃度をメーカー固有の単位で直接比較することはできなかった。特に、メーカーは主要アレルゲンの測定に異なる標準、抗体、測定方法(「自社アッセイ」)を使用することが多かったからである。
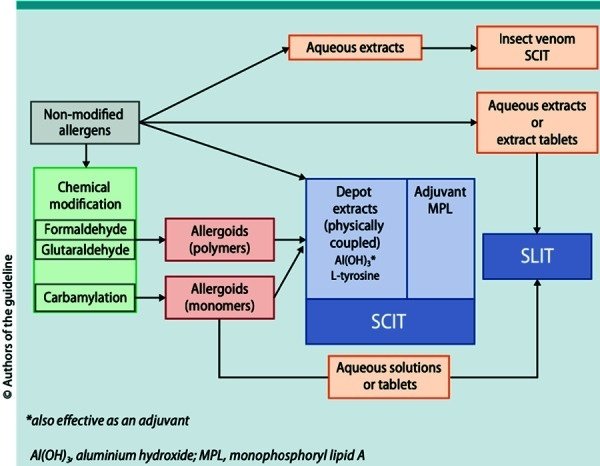
一般に、皮下免疫療法(SCIT)には、アレルゲンの構造が変化していない非修飾(「ネイティブ」)抽出物と化学修飾抽出物(アレルゴイド)が利用可能である。後者は、反応性の低いB細胞エピトープを有するためIgE結合が減少し、T細胞エピトープおよび免疫原性効果は保持されるべきであるという概念に基づいている [24]. 昆虫毒アレルギーの治療開始において一般的な水性抽出物に加え、ヨーロッパでは多くの半抽出物がSCITに使用されています。ここでは、アレルゲンまたはアレルゴイドは、水酸化アルミニウム [Al(OH)3] またはチロシンなどの担体に物理的に結合している [25] (Figure 2). 舌下免疫療法(SLIT)用製剤は、アレルゲンが未修飾または化学的に修飾された状態で水溶液または錠剤として提供されている(図2)。また、冷蔵庫での保管を前提とした製剤と、室温での保管が可能な製剤がある。
図2.
図2.
AITに利用可能なアレルゲン抽出物(説明は3.1.項を参照)。
結論2:AIT製品(SCITとSLIT)は、その組成が不均一であるため比較できない。同様に、有効成分の測定方法が異なるため、現在までに各メーカーから提示されたアレルゲン濃度も比較できない。SCITでは、非修飾アレルゲンは水性または物理的結合(セミデポ)抽出物として、化学修飾抽出物(アレルゴイド)はセミデポ抽出物として使用される。SLIT用のアレルゲン抽出物およびアレルゴイドは、水溶液または錠剤として使用される。今後、欧州薬局方により、シラカバ花粉抽出物中のBet v 1、チモシー牧草抽出物中のPhl p 5aの量表示が義務化される予定である。
3.2. 臨床試験における皮下または舌下適用によるアレルゲン免疫療法の評価基準
3.2.1 主要評価項目と副次的評価項目
無作為化比較臨床試験においてAITの有効性を実証するためには、主要評価項目の慎重な選択が不可欠である [26, 27] 。AITの有効性は、症状スコア(例:個々の症状;総合症状スコア(TSS))、投薬スコア、症状・投薬複合スコア(CSMS)、QOL評価(健康関連QOL)、その他の方法(例:VAS(視覚的アナログスケール)、「良好日」「重症日」)等の患者報告アウトカム(PRO)を用いて測定する [27, 28, 29]。
一次および二次アウトカム指標の検証の欠如とCSMSの様々なバリエーション提案 [27] により、異なる研究の結果を比較することは非常に困難である [30] 。2008年以降、欧州の規制当局(欧州医薬品庁(EMA))はCSMSの使用を推奨しており、薬の使用は症状の程度に影響するため、症状の報告に加え、対症療法の必要性もスコアに反映させるべきであるとして、個人スコアともに陽性試験結果を(正当な例外として)容認しています。しかし、EMAは特定のCSMSにコミットしているわけではありません[31, 32]。欧州アレルギー臨床免疫学会(EAACI)のタスクフォース作業部会は、将来の臨床試験における成人と小児の調和を目指し、2014年から主要評価項目としてのCSMSの基準を支持している[27, 30]。最近では、有効性を評価するためのレスポンダー解析も追加で提案されています[30, 33]。
さらに、プラセボ群と積極的治療群における潜在的バイオマーカー(IgE、IgG、IgG4、ブロッキング抗体活性、制御性T細胞活性、好塩基球反応性など)としての検査データの評価も妥当である[7, 34, 35]。
推奨1:安全性と有効性に関するデータは、例えばEAACIまたは世界アレルギー機関(WAO)の勧告に従った等級付けによって標準化されるべきである。さらに、AIT のバイオマーカーや免疫学的機序に関するさらなる研究が必要である(強い合意、 同意率 100%)。
3.2.2. 日常的な条件下での AIT の有効性のモニタリング
日常的な条件下でのAITの成功に関する実環境証拠(RWE)研究はほとんどない[36、37、38]。法定医療保険に加入している患者の処方箋とコード化されたデータに基づくAITの有効性と二次予防効果に関するエビデンスが増えている[39, 40, 41]。臨床研究以外のAITの適用に関するRWEデータを作成する代替案は、患者によってますます利用されるようになっているハンドデバイスアプリケーション(アプリ)を使用することであり、AITのための患者の早期層別化や、さらに治療モニタリングに役立つ可能性があります[42, 43]。例えば、アプリ「MASK-air」(Mobile Airways Sentinel Network [38, 42, 44])のデータセットに基づき、最近行われたコンセプト研究では、AITが日常的な治療においてアレルギー症状を軽減し、患者の仕事での生産性を高めるようであることが示された [45].
3.2.3. アレルゲン暴露
AITの臨床的効果を評価するためには、さらに(地域)アレルゲン暴露を経時的に記録する必要がある [30, 46]。EAACIが提案する花粉濃度による花粉シーズンの定義は、将来の臨床試験で利用するために、イネ科とカバノキ科の花粉について既に検証されている [47, 48]。季節性アレルゲンについては、EAACIは、同じ季節に全ての研究対象者を募集し、特に花粉のピーク時に結果を測定し、地理的に異なる地域で同時に2つの同一の研究を実施することを推奨している[30, 47]。
3.2.4. データ解析とプレゼンテーション
すべての研究結果は、適切な形で評価、発表、出版されることが不可欠である。この目的のために、標準化されたチェックリスト(www.consort-statement.org)を通じて、最小限の、しかし透明性のある試験情報を保証することを目的とした基準(CONSORT:Consolidated Standards of Reporting Trials)が開発された [49, 50]。これにはintention-to-treat(ITT)分析における臨床データの評価が含まれ、これは、実践条件下でAITの実際の効果を実証できるように、試験に参加したすべての患者(非常に早期に脱落した患者を含む)を考慮に入れたものである [49, 50, 51]。一方、パープロトコル(PP)解析は、最適な標準化された条件下で、効果の最大等級を推定するのに適している。また、FAS(Full Analysis Set)解析では、全患者のデータ、すなわち、組み入れ基準に違反した患者や試験プロトコルを逸脱して治療を受けた患者のデータも記録し、治療の安全性プロファイルを説明することが可能である。
AITの臨床試験で有意なプラセボ反応が見られるのは例外ではなく原則であり、主要な標的パラメータはPROであるため [52, 53] 、今後の試験では、プラセボで得られた効果も有効成分で得られた効果と同様に詳細に明示することが望ましい [30, 52, 53, 54]。
結論3:AITの臨床効果は、患者報告アウトカム(PRO)を主要評価項目及び副次評価項目として用いて測定される。臨床第Ⅲ相試験において、EMAは主要評価項目としてcombined symptom and medication score (CSMS)を規定している。CONSORT 勧告は、試験結果の評価、発表、公表の基準を規定している。プラセボ群の結果は、積極的治療群の結果と同様に詳細に記述されなければならない。
3.3. アレルゲン製剤の販売認可の意義
指令2001/83/ECによると、試験用および治療用アレルゲンは、すべてのEU加盟国において医薬品であり、販売認可の対象となる。しかし、この指令の第5条によると、特別なニーズを満たすために、これらの規定の適用除外を行うことができます。
ドイツでは、フランクフルト近郊のランゲンにあるPaul-Ehrlich-Institut(PEI)がアレルゲン製品に関する国の所轄官庁として責任を負っています。オーストリアでは、販売認可は「連邦医療安全局」(BASG)が行い、BASGの業務は「オーストリア健康・食品安全庁」(AGES MEA)の事業部門である「オーストリア医薬品・医療機器庁」(Medizinmarktaufsicht)が担ってきました。スイスでは、アレルゲンの販売認可はSwissmedic(Schweizerisches Heilmittelinstitut)が監督しています。
ドイツでは、指令2001/83/ECの範囲は、ドイツ医薬品法(Arzneimittelgesetz (AMG))で完全に実施されている。[55]. これによると、試験用・治療用アレルゲンは完成医薬品であり、国内所轄官庁から販売許可を得た場合のみドイツ国内で販売することができる。EU指令の第5条に従い、治療用アレルゲンの個々の製剤(「指名患者用製剤」(NPP))は、完成医薬品であっても、製造販売承認の要件から免除される免除措置がある(表1)。承認されたAIT製品およびNPPは、処方箋が必要であり、販売可能である。
表1.
表1.
ドイツ医薬品法(AMG)の重要用語(https://www.gesetze-im-internet.de/englisch_amg/englisch_amg.html)およびオーストリアとスイスの特殊性、一部筆者による翻訳。
2008年まで、すべてのアレルゲン源からの治療用アレルゲンは、ドイツでは販売許可なしにNPPとして販売することができた。2008年、ドイツのTAOが施行され、ドイツで最も一般的なアレルゲン源(表2)からの有効成分を含む療法用アレルゲン製品については、品質、有効性、安全性が販売認可手続きで例外なく証明されなければならず、これらのAIT製品は販売認可なしでNPPとして販売できなくなった[20]。
表2.
表2.
ドイツで製造販売承認を必要とする療法アレルゲンのリスト*[20]。
ドイツでTAOが発効した時点で、それぞれのアレルゲン源を含みNPPとして市販されていた製品については、市販性を維持するために販売認可の申請が必要であった。販売認可が求められない対応する製品の市場性は、2011年11月の経過期間を経て終了し、それ以降、ドイツでは市場に出回らなくなった[56]。TAOの開発プログラムの下で評価され、さらに開発された2つの製剤について、2018年に最初の国内販売認可が与えられた(表3)。さらに49の治療用アレルゲンについては、法的な経過措置のもとで販売認可の申請がまだ保留されている(PEIの「TAOによる市場性のある治療用アレルゲン」のリストによる;2022年4月12日時点;https://www.pei.de/DE/arzneimittel/allergene/therapie-verkehrsfaehig/verkehrsfaehig-node.html)。
表3.
表3.
欧州連合(EU)における医薬品の製造販売承認手続き。
これらの治療用アレルゲン(表2)が製造される調製前バルクは、連邦バッチ試験(調製前バルクバッチ試験)の対象となるが、認可製剤では可能な限り最終製品でバッチ試験が実施される。一方、製造工程、臨床効果、安全性についての公的な審査は、認可のプロセスにおいてのみ行われる。TAOに基づく製造販売承認の申請が決定されるまでは、これらの製品は処方・販売が可能な点で、承認済み製剤と同等である。しかし、臨床文書において有効性の証明および/または製品の安全性が損なわれている証拠がない場合、最終的にPEIによって販売承認が拒否されるまで、さらなるバッチリリースは拒否されることになります。TAO の添付文書に記載されたアレルゲンを含まない NPP として製造された他のすべての治療用アレルゲン (表 4 の例)は、依然として製造販売承認の要件が免除されており、したがって公的な品質、有効性、忍容性の 管理や連邦バッチテストの対象にはならない。ドイツの医薬品法によれば、製造管理及び品質管理に関する基準(GMP)に適合することを保証する製造承認が必要である。
表4.
表4.
TAO*で規制されていないアレルゲン群を有するAITのNPPの例[20]。
認可製剤(http://www.pei.de)は、外箱および製品特性概要(SmPC)に記載された販売認可番号によってNPPと区別することができる。
製造販売承認は、有益性とリスクの比率が肯定的な場合にのみ付与されます。特に、医薬品の製造および品質管理に関する情報、すべての前臨床試験および臨床試験の結果、その他の医学的試験結果を、承認書類とともに所轄官庁に提出する必要があります。製造販売承認を得るためには、医薬品の品質、有効性、安全性が現在の技術水準に基づいて実証される必要があります。知識のレベルは時間とともに進化し、その結果、一般的に要求事項が増加します。そのため、臨床試験で収集されるデータの質が高くなり、それに基づいて承認されるAIT製品の有効性と安全性に関するエビデンスのグレードが高くなっています。現在の技術水準としては、例えば、GMP、GCP(good clinical practice)、欧州薬局方(Pharmacopoea Europaea)、アレルゲン製品の製造及び品質に関するEMAの対応するガイドライン(https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-allergen-products-production-quality-issues_en.pdf)及びAIT製品の臨床開発に関するガイドライン(http://www.ema.europa.eu/docs/en_GB/document_library/Scienti %20c_guideline/2009/09/WC500003605.pdf) [21, 31, 57] が挙げられる。AIT製剤は、用量設定試験(第Ⅱ相)及び確認臨床試験(第Ⅲ相)を経て、プラセボと比較した有効性及び安全性が確認された適応症及び患者群にのみ承認されるのが現状である。倫理的な理由から、ヒメ毒AIT製剤の承認にはプラセボ対照は必要ありません。この場合の比較対象は、通常、確立した基準製剤です。
欧州連合で承認されたAITに関する臨床試験の最新の概要は、EU臨床試験登録(www.clinicaltrialsregister.eu)で確認することができます。製造者は、対応する試験で得られた有効性に関する結果(1990年と現在では要件が異なるため、その質は大きく異なる可能性があります)を、SmPCの5.1項に記載することができます。認可された製剤の場合、SmPCのこの情報も当局によって審査されています。現在の製造販売承認では、このオプションはメーカーが使用しており、医師がこの製剤に関する情報を得る良い機会となっています。
認可された最終医薬品は、AITに必要なアレルゲン抽出物の全範囲をカバーできないため(特に、より少ない頻度のアレルゲン源)、NPPは臨床試験に十分な患者数を確保できない低頻度のアレルギーに対する正当な理由を保持している(表4)[58]。
結論4:頻度の高いアレルゲン源(甘い草の花粉(トウモロコシを除く)、カバノキ、ハンノキ、ヘーゼル、イエダニ、ハチとスズメバチの毒)を含む製品は、ドイツでは治療アレルゲン条例に従って販売認可を得なければならない。認可のプロセスでは、これらの製品の品質、有効性、安全性が評価されます。EMAのガイドラインに従ってリスク・ベネフィット比を実証する認可済みまたは販売可能なアレルゲン製品を適用することが望ましい。指名患者用製品は、AITのための希少アレルゲン源の処方に用いられる。治療用アレルゲン条例に記載されているアレルゲンと混合することはできない。オーストリアとスイスには、国別の規制が適用される。
推奨2:EMAのガイドラインに従ってリスク・ベネフィット比を実証した認可済みあるいは販売可能なアレルゲン製剤を好ましく適用すべきである(コンセンサス、同意94%)。
3.4. AITの社会経済的側面
ARC、アレルギー性喘息、アレルギー性皮膚疾患などのアレルギー性疾患は、患者個人の健康だけでなく、医療費や経済全体にも大きな影響を与える [59, 60, 61, 62] 。疾病に直接関連する費用だけでなく、間接的で無形の費用も、罹患者と医療制度に負担をかけている [60, 63]。ARCの直接的な疾病コストは、1990年代には既に数億ユーロに達していた。ARCの総費用が高いのは、一人当たりの費用が高いからではなく、むしろこの疾患の高い有病率からきている。アレルギー疾患の無形のコストは、本質的に生活の質に対する高い等級の障害によって決定される。
アレルギー疾患のガイドラインに基づく治療は、疾患の負担と進行を軽減し、QOLを向上させることにより、高いレベルの患者利益を創出することに役立っている。治療の選択肢としては、対症療法、アレルゲン回避、そして多くの場合、疾患修飾型治療としてAITがあります。経済的観点からは、AITの費用対効果は、その臨床効果と妥当なコストでの患者の利益に基づいている [64] 。現在の研究によると、AITの治癒的特性と予防的特性の両方により、疾患の個々の経過が有利に改善される(疾患修飾効果)。アレルギー性鼻炎の患者は、10年以内に気管支喘息を発症する相対リスクが3.5倍高くなります[65]。文献上、AITが(アレルギー性気管支喘息への)疾患進行を抑制することによる疾患修飾作用を支持するいくつかの研究がある([66, 67]、第4章も参照)。
治療薬の医療経済評価は、a)費用対効果、b)費用対効果、c)費用対効果の分析に基づいて行われる。これらの分析により、異なる治療法や単体の製品を比較し、経済的な観点からのメリット・デメリットを評価することができる。AITに関する現在の文献では、すべての形式の分析が報告されている[60]。a)では対費用、b)では対費用と臨床スコアなどの自然な臨床結果、c)では対費用とQOLなどの患者報告エンドポイントとの比較分析が行われている。
このような分析の結果は、製剤の評価に用いられ、医療制度による償還支援の決定において重要な役割を果たす。ドイツではないが多くの国では、AIT後に1年ごとに得られるQOLは、標準化された「質調整生存年」(QALY)を用いて決定され、増分費用便益分析に用いられている[68]。完全な健康状態での各年齢はQALY1として表され、疾患負荷に応じて減少し、死亡の場合はQALY0.0となる。病気の経過、異なる処置や治療のタイムポイント(この場合はAIT)のコストの差を関連するQALYで割ることによって、増分費用効果比(ICER)を得ることができる。
最近の研究では、AITのICERは、その適用経路に関係なく、慢性疾患の治療の範囲内にあることが示されている [69, 70] 。ドイツで行われた別の費用対効果分析では、AITの費用削減の可能性が強調されている [71]。適応症群における治療率の向上は、さらに経済的な重要性を持つものである [72]。
メタアナリシスでは、舌下投与と皮下投与の経路の間に関連する差はないことも判明している [73]。しかし、費用の性質がこれらの分析に影響を及ぼしている [74]。また、AITの経済性を示す国際的な研究も数多く存在する[75, 76, 77]。1年当たりの累積ICERに基づく長期分析では、治療開始時の多額の投資が、平均して7年後には費用中立であることが証明されている [78]。これらの効果は、治療のコンプライアンスに強く依存していることを強調すべきである。一般的に、SCITとSLITのコストを比較するためには、3年間の治療期間について、その時点で有効な個々の製品の価格(公式薬価リスト(LAUER-TAXE®)と製造者の推奨による投与量による)を使用することが望ましいとされています。
結論5:アレルギー性鼻結膜炎(ARC)およびアレルギー性気管支喘息は、社会全体に多大な直接費、間接費、および無形費をもたらしています。AITは、ガイドラインに沿って適応され使用された場合、治療へのアドヒアランスが良好であれば、薬物療法のみと比較して、長期的に有意に費用対効果が高い。AIT製品の選択は、ドイツの社会法に基づき、臨床的利益がコストに優先するため、個々に決定されなければならない。
第4章. AITの有効性
4.1. AITの有効性を評価するシステマティックレビューとメタアナリシス
システマティックレビューは、定義された再現性のある文献検索方法を用いて医学文献を要約し、批判的な評価を行うものである。一方、メタアナリシスは、多くの研究を数学的・統計的に統合し、異なる解析の総和によって効果量を推定するものである。メタアナリシスでは、効果の大きさだけでなく、平均値に対する値の分布も報告されます。メタアナリシスという言葉は、効果量の適切な計算、重み付け、異質性の分析などの確立された統計手法と、メタアナリシス・データの異なる階層構造を考慮した統計モデルに従った場合にのみ使用すべきである[79, 80, 81]。PRISMA(Preferred Reporting Items for Systematic Reviews and Meta-Analyses)声明により、エビデンスに基づく医療におけるシステマティックレビューとメタアナリシスの表示(good reporting practice)と言語に関する同意済みの基準が確立されている[82, 83]。
エビデンスに基づく医療では、メタアナリシスはエビデンスヒエラルキーのピラミッドの頂点にあるというコンセンサスがある[84]。しかし、メタアナリシスもまた批判されており、特に、質の低い研究や異質性の高い研究が含まれ、出版バイアス(有意な効果がない、または有意な効果がないと報告した研究はほとんど出版されていない)の可能性を無視する場合である [84] 。最近、システマティックレビューやメタアナリシスの著者の多くが、重要な方法論のステップをすべて徹底的に踏んでいないことが報告されている [85]。メタアナリシスは、その有用性にもかかわらず、科学的統合と意思決定に関して限界がある [79] 。メタアナリシスは、エビデンスが不十分な分野に光を当てることはできるが、この欠点を補うことはできない(「統計的・科学的手法であり、魔法の技術ではない」) [79]。研究結果の異質性を低減し、同時に日常の診療に関連する記述を行う方法の一つは、あらかじめ定義された基準に従って解析に含める研究を厳密に選択することである [1, 27, 86]。
例えば、各群100人以上のAIT試験、CONSORT [87, 88, 89]に従って結果を報告するための標準化された手段を用いた試験、又は例えばCSMS [27, 86]を適用した試験のみを含めることが可能であろう。制約には、常にバイアスの可能性があることに留意すべきである。
AITに関するメタアナリシスは繰り返し実施されており、最近のメタアナリシスでは、質の高い症例を多く含むより多くの研究を含めることができるようになった。2009年までに発表されたメタアナリシスの概要は、[90]および[91]に記載されている。最近発表された適応症関連のメタアナリシスと、含まれる研究の数および発表年は、表5に示すとおりである。これらのシステマティックレビューやメタアナリシスの結果は、国内外のガイドラインやクリニカルパスで考慮されている [30, 33, 38, 92, 93]。
表5.
表5.
AITに関する現在の適応症関連のメタアナリシス(MA)およびシステマティックレビュー(SR)。
とはいえ、メタアナリシスは、日常の患者管理におけるAITに関する多くの実際的な疑問に答えることはできない[94, 95]。臨床試験におけるAITのエビデンスを評価するために重要な他のパラメータ、例えば脱落率[96]、アドヒアランス[97]、プラセボで得られた効果[30、52、53、54]もメタアナリシスではほとんど考慮されていないか、されていない。
要約すると、メタアナリシスでは、アレルギー性鼻炎/鼻結膜炎、アレルギー性喘息、昆虫毒アレルギーにおけるAITの有効性が十分に立証されていることが確認された。しかし、すべての解析で報告された研究の異質性から、著者らは、AITにおいてクラス効果の意味での一般的な推奨は不可能であり、個々のAIT製剤について個別に有効性と忍容性の特定の証拠が必要であることを強調している。
結論6:システマティックレビューとメタアナリシスにより、特定の適応症、アレルゲン、年齢層に対するSCITとSLITの有効性が証明された。対照試験から得られたデータは、その範囲、質、製剤、投与レジメンなどの点で大きく異なっており、製品ごとの評価が必要である。特定の製剤の有効性を、同じ方法で投与されるすべての製剤に広く転用することは支持されない。
4.2. ドイツ、スイス、オーストリアで販売されているAIT製品の製品別評価(イネ科、樹木花粉(Betulaceae)、ハウスダストマイトのアレルゲンの同族群)。
AIT 製品に関する臨床上の記録は上記のように異質性が高いため、ドイツ、スイス、オーストリアで販売されている AIT 製品の製品別評価が推奨される。S2kガイドラインの更新に伴い、DGAKIホームページの個別製品一覧表が修正され、更新されました(https://dgaki.de/leitlinien/s2k-leitlinie-ait/)。この表形式は6ヶ月ごとに更新される予定です。このリストは、ドイツおよび欧州の当局であるPEIおよびEMA、臨床試験登録機関であるclinicaltrialsregister.eu、およびそれぞれの治療アレルゲンの参照された科学的全出版物から提供された情報のみに基づいて作成されています。
このリストには、AIT製品に関する以下の特徴が含まれています(アルファベット順に、3つの相同グループに分かれています)。i) 該当する場合は製造販売承認の年、承認の詳細(TAO前の国内承認手続き、TAOに基づく国内承認手続き、EMAによる欧州承認手続き、小児の治療に関する承認、青年の治療に関する承認)、ii) 現在販売されている用量の製品に関する試験の概要(第II相および第III相試験)、入手できる場合は論文の情報、iii) TAO規制手続きによる製品に関する試験の概要(第II相および第III相試験)および入手できる場合は論文の情報。
結論7:明確に定義された基準に従って、個々のAIT製剤の製品別評価を行うことが推奨される。DGAKIウェブサイト(https://dgaki.de/leitlinien/s2k-leitlinie-ait/)には、AIT製品固有の情報が表形式で掲載されており、ドイツ・オーストリア・スイスで流通しているイネ科・樹木花粉(Betulaceae)・ハウスダストマイト・アレルゲン製剤の相同グループが含まれています。
4.3. イネ科花粉症
イネ科花粉症による呼吸器系アレルギー(アレルギー性鼻炎/鼻結膜炎、アレルギー性喘息)は、我々の気候において最も一般的なアレルギーの一つです。イネ科(Poaceae)は世界中に存在する。イネ科の亜科(「温帯」イネ属)には、主に我々の緯度に自生し、その花粉アレルゲンが非常に交差反応を示すイネが含まれます。亜熱帯イネ科(Panicoideae/Chloridoidae)は、特に暖かい気候帯で見られ、その花粉は我々の緯度に自生するイネ科の花粉と部分的にしか交差反応を示しません[107]。しかし、熱帯のイネ科植物もヨーロッパに生息している [108]。花粉を数える際、個々の種の花粉を区別することは不可能である。ここで生育する亜熱帯性イネ科植物の花粉量に関するデータは、ドイツでは得られていない。
イネ科の花期は4月頃から9月までと非常に長いため、イネ科の花粉症は多くの患者にとって深刻な負担であり、生活の質に大きく影響する。AITは、唯一の原因療法であり、対症療法を補完するものです。AIT については、イネ科に属する多数のイネ属または少数のイネ属の花粉を混合したものが市販されており、イネ科花粉エキスの組成が異なっていても、グループ 1 またはグループ 5 の主要アレルゲン化合物を基準に標準化しても、アレルギー活性に有意差はない [109] [9].
アレルギー性鼻炎は、アレルギー性喘息発症の主要な危険因子である[65]。ここで、イネ科花粉アレルゲンを用いたAITは、抗症状緩和薬との補完効果に加えて、予防的治療の可能性を示しています。以下は、季節性ARCおよびアレルギー性喘息患者におけるイネ科花粉症に対するAITの有効性および安全性に関する現在のエビデンスの概要である。
しかし、AIT に使用される様々な製品の有効性と安全性に関して、臨床記録やエビデンスに高い異質性が残っている。したがって、イネ科花粉抽出物については(以降の章で報告する他のすべてのアレルゲン抽出物についても同様)、臨床開発プログラムおよび臨床試験で記録された有効性と安全性に基づいて、異なるAIT製品を評価すること(製品固有の評価)が推奨される。
4.3.1. ARCおよび草本花粉症におけるAITの有効性
SCIT
イネ科花粉症関連 ARC の成人患者の治療において、SCIT の有効性を示す文献は数多く存在する([17, 98, 110, 111, 112, 113, 114, 115, 116, 117, 118]を含む)。
入手可能な、あるいは市場認可されているすべてのイネ科植物花粉エキスが WAO と EMA の有効性基準に従って試験されているわけではなく、ほとんどの製剤について特定の小児科試験が行われているわけでもない。284人の小児を含む非盲検、非対照、多施設研究では、ドイツで承認された6種類のSCIT製剤の効果に有意差は認められなかった [119] 。
ARCの小児および青年において、カバノキ、イネ科植物、カバノキ-イネ科植物混合物のSCIT製剤は、ARCの症状を軽減するだけでなく、前向き非盲検試験(「予防アレルギー治療(PAT)試験」 [66] )でアレルギー性ぜんそくの発症リスクを低減することが可能であった。この効果は、薬物療法による対症療法のみを受けた対照群と比較して、SCIT終了後7年経過しても観察された [120]。処方箋とコード化されたデータを用いたRWE研究では、アレルギー性鼻炎と季節性アレルゲンに対するアレルギーを持つ患者の気管支喘息の発生率に対するAITの統計的に有意な保護効果が示された [121]。別のRWE研究では、イネ科花粉SCIT後、アレルギー性鼻炎の投薬が64.8%と統計的に有意に減少し、小児でも同様の効果が60.7%であることが示されました[39]。
結論8:イネ科花粉症におけるARCのSCITの有効性は、成人患者における多くの研究により非常によく証明されているが、小児および青年においては、これはほとんど研究により証明されていない。非対照試験と RWE 試験では、小児および青年における喘息予防効果が示された。一般に、臨床効果の証明には製品ごとの違いがあり、製品ごとの評価が重要であることがわかります。これは、以下のアレルゲングループ全てに当てはまる。
SLIT
喘息を併発している、または併発していないARCにおける草花木綿抽出物によるSLITの有効性は、欧州 [122, 123] および米国 [124, 125] で実施されたいくつかの大規模研究で証明されています。すでに販売認可を受けている舌下錠の臨床効果については、(研究の数や方法において)高いレベルのエビデンスがある[122, 123, 126]。
5歳からのイネ科花粉症児を対象に1シーズンにわたってイネ科錠剤を調査した研究では、成人の研究と同等の効果サイズが実証されています[127, 128, 129]。そのため、両製剤は5歳からの小児用としても承認されている。
現在市販されている両方のイネ科の錠剤について、成人では「キャリーオーバー」効果が実証されています。3年間の治療期間終了後1年 [130, 131] または2年 [132] 経過しても臨床効果が維持されたのです。5歳以上の小児を対象とした二重盲検プラセボ対照試験において、1種類の草タブレットで、3年間の継続投与終了から2年後にキャリーオーバー効果が示された[67]。大規模な二重盲検プラセボ対照(DBPC)試験でも、液体イネ科SLIT製剤が小児と成人の両方で臨床的に有効であることが示されている[133, 134, 135, 136]。他の液体イネ科SLIT製剤の研究結果は矛盾しているか、これらの製剤はDBPC研究において全く検討されていない。
SLITについても、下気道への関与(喘息発症)についての予防効果は、これまでのところほとんどが非盲検試験で実証されている [137、138、139]。喘息予防に関する唯一のプロスペクティブな対照研究は、研究開始時に鼻結膜症状のみを有する800人以上のイネ科アレルギーの小児および青年を対象に実施されたものである。イネ科植物錠剤(SLIT)を用いた3年間のAITにより、治療2年目から治療中止2年後、すなわち試験開始から5年後まで、プラセボ治療と比較して喘息症状および喘息薬の有意な減少が認められた(「草の舌下免疫療法錠喘息予防(GAP)」) [67].しかし、文書化された可逆的肺閉塞とあらかじめ定義された喘息の初発(主要評価項目)には、有意差は認められませんでした。
あるRWE研究では、成人および5歳から18歳の小児・青年の両方において、アレルギー性鼻炎に対する薬の処方を減らすという点で、SLITが統計的に有意な影響を与えることが示されました[40]。また、別のRWE研究では、イネ科の花粉のSLIT後、アレルギー性鼻炎の薬の処方が53.6%と統計的に有意に減少し、小児でも同様の効果があることが示されました[39]。さらに、2種類の草花木綿タブレットを用いたドイツのRWE研究では、少なくとも2年間のSLIT治療コース後に、アレルギー性鼻炎の薬の処方数が50%減少することが示されました[140]。
結論9:成人および小児のイネ科花粉症によるARCにおけるSLITの有効性と安全性は、非常によく知られている。しかし、製品特有の違いが存在する。ある対照研究では、小児および青年における喘息予防効果が示されている。
4.3.2. アレルギー性喘息とイネ科花粉症におけるAITの有効性
SCIT
ARCにおけるSCITの使用とは対照的に、アレルギー性気管支喘息におけるSCITの適応は、通常より限定的である [86, 141, 142, 143] 。SCITは、適切な抗喘息療法に取って代わるものではない。数多くの研究に基づいて、SCITは、喘息症状のアレルギー性要素が十分に立証され、それぞれのアレルゲンへの暴露後に明確な臨床症状を伴うアレルギー性感作によって確認される軽度から中等度の喘息の場合(喘息に関するグローバルイニシアチブ(GINA)2020[143]、ドイツ呼吸器学会(DGP)およびドイツ呼吸器連盟[141]による分類)、推奨され得るものである。これは、Cochrane Library [144] のメタ分析データに基づくドイツの "Nationale Versorgungsleitlinie Asthma" [142] の勧告とも一致しています。後者には、ハウスダストマイトアレルゲン(42研究)、花粉アレルゲン(27研究)、動物アレルゲン(10研究)、およびその他のアレルゲンに対するアレルギー性喘息患者3,459人の合計で88の無作為化対照、しかし手法的に異質のSCIT研究が含まれている。評価したすべての研究を分析した結果、症状スコアと薬の消費量が有意に減少することが示されました。さらに、非特異的気管支過敏症もわずかではあるが有意に減少した。SCIT 患者におけるハウスダストマイト・アレルゲン、花粉、動物アレルゲンに対するアレルゲン特異的気管支過敏症の有意な減少は、関連アレルゲンにさらされた際の喘息増悪の相対リスクの低さと解釈することができる。対象となった研究のうち20件では、肺機能パラメータが分析された:肺機能の改善傾向がみられたが、これは有意には至らなかった [144] 。しかし、間欠性または軽度の持続性喘息患者は、通常、肺機能パラメータに有意な障害を示さないため、この臨床エンドポイントは、SCITの有効性を評価するのに適していない。残念ながら、このCochrane Studyでは、小児に対する個別の解析は行われていない。
喘息のコントロールが不十分な比較的少数の患者群は、AITの慎重な適応と開始をもたらす全身性の副作用のリスク群に相当する [1, 92] 。2017年に発表された気管支喘息におけるAITに関する最も包括的な系統的レビューとメタ解析には、89のDBPC試験が含まれていた[100]。このメタ解析に含めることができた9件のSCIT試験において、すべてのアレルゲン(草花、木花、動物、カビ)に関して(標準平均差(SMD)-1.64、95%CI -2.51~-0.78) 、草花サブグループ(SMD -1.18、95%CI -2.17~-0.20; 4試験)ともに症状スコア改善における強い効果が認められました。この効果は、18歳未満の小児および青年においても認められた。また、すべてのアレルゲンに関連する投薬スコアの改善においても7試験から強い効果が認められ(SMD -1.65, 95% CI -2.52 to -0.79)、草花のサブグループでは暗黙の効果(ただし未確認)が示されたが(SMD -0.06, 95% CI -0.41 to 0.28)、ここでは2試験のみ評価することが可能であった。副次的評価項目については、全アレルゲン群のアレルゲン特異的気管支過敏症の改善に関して強い効果があり(SMD 0.93, 95% CI 0.08~1.79; 3試験)、後者は8つの高品質RCTでも支持されており、疾患特異的QOLの有意な改善(SMD -0.83, 95% CI -1.19~-0.47; 3試験)でも支持されていました。このメタアナリシスに含まれる、季節性イネ科花粉関連喘息を持つ3歳から16歳の小児および青年35人を対象としたDBPC研究 [100] では、非修飾(ネイティブ)アレルゲン抽出物を用いたSCITにより、喘息症状-投薬スコアが著しく低下することが示された [145].
気管支喘息を有するARCの子供284人を含む非盲検、非対照、多施設研究において、ドイツで承認された6種類のSCIT製剤の効果に喘息児の有意差は認められなかった [119]。RWEの研究では、3年間の治療後、喘息薬の処方が14.0%、小児では27.4%、統計的に有意に減少したことが示されています[39]。
結論10:イネ科花粉症による季節性アレルギー性喘息におけるイネ科花粉抽出物によるSCITの有効性は、成人患者において十分に証明されているが、小児においては少数の研究で証明されているに過ぎない。
SLIT
ARCと比較して、気管支アレルギー性喘息患者におけるSLITの有効性については、限られた数の研究しかありません。利用可能なデータのほとんどは、ARCにおけるAITの有効性に関する研究のサブグループ分析によるもので、気管支喘息を併発した患者も含まれています。新しい重要なアプローチは、小児および成人の気管支喘息患者におけるAIT製剤の有効性に関する研究で、吸入コルチコステロイドの1日投与量を段階的に減少させながら喘息コントロールを良好に保つことを主要エンドポイントとして分析したものである[146]。
2017年に発表されたアレルギー性喘息におけるAITに関するEAACIの系統的レビューとメタアナリシスでは、短期研究でSLITを使用している患者のサブグループ分析では、症状スコア(SMD -0.35; CI -0.75~0.05) と投薬スコア(SMD -0.29; CI -0.82~0.24 )の減少に関して疑わしい利益のみが示されました[100]。しかし、6件の二重盲検プラセボ対照SLIT研究のみが含まれ、そのほとんどが古いもの(1999年から2009年の間に発表)であった。これらの研究のうち、喘息における草花SLITを調べたのは2件のみで、1件は成人における有意な効果を示さず [147]、1件は小児および青年におけるプラスの効果を示した [148]。全体として、猫、ダニ、草の花粉の水性抽出物を用いた研究は、異質性が非常に高いものであった。分析された製品のほとんどは、もはや現在の基準を満たしていないため、メタアナリシスの結果は、現在の推奨事項を導き出すために限定的にしか使用できない。アレルギー性気管支喘息に対する最新のSLIT製剤の効果に関するさらなる研究結果は、今後数年以内に利用可能になると予想されます。
AIT介入の目的は、良好な喘息コントロールを維持し、喘息増悪のリスクを軽減するために必要な薬物療法を減らすことであるべきです。この点に関して、RWE分析では、既存の気管支喘息を持つ患者さんにおいて、喘息薬の処方が統計的に有意に減少していることがわかりました。さらに、データは、喘息薬の最初の処方の統計的に有意な減少レベルに基づき、AIT中に喘息を発症するリスクの減少を示唆しました[40]。別のRWE研究でも、治療3年後の喘息薬の処方が、すべての年齢層で10.6%、小児で21.0%、統計的に有意に減少したことが示されています[39]。2種類の草花木灰錠を用いたRWE研究では、SLIT後の喘息治療の初期処方の相対リスクは、既存の喘息における喘息薬の処方数と同様に、SLIT群で62.5%と有意に低いことが示されました[140]。
より最近のRWE研究では、GINA重症度に応じた喘息薬の処方に基づいて、AITによる喘息進行の有意な減少を実証することができたが、それ以上は明記されなかった。この効果は、全人口よりも青年・若年層で大きかった[149]。
結論11:イネ科花粉症によって誘発される季節性気管支喘息の成人におけるSLITの有効性に関する代表的な研究はごくわずかであり、小児や青年の年齢層における代表的な研究もほとんど存在しない。現在のデータに基づくと、イネ科の花粉によるアレルギー性喘息にSLITを推奨する根拠は限られている。
推奨3:イネ科花粉症による季節性ARCにおいて、AITの適応がある場合は、成人および小児・青年において、有効性が証明された製品のみを用いて実施すべきである。イネ科花粉症による季節性気管支喘息が良好または部分的にコントロールされている場合、成人および小児・青少年にAITの適応があれば実施すべきである(強い合意、100%の一致)。
4.4. 樹木花粉アレルゲン (カバノキ科)
白樺/ヘーゼル/ハンノキ/オーク/ブナの花粉はすべてブナ科(Fagales)に属し、高い交差反応性を示しますが、白樺は最も関連性の高いアレルゲンの供給源とされています。シラカバ花粉エキスによるAITは、ハシバミとハンノキの花粉シーズンの症状も軽減するという証拠が存在し、カシの花粉関連症状の改善効果も実証されています[150]。
4.4.1. ARCと樹木花粉(Betulaceae)アレルギーにおけるAITの有効性
SCIT
シラカバ花粉症に対するAITの有効性に関する一連のDBPC研究において、いくつかの製剤で症状の軽減や薬剤使用の減少が示された [98、151、152、153、154、155、156]。逆に、他の多くの市販されているシラカバ花粉抽出物の安全性と有効性は、DBPC試験で実証されたことはありません。具体的な小児科での研究は、すべての製剤について不足している。
ドイツのRWE研究では、白樺SCITの処方後、最初の6年間に処方された症状緩和のための薬が28.6%(統計的に有意)少ないことがわかった [41]。別のRWE試験では、AITの3年後にさらに顕著で統計的に有意な効果が示されました。樹木花粉抽出物によるSCITを受けた患者群全体では、対症療法的なアレルギー治療の処方数が56%減少しました[39]。小児では、処方数は42.3%減少した(統計的に有意)。
結論12:成人における樹木花粉(ベツラカ)アレルギーによるARCに対するSCITの有効性は、多くの研究によって証明されているが、小児や青年における具体的な研究は不足している。健康保険の処方箋に基づく最初のリアルワールドの分析データは、すべての年齢層で有効であることを示している。
SLIT
シラカバ花粉症患者に対するSLITの錠剤および滴下製剤は、最新の規格に基づき認可されています。シラカバ花粉抽出物を用いた最初のDBPC試験では、1年間の治療後、プラセボと比較して症状および投薬スコアの有意な減少が示されました[157]。570人以上のシラカバ花粉症成人患者を含む2014年に発表された別の試験では、2年間のプレ/コ季節的SLIT-コースにおいて、プラセボに対する液体樹木花粉エキスの統計的に有意な優位性が見出されました[158]。また、無作為化試験において、この製剤の急速な増量の安全性が6-14歳の小児および青年で確認されました[159]。
すでに販売されている舌下液剤の用量設定試験 [160] で、プラセボと比較して高アレルゲン濃度での有効性に有意差が認められたため、さらに高アレルゲン濃度の新製剤が開発され検討された。その後、406人の成人を含むDBPC試験で、良好な安全性プロファイルとともに、症状と投薬の複合スコアに統計的に有意で臨床的に関連した減少が確認されました[161]。この製剤については、小児および青年に関する研究はまだ不足している。
新たに開発されたカバノキ花粉の錠剤の安全性と有効性は、12歳から65歳の634人の被験者を対象とした重要な第III相試験でも実証されました。634名の被験者のうち、60名が青年であった[162]。この研究では、ハンノキとハシバミの花粉の季節の症状の改善に関しても、カバノキ花粉エキスによる治療しか行われていませんでしたが、プラスの効果が認められました。
多くの古い液体樹木花粉(シラカバまたはシラカバ/ハンノキ/ヘイゼル混合)SLIT製剤については、不均一な研究結果が得られているか、DBPC試験でまだ調査されていません。
樹木花粉症に関しては、RWEのデータでも、データセット全体で、処方された対症療法薬の数が46.5%減少し、統計的に有意であったことが報告されています[39];子供と青年では36.8%の減少で、これも統計的に有意でした。また、AIT中止後6年目まで同じ結果であった(32.9%、統計学的に有意)[41]。
結論13:樹木花粉症によるARCにおけるSLITの安全性と有効性は、成人患者において非常によく立証されている。小児や青年の樹木花粉症患者に対しては、いくつかの研究がこの治療法の安全性と有効性を示している。
4.4.2. アレルギー性喘息と樹木花粉症における AIT の有効性
アレルギー性喘息や樹木花粉症に対する AIT の有効性については、まだ数少ない研究しかありません。
SCIT
SCIT製剤に関する現在の4つのDBPC試験では、ARC患者の25~40%がカバノキ花粉関連喘息を併発していた(コントロールされていた) [153, 154, 163, 164]。喘息の症状コントロールに関する結果は、これら4つの試験のうち1つのみで発表された。この試験では、プラセボと比較して積極的に治療した試験群では、白樺花粉の季節に喘息コントロールテストがわずかに改善されたが、有意に良好であることが実証された。4つの試験すべてにおいて、AIT下の喘息患者における副作用の頻度の増加は報告されていない。特に、喘息発作やアナフィラキシーを起こした症例はありませんでした。限られた検出力のプラセボ対照試験では、治療 1 年後に気管支アレルゲン特異的過敏反応の低下が認められました[151]。
RWE研究では、白樺花粉アレルゲンによるSCIT後6年間で喘息薬の処方回数が32%減少したことが明らかになりました [41]。これらの効果は、3年間の治療後の別のRWE研究でも実証されている(全体9.3%、子供14.1%、いずれも統計的に有意)[39]。
結論 14: DBPC 試験により、樹木花粉(カバノキ科)アレルギーを原因とする季節性アレルギー性喘息の成人に、樹木花粉エキスを用いた SCIT が有効であることが示された。成人および小児の季節性アレルギー性喘息における樹木花粉抽出物によるSCITの有効性は、これまであまり検討されてこなかった。しかし、健康保険の処方データに基づく実臨床分析のデータから、この適応症における有効性が示唆されています。
SLIT
SLIT製剤を検討した3件のDBPC試験において、組み入れられた患者の20~40%がコントロールされた喘息患者であった [158、161、162]。喘息の症状コントロールに関する結果は、これら3つの試験のうち2つから入手可能である。そのうちの1つの試験では、白樺花粉の季節に喘息コントロールテストがわずかではあるが有意に良好であることが実証された。しかし、ハンノキ、ヘーゼル、シラカバの花粉シーズン全体では確認されなかった。2番目の研究では、積極的に治療したグループとプラセボグループの間で喘息の症状コントロールに差がないことが判明しました。3つの試験すべて、および6歳から14歳の小児を対象とした試験において、喘息患者における副作用の増加は見られず、特に喘息発作やアナフィラキシーは見られませんでした。RWE分析では、SLIT後の6年間のフォローアップ期間中に、既存の気管支喘息に対する喘息薬の処方が減少した(41.2%、統計的に有意)ことがわかりました[41]。一方、別のRWEでは、そのような効果は確認できなかった[39]。
さらに、未治療の対照群と比較して、AITコースでは喘息薬の初回処方回数が少ないという点で有意な改善が報告された。しかし、AIT中止後の6年間のフォローアップ期間では、これらの効果をさらに実証することはできなかった[41]。
白樺花粉症喘息におけるSLITの有効性を主に調査した臨床試験は見つからなかった。
結論15:樹木花粉によるSLITは、喘息がコントロールされている患者に安全に適用できる。しかし、ARCに関する研究では、喘息の症状コントロールに対する効果はばらばらであった。
推奨 4:樹木(カバノキ科)花粉に対する ARC では、適応があれば、有効性が実証された製剤を用いて、 成人において樹木花粉抽出物を用いた AIT を実施する必要がある。小児および青年では、樹木の花粉による AIT を実施することを考慮してもよい。ベト病菌アレルギーによる季節性喘息がよくコントロールされているか、部分的にコントロールされている場合、成人および小児・青少年においてAITの適用を検討することができる。(コンセンサス、合意率89%)
4.5. その他の樹木花粉(非ベチュラ科)に対するアレルギー
春や夏にARCや喘息を引き起こすカバノキ科やブナ科と交差反応を起こさない、臨床的に関連性のあるその他の樹木花粉アレルゲン-ソースは、例えば、トネリコ、ヒノキ、プラタナスの花粉などです。これらのアレルゲンを含むAITエキスは、TAOによって規制されておらず、質の高い研究も行われていません。
治療用エキスの入手可能性は、しばしば制限されています。同種のアレルゲン源(例えば、トネリコアレルギーの治療にはオリーブ花粉)が使用できることもある。
結論 16:カバノキ科やブナ科と交差反応を示さないその他の樹木花粉、例えばトネリコ、ヒノキ、プラ ンの花粉については、臨床効果に関するエビデンスはほとんどなく、また治療用エキスの入手可能性も限 られている。
推奨5:カバノキ科及びブナ科に交差反応しない樹木の花粉を用いたAITは、現在のエビデンスに照らし合わせて一般的な推奨はできないが、個々の症例で実施することは考えられる(3.3章キーワード「指名患者用製品」参照)。AIT を開始する前に、同定された感作の臨床的関連性が証明される必要がある。(強い合意、100%の同意)
4.6. ハウスダストマイトに対するアレルギー
イエダニ(主に Dermatophagoides pteronyssinus と Dermatophagoides farinae)は世界的に一般的である。イエダニに対する AIT の研究のほとんどは、これら 2 種(「イエダニ」)のアレルゲン抽出物を用いて行われ、他のダニ種、特に貯蔵ダニ種の抽出物を用いた治療の有効性を検討した研究はごく少数にとどまっている。しかし、これらの抽出物の用量設定試験は行われていない。イエダニ種の間には高度な交差反応があるが、貯蔵庫ダニ・アレルゲンとの交差反応はごくわずかである [165] 。ほとんどの患者が両方のイエダニに対して感作されていますが、中央ヨーロッパでは、少なくとも11%がDermatophagoides pteronyssinusのみ、5%がDermatophagoides farinaeのみに対して皮膚テスト反応を示しています [166]。
4.6.1. ARCおよびダニアレルギーにおけるAITの有効性
SCIT
SCITに使用されるイエダニ抽出物の用量反応関係については、わずかな研究しか発表されておらず、ほとんどの研究が現代の方法論的品質基準を満たしていない [167、168、169、170、171]。ほとんどの製剤について用量設定試験が行われていないため、これらの抽出物を用いたAITが(安全性および有効性の点で)最適な用量で実施されているかどうかは不明である。さまざまなイエダニ抽出物を用いたSCITの有効性は、DBPC試験で実証されている[169、172、173、174]が、市販されている製品の臨床資料はかなり異なっている。結果は、2019年からのメタ分析にまとめられている[175]。2種類のハウスダストマイト抽出物を直接頭から比較した研究は1件のみで、その臨床効果に関する有意差は認められなかった[176]。ハウスダストマイト抽出物を用いたSCITの小児研究([177]を含む)は、ほとんど発表されていない。RWE研究では、小児と成人の両方で、少なくとも2年間のハウスダストマイトのアレルゲンによる治療後に、ARCの治療のために処方される薬剤の数が統計的に有意に減少することが示された[178]。
結論17:成人患者のARCにおけるイエダニ抽出物を用いたSCITの安全性と有効性に関するデータが入手可能である。小児におけるこの治療の安全性と有効性は、症例数の少ない研究で実証されているが、現代の方法論基準に従った二重盲検プラセボ対照SCIT試験が不足しているのが現状である。
SLIT
ARCにおけるSLITの有効性:いくつかのSLITハウスダストマイト抽出物について、高い方法論的品質を有する用量設定試験が発表されている。主要評価項目は、実生活条件下での症状-投薬スコア [179, 180]、暴露室での標準化アレルゲンチャレンジ [181] または結膜チャレンジ [182] 、およびIgE遮断因子の産生における免疫学的変化 [183] であった。
ARCにおけるイエダニ抽出物を用いたSLITの有効性については、近年、いくつかの製剤について、方法論的に質の高い大規模で十分な検出力を有する研究が発表されている[180, 184, 185, 186, 187, 188, 189]。ドイツでは、2つのハウスダストマイト錠剤が販売認可を受けている。メタアナリシスでは、いくつかの試験から得られたデータが分析されています [190] 。全体として、イエダニ抽出物によるSLITで認められた効果の大きさは、花粉抽出物による研究よりも小さい(上記参照)。小児の研究も発表されているが [185、191、192、193]、調査された用量は成人のものよりも部分的に低い [185]。
結論18:いくつかのイエダニSLIT製剤について、成人及び青年患者のARCにおける有効性と安全性は、多数の症例を用いた研究により証明されている。また、ARCとハウスダストマイトアレルギーの小児におけるSLITの有効性と安全性も研究により証明されている。
4.6.2. アレルギー性喘息とダニアレルギーにおけるAITの有効性
SCIT
ハウスダストマイト関連喘息の成人におけるハウスダストマイト抽出物を用いたSCITの有効性および安全性は、いくつかの臨床試験で実証されています。症状スコア [194, 195, 196, 197] 、投薬の使用 [194, 195, 196, 197, 198] 、アレルゲン特異的気管支過敏症 [194, 198] およびQOLパラメータ [194, 197] が臨床エンドポイントに使用されています。ハウスダストマイトアレルギーの小児におけるハウスダストマイト抽出物を用いたSCITの臨床効果は、いくつかの研究 [199, 200] で確認されているが、研究はプラセボ対照ではなく、エンドポイントはアレルゲン特異的気管支反応亢進症 [199] または吸入コルチコステロイド減少 [200] であった。RWE分析では、小児と成人の両方でハウスダストマイトのアレルゲンによる治療を少なくとも2年間行った後、初めて喘息薬を処方される回数が有意に減少したことが報告された [178] 。同様の効果は、以前のRWE研究[121]で見出された。さらに、治療中止から6年後まで、既存の気管支喘息のために処方された喘息薬の数は、子供と大人で有意に減少していた[178]。この効果は、特に小児で顕著であった。
結論19:成人については、ハウスダストマイトアレルギーによるアレルギー性喘息に対するSCITの有効性と安全性は研究により証明されている。しかし、各研究で使用された臨床的エンドポイントは大きく異なるため、異なる研究で示された効果の大きさを比較することはできない。小児および青年に関するデータは限られていますが、この年齢層におけるアレルギー性喘息に対するハウスダストマイトSCITの有効性および安全性を示すエビデンスは存在します。
SLIT
ハウスダストマイトアレルギーによる気管支喘息を少なくとも部分的に制御するSLITの安全性[201]と有効性は、5歳からの小児の研究[202]、12歳からの小児・青年および成人における研究[146、179、203、204]で検討されています。喘息増悪[146]、喘息コントロール[203]、喘息薬消費への影響[179、202]、症状-投薬スコア[204]など様々なエンドポイントにおいて統計的に有意な効果が確認された。
結論20:成人において、ハウスダストマイトアレルギーによるアレルギー性喘息に対するSLITの有効性と安全性は、研究により証明されている。しかし、研究で使用された臨床的エンドポイントは大きく異なるため、異なる研究で示された効果量の比較は不可能である。小児および青年に関するデータは限られているが、この年齢層のアレルギー性喘息におけるハウスダストマイト SLIT の有効性および安全性を示すエビデンスは存在する。
推奨 6:臨床的に関連したイエダニ感作に明らかに関連する ARC 患者には、臨床試験で有効性と安全性が確認されたイエダニ抽出物を用いた SCIT または SLIT を実施すべきである。ハウスダスト・ダニ関連喘息では、SCIT または SLIT の適用を検討することができる。その前提として、治療レベルにかかわらず、少なくとも部分的に喘息がコントロールされていることが必要である。これは、治療期間中に一貫して再評価されるべきものである。喘息治療のより高い段階では、十分に経験を積んだアレルギー専門医や小児科専門医がAITの適応と監視を行うべきである。(強いコンセンサス、100%の同意)
4.7. 貯蔵庫ダニアレルギー
貯蔵庫ダニ(Acarus siro, Tyrophagus putrescentiae (Acaridae family), Glycophagus domesticus, Lepidoglyphus destructor (Glycyphagidae family) )に対する分離型感作は当地では非常に稀で、通常はハウスダストマイトに対する感作が併発されることがある。貯蔵庫ダニとイエダニのアレルゲン間の交差反応は低い。しかし、様々な種類のイエダニの間で交差反応が存在する可能性があります。貯蔵ダニアレルギーによるARCにおいて、SCITの有効性を示す証拠は非常に限られており [205]、SLITについては研究が確認されていない。
結論21:ツメダニ抽出物を用いた製剤については、その臨床的有効性を示す証拠はごくわずかであり、AITのための製剤の入手可能性も限られている。
推奨 7:臨床試験による一般的な推奨はできないが、個々の症例では、ツメダニ製剤を用いた AIT の適用を検討してもよい(3.3 章キーワード「指名患者用製剤」参照)。AIT の適応には、同定されたアレルギー性感作の臨床的な関連性を確認する必要がある。(強い合意、100%の同意)
4.8. その他のアレルゲン
多くの患者は、上記のシラカバ、イネ科植物、イエダニなどのアレルゲンに感作している。しかし、地域差は大きいものの、50%以上の患者で、樹木花粉(トネリコ、ヒノキ、プラタナス)、ハーブ花粉(ヨモギ、ブタクサ、イラクサ、オオバコ、ペリトレ)、哺乳類アレルゲン、カビ胞子(Alternaria sp.、Cladosporium sp.)などの他の吸入性アレルゲンも役割を演じている [206].異質性が高く、患者数が少ないため、これらのアレルゲンはドイツのTAOから除外された。これは、現実的な期間内にドイツで質の高い研究のために大規模な患者群を登録することが困難であることを予見してのことであった。これらのアレルゲンを含む AIT 製剤に関する研究は、少数の例外を除き、小規模であり、質も高くはな い。
4.8.1. ブタクサ(Ambrosia sp.)
ブタクサは、100年以上前に北米で最も重要な吸入性アレルゲンの1つとして認識されたため、希少アレルゲンの中では例外的存在です [207]。Ambrosia artemisiifoliaは、バイオインベーダーとして1世紀以上前に北米から東ヨーロッパに導入され、気候変動に後押しされ、現在ヨーロッパ北西部に広がりつつあり [208] 、特にオーストリア東部やドイツでブタクサ花粉への曝露が増えている [207, 209]。
ブタクサ (Ambrosia artemisiifolia) とヨモギ (Artemisia vulgaris) を、例えば成分分解診断法 (CRD, 主要アレルゲン成分 Amb a1 または Art v1, それぞれ) によって正確に区別することは重要であり、この 2 つのハーブは似ているが部分的には交差反応性のアレルゲン源であり、ほとんどのヨモギ花粉症患者はブタクサエキスによる AIT からは恩恵を受けないだろうからである。例えば、ドイツ南西部では、ブタクサ(30%)に対する感作がヨモギ(24%)よりも多いことが、エキスによる診断で示唆されているようです。しかし、主要アレルゲンを検出するCRDでは、Art v1が13%の血清で陽性であるのに対し、Amb a1がわずか2%の血清で陽性であるブタクサに感作する真のヨモギ感作が明らかに優勢である [210] 。
4.8.1.1. ARC とブタクサ花粉に対するアレルギーに対する AIT の有効性
SCIT
小児におけるブタクサ抽出物を用いた SCIT の研究はない。成人におけるブタクサ花粉抽出物を用いたSCITの有効性は、北米の研究において十分に確認されている [211, 212]。
SLIT
北米ですでに 10 年前から承認されているブタクサ錠剤が,最近ドイツとオーストリアで承認された。臨床的有効性のエビデンスは高いが、研究は主に北米で実施されている [213]。
北米と EU で行われた最近の DBPC 試験では、ブタクサ錠剤の有効性が印象的に示され、ARC と喘息を持つ 1,025 人の子供において、ブタクサ花粉シーズンのピーク時に TCS (投薬と症状のスコアの組み合わせ) が 38%、暴露期間全体では 32% 減少した [214] 。この製剤の忍容性は良好であった。他の製剤については、小児における有効性のエビデンスは不十分である。
ブタクサアレルギーの成人患者では、565名の患者を含むDBPC用量設定試験により、半量で21%、現在販売承認されている高用量で27%のTCSの改善が認められた[215, 216, 217]。
4.8.1.2. アレルギー性喘息およびブタクサ花粉症に対するAITの有効性
SCIT
小児におけるブタクサ抽出物を用いたSCITに関する研究はない。アレルギー性鼻炎の成人患者に非商用エキスを使用した上記の米国の古い研究では、アレルギー性喘息を併発した患者の臨床症状の改善も実証されています[211]。
SLIT
上記で報告されたSLIT研究 [214] では、小児の42%が気管支喘息も患っていた。このサブグループにおいて、積極的に治療された小児では、プラセボに対して喘息症状の31%の改善がみられた[214]。
ブタクサ錠の極めて重要な試験において、最終的に承認された用量で治療された気管支喘息の成人患者のサブグループ(19%)の結果が報告されたが、喘息における有効性は別に発表されなかった[216]。また、有害事象の発現率は低く、全体と差はなかった。
結論22 ブタクサ花粉症におけるAITの有効性は、成人のARCにおけるSCITでは確立されているが、喘息では弱く、小児のデータは不足している。SLIT については、ブタクサ花粉エキスを含む錠剤の有効性が、成人および ARC の小児で非常によく示されている。
推奨8:臨床的にブタクサアレルギーが証明され、気管支喘息を伴う/伴わない鼻結膜炎を持つ小児および成人には、ブタクサ花粉抽出物錠剤によるSLITを実施すべきである。あるいは、鼻炎と喘息を持つ成人では、ブタクサエキスによるSCITを検討することもできる。(コンセンサス、一致率 87%)
4.8.2. その他のアレルゲン(パリエタリア、ペットアレルゲン、カビ胞子)
ペリトリー(Parietaria sp.)は、花粉飛散期間が非常に長い地中海沿岸地域では、重要なアレルゲンとなっています。地域によっては、ほぼ通年でアレルゲンへの暴露があります [218, 219]。ペリトリーは、原産のイラクサ(Urtica)と同様にウコギ科の植物ですが、両者の間で交差反応が起こる可能性は低いようです [220]。イラクサと同様に、リブウォータープランテーン(Plantago sp.)、ヨモギ(Artemisia sp.)、ブタクサ(Ambrosia)は中央ヨーロッパの中・晩夏に重要なアレルゲン源となっています [221]。オーストリア東部およびドイツ南西部では、真性ヨモギ(Artemisisa sp.)花粉症がブタクサ花粉症よりも偶発的に多く見られます [206, 210]。
ペット・アレルゲン
多くの患者はペットに感作されており、その多くでは、ペットの飼育をあきらめることによるアレルゲン回避ではなく、AITを強く希望している。
合成 Fel d1 ペプチドを用いた SCIT の開発は、有望な初期研究 [222] の後、フェーズ III [223] で失敗し、市販されることはないだろう。また、猫アレルゲンを直接リンパ節に塗布する革新的なアプローチも、それ以上開発されていない [224]。
猫や犬のふけに対するアレルギーを持つ患者において、AITの臨床効果を実証した研究はほとんどありません [225, 226, 227, 228, 229, 230]。エビデンスが限られているため、猫のふけに対するAITは、個々のケースバイケースの決定において、重大なリスクおよび費用/便益の評価が必要である。犬については、エビデンスが不十分であり、ここではさらに批判的にAITの適応を設定する必要がある。そのため、2018年のスペインのコンセンサスステートメントでは、ペットアレルギーの管理においては、常にアレルゲン回避が優先されるべきであると結論づけられています。これが不可能なはずの場合にのみ、個々のケースでAITを検討することができる[231]。動物アレルゲン抽出物を用いたAITの場合、AITの経過中に既存の喘息を十分にコントロールすることに特に注意を払う必要がある。
犬猫アレルギーに対するAITの臨床効果に関するより最近の情報(2020年)は、シリンジドライバーを用いた皮下注入という別の投与経路を調査した実験的研究によるものです [232]。
カビの胞子
実際には、カビアレルギーの問題は、しばしば目に見える屋内のカビの蔓延に関連しています。関連する衛生的・法的な意味をここで論じることはできませんが、AWMFの室内カビ曝露の医学的臨床診断のためのガイドラインが参考になります [233]。
季節性屋外カビの胞子に対するアレルギーについては、臨床的有効性の証拠は、Alternaria alternataおよびCladosporium herbarum抽出物を用いた少数のSCIT試験に限られている [234, 235, 236]。Alternariaアレルギーの小児を対象とした3年間のDBPC試験では、治療2年目からSCITの有効性が実証された [237] 。カビ・アレルゲン抽出物の製造の難しさは、バイオリアクターで増殖したカビが、患者が吸入した胞子と異なるアレルゲンを生成することです。この問題を克服するために、111人の青年および成人におけるスペインの多施設研究が、組換えAlt a1を用いたSCITで有望な結果を示している [238]。しかし、承認された化合物が開発されるには、まだ時間がかかると思われる。
結論23:他のアレルゲン抽出物(イネ科植物、シラカバ、ダニ、ブタクサを除く)を用いたAITの効果については、SCITとSLITに関するいくつかの研究があるが、現状では治療効果を評価することは不可能である。
推奨9:他のアレルゲン抽出物(イネ科植物、樹木(Betulacea-like)、イエダニ、ブタクサを除く)によるAITは、現在の臨床記録により一般的な推奨が不可能であっても、個々の症例では検討できる(3章3節キーワード「指名患者製品」参照のこと)。AITに先立ち、同定されたアレルギー感作の臨床的妥当性、特にペットのふけアレルギーの場合、個々の有益性とリスクの比率を慎重に評価する必要がある。(強いコンセンサス、100%の同意)。
4.9. ピーナツアレルギー
19.0%のピーナッツは、欧州アナフィラキシー登録に基づく2016年の評価で示されたように、虫刺され(22.1%)に次いで、小児および青年におけるアナフィラキシーの2番目に多い理由である[239]。2020年に実施された同じ情報源に基づくより最近の評価では、2006年にこれらの反応の記録が開始されて以来、合計10,624例のアナフィラキシーが確認され、そのうち33.1%(n=3,514)は食物に対するアナフィラキシーであったと報告されている。このうち1,962例は小児および青年が関与していました。これらの1,962例のうち、23.4%(n = 459)はピーナッツによって誘発されました[240]。免疫学的研究により、ピーナッツによるAITは、アレルゲン特異的なTh2細胞およびIgE抗体の減少、ならびにアレルゲン遮断IgGおよびIgA抗体の産生をもたらすことが示されています [241, 242, 243, 244]。対照的に、制御性T細胞の誘導に関する多様な結果があり、これらはTh2細胞の不安定な分化型にのみ対応し、治療期間中の持続的な耐性誘導を複雑にしていることが示されている。
2014年のシステマティックレビューとメタアナリシスによると、ヨーロッパにおけるピーナッツアレルギーの有病率は、プロボケーションテストで確認された場合0.2%(95% CI 0.2~0.3%) 、ピーナッツアレルギー歴および/またはピーナッツプロボケーションテスト陽性が重なった場合1.6%(95% CI 1.2~1.9% )となっています [245].
ピーナッツ・アレルゲンに対する耐性の自然発生は、3年間で患者の約20%にしか認められません[246, 247, 248, 249]。アナフィラキシーという潜在的に重大な脅威のために、患者およびその家族の生活の質は著しく低下しうる [250, 251]。
近年、ピーナッツアレルギーの治療のためのAITに対する様々なアプローチが大規模な臨床試験で検討されている。原理的には、皮下、舌下、皮下、および経口アレルゲン塗布の可能性がある。
現在、最も研究が進んでいるのは、経口耐性誘導(OTI)の分野である。この治療法では、少量のピーナッツに誤って暴露した後のアナフィラキシー反応の予防として、耐性閾値を高めるために、正確に定義された量の食物アレルゲンを毎日飲み込みます。これまでのところ、この治療法は、治療中止後の疾患改善という点では、臨床的な有用性を示すことはできていません。有効性と安全性に関するいくつかの臨床研究がある[252, 253]。ある製剤は、ピーナッツアレルギーが確認された4~17歳の小児および青年の治療薬として2021年に承認された。この製剤では、耐性閾値の上昇に関する有効性が実証されました。さらに、QOLの部分的な改善も示された[253]。長期的な研究において、治療の効果は、治療を継続した最初の1年以降も追跡することができた [254]。現在までのところ、24ヶ月を超える治療期間に関するデータはない。
結論 24:ピーナッツアレルギーでは、AITの様々な適用経路が研究されており、経口耐性誘導(OTI)の臨床試験が最も多く実施されている。ある OTI 製剤は、ピーナッツアレルギーの診断が確定した小児および青年の治療薬として市場認可を取得した。
ピーナッツを用いたOTIの適応は、予想される治療のアドヒアランスと患者およびその家族の苦痛の程度を特別に考慮する必要があります。治療中の増強因子を避けるため、治療に関連するさまざまな全身性副作用のために、特別な予防措置を考慮する必要があります。エピネフリン自動注射器は、維持療法を含め、治療期間中ずっと手元に置いておく必要があります。初回投与およびその後の増量段階は、食物アレルギーおよびアナフィラキシーの治療経験が豊富な施設で実施する必要があります。現在、専門家委員会において、4-17 歳のどの特別なグループにこの治療法を優先的に使用するかが議論されている。
推奨 10:全身性ピーナッツアレルギーの小児および青年には、リスク・ベネフィットを考慮した上で、経口耐 性誘導療法を行うべきである。(強い合意、100%の同意)
4.10. アトピー性皮膚炎
SCIT
アトピー性皮膚炎(AD)およびダニ感作が証明された患者における AIT の臨床効果は、1 年間の試験で示され、週 1 回の間隔で投与された本療法により SCORAD(Scoring Atopic Dermatitis)が有意に改善した [255] 。168人の成人を対象とした重合ダニアレルゴイドを用いたDBPC第III相試験において、SCORADの有意な改善は、重度のAD患者においてのみ記録された[256]。8件の無作為化対照試験(うち6件はSCITを、2件はSLITを使用)を含む、ADにおけるAITの有効性に関する2013年のメタアナリシスでは、全体的にプラスの効果が認められた[257]。一方、合計733人の患者を対象とした12の研究を含む2016年のコクラン系統的レビュー[105]では、ADにおける吸入性アレルゲンによるAITの一貫した効果が示されなかった。
SLIT
ADに対するSLITの有効性は、いくつかの研究で検討されているが[258, 259, 260, 261]、後者の研究はプラセボ対照試験ではなかった。合計239人の患者を含むDBPC 4群研究では、SCORADが主要評価項目とされた。他の研究で報告されたように、プラセボ群でも顕著な湿疹の改善がみられた。しかし、高用量で投与した場合、6週間後のFAS解析では、プラセボと比較して統計的に有意な効果が認められました[258]。ハウスダストマイトアレルギーおよびADを有する5歳~18歳の小児および青年を対象とした無作為並行群間試験(第IIIb相試験)において、滴下製剤を用いたSLITによる72週間の治療後に、SCORADが有意に減少したことが報告された[260]。
結論25:AIT製剤は、ADの治療に対して市場認可を取得していない。しかし、ADは、特に指示された場合、AITの禁忌とはならない。ほとんどの研究において、ダニ抽出物を用いたSCITおよびSLITは、ダニアレルギーに関連するAD患者において良好な効果を示している。
推奨 11:呼吸器系アレルギーに AIT が適応される場合、AD を併発した場合にも適用されるべきである。(コンセンサス、合意率92%)。
第5章 AITの適応と禁忌
5.1. 背景
AITの成功には、禁忌の可能性を考慮した適応が不可欠である。無症候性アレルギー感作は AIT の適応とはならない。
ARCが存在する場合、アレルギー性喘息発症の二次予防に関するデータは限られており、現状では明確な推奨はできない。しかし、現実のデータでは、AITが既存の気管支喘息の悪化 [149] または喘息症状の発現に関して、疾患修飾または予防効果を有することが確認されている [40, 41] 。
様々な変数が治療の順守とAITの全体的な成功に影響を与えるため、治療計画時、特に投与経路の選択時に考慮する必要がある。患者には、AITの実施について詳細かつ慎重に情報を提供することが不可欠である。AIT開始時の第一目標は、少なくとも3年間の治療期間である。
5.2. AITの適応
IgE感作の証拠を伴うアレルゲン関連症状に加えて、AIT(表6)の適応となる前提条件は、アレルゲン回避が十分でないことと、適切な標準化アレルゲン抽出物または高品質アレルゲン抽出物の利用が可能であることである。個々のケースでは、5歳未満の患者に治療開始の適応となる場合がある。これは、特に昆虫毒アレルギーの場合、適応があり実行可能であれば適用される。
表6.
表6.
適応症 AIT を使用するための前提条件。
結論 26:AITを開始する適応には、様々な前提条件が不可欠である。また、一定の条件のもとでは、AITは症状の軽い患者に対しても疾患修飾を治療目標とした使用が可能である。
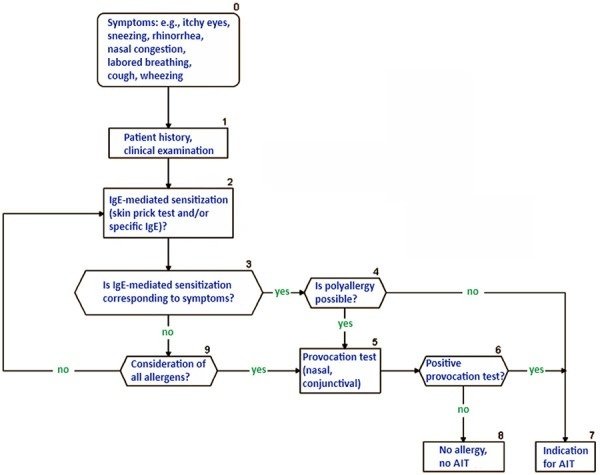
図3は、季節性および通年性アレルゲンを用いたAITの適切な診断と適応のための臨床アルゴリズムを示す。重症度の評価には、単一症状あるいは複数症状が関係する場合がある。個々の疾患負担は、AITの適応に決定的な影響を与える[262]。さらに、あるAITの適用経路に対する患者の個々の適合性を検討するための基準を考慮する必要がある(表7)[33]。
図3.
図3.
喘息を伴う/伴わない中等症から重症の鼻炎/鼻結膜炎の診断とAITの適応(臨床アルゴリズム)。臨床症状との間に明確な相関がない場合(例えば、共時性アレルゲンに対する多感作の場合)、...
表7.
表7.
各 AIT 適用経路に対する患者の個別適合性を検討するための基準、[33]より改変。
推奨12:AIT開始の適応を確定する際には、一定の前提条件を確認し、臨床アルゴリズムを用いるべきである。また、個々の患者の AIT 適性を検討する基準も考慮すべきであり、詳細な情報提供や教育手 段を通じて、患者中心のケアのために患者が意思決定に関与することが必要である。(強いコンセンサス、100%の同意)
また、AITの適応を設定する際には、患者中心のケアの観点から、患者に包括的な情報を提供し、適用経路やAIT製品の選択に関する重要なポイントを議論することが中心的な重要事項である(表8)。
表8.
表8.
AIT の適応の確立、塗布経路および AIT 製剤の選択において、患者・家族と話し合うべき重要なポイント。
結論27:治療法の決定には,塗布経路や組織上の注意点について,患者・家族との明確なコミュニケーションが必要である。
5.3. AIT における成分ベースの IgE 診断法
成分ベースのIgE診断(または成分分解診断(CRD))は、花粉に対する多感受性、特に汎アレルゲンに対する感作がある場合に有用であり、AITの成功確率の評価にも使用できる [263, 264](表9)。主要なアレルゲン成分への感作がない患者は、花粉症におけるAITの治療成功率が低い可能性がある[265]。汎アレルゲンへの感作のみでは、AITの適応とはならない。
表9.
表9.
吸入アレルゲンによるAITの適応を確立する際に有用なアレルゲン成分(主要アレルゲンa対汎アレルゲンb)。
結論28:成分分解診断は、特にポリ感作の場合、AITの成功確率を推定するのに有用である。
5.4. 感作性と臨床的関連性
ハウスダスト・ダニや動物に対する通年感作の場合、感作の臨床的関連性が疑われる場合には、その判断が必要である。アスペルギルスまたはペニシリウムアレルギーにおける AIT のデータは不十分であり、そのため、本治療を推奨できない。
ハウスダストマイトアレルギーが証明された場合、ダニ回避策(ダニアレルゲン対策マットレスカバー(包帯)、洗濯可能なベッドカバー、ハウスダストマイトアレルゲンを減らすためのその他の手段)が十分に有効でない場合、AITを適応・適用する必要があります。
2008年に発表されたメタアナリシスでは、ダニ回避策のみの効果に疑問が呈されています[266]。ダニが有意に減少したことを証明できたのは、対象となった54件の研究のうち17件のみであった。全体として、介入手段は不均質であり、小児におけるサブグループ解析は提示されていない。このメタアナリシスの方法論的欠陥のため、著者らの結論は理解できない。したがって、提示された介入策は、主に臨床的に関連するハウスダストマイトアレルギーを有する患者に示される [267, 268]。
アレルギー予防に関するドイツのS3ガイドラインでも、三次予防のためのダニ回避策の価値が強調されている [269] 。また、防ダニカバーと非防ダニカバーに関する最近の質の高いプラセボ対照研究では、防ダニカバーがダニアレルギー喘息児の喘息増悪のための救急室受診回数を有意に減少させることが示唆されています[270]。小児にイエダニ抽出物を用いたAITを開始する前に、鼻腔内挑発を行うことが望ましいが、絶対に必要というわけでもない。オーストリアの専門学会は、成人患者であってもハウスダスト・ダニAITの適応となる前に、いかなる臓器誘発も規定しない。
動物アレルギーやカビアレルギーの場合、AITは特定のケースにのみ適応される(例外:アルテルナリア・アレルギー、下記参照)。
動物アレルギーの場合、アレルゲン回避が対策として選択される。これが確保できない場合、動物アレルゲン抽出物を用いたSCITが特定の症例(例:職業的暴露)において選択肢となる(図3)。猫アレルギーに対するAITの経験は最も豊富である。
通年性のカビについては、ほとんどエビデンスがなく、完全な回避はしばしば困難であるが、季節性のカビアレルギーおよび十分に特性化された治療アレルゲン(Alternaria、Cladosporium)の場合、やや優れたエビデンスと安全性プロファイルにより、カビアレルゲンによるSCITが検討できる [234, 235, 237]。カビの主要アレルゲンであるAlternaria alternata(Alt a 1)は、Bet v 1に類似した主要アレルゲンである。特に、オーストリア東部では、アルテルナリアは、5月から10月までの長い胞子シーズンで重要なアレルゲンとなっています。
5.5. 非相同アレルゲン群の混合物
AITの効果は、適切な患者の選択だけでなく、臨床的に関連する各アレルゲンの最適な治療量とAITの期間(累積投与量)にも依存する。AITの有効性と免疫学的効果に関する知見は、主に単一のアレルゲン抽出物による単剤療法が実施された研究に基づいている。したがって、臨床試験のデータから支持されない場合は、異なる(非相同)アレルゲン群をアレルゲン製剤中に混合してはならない。例えば、DBPC SCIT試験において、樹木と草花のアレルゲンを化学的に改良した混合物は、治療2年目の樹木と草花の季節を通じて、有意な(中程度ではあるが)臨床効果を示した [271] 。
季節性アレルゲンと多年性アレルゲンは、一般的に1つの抽出物に混合されない。これは、ダニと動物アレルゲン、ダニとカビアレルゲンの組み合わせや、花粉とカビアレルゲンの抽出物にも適用され、酵素分解過程のために決して混合してはならない [272] 。
推奨13:季節性アレルゲンと通年性アレルゲンは、1つのエキスで決して混合してはならない。さらに、ダニと動物アレルゲン、ダニとカビアレルゲン、花粉とカビアレルゲンの組み合わせは、酵素分解プロセスの関係上、決して混合してはならない。(強いコンセンサス、100%の一致)
5.6. AIT の禁忌
SCITとSLITを決定する際には、多くの禁忌を考慮しなければならない [33, 273](表10)。
表10.
表10.
AITの禁忌
コントロールされていない喘息は、AITの全身的な副作用の危険因子である。したがって、コントロールされていない喘息または重症の喘息患者、あるいは肺機能が著しく低下している(FEV1≦70%予測値)成人喘息患者には、AIT(SCITおよびSLITの両方)を使用しないことが推奨されています[141]。コントロールされていない気管支喘息は、小児および青年におけるAITの開始の禁忌でもある [92, 275]。まず、原因療法を開始できるようにするために、特に治療の強化によって喘息の症状コントロールの改善を目指す必要がある。AIT下で喘息が増悪した場合、喘息治療を一貫して増やし、コントロールが回復するまでAITを一時停止すべきである [276] 。
妊娠はAIT開始の禁忌とされているが、昆虫毒(ハチ、スズメバチ)に対する生命にかかわるアレルギーで忍容性が良好な場合にはSCITの継続が望ましく、忍容性が良好であれば(SmPCおよび添付文書の勧告に従って)航空アレルゲンによるAITの継続は可能である [277, 278]。非常にまれなケースに限り、SCITを妊娠中に開始することができる(例:生命を脅かす昆虫毒アレルギーの場合)[93]。
β遮断薬による投薬(眼科薬など局所的に適用される場合も)は、SmPCの特性においてSCITの禁忌として記載されることがあるが、現在は昆虫毒アレルギーの場合にのみ相対的禁忌とみなされる [276]。大規模な国際多施設共同試験で、β遮断薬またはACE阻害剤による治療のいずれでも副作用のリスクは増加しないことが示された[279]。レニン-アンジオテンシン代謝を阻害するAT-II遮断薬についても、同じことが推定される。AITの適応を決定する際には、患者と一緒にリスクとベネフィットの詳細な分析を行い、慎重に説明する必要がある。また、これらの物質による必要な治療を継続するかどうかは、処方医と一緒に個別に判断する必要があります。具体的なデータがなくても、免疫抑制剤との併用は、AITの効果を弱めることが示唆されている(表10)[280]。
SCITの明確かつ厳密に定義された適応症(病歴における昆虫毒に対する重度のアナフィラキシー反応)において、心臓病を有し、β-ブロッカーの服用が明確に指示されている患者25人のスイスのケースシリーズでは、SCITによる重度の副作用の増大はないと報告されている[281]。
AITの舌下投与では、適応と禁忌(表6、表10)も考慮する必要がある[33、92、98]。全身的な副作用は、SCITよりもSLITの方が少ない [33、99]。口腔粘膜の慢性疾患または非常に頻繁に再発する疾患(例:慢性再発性アフタ)を有する患者は、SLITに適さない。現代の効果的な高用量SLIT療法、特に錠剤では、それ自体まれな好酸球性食道炎の発生または再活性化の増加が観察されている [282, 283, 284, 285, 286, 287]。したがって、これらの胃腸障害の既往がある場合は、SLITの禁忌と考えるべきであろう。その他、SLITの禁忌はSCITの禁忌と同様であり(表10)、使用する製品のSmPCおよび添付文書に留意する必要がある。特に低年齢の小児では、SLITを開始する前に、正しい舌下投与と粘膜との適切な接触時間が実現可能かどうかを確認することが重要である。
重度の精神障害の場合、適応と投与経路を慎重に検討する必要がある。
AITの一般的な安全性には、構造的要件と医療知識、技能、能力が大きく影響する [288]。このことから、危険因子を持つ患者の治療は、AITの使用について十分な経験を持つ施設でのみ行うべきであると言える。
結論 29:AITには様々な禁忌があるが、適用経路による違いはごくわずかである。
推奨 14:様々な禁忌がAITの使用に対して語られており、考慮されるべきである。これらを評価する際には、それぞれの製品特性の概要と添付文書を考慮する必要がある。たとえ禁忌があっても、リスクとベネフィットの比率を考慮した上で、正当な理由があれば、AITは可能である。(強いコンセンサス、100%の同意)
5.7. 禁忌事項があってもAITを行う
一部の症例では、相対的禁忌がある場合にも AIT を開始することができる。よくコントロールされている橋本病自己免疫甲状腺炎は、薬物療法で容易に補うことができる自己免疫疾患の典型例であり、この種の疾患は必ずしもAITの禁忌ではありません。多発性硬化症、重症筋無力症、エリテマトーデス、関節リウマチ、クローン病などの他の自己免疫疾患では、疾患活動性や経過を考慮し、個別に検討した上でAITを開始することが可能です。AITが自己免疫疾患を誘発するという証拠は、症例の記述に基づいている(22例を含む15件の論文、うち12例は血管炎) [289] 。ネフローゼ症候群におけるAITの評価に関する証拠も同様に不十分である。
デンマークの登録ベースの観察研究では、10年間の観察期間(1997~2006年)において、SCITは死亡率の低下(ハザード比(HR)0.71;95%CI 0.62~0.81 )と同様に心筋梗塞(HR 0.70;95% CI 0.52~0.93 )および自己免疫疾患(HR 0.86;95% CI 0 .74~0.99 )に関連していたことが示されている [290] 。
したがって、SCITによる自己免疫疾患の発症リスクはおそらく非常に低いが、特に複数年にわたる治療であるため、考慮する必要がある。その疑いがある場合は、関連性が明らかになるまでAITを中止すべきである。
表10に示した免疫不全の禁忌のうち特殊なケースとして、HIVの複製が陰性でCD4数が正常であり、抗レトロウイルス薬の併用療法(cART)によりコントロールされている慢性安定HIV(ヒト免疫不全ウイルス)感染における後天性免疫不全症が挙げられる。これまでに、症例報告や3例の小規模ケースシリーズが文献で報告されている[291, 292]。
cART下でのAITは安全で、悪化させず、効果的であると思われる[293]。明確な適応があれば、cARTを受けていて病状が安定しているHIV陽性患者でAITを開始することができる。
高齢はAITの禁忌ではなく、腫瘍疾患の発生率は年齢とともに増加するため、腫瘍疾患の既往を持つARC/喘息患者の人口は増加している。現在安定している比較的最近の腫瘍疾患は、必ずしも禁忌とはならない。メラノーマと昆虫毒アレルギーの患者4名とARCと乳癌の患者1名のケースシリーズでAITを完了させることができた。これらの患者のほとんどで、5年以上経過しても腫瘍の再活性化は観察されなかった [294]。
結論30:適応を確定する際には、臨床効果に影響を与える可能性のある因子を考慮しなければならない。適応があり、合併症を考慮した場合、65歳以上の患者や自己免疫疾患を持つ患者でもAITは可能である。SCITとSLITの違いは、主に禁忌について考慮することである。禁忌症例があっても、個々の症例ではAITの適応がある場合もある。
推奨15:様々な変数がAITの成功に影響するので、治療計画時に考慮する必要がある。(強いコンセンサス、100%の同意)
第6章. AITの投与
6.1. 併用する薬物療法
成人におけるAITの適応は、中等度から重度の断続的・持続的アレルギー性鼻炎・鼻結膜炎および/または少なくとも部分的にコントロールされたアレルギー性喘息で、アレルゲン回避や薬物療法では症状を十分にコントロールできない場合である。小児では、軽度の症状であってもAITの予防/疾患修飾効果が期待できるため、AITの適応となることがある。ARC、喘息ともに薬物療法が基本であり、AITはそれに加えて使用される。薬物療法は、それぞれARC[295]または喘息[141、142]の適応のガイドラインに従って行われ、ARCでは全身性抗ヒスタミン薬および/または局所ステロイド薬(局所抗ヒスタミン薬との併用もある)の使用が基本である。喘息では吸入コルチコステロイド単独または長時間作用型β-2-アゴニスト(LABA)、ロイコトリエン受容体拮抗薬(LTRA)、長時間作用型ムスカリン受容体拮抗薬(LAMA)との併用療法が行われます。この薬物療法とAITの同時使用は、AITの効果には影響しないが、使用する有効成分の抗アレルギー作用や抗炎症作用により、AITの副作用に有益な効果を与えたり緩和させたりすることができる。デポコルチコステロイドの筋肉内注射は、残念ながらまだ使用されているが、重大な局所的・全身的副作用をもたらすため、警告しなければならず、ガイドラインに基づく薬物療法には含まれない [296] 。副作用は一般的で、時に重篤である。例えば、脂肪萎縮、筋萎縮、膿瘍、および大腿骨頭壊死が起こりうる。長期的には、糖尿病、骨粗鬆症、白内障のリスクがある [297, 298, 299, 300]。患者は、これらの注射をAITと関連付けたり、混同したりしてはならない。このような治療形態を検討し、安全性と有効性を証明した研究はない。
結論31:ARCも喘息も薬物療法が治療の基本であり、AITはそれに加えて適用されるものである。
推奨16:ARCやアレルギー性喘息のガイドラインに基づく薬物療法に加えて、AITを適用すべきである。デポコステロイドの筋肉注射は、ガイドラインに基づく薬物療法に含まれないので、実施すべきではない。(強いコンセンサス、100%の同意)
6.2. AITの処方と投与
1996年1月1日以降、ドイツで使用される治療用アレルゲンのSmPCとパッケージリーフレットには、以下の警告を記載することが義務付けられている。「注射用減感作ワクチンは、アレルギーの訓練を受けた医師または経験豊かな医師によってのみ処方・投与される」(PEI, 1995年4月5日付通信)。
オーストリアでは、治療用アレルゲンの処方とAITの適用は、アレルギーに精通した専門医が行うことができます。AITの維持療法は、一般開業医に委任することができる。さらに、オーストリアでは、医療業務は、委任した医師に従属し、指示によって拘束される医療従事者に委任することができます。しかし、その責任は委任した医師にあります。
オーストリア医療法§49(3) 「(3) 個々の場合、医師は医療行為を他の医療専門家または医療専門家の訓練生に委任することができるが、それぞれの行為が後者の専門的能力の範囲内であることが条件である(連邦法Nr I 2001/110)。医師は、この指示に対して責任を負う。[...]" [301].
結論32:ドイツ、オーストリア、スイスでは、AITを適用する医師には異なる法的規定が適用される。
推奨17:AITは、アレルギー学の副専門医("Zusatz-weiterbildung Allergologie"、ドイツ)、アレルギー学の専門医("Spezialisierung in Allergologie"、オーストリア)、アレルギー専門医(Facharzt für Allergologie、スイス)、またはこの治療について十分な経験を有し薬物の副作用(アナフィラキシーショック、重度の喘息発作など)に緊急対応可能な医師に行われるべきものである。AIT を開始する前に、文書化を含む患者情報の提供を行うべきである。(強いコンセンサス、100%の同意)
スイスでは、事前にアレルギー検査が行われれば、プライマリーケア提供者でもAITを実施することができる。
適応が確立された後、他の医師がAITを実施または継続する場合、AITの一貫した低リスクの投与を確保するために、緊密な協力が必要である。これは、特に薬物有害反応(ADR)の発生に適用される。必要であれば、患者は最初にAITを指示した医師のもとに戻されるべきである。
勧告18:遅くとも1、2年後にAITの顕著な効果が認められない場合は、上記の基準(勧告17)を 満たす医師によって批判的に再検討されるべきである。(強いコンセンサス、100%の同意)
必要であれば、製剤や適用経路の変更、季節前投与から通年投与への変更、あるいは治療の中止を検討することができる。一般に、SCITおよびSLITの投与は、臨床試験で安全性と有効性が十分に証明された製剤にのみ推奨されます(第4章参照)。希少なアレルゲンの場合、患者数が少ないため、臨床試験の実施可能性と限界を考慮する必要がある。ドイツのTAOはこのためのガイドとなりうる。
6.3. 患者への情報提供
AIT を開始する前に、患者は治療の実施、種類、期間、期待される効果、考えられるリスク、お よび考えられる代替案について知らされていなければならない。ドイツアレルギー専門医協会(Ärzteverband Deutscher Allergologen:AeDA)は、これに関する包括的な声明を発表している([302]、ダウンロードはこちら:www.aeda.de)。このリスク情報は、自己決定情報とも呼ばれ、医療措置への同意の前に行われなければならない。ドイツ民法第630e条第1項第1文及び第2文の規定によれば、「...治療当事者は、同意に関連するあらゆる状況を患者に通知する義務がある。これには特に、措置の性質、範囲、実施、予想される結果、リスク、また診断や治療に関する必要性、緊急性、適合性、成功の見込みが含まれる" とされています。
治療が複数の異なる本質的なリスクを含んでいる場合、患者はこれらのリスクすべてについて情報を得なければならない。この情報は、常に口頭で提供されなければならないことに留意することが重要であり、テキスト文書は補足としてのみ使用することができる。第630e条第2項第1号、第2節。「さらに、患者がテキスト形式で受け取る文書も参照することができる...」。しかし、口頭による情報は常に決定的なものである。患者は補足的な文章を受け取らなければならない(第630e条第2項)。「患者は、情報または同意に関連して署名した文書の複製を提供されなければならない」。第630h条(第2項第1文)によれば、医師は、患者が十分な情報を与えられ、治療に同意したことを証明する義務を負うとされています。"治療者は、630d項に従って同意を取得し、630e項の要件に従って情報を提供したことを証明しなければならない。"
この文章の手渡しを患者ファイルに記録することが推奨される。AeDAでは、この情報を英語のテキスト形式で提供している(「治療情報シートSCIT」(図4)、「治療情報シートSLIT」(図5)、ダウンロード元:www.aeda.de)。患者情報は、理解しやすい方法で提供されなければならず(Secton 630e, paragraph 2, number 2)、「...患者がよく考えて同意に関する決定を行うことができるように、十分な時間内に提供されなければならない」とされています。
図4.
図4.
皮下特異的免疫療法(減感作療法)の患者向け情報。
図5.
図5.
舌下特異的免疫療法に関する患者情報。
結論33:AITの実施には、詳細で十分な文書化された患者情報が必須である。この点では、「治療情報シートSCIT」と「治療情報シートSLIT」の文書が参考になる。
患者情報の提供は、上記の基準を満たす医師にのみ委任することができ(勧告17)、非医療関係者(専門家)には委任しない。治療法の選択肢について患者に情報を提供する目的は、患者がいくつかの治療法の選択肢の中から選択できるようにすることであるべきです。しかし、これは治療担当医がすべての治療選択肢を提示しなければならないことを意味しない。口頭で伝えた情報を適切に文書化することは必須であり、患者または両親・法的保護者の書面による同意が推奨される。
6.4. コンプライアンスとアドヒアランス
コンプライアンス」とは、患者が受動的に医師の指示に従うことであり、治療の成否は主に患者に責任があることを意味する。一方、より現代的な「アドヒアランス」という概念は、患者と医師が共に治療法を決定したこと、つまり、治療の目標を設定し、その達成方法を決定したことを意味します [303、304、305、306]。
AITの場合、成功するかどうかは適切な治療期間に依存するため、医学的な推奨を実行することが特に重要である。他の治療法と同様に、AITの作用機序に関する包括的な情報を患者に提供することで、患者の治療継続性も向上する [33, 307, 308, 309, 310]。
SCITは医師が適用するため、治療アドヒアランスのモニタリングは一般にSLITの場合よりも容易である。その結果、SLITと比較してSCITの治療アドヒアランスがどの程度良好であるかは、アドヒアランスが「現実の」条件下で調査されたか、臨床試験の文脈で調査されたかによって大きく異なるため、現在のところ議論の余地があります。後者では、当然ながら、服薬アドヒアランスは良好です [305]。
アドヒアランスに関しては、SCITとSLITに関する臨床試験のデータがまとめられており [311]、SCITでは約70%、SLITでは約75%の治療アドヒアランスが報告されている。しかし、これらの結果は、異なる治療レジメンと適応症および患者群を使用した米国と欧州の研究が組み合わされたため、限定的である。ある無作為化研究では、喘息を併発するかしないアレルギー性鼻炎患者271人(15~65歳)に、3年間にわたってSLITが投与された [139] 。全期間にわたって治療を受けた患者のほぼ72%において、著者は80%以上のアドヒアランス率を見出し、18%の患者では、アドヒアランス率が60~80%であった [139]。別のレビュー[312]では、SCITとSLITのアドヒアランス率に差はなく、最近の研究で見出された率は、適用ルートにかかわらず、75~90%であることが判明しました。しかし、これらのデータも臨床試験から得られたものであり、日常診療における治療アドヒアランス [125] を非常に不正確に反映している。
治療のアドヒアランスの欠如は、治療の成功を脅かす。これは、実際の法定健康保険SCIT処方データの分析 [313] の結論であり、長年にわたって継続率が低下していることが示されています。一般的なSCIT製品で治療された患者のうち、3年目にSCITが実施されたのはわずか24%であった。ドイツとイタリアのデータは、それぞれ「ポスター」と「レター」として発表され、SLITの3年間の否定的な結果(13.2 - 22.7%)を示している [311, 314]。実際の法定健康保険処方データのさらなる分析により、市場をリードするSCITおよびSLIT製品で治療された1,409人の患者の持続性が決定された[315]。この分析では、治療3年目の患者の34~51%が満足のいかない持続性であることが確認された。4歳から18歳までの562人の子供と青年の法定健康保険処方データの分析では、AITの3年目の継続率は44.1%であった[316]。RWE条件下での最近の研究では、SCITとSLIT製品のアドヒアランスに有意な、また年齢依存の差があることが示されている。例えば、処方箋データに基づくレトロスペクティブな研究では、3年間の皮下投与後のハウスダストマイト・アレルギーのアドヒアランスは38.6%でした。アドヒアランス率は、青年の41.3%と成人の35.5%に対して、研究対象の小児の47.9%と著しく高いことが示されました[178]。
SLITとSCIT製剤(草花と樹木の花粉)の治療アドヒアランスについて、同じく処方箋データに基づくレトロスペクティブRWE研究では、2つの適用形態間で有意差をもって同様にはるかに低いアドヒアランス率を示した。3年後の草花と樹木の花粉症に対するSCITアドヒアランスがそれぞれ37.5%と35.0%だったのに対し、調査対象となった2つのドロップとタブレットの調合に対するSLITアドヒアランスは草花で9.6~13.4%、樹木花粉で10.3~18.2%と幅があることが判明した。ここでも、治療された小児のアドヒアランスは、皮下投与された樹木花粉と草花アレルロイドの成人よりも有意に良好であった [39] 。ハウスダストマイト・アレルロイドを用いたSCITを受けた5,677人の患者とハウスダストマイト錠を用いたSLITを受けた4,720人の患者の処方データに基づくドイツのレトロスペクティブ・コホート分析では、3年後のSCITの治療アドヒアランスは55.0%、一方SLITは30.3%だった [317].2つの治療形態間の有意差は、別の研究でも実証されており、3年間の治療継続率は、花粉SCITが42%、ハウスダストマイトSCITが45%であるのに対し、花粉SLITは16%でした [318]。
別の研究では、SCITとSLITの患者に、特に、治療終了後の治療の有害面について質問した [304]。その結果は、満足のいく治療アドヒアランスが得られない理由についての洞察を与えてくれるかもしれない。患者の69.5%が治療に時間がかかることを訴え、62.5%が副作用について訴えた。60.7%の患者が症状の緩和を感じず、53.7%が治療に関する十分な情報を受け取っていなかった。したがって、不十分な患者情報、不十分な治療の実施と診療管理は、治療を早期に中止する重要な理由となる。このことから、治療継続性を高めるための合理的な推奨事項を導き出すことができる(表11)。
表11.
表11.
AITの治療アドヒアランスを高めるための方策([33, 305, 307, 308, 309, 319]より改変)。
AITにおけるアドヒアランスの向上は、この原因療法である治療法の有効性を確保するための今後の最も重要な課題の一つです。医師のパフォーマンスに対する追加的なインセンティブとサポート(バイエルン州の選択的契約など)が望まれる。
結論34:投与方法にかかわらず、AIT患者の治療遵守率は、治療の成功にとって決定的に重要であるにもかかわらず、医師が想定しているよりも低い。AITの服薬アドヒアランスを向上させることは、治療の最適な効果を確保するための最も重要な課題の一つである。患者固有の要件を考慮し、患者への包括的な指導を行い、診療所・クリニックの管理を最適化することが、高いアドヒアランスを得るための決定的な要素である。
6.5. 皮下免疫療法
表12は、SCITを実施する際に推奨される手順の概要である。
表12.皮下免疫療法
表12.
SCIT実施時の推奨手順と注意事項
注射の前に、患者は関連する現在の症状(例えば、アレルギー症状や感染の兆候)、前回の注射の忍容性、過去の病気、新規または変更された薬の摂取、ワクチン接種について尋ねられ、前回の注射からの間隔が確認されます[321]。治療用アレルゲン製剤は、~4 ℃の冷蔵庫で保管すること。患者立会いのもと、製剤名と患者名を音読するなどして、混乱を防ぐことができる。
注射は、医師が皮膚部位を消毒した後、注射針(14~18ゲージ、短刃、十分な長さの針)と0.1mLまでの細かい目盛りのついた1mLシリンジを使用して行うこと。注射は、上腕伸側部の肘頭から手のひら幅上で、事前に吸引(注射量に応じて数回)した後、リフトした皮膚のひだに厳密に皮下注射し、注射部位と投与量を明記して文書化します。注射針の選択にあたっては、ドイツでは、病院や医療分野における鋭利な/先の尖った器具による怪我を避けるための国家ガイドラインである生物物質条例(Biostoffverordnung)BGR 250/TBR 250(医療・福祉における生物薬剤に関する専門団体規則/技術規則)に従い、必要に応じて怪我防止用の注射システム(リトラクトシステム、針シールドなど)が付いた注射針を選択しなければならない[322]。
注射後、患者は少なくとも30分間は医師の監視下におかなければならない [33]。
患者は、この間およびその後、アレルギー反応を示す症状があれば、直ちにスタッフに知らせる必要があります。待機時間後、注射部位を確認する必要があります。局所反応が増加した場合、使用したSCIT療法アレルゲンエキスのSmPCおよびパッケージリーフレットに記載されているそれぞれの指示に従って、次の注射の投与量を調整する必要があるため、直径を記録しておく必要があります。
結論35:SCITがガイドラインに従って実施されることを保証するために、様々な予防策や手順が有用である。これらは各SCIT製剤の製品特性概要やパッケージリーフレットにも記載されている。
推奨19:SCIT製剤の製品特性概要とパッケージリーフレットに従わなければならない。SCITを使用する場合、アレルギー反応の増強因子(例えば、肉体労働、サウナ訪問、アルコール摂取)は、注射の直前と注射後の残りの日は避けるべきです。SCIT注射と予定されている予防接種の間隔は、少なくとも1週間は必要です。したがって、SCITの維持期にはワクチン接種を行うことが推奨されます。即時のワクチン接種(例:怪我をした後の破傷風)は、いつでも検討可能です。その後、SCITは製品特性の概要とパッケージリーフレットに従って継続される。(強いコンセンサス、100%の同意)
推奨20:一般に、SCITとSLITの両方の投与は、臨床試験で安全性と有効性の十分な証拠が得られている製剤にのみ推奨されます。ただし、希少なアレルゲン(ドイツ治療アレルゲン条例に含まれないもの)で、患者数の不足により十分な規模の試験を実施できない場合は例外とする。(強いコンセンサス、100%の同意)
多くのAIT製剤/治療用アレルゲンでは、治療は徐々に投与量を増やす初期治療(初期、用量漸増期)と、その後の継続治療(維持期)からなる。すべての投与計画は、メーカーおよび製剤に関連した推奨事項であり、個別に調整する必要がある。投与量増加のための様々な初期投与方式があり、一般的にはコンベンショナルアップドーズ、クラスターアップドーズ、ラッシュアップドーズに分類される。
季節性アレルゲンに対しては、一般に、アレルギーシーズン外に最大用量まで治療を増量し、さらに少なくとも3年間継続することが推奨されています [1, 33] 。特定の治療アレルゲンについては、季節内治療開始も可能である(SmPCおよびパッケージ・リーフレットによる)[323]。治療間隔は、水溶液療法アレルゲンでは3~7日、セミデポ剤療法アレルゲンでは1~2週間で、用量漸増期(SmPCおよび添付文書によれば、しばしば前回の2倍の用量)である。航空アレルゲンの場合、SCITにはセミ・デポ剤アレルゲンが主に使用される。クラスターまたはラッシュ用量漸増レジメンでは、治療日に複数回の注射が行われる [324, 325] 。
SmPCおよび添付文書で認められている場合、注射時にアレルギー症状がない場合、および注意深い臨床記録が作成されている場合、用量を減らすことなく季節ごとにSCITを行う(症状のある季節に継続)ことは可能である。新しいロットの開始時に生物学的活性が異なる可能性があるため(製剤及びメーカー固有のSmPC及びパッケージリーフレット)、治療を継続する場合にも計画量の減量が必要となる場合があります。
注射間隔を超えた場合は、SmPC及び添付文書に従って減量し、間隔が長くなればなるほど減量する。呼吸器系アレルギーの場合、SCITは少なくとも3年間は継続する必要があります。
同じセッションで2つの異なるアレルゲン抽出物を用いた並行AITの対照研究はわずかであるが [326] 、安全上の理由から、注射または舌下投与の間に(15~)30分の間隔を空けることが日常臨床で有用であることが証明されている。ただし、SmPC及びパッケージリーフレットを参照する必要がある。最後の注射の後、通常の医療観察時間である30分を守らなければならない。したがって、複数の製剤を用いれば、1日に数回の完全な治療セッション(注射、30分の経過観察)が可能である。また、それらを別の日に投与することも可能です。
AITは一般的に外来で使用される。急な更新を行う場合(下記参照)、またはリスクのある患者(より顕著な全身反応、相対的禁忌)には、入院してSCITを開始することを検討する必要があります。また、アレルギー性喘息患者においては、定期的に肺機能検査を実施し、必要に応じて注射の前後に肺機能検査を行うことが推奨されます。
ハチ毒AITの適応症、禁忌、治療モニタリングの選択肢、治療期間に関する情報については、AWMFのハチ・スズメバチ毒アレルギーの診断と治療に関するガイドライン [327] を参照すること。
6.6. 舌下免疫療法
SLITは、メーカーのSmPCおよび添付文書に従って外来で実施される。
製剤やメーカーの指示にもよるが、初回投与は、アレルギー学的に経験のある医師の監督とフォローアップのもとで行う必要がある。各製剤およびメーカー固有の情報(SmPCおよびパッケージ・リーフレット)によると、いくつかの治療アレルゲンによるSLITは、花粉の季節に開始することができます(「季節内開始」)。
呼吸器のウイルス感染の場合、医師の推奨に従って使用を継続するか、中断しなければなりません(SmPCおよびパッケージ・リーフレットを参照)。口腔/咽頭の粘膜の急性炎症または損傷、口腔/歯科の大手術、急性胃腸炎、またはコントロールされていない喘息の場合、アレルゲン抽出物を摂取するべきではありません(SmPCおよびパッケージ・リーフレットを参照)。ダニ用SLIT製剤については、コントロールされていないが重症ではない喘息の患者において、AITの安全性が証明されている[92、146]。
結論36:SLITがガイドラインに従って実施されるようにするためには、様々な予防策や手順が有用である。これらは、SLIT製剤の製品特性概要やパッケージリーフレットに記載されている推奨事項に基づくものである。
SmPCとパッケージ・リーフレットが許容する場合、アレルギー症状がないか軽い場合、そして臨床記録が慎重に行われる場合、減量せずに同時期のSLIT(症状のある季節に継続)を行うことは可能です。SLITの投与期間は、少なくとも3年であるべきである。他の診療所で治療を継続する場合は、特に安全性と有効性に関して、最初に適応を定めた医師と緊密に協力する必要がある。
推奨21:SLITは、メーカーの製品特性概要とパッケージリーフレットに従って実施されるべきである。もし、適応症が確定した後に、他の医師がAITを適用したり、継続したりする場合は、一貫した低リスクの治療を保証するために、緊密な協力が必要である。(強いコンセンサス、100%の合意)
第7章 安全性、危険因子、有害事象
7.1. SCIT
SCIT製剤によるAITは、それが正しく適用され、適応症に基づいた患者選択がなされ、この治療に経験のある診療所/クリニックで行われるならば、安全で忍容性の高いものである [328, 329, 330]。注射部位の局所反応(発赤,腫脹,痒み)は非常によくみられるが,局所的な治療(例えば,冷却や局所グルココルチコイド)または全身性の抗ヒスタミン薬で簡単に治療できる。
注射部位に局所反応(赤みおよび/または腫れ直径10cm以上)が増加した場合、次の注射の投与量については、それぞれのSCIT製剤の特定の製造者の情報およびパッケージリーフレットを考慮しなければなりません。しかし、米国のワーキンググループは、彼ら自身の患者データのレトロスペクティブな分析において、局所反応の増加は、全身反応の発生に対する個人のリスクの増加を意味しないことを示すことができました[331]。
Al(OH)を含有する SCIT 製品の場合、特に皮下ではなく皮内投与という不正確な手技を用いた場合に、まれに持続性の結節や肉芽腫が生じることがあり、これは Al(OH)接触アレルギーの発現である可能性もあるが、異物反応である可能性が最も高い [332, 333, 334]。このような場合、Al(OH)を含まないアレルゲンエキスに変更することが望まれる。アルミニウム塩は、アレルゲン特異的SCITにおいて最もよく使用されるデポアジュバントである [335] 。アジュバントとしてのアルミニウムのリスクは、長い間批判的に議論されてきた。2014年にPEIが発表した治療アレルゲンにおけるアルミニウムの安全性に関する声明では、局所忍容性、感作性、毒性、ドイツにおけるファーマコビジランスのデータについて取り上げている[336]。
これによると、アルミニウムの感作性ポテンシャルは一般的に低いと想定でき、SCIT使用時に患者における感作性の孤立した報告があるのみである[332, 333, 337]。毒性作用は、再吸収されたアルミニウムの量に依存する [337]。SCITの寄与は-3年間の治療を想定し、1回0.5mgのアルミニウムを年間8回皮下注射する維持量に基づくと-他の供給源と比較して低いと分類される。1986年から2013年までに報告されたすべての治療アレルゲンの副作用を評価した結果、安全性のシグナルは得られなかった。PEIは、現在入手可能な科学的データは、アルミニウムがアジュバントされたアレルゲンを用いたSCITによる小児または成人へのリスクを示唆するものではないと結論付けています。したがって、現在の知識に基づいて、アルミニウムがアジュバントされた承認済みの治療アレルゲンを使用するという習慣を変更する理由はないと考えられます。
アルミニウム含有アジュバントの安全性に関するデータをさらに改善するために、2015年にPEIによって生理学的根拠に基づくトキシコキネティクス(PBTK)モデルに関する研究プログラムが開始され、アルミニウム添加薬の安全性を継続的に評価するための支援として資金提供されました[338]。
結論37:現在の知見に基づけば、アルミニウム添加SCIT製剤の使用は、小児や成人における毒性作用のリスクをもたらさない。
SCITにおいて考えられる全身性のアレルギー反応には、軽度から重度の皮膚、胃腸、呼吸器、または心臓血管の反応がある。米国アレルギー・喘息・免疫学会(AAAAI)および米国喘息・アレルギー・免疫学会(ACAAI)が2008年から2013年にかけて実施した、34万4480人の患者における2890万回の注射受診に基づく調査では、全身性反応は合計1.9%に認められ、そのうちグレード3の反応(WAO分類)は1万回の注射の0.49例(患者数の0.08%)、グレード4の反応63例(患者数の0.02%)でした [339, 340]。全身反応の14%は注射後30分以上経過してから始まったが、これらはほとんどが軽度から中等度であり、致命的なものはなかった。アレルギー専門医の治療を受けた患者で2例、非アレルギー専門医の治療を受けた患者でさらに2例の致命的な反応が確認されたと報告されている[340, 341, 342]。継続調査において、2015年から2017年にかけて5件の死亡確認が追加報告されており、合計9年間で年間0.8件の致死的反応に相当する[343]。
2012 - 2014年にフランス、ドイツ、スペインで実施されたアレルゲン免疫療法における有害全身反応に関する欧州調査(EASSI)では、MedDRA用語(www.medra.org)を用いた57,463回のSCIT投与、3,398回のSCIT療法に関連して、97件の全身性反応が発生し、すなわち、全身性反応は全療法の2.9%、全注射量の0.17%でそれぞれ発生したとされた。致命的な反応は発生しなかった[344]。小児及び青年(11.7±3.9歳)のサブグループでは、1,127回の治療、19,669回の注射を受けた患者の1.53%に全身性反応が発現した[345]。全体的なグループにおいて、非修飾抽出物の使用、(満足な症状コントロールの可能性を示すものとして)症候性アレルギー薬の非使用、喘息、動物または花粉への感作、クラスター対ラッシュ方式、および過去のアナフィラキシーエピソードは、全身反応の高いリスクと関連していました。
2012年から2014年にかけて581人の小児患者を対象に行われた別の前向き観察研究では、合計10,015回の注射を受けた患者の2.2%に即時型全身反応が認められ、7.4%に遅延型全身反応が発生しました[346]。Ring and Messmer分類によるグレードIIIの重篤な全身反応[347]は、全治療の0.03%に認められ、すべて注射後30分以内に発生した。グレード IV の反応は認められませんでした[346]。
PEIのデータ(1991年~2000年)によると、重篤な反応の発生率は、非修飾(ネイティブ)アレルゲン抽出物で0.002~0.0076%(注射回数に基づく)、化学修飾アレルゲン抽出物(アルゴイド)で0.0005~0.01%と算出されています[348]。重篤な反応は、時にリスク要因で説明でき、通常は注意と予防で回避できる [328, 330, 349]。表13は、AITにおける全身性反応の発生に関連する可能性のあるリスク要因の概要を示している。
表13.
表13.
AIT時の全身反応の危険因子([328, 330, 344, 349, 350, 351]より改変)。
結論 38:ほとんどの副反応は、重症度が軽度から中等度であり、管理は容易である。SCITでは、重篤で生命を脅かす可能性のある全身性反応の発生はあり得るが、すべての安全対策が守られれば非常にまれである。
推奨 22:AIT において重篤な反応が発生した場合、治療の継続または中止の判断は、アレルギー専門医 またはこの治療に経験のある医師が、治療継続のリスク、適応症、治療法の選択肢を考慮し、患者との共同決定として 行うべきである(第5章、第6章も参照のこと)。(強いコンセンサス、100%の同意)。
この目的のために、患者は最初にSCITの適応を確立した医師に紹介される必要があるかもしれない。上記の危険因子を特定し、今後SCITとの関連性を回避する必要がある。治療を継続する場合、それぞれの製剤のSmPCおよびパッケージリーフレットに従って、投与量を減らすことが推奨されます。有害反応の場合、ヒスタミン1(H1)受容体拮抗薬の経口投与による前投薬で、起こりうる全身反応の頻度と重篤度を減らすことが可能である。しかし、前投薬を行っても、これらを排除することはできない[280, 324, 325, 352, 353, 354]。治療開始時の包括的な患者教育が特に重要である(第6章も参照)。重篤な副作用の管理については、第8章(緊急時の治療)で詳しく説明しています。
7.2. SLIT
SLIT製剤によるAITは、適応症に応じた患者の選択と実施により、適切に適用されれば安全であると分類されている[125、355]。副作用は用量依存的であり [183, 356, 357]、レビューでは~45~80%の範囲と報告されている [358, 359]。副作用は通常軽度で、主に局所粘膜反応(口腔咽頭そう痒症、知覚異常、口腔/咽頭腫脹、舌の潰瘍化など)として発現する [125、183、350、356、357、358、359、360、361]。局所的な薬物有害反応は、主に治療開始時または最初の数週間に現れ [362]、通常は数週間の治療で自己限定的になる [125]。しかし、副作用は、特に治療開始段階において、治療を早期に中止する危険因子となる。したがって、治療開始時の包括的な患者情報の提供が特に重要である(第6章、キーワード「患者情報」も参照)。SLIT中の消化器症状については、14%の症例で報告されている[355]。好酸球性食道炎、腹部不快感、呼吸困難、喘息増悪、さらに全身性そう痒症やアナフィラキシーが個々の患者で報告されている [125, 356, 183, 357, 358, 359]。SLITによる有害な重篤な全身反応のリスクはSCITよりも低いと考えられるが [125, 348] 、SLITによる重篤な反応は文献に記載されている [350, 358]。しかし、これらの事例のいくつかは、治療が現在の基準に適合していなかった(非標準化抽出物、急ぎのプロトコル、過剰投与、以前に重度の反応によりSCITを中止した患者) [350]。99] によると、6人の患者で全身性の副作用を治療するためにエピネフリンが使用されたが、ここでは重度のアナフィラキシーが報告されていない。米国では、安全上の理由から、SLIT患者はアナフィラキシー反応の自己治療用にエピネフリン自動注射器を処方されなければならない。欧州ではそのような推奨はない。SCITと同様に、SLITの重篤な全身性副作用の発生に対する重要な危険因子は、コントロール不良の喘息です [350]。
SLITの安全性プロファイルについては、ほとんどの副作用が自宅で発生し、(非常にまれな)全身性反応に対して迅速な医療介入の可能性がないことを忘れてはならない。したがって、副作用、飲み忘れ、SLITを一時的に中断すべき状況などの場合にどうすればよいかを、患者またはその親に知らせておくことが重要である。後者には、選択的口腔顎顔面手術、口腔咽頭感染症や病変(潰瘍、歯肉炎、歯周炎)、胃腸炎、喘息の増悪が含まれます [125] 。患者にとって苦痛となる局所的な副作用、例えばそう痒症やわずかな粘膜腫脹の場合、特に治療開始時に経口H1受容体拮抗薬の予防的摂取を検討することができる。また、口唇の血管浮腫など、より強い局所反応を繰り返す場合は、投与量を調整するか、必要であれば治療を中止する。
推奨23:SLITは自宅で行われ、医師の監督下にないため、患者には正しい使用方法、起こりうる副作用、その管理、危険因子について非常に慎重かつ総合的に説明する必要がある。(強いコンセンサス、100%の同意)
アレルゲンの皮下適用後に重篤な全身性反応を起こしたことがある場合も、SLITによる重篤な全身性反応の可能性の危険因子である [363] 。WAOは、SLITにSCITの全身反応の等級付け[274]([339](表14)に従って修正)を採用することを推奨し、またSLITにおける局所副作用の統一された分類(表15)を提案しています[125、364]。
表14.
表14.
2017年世界アレルギー機関(WAO)基準によるアレルゲン免疫療法における全身性有害事象の等級付け([274]より([339]に基づいて修正))。
表15.
表15.
2013年世界アレルギー機関(WAO)基準による舌下免疫療法(SLIT)の局所有害事象の等級付け([364]より)。
両分類とも、AIT(SLITおよびSCIT)の副作用の頻度と重症度をより正確に把握できるよう、世界的にシンプルで標準化された報告システムを構築することが目的である[366]。
アドヒアランスの欠如、新たな禁忌、許容できない局所的副作用の持続、重篤な治療後反応、SLITの1年後の臨床効果の未達成などが、治療を早期に中止する理由となりえます。SLITがうまくいかない場合、診断を批判的に見直す必要があります。競合するアレルギーが検出されない場合、アレルゲン抽出物の組成がメーカーにより異なるため、製剤の変更を検討することができます [367]。
結論39:口やのどの用量関連局所副作用は、SLITの開始時に頻繁に発生し、治療の早期中止の危険性がある。一方、全身性の反応、特に重篤な反応やアナフィラキシー反応は、孤立したケースで報告されているが、SCITに比べるとはるかに少ない頻度で起こる。
推奨24:苦痛を伴う局所症状を軽減するために、前投薬として経口H1抗ヒスタミン剤を考慮してもよい。(強い合意、100%の同意)
7.3. ドイツ、オーストリア、スイスにおける AIT の有害事象の報告
ドイツでは、製造販売業者は、次のような疑いのあるすべての症例に関する情報を送信しなければならない。1) 国内外で発生した重篤な副作用については15日以内に、2) 国内またはEU加盟国で発生した非重篤な副作用については、その情報を知ってから90日以内に、規則(EC) 726/2004第24条に基づき、EudraVigilanceデータベースに電子的に送信することが義務付けられています。日常的に使用されるADRの疑いについて報告することは、医薬品の安全性についてできるだけ多くのデータを取得し、医薬品のリスク・ベネフィット比を継続的に監視できるようにするために、非常に重要です。したがって、医師、薬剤師、その他の医療従事者は、ADRの疑いがある場合、国の報告システム(ドイツで使用されているアレルゲン製剤のPEI)に報告する必要があります(PDF形式:郵送、ファックス、Eメールで送付)。ドイツでは、患者はオンラインでADRを報告することができます(https://nebenwirkungen.bund.de)。
オーストリアでは、連邦医療安全局-BASGが行政の責任を担っています。BASGはオーストリア連邦保健省-BMGの直属で、AGESの所有者であるオーストリア共和国を代表しています。オーストリア医薬品・医療機器庁(AGES MEA)は、医薬品・医療機器の有効性・安全性の評価、市場調査、製造業者への査察、臨床試験などを担当しています。AGES MEAの職員は、連邦医療安全局(BASG)の代理として、主権的な活動を行います。オーストリア医薬品法およびファーマコビジランス条例2013(https://www.ris.bka.gv.at/GeltendeFassung.wxe?Abfrage=Bundesnormen&Gesetzesnummer=20008606)によると、医師、歯科医師、獣医、助産師、薬剤師、薬剤師の専門家グループのメンバー、および1994年工業法に従って医薬品の製造または医薬品の卸売取引に従事することを認められた商人、ならびに医薬品専門家の販売許可証保有者は、ADR発生をAGES MEAに報告する義務を負っています。ドイツと同様、製造販売業者は、国内外で発生した重篤なADRの疑いのあるすべての情報を、それを知った日から15日以内にEudraVigilanceデータベースに電子的に送信する必要があります。欧州連合内で発生したすべての非重篤なADRの疑いに関する情報は、それを知ってから90日以内に、販売承認権者がEudraVigilanceデータベースに電子的に提出しなければなりません(AMG Section 75j para.3)。オーストリアでは、患者自身が電子的にADRを報告するオプションも用意されています(https://www.basg.gv.at/marktbeobachtung/meldewesen/nebenwirkungsmeldung-human)。
スイスでは、2002年に新しい医薬品法(Heilmittelgesetz:HMG)が導入されて以来、医療従事者は、致命的または生命を脅かす、重大または永久的な損害を引き起こす、あるいは医薬品情報(drug compendium)に記載されていないまたは不十分な特定のADRの報告義務を負っています [368]。報告は、地域のファーマコビジランスセンターのいずれかに専用の書式で行われる。このセンターがデータ入力とSwissmedicへの電子転送(患者および主要な通知者については匿名化)を行います。Swissmedicへの直接の報告は、ElViS(Electronic Vigilance System)で電子的に行われます。報告書は、地域のファーマコビジランスセンターと密接に連携して編集・推定されます。ElViSは、スイスのADRデータベースを管理し、重大なADRや新しいADRを関係する製薬会社に転送しています。また、すべての報告書を世界保健機関(WHO)にも送ります。
製造販売業者もまた、製造販売承認者として、ADRと品質欠陥を報告する義務を負っています。通知すべきADRには、重篤なADR、既知または未知のADRの蓄積、品質欠陥、流通における異常な制限などが含まれます。
欧州連合(EU)およびスイスでは、販売承認後、販売承認者は、欧州医薬品庁(EMA)がEU加盟国および業界と緊密に協力して開発したPSURリポジトリに「安全性定期報告」(PSUR)を送信することが義務づけられています。
結論40:ドイツ、オーストリア、スイスでは、原則として重篤なAIT ADRの発生を報告する義務があるが、実際の運用については国別の規制がある。
緊急処置
重篤な反応の初期症状には、手のひらや足の裏のほてりやかゆみ、肛門周囲や性器周囲のかゆみ、喉の炎症/咳、尿意・便意、くしゃみ発作、全身性掻痒感などがあります。さらに、呼吸器系および/または循環器系の症状が急速に発生することがあります。AIT後の全身反応は、通常、塗布後最初の30分以内に起こる。したがって、SCITを使用する場合、患者は注射後少なくとも30分間は医学的観察下におかなければならず、アレルギー反応を疑う症状があれば直ちに報告しなければならない [33] 。しかし、注射後30分より後に起こる全身反応も報告されている [346] 。患者・保護者に説明し、適切な指示を与える必要があります。
全身性反応は、急速に悪化する危険性があるため、遅滞なく治療しなければならない [369] 。関係者は、アレルギー救急のための義務的な薬剤や機器の取り扱いに精通している必要があります(表16) [320] 。重篤な全身性反応の治療は、その段階に応じ、アナフィラキシーガイドラインに従って適切に行うべきである。患者の適切な体位、エピネフリンの筋肉内投与(体重(BW)が7.5/15~25/30kgの患者には150μg、BW30kg以上の患者には300μg、BW60kg以上には500μgが可能)、大腔静脈ラインによる容量療法、酸素(O2)投与などが、呼吸器症状や循環器症状がある患者の初期対応としてあげられる。閉塞性呼吸器症状がある場合は、サルブタモールの早期使用が推奨される。アナフィラキシー反応の急性期治療には、迅速な薬理効果(例:循環の安定化)を確保するため、エピネフリンの早期筋肉内投与が推奨される [369] 。反応が十分でない場合は、エピネフリンの反復投与が望ましい。実用的な理由から、遅滞なく治療的介入を行えるよう、十分な投与量のエピネフリン自己注射器を用意することが推奨される。関係するすべてのスタッフは、全身性アレルギー反応の場合に即座に対応できるよう定期的に訓練を受けるべきである [320] 。
表16.
表16.
AITにおけるアナフィラキシー反応の治療用救急機器([320]より引用)。
アナフィラキシーの緊急治療に関する治療勧告は、臨床試験の限られたデータに基づいているが、世界的(WAO) [369] 、欧州レベル(EAACI、 [370, 371] )、またSCIT中の緊急時の急性治療にも適用するエピネフリン筋肉内投与の推奨 [320] に関しては、国内でも合意されている。提示された勧告は、アナフィラキシー反応がSLIT中に発生した場合にも同様に適用される。
結論41:AITの設定における有害な全身反応のリスクと結果は、スタッフの訓練、安全基準の遵守、およびエピネフリン筋注の早期投与などの緊急措置の迅速な適用によって効果的に低減することができる。アナフィラキシー反応の急性期治療と管理に関する詳細は、2021年に発行された対応するドイツのS2kガイドラインに記載されている。
推奨25:AITの実施と起こりうる副反応の治療のために、スタッフの広範な訓練、適切な安全基準の適用、およびエピネフリンの早期筋肉内投与を含む必要な緊急措置の迅速な適用が確保されるべきである。(強いコンセンサス、100%の同意)
AITの今後の展望
皮下・舌下免疫療法という確立された投与方法に加え、表皮免疫療法や経口免疫療法によるピーナッツアレルギーの治療法の臨床開発が進んでいる [372, 373]。今後、さらなるアレルゲンや適応症が続くと予想される。
リンパ管内免疫療法は、特に注射の必要性を減らし、アレルゲンの投与量を少なくするという利点が期待できるが、矛盾する結果があるため、さらなる研究が必要である [374] 。
アレルゲンまたはアレルゲンミックスとTLRアゴニスト(TLR4、TLR9)の組み合わせは、Th2からTh1への免疫逸脱の増加および制御性T細胞(Treg)の誘導をもたらすことが示唆されている [375]. TLR4アゴニストを含むSCIT製剤はすでに市販されており、TLR9アゴニストとの併用についても、いくつかの肯定的な研究が行われている。
AITと生物学的製剤(抗IgE、抗2型炎症 [376, 377])の併用は、副作用の軽減と2型アレルギー性炎症の抑制の両方をもたらすと考えられている。抗IgE薬(オマリズマブ)とAITの併用については、副作用の軽減に関して有望な結果が得られています。しかし、この戦略を日常臨床に移行するには、より大規模な無作為化プラセボ対照試験が必要である [377, 378] 。
抗IL4抗体とSCITの併用は、Th2細胞および後期反応の抑制をもたらしたが、追加の臨床効果はまだ示されていない[376]。しかし、2型反応を抑制する新しい生物学的製剤が販売認可され、さらに開発されれば、この点に関する新しい知見が得られる可能性が高い。
もう一つのアプローチとして、IgG/IgE比を高めるためにヒトIgG4モノクローナル抗体を用いたアレルゲン特異的受動免疫療法を開発することが進められている。Fel d 1に対するIgG4を用いた研究では、猫アレルゲンによる誘発後、臨床症状の速効的かつ効果的な軽減が示されました [379] 。
改良型アレルゲンまたはアレルゲン断片の開発は、効果/副作用プロファイルの改善、製剤の標準化、治療期間の点で大きな可能性を持っている。その戦略は、核酸ベースの方法やペプチドの開発から、アレルゲンの野生型または改変型変異体の組換え生産まで多岐にわたる[380]。様々なアレルゲンを対象としたポジティブな第Ⅱ相試験がいくつかあるが、猫アレルギー患者の治療を目的としたペプチドのネガティブな第Ⅲ相試験もあり、その開発は中止されている(4.8.2章、キーワード「ペットアレルゲン」参照)。
今後、ワクチン学の最新の手法を応用することで、この分野に関連する新たな展開が期待される[9]。
結論 42: アレルゲン免疫療法は、有効性と安全性の向上と持続性の観点から、さらなる発展が必要である。現在、多くの革新的なアプローチが開発されている。
結論のまとめ
AITの主な免疫修飾は、i) 制御性免疫細胞(DCregs、Tregs、Bregs)の一時的誘導、ii) アレルゲン特異的自然免疫とTヘルパー細胞活性の低下、iii) アレルゲンブロッキングIgGおよびIgA抗体の形成、である。最後に、臨床的アレルゲン耐性の免疫学的前提条件として、主にTh2優位のエンドタイプから「T細胞正常化」エンドタイプが出現する。
AIT製品(SCITとSLIT)は、その組成が不均一であるため比較することはできない。同様に、有効成分の測定方法が異なるため、現在までに各メーカーから提示されたアレルゲン濃度も比較できない。SCITでは、非修飾アレルゲンは水性または物理的結合(セミデポ)抽出物として、化学修飾抽出物(アレルゴイド)はセミデポ抽出物として使用される。SLIT用のアレルゲン抽出物およびアレルゴイドは、水溶液または錠剤として使用される。今後、欧州薬局方により、シラカバ花粉抽出物にはBet v 1、チモシー牧草抽出物にはPhl p 5aの量的表示が義務付けられる予定である。
AITの臨床効果は、患者報告アウトカム(PRO)を主要評価項目および副次評価項目として測定されます。EMA では、第 III 相臨床試験において、主要評価項目として症状・薬物複合スコア(CSMS) を定めている。CONSORT 勧告では、試験結果の評価、発表、公表の標準的な手順が規定されている。プラセボ群の結果は、積極的な治療を行った群と同様に詳細に記述されなければならない。
頻度の高いアレルゲン源(甘い草の花粉(トウモロコシを除く)、カバノキ、ハンノキ、ヘーゼル、イエダニ、ハチおよびスズメバチの毒)を含む製品は、ドイツでは治療アレルゲン条例に基づき販売認可を取得しなければなりません。認可のプロセスでは、これらの製品の品質、有効性、安全性が評価されます。EMAのガイドラインに従ってリスク・ベネフィット比を実証する認可済みまたは販売可能なアレルゲン製品を適用することが望ましい。指名患者用製品は、AITのための希少アレルゲン源の処方に使用される。治療用アレルゲン条例に記載されているアレルゲンと混合することはできない。オーストリアとスイスには、国別の規制が適用されます。
アレルギー性鼻結膜炎とアレルギー性気管支喘息は、社会全体に多大な直接、間接、無形のコストを引き起こしている。AIT は、適応がありガイドラインに従って使用される場合、治療へのアドヒアランスが良好であれば、 薬物療法のみと比較して長期的に費用対効果が有意に高いです。AIT製品の選択は、ドイツの社会法に基づき、臨床的利益が費用より優先されるため、個人ベースで決定する必要がある。
システマティックレビューやメタアナリシスでは、特定の適応症、アレルゲン、年齢層に対してSCITやSLITの有効性が証明されています。対照研究からのデータは、その範囲、質、調剤、投与レジメンの点で大きく異なっており、製品固有の評価が必要です。特定の製剤の有効性を、同じ方法で投与されるすべての製剤に広く転嫁することは支持されない。
明確に定義された基準に従って、個々のAIT製剤を製品ごとに評価することが推奨される。DGAKI のウェブサイト(https://dgaki.de/leitlinien/s2k-leitlinie-ait/)には、AIT 製剤の製品別情報が表形式で掲載されており、ドイツ・オーストリア・スイスで流通するイネ科、樹木花粉(Betulaceae)、ハウスダストマイトアレルゲン製剤の相同グループが含まれています。
イネ科花粉症における ARC の SCIT の有効性は、成人患者における多くの研究によって非常によく証明されているが、小児および青年においては、ほとんど証明されていない。非対照試験および RWE 試験では、小児および青少年における喘息予防効果が示されています。一般に、臨床効果の証明には製品ごとの違いがあり、製品ごとの評価が重要であることがわかります。このことは、以下のすべてのアレルゲン群にも当てはまる。
成人および小児におけるイネ科花粉症によるARCに対するSLITの有効性と安全性は、非常によく知られている。しかし、製品特有の違いが存在する。ある対照研究では、小児および青年における喘息予防効果が示されています。
イネ科花粉症による季節性アレルギー性喘息におけるイネ科花粉エキス配合のSCITの有効性は、成人では十分に証明されていますが、小児では少数の研究で証明されているに過ぎません。
イネ科花粉症による季節性気管支喘息の成人患者におけるSLITの有効性に関する代表的な研究はごくわずかであり、小児や青年の年齢層における代表的な研究はほとんどありません。現在のデータに基づくと、イネ科花粉によるアレルギー性喘息にSLITを推奨する根拠は限られています。
成人の樹木花粉(ベツラカ)アレルギーによるARCにおけるSCITの有効性は、多くの研究によって十分に立証されていますが、小児や青少年における具体的な研究は不足しています。しかし、小児・青少年を対象とした研究はほとんどなく、健康保険の処方箋に基づく初めての実地分析データから、すべての年齢層で有効であることが示されています。
樹木花粉症によるARCに対するSLITの安全性と有効性は、成人患者において非常によく立証されています。小児・青年の花粉症患者に対しては、いくつかの研究がこの治療法の安全性と有効性を示しています。
DBPC 試験では、樹木花粉症に起因する季節性アレルギー性喘息の成人患者において、樹木花粉抽出物を用いた SCIT が有効であることが示されています。
成人および小児の季節性アレルギー性喘息に対する花粉症治療薬の有効性については、これまであまり検討されてきませんでした。しかし、健康保険の処方データに基づく実地解析のデータから、この適応症における有効性が示唆されています。
樹木花粉を用いたSLITは、喘息がコントロールされている患者において安全に適用することができます。しかし、ARCに関する研究では、喘息の症状コントロールに対する効果はばらばらであった。
カバノキ科とブナ科に交差反応を示さないその他の樹木花粉、例えばトネリコ、ヒノキ、プラタナスの花粉については、臨床効果に関する証拠はほとんどなく、治療用抽出物の入手も限られます。
成人患者に対するアークでのハウスダストマイト抽出物を用いたSCITの安全性と有効性に関するデータは入手可能である。小児に対する安全性と有効性は、症例数の少ない研究で証明されているが、近代的な方法論基準に従った二重盲検プラセボ対照 SCIT 研究が不足しているのが現状である。
いくつかのハウスダスト・ダニ用SLIT製剤については、成人および思春期の患者におけるARCでの有効性と安全性が、多数の症例を用いた研究により証明されている。また、小児のARCおよびハウスダストマイトアレルギーにおけるSLITの有効性と安全性も研究により明らかにされている。
成人では、ハウスダストマイトによるアレルギー性喘息に対するSCITの有効性・安全性が研究により証明されている。しかし、各研究で使用された臨床的エンドポイントは大きく異なるため、異なる研究で示された効果の大きさを比較することはできません。小児および青年に関するデータは限られているが、この年齢層におけるアレルギー性喘息に対するハウスダストマイト SCIT の有効性および安全性を示すエビデンスは存在する。
成人の場合、ハウスダストマイトアレルギーによるアレルギー性喘息に対する SLIT の有効性と安全性は研究により証明され ている。しかし、研究で使用された臨床エンドポイントは大きく異なるため、異なる研究で示された効果の大きさを比較することはできません。小児および青年に関するデータは限られているが、この年齢層におけるアレルギー性喘息に対するハウスダストマイトSLITの有効性および安全性を示すエビデンスは存在する。
貯蔵庫ダニ抽出物を用いた製剤については、その臨床的有効性を示すエビデンスはごくわずかであり、AIT用製剤の入手も困難である。
ブタクサ花粉症におけるAITの有効性は、成人のARCにおけるSCITでは十分に確立されているが、喘息では弱く、小児のデータは不足している。SLIT については、ブタクサ花粉エキスを含有する錠剤の有効性が、成人および ARC の小児で非常によく立証されている。
他のアレルゲン抽出物(イネ科植物、シラカバ、ダニ、ブタクサを除く)を用いたAITの効果については、SCITとSLITに関するいくつかの研究があるが、現時点では治療効果を評価することができない。
ピーナッツアレルギーでは、様々な経路でのAITの適用が研究されており、最も臨床試験が進んでいるのは経口耐性獲得(OTI)である。OTI製剤の1つがピーナッツアレルギーの診断が確定した小児および青年の治療薬として承認されています。
ADの治療薬として承認されたAIT製剤はありません。しかし、ADはAITの禁忌ではありません。ほとんどの研究において、ハウスダストマイト抽出物を用いたSCITおよびSLITは、ハウスダストマイト・アレルギーに関連するAD患者において良好な効果を示しています。
AITを開始する適応には、様々な前提条件が必要である。また、特定の条件下では、AITは、疾患修飾を治療目標とする軽症の患者にも使用することができる。
治療法の決定には、塗布経路や組織的な注意事項に関して、患者や家族との明確なコミュニケーションが不可欠である。
成分分解診断法は、特に多感症の場合、AIT の成功確率を推定するのに有用である。
AITには様々な禁忌があるが、塗布経路による違いはごくわずかである。
適応を確定する際には、臨床効果に影響を与える可能性のある因子を考慮しなければならない。適応があり、合併症を考慮した場合、65歳以上の患者さんや自己免疫疾患のある患者さんにもAITは可能です。SCITとSLITの違いは、主に禁忌について考慮することである。禁忌がある場合でも、個々の症例によってはAITの適応となる場合があります。
ARCと喘息は薬物療法が基本であり、AITはそれに加えて適用される。
ドイツ、オーストリア、スイスでは、AITを適用する医師には異なる法的規定が適用されます。
AITを実施するためには、詳細かつ文書化された患者情報が必須条件となります。この点については、「治療情報シートSCIT」および「治療情報シートSLIT」という文書が参考になります。
投与方法にかかわらず、AIT患者の治療アドヒアランスは、治療の成功にとって決定的に重要であるにもかかわらず、医師が想定しているよりも低いのが現状です。AITの服薬アドヒアランスを向上させることは、治療の最適な効果を確保するために最も重要な課題の一つです。患者固有の要件を考慮し、患者への包括的な指導を行い、診療所/クリニックの管理を最適化することが、高いアドヒアランスを得るための決定的な鍵となる。
SCIT がガイドラインに従って実施されるようにするためには、様々な注意事項や手順が役立つ。これらは、各SCIT製剤の製品特性概要およびパッケージリーフレットにも記載されています。
SLITがガイドラインに従って実施されることを保証するために、様々な注意事項や手順が役に立ちます。これらは、SLIT製剤の製品特性概要およびパッケージリーフレットに記載されている推奨事項に基づいています。
現在の知見によれば、アルミニウム添加SCIT製剤の使用は、小児および成人における毒性作用のリスクをもたらすものではありません。
ほとんどの副作用は軽度から中等度であり、対処も容易です。SCITにおいて、生命を脅かす可能性のある重篤な全身性反応の発生はあり得ますが、すべての安全対策が順守されていれば非常に稀です。
口やのどの用量関連局所副作用は、SLITの開始時に頻繁に発生し、治療を早期に中止するリスクを伴います。一方、全身性の反応、特に重篤な反応やアナフィラキシー反応は、孤立したケースで報告されていますが、SCITに比べると発生頻度ははるかに低くなっています。
ドイツ、オーストリア、スイスでは、原則としてAITの重篤なADRの発生を報告する義務がありますが、実際の運用については国別の規制があります。
AIT の設定における全身性副作用のリスクと結果は、スタッフのトレーニング、安全基準の遵守、および早期 のエピネフリン筋肉内投与を含む緊急措置の迅速な適用により、効果的に低減することができる。アナフィラキシー反応の急性期治療と管理に関する詳細は、2021年に発表された対応するドイツのS2kガイドラインに記載されています。
アレルゲン免疫療法は、有効性と安全性を高め、持続させるという観点から、さらなる発展が求められています。現在、多くの革新的なアプローチが開発されている。
謝辞
翻訳を担当したVeronika Luger(Dustri, Germany)、翻訳(英語)原稿をネイティブチェックしたIsabel Hyde(Leeds Institute of Rheumatic and Musculoskeletal Medicine (LIRMM), University of Leeds, Leeds, United Kingdom)に謝意を表します。
資金調達
ハノーバーでのコンセンサス会議(会場、技術設備、夕食、昼食)、デジタル会議(GoToTraining)、 AWMF モデレーターは DGAKI の資金援助を受けており、エビデンスレポートのための方法論者も同様に DGAKI の資金援助を受けている。参加者同席の第1回コンセンサス会議の旅費・宿泊費は、それぞれの専門学会・団体から出費された。また、報酬は支払われていない。
利益相反
利益相反は AWMF ポータル interessenerklaerung-online.de を用いて記録し、DGAKI の利益相反担当者が評価し(詳細はガイドライン報告書を参照)、AWMF に従って集計した。ガイドライン報告書と利益相反表は、www.awmf.org/leitlinien/detail/ll/061-004.html。
論文情報
Allergol Select. 2022; 6: 167-232.
オンライン公開 2022 Sep 6. doi: 10.5414/ALX02331E
PMCID: PMC9513845
PMID: 36178453
Oliver Pfaar,1 Tobias Ankermann,2 Matthias Augustin,3 Petra Bubel,4 Sebastian Böing,5 Randolf Brehler,6 Peter A. Eng,7 Peter J. Fischer、8 Michael Gerstlauer、9 Eckard Hamelmann、10 Thilo Jakob、11 Jörg Kleine-Tebbe、12 Matthias Volkmar Kopp、13 Susanne Lau、14 Norbert Mülleneisen、15 Christoph Müller、16 Katja Nemat、 17,18 Wolfgang Pfützner、19 Joachim Saloga、20 Klaus Strömer, 21 Peter Schmid-Grendelmeier、22 Antje Schuster、23 Gunter Johannes Sturm、24 Christian Taube、25 Zsolt Szépfalusi、26 Christian Vogelberg、27 Martin Wagenmann、28 Wolfgang Wehrmann、29 Thomas Werfel、30 Stefan Wöhrl、31 Margitta Worm、32 および Bettina Wedi30
コメント参加とプロセスサポート
Susanne Kaul, 33 Vera Mahler, 33 and Anja Schwalfenberg34
1マールブルグ大学病院耳鼻咽喉科,頭頸部外科,鼻科・アレルギー科,マールブルグ,フィリップス大学。
2小児科、Städtisches Krankenhaus Kiel、キール。
3ハンブルク大学医療センター(ハンブルク)皮膚科・看護学科医療サービス研究機関
4ENT診療所 Dr. Bubel、Eisleben。
5空気学、アレルギー学および睡眠医学の専門診療所(デュッセルドルフ/ミールブッシュ)。
6ミュンスター大学病院皮膚科、ミュンスター、ドイツ。
7小児呼吸器・アレルギー科小児病院(スイス、アーラウ)、7小児呼吸器・アレルギー科(スイス、アーラウ)。
8小児青少年医学診療所(アレルギー科・小児呼吸器科、シュヴェービッシュ・グミュント、ドイツ
9アウグスブルク大学医療センター小児呼吸器・アレルギー科(アウグスブルク)。
10ビーレフェルト大学小児センター小児科(ビーレフェルト市
11ユストゥス・リービッヒ大学キーセン校大学医療センター皮膚科・アレルギー科(キーセン市)。
12アレルギー・喘息センター・ウェステンド、外来診療所・研究センター、ベルリン、ドイツ
13ベルン大学病院小児科、ベルン、スイス。
14シャリテ大学ベルリン、小児呼吸器内科、免疫学およびクリティカルケア医学、ベルリン。
15レバークーゼン喘息・アレルギーセンター
16フライブルク大学医療センター、小児科、一般小児科、青年医学、新生児科(フライブルク)。
17小児肺・アレルギー科(診療)、ドレスデン・フリードリヒシュタット小児センター(Kid)、ドレスデン。
18ドレスデン大学アレルギーセンター、ドレスデン大学病院(UKD)、ドレスデン。
19フィリップス大学マールブルグ校皮膚科・アレルギー科、大学クリニック、マールブルグ
20ヨハネス・グーテンベルク大学大学医療センター皮膚科(マインツ)。
21プライベートオフィス皮膚科、アハウス、ドイツ
22チューリッヒ大学病院皮膚科アレルギー科(スイス、チューリッヒ
23デュッセルドルフ大学病院小児科(ドイツ、デュッセルドルフ)。
24グラーツ医科大学皮膚・泌尿器科、アレルギー外来、ロイマンプラッツ、ウィーン、オーストリア
25エッセン大学病院呼吸器科(ドイツ、エッセン、ルールランドクリニーク
26ウィーン医科大学小児科・青年医学部、小児呼吸器科・アレルギー科・内分泌科、小児科総合センター、ウィーン、 オーストリア。
27カール・グスタフ・カールス大学病院小児肺・アレルギー科、テクニカル、ドレスデン大学、ドレスデン。
28デュッセルドルフ大学病院耳鼻咽喉科(HNO-Klinik)(デュッセルドルフ)。
29MVZ Dermatology and Dermatological Surgery Münster, Münster,
30ハノーバー医科大学皮膚科・アレルギー科、包括的アレルギーセンター、ハノーバー、ドイツ
31フロリッドスドルフ・アレルギーセンター(FAZ)、ウィーン、オーストリア
32シャリテ-ベルリン大学、ベルリン自由大学およびベルリン・ハンボルト大学の法人会員、皮膚科・アレルギー科(ベルリン)。
33パウル・エーリック研究所(ランゲン)、および
34ドイツアレルギー喘息協会(メンヘングラートバッハ、ドイツ
通信先 Prof. Dr. med. Oliver Pfaar, Klinik für Hals-, Nasen- und Ohrenheilkunde, Universitätsklinikum Gießen und Marburg GmbH, Standort Marburg, Baldingerstraße, 35043 Marburg, gro.raafp@revilo.
Received 2022 Mar 15; Accepted 2022 Aug 15.
著作権 © Dustri-Verlag Dr. K. Feistle
本論文は、Creative Commons Attribution Licenseの条件の下で配布されるオープンアクセス論文であり、原著を適切に引用することを条件に、いかなる媒体においても無制限の使用、配布、複製を許可するものです。
これは、doi: 10.5414/ALX02331の再版です。
Allergologie Selectの記事はDustri-Verlagの提供でここに提供されています。
参考文献
Pfaar O Bachert C Bufe A Buhl R Ebner C Eng P Friedrichs F Fuchs T Hamelmann E Hartwig-Bade D Hering T Huttegger I Jung K Klimek L Kopp MV Merk H Rabe U Saloga J Schmid-Grendelmeier P Schuster A Guideline on allergen-specific immunotherapy in IgE-mediated allergic diseases(アレルギー疾患におけるアレルギー物質特異的免疫療法に関する指針): ドイツアレルギー・臨床免疫学会(DGAKI)、小児アレルギー・環境医学学会(GPA)、ドイツアレルギー学会(AeDA)、オーストリアアレルギー・免疫学会(ÖGAI)、スイスアレルギー・免疫学会(SGAI)、ドイツ皮膚科学会(DDG)、ドイツ耳鼻咽喉科学会による S2k ガイドライン。頭頸部外科学会(DGHNO-KHC)、ドイツ小児科・青年医学会(DGKJ)、小児肺学会(GPP)、ドイツ呼吸器学会(DGP)、ドイツ耳鼻咽喉科医会(BV-HNO)、小児・青年医専門連盟(BVKJ)、連邦肺臓医会(BDP)、ドイツ皮膚科医会(BVDD)などがあります。アレルゴ・ジェー・イント. 2014; 23: 282-319. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Maintz L Bussmann C Bieber T Novak N Contribution of histamine metabolism to tachyphylaxis during the buildup phase of rush immunotherapy(ラッシュ免疫療法のビルドアップ期におけるヒスタミン代謝のタキフィラキシーへの寄与)。Jアレルギー臨床免疫学。2009; 123: 701-703. [PubMed] [Google Scholar] 。
Pilette C Nouri-Aria KT Jacobson MR Wilcock LK Detry B Walker SM Francis JN Durham SR 草花の免疫療法は粘膜TGF-β発現と関連したアレルゲン特異的IgA2抗体反応を誘発する。J Immunol. 2007; 178: 4658-4666. [PubMed] [Google Scholar].
Novak N Mete N Bussmann C Maintz L Bieber T Akdis M Zumkehr J Jutel M Akdis C ヒスタミン受容体2によるアレルゲン特異的免疫療法中の好塩基球活性化の早期抑制。J Allergy Clin Immunol. 2012; 130: 1153-1158.e2. [PubMed] [Google Scholar].
Bellinghausen I Metz G Enk AH Christmann S Knop J Saloga J Insect venom immunotherapy induces interleukin-10 production and the Th2-to-Th1 shift, and changes surface marker expression in venom-allergic subjects. Eur J Immunol. 1997; 27: 1131-1139. [PubMed] [Google Scholar].
Akdis CA Akdis M アレルゲンに対する免疫寛容のメカニズム:IL-10 と Tregs の役割. J Clin Invest. 2014; 124: 4678-4680. [PMC無料記事] [PubMed] [Google Scholar].
Shamji MH Kappen JH Akdis M Jensen-Jarolim E Knol EF Kleine-Tebbe J Bohle B Chaker AM Till SJ Valenta R Poulsen LK Calderon MA Demoly P Pfaar O Jacobsen L Durham SR Schmidt-Weber CB Biomarkers for monitoring clinical efficacy of allergen immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper. Allergy. 2017; 72: 1156-1173. [PubMed] [Google Scholar].
Möbs C Ipsen H Mayer L Slotosch C Petersen A Würtzen PA Hertl M Pfützner W Birch pollen immunotherapy resulted in long-term loss of Bet v 1-specific TH2 responses, transient TR1 activation, and synthesis of IgE-blocking antibodies.白樺花粉免疫療法は、長期的なBet v 1特異的TH2応答の喪失、一過性のTR1活性化、IgE遮断抗体の合成をもたらす。Jアレルギー・クリニック・イミュノール。2012; 130: 1108-1116.e6. [PubMed] [Google Scholar].
Pfaar O Bonini S Cardona V Demoly P Jakob T Jutel M Kleine-Tebbe J Klimek L Klysner S Kopp MV Kuna P Larché M Muraro A Schmidt-Weber CB Shamji MH Simonsen K Somoza C Valovirta E Zieglmayer P Zuberbier T Perspectives in allergen immunotherapy: 2017 and beyond. Allergy. 2018; 73: 5-23. [PubMed] [Google Scholar].
Zissler UM Jakwerth CA Guerth FM Pechtold L Aguilar-Pimentel JA Dietz K Suttner K Piontek G Haller B Hajdu Z Schiemann M Schmidt-Weber CB Chaker AM Early IL-10 producing B-cells and coinciding Th/Tr17 shifts during three year grass-pollen AIT.(3年間の草花AITにおける初期のIL-10産生B細胞とTh/Tr17シフトの一致)。EBioMedicine. 2018; 36: 475-488. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Berings M Karaaslan C Altunbulakli C Gevaert P Akdis M Bachert C Akdis CA Advances and highlights in allergen immunotherapy: 臨床的・免疫学的寛容の持続にむけて。J Allergy Clin Immunol. 2017; 140: 1250-1267. [PubMed] [Google Scholar].
Shamji MH Durham SR 吸入アレルゲンに対するアレルゲン免疫療法のメカニズムと予測バイオマーカー. J Allergy Clin Immunol. 2017; 140: 1485-1498. [PubMed] [Google Scholar].
Wambre E アレルゲン特異的免疫療法のCD4+ T細胞への影響。Curr Opin Allergy Clin Immunol. 2015; 15: 581-587. [PMC フリーアーティクル] [PubMed] [Google Scholar].
James LK Bowen H Calvert RA Dodev TS Shamji MH Beavil AJ McDonnell JM Durham SR Gould HJ Allergen specificity of IgG(4)-expressing B cells in patients with grass pollen allergy undergoing immunotherapy. J Allergy Clin Immunol. 2012; 130: 663-670.e3. [PubMed] [Google Scholar].
Reithofer M Böll SL Kitzmüller C Horak F Sotoudeh M Bohle B Jahn-Schmid B Alum-adjuvanted allergoids induce functional IgE-blocking antibodies. Clin Exp Allergy. 2018; 48: 741-744. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Rauber MM Wu HK Adams B Pickert J Bohle B Shamji MH Pfützner W Möbs C グルタールアルデヒド修飾アレルロイドによる白樺花粉アレルゲン特異的免疫療法はIL-10分泌と保護抗体応答を誘導する。Allergy. 2019; 74: 1575-1579. [PubMed】【Google Scholar】。
Pfaar O Urry Z Robinson DS Sager A Richards D Hawrylowicz CM Bräutigam M Klimek L A randomized placebo-controlled trial of rush preseasonal depigmented polymerized grass pollen immunotherapy. アレルギー。2012; 67: 272-279. [PubMed] [Google Scholar] 。
18。ファンデVeen W Stanic B WirzのJansen K Globinska A Akdis Mアレルゲンへの免疫寛容とそれ以降における制御B細胞の役割。J Allergy Clin Immunol. 2016; 138: 654-665. [PubMed][Google Scholar].Shamji MH Layhadi JA Sharif H Penagos M Durham SR 吸入アレルゲンに対するアレルゲン特異的免疫療法のための免疫反応とバイオマーカー. J Allergy Clin Immunol Pract. 2021; 9: 1769-1778. [PubMed] [Google Scholar].
Verordnung über die Ausdehnung der Vorschriften über die Zulassung der Arzneimittel auf Therapieallergene, die für einzelone Personen auf Grund einer Rezeptur werden, soieüber Verfahrensregelung der stautlichen Chargenprüfung (Therapieallergene-Verordnung). Bundesgesetzbl. 2008; 51: 2177-2178. [Google Scholar].
https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-allergen-products-production-quality-issues_en.pdf. 欧州医薬品庁(European Medicines Agency). . ヒト用医薬品委員会(CHMP). アレルゲン製品に関するガイドライン:製造と品質に関する問題。EMEA/CHMP/BWP/304831/2007. ロンドン, 20 November, 2008 . (アクセス日 2022 年 4 月 12 日).
van Ree R Chapman MD Ferreira F Vieths S Bryan D Cromwell O Villalba M Durham SR Becker WM Aalbers M André C Barber D Cistero Bahima A Custovic A Didierlaurent A Dolman C Dorpema JW Di Felice G Eberhardt F Fernandez Caldas E The CREATE project: development of certified reference materials for allergenic products and validation of methods for their quantification.アレルギー物質に関する認定標準物質の開発、定量化法の妥当 性の検証。Allergy. 2008; 63: 310-326. [PubMed] [Google Scholar].European Directorate for the Quality of Medicines and HealthCare (EDQM)(欧州医薬品医療品質理事会). 欧州評議会編.Monograph: アレルゲン製品 - Producta Allergenica 07/2014:1063. Strasbourg: Council of Europe; 2014; 3945-3947.
Grammer LC Shaughnessy MA Patterson R アレルゲン免疫療法の変更形態。Jアレルギー臨床免疫学。1985; 76: 397-401. [PubMed] [Google Scholar].
Jensen-Jarolim E Bachmann MF Bonini S Jacobsen L Jutel M Klimek L Mahler V Mösges R Moingeon P O Hehir RE Palomares O Pfaar O Renz H Rhyner C Roth-Walter F Rudenko M Savolainen J Schmidt-Weber CB Traidl-Hoffmann C Kündig T Allergen Immunotherapyにおける市販のアジュバンドと処方における最新技術について。欧州アレルギー・臨床免疫学会(EAACI)のポジションペーパー。Allergy. 2020; 75: 746-760. [PubMed] [Google Scholar].
Gerth van Wijk R 正と負のAIT試験。何が違いを生むのか?アレルゴJ Int. 2018; 27: 167-172. [PMC無料記事] [PubMed] [Google Scholar].
Pfaar O Demoly P Gerth van Wijk R Bonini S Bousquet J Canonica GW Durham SR Jacobsen L Malling HJ Mösges R Papadopoulos NG Rak S Rodriguez del Rio P Valovirta E Wahn U Calderon MA Recommended for the standardization of clinical outcomes used in allergen immunotherapy trials for allergic rhinoconjunctivitis: an EAACI Position Paper.(アレルギーの免疫療法試験で用いられる臨床結果の標準化の推奨事項:EAACIポジションペーパー)。Allergy. 2014; 69: 854-867. [PubMed][Google Scholar].
Klimek L Bergmann KC Biedermann T Bousquet J Hellings P Jung K Merk H Olze H Schlenter W Stock P Ring J Wagenmann M Wehrmann W Mösges R Pfaar O Visual analogue scales (VAS): 日常診療におけるアレルギー性鼻炎の症例における症状の記録と治療モニタリングのための測定器。ドイツアレルギー学会(AeDA)およびドイツアレルギー・臨床免疫学会(DGAKI)耳鼻咽喉科部会のポジションペーパー、ドイツ耳鼻咽喉科・頭頸部外科学会(DGHNOKHC)の臨床免疫学、アレルギー学、環境医学に関するワーキンググループとの共同作業による。Allergo J Int. 2017; 26: 16-24. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pfaar O Gerth van Wijk R Klimek L Bousquet J Creticos PS 小児および青年の年齢層におけるアレルゲン免疫療法の臨床試験:現在の概念と将来のニーズ。Clin Transl Allergy. 2020; 10: 11. [PMC無料記事] [PubMed] [Google Scholar].
Pfaar O Alvaro M Cardona V Hamelmann E Mösges R Kleine-Tebbe J アレルゲン免疫療法の臨床試験:現在のコンセプトと将来のニーズ。Allergy. 2018; 73: 1775-1783. [PMCフリーアーティクル] [PubMed] [Google Scholar].
欧州医薬品庁(European Medicines Agency). Commitee for medicinal products for human use (CHMP): Guideline on the Clinical Development of Products for Specific Immunotherapy for The Treatment of Allergic Diseases (CHMP/EWP/18504/2006). https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-development-products-specific-immunotherapy-treatment-allergic-diseases_en.pdf (Date of access April 12, 2022).欧州医薬品審査庁.
Bousquet J Schünemann HJ Bousquet PJ Bachert C Canonica GW Casale TB Demoly P Durham S Carlsen KH Malling HJ Passalacqua G Simons FE Anto J Baena-Cagnani CE Bergmann KC Bieber T Briggs AH Brozek J Calderon MA Dahl R How to design and evaluation randomized controlled trials in immunotherapy for allergic rhinitis: an ARIA-GA(2) LEN statement. アレルギー。2011; 66: 765-774. [PubMed] [Google Scholar] 。
Roberts G Pfaar O Akdis CA Ansotegui IJ Durham SR Gerth van Wijk R Halken S Larenas-Linnemann D Pawankar R Pitsios C Sheikh A Worm M Arasi S Calderon MA Cingi C Dhami S Fauquert JL Hamelmann E Hellings P Jacobsen L EAACI Guidelines on Allergen Immunotherapy(アレルギー誘発免疫療法に関するEAACI指針)。アレルギー性鼻結膜炎。Allergy. 2018; 73: 765-798. [PubMed] [Google Scholar].
Breiteneder H Peng YQ Agache I Diamant Z Eiwegger T Fokkens WJ Traidl-Hoffmann C Nadeau K O'Hehir RE O'Mahony L Pfaar O Torres MJ Wang DY Zhang L Akdis CA Biomarkers for diagnosis and prediction of therapy response in allergic diseases and asthma. Allergy. 2020; 75: 3039-3068. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pfaar O Agache I de Blay F Bonini S Chaker AM Durham SR Gawlik R Hellings PW Jutel M Kleine-Tebbe J Klimek L Kopp MV Nandy A Rabin RL van Ree R Renz H Roberts G Salapatek AM Schmidt-Weber CB Shamji MH Perspectives in allergen immunotherapy: 2019 and beyond. Allergy. 2019; 74: 3-25. [PubMed] [Google Scholar].
Paoletti G Di Bona D Chu DK Firinu D Heffler E Agache I Jutel M Klimek L Pfaar O Mösges R DunnGalvin A Genuneit J Hoffmann HJ Canonica GW Allergen immunotherapy: 観察および無作為化試験 "実世界の証拠 "の成長の役割。Allergy. 2021; 76: 2663-2672. [PubMed] [Google Scholar].
Pfaar O Bousquet J Durham SR Kleine-Tebbe J Larché M Roberts G Shamji MH Gerth van Wijk R Allergen Immunotherapyの100と10年。経験的観察からエビデンスへの旅。アレルギー。2022; 77: 454-468. [PubMed] [Google Scholar].
Bousquet J Pfaar O Togias A Schünemann HJ Ansotegui I Papadopoulos NG Tsiligianni I Agache I Anto JM Bachert C Bedbrook A Bergmann KC Bosnic-Anticevich S Bosse I Brozek J Calderon MA Canonica GW Caraballo L Cardona V Casale T 2019 ARIA Care pathways for allergen immunotherapy(アレルゲン免疫療法に関するケアパス。Allergy. 2019; 74: 2087-2102. [PubMed] [Google Scholar].
Vogelberg C Brüggenjürgen B Richter H Jutel M 草木花粉によるアレルギー性鼻炎および喘息における皮下および舌下免疫療法の実環境でのアドヒアランスとエビデンス。患者はアドヒアランスを優先する。2020; 14: 817-827. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Zielen S Devillier P Heinrich J Richter H Wahn U 舌下免疫療法はアレルギー性鼻炎の長期的な緩和をもたらし、喘息のリスクを低減させる。レトロスペクティブな実データベースの分析。Allergy. 2018; 73: 165-177. [PMC無料論文] [PubMed] [Google Scholar].
Wahn U Bachert C Heinrich J Richter H Zielen S 白樺花粉関連アレルギー性鼻炎および喘息に対するアレルゲン免疫療法のリアルワールドでの利点。Allergy. 2019; 74: 594-604. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Bousquet J Jutel M Pfaar O Fonseca JA Agache I Czarlewski W Bachert C Bergmann KC Cruz AA Klimek L Kvedariene V Larenas-Linnemann DE Papadopoulos NG Patella V Regateiro FS Scichilone N Shamji MH Sheikh A Valovirta E Ventura MT Zuberbier T AITとその停止に対する患者層別におけるモバイルヘルステクノロジの役割。ARIA-EAACI Perspective。J Allergy Clin Immunol Pract. 2021; 9: 1805-1812. [PubMed] [Google Scholar].
Bousquet J Pfaar O Agache I Bedbrook A Akdis CA Canonica GW Chivato T Al-Ahmad M Abdul Latiff AH Ansotegui IJ Bachert C Baharuddin A Bergmann KC Bindslev-Jensen C Bjermer L Bonini M Bosnic-Anticevich S Bosse I Brough HA Brussino L ARIA-EAACI care pathways for allergen immunotherapy in respiratory allergy.(アレルギーのアレルゲン免疫療法のケアパス。Clin Transl Allergy. 2021; 11:e12014. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bédard A Basagaña X Anto JM Garcia-Aymerich J Devillier P Arnavielhe S Bedbrook A Onorato GL Czarlewski W Murray R Almeida R Fonseca JA Correia da Sousa J Costa E Morais-Almeida M Todo-Bom A Cecchi L De Feo G Illario Menditto E モバイル技術による花粉シーズン時と外時のアレルギー性鼻炎治療法について。MASK研究。Clin Transl Allergy. 2020; 10: 62. [PMC無料記事] [PubMed] [Google Scholar].
Pfaar O Sousa-Pinto B Devillier P Walter Canonica G Klimek L Zuberbier T Fonseca JA Bousquet J MASK-air研究におけるアレルゲン免疫療法の効果:概念実証の分析。Allergy. 2021; 76: 3212-3214. [PubMed][Google Scholar].
Bergmann KC Buters J Karatzas K Tasioulis T Werchan B Werchan M Pfaar O The development of birch pollen seasons over 30 years in Munich, Germany-An EAACI Task Force report.(ドイツ・ミュンヘンにおける30年間のシラカバ花粉シーズンの発展-EAACIタスクフォース報告書)。Allergy. 2020; 75: 3024-3026. [PubMed】【Google Scholar】。
Pfaar O Bastl K Berger U Buters J Calderon MA Clot B Darsow U Demoly P Durham SR Galán C Gehrig R Gerth van Wijk R Jacobsen L Klimek L Sofiev M Thibaudon M Bergmann KC Defining pollen exposure times for clinical trials of allergen immunotherapy for pollen induced rhinoconjunctivitis - an EAACI position paper. Allergy. 2017; 72: 713-722. [PubMed] [Google Scholar].
Karatzas K Katsifarakis N Riga M Werchan B Werchan M Berger U Pfaar O Bergmann KC New European Academy of Allergy and Clinical Immunology definition on pollen season mirrors symptom load for grass and birch pollen-induced allergic rhinitis.(花粉シーズンに関する新しい欧州アレルギー臨床免疫学会の定義は、草花と樺の花粉によるアレルギー性鼻炎の症状負荷を反映している。Allergy. 2018; 73: 1851-1859. [PubMed] [Google Scholar].
Bousquet PJ Brozek J Bachert C Bieber T Bonini S Burney P Calderon M Canonica GW Compalati E Daures JP Delgado L Demoly P Dahl R Durham SR Kowalski ML Malling HJ Merk H Papadopoulos N Passalacqua G Simon HU The CONSORT statement checklist in allergen-specific immunotherapy: a GA2LEN paper.日本アレルゲン学会誌[日本アレルゲン学会誌]、日本アレルゲン学会誌[日本アレルゲン学会誌]、日本アレルゲン学会誌[日本アレルゲン学会誌]。アレルギー。2009; 64: 1737-1745. [PubMed] [Google Scholar].
Bousquet PJ Calderon MA Demoly P Larenas D Passalacqua G Bachert C The Consolidated Standards of Reporting Trials (CONSORT) Statement applied to allergen-specific immunotherapy with inhalant allergens: a Global Allergy and Asthma European Network (GA(2)LEN) article. J Allergy Clin Immunol. 2011; 127: 59-56, 56 e41-11. [PubMed] [Google Scholar].
Brehler R Klimek L Kopp MV Christian Virchow J特異的免疫療法-適応と作用機序。Dtsch Arzteblイント2013; 110:148から158。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Wedi B Wieczorek D Kapp A [吸入性アレルゲンを用いたアレルゲン特異的免疫療法の臨床試験におけるプラセボ効果]. Hautarzt. 2017; 68: 297-306. [PubMed] [Google Scholar].
Frew AJ Pfaar O アレルゲン免疫療法におけるプラセボ効果:専門家の意見. Allergo J Int. 2018; 27: 162-166. [PMC無料記事] [PubMed] [Google Scholar].
Pfaar O Agache I Bergmann KC Bindslev-Jensen C Bousquet J Creticos PS Devillier P Durham SR Hellings P Kaul S Kleine-Tebbe J Klimek L Jacobsen L Jutel M Muraro A Papadopoulos NG Rief W Scadding GK Schedlowski M Shamji MH Placebo effects in allergen immunotherapy-An EAACI Task Force Position Paper.(アレルゲン免疫療法におけるプラシーボ効果-EAACIタスクフォースポジションペーパー)。Allergy. 2021; 76: 629-647. [PubMed] [Google Scholar].
Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz - AMG). このような場合、「逐次刊行物」に掲載されている「逐次刊行物」の内容を確認することが重要です。2005 年 12 月 (BGBl. I S. 3394) の改正により、2021 年 9 月 27 日 (BGBl. I S. 4530) 以降、2022 年 1 月 28 日まで変更されたものです。
Englert S May S Kaul S Vieths S Die Therapieallergene-Verordnung. Hintergrund und Auswirkungen. Bundesgesundheitsbl. 2012; 55: 351-357. [PubMed] [Google Scholar] 。
Mahler V Esch RE Kleine-Tebbe J Lavery WJ Plunkett G Vieths S Bernstein DI Understanding differences in allergen immunotherapy products and practices in North America and Europe(北米と欧州におけるアレルゲン免疫療法の製品と実践の違いを理解する。J Allergy Clin Immunol. 2019; 143: 813-828. [PubMed] [Google Scholar].
中~低規模の試験集団におけるアレルゲン製剤開発のためのガイドラインに関するコンセプトペーパー。EMA/CHMP/251023/2018 Rheumatology / Immunology Working Party (RIWP) (of 13th December 2018. https://www.ema.europa.eu/en/documents/scientific-guideline/concept-paper-guideline-allergen-products-development-moderate-low-sized-study-populations_en.pdf (Date of access April 12, 2022).より引用。
Incorvaia C Agostinis F Amoroso S Ariano R Barbato A Bassi M Cadario G Campi P Cardinale F Romano C Ciprandi G D'Anneo R Dal Bo S Di Gioacchino M Fiocchi A Galimberti M Galli E Giovannini M La Grutta S Lombardi C Pharmacoeconomics of subcutaneous allergen immunotherapy(皮下アレルゲン免疫療法の医療経済). ユーロアンアレルギークリニックイミュノール。2007; 39: 17-20. [PubMed] [Google Scholar] 。
オーガスティンMで。Klimek L、Vogelberg C、Werfel T(Hrsg)。Weißbuch Allergie in Deutschland. 4. überarb.とerw. Aufl. München: Springer Medizin Verlag; 2018; 52-60. [Google Scholar】をご参照ください。]
Böcking C Renz H Pfefferle PI [Prevalence and socio-economic relevance of allergies in Germany]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2012; 55: 303-307. [PubMed] [Google Scholar].
Jutel M Agache I Bonini S Burks AW Calderon M Canonica W Cox L Demoly P Frew AJ O'Hehir R Kleine-Tebbe J Muraro A Lack G Larenas D Levin M Martin BL Nelson H Pawankar R Pfaar O van Ree R Allergen Immunotherapy IIに関する国際コンセンサス:メカニズム、標準化、薬剤経済性.日本アレルギー学会誌, pp. J Allergy Clin Immunol. 2016; 137: 358-368. [PubMed] [Google Scholar].
Lamb CE Ratner PH Johnson CE Ambegaonkar AJ Joshi AV Day D Sampson N Eng B Employer perspective from the United States compared to select medical conditionsアレルギー性鼻炎による職場の生産性低下の経済的影響(米国)。Currメッドレズオピン。2006; 22: 1203-1210. [PubMed] [Google Scholar] 。
Klimek L Chaker AM Mösges R [アレルギー疾患のコストとアレルゲン特異的免疫療法による保存の可能性。個人的な評価]。HNO. 2017; 65: 801-810. [PubMed] [Google Scholar].
Shaaban R Zureik M Soussan D Neukirch C Heinrich J Sunyer J Wjst M Cerveri I Pin I Bousquet Jarvis D Burney PG Neukirch F Leynaert B Rhinitis and onset of asthma: a longitudinal population-based study. Lancet。2008; 372: 1049-1057. [PubMed] [Google Scholar] 。
Möller C Dreborg S Ferdousi HA Halken S Høst A Jacobsen L Koivikko A Koller DY Niggemann B Norberg LA Urbanek R Valovirta E Wahn U花粉免疫療法は、季節性鼻結膜炎(PAT-研究)と子供の喘息の開発を削減します。Jアレルギー臨床免疫学。2002; 109: 251-256. [PubMed] [Google Scholar] 。
Valovirta E Petersen TH Piotrowska T Laursen MK Andersen JS Sørensen HF Klink R Varga E-M Huttegger I Agertoft L Halken S Jørgensen M Hansen LG Cronjäger R Hansen KS Petersen TH Rubak S Valovirta E Csonka P Mickelsson O Results from the 5-year SQ grass sublingual immunotherapy tablet asthma prevention (GAP) trial in child with grass pollen allergies. J Allergy Clin Immunol. 2018; 141: 529-538.e13. [PubMed] [Google Scholar].
Hagen A Gorenoi V Schönermark MP アレルギー性鼻炎の治療における特異的免疫療法(SIT). GMSの保健技術アセスメント。2010; 6:Doc01。[PMC無料記事] [PubMed][Googleスカラー]。
Ronaldson S Taylor M Bech PG Shenton R Bufe A 小児におけるSQ規格のイネ科アレルギー免疫療法錠(グラザックス®)の経済評価。クリニコン・アウトカムズ・レズ 2014; 6: 187-196. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Brüggenjürgen B Reinhold T オーストリア、スペイン、スイスにおける草花皮下免疫療法(SCIT)と舌下免疫療法(SLIT)および対症療法の費用対効果を比較した結果。J Med Econ. 2018; 21: 374-381. [PubMed] [Google Scholar].
Westerhout KY Verheggen BG Schreder CH Augustin M ドイツにおける草花アレルギー性鼻結膜炎患者に対する免疫療法の費用対効果分析. 2012; 15: 906-917。[PubMed] [Google Scholar] 。
Richter AK Klimek L Merk HF Mülleneisen N Renz H Wehrmann W Werfel T Hamelmann E Siebert U Sroczynski G Wasem J Biermann-Stallwitz J 治療率の上昇が呼吸器アレルギーにおける皮下免疫療法(SCIT)の費用効果に与える影響:決定分析モデルによるアプローチ. Eur J Health Econ. 2018; 19: 1229-1242. [PubMed] [Google Scholar].
Titulaer J Arefian H Hartmann M Younis MZ Guntinas-Lichius O アレルギー性鼻炎治療のコストエフェクティブネス。探索的研究。SAGE Open Med. 2018; 6: 2050312118794588. [PMC無料論文] [PubMed] [Google Scholar].
Ellis AK Gagnon R Hammerby E Lau A カナダにおけるハウスダストマイトアレルギー性鼻炎の治療における舌下免疫療法錠:治療費を最小化するための代替案?Allergy Asthma Clin Immunol. 2019; 15: 27. [PMCフリー記事] [PubMed] [Google Scholar].
Allen-Ramey F Mao J Blauer-Peterson C Rock M Nathan R Halpern R アレルギー免疫療法を受けるアレルギー性鼻炎患者の医療費:レトロスペクティブ観察研究. Curr Med Res Opin. 2017; 33: 2039-2047. [PubMed] [Google Scholar].
Asaria M Dhami S van Ree R Gerth van Wijk R Muraro A Roberts G Sheikh A アレルギー性鼻炎、喘息、食物アレルギーおよび毒物アレルギーの管理のためのアレルゲン免疫療法の医療経済分析。系統的な概要。Allergy. 2018; 73: 269-283. [PubMed] [Google Scholar].
Lombardi C Melli V Incorvaia C Ridolo E 季節性アレルギー性鼻炎に対する5草花粉錠による舌下免疫療法の薬理経済学. Clin Mol Allergy. 2017; 15: 5. [PMCフリー記事] [PubMed] [Google Scholar].
Schädlich PK Brecht JG ドイツにおけるアレルギー性鼻炎の特異的免疫療法と対症療法の経済評価. ファーマコエコノミクス。2000; 17: 37-52. [PubMed】【Google Scholar】。
Gurevitch J Koricheva J Nakagawa S Stewart G Meta-analysis and the science of research synthesis(グレビッチ J コリシェバ J 中川スチュワート G メタアナリシスと研究合成の科学)。Nature. 2018; 555: 175-182. [PubMed][Google Scholar].
Noordzij M Hooft L Dekker FW Zoccali C Jager KJ Systematic reviews and meta-analyses: when they are useful and when to be careful. Kidney Int. 2009; 76: 1130-1136. [PubMed] [Googleスカラー]。
Noordzij M Zoccali C Dekker FW Jager KJ Adding up the evidence: systematic reviews and meta-analyses. Nephron Clin Pract. 2011; 119: c310-c316. [PubMed] [Google Scholar].
このような場合、「システマティックレビューとメタアナリシスのための好ましい報告項目:PRISMA声明」を参照する必要があります。J Clin Epidemiol. 2009; 62: 1006-1012. [PubMed] [Google Scholar].
Moher D Shamseer L Clarke M Ghersi D Liberati A Petticrew M Shekelle P Stewart LA Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P) 2015 statement.を参考にした。Syst Rev. 2015; 4: 1. [PMCフリー論文] [PubMed] [Google Scholar].
Esterhuizen TM Thabane L Con: Meta-analysis: some key limitations and potential solutions. Nephrol Dial Transplant. 2016; 31: 882-885. [PubMed][Google Scholar].
Giang HTN Ahmed AM Fala RY Khattab MM Othman MHA Abdelrahman SAM Thao LP Gabl AEAE Elrashedy SA Lee PN Hirayama K Salem Huy NT 臨床試験の系統的レビューおよびメタ解析の著者が用いる方法論のステップ:横断的研究。BMC Med Res Methodol. 2019; 19: 164. [PMC無料記事] [PubMed] [Google Scholar].
Jutel M Agache I Bonini S Burks AW Calderon M Canonica W Cox L Demoly P Frew AJ O'Hehir R Kleine-Tebbe J Muraro A Lack G Larenas D Levin M Nelson H Pawankar R Pfaar O van Ree R Sampson Hアレルギー免疫療法に関する国際合意書。J Allergy Clin Immunol. 2015; 136: 556-568. [PubMed] [Google Scholar].
Moher D Hopewell S Schulz KF Montori V Gøtzsche PC Devereaux PJ Elbourne D Egger M Altman DG CONSORT 2010 Explanation and Elaboration(2010年版説明と推敲): 並行群間無作為化試験を報告するための更新されたガイドライン。J Clin Epidemiol. 2010; 63: e1-e37. [PubMed] [Google Scholar].
また、このような場合にも、「CONSORTステートメント」の改訂が必要である。Ann Intern Med. 2001; 134: 663-694. [PubMed] [Google Scholar] 。
Begg C Cho M Eastwood S Horton R Moher D Olkin I Pitkin R Rennie D Schulz KF Simel D Stroup DF Improving the quality of reporting of randomized controlled trials(無作為化比較試験の報告の質を改善する。CONSORTステートメント。JAMA。1996; 276: 637-639. [PubMed] [Google Scholar].
Calderón MA Casale TB Togias A Bousquet J Durham SR Demoly P Allergen-specific immunotherapy for respiratory allergies: from meta-analysis to registration and beyond. Jアレルギークリニックイミュノール。2011; 127: 30-38. [PubMed] [Google Scholar] 。
Compalati E Penagos M Tarantini F Passalacqua G Canonica GW 呼吸器アレルギーの特異的免疫療法:現在のメタアナリシスによる技術の現状。アンアレルギー喘息免疫学。2009; 102: 22-28. [PubMed] [Google Scholar] 。
Agache I Lau S Akdis CA Smolinska S Bonini M Cavkaytar O Flood B Gajdanowicz P Izuhara K Kalayci O Mosges R Palomares O Papadopoulos NG Sokolowska M Angier E Fernandez-Rivas M Pajno G Pfaar O Roberts GC Ryan D EAACI Guidelines on Allergen Immunotherapy: House Dust Mite-driven allergic asthma. Allergy. 2019; 74: 855-873. [PubMed] [Google Scholar].
Sturm GJ Varga EM Roberts G Mosbech H Bilò MB Akdis CA Antolín-Amérigo D Cichocka-Jarosz E Gawlik R Jakob T Kosnik M Lange J Mingomataj E Mitsias DI Ollert M Oude Elberink JNG Pfaar O Pitsios C Pravettoni V Ruëff F EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2018; 73: 744-764. [PubMed] [Google Scholar].
Larenas-Linnemann DES Antolín-Amérigo D Parisi C Nakonechna A Luna-Pech JA Wedi B Davila I Gómez M Levin M Ortega Martell JA Klimek L Rosario N Muraro AM Agache I Bousquet J Sheikh A Pfaar O アレルゲン免疫療法の国家臨床実践指針。AGREE-IIを適用した国際的な評価。Allergy. 2018; 73: 664-672. [PubMed] [Google Scholar].
Caimmi D Calderon MA Bousquet J Demoly P Allergen Immunotherapy Outcomes and Unmet Needs: A Critical Review. Immunol Allergy Clin North Am. 2016; 36: 181-189. [PubMed] [Google Scholar].
Makatsori M Pfaar O Calderon MA アレルゲン免疫療法:臨床成績評価。J Allergy Clin Immunol Pract. 2014; 2: 123-129, quiz 130... [PubMed] [Google Scholar].
Bender BG Oppenheimer J 舌下免疫療法のノンアドヒアランスという特別な課題。J Allergy Clin Immunol Pract. 2014; 2: 152-155. [PubMed][Google Scholar].
Dhami S Nurmatov U Arasi S Khan T Asaria M Zaman H Agarwal A Netuveli G Roberts G Pfaar O Muraro A Ansotegui IJ Calderon M Cingi C Durham S van Wijk RG Halken S Hamelmann E Hellings P Jacobsen L Allergen immunotherapy for allergic rhinoconjunctivitis: システマティックレビューとメタアナリシス。Allergy. 2017; 72: 1597-1631. [PubMed][Google Scholar].
Nurmatov U Dhami S Arasi S Roberts G Pfaar O Muraro A Ansotegui IJ Calderon M Cingi C Durham S van Wijk RG Halken S Hamelmann E Hellings P Jacobsen L Knol E Larenas-Linnemann D Lin SY Maggina V Oude-Elberink H Allergen immunotherapy for allergic rhinoconjunctivitis: a systematic overview of systematic reviews.アレルギーの免疫療法:アレルギー性鼻・結膜炎の免疫療法:システマティックレビューの概要。Clin Transl Allergy. 2017; 7: 24. [PMC無料記事] [PubMed] [Google Scholar].
Dhami S Kakourou A Asamoah F Agache I Lau S Jutel M Muraro A Roberts G Akdis CA Bonini M Cavkaytar O Flood B Gajdanowicz P Izuhara K Kalayci Ö Mosges R Palomares O Pfaar O Smolinska S Sokolowska M Allergen immunotherapy for allergic asthma.Analogin[1][2][3][4][5][6][7]。システマティックレビューとメタアナリシス。Allergy. 2017; 72: 1825-1848. [PubMed][Google Scholar].
Asamoah F Kakourou A Dhami S Lau S Agache I Muraro A Roberts G Akdis C Bonini M Cavkaytar O Flood B Izuhara K Jutel M Kalayci Ö Pfaar O Sheikh A Allergen immunotherapy for allergic asthma: a systematic overview of systematic reviews.アレルゲン喘息に対する免疫療法:システマティックレビュー。Clin Transl Allergy. 2017; 7: 25. [PMCフリー記事] [PubMed] [Google Scholar].
Nurmatov U Dhami S Arasi S Pajno GB Fernandez-Rivas M Muraro A Roberts G Akdis C Alvaro-Lozano M Beyer K Bindslev-Jensen C Burks W du Toit G Ebisawa M Eigenmann P Knol E Makela M Nadeau KC O'Mahony L Papadopoulos N IgE媒介食物アレルギーのアレルゲン免疫療法: システマティックレビューとメタアナリシス(A systematic review and meta-analysis)(Clin Transl-Allergy. Allergy. 2017; 72: 1133-1147. [PubMed] [Google Scholar].
Chu DK Wood RA French S Fiocchi A Jordana M Waserman S Brożek JL Schünemann HJ ピーナッツアレルギーに対する経口免疫療法(PACE):有効性と安全性に関する系統的レビューおよびメタ分析。Lancet. 2019; 393: 2222-2232. [PubMed] [Google Scholar].
Dhami S Zaman H Varga EM Sturm GJ Muraro A Akdis CA Antolín-Amérigo D Bilò MB Bokanovic D Calderon MA Cichocka-Jarosz E Oude Elberink JN Gawlik R Jakob T Kosnik M Lange J Mingomataj E Mitsias DI Mosbech H Ollert M Allergen immunotherapy for insect venom allergy: a systematic review and meta-analysis. Allergy. 2017; 72: 342-365. [PubMed] [Google Scholar].
Tam HH Calderon MA Manikam L Nankervis H Núñez IG Williams HC Durham SR Boyle RJ アトピー性湿疹の治療に対する特異的アレルゲン免疫療法:Cochrane systematic review(コクラン系統的レビュー)。Allergy. 2016; 71: 1345-1356. [PubMed][Google Scholar].
Fortescue R Kew KM Leung MST Sublingual immunotherapy for asthma(喘息に対する舌下免疫療法)。Cochrane Database Syst Rev. 2020; 9: CD011293. [PMC フリーアーティクル] [PubMed] [Google Scholar].
デイビスJM草の花粉アレルゲンは、グローバル:アレルギー性呼吸器疾患の負担に亜熱帯の草の貢献。Clin Exp Allergy. 2014; 44: 790-801. [PubMed] [Google Scholar].
Bastl M Bastl K Dirr L Berger M Berger U 季節を通したイネ科花粉症症状の変動性。ウィーン(オーストリア)における2014年から2016年のPatient's Hayfever Diaryからの症状データプロファイルの比較。世界アレルギー臓器日報 2021; 14: 100518. [PMC無料論文] [PubMed] [Google Scholar].
Kopp MV Bovermann X Klimek L Accelerated Dose Escalation with three Injections of an Aluminum Hydroxide-Adsorbed Allergoid Preparation of Six Grasses Is Safe for Patients with Moderate to Severe Allergic Rhinitis. Int Arch Allergy Immunol. 2020; 181: 94-102. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Frew AJ Powell RJ Corrigan CJ Durham SR Group UKIS Efficacy and safety of specific immunotherapy with SQ allergen extract in treatment-resistant seasonal allergic rhinoconjunctivitis.(治療抵抗性季節性アレルギー性結膜炎におけるSQアレルゲン抽出物による特異的免疫療法の有効性と安全性). J Allergy Clin Immunol. 2006; 117: 319-325. [PubMed][Google Scholar].
Corrigan CJ Kettner J Doemer C Cromwell O Narkus A Study G Efficacy and safety of preseasonal-specific immunotherapy with an aluminium-adsorbed six-grass pollen allergoid. Allergy. 2005; 60: 801-807. [PubMed] [Google Scholar] 。
DuBuske LM Frew AJ Horak F Keith PK Corrigan CJ Aberer W Holdich T von Weikersthal-Drachenberg KJ Ultrashort-specific immunotherapy successfully treat seasonal allergic rhinoconjunctivitis to grass pollen(超短時間特異的免疫療法は、イネ科花粉に対する季節性アレルギー性鼻・結膜炎をうまく治療する。アレルギー喘息プロクセス。[PubMed] [Google Scholar].
Brewczynski P Kroon A Wirksamkeit unf Verträglichkeit einer Immuntherapie mit modifizierten Gräserpollenallergenen. Allergologie。1999; 22: 411-420. [Google Scholar】。]
Dolz I Martínez-Cócera C Bartolomé JM Cimarra M草花エキスAlutard SQの免疫療法の二重盲検、プラセボ対照試験で、最初のラッシュ免疫療法で3年間の期間中です。アレルギー。1996; 51: 489-500. [PubMed] [Google Scholar] 。
ウォーカーSM Pajno GBリマMTウィルソンDRダーラムSR季節性鼻炎や喘息のための草の花粉の免疫療法:無作為化比較試験。Jのアレルギー臨床免疫学。2001; 107: 87-93. [PubMed] [Googleスカラー]。
Schmid JM Würtzen PA Siddhuraj P Jogdand P Petersen CG Dahl R Erjefält JS Hoffmann HJ Basophil sensitivity reflects long-term clinical outcome of subcutaneous immunotherapy in grass pollen-allergic patients. アレルギー。2021; 76: 1528-1538. [PubMed】【Google Scholar】。
Bozek A Kolodziejczyk K Krajewska-Wojtys A Jarzab J 季節前、皮下免疫療法:草アレルギーの高齢患者における二重盲検、プラセボ対照試験。Ann Allergy Asthma Immunol. 2016; 116: 156-161. [PubMed][Google Scholar].
Pfaar O Hohlfeld JM Al-Kadah B Hauswald B Homey B Hunzelmann N Schliemann S Velling P Worm M Klimek L Dose-response relationship of a new Timothy grass pollen allergoid in comparison with a 6-grass pollen allergoid. Clin Exp Allergy. 2017; 47: 1445-1455. [PubMed] [Google Scholar].
Kopp MV König IR Friedrichs F Umpfenbach HU Niggemann B Millner-Uhlemann M 小児における皮下特異的免疫療法のための6種類のアレルゲンエキスの比較。オープンラベル、プロスペクティブ、コントロールされた観察的試験。Int Arch Allergy Immunol. 2019; 180: 284-290. [PubMed] [Google Scholar].
Jacobsen L Niggemann B Dreborg S Ferdousi HA Halken S Høst A Koivikko A Norberg LA Valovirta E Wahn U Möller C Specific immunotherapy has long-term preventive effect of seasonal and perennial asthma: PAT研究の10年間のフォローアップ。アレルギー。2007; 62: 943-948. [PubMed] [Google Scholar] 。
シュミットJシュヴァルツKシュタドラーE Wüstenberg EGアレルギー性鼻炎のためのアレルギー免疫療法は、効果的に喘息を防ぐことができます。大規模なレトロスペクティブコホート研究からの結果。J Allergy Clin Immunol. 2015; 136: 1511-1516. [PubMed] [Google Scholar].
Didier A Malling HJ Worm M Horak F Jäger S Montagut A André C de Beaumont O Melac M 季節性アレルギー性鼻炎に対する5草花粉錠による1日1回舌下免疫療法の最適な用量、有効性および安全性。J Allergy Clin Immunol. 2007; 120: 1338-1345. [PubMed] [Google Scholar].
Durham SR Yang WH Pedersen MR Johansen N Rak S 1日1回イネ科アレルゲンタブレットによる舌下免疫療法:季節性アレルギー性鼻結膜炎における無作為化比較試験(A randomized controlled trial in seasonal allergic rhinoconjunctivitis). Jアレルギー臨床免疫学。2006; 117: 802-809. [PubMed] [Google Scholar] 。
Nelson HS Nolte H Creticos P Maloney J Wu J Bernstein DI Efficacy and safety of timothy grass allergy immunotherapy tablet treatment in North American adults(北米成人におけるチモシー草アレルギー免疫療法タブレット治療の効果と安全性)。J Allergy Clin Immunol. 2011; 127: 72-80, 80 e71-72. [PubMed】【Google Scholar】。
Canonica GW Cox L Pawankar R Baena-Cagnani CE Blaiss M Bonini S Bousquet J Calderón M Compalati E Durham SR van Wijk RG Larenas-Linnemann D Nelson H Passalacqua G Pfaar O Rosário N Ryan D Rosenwasser L Schmid-Grendelmeier P Senna G Sublingual immunotherapy(舌下免疫療法): 世界アレルギー機関ポジションペーパー2013年版更新。世界アレルギー機関J. 2014; 7: 6. [PMC無料記事] [PubMed] [Google Scholar].
Calderon M Mösges R Hellmich M Demoly P 特定草本花粉免疫療法におけるエビデンスベースの医療に向けて。アレルギー。2010; 65: 420-434. [PubMed] [Googleスカラー]。
Wahn U Tabar A Kuna P Halken S Montagut A de Beaumont O Le Gall M Efficacy and safety of 5-grass-pollen sublingual immunotherapy tablets in pediatric allergic rhinoconjunctivitis(小児アレルギー性鼻閉症における5草花舌下免疫療法の有効性と安全性)。J Allergy Clin Immunol. 2009; 123: 160-166.e3. [PubMed] [Google Scholar] 。
Bufe A Eberle P Franke-Beckmann E Funck J Kimmig M Klimek L Knecht R Stephan V Tholstrup B Weisshaar C Kaiser F SQ標準化イネ科アレルゲン錠の舌下免疫療法における小児の安全性と有効性。Jのアレルギー臨床免疫学。2009; 123: 167-173.e7. [PubMed] [Google Scholar] 。
Blaiss M Maloney J Nolte H Gawchik S Yao R Skoner DP Efficacy and safety of timothy grass allergy immunotherapy tablets in North American children and adolescents(北米の小児および青年におけるチモシー草アレルギー免疫療法用錠剤の有効性および安全性。J Allergy Clin Immunol. 2011; 127: 64-71, 71 e61-64. [PubMed] [Google Scholar].
Didier A Malling HJ Worm M Horak F Sussman G Melac M Soulié S Zeldin RK 草花粉によるアレルギー性鼻結膜炎の成人における300IR 5-草花粉舌下錠による治療中断の後効果。Clin Exp Allergy. 2013; 43: 568-577. [PubMed] [Google Scholar].
Durham SR Emminger W Kapp A Colombo G de Monchy JG Rak S S SQ標準化イネ科アレルギー免疫療法錠による治療後のイネ科花粉誘発性鼻結膜炎の長期臨床効果。J Allergy Clin Immunol. 2010; 125: 131-138. [PubMed] [Google Scholar] 。
Durham SR Emminger W Kapp A de Monchy JG Rak S Scadding GK Wurtzen PA Andersen JS Tholstrup B Riis B Dahl R SQ-standardized草アレルギー舌下免疫療法:無作為試験における3年間の治療後2年間の疾患修飾の確認。J アレルギー臨床免疫学。2012; 129: 717-725.e5. [PubMed][Google Scholar].
ワームMは鼻結膜炎患者における高用量舌下免疫療法の有効性と忍容性。Eur Ann Allergy Clin Immunol. 2006; 38: 355-360. [PubMed] [Google Scholar] 。
Wahn U Klimek L Ploszczuk A Adelt T Sandner B Trebas-Pietras E Eberle P Bufe A High-dose sublingual immunotherapy with single-dose aqueous grass pollen extract in children is effective and safe: a double-blind, placebo-controlled study. J Allergy Clin Immunol. 2012; 130: 886-93.e5. [PubMed][Google Scholar].
オットH Sieber J Brehler R Fölster-Holst R Kapp A Klimek L Pfaar O Merk H草花下舌下免疫療法の3シーズン連続と治療停止後の有効性:ECRIT研究。アレルギー。2009; 64: 179-186. [PubMed] [Google Scholar] 。
Pfaar O Klimek L Efficacy and safety of specific immunotherapy with a high dose sublingual grass pollen preparation: a double-blind, placebo-controlled trial.イネ科花粉の高用量舌下製剤による特異的免疫療法の有効性と安全性。アンアレルギー喘息免疫学。2008; 100: 256-263. [PubMed] [Google Scholar].
Di Rienzo V Marcucci F Puccinelli P Parmiani S Frati F Sensi L Canonica GW Passalacqua G ハウスダストマイトによる喘息児における舌下免疫療法の長期的効果:10年間のプロスペクティブスタディ。Clin Exp Allergy. 2003; 33: 206-210. [PubMed] [Google Scholar] 。
Novmbre E Galli E Landi F Caffarelli C Pifferi M De Marco E Burastero SE Calori G Benetti L Bonazza P Puccinelli P Parmiani S Bernardini R Vierucci A Coseasonal sublingual immunotherapy reduces development of asthma in children with allergic rhinoconjunctivitis. J Allergy Clin Immunol. 2004; 114: 851-857. [PubMed] [Google Scholar] 。
Marogna M Spadolini I Massolo A Canonica GW Passalacqua G実生活における呼吸器アレルギーに対する舌下免疫療法のランダム化比較オープンスタディ:臨床効果など。Allergy. 2004; 59: 1205-1210. [PubMed] [Googleスカラー]。
Devillier P Wahn U Zielen S Heinrich J草花舌下免疫療法錠は草花関連アレルギー性鼻炎の長期的緩和と喘息リスクの低減をもたらす:レトロスペクティブ、リアルワールドのデータベースサブ分析からの知見。Expert Rev Clin Immunol. 2017; 13: 1199-1206. [PubMed] [Google Scholar].
Buhl R Bals R Baur X Berdel D Criée CP Gappa M Gillissen A Greulich T Haidl P Hamelmann E Kardos P Kenn K Klimek L Korn S Lommatzsch M Magnussen H Nicolai T Nowak D Pfaar O Rabe KF〔喘息の診断と治療に関するガイドライン-ドイツ呼吸器学会とドイツAtemwegsligaのガイドラインと小児呼吸器学会とオーストリア肺科学学会の協力〕. Pneumologie. 2017; 71: e2. [PubMed] [Google Scholar].
Bundesärztekammer (BÄK). Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF).の項を参照。Nationale VersorgungsLeitlinie Asthma - Langfassung, 4. Auflage. バージョン1. 2020 [引用: 2021-09-22].
喘息に対するグローバル・イニシアティブ(GINA)編。喘息の管理と予防のための世界戦略(2020年更新)www.ginasthma.org/gina-reports/.
Abramson MJ Puy RM Weiner JM Injection allergen immunotherapy for asthma(喘息に対する注射アレルゲン免疫療法)。Cochrane Database Syst Rev. 2010; CD001186. [PubMed】。]
ロバーツGハーリーC Turcanu VラックG小児季節性アレルギー性喘息の効果的な治療法として草の花粉の免疫療法。Jアレルギー・クリニック・イミュノール。2006; 117: 263-268. [PubMed] [Google Scholar] 。
Virchow JC Backer V Kuna P Prieto L Nolte H Villesen HH Ljørring C Riis B de Blay F Efficacy of a House Dust Mite Sublingual Allergen Immunotherapy Tablet in Adults with Allergic Asthma(アレルギー性喘息患者におけるダニ舌下アレルゲン免疫療法タブレットの有効性。無作為化臨床試験。JAMA. 2016; 315: 1715-1725. [PubMed] [Google Scholar].
Dahl R Stender A Rak S 鼻結膜炎を有する喘息患者におけるSQ標準化イネ科アレルゲンタブレットによる特異的免疫療法。アレルギー。2006; 61: 185-190. [PubMed] [Google Scholar] 。
Stelmach私Kaczmarek - Woźniak J Majak P Olszowiec - Chlebna M Jerzynska Jの有効性と安全性高用量舌下免疫療法の超ラッシュ方式で草の花粉にアレルギーがある子供たち。臨床Expアレルギー。2009; 39: 401-408. [PubMed] [Googleスカラー] 。
シュミットJ Wüstenberg E Küster D Mücke V Serup -ハンセンN Tesch F喘息の進行におけるアレルギー免疫療法の緩和な役割。人口ベースのコホート研究の結果。アレルギー。2020; 75: 596-602. [PubMed】【Google Scholar】。
Couroux P Ipsen H Stage BS Damkjaer JT Steffensen MA Salapatek AM Lund K Würtzen PA A birch sublingual allergy immunotherapy tablet reduces rhinoconjunctivitis symptoms when exposed to birch and oak and in the birch homologous group all trees allergens to IgG induce a birch. Allergy. 2019; 74: 361-369. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Arvidsson MB Löwhagen O Rak S 白樺花粉症患者における2年間のプラセボ対照免疫療法の気道症状および投薬に対する影響。Jのアレルギー臨床免疫学。2002; 109: 777-783. [PubMed] [Google Scholar] 。
Balda BR Wolf H Baumgarten C Klimek L Rasp G Kunkel G Müller S Mann W Hauswald B Heppt W Przybilla B Amon U Bischoff R Becher G Hummel S Frosch PJ Rustemeyer T Jäger L Brehler R Luger T 木花粉症は分子標準アレルゲン7本のプレシーズナル注入による短期免疫療法(STI)で効率的に治療できることが明らかになった。Allergy. 1998; 53: 740-748. [PubMed] [Google Scholar] 。
Bødtger U Poulsen LK Jacobi HH Malling HJ The subcutaneous birch pollen immunotherapy の安全性と効果-1年間の無作為化二重盲検プラセボ対照試験。Allergy. 2002; 57: 297-305. [PubMed] [Google Scholar] 。
Höiby AS Strand V Robinson DS Sager A Rak S Depigoid白樺花粉抽出物による2年間の免疫療法の有効性、安全性、および免疫学的効果:無作為化二重盲検プラセボ対照試験。Clin Exp Allergy. 2010; 40: 1062-1070. [PubMed] [Google Scholar].
Pfaar O Robinson DS Sager A Emuzyte R 脱色素重合混合樹木花粉抽出物による免疫療法:臨床試験とレスポンダー分析。Allergy. 2010; 65: 1614-1621. [PubMed] [Google Scholar] 。
Drachenberg KJ Heinzkill M Urban E Kurzzeit-Immuntherapie mit Baumpollen-Allergoiden und dem Adjuvanz Monophosphoryl Lipid A. Ergebnisse einer randomisierten, doppelblinden, plazebokontrollierten Multicenterstudie. Allergologie。2002; 25: 466-474. [Google Scholar].
Khinchi MS Poulsen LK Carat F André C Hansen AB Malling HJ 白樺花粉アレルゲン特異的舌下および皮下免疫療法の臨床的有効性:無作為プラセボ対照二重盲検ダミー試験(ALP). Allergy. 2004; 59: 45-53. [PubMed] [Google Scholar].
Worm M Rak S de Blay F Malling HJ Melac M Cadic V Zeldin RK Sustained efficacy and safety of a sublingual solution of birch pollen allergen extract in adults with allergic rhinoconjunctivitis: results of a double-blind, placebo-controlled study. Clin Transl Allergy. 2014; 4: 7. [PMCフリー論文] [PubMed] [Google Scholar].
Mösges R Graute V Christ H Sieber HJ Wahn U Niggemann B 樹木花粉症喘息児における舌下免疫療法の超急速滴定の安全性。小児科アレルギー免疫学。2010; 21: 1135-1138. [PubMed] [Google Scholar] 。
Pfaar O van Twuijver E Boot JD Opstelten DJ Klimek L van Ree R Diamant Z Kuna P Panzner P A randomized DBPC trial to determine the optimal effective and safe dose of a SLIT-birch pollen extract for the treatment of allergic rhinitis: results of a phase II study. Allergy. 2016; 71: 99-107. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Pfaar O Bachert C Kuna P Panzner P Džupinová M Klimek L van Nimwegen MJ Boot JD Yu D Opstelten DJE de Kam PJ 喘息を伴うまたは伴わない季節性アレルギー性鼻結膜炎患者における液体カバノキ花粉製品によるアレルゲン舌下免疫療法。J Allergy Clin Immunol. 2019; 143: 970-977. [PubMed] [Google Scholar].
Biedermann T Kuna P Panzner P Valovirta E Andersson M de Blay F Thrane D Jacobsen SH Stage BS Winther L The SQ tree SLIT-tablet is highly effective and well tolerated: 無作為化二重盲検プラセボ対照第III相試験の結果。J Allergy Clin Immunol. 2019; 143: 1058-1066.e6. [PubMed] [Google Scholar].
Worm M Rak S Samoliński B Antila J Höiby AS Kruse B Lipiec A Rudert M Valovirta E Efficacy and safety of birch pollen allergoid subcutaneous immunotherapy: 2年間の二重盲検、プラセボ対照、無作為化試験と1年間の非盲検延長試験。Clin Exp Allergy. 2019; 49: 516-525. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Worm M Higenbottam T Pfaar O Mösges R Aberer W Gunawardena K Wessiepe D Lee D Kramer MF Skinner M Lees B Zielen S Randomized controlled trials define shape of dose response for Pollinex Quattro Birch allergoid immunotherapy。Allergy. 2018; 73: 1812-1822. [PMCフリーアーティクル] [PubMed] [Google Scholar].
165.ヴァン・ハーゲ・ハムステンMヨハンソンSG貯蔵ダニ。Exp Appl Acarol. 1992; 16: 117-128. [PubMed] [Google Scholar] 。Koch L Laipold K Arzt-Gradwohl L Čerpes U Sturm EM Aberer W Sturm GJハウスダストマイトアレルギーにおけるIgE多重検査は有用であり、感度は抽出物ベースのシングルプレックステストと同等である。Allergy. 2020; 75: 2091-2094. [PMC無料記事] [PubMed] [Google Scholar].
Haugaard L Dahl R Jacobsen L A controlled dose-response study of immunotherapy with standardized, partially purified extract of house dust mite: clinical efficacy and side effects. J Allergy Clin Immunol. 1993; 91: 709-722. [PubMed] [Google Scholar] 。
Moreno V Alvariño M Rodríguez F Roger A Peña-Arellano MI Lleonart R Pagán JA Navarro JA Navarro LA Vidal C Ponte-Tellechea A Gómez-Fernández MC Madariaga-Goirigolzarri B Asturias JA Hernández-Fernandez de Rojas D Randomized dose-response study of subcutaneous immunotherapy with the Dermatophagoides pteronyssinus extract in patients with respiratory allergy. Immunotherapy. 2016; 8: 265-277. [PubMed] [Google Scholar].
Pfaar O Nell MJ Boot JD Versteeg SA van Ree R Roger A Riechelmann H Sperl A Oude Elberink JN Diamant Z Bachert C A randomized, 5-arm dose finding study with a mite allergoid SCIT in allergic rhinoconjunctivitis patients。Allergy. 2016; 71: 967-976. [PubMed] [Google Scholar].
Jutel M Rudert M Kreimendahl F Kuna P Efficacy and tolerability of a house dust mite allergoid in allergic bronchial asthma: a randomized dose-anging trial. Immunotherapy. 2018; 10: 1149-1161. [PubMed] [Google Scholar].
Pfaar O Gerth van Wijk R ミテアレルギー性鼻炎:アレルゲン特異的免疫療法試験における臨床的有効性をどのように評価するのか?Curr Treat Options Allergy. 2015; 2: 1-9. [PMC無料記事] [PubMed] [Google Scholar].
Pichler CE Marquardsen A Sparholt S Løwenstein H Bircher A Bischof M Pichler WJ Dermatophagoides pteronyssinus と D. farinae による特異的免疫療法により、気管支の過剰反応性が低下する。アレルギー。1997; 52: 274-283. [PubMed] [Google Scholar] 。
Riechelmann H Schmutzhard J van der Werf JF Distler A Kleinjans HA有効性とアレルギー性鼻炎のグルタルアルデヒド修飾ハウスダストマイト抽出物の安全性。Am J Rhinol Allergy。2010; 24: e104-e109. [PubMed] [Google Scholar] 。
バーニー VA Tabbah K Mavroleon G Frew AJ ハウスダストマイトによって誘発された重度の通年性アレルギー性鼻炎患者における特異的免疫療法の有用性:二重盲検、無作為化、プラセボ対照試験。Clin Exp Allergy. 2003; 33: 1076-1082. [PubMed] [Google Scholar] 。
Huang Y Wang C Wang X Zhang L Lou H Efficacy and safety of subcutaneous immunotherapy with house dust mite for allergic rhinitis: 無作為化対照試験のメタアナリシス。Allergy. 2019; 74: 189-192. [PubMed] [Google Scholar].
Li J Wu Y Yang Y Huang N Li W Zhang S Jiang Q Yang L Zhu R アレルギー性鼻炎に対する2つの市販ハウスダストマイト抽出物の有効性と安全性:ヘッドツーヘッドスタディ. Int Forum Allergy Rhinol. 2019; 9: 876-882. [PubMed] [Google Scholar].
Yukselen A Kendirli SG Yilmaz M Altintas DU Karakoc GB 皮下および舌下免疫療法を受けたダニに単感作された小児の臨床および炎症パラメータの2年間のフォローアップ。Asian Pac J Allergy Immunol. 2013; 31: 233-241. [PubMed] [Google Scholar].
Jutel M Brüggenjürgen B Richter H Vogelberg C ハウスダストマイトによるアレルギー性鼻炎および喘息における皮下アレルゲン免疫療法の実環境におけるエビデンス。Allergy. 2020; 75: 2050-2058. [PubMed】【Google Scholar】。
Mosbech H Deckelmann R de Blay F Pastorello EA Trebas-Pietras E Andres LP Malcus I Ljørring C Canonica GW Standardized quality (SQ) house dust mite sublingual immunotherapy tablet (ALK) reduces inhaled corticosteroid use while maintaining asthma control: a randomized, double-blind, placebo-controlled trial.モスベックHデッケルマンRデブレーFパストレッロEAは喘息コントロールを維持しながら、吸入コルチコステロイドの使用を減少させる。J Allergy Clin Immunol. 2014; 134: 568-575.e7. [PubMed][Google Scholar].
Bergmann KC Demoly P Worm M Fokkens WJ Carrillo T Tabar AI Efficacy and safety of sublingual tablets of house dust mite allergen extracts in adults with allergic rhinitis(成人のアレルギー性鼻炎におけるダニアレルゲン抽出物の舌下錠の効果と安全性)。J Allergy Clin Immunol. 2014; 133: 1608-1614 e1606. [PubMed][Google Scholar].
Roux M Devillier P Yang WH Montagut A Abiteboul K Viatte A Zeldin RK Efficacy and safety of sublingual tablets of house dust mite allergen extracts(ハウスダストマイトアレルゲン抽出物の舌下錠の効果と安全性。環境暴露室における用量範囲研究の結果。J Allergy Clin Immunol. 2016; 138: 451-458.e5. [PubMed][Google Scholar].
Hüser C Dieterich P Singh J Shah-Hosseini K Allekotte S Lehmacher W Compalati E Mösges R ハウスダストマイトアレルギー患者におけるモノマーアレルゴイド舌下錠による12週間のDBPC用量設定試験。Allergy. 2017; 72: 77-84. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Corzo JL Carrillo T Pedemonte C Plaza Martin AM Martín Hurtado S Dige E Calderon MA成人および小児におけるハウスダストマイトアレルギー免疫療法タブレットの二重盲検無作為化第I相試験中の忍容性を示す。J Investig Allergol Clin Immunol. 2014; 24: 154-161. [PubMed] [Googleスカラー]を参照してください。
Demoly P Emminger W Rehm D Backer V Tommerup L Kleine-Tebbe J ハウスダストマイトによるアレルギー性鼻炎のSQ HDM SLIT-tabletの2回投与による効果的な治療法。無作為化二重盲検プラセボ対照第III相試験の結果。J Allergy Clin Immunol. 2016; 137: 444-451.e8. [PubMed] [Google Scholar].
Masuyama K Okamoto Y Okamiya K Azuma R Fujinami T Riis B Ohashi-Doi K Natsui K Imai T Okubo K Efficacy and safety of SQ house dust mite sublingual immunotherapy-table in Japanese children. Allergy. 2018; 73: 2352-2363. [PubMed] [Google Scholar].
岡本 洋子 藤枝 聡 岡野 睦 吉田 祐子 角藤 聡 増山 圭一 ハウスダストマイト舌下錠はアレルギー性鼻炎患者において有効かつ安全である. Allergy. 2017; 72: 435-443. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Okubo K Masuyama K Imai T Okamiya K Stage BS Seitzberg D Efficacy and safety of the SQ house dust mite sublingual immunotherapy tablet in Japanese adults and adolescents with house dust mite-induced allergic rhinitis. J Allergy Clin Immunol. 2017; 139: 1840-1848 e1810. [PubMed][Google Scholar].
Nolte H Bernstein DI Nelson HS Kleine-Tebbe J Sussman GL Seitzberg D Rehm D Kaur A Li Z Lu S 北米の青年および成人におけるハウスダストマイト舌下免疫療法錠の有効性、無作為プラセボ対照試験で確認。J Allergy Clin Immunol. 2016; 138: 1631-1638. [PubMed] [Google Scholar].
Demoly P Corren J Creticos P De Blay F Gevaert P Hellings P Kowal K Le Gall M Nenasheva N Passalacqua G Pfaar O Tortajada-Girbés M Vidal C Worm M Casale TB A 300 IR sublingual tablet is an effective, safe treatment for house dust mite-induced allergic rhinitis: 国際的な二重盲検プラセボ対照無作為化第III相臨床試験。J Allergy Clin Immunol. 2021; 147: 1020-1030.e10. [PubMed】【Google Scholar】。
Feng B Xiang H Jin Hao J Huang S Shi Y Chen R Chen B House Dust Mite-Induced Allergic Rhinitisに対する舌下免疫療法の有効性: 無作為化対照試験のメタアナリシス。Allergy Asthma Immunol Res. 2017; 9: 220-228. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Maloney J Prenner BM Bernstein DI Lu S Gawchik S Berman G Kaur A Li Z Nolte H House Dust Mite sublingual immunotherapy standardized quality tablet in children allergic to house dust mitesの安全性について。Ann Allergy Asthma Immunol. 2016; 116: 59-65. [PubMed] [Google Scholar].
Aydogan M Eifan AO Keles S Akkoc T Nursoy MA Bahceciler NN Barlan IB ハウスダストマイトに単感作したアレルギー性鼻結膜炎の子どもにおける舌下免疫療法:二重盲検プラセボ対照無作為化試験。Respir Med. 2013; 107: 1322-1329. [PubMed] [Google Scholar].
Wang DH Chen L Cheng L Li KN Yuan H Lu JH Li H ハウスダストマイト誘発アレルギー性鼻炎における舌下免疫療法の作用発現の速さ:多施設、無作為化、二重盲検、プラセボ比較試験。Laryngoscope. 2013; 123: 1334-1340. [PubMed] [Google Scholar].
Ameal A Vega-Chicote JM Fernández S Miranda A Carmona MJ Rondón MC Reina E García-González JJ アレルギー性喘息におけるDermatophagoides pteronyssinusの改良アレルゲン抽出物の有効性および安全性を評価するための二重盲検プラシーボ対照試験。Allergy. 2005; 60: 1178-1183. [PubMed] [Google Scholar] 。
Olsen OT Larsen KR Jacobsan L Svendsen UG A 1-year, placebo-controlled, double-blind house-dust-mite immunotherapy study in asthmatic adults(喘息成人における1年間のプラセボ対照二重盲検ハウスダスト・ダニ免疫療法試験)。アレルギー。1997; 52: 853-859. [PubMed] [Google Scholar] 。
Wang H Lin X Hao C Zhang C Sun B Zheng J Chen P Sheng J Wu A Zhong N A double-blind, placebo-controlled study of house dust mite immunotherapy in Chinese asthmatic patients. Allergy. 2006; 61: 191-197. [PubMed] [Google Scholar] 。
García-Robaina JC Sánchez I de la Torre F Fernández-Caldas E Casanovas M Dermatophagoides pteronyssinus と Dermatophagoides farinae の改良版抽出物によるダニアレルギー性喘息の管理成功(二重盲検、プラシーボ比較試験にて。J Allergy Clin Immunol. 2006; 118: 1026-1032. [PubMed] [Google Scholar].
Blumberga G Groes L Haugaard L Dahl R 中等度および重症のハウスダストマイトアレルギー喘息患者におけるSQ標準化特異的免疫療法皮下投与のステロイド温存効果。アレルギー。2006; 61: 843-848. [PubMed] [Google Scholar] 。
Rosewich M Arendt S El Moussaoui S Schulze J Schubert R Zielen S Bronchial allergen provocation: a useful method to assess the efficacy of specific immunotherapy in children.小児アレルゲン誘発:小児における特異的免疫療法の有効性を評価する有用な方法。Pediatr Allergy Immunol. 2013; 24: 434-440. [PubMed】【Google Scholar】。
Zielen S Kardos P Madonini E Steroid-sparing effects with allergen-specific immunotherapy in children with asthma: a randomized controlled trial.小児喘息におけるアレルゲン特異的免疫療法によるステロイド節約効果。Jアレルギー臨床免疫学。2010; 126: 942-949. [PubMed] [Google Scholar] 。
岡宮啓子 関野裕子 東理恵 工藤正樹 坂口正樹 根本文男 村松直樹 前川由紀子 田中敦子 SQハウスダストマイト舌下免疫療法錠の日本人成人ハウスダストマイト誘発アレルギー性喘息における安全性プロファイル:無作為二重盲検プラセボ対照第1相試験.J Asthma. J Asthma. 2019; 56: 1347-1355. [PubMed] [Google Scholar].
Pham-Thi N Scheinmann P Fadel R Combebias A Andre C 薬物療法とダニ回避策によって最適にコントロールされているハウスダストマイト誘発性アレルギー性喘息の子どもにおける舌下免疫療法の有効性の評価。小児科アレルギー免疫学。2007; 18: 47-57. [PubMed] [Google Scholar] 。
Wang L Yin J Fadel R Montagut A de Beaumont O Devillier Pハウスダストマイト舌下免疫療法は安全であり、中等度の持続性喘息に有効であると思われる。Allergy. 2014; 69: 1181-1188. [PubMed][Google Scholar].
Niu CK Chen WY Huang JL Lue KH Wang JY Efficacy of sublingual immunotherapy with high-dose mite extracts in asthma: a multi-center, double-blind, randomized, and placebo-controlled study in Taiwan.台湾における高用量ダニ抽出物の舌下免疫療法の有効性. Respir Med. 2006; 100: 1374-1383. [PubMed] [Google Scholar] 。
Armentia-Medina A Tapias JA Martín JF Ventas P Fernández A 貯蔵ダニlepidoglyphus destructorによる免疫療法。Allergol Immunopathol(マドル)。1995; 23: 211-223. [PubMed] [Google Scholar] 。
Hemmer W Schauer U Trinca A-M Neumann C Prävalenz der Ragweedpollen-Allergie in Ostösterreich 2009 [cited 2019 September 9th, 2019]:[52 p.]. https://www.noel.gv.at/noe/Gesundheitsvorsorge-Forschung/Ragweedpollen_Allergie.pdf (Date of access: April 12, 2022).より引用。
Platts-Mills TA The allergy epidemics: 1870-2010(アレルギーの流行:1870-2010)。J Allergy Clin Immunol. 2015; 136: 3-13. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lake IR Jones NR Agnew M Goodess CM Giorgi F Hamaoui-Laguel L Semenov MA Solmon F Storkey J Vautard R Epstein MM Climate Change and Future Pollen Allergy in Europe(ヨーロッパにおける気候変動と将来の花粉症。エンバイロン・ヘルス・パースペクト。2017; 125: 385-391. [PMC無料記事] [PubMed] [Google Scholar].
Röseler STM Baron JM Höflich C Merk HF Bas M Bier H Dott W Fietkau K Hajdu Z Kaiser L Kraus T Laven G Moll-Slodowy S Mücke HG Straff Wurpts G Yazdi AS Chaker A Balakirski G "New" inhalant plant allergen. Allergol Select. 2020; 4: 1-10. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Boehme MWJ Kompauer I Weidner U Piechotowski I Gabrio T Behrendt H Atemwegsbeschwerden und Sensibilisierungen gegen Pollen von Ambrosia artemisiifolia und Beifuß bei Erwachsen in Süd-West-Deutschland.Atemsは、花粉を吸入する植物アレルギーを誘発する。Dtsch Med Wochenschr。 2013; 138: 1651-1658。[PubMed] [Google Scholar].
Grammer LC Shaughnessy MA Bernhard MI Finkle SM Pyle HR Silvestri L Patterson R The safety and activity of polymerized ragweed: a double-blind, placebo-controlled trial in 81 patients with ragweed rhinitis.Jアレルギー・クリニック・イムノル(JAA)誌(2012年7月)。Jアレルギー臨床免疫学。1987; 80: 177-183. [PubMed] [Google Scholar] 。
Patel P Holdich T Fischer von Weikersthal-Drachenberg KJ Huber B Efficacy of a short course of specific immunotherapy in patients with allergic rhinoconjunctivitis to ブタクサ花粉症患者における特異的免疫療法の短期間有効性。J Allergy Clin Immunol. 2014; 133: 605-616. [PubMed][Google Scholar].
Creticos PS Pfaar O ブタクサ舌下錠免疫療法:パートI-エビデンスに基づく臨床的有効性と安全性。Immunotherapy. 2018; 10: 605-616. [PubMed] [Google Scholar].
Nolte H Bernstein DI Nelson HS Ellis AK Kleine-Tebbe J Lu S Randomized, Placebo Controlled Trial in the Children with Allergic RhinoconjunctivitisにおけるRagweed SLIT-Tablet の有効性と安全性. J Allergy Clin Immunol Pract. 2020; 8: 2322-2331.e5. [PubMed][Google Scholar].
Nolte H Hébert J Berman G Gawchik S White M Kaur A Liu N Lumry W Maloney J 北米成人におけるブタクサアレルギー免疫療法錠の有効性と安全性に関する無作為化対照試験。Ann Allergy Asthma Immunol. 2013; 110: 450-456.e4. [PubMed】【Google Scholar】。
Creticos PS Maloney J Bernstein DI Casale T Kaur A Fisher R Liu N Murphy K Nékám K Nolte H 北米とヨーロッパの成人を対象としたブタクサアレルギー免疫療法タブレットの無作為化比較試験。J Allergy Clin Immunol. 2013; 131: 1342-9.e6. [PubMed】【Google Scholar】。
Nolte H Amar N Bernstein DI Lanier BQ Creticos P Berman G Kaur A Hébert J Maloney J短いブタクサ舌下免疫療法タブレットの安全性と忍容性。Ann Allergy Asthma Immunol. 2014; 113: 93-100.e3. [PubMed][Google Scholar].
Ariano R Kroon AM Augeri G Canonica GW Passalacqua G Parietariaを用いたアレルゲン免疫療法の長期治療。無作為化比較試験における臨床的および免疫学的効果。Allergy. 1999; 54: 313-319. [PubMed] [Google Scholar] 。
Ferrer M Burches E Peláez A Muñoz A Hernández D Basomba A Enrique E Alonso R Cisteró-Bahima A Martín S Rico P Gandarias B Parietaria judaica による免疫療法の二重盲検、プラセボ対照試験:臨床効果と耐性。J Investig Allergol Clin Immunol. 2005; 15: 283-292. [PubMed] [Google Scholar] 。
Vega-Maray AM Fernández-González D Valencia-Barrera R Suárez-Cervera M Urtica dioica, a member of the Urticaceae allergenic familyにおけるアレルギー誘発性タンパク質。Ann Allergy Asthma Immunol. 2006; 97: 343-349. [PubMed] [Google Scholar] 。
Gadermaier G Eichhorn S Vejvar E Weilnböck L Lang R Briza P Huber CG Ferreira F Hawranek T Plantago lanceolata: an important trigger of summer pollinosis with limited IgE cross-reactivity. J Allergy Clin Immunol. 2014; 134: 472-475. [PubMed] [Google Scholar].
Couroux P Patel D Armstrong K Larché M Hafner RP Fel d 1由来合成ペプチド免疫調節エピトープは、猫アレルギー被験者において長期的な治療効果を示す。Clin Exp Allergy. 2015; 45: 974-981. [PubMed][Google Scholar].
サーカシア・ファーマシューティカルズ・インク(Circassia Pharmaceuticals Inc. Circassia Announces Top-Line Results from Cat Allergy Phase III Study [Internet]. 2016. https://www.circassia.com/media/press-releases/circassia-announces-top-line-results-from-cat-allergy-phase-iii-study/ (アクセス日: 2022年4月12日).
Senti G Crameri R Kuster D Johansen P Martinez-Gomez JM Graf N Steiner M Hothorn LA Grönlund H Tivig C Zaleska A Soyer O van Hage M Akdis CA Akdis M Rose H Kündig TM Cat Allergyに対するリンパ内免疫療法はわずか3回の注射で耐性を誘発する。J Allergy Clin Immunol. 2012; 129: 1290-1296. [PubMed] [Google Scholar] 。
Bucur J Dreborg S Einarsson R Ljungstedt - Påhlman I Nilsson JE Persson G犬や猫のアレルゲン製剤と免疫療法犬敏感と猫敏感な喘息患者である。アンアレルギー。1989; 62: 355-361. [PubMed] [Google Scholar] 。
Hedlin Gグラフ- Lonnevig V Heilborn H Lilja G Norrlind K Pegelow K Sundin B Lowenstein H猫や犬のふけの抽出物との免疫療法。Vの3年間の治療の効果。Jのアレルギー臨床免疫学。1991; 87: 955-964. [PubMed] [Google Scholar] 。
Hedlin G Heilborn H Lilja G Norrlind K Pegelow KO Schou C Løwenstein H猫または犬の免疫療法の3年コースで治療した患者の長期的なフォローアップ。Jアレルギー臨床免疫学。1995; 96: 879-885. [PubMed] [Google Scholar] 。
Nanda A O'connor M Anand M Dreskin SC Zhang L Hines B Lane D Wheat W Routes JM Sawyer R Rosenwasser LJ Nelson HS Dose dependence and time course of the immunologic response to administration of standardized cat allergen extract(標準化猫アレルゲン抽出物の投与による免疫反応の用量依存性および時間経過)。J Allergy Clin Immunol. 2004; 114: 1339-1344. [PubMed] [Google Scholar].
Sundin B Lilja G Graff-Lonnevig V Hedlin G Heilborn H Norrlind K Pegelow KO Løwenstein H 部分精製・標準化した動物のふけ抽出物による免疫療法。動物のフケ喘息患者を対象とした二重盲検試験による臨床的結果。Jアレルギー臨床免疫学。1986; 77: 478-487. [PubMed] [Google Scholar] 。
Alvarez-Cuesta E Berges-Gimeno P González-Mancebo E Fernández-Caldas E Cuesta-Herranz J Casanovas M Standardized Cat dander extractによる舌下免疫療法:ダブルブラインドプラセボコントロールスタディにおける有効性についての評価。アレルギー。2007; 62: 810-817. [PubMed] [Google Scholar] 。
Dávila I Domínguez-Ortega J Navarro-Pulido A Alonso A Antolín-Amerigo D González-Mancebo E Martín-García C Núñez-Acevedo B Prior N Reche M Rosado A Ruiz-Hornillos J Sánchez MC Torrecillas M 犬と猫のアレルギーに関する合意文書です。Allergy. 2018; 73: 1206-1222. [PubMed] [Google Scholar].
Uriarte SA Sastre J 高用量の猫と犬の抽出物による皮下免疫療法。実生活での研究。J Investig Allergol Clin Immunol. 2020; 30: 169-174. [PubMed】【Google Scholar】。
Wiesmüller GA Heinzow B Aurbach U Bergmann KC Bufe A Buzina W Cornely OA Engelhart S Fischer Gabrio T Heinz W Herr CEW Kleine-Tebbe J Klimek L Köberle M Lichtnecker H Lob-Corzilius T Merget R Mülleneisen N Nowak D Abridged version of the AWMF guideline for the medical clinical diagnostics of indoor mold exposure(AGMFガイドライン、室内でのカビへの暴露に関する医療臨床診断の要約).ドイツ衛生・環境医学・予防医学学会(GHUP)のS2Kガイドラインとドイツアレルギー学会(AeDA)、ドイツ皮膚科学会(DDG)、ドイツアレルギー・臨床免疫学会(DGAKI)、ドイツ産業・環境医学学会(DGAUM)の協力によるもの。the German Society for Hospital Hygiene(DGKH)、the German Society for Pneumology and Respiratory Medicine(DGP)、the German Mycological Society(DMykG)、the Society for Pediatric Allergology and Environmental Medicine(GPA)、the German Federal Association of Pediatric Pneumology(BAPP)、the Austrian Society for Medical Mycology(ÖGMM)などが挙げられる。Allergo J Int. 2017; 26: 168-193. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Dreborg S Agrell B Foucard T Kjellman NI Koivikko A Nilsson S 精製し標準化したCladosporium herbarum製剤を用いた小児における多施設二重盲検免疫療法臨床試験。I.臨床的結果。アレルギー。1986; 41: 131-140. [PubMed] [Google Scholar].
Horst M Hejjaoui A Horst V Michel FB Bousquet J 標準化されたAlternaria抽出物を用いた二重盲検プラセボ対照突進免疫療法。J アレルギーの臨床免疫学。1990; 85: 460-472. [PubMed] [Google Scholar] 。
Malling HJ Dreborg S Weeke Bの診断とカビアレルギーの免疫療法。Vの臨床効果とCladosporium herbarumと免疫療法の副作用。アレルギー。1986; 41: 507-519. [PubMed] [Google Scholar] 。
クナP Kaczmarek J Kupczyk Mの有効性と小児のAlternaria alternataに対するアレルギーのための免疫療法の安全性。Jのアレルギー臨床免疫学。2011; 127: 502-508 e501-506. [PubMed] [Googleスカラー]。
Tabar AI Prieto L Alba P Nieto A Rodríguez M Torrecillas M Huertas B Gómez E Fernández FJ Blanca M Rodríguez D Palacios R Major allergen Alt a 1によるアレルゲン特異的免疫療法の二重盲検、無作為、プラセボ制御試験。 J Allergy Clin Immunol. 2019; 144: 216-223.e3. [PubMed】【Google Scholar】をご参照ください。
Grabenhenrich LB Dölle S Moneret-Vautrin A Köhli A Lange Spindler T Ruëff F Nemat K Maris I Roumpedaki E Scherer K Ott H Reese T Mustakov T Lang R Fernandez-Rivas M Kowalski ML Bilò MB Hourihane JO Papadopoulos NG 小児および青年におけるアナフィラキシーを対象としたもの。欧州アナフィラキシーレジストリ。J Allergy Clin Immunol. 2016; 137: 1128-1137.e1. [PubMed][Google Scholar].
Maris I Dölle-Bierke S Renaudin JM Lange L Koehli A Spindler T Hourihane J Scherer K Nemat K Kemen C Neustädter I Vogelberg C Reese T Yildiz I Szepfalusi Z Ott H Straube H Papadopoulos NG Hämmerling S Staden U 小児と青年におけるピーナッツ誘発アナフィラキシー.欧州アナフィラキシーレジストリからのデータ。アレルギー。2021; 76: 1517-1527. [PubMed] [Google Scholar].
Tordesillas L Berin MC Mechanisms of Oral Tolerance(トルデシラスLベリンMCメカニズムオブオーラルトレランス)。Clin Rev Allergy Immunol. 2018; 55: 107-117. [PMC無料記事] [PubMed] [Google Scholar].
Ryan JF Hovde R Glanville J Lyu SC Ji X Gupta S Tibshirani RJ Jay DC Boyd SD Chinthrajah RS Davis MM Galli SJ Maecker HT Nadeau KC Successful immunotherapy induces previously unidentified allergen-specific CD4+ T-cell subsets。Proc Natl Acad Sci USA. 2016; 113: E1286-E1295. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Chinthrajah RS Hernandez JD Boyd SD Galli SJ Nadeau KC Molecular and cellular mechanisms of food allergy and food tolerance(食物アレルギーと食物耐性の分子および細胞メカニズム)。J Allergy Clin Immunol. 2016; 137: 984-997. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Tordesillas L Berin MC Sampson HA Immunology of Food Allergy(食物アレルギーの免疫学)。Immunity. 2017; 47: 32-50. [PubMed][Google Scholar].
Nwaru BI Hickstein L Panesar SS Roberts G Muraro A Sheikh A Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy. 2014; 69: 992-1007. [PubMed] [Google Scholar].
Bock SA Atkins FM ピーナッツアレルギーの自然史。J Allergy Clin Immunol. 1989; 83: 900-904. [PubMed][Google Scholar]。
Ho MH Wong WH Heine RG Hosking CS Hill DJ Allen KJ 小児におけるピーナッツアレルギー寛解の早期臨床的予測因子。J Allergy Clin Immunol. 2008; 121: 731-736. [PubMed] [Google Scholar].
Hourihane JO Roberts SA Warner JO Hourihane JOB Roberts SA Warner JO ピーナッツアレルギーの解決:症例対照研究。BMJ。1998; 316: 1271-1275. [PMC無料記事] [PubMed][Googleスカラー]。
Skolnick HS Conover-Walker MK Koerner CB Sampson HA Burks W Wood RA The natural history of peanut allergy(ピーナッツアレルギーの自然史). J Allergy Clin Immunol. 2001; 107: 367-374. [PubMed] [Google Scholar].
Avery NJ King RM Knight S Hourihane JO ピーナッツアレルギーの子供の生活の質の評価。小児科アレルギー免疫学。2003; 14: 378-382. [PubMed] [Google Scholar] 。
King RM Knibb RC Hourihane JO Impact of peanut allergy on the quality of life, stress and anxiety in the family.ピーナッツアレルギーが家族の生活の質、ストレスや不安に与える影響。アレルギー。2009; 64: 461-468. [PubMed] [Google Scholar] 。
Vickery BP Vereda A Casale TB Beyer K du Toit G Hourihane JO Jones SM Shreffler WG Marcantonio A Zawadzki R Sher L Carr WW Fineman S Greos L Rachid R Ibáñez MD Tilles S Assa'ad AH Nilsson C Rupp N AR101 Peanut Allergy Oral Immunotherapy(ピーナッツアレルギーに対 する経口免疫療法。N Engl J Med. 2018; 379: 1991-2001. [PubMed] [Google Scholar].
O'B Hourihane J Beyer K Abbas A Fernández-Rivas M Turner PJ Blumchen K Nilsson C Ibáñez MD Deschildre A Muraro A Sharma V Erlewyn-. Lajeunesse M Zubeldia JM De Blay F Sauvage CD Byrne A Chapman J Boralevi F DunnGalvin A O'Neill C Norval D Vereda A Skeel B Adelman DC du Toit G Efficacy and safety of oral immunotherapy with AR101 in European children with a peanut allergy (ARTEMIS).A MULTIPENTER DELAYS DELAYS DELAYS DELAYS DELAYS DELAYS G: 多施設共同、二重盲検、無作為化、プラセボ対照の第 3 相試験。Lancet Child Adolesc Health. 2020; 4: 728-739. [PubMed] [Google Scholar].
Vickery BP Vereda A Nilsson C du Toit G Shreffler WG Burks AW Jones SM Fernández-Rivas M Blümchen K O'B Hourihane J Beyer K Smith A Ryan R Adelman DC Peanut Allergyに対する継続的および毎日の経口免疫治療法。2 年間の非盲検追跡試験の結果。J Allergy Clin Immunol Pract. 2021; 9: 1879-1889.e14. [PubMed][Google Scholar].
Werfel T Breuer K Ruéff F Przybilla B Worm M Grewe M Ruzicka T Brehler R Wolf H Schnitker J Kapp A アトピー性皮膚炎とハウスダストマイトへのアレルギー感作を有する患者における特異的免疫療法の有用性:多施設、無作為化、用量反応性試験。Allergy. 2006; 61: 202-205. [PubMed] [Google Scholar].
Novak N Bieber T Hoffmann M Fölster-Holst R Homey B Werfel T Sager A Zuberbier T Efficacy and safety of subcutaneous allergen-specific immunotherapy with depigmented polymerized mite extract in atopic dermatitis(アトピー性皮膚炎における重合ダニ抽出物皮下免疫療法の有効性と安全性)。J Allergy Clin Immunol. 2012; 130: 925-31.e4. [PubMed] [Google Scholar].
Bae JM Choi YY Park CO Chung KY Lee KH Efficacy of allergen-specific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials. J Allergy Clin Immunol. 2013; 132: 110-117. [PubMed] [Google Scholar].
Liu L Chen J Xu J Yang Q Gu C Ni C Li L Lu X Yao Z Tao J Guo Y Fang H Ding Y Qian Q Zhou N Wang M Deng D Xie H Li S Huang Y Zhao N Zheng M マイト感作患者のアトピー性皮膚炎の舌下免疫療法:多施設、無作為、ダブルブラインド、プラセボ制御試験。Artif Cells Nanomed Biotechnol. 2019; 47: 3540-3547. [PubMed】【Google Scholar】。
Pajno GB Caminiti L Vita D Barberio G Salzano G Lombardo F Canonica GW Passalacqua G アトピー性皮膚炎のマイト感作児における舌下免疫療法:無作為化二重盲検プラセボ対照試験。J Allergy Clin Immunol. 2007; 120: 164-170. [PubMed] [Google Scholar] 。
Di Rienzo V Cadario G Grieco T Galluccio AG Caffarelli C Liotta G Pecora S Burastero SE アトピー性皮膚炎のダニ感作児における舌下免疫療法:無作為化、オープン、並行群間試験(ARI)。Ann Allergy Asthma Immunol. 2014; 113: 671-673.e1. [PubMed][Google Scholar].
Qin YE Mao JR Sang YC Li WX アトピー性皮膚炎患者におけるDermatophagoides farinae dropsによる舌下免疫療法の臨床的有効性とコンプライアンス. Int J Dermatol. 2014; 53: 650-655. [PubMed] [Google Scholar].
Bousquet J Van Cauwenberge P Khaltaev N アレルギー性鼻炎と喘息への影響。Jのアレルギー臨床免疫学。2001; 108: S147-S334。[PubMed] [Googleスカラー] 。
デル-リオ-カマーチョGモンテスアルホナAMフェルナンデス-カンタレーホPadial JロドリゲスカタランJどのように分子診断では、多重感作花粉症児の免疫療法の処方を変更することがあります。Allergol Immunopathol (Madr). 2018; 46: 552-556. [PubMed] [Google Scholar].
Incorvaia C Al-Ahmad M Ansotegui IJ Arasi S Bachert C Bos C Bousquet J Bozek A Caimmi D Calderón MA Casale T Custovic A De Blay F Demoly P Devillier P Didier A Fiocchi A Fox AT Gevaert P Gomez M Personalized Medicine for Allergy Treatment: アレルゲン免疫療法は、まだユニークで比類のないモデル。Allergy. 2021; 76: 1041-1052. [PubMed] [Google Scholar].
Schmid-Grendelmeier P [組み換えアレルゲン。 日常的な使用のため、またはまだ唯一の科学?]. Hautarzt。2010; 61: 946-953. [PubMed] [Google Scholar].
Gøtzsche PCヨハンセンHK喘息のためのハウスダストマイト対策:系統的レビュー。アレルギー。2008; 63: 646-659. [PubMed] [Googleスカラー]。
コップMV Niggemann BのフォースターJのハウスダストマイトアレルギー:誘発アレルゲンの完全な除去は、主要な治療法です。アレルギー。2009年、64:1402-1403 、著者は1405を返信。[PubMed] [Google Scholar] 。
Muche-Borowski C Kopp M Reese I Sitter H Werfel T Schäfer T Beyer K Friedrichs F Hamelmann E Hellermann M Huss-Marp J Kleinheinz A Lau S Rietschel E Rudack C Schmidt S Schnadt Schnitzer S3-Leitlinieアレルギー予防-更新2009年. Allergo J. 2009; 18: 322-341。[Googleスカラー]を
Kopp MV Muche-Borowski C Abou-Dakn M Ahrens B Beyer K Blümchen K Bubel P Chaker A Cremer M Ensenauer R Gerstlauer M Gieler U Hübner IM Horak F Klimek L Koletzko BV Koletzko S Lau S Lob-Corzilius T Nemat K Peters EMJ Pizzulli A Reese I Rolinck- Louw E Rouw Hüber K Hüber K Bubel P Chaker M Ensenauer R Gerstlauer M Gieler U Hüber K Blümchen K Chaker K Bluez K Bluez K Bluker K Bluez K Bluker K Bluker K Werninghaus C Rouw E Schaub B Schmidt S Steiß JO Striegel AK Szépfalusi Z Schlembach D Spindler T Taube C Trendelenburg V Treudler R Umpfenbach U Vogelberg C Wagenmann M Weißenborn A Werfel T Worm M Sitter H Hamelmann E S3 ガイドラインアレルギー予防。Allergol Select. 2022; 6: 61-97. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Murray CS Foden P Sumner H Shepley E Custovic A Simpson A Preventing Severe Asthma Exacerbations in Children(小児喘息の重症化を予防する。ダニ不透過性ベッドカバーの無作為化試験。Am J Respir Crit Care Med. 2017; 196: 150-158. [PubMed] [Google Scholar].
Pfaar O Biedermann T Klimek L Sager A Robinson DS Depigmented-polymerized mixed grass/birch pollen extract immunotherapy is effective in polysensitized patients(多感症患者における色素沈着重合混合草/バーチ花粉抽出物免疫療法の有効性)。Allergy. 2013; 68: 1306-1313. [PubMed] [Google Scholar].
Nelson HS アレルゲンミックスを用いた特異的免疫療法:エビデンスは何か?Curr Opin Allergy Clin Immunol. 2009; 9: 549-553. [PubMed] [Google Scholar].
Pitsios C Demoly P Bilò MB Gerth van Wijk R Pfaar O Sturm GJ Rodriguez del Rio P Tsoumani M Gawlik R Paraskevopoulos G Ruëff F Valovirta E Papadopoulos NG Calderón MA アレルゲン免疫療法の臨床禁忌:EAACIポジションペーパー(英語). Allergy. 2015; 70: 897-909. [PubMed】【Google Scholar】。
Cox LS Sanchez-Borges M Lockey RF World Allergy Organization System System of Systemic Allergic Reaction Grading System(世界アレルギー機関全身性アレルギー反応評価システム)。修正は必要か?J Allergy Clin Immunol Pract. 2017; 5: 58-62.e5. [PubMed] [Google Scholar] を参照。
Ferrando M Racca F Madeira LNG Heffler E Passalacqua G Puggioni F Stomeo N Canonica GW A critical appraisal on AIT in childhood asthma.(小児喘息におけるAITに関する批判的評価)。Clin Mol Allergy. 2018; 16: 6. [PMC無料記事] [PubMed] [Google Scholar].
Lim CE Sison CP Ponda P 皮下免疫療法に対する小児と成人の全身反応の比較。J Allergy Clin Immunol Pract. 2017; 5: 1241-1247.e2. [PubMed][Google Scholar].
Zuberbier T Bachert C Bousquet PJ Passalacqua G Walter Canonica G Merk H Worm M Wahn U Bousquet J GA LEN/EAACI pocket guide for allergen-specific immunotherapy for allergic rhinitis and asthma. アレルギー。2010; 65: 1525-1530. [PubMed] [Google Scholar] 。
Demoly PピエットVのドーレスJP妊娠中のアレルギー性鼻炎の治療。薬物。2003; 63: 1813-1820. [PubMed] [Googleスカラー]。
Sturm GJ Herzog SA Aberer W Alfaya Arias T Antolín-Amérigo D Bonadonna P Boni E Bożek A Chełmińska M Ernst B Frelih N Gawlik R Gelincik A Hawranek T Hoetzenecker W Jiménez Blanco A Kita Kendirlinan R Košnik M Laipold Kβ-blockers と ACE inhibitor are not a risk factor for severe systemic sting reactions and adverse events during venom immunotherapy(毒免疫治療におけるβ-ブロッカーとACE阻害薬は、重症全身性刺傷反応の危険因子と有害事象ではない). Allergy. 2021; 76: 2166-2176. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Wedi B Ruëff F【アレルゲン特異的免疫療法における薬物予防と併用薬】. Hautarzt. 2011; 62: 663-670. [PubMed] [Google Scholar].
Müller UR Haeberli G Hymenoptera毒物アレルギーの免疫療法中のベータ遮断薬の使用。Jアレルギー臨床免疫学。2005; 115: 606-610. [PubMed] [Google Scholar] 。
Miehlke S Alpan O Schröder S Straumann A 花粉舌下免疫療法による好酸球性食道炎の誘発。Case Rep Gastroenterol. 2013; 7: 363-368. [PMC無料記事] [PubMed][Googleスカラー]。
Béné J Ley D Roboubi R Gottrand F Gautier S舌下免疫療法によるダニへの減感作後の好酸球性食道炎。Ann Allergy Asthma Immunol. 2016; 116: 583-584. [PubMed] [Google Scholar].
Rokosz M Bauer C Schroeder S 経腸栄養チューブ依存の小児患者におけるエアロアレルゲン舌下免疫療法による好酸球性食道炎. Ann Allergy Asthma Immunol. 2017; 119: 88-89. [PubMed] [Google Scholar].
Babaie D Mesdaghi M Nishino M Mansouri M Ebisawa M Oral and Sublingual Immunotherapy: 好酸球性消化管障害の潜在的原因?Int Arch Allergy Immunol. 2017; 172: 89-98. [PubMed] [Google Scholar].
Kawashima K Ishihara S Masuhara M Mikami H Okimoto E Oshima N Ishimura N Araki A Maruyama R Kinoshita Y スギ花粉エキスによる舌下免疫療法後の好酸性食道炎の発症:A case report. Allergol Int. 2018; 67: 515-517. [PubMed] [Google Scholar].
Egan M Atkins D 好酸球性食道炎(EoE)と航空アレルゲンの関係とは?アレルゲン免疫療法への示唆。Curr Allergy Asthma Rep. 2018; 18: 43. [PMCフリー記事] [PubMed] [Google Scholar].
Rodríguez Del Rio P Pitsios C Tsoumani M Pfaar O Paraskevopoulos G Gawlik R Valovirta E Larenas-Linnemann D Demoly P Calderón MA アレルゲン免疫療法の禁忌に関する医師の経験や意見について。CONSIT調査。Ann Allergy Asthma Immunol. 2017; 118: 621-628.e1. [PubMed] [Google Scholar].
Linneberg A Madsen F Skaaby T アレルゲン特異的免疫療法と自己免疫疾患のリスク。Curr Opin Allergy Clin Immunol。2012; 12: 635-639. [PubMed] [Google Scholar].
Linneberg A Jacobsen RK Jespersen L Abildstrøm SZ 皮下アレルゲン特異的免疫療法と自己免疫疾患、虚血性心疾患および死亡率の発生との関連。J Allergy Clin Immunol. 2012; 129: 413-419. [PubMed] [Google Scholar].
Randhawa IS Junaid I Klaustermeyer WB ヒト免疫不全ウイルス患者におけるアレルゲン免疫療法:T細胞活性化およびウイルス複製への効果。Ann Allergy Asthma Immunol. 2007; 98: 495-497. [PubMed] [Google Scholar] 。
Fodeman J Jariwala S Hudes G Jerschow E Rosenstreich D HIV患者3名におけるアレルゲン皮下免疫療法。Ann Allergy Asthma Immunol。2010; 105: 320-321. [PubMed] [Google Scholar] 。
Iemoli E Borgonovo L Fusi A Magni C Ricci ED Rizzardini G Piconi S HIV陽性患者における舌アレルゲン免疫療法。Allergy. 2016; 71: 412-415. [PubMed] [Google Scholar].
Wöhrl S Kinaciyan T Jalili A Stingl G Moritz KB Malignancy and specific allergen immunotherapy: the results of a case series.(ヴェール S キナシヤン T ジャリリ A スティングル G モリッツ KB 悪性腫瘍と特異的アレルゲン免疫療法)。Int Arch Allergy Immunol. 2011; 156: 313-319. [PubMed] [Google Scholar].
Bachert C Borchard U Wedi B Klimek L Rasp G Riechelmann H Schultze-Werninghaus G Wahn U Ring J Allergische Rhinokonjuktivitis. ドイツアレルギー学会および臨床免疫学会の規約(DGAI)。Interdisziplinäre Arbeitsgruppe "Allergische Rhinitis" der Sektion HNO. Allergo J. 2003; 12: 182-194。[Google Scholar].
Mülleneisen NKバーグマンKC Intramuskuläre Injektionフォンデポ-GlukokortikoidenビーPollinosisです。Bitte nie wieder! Allergo J. 2020; 29: 52-54。[Google Scholar】を参照してください。]
Köbberling J Gefahren der Depotkortikoid- Therapie. 内科医ヴェルト。1979; 4: 118-122. [Googleスカラー]を
Mygind N Laursen LC Dahl M全身コルチコステロイド治療季節性アレルギー性鼻炎:一般的なしかし、不十分な文書化された治療法です。アレルギー。2000; 55: 11-15. [PubMed] [Google Scholar] 。
シュワーベ U パフラット D ルートヴィヒ W-D クラウバー J Arzneiverordnungs-Report 2018. シュプリンガー・ベルラーク; 2018.; 479. [Google Scholar】を参照してください。]
Spritzenabszess nach intramuskulärer Injektion von Depot-Triamcinolon (Triam Inject u.a). Arzneitelegramm. 2020; 51: 63-64. [Google Scholar]
Bundesgesetz über die Ausübung des ärztlichen Berufes und die Standesvertretung der Ärzte (Ärztegesetz 1998 - ÄrzteG 1998) StF: BGBl. I Nr. 169/1998 (NR: GP XX RV 1386 AB 1400 S. 142. BR: AB 5785 S. 645.) (CELEX-Nr.: 378L0686, 378L0687, 381L1057, 393L0016).のとおりです。
Klimek L Aufklärung vor Beginn einer allergenspezifischen Immuntherapie。AeDAはTherapieinformationsblätterをempiehltします。アレルゴJ. 2019; 28: 118. [Google Scholar】をご覧ください。]
McDonald HP Garg AX Haynes RB 患者の薬物処方へのアドヒアランスを高めるための介入:科学的レビュー。JAMA. 2002; 288: 2868-2879. [PubMed] [Google Scholar].
Sondermann N Shah-Hosseini K Henkel K Schwalfenberg A Mösges R Erfolgsfaktoren der Adherence bei Hyposensibilisierung. Allergologie。2011; 34: 441-446. [Googleスカラー]を
Vogelberg C Therapieadhärenz und ihre Einflussfaktoren bei der Allergen-Immuntherapie. Allergologie。2022; 45: 7-11. [Googleスカラー]を
Osterberg L Blaschke T服薬アドヒアランス。N Engl J Med。2005; 353: 487-497. [PubMed] [Google Scholar] 。
Baiardini I Braido F Bonini M Compalati E Canonica GWなぜ医師や患者は、ガイドラインに従わないのですか?Curr Opinアレルギー臨床免疫学。2009; 9: 228-233. [PubMed] [Googleスカラー]。
Pfaar OアンジェE Muraro A Halken SロバーツGのアルゴリズムアレルギー性鼻結膜炎におけるアレルゲン免疫療法で。Allergy. 2020; 75: 2411-2414. [PubMed][Google Scholar].
Incorvaia C Rapetti A Scurati S Puccinelli P Capecce M Frati F 舌下免疫療法のコンプライアンスを支持する上で患者の教育の重要性。アレルギー。2010; 65: 1341-1342. [PubMed] [Google Scholar].
Demoly P Passalacqua G Pfaar O Sastre J Wahn U アレルギー免疫療法における患者参加と患者支援プログラム:長期的アドヒアランス向上のための行動喚起。Allergy Asthma Clin Immunol. 2016; 12: 34. [PMC無料記事] [PubMed] [Google Scholar].
Senna G Ridolo E Calderon M Lombardi C Canonica GW Passalacqua G アレルゲン特異的免疫療法へのアドヒアランスのエビデンス。Curr Opin Allergy Clin Immunol. 2009; 9: 544-548. [PubMed] [Google Scholar].
Incorvaia C Mauro M Ridolo E Puccinelli P Liuzzo M Scurati S Frati F アレルゲン免疫療法における患者のコンプライアンス。患者は、アドヒアランスを好む。2008; 2: 247-251. [PMCの無料記事] [PubMed][Googleスカラー]。
Claes C Mittendorf T Graf von der Schulenburg JM [ドイツの法定健康保険内で処方されたアレルゲン特異的皮下免疫療法(SCIT)の処方の永続性と頻度]。Med Klin(ミュンヘン)。2009; 104: 536-542. [PubMed] [Google Scholar] 。
Egert-Schmidt A Martin E Müller U Schulte M Thum-Oltmer S Patienten-Compliance in der Spezifischen Immuntherapie - Ein Vergleich von SCIT- und SLIT-Präparaten. Allergo J. 2011; 20: S40. [Google Scholar].
Sieber JデゲストSシャーホッセイニK Mösges R処方更新率で測定された長期、特定の草の花粉の免疫療法と服用の永続性。Currメッドレズオピン。2011; 27: 855-861. [PubMed] [Googleスカラー]。
Eberle P Schreder H Shah-Hosseini K Moesges R Medikamenten - Persistenz bei Kindern und Jugendlichen unter einer Langzeithyposensibilisierung mit Gräserpollenextrakten. Verordnungsdatenを使用したVersorgungsstudieのErgebnisse einer。Allergologie. 2013; 36: 9-18. [Google Scholar].
Vogelberg C Brüggenjürgen B Richter H Jutel M ドイツにおけるハウスダストマイト免疫療法:皮下アレルゴイドと舌下錠の実際のアドヒアランスを示す。アレルゴJ Int. 2020; 30: 183-191。[Google Scholar】。]
Egert-Schmidt AM Kolbe JM Mussler S Thum-Oltmer S ドイツにおけるアレルゲン免疫療法の異なる投与経路に対する患者のコンプライアンス。Patient Prefer Adherence. 2014; 8: 1475-1481. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Roberts G Vazquez-Ortiz M Khaleva E DunnGalvin A Gore C Marchisotto MJ Mortz CG Pfaar O Sánchez A すべての環境におけるアレルギーおよび喘息を有する思春期および若年成人患者に対する移行およびサービス改善の必要性。アレルギー。2020; 75: 2731-2733. [PubMed] [Google Scholar]を参照してください。
Ring J Beyer K Biedermann T Bircher A Fischer M Fuchs T Heller A Hoffmann F Huttegger I Jakob T Klimek L Kopp MV Kugler C Lange L Pfaar O Rietschel E Rueff F Schnadt S Seifert R Stöcker B Treudler R Vogelberg C Werfel T Worm M Sitter H Brockow K アナフィラキシーの急性療法と管理に関するガイドライン (S2k): 2021 update: S2k-Guideline of the German Society for Allergology and Clinical Immunology (DGAKI), the Medical Association of German Allergologists (AeDA), the Society of Pediatric Allergology and Environmental Medicine (GPA), the German Academy of Allergology and Environmental Medicine (DAAU), the German Professional Association of Pediatricians (BVKJ), the Society for Neonatology and Pediatric Intensive Care (GNPI), the German Society of Dermatology (DDG).のガイドライン。オーストリアアレルギー免疫学会(ÖGAI)、スイスアレルギー免疫学会(SGAI)、ドイツ麻酔集中治療医学会(DGAI)、ドイツ薬理学会(DGP)、ドイツ呼吸器学会(DGP)、患者団体ドイツアレルギー喘息協会(DAAB)、ドイツアナフィラキシー研修教育ワーキンググループ(AGATE)。Allergo J Int. 2021; 30: 1-25. [PMC無料論文] [PubMed] [Google Scholar].
Fischer PJ Friedrichs F Praktische Durchführung der Hyposensibilisierung. Monatsschr Kinderheilkd。608-615. [Googleスカラー]を
Klimek L Umsetzung der EU-Richtlinie 2010/32/EU fordert verletzungssichere Spritzen: im HNO-Bereich ist hiervon insbesondere auch die subkutane Immuntherapie (SCIT) betroffen. HNO-Mitteilungen. 2013; 63: 189. [Google Scholar].
Pfaar OウルフH Klimek L Schnitker J Wüstenberg Eの免疫効果と8日間のアップ投与スケジュールで季節内皮下免疫療法の忍容性を標準化品質-単位:二重盲検、無作為、プラセボ対照試験。Clin Ther. 2012; 34: 2072-2081. [PubMed] [Google Scholar].
カラブリアCW加速免疫療法スケジュール。2013; 13: 389-398。[PubMed】【Google Scholar】。
カラブリアCWコックスL加速免疫療法スケジュールとプレメディケーション。2011年、31:251から263、IXを免疫アレルギー臨床ノースアム。[PubMed】【Google Scholar】。
Demoly P Passalacqua G Pfaar O Sastre J Wahn U アレルギー免疫療法によるポリアレルギー患者の管理:実践に基づいたアプローチ。Allergy Asthma Clin Immunol. 2016; 12: 2. [PMCフリー記事] [PubMed] [Google Scholar].
Przybilla B Rueff F Walker A Räwer H Aberer W Bauer C Berdel D Biedermann T Brockow K Forster J Fuchs T Hamelmann E Jakob T Jarisch R Merk HF Müller U Ott H Sitter W Urbanek R Wedi B Diagnose und Therapie der Bienen- und Wespengiftallergie。Allergo J. 2011; 20: 318-339. [Googleのスカラー]を
Malling HJ アレルゲン特異的注射免疫療法のリスクを最小化する。Drug Saf. 2000; 23: 323-332. [PubMed] [Google Scholar] 。
Cox L Calderón M Pfaar O アレルギー疾患に対する皮下アレルゲン免疫療法:既存および新規製剤の有効性、安全性および費用対効果の検証。Immunotherapy. 2012; 4: 601-616. [PubMed] [Google Scholar].
Alvarez-Cuesta E Bousquet J Canonica GW Durham SR Malling HJ Valovirta E アレルゲン特異的免疫療法実用化のための基準。アレルギー。2006; 61: 1-20. [PubMed] [Google Scholar] 。
Kelso JM 免疫療法注射の全身反応の割合は、局所反応の後に投与量を減らしても減らさなくても同じである。Ann Allergy Asthma Immunol. 2004; 92: 225-227. [PubMed] [Google Scholar].
Frost L Johansen P Pedersen S Veien N Ostergaard PA Nielsen MH アルミニウム含有アレルゲン抽出物で低感作された小児における持続的な皮下結節。アレルギー。1985; 40: 368-372. [PubMed] [Google Scholar] 。
Netterlid E Hindsén M Björk J Ekqvist S Güner N Henricson KA Bruze Mアルミニウムへの接触アレルギーと低感作療法を受けている子供たちの持続的な皮下結節の間に関連性がある。Contact Dermat. 2009; 60: 41-49. [PubMed] [Google Scholar] 。
Vogelbruch M Nuss B Körner M Kapp A Kiehl P Bohm W Aluminium-induced granuloma afteraccurate intradermal hyposensitization injection of aluminium-adsorbed depot preparations(アルミニウム吸着デポ剤皮内投与によるアルミニウム誘発肉芽腫)。アレルギー。2000; 55: 883-887. [PubMed] [Google Scholar] 。
Kramer MF Heath MD Aluminium in allergen-specific subcutaneous immunotherapy--a German perspective(アレルゲン特異的皮下免疫療法におけるアルミニウム)。Vaccine. 2014; 32: 4140-4148. [PubMed] [Google Scholar].
https://www.pei.de/DE/newsroom/veroffentlichungen-arzneimittel/sicherheitsinformationen-human/2014/ablage2014/2014-01-21-sicherheitsbewertung-von-aluminium-in-therapieallergenen.html. (アクセス日 2022年4月12日).
Lopez S Pelaez A Navarro LA Montesinos E Morales C Carda C アルミニウム沈殿抗原抽出物で低感作された患者におけるアルミニウムアレルギー。接触皮膚。1994; 31: 37-40. [PubMed] [Google Scholar] 。
Weißer K Matheis W Keller-Stanislawski B Entwicklung eines PBTK-Modells for die Risikobewertung der Aluminiumexposition aus Adjuvanzien. Bull Arzneimittelsicherh. 2017; 3: 26-29. [Google Scholar】を参照。]
Cox L Larenas-Linnemann D Lockey RF Passalacqua G Speaking the same language.コックス L ラレナス・リンネマン D ロッキー RF パッサラックア G 同じ言語を話す。世界アレルギー機関皮下免疫療法全身反応評定システム(The World Allergy Organization Subcutaneous Immunotherapy System System of Systemic Reaction Grading System)。J Allergy Clin Immunol. 2010; 125: 569-574. [PubMed] [Google Scholar].
Epstein TG Liss GM Murphy-Berendts K Bernstein DI 皮下免疫療法に対する致死的および非致死的反応のリスクファクター(危険因子)。アレルゲン免疫療法に関する全国サーベイランス調査(2008年~2013年)。Ann Allergy Asthma Immunol. 2016; 116: 354-359.e2. [PubMed] [Google Scholar].
Burks AW Calderon MA Casale T Cox L Demoly P Jutel M Nelson H Akdis CA Update on allergy immunotherapy(アレルギー免疫療法に関する最新情報)。米国アレルギー喘息免疫学会/欧州アレルギー臨床免疫学会/PRACTALLコンセンサスレポート。J Allergy Clin Immunol. 2013; 131: 1288-96.e3. [PubMed】【Google Scholar】。
Epstein TG Liss GM Murphy-Berendts K Bernstein DI AAAAI and ACAAI surveillance study of subcutaneous immunotherapy, Year 3: what practices modify the risk of systemic reactions? Ann Allergy Asthma Immunol. 2013; 110: 274-278.e1. [PubMed] [Google Scholar].
Epstein TG Liss GM Berendts KM Bernstein DI AAAAI/ACAAI Subcutaneous Immunotherapy Surveillance Study (2013 - 2017)。死亡例、感染症、遅延反応、エピネフリン自動注射器の使用状況。J Allergy Clin Immunol Pract. 2019; 7: 1996-2003. [PubMed] [Google Scholar].
Calderón MA Vidal C Rodríguez Del Río P Just J Pfaar O Tabar AI Sánchez-Machín I Bubel P Borja J Eberle P Reiber R Bouvier M Lepelliez A Klimek L Demoly P European Survey on Adverse Systemic Reactions in Allergen Immunotherapy (EASSI): a real-life clinical assessment.アレルゲン抗原治療における全身反応の有害性に関する欧州調査(ASI). Allergy. 2017; 72: 462-472. [PubMed] [Google Scholar].
Rodríguez Del Río P Vidal C Just J Tabar AI Sanchez-Machin I Eberle P Borja J Bubel P Pfaar O Demoly P Calderón MA The European Survey on Adverse Systemic Reactions in Allergen Immunotherapy (EASSI).(アレルゲン免疫療法における有害全身反応に関する欧州調査): 小児の評価。Pediatr Allergy Immunol. 2017; 28: 60-70. [PubMed] [Google Scholar].
Tophof MA Hermanns A Adelt T Eberle P Gronke C Friedrichs F Knecht R Mönter E Schöpfer H Schwerk N Steinbach J Umpfenbach HU Weißhaar C Wilmsmeyer B Bufe A アレルギー疾患を持つ小児の皮下免疫療法中の副作用。Pediatr Allergy Immunol. 2018; 29: 267-274. [PubMed] [Google Scholar].
Ring J Messmer K コロイド容量代替物に対するアナフィラキシー様反応の発生率と重症度. Lancet。1977; 1: 466-469. [PubMed] [Googleスカラー]。
Lüderitz -ピュッシェルUケラーStanislawski B Haustein DのNeubewertungデリスクテストと治療allergenの危険にさらされている。1991年から2000年までのUAWの発表の分析。Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutzです。2001; 44: 709-718. [Google Scholar]
Makatsori M Calderon MA Anaphylaxis: still a ghost behind allergen immunotherapy. Curr Opin Allergy Clin Immunol。2014; 14: 316-322. [PubMed】【Google Scholar】。
Calderón MA Simons FE Malling HJ Lockey RF Moingeon P Demoly P Sublingual allergen immunotherapy: mode of action and its relationship with the safety profile. アレルギー。2012; 67: 302-311. [PubMed] [Google Scholar] 。
James C Bernstein DI アレルゲン免疫療法:安全性に関する最新のレビュー。Curr Opin Allergy Clin Immunol. 2017; 17: 55-59. [PMC無料記事] [PubMed] [Google Scholar].
Nielsen L Johnsen CR Mosbech H Poulsen LK Malling HJ Antihistamine premedication in specific cluster immunotherapy: a double-blind, placebo-controlled study. J Allergy Clin Immunol. 1996; 97: 1207-1213. [PubMed] [Google Scholar] 。
Reimers A Hari Y Müller U フェキソフェナジンの前処理によるミツバチ毒のウルトララッシュ免疫療法からの副作用の減少:二重盲検、プラセボ対照試験。アレルギー。2000; 55: 484-488. [PubMed][Google Scholar].
フェキソフェナジン前投与がアレルギー性鼻炎患者における免疫療法の安全性に及ぼす影響. Ann Allergy Asthma Immunol. 2006; 96: 600-605. [PubMed] [Google Scholar].
Radulovic S Calderon MA Wilson D Durham S アレルギー性鼻炎のための舌下免疫療法。CochraneデータベースSyst Rev。[PMC無料記事] [PubMed][Googleスカラー]。
Kleine - Tebbe J Ribel M Herold DA舌下免疫療法のためのSQ標準化草アレルゲン錠の安全性:無作為化、プラセボ対照試験。アレルギー。2006; 61: 181-184. [PubMed] [Googleスカラー]。
Birk AO Andersen JS Villesen HH Steffensen MA Calderon MA 成人におけるSQツリーSLIT錠の忍容性。Clin Ther. 2017; 39: 1858-1867. [PubMed] [Google Scholar] を参照。
Lin SY Azar A Suarez-Cuervo C Diette GB Brigham E Rice J Ramanathan M Robinson KA喘息の治療における舌下免疫療法の役割。最新のシステマティックレビュー。Int Forum Allergy Rhinol. 2018; 8: 982-992. [PubMed] [Google Scholar].
Blanco C Bazire R Argiz L Hernández-Peña J 呼吸器アレルギーの舌下アレルゲン免疫療法:システマティック・レビュー。Drugs Context. 2018; 7: 212552. [PMC無料記事] [PubMed] [Google Scholar].
Cox LS Larenas Linnemann D Nolte H Weldon D Finegold I Nelson HS 舌下免疫療法:包括的レビュー。J Allergy Clin Immunol. 2006; 117: 1021-1035. [PubMed] [Google Scholar].
Passalacqua G Garelli V Sclifò F Canonica GW アレルギー性鼻炎や結膜炎のための舌下免疫療法。Immunotherapy。2013; 5: 257-264. [PubMed] [Googleスカラー]。
Casale TB Cox LS Wahn U Golden DBK Bons B Didier A Safety Review of 5-Grass Pollen Tablet from Pooled Data of Clinical Trials(臨床試験のプールデータからの5-グラスポーレン錠の安全性レビュー)。J Allergy Clin Immunol Pract. 2017; 5: 1717-1727. [PubMed][Google Scholar].
363.de Groot H Bijl A 草本花粉錠による舌下免疫療法の初回投与後のアナフィラキシー反応。アレルギー。2009; 64: 963-964. [PubMed] [Googleスカラー]。Passalacqua G Baena-Cagnani CE Bousquet J Canonica GW Casale TB Cox L Durham SR Larenas-Linnemann D Ledford D Pawankar R Potter P Rosario N Wallace D Lockey RF 呼吸器アレルギーに対する舌下免疫療法の局所副作用の評価:同じ言語を話すこと。J Allergy Clin Immunol. 2013; 132: 93-98. [PubMed] [Googleスカラー]。
Sampson HA Muñoz-Furlong A Campbell RL Adkinson NF Bock SA Branum A Brown SG Camargo CA Cydulka R Galli SJ Gidudu J Gruchalla RS Harlor AD Hepner DL Lewis LM Lieberman PL Metcalfe DD O'Connor R Muraro A Rudman A Second symposium on the definition and management of anaphylaxis: summary report--Second National Institute of Allergy and Infectious Disease/Food Allergy and Anaphylaxis Network symposium(第2回国立アレルギー感染症研究所・食物アレルギー・アナフィラキシーネットワークシンポジウム). J Allergy Clin Immunol. 2006; 117: 391-397. [PubMed】【Google Scholar】。
Vidal C Rodríguez Del Río P Gude F Casale T Cox L Just J Pfaar O Demoly P Calderón MA Allergen Immunotherapyによる全身性有害反応の国際比較。J Allergy Clin Immunol Pract. 2019; 7: 1298-1305.e3. [PubMed] [Google Scholar].
Park KH Son M Choi SY Park HJ Lee JH Jeong KY Lee JS Park JW In vitro evaluation of allergen potencies of commercial house dust mite sublingual immunotherapy reagents(市販のハウスダストマイト舌下免疫療法試薬のアレルゲン力価)。Allergy Asthma Immunol Res. 2015; 7: 124-129. [PMC フリーアーティクル] [PubMed] [Google Scholar].
スイスメディック(編).Schweiz Ärztezeitung. Neues Heilmittelgesetz: 新ハイブリッド車:unerwünschte Arzneitmittelwirkungen用FachleuteのMeldepflicht。2002; 83: 819-822. [Google Scholar]
Simons FE Ardusso LR Bilò MB Dimov V Ebisawa M El-Gamal YM Ledford DK Lockey RF Ring J Sanchez-Borges M Senna GE Sheikh A Thong BY Worm M 2012 Update: World Allergy Organization Guidelines for the assessment and management of anaphylaxis. Curr Opin Allergy Clin Immunol. 2012; 12: 389-399. [PubMed] [Google Scholar].
Muraro A Roberts G Worm M Bilò MB Brockow K Fernández Rivas M Santos AF Zolkipli ZQ Bellou A Beyer K Bindslev-Jensen C Cardona V Clark AT Demoly P Dubois AE DunnGalvin A Eigenmann P Halken S Harada L Lack G Anaphylaxis: Guidelines from the European Academy of Allergy and Clinical Immunology(欧州アレルギー臨床免疫学会のガイドライン). Allergy. 2014; 69: 1026-1045. [PubMed][Google Scholar].
Muraro A Worm M Alviani C Cardona V DunnGalvin A Garvey LH Riggioni C de Silva D Angier E Arasi S Bellou A Beyer K Bijlhout D Bilò MB Bindslev-Jensen C Brockow K Fernandez-Rivas M Halken S Jensen B Khaleva EAACIガイドライン。アナフィラキシー(2021年更新)。アレルギー。2022; 77: 357-377. [PubMed】【Google Scholar】。
Vickery BP Hourihane JO Adelman DC ピーナッツアレルギーのための経口免疫療法。N Engl J Med. 2019; 380: 691-692. [PubMed] [Google Scholar]を参照してください。
Fleischer DM Greenhawt M Sussman G Bégin P Nowak-Wegrzyn A Petroni D Beyer K Brown-Whitehorn T Hebert J Hourihane JO Campbell DE Leonard S Chinthrajah RS Pongracic JA Jones SM Lange L Chong H Green TD Wood R Cheema A Epicutaneous Immunotherapy vs Placebo Effect of Peanut Protein Ingestion among Children With Peanut Allergy(ピーナッツアレルギー患児のピーナッツタンパク質摂取への反応に、経皮免疫療法の効果とプラシーボの効果。PEPITES Randomized Clinical Trial(無作為化臨床試験)。JAMA. 2019; 321: 946-955. [PMC無料記事] [PubMed] [Google Scholar].
Senti G Freiburghaus AU Larenas-Linnemann D Hoffmann HJ Patterson AM Klimek L Di Bona D Pfaar O Ahlbeck L Akdis M Weinfeld D Contreras-Verduzco FA Pedroza-Melendez A Skaarup SH Lee SM Cardell LO Schmid JM Westin U Dollner R Kündig TM Intralymphatic Immunotherapy(リンパ内免疫療法。最新情報とアンメットニーズ。Int Arch Allergy Immunol. 2019; 178: 141-149. [PubMed] [Google Scholar].
Aryan Z Holgate ST Radzioch D Rezaei N A new era of targeting the ancient gatekeepers of the immune system: toll-like agonists in the treatment of allergic rhinitis and asthma. Int Arch Allergy Immunol. 2014; 164: 46-63. [PubMed】【Google Scholar】。
Chaker AM Shamji MH Dumitru FA Calderon MA Scadding GW Makatsori M Jones I He QA Subramanian KK Arm JP Durham SR Schmidt-Weber CB 抗IL-4傘下の短期草花皮下免疫療法:無作為化対照試験。J Allergy Clin Immunol. 2016; 137: 452-461.e9. [PubMed][Google Scholar].
Pfaar O Gehrt F Li H Rudhart SA Nastev A Stuck BA Hoch S Anti-IgE: A treatment option in allergic rhinitis? Allergol Select. 2021; 5: 119-127. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Dantzer JA Wood RA アレルゲン免疫療法におけるオマリズマブの使用。Clin Exp Allergy. 2018; 48: 232-240. [PubMed][Google Scholar].
Orengo JM Radin AR Kamat V Badithe A Ben LH Bennett BL Zhong S Birchard D Limnander A Rafique A Bautista J Kostic A Newell D Duan X Franklin MC Olson W Huang T Gandhi NA Lipsich L Stahl N アレルゲンと結びつきIgE関与を妨げるモノクローナルIgG抗体で猫アレルギーを治療しています。Nat Commun. 2018; 9: 1421. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Zhernov Y Curin M Khaitov M Karaulov A Valenta R Recombinant allergens for immunotherapy: state of the art. Curr Opin Allergy Clin Immunol。2019; 19: 402-414. [PMC無料記事】【PubMed】【Google Scholar】。
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
