栄養を感知するAgRPニューロンが、エネルギー欠乏時の肝臓オートファジーの制御を中継する
細胞メタボリズム
2023年4月18日オンライン公開
In Press, Corrected Proofこれは何ですか?
記事
栄養を感知するAgRPニューロンが、エネルギー欠乏時の肝臓オートファジーの制御を中継する
https://www.sciencedirect.com/science/article/pii/S1550413123001249
著者リンク open overlay panelWeiyi Chen 1 2 3, Oliver Mehlkop 1 2 3, Alexandra Scharn 1 2 3, Hendrik Nolte 4, Paul Klemm 1 2 3, Sinika Henschke 1 2 3, Lukas Steuernagel 1 2 3, Tamara Sotelo-Hitschfeld 1 2 3, Ecem Kaya 1 2 3, Claudia Maria Wunderlich 1, Thomas Langer 4, Natalia L.Kononenko 3 5, Patrick Giavalisco 4, Jens Claus Brüning 1 2 3 6 7
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.cmet.2023.03.019Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
AgRPを介した肝オートファジーフラックスの活性化にはNPYの発現が必要である
AgRP→PVHの神経回路がHPA軸と全身のコルチコステロンレベルを制御する
短期絶食時のAgRP活性阻害は、肝オートファジーのフラックスを鈍化させる
加齢による絶食誘発HPA軸活性化と肝臓オートファゴソーム形成の障害
概要
オートファジーは、エネルギー不足を感知して老化や代謝を制御する重要な因子である。我々は、マウスを絶食させると、視床下部のAgRPニューロンの活性化と並行して、肝臓のオートファジーが活性化することを発見した。AgRPニューロンの光遺伝学的および化学遺伝学的活性化は、オートファジーを誘導し、オートファジー制御因子のリン酸化を変化させ、ケトジェネシスを促進する。AgRPニューロンによる肝臓のオートファジー誘導は、視床下部傍核(PVH)のNPY放出に依存しており、NPY1R発現ニューロンのシナプス前抑制を介してPVHCRHニューロンを活性化している。逆に、エネルギー欠乏時にAgRPニューロンを阻害すると、肝オートファジーの誘導と代謝のリワイヤリングが阻害される。AgRPニューロンの活性化は、循環コルチコステロン濃度を上昇させ、肝グルココルチコイド受容体の発現を低下させると、AgRPニューロン依存的な肝オートファジーの活性化が抑制される。以上のことから、本研究は、栄養不足時の代謝適応を制御する肝臓オートファジーの基本的な制御原理を明らかにした。

図解抄録
ダウンロード 高解像度画像ダウンロード(138KB)
ダウンロード フルサイズ画像をダウンロードする
キーワード
AgRPニューロン
オートファジー
視床下部
非細胞的な自律
短期断食
肝代謝
HPA軸
コルチコステロン
CRHニューロン
NPY1R
はじめに
視床下部は、摂食、飲水、体温調節などの基本的な恒常性維持反応の制御における重要な中枢である。特に、視床下部弧状核(ARH)の神経細胞は、不完全な血液脳関門の特権的な局在を示し、循環から発信されるシグナルを敏感に感知することが可能です2。ここには、解剖学的に隣接し、機能的に異なる2つの神経細胞集団、すなわち、アグーチ関連ペプチド(AgRP)発現ニューロンとプロオピオメラノコルチン(POMC)発現ニューロンが存在し、これらは代謝の合図を感知し統合することにより、食物摂取とエネルギー消費のみならず全身のブドウ糖恒常性、タンパク質恒常性も調節するために重要である3。成体マウスのAgRPニューロンの選択的切除は、飼料摂取量を減少させるが4,5、AgRPニューロンを光遺伝学的および化学遺伝学的に刺激すると、強迫的な食物要求と摂食行動が引き起こされる6,7。適応的摂食反応に加えて、AgRPニューロンの活動は、生物のエネルギー利用能力と協調して追加の自律および行動反応も調整します。このことは、グルコースホメオスタシスのCNS依存的な制御において例証されている。AgRPニューロンのインスリン受容体を選択的に不活性化したマウスでは、インスリンによる肝グルコース産生抑制能が低下しています8。さらに、AgRPニューロンの急性光遺伝学的および化学遺伝学的刺激は、褐色脂肪組織(BAT)におけるグルコース代謝の阻害を介し、末梢のインスリン感受性を低下させる9。末梢信号を統合し、エネルギー利用可能性に応じて電気活動を調整する能力に関連して、感覚的食物知覚は、AgRPニューロンの一過性および急速な阻害に関与している10。一方、POMCニューロンは、食後を想定して肝臓のプロテオスタシスを調節するために、食物の知覚に伴って活性化される。
メラノコルチンニューロンを介したエネルギー恒常性と複数の統合的な生理反応のこの協調的な制御は、飢餓が生物にとって生命を脅かす挑戦であるため、生物の生存にとって重要である。ここで、AgRPニューロンによる摂食は、全身の生存メカニズムをサポートする。しかし、餌がない状態では、限られた餌の供給を補うために、さらなる細胞自律的・全身的なメカニズムが活性化される。この制御において進化的に保存された主要な経路はオートファジーである。従来、オートファジーは、細胞の恒常性を維持し、栄養不足時のエネルギー生産のための代謝基質を提供するために、タンパク質、脂質、核酸などの細胞質成分をリソソームへ誘導し、分解する細胞自律的なプロセスとみなされてきた。12 オートファジーの誘導には、オートファゴソームと呼ばれる二重膜小胞の新規形成が必要であり、この小胞はリソソームと融合する際に荷物を取り込んで分解に向かわせる13。オートファジーの開始は、Ulk-1とmTOR(哺乳類ラパマイシン標的)の拮抗キナーゼによって厳密に制御されている。栄養飢餓は、5'アデノシン一リン酸活性化プロテインキナーゼ(AMPK)の活性化を誘導し、この活性化がUlk-1をリン酸化・活性化してオートファジーを活性化する14。LC3-IIはp62などのオートファジー受容体に認識されて、分解する標的貨物に結び付けられる。伸長したオートファゴソームは、さらに機能的な成熟を経て、最終的にリソソームと融合し、荷物の分解を促進する。オートファジーは、エネルギー制御の役割を果たすだけでなく、タンパク質の品質管理においても重要な役割を担っており、ミスフォールドしたタンパク質や損傷した細胞小器官をリソソームで分解している。オートファジーの変化は、老化や、代謝異常などの老化関連疾患の発症に密接に関係しています12,15。
このように、オートファジーは様々な代謝プロセスの制御において重要な役割を担っています。オートファジーの機能が低下した状態でのグリコーゲンの蓄積は、加齢に伴う疾患の一因となる。さらに、飢餓に応答して、脂質滴はオートファジーによって選択的に分解され、リパーゼを介したエネルギー供給のための脂肪酸の解放に代わるメカニズムを提供することができる。さらに、オートファジーを介した核内共抑制因子(NCoR1)の分解は、肝脂質恒常性制御におけるPPARαの活性化を促進し、PPARαの活性化はオートファジーを促進することが示されている18。したがって、オートファジーと脂質代謝の激しい双方向の相互作用は、代謝の恒常性や老化、代謝障害の発生をコントロールしている。
注目すべきは、AgRPとPOMCニューロンにおけるオートファジーの誘導が、それらのエネルギー状態依存的な制御と関連していることである。さらに、AgRPニューロン内のオートファジー遺伝子Atg7を特異的に欠損させたマウスでは、POMCとα-メラノサイト刺激ホルモン(α-MSH)レベルが上昇し、体重と脂肪量の減少に寄与していると考えられている。また、POMCニューロンのオートファジーが機能しなくなると、軸索の伸長や下流の標的核への投射が阻害され、代謝異常が引き起こされる20。興味深いことに、POMCニューロンにおけるオートファジーの誘導は、BATにおける低温誘導性脂肪分解に関連している21。
本研究では、空腹時に活性化するAgRPニューロンとエネルギー不足時の肝臓生理の適応との相互作用の可能性について検討しました。その結果、短期間の飢餓状態によるAgRPニューロン活性の誘導、あるいは摂食状態でのAgRPニューロンのオプトジェニックおよびケモジェニック活性化が、肝オートファジックのフラックスと代謝のリモデリングを促進することを見出した。興味深いことに、この現象は神経ペプチド(NPY)の発現がない場合には消失し、AgRPニューロンにおけるNPYの選択的再発現によりAgRPニューロン依存的な肝オートファジーの活性化が回復する。さらに、NPYはPVHのCRHニューロンを支配するNPY1R発現GABA作動性ニューロンのシナプス前抑制を促進することも明らかにした。重要なことは、短期断食中にAgRPニューロンを化学的に抑制すると、飢餓に起因する肝臓のオートファジーが消失することである。最後に、AgRPニューロンによる肝臓オートファジーの誘導は、血清コルチコステロン濃度の上昇と肝臓グルココルチコイド受容体(GR)シグナルを介することが明らかになった。以上のことから、本研究は、栄養不足時の代謝適応制御における肝臓オートファジーの基本的な制御原理を明らかにするものである。
研究成果
短期絶食とAgRPニューロン活性化により肝臓のオートファジーが促進される
ARHの空腹を促すAgRP-およびNPY-co-発現(AgRP)ニューロンの絶食誘発活性化の動態を評価するために、短期間の食物欠乏のモデル、すなわち暗黒サイクルに入った4時間後および6時間後を採用した(図S1A)。自然摂食サイクルの最初の4時間と6時間の間に食物へのアクセスを制限すると、食物へのアクセスが自由な動物と比較して、血糖濃度が低下し、体重が1.0〜1.5 g減少した(図S1BとS1C)。AgRP発現ニューロン(シアン)におけるFos mRNA(マゼンタ)発現のダブルin situハイブリダイゼーションによりAgRPニューロンの活性化を評価したところ、4時間後にはFos陽性AgRPニューロンの割合が絶食マウスの12%から47%に、6時間後にはFos陽性細胞の割合が絶食マウスの8%から59%に増加し、これらの細胞の活性化が確認できた(図S1Dおよび図S1F)。一方、食欲不振のPOMCニューロン(黄色)の活性化は、同期間中、摂食マウスに比べて絶食マウスで容易に減少した(図S1DおよびS1E)。これらの結果は、短期間の栄養供給の変化により、AgRPとPOMCニューロンの活性が急速に変化することを強調するものであった。
AgRPとPOMCニューロンのこのような短期的な制御と、肝臓や脂肪組織などの末梢臓器の代謝経路を制御する役割がよく知られていることから22,23、我々は次に、対照マウスの空腹時に観察されたものと同等の時間経過で、光遺伝的刺激によりAgRPニューロンを活性化した場合の結果を調査しました。AgRPニューロンに特異的に光活性化イオンチャネルChannelrhodopsin-2(ChR2)を発現させたマウスのARH上部に光ファイバーを設置した(図1A)。光サイクル中にAgRPニューロンを青色光で照射すると、既述のようにレーザー刺激がない場合に観察される食物摂取量と比較して、4時間にわたる食物摂取量の増加が生じた(図S2AおよびS2B)6。さらに、食物不在の光サイクル中に1、2および4時間のAgRPニューロンの光遺伝的活性化を実施した(図1A)。これらの動物の肝臓からmRNAを抽出し、ディープmRNAシーケンシングに供した。1時間のオプトジェニックAgRPニューロン刺激では肝臓のトランスクリプトームにはわずかな変化しか見られなかったが(データ示さず)、オプトジェニックAgRPニューロン活性化後2時間から4時間の間に遺伝子発現に漸進的かつ重なり合った変化が見られた(図1B)。実際、AgRPニューロンの光刺激2時間後と4時間後に時間依存的に増加(n = 707)または減少(n = 612)を示す1319遺伝子の協調制御があった(FDR < 0.05)(図1C)。次に、AgRPニューロンの活性化によって制御される肝臓の特定の経路を特定するために、これらの遺伝子を遺伝子オントロジー(GO)項の濃縮解析に供した。この解析により、オートファジー制御と異化アミノ酸代謝経路が、上位に濃縮されたGO用語の中に含まれていることが判明した(図1D)。
ダウンロード: 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図1. AgRPニューロンのオプトジェネティック刺激により、肝臓のオートファジーを誘導する
(A)食物存在下および非存在下でのAgRPニューロンのオプトジェニック活性化の実験デザイン。
(B) 2時間刺激(黄色)、4時間刺激(青色)、および2時間と4時間の刺激間の重複肝転写物(赤色)のLog2-fold変化の散布図(n = 5動物/グループ)。各色のドットは、有意に制御された遺伝子を表す。
(C) 2時間および4時間のAgRPニューロン活性化後に増加または減少する肝遺伝子発現のLog2-fold変化量。
(D) フィッシャーの正確検定結果を、有意に濃縮された遺伝子オントロジー用語と有意に制御された遺伝子の割合を示す棒グラフに表した。
(E)オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子発現の定量的リアルタイムPCRによる検証;データは、それぞれのChR2WT群に対して正規化し、Tbp発現に対する個々の値を散布図として表す(n=5動物/群)。
(F)1、2、および4時間光刺激したChR2WTおよびChR2AgRPマウスの肝臓ホモジネートの代表的なウェスタンブロット分析で、オートファジー・マーカー・タンパク質LC3-I、LC3-IIおよびp62ならびに対応するgapdh負荷コントロールを示す(定量化に用いた追加のウェスタンブロットについて図S2C参照)。
(G)1、2、および4時間のオプトジェニック刺激を受けたChR2WTおよびChR2AgRPマウスの肝臓抽出物の核後上清におけるオートファジー性マーカータンパク質の濃度分析(n=9〜10匹/グループ/時間点)。
(H)4時間オプトジェネティック刺激を受けたChR2WTおよびChR2AgRPマウスの肝臓切片の代表的なTEM画像である。(TOP)オートファジー液胞を青矢印で示し、二重膜オートファゴソームのデジタルズーム画像を白点枠で囲んでいる。スケールバー、1μm。
(I) ChR2WTおよびChR2AgRPマウスにおける1、2、4時間の光遺伝学的刺激後の100μm2あたりの二重膜自食胞の定量化(n = 4動物/グループ/時点、約20画像/動物/肝臓)。
(J) AgRPニューロンの4時間のオプトジェニック活性化後のin vivoでのリューペプチンベースのLC3-IIフラックス分析による肝臓ホモジネートの実験デザインおよび代表的なウェスタンブロット分析。マウスはコントロールとして生理食塩水を注入した(n = 4動物/グループ)。
(K)(J)に記載された肝臓における正味のLC3-IIフラックス(n=4動物/グループ)。
データは、平均±SEMとして表される。統計解析は、二元配置分散分析に続くŠídákポストホックテスト(EおよびFについては反復測定[RM]なし)、一元配置分散分析に続くTukeyのポストホックテスト(Iについて)または非対二尾スチューデントのtテスト(Kについて)により行われた。∗p ≤ 0.05; p ≤ 0.01; p ≤ 0.001, p ≤ 0.0001 (図 S1 および S2 も参照).
さらに、定量的リアルタイムPCR解析により、オートファジーに関連する転写産物(Trp53inp1、Ulk1、Sesn2、Atp6v0d1)の肝発現が増加することが明らかになりました。さらに、脂質代謝に関わる遺伝子(Plin5、Lpin1、Lpin2、Lipg、Ppargc1a、Foxo1)の協調制御が検出された(図1E)。また、AgRPニューロンの活性化は、FOXO/Ppargc1aの転写制御下にある糖新生の主要な制御因子(G6pc、Pck1)の発現を増加させ、このうち両者の発現もAgRPニューロン刺激により増加した(図1E)。
肝臓におけるオートファジーは、糖代謝と脂質代謝の両方の制御に関連していることから、次に、AgRPニューロン短期刺激後にオートファジーが本当に活性化されるかどうかを評価した。そこで、AgRPニューロン光刺激マウスの肝臓において、オートファゴソーム量の指標である微小管関連タンパク質軽鎖3(LC3、LC3-II/LC3-Iの比)、オートファジーによって分解される受容体であるp62(別名:SQSTM1/セクレストソーム1)の免疫ブロッティングをオートファジー誘導マーカーとして実施しました。この解析により、AgRPニューロンの光刺激から2時間後と4時間後に、LC3の処理が時間依存的に増加したのに対し、p62の存在量は変化しなかった(図1Fと図1G)。
AgRPニューロンの活性化が肝臓でのオートファジーを促進するのに十分であるという考えをさらに裏付けるために、透過型電子顕微鏡(TEM)を用いて、オプトジェニックAgRPニューロン刺激を行ったマウスの肝臓切片におけるオートファジー空胞を定量化しました。AgRPニューロンでChR2が発現していない同腹子は、コントロールとして4時間光刺激した。ここで、4時間の光遺伝学的AgRPニューロン刺激を行ったマウスの肝臓において、コントロールと比較して3倍に相当するオートファジー液胞の数の漸増を検出した(図1Hおよび図1I)。
最後に、AgRPニューロン活性化の有無にかかわらず、マウスにおけるリソソーム阻害後のLC3-II蓄積を評価した。リソソーム阻害剤(リューペプチン)の存在下と非存在下でのLC3-II蓄積の程度は、LC3-IIフラックスまたはオートファジーフラックスを反映する。この方法は、生体内のオートファジーの研究に広く用いられている24。興味深いことに、AgRPニューロンを光遺伝学的に刺激すると、肝のLC3-IIフラックスが明らかに増加した(図1Jおよび図1K)。これらの実験は、AgRPニューロンの光遺伝学的刺激が、肝臓におけるオートファジックのフラックスを活性化するのに十分であることを実証している。
中枢性グレリン作用と短期絶食は肝臓のオートファジーを促進する
AgRPニューロンの光遺伝学的刺激により肝臓のオートファジーが活性化されるという考え方に基づき、我々は、AgRPニューロンを介して主に作用することがよく知られている自然の絶食関連刺激が、肝臓のオートファジーを促進することができるかどうかを検討することを目的としました。グレリンは、エネルギー不足に反応して消化管から放出されるオレキシジェニックペプチドホルモンであり、AgRPニューロンに発現するグレリン受容体(GhSR)を介して摂食を促進する25,26,27。自由摂食のC57BL/6Nマウスに、グレリン(1.5μg)を1日の光周期のZT1およびZT3に2回脳室内注射した(図S3A)。予想通り、グレリンのi.c.v.投与は、AgRPニューロンの活性化について記載されていたものと同様に、4時間にわたる食物摂取量の有意な増加を促進し(図S3B〜S3D)、絶食マウスでは運動活性を促進したが摂食マウスでは促進しなかった(図S3EおよびS3F)9。食物不在下でグレリンを繰り返し注射すると、食塩水を注射したマウスに比べてAgRPニューロンでのFos mRNA発現が9%から75%に急速に増加した(図S3GとS3H)。興味深いことに、グレリンのi.c.v.注射を繰り返すと、最初の注射から4時間後に肝臓のLC3脂質の3倍の増加とp62タンパク質発現の約30%の減少によって証明されるように、オートファジーを促進した(図S4AからS4C)。重要なことは、同じ用量のグレリンのi.p.注射は肝臓のオートファジーを誘導することができず、グレリンが肝臓のオートファジーを活性化するために中枢に作用するという証拠を提供した(図S4BおよびS4D)。さらに、グレリンのi.c.v.投与(i.p.投与ではない)は、オートファジー、グルコース代謝、脂質代謝に関連する遺伝子発現に、オプトジェニックAgRPニューロン活性化で観察されたのと同様の変化を、弱い程度ではあるが引き起こし、低用量の末梢適用グレリンは、比較的に軽い食物摂取刺激( i.p. 2倍 vs i.c.v. 5倍 )を誘発した( 図 S4E-S4I)。
AgRPニューロンのオプトジェニックまたはグレリン誘導活性化で観察された肝臓オートファジーの誘導および肝臓mRNA発現の変化を、短期間の栄養欠乏下で観察されたものと直接比較するために、4時間および6時間絶食させたマウスで肝臓オートファジーの誘導を評価しました。この分析により、4時間の暗黒サイクルへの食物制限は、AgRPニューロンのオプトジェニックまたはグレリン媒介活性化と比較して、LC3プロセッシングの同様の増加を誘導することがわかった(図S5AおよびS5B)。次に、暗黒サイクルに4時間絶食させたC57BL/6Nマウスにおいて、リューペプチンを用いたオートファジックフラックス評価を実施した。リューペプチンの存在下で、絶食させたマウスはLC3-II蓄積の著しい増加を示し、肝ネットLC3-IIフラックスの明確な刺激を明らかにした(図S5CおよびS5D)。同様に、オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子の肝臓mRNA発現プロファイルは、強固に制御された(図S5E)。
AgRPニューロン依存的な肝臓オートファジーの活性化にはNPYの発現が必要である
これらの神経細胞は、AgRPに加えて、Neuropeptide Y(NPY)と抑制性神経伝達物質GABAを発現しており、これらの細胞からのAgRP、NPY、GABAの放出は、食物摂取の運動活性化の際に異なる局面を制御している28,29,30ここで我々は、NPY存在または不在下で、ARH内のAgRP/NPY共発現神経細胞からNPY放出を活性化して肝オートファジーを促進する可能性について検証した。これを実現するために、ROSA26遺伝子座のChR2をCre依存的に発現するマウス(ROSA26ChR2)とNPY遺伝子座のヌル変異をヘテロ接合したマウス(NPYΔ/wtマウス)を交配した31。さらにAgRP-IRES-Creマウスとの交配により、同腹子が得られ、これらはコントロール(ROSA26ChR2fl/wt;AgRPCrewt/wt;NPYwt/wt、すなわち.NPYwt/wt)、NPYの存在下でAgRPニューロンでChR2を発現した(ROSA26ChR2fl/wt;AgRPCreCre/wt;NPYwt/wt、すなわち、 ChR2AgRP;NPYwt/wt)、AgRPニューロンにおけるChR2発現の非存在下でNPY発現を欠く(ROSA26ChR2fl/wt;AgRPCrewt/wt;NPYΔ/Δ、すなわち.NPYΔ/Δ)、またはAgRPニューロンでChR2を発現しNPYを欠くもの(ROSA26ChR2fl/wt; AgRPCreCre/wt; NPYΔ/Δ、すなわちChR2AgRP;NPYΔ/Δ)(図2A)だった。AgRPニューロンの光遺伝学的刺激は、ChR2AgRP; NPYwt/wtマウスにおいてLC3脂質の明確な3倍の誘導を誘発したが、この反応はNPYノックアウトマウスのAgRPニューロンの光遺伝学的刺激により消失した(図2B、2C、およびS6A)。同様に、ChR2AgRP; NPYwt/wtマウスのAgRPニューロン活性化で明確に誘導されたオートファジー、グルコース代謝、脂質代謝に関する遺伝子のmRNA発現誘導は、NPY非発現のAgRPニューロン活性化で同様に減少した(図2D)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図2. AgRPを介した肝オートファジーの制御には、NPYの発現が必要である。
(A) ARHにおけるNPYのウイルスによる再発現のワークフロー、NPYの存在下および非存在下でAgRPニューロンを光遺伝学的に刺激するための実験デザイン。
(B)4時間の光刺激後に給餌したChR2WT、ChR2AgRP、ChR2 NPYΔ/Δ、およびChR2AgRP-NPYΔ/Δマウスの肝臓抽出物を用いた代表的なウェスタンブロット(定量化に用いた追加のウェスタンブロットについては図S6A参照)。
(C)(B)のマウスの肝臓ホモジネートの核後上清におけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック分析(n=9〜10動物/グループ)。
(D)オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子の定量的リアルタイムPCR分析;データは、ChR2WTの同腹子に正規化し、Tbp発現に対する個々の値で散布点プロットとして表した(n=6匹/グループ)。
(E)NPYの存在下および非存在下におけるAgRPニューロンのDREADD刺激に関する実験デザイン。
(F)ZT3.5およびZT5.5でのCNO(1mg/kg)のi.p.注射後、ZT7.5で犠牲にした、摂食したhM3DgqWT、hM3DgqAgRP、hM3DgqNPYΔ/Δ、およびhM3DgqAgRP-NPYΔ/Δマウスからの肝臓エキスの代表的ウエスタンブロット(定量化に用いた追加のウエスタンブロットは図S6Fをも参照)。
(G)hM3DgqWT(n=7)の肝臓ホモジネートの核後上清におけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック分析である、 hM3DgqAgRP(n=14)、hM3Dgq NPYΔ/Δ(n=9)、およびhM3DgqAgRP-NPYΔ/Δ(n=9)のマウス。
(H)ChR2AgRPおよびChR2AgRP-NPYΔ/Δマウスではコントロールウイルス(AAV-DIO-mCherry)を、ChR2AgRP-NPYΔ/ΔマウスではNPYウイルス(AAV-DIO-NPY)をARHで両側注射して発現が成功したことを示す代表的な共焦点画像である。なお、ARHとPVHのNPY含有線維は、免疫組織化学を用いてNPYを再発現したChR2AgRP-NPYΔ/Δマウスで検出された;これは対応するコントロールには存在しない。
(I)オプトジェニック刺激4時間後の(H)のマウスからの肝臓抽出物を用いたオートファジックマーカー蛋白質の代表的なウェスタンブロット(定量化に用いた追加の複製物については図S6Gも参照)。
(J)(I)のマウスからの肝臓ホモジネートの核後上清におけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック分析(n=10〜17動物/グループ)。
データは、平均値±SEMで表した。統計解析は、一元配置分散分析、Tukeyのポストホックテストにより実施した。∗p ≦ 0.05; p ≦ 0.01; p ≦ 0.001, p ≦ 0.0001 (図 S6 も参照).
補完的なアプローチによりAgRPニューロンのNPY依存および非依存シグナルの役割をさらに確認するため、NPY発現の有無にかかわらずAgRPニューロンを化学的に活性化した場合の結果を調べた。この目的のために、NPYを発現しているマウスまたは欠損しているマウスのAgRPニューロンにおいて、ROSA26遺伝子座由来の刺激性化学原性受容体hM3DGq(ROSA26hM3DGq)をCre依存的に発現させました(図2E)。AgRPニューロンのオプトジェニック刺激時に観察されたものと同様に、AgRPニューロンのケモジェニック活性化も肝臓のLC3脂質化を著しく促進し、この反応はhM3DGqAgRP;NPYΔ/Δマウスでは消失した(図2F、2G、およびS6F)。
NPYの発現がARHのAgRPニューロンに限定されないことはよく知られている。実際、NPYは中枢神経系と末梢組織の両方でも広く発現している。そこで、NPY欠損マウスで観察されたAgRPニューロン活性化に伴う肝臓のオートファジー誘導の変化が、実際にAgRPニューロンにおけるNPY発現の欠損による特異的な結果であるかどうかを調査することを目的とした。そこで、ChR2AgRP; NPYwt/wtマウスおよびChR2AgRP; NPYΔ/ΔマウスではmCherryのCre依存的発現を可能にするAAVを、ChR2AgRP; NPYΔ/ΔマウスではNPYのCre依存的発現を可能にするAAVをARH内に立体的に導入しました。免疫組織化学的解析により、ChR2AgRP; NPYwt/wtマウスおよびChR2AgRP; NPYΔ/ΔマウスのARHにおけるAgRPニューロンでのmCherry発現の成功、およびChR2AgRPのARHにおけるNPYの発現を確認した; mCherry発現ウイルスを注射したNPYwt/wtマウス、およびCre依存的なNPYの発現を可能にするAAVを注射したChR2AgRP; NPYΔ/Δマウスでは、以前に記述したように(図2H)。 30 mCherry発現ウイルスを注射したChR2AgRP; NPYwt/wtマウスの肝臓では、レーザー刺激によりLC3プロセッシングが明らかに誘導されたが、この応答はChR2AgRP; ARHにAAV mCherryを注射したNPYΔ/Δマウスでは消失したが、AgRPニューロン制限下でNPYを再発現したChR2AgRP; NPYΔ/Δマウスでは回復した(図2I、2J、S6G)。さらに、オートファジー、グルコース代謝、脂質代謝に関与する肝遺伝子の制御も、AgRPニューロンのNPY再発現により、ほぼ回復した(図S6H)。
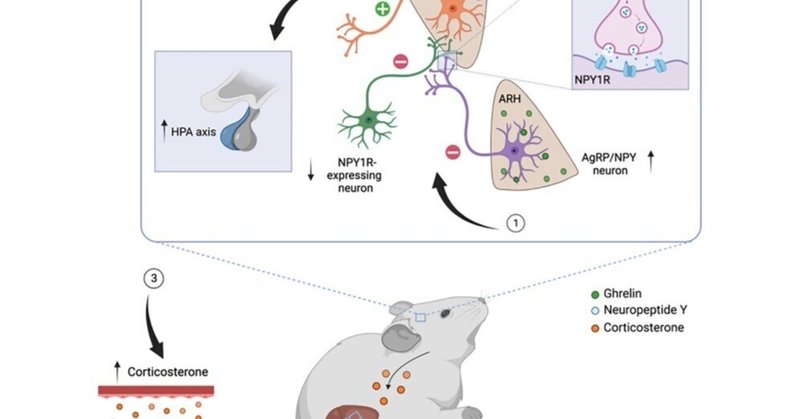
PVHNPY1Rニューロン阻害は肝オートファジーを活性化する
AgRPニューロンは、中枢神経系における広範な神経細胞ネットワークを通じて、食物摂取および代謝調節機能を発揮する9,32。視床下部傍室核(PVH)、視床傍室視床(PVT)、外側視床下部(LHA)、線条体終末ベッド核(BNST)のAgRP突起の光遺伝学的刺激は、AgRPニューロン活性化による食物摂取促進効果に寄与するが32、LHAとBNSTの突起刺激は、グルコースホメオスタシスの短期制御に寄与する9。肝臓のオートファジー制御を担うAgRPニューロンの下流の神経回路を解明するために、ChR2AgRPマウスで光遺伝学的神経回路マッピング実験を実施した(図S8A)。光ファイバーをPVHの上に埋め込み、マウスにその後10mWと20mWの青色光照射を行った(図S7AおよびS7B)。どちらのレーザー出力も、以前に説明したように、食物摂取の同様の増加を誘発した(図S7B)32。したがって、日周期で食物を摂取しない状態で4時間、AgRP→PVH投射の光刺激を、10mWのレーザー強度を用いて行った。AgRP → PVH突起の光刺激により、肝臓のLC3プロセッシングが増加し、オートファジー、グルコース代謝、脂質代謝に関連する肝臓の遺伝子発現が、ARHのAgRP神経体部を刺激した場合と同様に協調的に変化した(図S8B、S8C、S9A)。同様に、AgRP → LHA突起の刺激も食物摂取量の大幅な増加をもたらし(図S7CおよびS7D)、食物非存在下で10mWの青色光照射も、AgRP → PVH突起の光刺激よりも程度は低いものの、肝臓のLC3プロセッシングを上昇させた(図S8DとS8E)。さらに、肝臓の遺伝子発現プロファイリングにより、オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子のmRNA発現変化のプロファイルが、AgRP → PVH突起刺激時に観察されたものと類似していた(図S9B)。一方、AgRP → BNST投射刺激では、摂食がしっかりと誘導されたにもかかわらず(図S7EおよびS7F)、肝臓におけるLC3プロセッシングは変化せず、オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子の発現はわずかな程度しか制御されなかった(図S8F、S8G、およびS9C)。これらのデータは、AgRPニューロンのPVHとLHAへの投射が、BNSTではなく、肝オートファジーの制御に主に関与している可能性を示しているが、これらの知見は、研究した投射部位内のAgRP繊維の密度に応じて、観察された生理学的変化のある程度は、AgRPニューロンソマタへの活動電位の逆伝播に起因する可能性も排除しているわけではない。
AgRPニューロンの活性化を介して脳が介在する肝臓のオートファジーを担う下流の神経回路をさらに明確にするために、PVHまたはLHAを介してNPYがこの反応を媒介する可能性について検討した。NPY1RおよびNPY5Rの活性化を介したNPYのニューロンに対する下流の抑制効果、およびAgRPニューロン刺激のオレキシジェニック効果を媒介するNPY1Rシグナルの役割がよく知られていることから33、NPY依存的にNPY1R発現ニューロンやPVHおよびLHA内の突起に発現するNPY1Rを抑制することが肝自食の制御に寄与すると仮定した。そこで、NPY1R-Creトランスジェニック動物に、抑制性DREADD受容体hM4Diを発現するCre依存性アデノ随伴ウイルス(AAV)をPVHまたはLHAに両側から注入した(図3A)。興味深いことに、CNOを介したPVHNPY1Rニューロンの阻害では、肝LC3脂質の有意な上昇とそれに伴うp62レベルの低下が観察された(図3Bおよび図3C)。さらに、PVHNPY1Rニューロンの化学原性阻害に伴い、オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子転写も誘導された(図3D)。一方、LHANPY1Rニューロンの阻害は、肝オートファジーにも肝遺伝子発現プロファイルにも影響を与えなかった(図3E-3G)。
ダウンロード: 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図3. PVHにおけるNPY1R阻害は肝臓のオートファジーを促進する
(A)NPY1R-CreマウスにおけるCre依存性AAV-hM4diのPVHまたはLHA標的送達のワークフローと、CNOによるNPY1R発現ニューロンの阻害のための実験デザイン。
(B)生理食塩水またはCNO(3mg/kg)処理後のPVHNPY1Rニューロンの4時間阻害の代表的なウェスタンブロットである。
(C)(B)のマウスの肝臓ホモジネートにおけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリー解析(n=10〜11匹/群)。
(D)オートファジー、グルコースおよび脂質代謝に関連する遺伝子の定量的リアルタイムPCR分析;データは生理食塩水群に対して正規化し、Tbp発現に対する個々の値を散布点プロットとして表す(n=7〜11匹/グループ)。
(E)生理食塩水またはCNO(3mg/kg)投与後のLHANPY1Rニューロンの4時間阻害の代表的なウエスタンブロット。
(F)(E)のマウスの肝臓ホモジネートにおける、オートファジーのマーカータンパク質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック解析(n=6動物/群)。
(G)オートファジー、グルコース代謝、および脂質代謝に関連する遺伝子の定量的リアルタイムPCR分析;データは、生理食塩水群に対して正規化し、Tbp発現に対する個々の値で散布点プロットとして表す(n=6動物/グループ)。
データは、平均値±SEMで表される。統計解析は、対にならない両側スチューデントのt検定により行った。∗p≦0.05、**p≦0.01、**p≦0.001、**p≦0.0001(図S13も参照).
AgRPニューロンの活性化は、短期栄養欠乏時の肝オートファジーの誘導に必要である
以上のことから、AgRPニューロンの活性化が肝臓のオートファジーを促進するのに十分であることが明らかになりました。しかし、AgRPニューロンの活性化が、短期間の食物制限中に肝オートファジーを調節するのに必要なのかどうかという重大な疑問が残りました。この疑問を探るため、我々は、短期間の食物制限中にAgRPニューロンを阻害し、AgRPニューロンの活性化の有無による食物除去時の肝オートファジーの誘導を評価することを目的とした。
具体的には、AgRP-IRES-CreマウスにCre依存性のAAVをARHに両側注射し、mCherry(AAV-hSyn-DIO-mCherry;mCherry)または変異ヒトグリシン受容体(AAV-FLEX-hGlyRa1AG-mCherry;Flex-hGlyRa1AG)、つまり内因性のリガンドグリシンに対して不活性だがイベルメクチンの投与により制御できるものを発現させています34。ARHのAgRP細胞の約50%〜60%がmCherryまたはFlex-hGlyRa1AGの発現に成功した(図S10AおよびS10B)。注目すべきは、変異したhGlyR受容体を発現するニューロンが、i.p.投与されたイベルメクチンに応答して神経活動の長期抑制を示したことである35。本研究では、両群のマウスにイベルメクチン(5 mg/kg)をi.p.注射し、続いて同日の暗期開始時に4時間の絶食を行った(図 4A)。AAV-DIO-mCherryを注入し、イベルメクチン処理を行ったマウスは、短期間の食物欠乏マウスにおいて、Fosを発現するAgRPニューロンの期待される割合(約40%)を示したが、AAV-Flex hGlyRa1AG-mCherry を注入したマウスは、イベルメクチン注入後の同じ期間の栄養欠乏においてAgRPニューロンのFos発現を誘導できなかった(図4Bおよび図4C)。このことは、短期間の絶食時にAgRPニューロンの活動をうまく抑制できたことを示している。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図4. 短期栄養欠乏時の肝オートファジー誘導はAgRPニューロンの活性化を必要とする
(A) AgRPニューロンにおけるmCherryまたはhGlyRのウイルスによる発現のワークフロー、AgRPニューロンの化学原性阻害の実験デザイン。
(B) イベルメクチン(IVM)注射後にAAV-DIO-mCherryまたはAAV-Flex-hGlyRを両側ARH内に注射した4時間絶食のAgRP-IRES-CreマウスのARHにおけるAgRP(シアン)およびcFos(マゼンタ)mRNA発現を示す代表的共焦点画像。
(C)i.p.IVM注射および4時間の短期絶食後の(B)のマウスからのcFos陽性AgRPニューロンの定量化(n = 6-7動物/グループ)。
(D)暗黒サイクルでの短期絶食後の(B)のマウスからの肝臓抽出物の代表的なウエスタンブロット(定量化に使用した追加の複製物については図S10Cも参照)。
(E)(B)のマウスからの肝臓ホモジネートにおけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック分析(n=13〜14動物/グループ)。
(F)AgRPニューロンの阻害および4時間の短期絶食後のin vivoにおけるリューペプチンを用いたLC3-IIフラックス解析による肝臓ホモジネートの代表的ウェスタンブロット解析。マウスにはコントロールとして生理食塩水を注入した。
(G)(F)のマウスからの肝臓ホモジネートからの正味LC3-IIフラックスのデンシトメトリー分析(n=5動物/群)。
(H)オートファジー、グルコースおよび脂質代謝に関連する遺伝子の定量的リアルタイムPCR分析;データは、AAV-DIO-mCherryを注射したマウスに対して正規化し、Tbp発現に対する個々の値を散布点プロットとして表す(n=13〜14匹/グループ)。
(I)4時間絶食時のZT11とZT15の間の体重の変化(n=13〜14匹/グループ)。
(J)ベースライン(ZT11)および4時間絶食後(ZT15)の血糖値測定;絶食前後の個々の動物の血糖値で表す(n=13〜14匹/群)。
データは、平均値±SEMで表される。統計解析は、非対称両側スチューデントt検定(C、E、F、G)または二元配置RM ANOVAとŠídák post hoc検定(H)により行った。∗p ≤ 0.05; p ≤ 0.01; p ≤ 0.001, p ≤ 0.0001 (図 S10 も参照).
重要なことは、オートファジーのフラックス(図4D-4GおよびS10C)およびオートファジー、グルコース代謝、脂質代謝に関連するmRNA転写物の発現(図4H)は、コントロールウイルスを注射したグループと比較してAAV-Flex-hGlyR-mCherryを注射した空腹マウスの肝臓で著しく減少した。これらのデータを総合すると、短期栄養欠乏時の肝臓オートファジー誘導には、AgRPニューロンの活性化が必要であることが立証された。さらに、栄養欠乏時のAgRPニューロンの活性化を抑制したマウスは、食物欠乏時の体重減少および血糖値低下が抑制された(図4Iおよび4J)ことから、絶食時の生理的適応の媒介にAgRPニューロンの活性化が重要であることが裏付けられた。
AgRPニューロンの活性化は、オートファジーと脂質動員を制御する経路において、肝のリン酸化プロテオームの変化を促進する。
AgRPニューロン刺激時のオートファジー制御における既知のシグナル経路の制御を調べるため、リボソームタンパク質S6、AKT、Atg14、AMPKのリン酸化と転写因子EB(TFEB)のタンパク質発現をオプトジェニックAgRPニューロン活性化の時間コースにわたって評価しました。その結果、神経細胞活性化から1時間後と2時間後にS6リン酸化が一過性に上昇し、2時間の刺激でAKTリン酸化が穏やかに活性化したが、AMPKリン酸化には変化がなかった(図S11A-S11C)。一方、AgRPの長時間活性化では、Atg14のリン酸化とTFEBの発現が増加した(図S11DおよびS11E)。長時間の光遺伝学的AgRPニューロン活性化により肝臓で影響を受ける経路をさらに定義するために、光遺伝学的AgRPニューロン活性化により肝臓のリン酸化プロテオームの変化を調査した。肝臓のオートファジーの駆動がAgRPニューロンのNPY発現に依存していることが明らかであることから、無刺激のマウスと、NPY発現の有無にかかわらずAgRPニューロンを4時間活性化したマウスを比較して、公平なリン酸化プロテオーム解析を実施した(図5A)。具体的には、一元配置分散分析を行って、合計92個の異なる制御を受けるリン酸化ペプチドを同定し、そのうち62個がNPYの存在下で4時間のAgRPニューロン活性化で増加し、NPYの非存在下では増加しませんでした(図5B)。興味深いことに、これらのリン酸化ペプチドは、オートファジーのよく知られた制御因子であるUlk1(S450)、Sqstm1(T269、T272)、Optn(S345)、Zfyve1(Dfcp1としても知られている)(S129)(図5Cおよび5D)を含むプレオートファゴソーム構造、オートファジー胞およびマクロオートファジーに関するGOタームに富んでいた(図5D)。特に、Zfyve1というタンパク質は、脂質滴の形成に重要な役割を果たすことが知られており、AgRPニューロン活性化後に1.95倍(q値<0.02)に上昇し、NPY欠失で減弱することが確認された。さらに、Lipin1およびLipin2には複数のリン酸化部位が検出され、同様の制御を示した。これらの実験結果は、検出された遺伝子発現の変化と一致し、AgRPニューロンの活性化に応答して、肝臓におけるオートファジーと脂質の動員をNPY依存的に制御することを示す証拠となった。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図5. AgRPニューロンの活性化は、オートファジーと脂質動員に関連する経路において、肝のリン酸化プロテオームの変化を促進する。
(A) 肝臓リン酸化プロテオミクスワークフローの模式図。
(B) 同定されたリン酸化ペプチドの数。有意に変化したリン酸化ペプチドは、一元配置分散分析と並べ替えベースの偽発見率(FDR)カットオフ0.10を使用して同定された。
(C)4時間光刺激後の個々のChR2WT、ChR2AgRP、ChR2 NPYΔ/ΔおよびChR2AgRP-NPYΔ/Δマウスにおける有意に変化した肝リン酸化ペプチドの階層的クラスタリング(n = 6動物/群)。行のデンドログラムは、ユークリッド距離と完全法を用いて計算した。
(D)差次的に制御されたリン酸化ペプチドクラスターの有意に濃縮されたGO用語を示す散布図。 p値は、Benjamini-Hochberg(BH)手順により多重検定について補正した。
(E)4時間光刺激したChR2WTおよびChR2AgRPマウス(n=9〜14匹/群)の肝臓における総ジグリセリド(DAG)、トリアシルグリセリド(TAG)およびアシルカルニチン(ACCa)濃度を示した。
(F)4時間光刺激したChR2WTおよびChR2AgRPマウス(n=11〜14匹/群)の肝臓のヒドロキシ酪酸濃度。
(G)4時間の短期絶食とAgRPニューロンの化学原性阻害を同時に行った肝臓の総ジグリセリド(DAG)、トリアシルグリセリド(TAG)およびアシルカルニチン(ACCa)濃度(n = 13-14動物/グループ)。
(H)4時間の短期絶食とAgRPニューロンの化学遺伝学的阻害を同時に行った後の肝臓のヒドロキシ酪酸濃度(n = 13-14匹/グループ)。
データは、平均値±SEMで表した。統計解析は、対にならない両側スチューデントのt検定で行った(E、F、G、およびHについて)。∗p≦0.05;**p≦0.01;**p≦0.001、***p≦0.0001(図S11およびS12も参照).
AgRPニューロンの活性化によって引き起こされる反応の代謝的影響を調べるために、我々は2つの独立した実験から肝臓のメタボローム解析を行った;ChR2WTとChR2AgRPマウスはARHで4時間ブルーライトを照射し、短期断食中に化学原性でAgRPニューロンの抑制を行った。アミノ酸の全体量は、AgRPニューロンの光遺伝学的活性化や絶食中のAgRPニューロンの抑制時に大きな変化を示さなかったが、AgRPニューロン刺激時にはアラニン、グルタミン、ヒスチジン濃度の減少、AgRPニューロン抑制時には増加が見られた(図S12AおよびS12D)。一方、分岐鎖アミノ酸であるイソロイシンとバリンの濃度は、既述のようにAgRPニューロン刺激で増加し36、空腹時のAgRPニューロン抑制で減少した(図S12Aおよび図S12D)。AgRPニューロン刺激は肝臓のトリアシルグリセリド(TAG)含量を変化させなかったが、ジグリセリド(DAG)は1.5倍、アシルカルニチンは2.5倍、ヒドロキシブチレート濃度は2倍と明らかに増加した(図5E、5F、S12B、およびS12C)。逆に、空腹時のAgRPニューロン阻害は、DAG、TAG、アシルカルニチン濃度に大きな変化を与えることなく、肝臓のヒドロキシブチレート濃度を著しく低下させた(図5G、5H、S12E、およびS12F)。これらのデータを総合すると、AgRPニューロンの活性化は、ß酸化とケトジェネシスを促進する可能性があることが示された。
AgRPニューロンの活性化は、循環コルチコステロン濃度を増加させる
肝臓におけるAgRPニューロン依存的なオートファジーの活性化には、いくつかの想定される末梢エフェクター経路が介在しているかもしれない。AgRPニューロンが肝臓とBATの自律神経を迅速に制御することによってグルコース代謝を制御するというよく知られた役割とは別に、体液性循環シグナルの長時間の変化が、オートファジーの制御において中枢神経系から肝臓へのシグナルを中継する可能性はもっともなことであると考えられる。そこで、我々はまず、よく知られている肝代謝の調節因子が、AgRPニューロンの長時間の活性化によってマウスの血漿中で変化するかどうかをスクリーニングした。その結果、AgRPニューロン刺激2時間後および4時間後に、循環コルチコステロン濃度が約2倍から3倍増加することが明らかになったが、AgRPニューロン刺激4時間後に循環グルカゴン濃度が増加する傾向は認められなかった(図6AおよびS12G)。循環インスリン濃度には有意な変化は観察されなかった(図S12H)。さらに、オプトジェニックAgRPニューロン活性化は、光刺激2時間後に循環ACTH濃度を一過性に増加させ、次いでオプトジェニック刺激4時間後に循環ACTH濃度を深く抑制した(図S12I)。これは、AgRPニューロンの長期活性化に伴うコルチコステロン媒介の視床下部-下垂体副腎(HPA)軸のフィードバック抑制を示唆していると考えられます。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図6. AgRPニューロンの活性化により、循環コルチコステロン濃度が上昇し、肝オートファジーを促進する
(A)AgRPニューロンの2時間および4時間のオプトジェニック刺激後の血清コルチコステロンレベル(n = 9-11動物/グループ)。
(B)NPYの存在下または非存在下でAgRPニューロンを4時間オプトジェニック刺激した後の血清コルチコステロンレベル(n = 9-10匹/グループ)。
(C)AgRP→PVH、AgRP→LHA、AgRP→BNSTの投射刺激をオプトジェニックに4時間行った後の血清コルチコステロン濃度(n=7〜9匹/群/投射)。
(D)化学遺伝学的PVHNPY1RまたはLHANPY1Rニューロン阻害を4時間行った後の血清コルチコステロンレベル(n = 6-11動物/グループ/プロジェクション)。
(E) i.p.デキサメタゾン単独投与およびリソソーム阻害剤(リューペプチン)との併用投与により、in vivoでオートファジー フラックスを測定するための実験デザインである。
(F)生理食塩水またはデキサメタゾンの単回i.p.注射を受けたC57BL/6Nマウスの肝臓ホモジネートの代表的なウエスタンブロットである。Gapdhはローディングコントロールとして使用した。
(G)(F)のマウス(n=7匹/群)の肝臓ホモジネートにおけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリック分析である。
(H)生理食塩水/ロイペプチンのi.p.注射のいずれかを受けたC57BL/6Nマウスから、生理食塩水/デキサメタゾン処理後1時間の肝臓ホモジネートの代表ウエスタンブロット。Gapdhはローディングコントロールとして使用した。
(I) (H)に記載された肝臓における正味のLC3-IIフラックス(n = 5動物/グループ)。
(J) 食事のない状態で4時間の光遺伝学的刺激を行う3週間前に、ChR2AgRPマウスの肝臓でScrmb-またはNr3c1-shRNAのいずれかのAAV媒介発現を行う実験デザイン。
(K)qPCRによる肝臓でのNr3c1のノックダウンの検証(n=7〜8匹/群)。
(L)(J)のマウスの肝オートファジックマーカー蛋白の代表的ウエスタンブロット。
(M)(L)のマウスの肝臓ホモジネートにおけるオートファジックマーカー蛋白質としてのLC3-II/LC3-I(LC3)およびp62/Gapdhの比のデンシトメトリー解析(n=7〜8匹/群)。
データは平均値±SEMで表した。統計解析は、二元配置のANOVAとŠídákポストホックテスト(A)、一元配置のANOVAとTukeyポストホックテスト(B)、または対にならない両側スチューデントtテスト(C、D、G、I、K、M)により実施した。nsは有意ではない、*p≦0.05、**p≦0.01、***p≦0.001、***p≦0.0001(図S14も参照)。
興味深いことに、AgRPニューロン活性化による循環コルチコステロン濃度の上昇を引き出す能力は、NPY欠損マウスでは消失した;これらの動物における肝臓オートファジーの誘導で観察されたことと同様であった(図6B)。注目すべきは、AgRP → PVHおよびAgRP → LHA突起の光刺激により、同様に血清コルチコステロン濃度が上昇したが、AgRP → BNST突起の光刺激では循環コルチコステロン濃度を上昇させることができなかった(図6C)。さらに、LHANPY1RではなくPVHNPY1Rニューロンの化学的阻害によっても、同様の循環コルチコステロン濃度の上昇が認められた(図6D)。これらの実験から、肝臓のオートファジーとコルチコステロンの循環濃度が、異なる相補的な実験条件下で並行して制御されていることが明らかになりました。
コルチコトロピン放出ホルモン(CRH)に依存したHPA軸の調節に関連するAgRP→PVHNPY1R-神経回路の性質を解明するために、PVHとLHAのCRHニューロンにおけるNPY1Rの発現を定量化した。その結果、NPY1Rを発現しているPVHCRHニューロンは14%、LHACRHニューロンは30%しか検出されなかった(図S13Aおよび図S13B)。CRHニューロンの活性化はHPA軸の活性化において重要なステップであるため37、次にNPY1R-CreマウスのPVHにAAV-hM4Diを定位投与し、化学遺伝学的にNPY1Rニューロンを阻害した後にin situ hybridizationを用いてPVHCRHニューロンにおけるFos発現について検討した。その結果、CNOのi.p.投与後にFos陽性PVHCRHニューロンの増加が観察され、標的とするNPY1Rニューロンの化学的阻害がPVHCRHニューロンを活性化することが示された(図S13Dおよび図S13E)。したがって、NPY1R-neuronを阻害すると、NPY依存的にPVHCRHニューロンの抑制が解除されると考えられる。これは、PVHのNPYがCRHニューロンを活性化するという記述と一致する38。このモデルでは、CRHニューロンを支配するNPY1RニューロンはおそらくGABA作動性であることが必要となる。PVHの大部分はグルタミン酸作動性ニューロンで構成されているため、次にPVHとその近傍のNPY1Rニューロンにおける小胞GABAトランスポーター(VGAT)であるSlc32Aa1の発現を評価しました。この解析により、PVHのNPY1R発現細胞のうち、92.1%がSlc17a6、小胞型グルタミン酸トランスポーターVGLUT2を発現していたが、VGATは7.9%しか発現しなかった(図S13C)。したがって、PVHNPY1R-ニューロンへの直接的なAgRP投射がPVHCRH細胞を阻害することは考えにくい。興味深いことに、PVHに近接するNPY1R発現細胞の35.1%がVGATを発現しており(図S13C)、これらの細胞は以前にPVHCRHニューロンに抑制性入力を与えることが証明されており、さらにPVHCRHニューロンはBNST、外側中隔、大麻核から長距離GABA作動性入力を受けている39、40)。AAV-hM4Diの定位注射がPVH周囲のGABA作動性NPY1R発現細胞も標的にしている可能性を調べるために、PVHを標的としたAAV-hM4Diを注射したNPY1R-CreマウスにおけるmCherry発現を分析しました。実際、この解析により、PVHのすぐ周囲にあるVGAT陽性NPY1RニューロンでmCherryが共発現していることがわかった(図S13F)。したがって、AgRPニューロンから放出されたNPYが、PVHに投射するGABA作動性PVH周辺NPY1Rニューロンからのシナプス前NPY1R発現投射を阻害することはもっともなことであると考えられる。その結果、PVHCRHニューロンの抑制が解除され、循環コルチコステロンの増加が促進され、肝臓のオートファジーが活性化されます。
異なるマウスモデルで観察された循環コルチコステロン濃度の並行制御と肝臓オートファジー誘導が因果関係にあるかどうかを調べるために、C57BL/6Nマウスに急性デキサメタゾン処理を行った。この目的のために、C57BL/6NマウスにZT3.5でデキサメタゾン(5 mg/kg体重[BW])を単回i.p.注射し、肝臓組織をオートファジーの誘導とオートファジー、糖代謝、脂質代謝に関する遺伝子発現の変化について分析しました(図6E)。デキサメタゾン投与4時間後、生理食塩水投与マウスと比較して、デキサメタゾンではp62レベルの顕著な低下と相まって、LC3処理の約2.5倍の増加が観察された(図6Fおよび図6G)。重要なことは、リソソーム阻害剤であるリューペプチンの存在下でデキサメタゾンを急性投与すると、in vivoで肝LC3-IIの蓄積が促進されることである(図6Hおよび図6I)。さらに、オートファジー、グルコース代謝、および脂質代謝経路の遺伝子の発現は、AgRPニューロンの活性化で観察されたのと同様の方向および大きさで変化した(図S14A)。また、デキサメタゾンが培養肝細胞のオートファジーを促進できるかどうかも検証した。実際、Hepa1-6細胞におけるデキサメタゾン処理は、時間依存的にLC3プロセッシングを誘導し、これらの細胞におけるオートファジーのフラックスを増強した(図S14BおよびS14C)。
デキサメタゾンの末梢投与により、AgRPニューロン刺激時に観察されるのと同様の肝オートファジーの変化を引き起こすことが確認されたため、次に、肝コルチコステロンの作用がAgRPニューロン依存的な肝オートファジーの制御に必要であるかを検討した。この目的のために、ChR2AgRPマウスに、スクランブルshRNA(コントロール)またはGR転写物(Nr3c1)を標的とするshRNAを肝臓特異的に発現させるAAVを静脈内注射した。AAVの送達から3週間後、AgRPニューロンをマウスの両グループで4時間光刺激した(図6J)。肝臓のmRNA発現は、AAV-Srmb-shRNAを注射したマウスと比較して、AAV-Nr3c1-shRNAを受けたマウスでGR発現の50%減少に成功していることを示した(図6K)。さらに、肝GR発現の減少は、AgRPニューロン光刺激による、LC3脂質の有意な減少によって証明されるオートファジーの誘導能力(図6Lおよび6M)およびオートファジー、グルコース代謝および脂質代謝に関連する遺伝子発現ネットワークの制御能力を低下させた(図S14D)。
加齢はグレリンおよび絶食によるHPA軸の活性化および肝オートファジーを減衰させる
したがって、我々は、HPA軸に依存する肝臓オートファジーの制御が、年齢依存的に変化するかどうかを調べることを目的とした。そこで、15週齢と78週齢のC57BL/6Jマウスにi.c.v.グレリンを投与し、中枢性グレリンによる血清コルチコステロン濃度および肝臓オートファジー制御能について検討した。まず、異なる年齢のマウスにおいて、摂食を誘導する中枢性グレリンの作用を検証した。興味深いことに、78週齢のマウスでは、15週齢のマウスと比較して、グレリンによる摂食誘導に対する反応が減弱していることが観察された(図7A)。これは、若齢マウスと比較して、高齢マウスでグレリンの中枢投与後に肝LC3処理が明らかに減少したことと一致している(図7B、7C、およびS14E)。最後に、グレリン刺激血清コルチコステロン濃度の大きさを評価したが、これは若齢マウスと比較して老化マウスで顕著に鈍化した(図7D)。
ダウンロード 高解像度画像ダウンロード(930KB)
ダウンロード フルサイズ画像をダウンロードする
図7. 加齢はグレリンと空腹を介したHPA軸の活性化および肝オートファジーを障害する
(A)15週齢および78週齢のC57BL/6Jマウスにおいて、黒矢印で示したi.c.v.生理食塩水(S)またはグレリン(Ghr)注射後4時間にわたる累積食物摂取量を示す。(右)4時間処理後の総食事摂取量の描写(n = 10-15匹/群/処理、クロスオーバー実験)。
(B)15週齢および78週齢のC57BL/6Jマウスに生理食塩水またはグレリンをi.c.v.投与した後の肝臓ホモジネートの代表的なウェスタンブロット(食物の非存在下で)。Gapdhはローディングコントロールとして使用した。太線は解剖を示す。
(C)(B)のマウスの肝臓ホモジネートにおけるオートファジックマーカー蛋白のデンシトメトリー解析(n=5〜8匹/群/処理)。
(D)15週齢および78週齢のC57BL/6Jマウスの血漿コルチコステロン濃度を、中心部の生理食塩水またはグレリン送達のいずれかから4時間後に測定した(n=5〜8匹/グループ/処理)。
(E)10週齢と81週齢のC57BL/6Jマウスの肝臓ホモジネートの代表的なウェスタンブロットで、自由食または暗黒サイクルに4時間絶食させたものである。Gapdhはローディングコントロールとして使用された。太線は解剖を示す。
(F)(E)のマウスの肝臓ホモジネート中のオートファジックマーカー蛋白質のデンシトメトリー分析(n=6〜7匹/グループ/処理)。
(G)(E)のマウスの血漿コルチコステロン濃度(n=6〜7匹/グループ/処理)。
(H)暗黒サイクルへの4時間の絶食後の体重の変化(n=6〜7匹/グループ/処理)。
(I)ZT11およびZT15それぞれにおける、アドリビタブルフィーディングおよび絶食させたC57BL/6Jマウスの血中グルコース濃度(n=6〜7匹/グループ/時点)。
データは平均値±SEMとして表した。統計解析は、二元配置ANOVAに続いてŠídákポストホックテストにより行った(A、C、D、FおよびGについてはRMなし、HおよびIについてはRM処理)。 ns、有意ではない、*p ≦ 0.05; **p ≦ 0.01; **p ≦ 0.001, **p ≦ 0.0001 (full western blotは図S14も参照).
次に、10週齢と81週齢のC57BL/6Jマウスを4時間の短期絶食パラダイムにさらし、肝オートファジーを評価しました。ここで、絶食によるLC3脂質化は、若齢マウスに比べて高齢マウスで有意に減少し、このことは、10週齢マウスに比べて81週齢マウスでは絶食中の循環コルチコステロン濃度の著しい減少を伴っていることが確認された(図7E-7GおよびS14F)。絶食による体重減少は2群間で同等であったが、81週齢のマウスでは、AgRPニューロン阻害の絶食マウスで観察されたのと同様に、絶食による血糖濃度の低下が鈍化した(図4J、7H、7I)。これらの結果から、肝臓のオートファジーの制御は、高齢動物において損なわれていることが示された。
考察
肝臓のオートファジーは、代謝の健康状態の中心的な統合体である。オートファジーに依存する協調的なタンパク質異化は肝臓のホメオスタシスにとって重要であるが42,43、この役割は代謝の健康維持における脂質(リポファジー)やグリコーゲンの分解にまで拡大している16,44。ここで、グルコースホメオスタシス制御におけるオートファジーの役割は多面的なものである。いくつかの研究では、飢餓時のグルコース供給と糖新生の制御におけるオートファジーの役割を示しているが45、他の研究では、肝臓のオートファジーが低下すると飢餓時のグルコース濃度が正常に維持されることが示されている46。さらに、肝臓オートファジーは、飢餓時のケト生成にも不可欠である46。我々は、AgRPニューロンの活性化を抑制することで、肝臓でのケトン体生成が減少することを示した。一方、AgRPニューロンを光遺伝的に活性化すると、肝臓のDAG、アシルカルニチン、ヒドロキシブチレート濃度が上昇し、β-酸化フラックスが増加することを示唆する。このように、AgRPニューロン操作によるオートファジーの双方向制御は、絶食に伴う肝臓脂質代謝の変化の双方向制御と並行している。一方、空腹時のAgRPニューロン依存的なオートファジーの活性化を阻害すると、糖新生酵素Pck1やG6Pの発現が阻害されるにもかかわらず、空腹時の血糖濃度の低下が抑制される一方、AgRPニューロンの活性化は糖新生の主要遺伝子の発現を促進し、インスリンによるAgRPニューロンの阻害が糖新生を抑制するというこれまでの知見と整合しています8。このように、AgRPニューロンによるグルコース代謝の制御は、より複雑で、BATなど肝臓以外の複数の組織の制御に関与している可能性が高いようです9。
分子レベルでは、AgRPニューロンの活性化は、肝臓で核ホルモン共活性化因子PGC1aの発現を誘導し、飢餓時にAgRPニューロンを阻害すると肝PGC1aの発現が減少する。PGC1aは、FOXO依存性の主要な糖新生遺伝子発現の共活性化因子として働くが47、肝脂質代謝の制御においてPPARaの共活性化因子としても機能し48、肝臓でのケトジェネシスを制御する49。さらに、AgRPニューロンの活性化によりPlin-5の発現が強く上昇することを検出した。Plin5は、脂質滴由来の一価不飽和脂肪酸を輸送し、SIRT1をアロステリックに活性化してPGC1依存性のPPARa共活性化を制御する50。さらに、AgRPニューロン活性化におけるLipin1の発現上昇は、肝PGC1a/PPARa経路の別のアンプとして作用し得る51。最後に、PPARaの活性化は、肝臓におけるオートファジーとリポファジーの絶食誘発活性化に不可欠である52。総合すると、我々の実験は、AgRPニューロン依存のPGC1/PPARaの二方向制御が、絶食中のケトジェニックとオートファジーを調整する複数の経路に影響を与えることを示している。今後、AgRPニューロンの活性化によって分解される特定のオートファジー積荷を調べるための研究が必要である。
分子や器官の品質管理や代謝のホメオスタシスにおけるこれらの基本的な制御機能を考慮すると、オートファジーは、線虫における食事制限、インスリンシグナルの障害、生殖細胞切除、ミトコンドリア機能の低下による長寿誘導効果の中心的存在として浮上している53。したがって、AgRP-ニューロン依存的なオートファジー誘導の柔軟で動的な制御は、多細胞生物の健康寿命を改善するために利用される可能性があります54。
このことは、AgRPニューロンの活性化による摂食促進効果に照らすと、一見すると直感に反しているように見えるかもしれない。しかし、AgRPニューロンの活性化を抑制する戦略は、肥満に対する新しい治療法の開発に有望視されています3。しかし、AgRPニューロン活性化の空腹促進効果は、化学遺伝学的または光学遺伝学的AgRPニューロン活性化の最初の数時間から数日間、急速に観察されますが6、7、長期のAgRPニューロン活性化ではもはや食物摂取量は増加せず、肥満を誘発することはできません55。さらに、AgRPニューロンはGABAの放出を介して食欲不振のPOMCニューロンを抑制することから56、肥満におけるPOMCニューロンへのGABA作動性シナプス入力の増加は、AgRPニューロンの活性化の延長によって引き起こされると仮定される。しかし、AgRPニューロンの化学的阻害は、食事によって誘発されるPOMCニューロンの抑制性シナプス後電流(IPSC)を減少させることができない57。我々は最近、プレプロノシセプチン(PNOC)発現ニューロンを、高脂肪食(HFD)摂取により活性化してPOMCニューロンを抑制するARHの新しいクラスのGABA作動性ニューロンとして同定し、ARHの代替GABA作動性ニューロンを肥満におけるPOMCニューロン活動の食事誘導阻害因子と定義した58。このように、肥満発症におけるAgRPニューロンの活性化の役割と、それを阻害して肥満治療とする考え方は、今後さらに定義されていくものと思われます。
一方、AgRPニューロンの動的制御が燃料使用量の適応に必要であるという事実は、代謝適応におけるAgRPニューロンのきめ細かな動的制御の必要性を示している。この考え方は、新生児マウスでAgRPニューロンを切除すると、多臓器の自律神経支配が変化し、普通食(NCD)を与えたマウスの燃料使用量の変化と肥満につながるという研究によってさらに支持されている22。同様に、AgRPニューロンの化学遺伝学的活性化は、白色脂肪組織(WAT)における脂肪分解の制御を介して、燃料消費を一部制御する23。これらの研究は、AgRPニューロンの活性化と多臓器における代謝適応の重要な役割を明らかにしたが、我々の発見は、肝臓におけるオートファジー、脂質代謝およびケトジェニックの制御において、その動的制御が役割を果たすことを特定した。
生物の健康と生存の制御におけるオートファジーの重要性を考慮し、オートファジー制御の調節ステップは、過去10年間、広範囲に研究され、解明されてきた(レビューについては、Kaushik et al.12 および Klionsky et al.15 を参照)。これらの研究は、主に細胞が自律的にエネルギー枯渇を感知するプロセスを制御することに重点を置いている。しかし、生存が脅かされるような状況下では、多細胞生物の生存のために、複数の細胞タイプが同時に適応しなければならないことを考慮することが重要である。そのため、ERストレスやミトコンドリアストレスを含む複数のストレス応答シグナル伝達経路において、非細胞自律制御の原理が、幅広い進化スペクトルの種で明らかにされている59,60,61,62,63 マウスでは、ARHの特殊なエネルギー感知メラノコルチンニューロンは同様の制御原理を担っています。AgRPとPOMCニューロンは、栄養感知ホルモンであるレプチン、インスリン、グレリン、GLP-1などの複数のシグナルと、グルコース、アミノ酸、脂肪酸などの栄養成分を直接統合する3。さらに、感覚情報を統合する神経回路を通じて、栄養の入手可能性が変化すると予想されるときには、すでに活動を適応させている。10。POMCニューロンによる肝小胞体ホメオスタシスの制御と同様に、POMCニューロンにおけるAtg7の発現は、肝臓およびBATにおける寒冷によるリポハギーの活性化および脂肪分解に重要である21)。急性寒冷ストレスは、POMCニューロンのオートファジー依存的な活性化に関与し、おそらくSNAの活性化を介して、1時間以内に肝臓のオートファジーを急速に活性化するが、飢餓誘発性のAgRP依存的な肝臓オートファジーの制御は、より長い活性化を必要とし、この経路は循環コルチコステロン濃度の上昇に依存する。POMCニューロンにおけるオートファジーの誘導は、食間断食の有益な代謝効果の一部に必要であることが示されたが64、今後の研究では、カロリー制限と断食の健康寿命を延ばす有益な効果を達成するために、AgRPとPOMCニューロン依存性の肝臓オートファジーの制御の潜在的寄与を調べることに焦点を合わせるべきである。
AgRPニューロン依存的な肝臓オートファジー制御と代謝適応に関わる神経回路について、我々は、PVHとLHAにあるAgRPニューロン投射を刺激することで、BNSTではなく肝臓でオートファジー誘導が起こり、NPY依存的に循環コルチコステロン濃度が上昇することを実証しました。このことは、AgRPニューロン依存的な末梢組織機能の制御における特異的なエフェクター部位を示唆している。我々は以前、AgRP→BNST投射が少なくとも部分的にBAT機能を制御することを示したが9、他の研究者は、AgRPニューロン活性化による食物摂取促進効果は、AgRPニューロン標的のより広いネットワークを通じて媒介されることを示している32。さらに、我々のデータは、NPYの中枢投与がPVHとLHAを介して部分的に摂食を増加させること65、PVHのAgRPニューロンの急性摂食調節作用がNPYシグナルに関与すること33、中枢NPY作用が肝臓グルコース代謝の制御に関連していること66を示すこれまでの知見と一致している。AgRPニューロンのNPY再演出の研究は、肝臓自食の制御においてAgRPニューロンから放出されたNPYが必要であるという事実をさらに明らかにしている。興味深いことに、オートファジーに関しては、いくつかの研究により、NPYが中枢神経系におけるオートファジーを促進することが明らかになっています67。NPYは、NPY Y1およびY5受容体の活性化を通じて、視床下部ニューロンにおけるオートファジーを刺激することが示されています68。重要なことは、AAV-hM4DiのPVH注射によりNPY1R発現ニューロンを阻害すると、肝オートファジーが活性化し、CRHPVHニューロンが活性化してHPA軸の活性化を促進することである(おそらくCRHPVHニューロンを抑制するGABAニューロンのシナプス前支配を介し、)。
最後に、AgRPニューロン/NPY依存的な肝臓のオートファジー誘導が、循環コルチコステロン濃度の上昇を介して行われることを示す、いくつかの独立した証拠を提供するものである。肝グルコネージョンの制御におけるグルココルチコイドの役割は、広範囲に研究されている。重要なことは、AgRPニューロンの活性化で発現が上昇するPGC1aが、HNF4a依存的にGR依存的にPck1やG6Pを発現させるコアクチベーターとして働く一方、PGC1a依存的にβ-酸化やケト化を誘導することはHNF4a非依存的であることだ49。興味深いことに、AgRPニューロンの活性化に応答して発現が上昇する肝臓のLipin1発現は、脂肪細胞と肝細胞の両方においてGR依存性転写の直接標的である69,70。グルコゲン生成酵素の発現制御におけるその役割に加えて、最近GRは肝グリコーゲン合成の制御における肝細胞のGck発現に関連しています。さらに、複数の研究により、複数の組織でオートファジーの制御におけるGRシグナルの役割が明らかにされている。GRの活性化はシャペロンを介したオートファジーとマイクロオートファジーを阻害するが71、デキサメタゾン投与は神経細胞とBAT72,73、骨格筋においてオートファジーを誘導する74。したがって、肝臓におけるGRシグナルの複雑な標的をさらに明確にすることは、エネルギー不足に対する肝臓の複雑な代謝適応におけるその役割についての理解を広げるかも知れない。
本研究の限界
本研究のいくつかの限界を認める。肝臓オートファジーの誘導は、AgRPニューロンの活性化に応答して、マウスの両性で観察された。各実験群は性別を一致させたが、肝臓のオートファジー誘導の程度における潜在的な性差を特定する能力には限界がある。本研究は、AgRPニューロンが栄養欠乏時の肝オートファジーの制御に重要な役割を果たすことを示しているが、AgRPニューロンがマイトファジーやリポファジーのような選択的オートファジーを潜在的に制御するかどうかを判断するためには、オートファゴソーム内のカーゴ(複数)の評価が重要であろう。興味深いことに、オートファジーのマーカーであるp62のタンパク質発現は、本研究では必ずしもオートファジー活性と逆相関するものではありませんでした。しかし、オートファジー中のp62の制御は複雑であり、転写制御の影響を受けている可能性がある。したがって、AgRPニューロン依存的なp62非依存的なオートファジー経路の制御を研究することは重要な側面となるであろう。
STAR★メソッド
キーリソース表
REAGENTまたはRESOURCEIDENTIFIE抗体Rabbit monoclonal GapdhCell Signaling TechnologyCat# 2118; RRID:AB_561053Mouse monoclonal SQSTM1/p62AbcamCat# ab56416; RRID:AB_945626Rabbit Polyclonal LC3BCell Signaling TechnologyCat# 2775; RRID: AB_915950Rabbit monoclonal LC3B (D11) XP®Cell Signaling TechnologyCat# 3868S; RRID:AB_2137707Rabbit Monoclonal NPYC Cell Signaling TechnologyCat# 11976; RRID:AB_2716286mCherry Monoclonal Antibody (16D7)Invitrogen™Cat# M11217; RRID: AB_2536611Donkey Polyclonal anti-Rabbit IgG (H+L), Alexa Fluor 647Invitrogen™Cat# A-31573; RRID: AB_2536183Donkey Polyclonal anti-Rat IgG (H+L), Alexa Fluor 594Invitrogen™Cat# A-21209; RRID:AB_2535795Goat polyclonal anti-mouse IgG-peroxidaseSigma AldrichCat# A4416; RRID: AB_258167Goat polyclonal anti-rabbit IgG-peroxidaseSigma AldrichCat# A6154; RRID:AB_258284Rabbit polyclonal TFEBCell Signaling TechnologyCat# 4240S; RRID:AB_11220225Rabbit monoclonal Phospho-Atg14 (Ser29)Cell Signaling TechnologyCat# 92340S; RRID: AB_2800182RabbitモノクローナルAtg14Cell Signaling TechnologyCat# 96752S;RRID:AB_2737056Rabbit monoclonal S6 (5G10)Cell Signaling TechnologyCat# 2217S;RRID:AB_331355Rabbit polyclonal Phospho-S6 (Ser235/236)Cell Signaling TechnologyCat# 2211S;RRID: AB_331679Rabbit polyclonal AMPKCell Signaling TechnologyCat# 2532L; RRID:AB_330331Rabbit monoclonal Phospho-AMPK (Thr172, 40H9)Cell Signaling TechnologyCat# 2535S; RRID:AB_331250Rabbit monoclonal AKT (pan, 11E7)Cell Signaling TechnologyCat# 4685S; RRID: AB_2225340Rabbit monoclonal Phospho-AKT (Ser473, D9E)Cell Signaling TechnologyCat# 4060L; RRID:AB_2315049Chicken polyclonal GFPAbcamCat# ab13970; RRID:AB_300798Rabbit polyclonal AgRP (83-132) amide (Human)Phoenix PharmaceuticalCat# H-003-53; RRID: AB_2313908細菌・ウイルス株AAV9-hSyn-DIO-mCherryAddgeneCat# 50459-AAV9; RRID:Addgene_50459AAV9-hSyn-DIO-hM4D(Gi)-mCherryAddgeneCat# 44362-AAV9; RRID:Addgene_44362AAV8-EF1a-DIO-mNPY-WPRE-1 Assoc. Prof. Zachary A. KnightChen et al.29 AAV2/10-Flex-hGlyR-mCherryDr. Henning FenselauLynagh and Lynch34AAV8-GFP-U6-Scrmb-shRNAVector BiolabsN/AAAV8-GFP-U6-mNR3C1-shRNAVector BiolabsCat# shAAV-266053
RefSeq# NM_008173化学物質、ペプチド、組換えタンパク質Tris BaseSigma AldrichCas# 77-86-1EDTASigma AldrichCat# E6758PMSFAppliChemCat# A0999NAFSigma AldrichCat# S7920cOmpleteTM、 Mini Protease Inhibitor CocktailRocheCat# 11836153001PhosSTOP™, phosphatase inhibitorRocheCat# 4906837001Western Blocking Reagent、 SolutionRocheCat#11921681001SignalStain® Antibody DiluentCell Signaling Technology#8112LSucroseSigma AldrichCas# 57-50-1ParaformaldehydeSigma AldrichCas# 30525-89-44x Laemmli sample bufferBio-RadCat# 161-0747Tween® 20 (Polysorbate)VWR FranceCas# 9005-64-5β-MercaptoethanolSigma AldrichCat# M3148DMEM.高グルコース、GlutaMAX™ギブコ™Cat# 61965-026Fetal Calf Serum(FS; Premium)PAN BiotechCat# P30-3302Penicillin-StreptomycinGibco™Cat# 15140-122Clozapine N-oxide、本剤の代謝物AbcamCat# ab141704Ghrelin(Rat、 マウス)Phoenix PharmaceuticalCat# 031-31Dexamethasone (in vitro)Sigma AldrichCat# D4902-100MGDexamethasone 21-phosphate disodium salt (in vivo)Sigma AldrichCat# D1159LeupeptinSigma AldrichCat# L8511-. 100MGA 塩化アンモニウムSigma AldrichCat# A9434-500GDonkey SerumSigma AldrichCat# S30-100MLBuprenorphineBayerPZN 01498870MeloxicamBoerhinger IngelheimPZN 07578423IvermectinSigma AldrichCat# I8898グリセロールフォーマルSigma AldrichCat# 499201、 2-プロパンジオールSigma AldrichCat# 398039ベンゾイルクロリドSigma AldrichCat# 259950- 5ML酢酸アンモニウムSigma AldrichCat# 73594蟻酸アンモニウムSigma AldrichCat# 7022113C10 ATP内部標準Sigma AldrichCat# 710695ギ酸Signa AldrichCat# 27001氷点下酢酸Sigma AldrichCat#338826Equisplashリピドミックス内部標準AvantiCat#330731Metabolomicsアミノ酸ミックス内部標準Cambridge IsotopesMSK A2Optima Acetonitrile LC/MS GradeFisher ScientificCat#A955-。 212Optima Methanol LC/MS GradeFisher ScientificCat# A456-212Optima Isopropanol LC/MS GradeFisher ScientificCat# A461-212Methyl-tert-. ブチルエーテルSigma AldrichCat# 306975Chromasolv LC-MS Ultra WaterHoneywellCat# 14263Critical commercial assaysMouse ACTH ELISA KitAbcamCat# ab263880Mouse Glucagon ELISA KitCrystal ChemCat# 81518Mouse Corticosterone ELISA KitCrystal ChemCat# 80556Ultra-. Sensitive Mouse Insulin ELISA KitCrystal ChemCat# 90080mirVana™ miRNA Isolation KitInvitrogen™Cat# AM1561Pierce™ BCA Protein Assay KitThermo Fisher ScientificCat# 23225高容量CDNA逆転写キットApplied Biosystems™Cat# 4368814TruSeq® Stranded mRNA Library PrepIlluminaCat# 20020595RNA 6000 Nano KitAgilent TechnologiesCat# 5067- 1511RNA 6000 Nano LadderAgilent TechnologiesCat# 5067-1529RNAscope Fluorescent Multiplex Detection Reagents v2ACDCat# 323100SuperSignal™ West Dura Extended Duration SubstrateThermo Fisher ScientificCat# 34075Takyon™ Low ROX Probe 2X MasterMix dTTP blueEurogentecCat# UF-LPMT-B0701Probe Mm-cFos-C1ACD- RNAscope ProbeCat# 316921Probe Mm-cFos-C2ACD-RNAscope ProbeCat# 316921-C2Probe Mm-AgRP-C2ACD-RNAscope ProbeCat# 400711-C2Probe Mm-POMC-C3ACD-RNAscope ProbeCat# 426141-. C3Probe Mm-GhSR-C3ACD-RNAscope ProbeCat# 314081-C3Probe Mm-NPY-C3ACD-RNAscope ProbeCat# 313321-C3Probe Mm-NPY1R-C1ACD-RNAscope ProbeCat# 427021Probe Mm-? NPY1R-C3ACD-RNAscope ProbeCat# 427021-C3Probe Mm-CRH-C1ACD-RNAscope ProbeCat# 316091Probe Mm-Slc17a6-C2ACD-RNAscope ProbeCat# 428871-C2Probe Mm-。 Slc17a6-C3ACD-RNAscope ProbeCat# 428871-C3Probe Mm-Slc32a1-C2ACD-RNAscope ProbeCat# 319191-C2Probe Mm-Slc32a1-C3ACD-RNAscope ProbeCat# 319191-。 C3Opal 520 FluorophoreAkoya BioscienceCat# FP1487001KTOpal 570 FluorophoreAkoya BioscienceCat# FP1488001KTOpal 650 FluorophoreAkoya BioscienceCat# FP1496001KTOpal 690 FluorophoreAkoya BioscienceCat# FP1497001KTHigh-。 Select™ TiO2 Phosphopeptide Enrichment KitThermo Fisher ScientificCat# A32993出典データRNAseq本論文NCBI GEO: GSE188472PhosphoproteomicsThis paperPRIDE: PXD029247実験モデル: Cell LinesHepa1-6ATCC(ATCC CRL-1830™) passage number 33; RRID: CVCL_0327Experimental models: 生物/株C57BL/6NCharles River LaboratoriesStrain# 027Aged C57BL/6JRjJanvier labsStrain# C57BL/6JRjAgRP-IRES-CreTong et al.75ChR2fl/fl mouseMadisen et al.76NPYΔ/Δ mouseErickson et al.31hM3DGqfl/fl Steculorum et al.9NPY1R-Cre Padilla et al.77 オリゴヌクレオチドTaqMan-Probe Trp53inp1Thermo Fisher ScientificMm00458141_m1TaqMan-Probe ULK1Thermo Fisher ScientificMm00437238_m1TaqMan-Probe Bag3Thermo Fisher ScientificMm00443474_m1TaqMan-Probeセザン2Thermo Fisher ScientificMm00460679_m1TaqMan-Probe プローブ Atp6v0d1Thermo Fisher ScientificMm00442694_m1TaqMan-Probe Plin5Thermo Fisher ScientificMm00508852_m1TaqMan-Probe Lpin1Thermo Fisher ScientificMm00550511_m1TaqMan-ProbeLpin2Thermo Fisher ScientificMm00522390_m1TaqMan- プローブLipgThermo Fisher ScientificMm00495368_m1TaqMan-Probe Pck1Thermo Fisher ScientificMm01247058_m1TaqMan-Probe G6pcThermo Fisher ScientificMm00839363_m1TaqMan-Probe PparaThermo Fisher ScientificMm00440939_m1TaqMan- Probe Ppargc1aThermo Fisher ScientificMm01208835_m1TaqMan-Probe Cd36Thermo Fisher ScientificMm00432403_m1TaqMan-Probe Foxo1Thermo Fisher ScientificMm00490671_m1TaqMan-Probe Nr3c1Thermo Fisher ScientificMm00433832_m1TaqMan-Probe Tbp (Dye: VIC-MGB)Thermo Fisher ScientificMm00446973_m1ソフトウェアおよびアルゴリズムFiji/ImageJソフトウェアSchindelin et al. 78 https://imagej.net/software/fiji/GraphPad Prism (Version 9.1.0)GraphPad Software Inc.https://www.graphpad.com/scientific-software/prism/2100 Expert SoftwareAgilent Technologies品番:G2953CASpectronaut 15.5.2111.50606Biognosys AGwww.biognosys.comInstantClue 0.11.0Nolte et al.79 www.instantclue.deTraceFinder 4.1Thermo Fisher ScientificOPTON-30626LIPIDSEARCH 4. 2Thermo Fisher ScientificOPTON-30880OtherNormal Chow Diet (ssniff R/M-H Phytoestrogenarm)ssniff Spezialdiäten GmbHCat# V15544-15% Criterion™ TGX™ Precast Midi Protein GelBio-RadCat# 5671085Any kD™ Criterion™ TGX™ Precast Midi Protein GelBio-RadCat# 5671125Trans-Blot (R)Turbo,Midi Format, 0. 2mm PVDFBio-RadCat# 1704157Epredia™ SuperFrost Ultra Plus™ GOLD Adhesion SlidesThermo Fisher ScientificCat# 11976299Vectashield Antifade Mounting-Medium with DAPIVector LaboratoriesCat# H-1200Contour血糖計BayerN/AContour Next stripBayerCat# #84167879ライカTCS SP-8-X Confocal microscopeLeica Microsystemshttps://www. leica-microsystems.com/products/confocal-microscopes/p/leica-tcs-sp8-x/2100 Bioanalyzer InstrumentAgilent TechnologiesPart Number:G2939BAFUSION SoloVilber Lourmathttp://www.vilber. de/produkte/chemilumineszenz/Laser Diode Fiber Light Source (473 nM)Doric LensesLDFLS_473/070Mono Fiber-optic Patch Cords (200 μM - NA0.48)Doric LensesMFP_200/230/900-0.48_0.32m_FC-CM3(P)PhenomasterTSE Systemshttps://www. tse-systems.com/service/phenomaster/Exploris 480質量分析計Thermo Fisher ScientificCat# BRE725532nLC 1200液体クロマトグラフィーThermo Fisher ScientificCat# LC140Buffer A: 0.1% (v/v) formic acidThermo Fisher ScientificLS118-1Buffer B: 0. 1%(v/v)ギ酸、80%アセトニトリルThermo Fisher ScientificLS122PoroShell 120 EC-C18 2.7-μm beadsAgilent Technologies899999-77ORBITRAP ID-X、Thermo Fisher ScientificFSN05-10001Q-Exactive HFT-Exactive PlusThermo Fisher ScientificIQLAAEGAAPFALGMBDKWats i-Class UPLCWatsw.waters. comCQUITY UPLC BEH C8カラム、130Å、1.7μm、2.1 mm X 100 mmWaters176000885ACQUITY UPLC HSS T3カラム、100Å、1.8μm、2. 1 mm X 100 mmWaters186003539Integrion 陰イオン交換クロマトグラフィーシステムThermo Fisher Scientific22153-60306IonPac AS11-HC, 4μm, 2x250mmThermo Fisher Scientific078035VANQUISH FLEX QUATERNARY UHPLCクロマトグラフィーシステムThermo Fisher Scientific5400. 0205ガラスおよびポリプロピレンHPLCバイアル用スクリューキャップCZTCat#3111L3010ポリプロピレンHPLCバイアルCZTCat#451127756ガラスHPLCバイアルCZTCat#451100012_E200ガラスHPLCバイアル用μL-ガラス挿入部CZTCat#501106012
リソースの確保
リードコンタクト
さらに詳しい情報、リソースや試薬のリクエストは、リードコンタクトのJens Claus Brüning (bruening@sf.mpg.de)までお願いします。
材料の入手方法
本試験では、独自の試薬は生成していない。
実験モデルおよび被験者の詳細
畜産業
すべての動物実験は、地元政府当局(Bezirksregierung Köln)により承認されたプロトコルを遵守し、NIHガイドラインに準拠して実施されたものである。マウスの飼育と維持は、ドイツ・ノルトライン・ヴェストファーレン州ケルン市の環境・消費者保護局・獣医課の許可を得ている。マウスは、22℃~24℃、12時間明暗サイクルで制御された環境内の個別換気ケージ(IVC)に収容された。マウスの健康状態を確認するために毎日チェックし、動物施設の健康状態のモニタリングは、毎年四半期ごとに実施した。マウスは離乳後、1ケージあたり5匹以下のグループに分けて飼育された。動物は、アドリビタムのアクセス標準齧歯類チョウ(ssniff V1554, 59494 Soest, Germany)および水を受けた。特に断りのない限り、本論文で作製したすべてのマウス系統は、C57BL/6Nバックグラウンドで家内飼育した。実験グループは、雄と雌の両方の性別を一致させた。実験手順の大部分は、10週齢から22週齢の成体マウスで実施された。老化研究は、10週齢から81週齢のC57BL/6J雄マウスで実施された。
マウスの系統
C57BL/6N
このマウス系統は、Charles River, Germanyから入手した。
老化したC57BL/6J
このマウス系統は、Janvier, Franceから入手した。
AgRP-IRES-Cre
マウスは、マックス・プランク代謝研究所(ケルン、NRW、ドイツ)の施設内で繁殖させたものを入手し、その世代については記述されている75。
NPY1R-Cre
マウスは既述の通り77、Jackson Laboratoriesから入手した(ストック# 030544)。
ChR2fl/flマウス
(ROSA26loxSTOPloxChR2(H134R)-EYFP-WPRE)の条件付き対立遺伝子(Ai32)76はJackson Laboratoriesから入手した(ストック# 012569)。これらのマウスは、ドイツ、NRW州ケルンのマックス・プランク代謝研究所の施設でホモ接合体動物として維持された。
NPYΔ/Δマウス
全身NPY欠損マウスは129svバックグラウンドであった31。
hM3DGqfl/fl
マウス(ROSA26CAGSloxSTOPloxhM3DGq)は、以前に記載されている。9 これらのマウスは、ホモ接合性のfl/fl動物として維持された。
実験用マウスラインの作製
ChR2AgRP
ヘテロ接合型AgRP-IRES-Creマウスをホモ接合型ChR2fl/flマウスと交配し、実験動物としてChR2AgRPマウスを作製した。ChR2WTの同腹子はコントロールとして使用した。
ChR2AgRP-NPYΔ/Δ
AgRP-IRES-CreマウスとChR2fl/flマウスの交配から得られた子孫を、全身NPY欠損(NPYΔ/Δ)マウスと交配しました。さらにChR2fl/flマウスとの交配を行い、ChR2fl/fl対立遺伝子に対するホモ接合性を発生させた。4つの実験群を生成するために、ChR2fl/fl;AgRP-IRES-CreCre/wt;NPYΔ/wtマウスをヘテロ接合体のNPYΔ/wtマウスと交配させた。その結果、4つの実験群はすべてヘテロ接合体ChR2fl/wtであった。
hM3DGqAgRP-NPYΔ/Δ
化学遺伝学実験用のマウスを作製するために、同様の繁殖戦略を行った。AgRP-IRES-CreCre/wtマウスとhM3DGqfl/flマウス、その後、NPYΔ/Δマウスを交配した。4つの実験グループを生成するために、hM3DGqfl/fl;AgRP-IRES-CreCre/wt;NPYΔ/wtマウスを、hM3DGqfl/fl;AgRP-IRES-Crewt/wt;NPYΔ/wtと交配させました。その結果、4つの実験群はすべてホモ接合体hM3DGqfl/flであった。
細胞株
Hepa1-6細胞(性別:女性)は、ATCC(ATCC® CRL-1830)継代数33から入手し、当研究所ではそれ以上の認証はしていない。これらは、ATTCによるエクトロメリアウイルスおよび当研究所におけるマイコプラズマの検査で陰性であった。細胞は、DMEM (1x) + GlutaMAX™ Dulbeccos Modified Eagle Medium; 4.5 g/l D-glucose (GIBCO) に10%ウシ胎児血清と5%ペニシリン/ストレプトマイシンを添加し、加湿インキュベーター(Binder International)で37℃, 5% CO2で標準条件下に維持しました。細胞は80~90%のコンフルエントで3日ごとに継代した。
メソッドの詳細
マウス実験
ダークサイクルでの短期ファスティング
光照射による概日リズムの乱れを回避するため、絶食実験の少なくとも1週間前にマウスを個別飼育した。ZT11で、餌を取り除く前に、基礎体重と血糖値を記録した。同時に、マウスとそれぞれの巣を清潔なケージに移し、ケージの底にこぼれた残留餌にアクセスできないように、ストレスを最小限に抑えた。対照群には、絶食期間中、餌と水を自由摂取させた。4時間または6時間の絶食後、体重および血糖値を測定し、マウスを暗所で麻酔し、それぞれZT15およびZT17で犠牲とした(図S1A参照)。同様のパラダイムで、短期絶食によるHPA軸活性化および肝オートファジーに対する老化(10週齢、および81週齢のC57BL/6Jマウス)の影響を検討した。
C57BL/6Nマウスに腹腔内注射をした。
グレリンのip注射 C57BL/6Nマウスの別のコホートにおいて、動物は、食物の非存在下で、ZT1およびZT3においてグレリン(100μL中1.5μg)または生理食塩水をip注射された。ZT5でマウスを犠牲にし、ウェスタンブロットを用いたオートファジックマーカーの事後解析のために肝臓サンプルを取り出した。その後、動物を経心的に灌流し、4%PFAで固定し、RNAscopeを用いたグレリン受容体発現AgRPニューロンの染色のために脳を摘出した。
デキサメタゾンのIp注射。C57BL/6Nマウスの別のコホートにおいて、餌を1時間(ZT2.5)前に除去し、餌がない状態でデキサメタゾン(5mg/kg)または生理食塩水をZT3.5に単回ip注射する。マウスはZT7.5で急速に断頭し、肝臓および体幹の血液サンプルを採取した(図6E参照)。
AAVを介した肝臓のグルココルチコイド受容体(Nr3c1)のノックダウン。U6プロモーターの制御下で、マウスNr3c1を標的とするshRNAをコードするアデノ随伴ウイルス(AAV)血清型8を使用した(AAV8-GFP-U6-mNr3c1-shRNA;Vector Biolabs)。簡単に説明すると、PBS中に2.5×1011GCを含むAAV8-GFP-U6-mNr3c1-shRNAまたはそれぞれのコントロールウイルス(AAV8-GFP-U6-scrambled-shRNA;Vector Biolabs)の総容量100μLをChR2AgRPマウスに尾静脈注射で送達した。ARH上部の光ファイバーカニューレの挿入は、1週間後に行った(図6J参照)。
定位手術の手順
マウスはイソフルランで麻酔され、脳定位フレーム(David Kopf Instruments)に乗せられた。術後疼痛を緩和するために、マウスはブプレノルフィン(0.1mg/kg)とメロキシカム(5mg/kg)を投与した。術後ケアの3日連続は、飲料水中のトラマドール(1 mg/mL)、1日2回の検査、1日1回の体重測定を含み、実験マウスの完全回復を記録した。
ファイバーの配置 フラットチップ光ファイバー(ファイバーコア=200μm、数値AP=0.48;Doric lenses Inc.)を、Bregmaからの対応する座標を使用して標的領域の上に移植した: ARH(前後方向(AP):-1.45mm、中央-外側(ML):0.2mm、背-腹(DV): -5.2mm)、PVH(AP: -0.82mm, ML: 0.25mm, DV: -4.2mm), LHA(AP: -1.6mm, ML: +1.05mm, DV: -4.55mm), BNST(AP: 0.45mm, ML: 0.5mm, DV: -3.8mm )。カニューレを頭蓋骨にしっかり固定するため、歯科用アクリルを塗布した。ウイルスを介したNPY再発現およびNr3c1の肝臓特異的shRNAノックダウン実験のために、光ファイバーをARHの上に配置した(AP: -1.45 mm; ML: 0.0 mm; DV: -5.2 mm)。
ウイルスの注入 AgRPニューロンの化学遺伝学的阻害のために、mCherryまたはhGlyRを発現するアデノ随伴ウイルス(AAV)(AAV9-hSyn-DIO-mCherryまたはAAV2/10-FLEX-hGlyR-mCherry)を約300nL、ARHに両側注入(bregma APからの座標: -1.45mm、ML:±0.25mm、DV:-5.75mm~-5.93mm)に100nL/minで注入し、注入5分後にガラスピペットを抜去した。ARHにおけるNPYの再発現についても同様の手法を用い、AAV8-EF1a-DIO-NPYウイルス(Z. Knight博士の好意により提供)またはコントロールウイルスAAV8-hSyn-DIO-mCherryを約300nL両側注射し、光ファイバカニューレの挿入を続けた。PVHNPY1RおよびLHANPY1Rニューロンの阻害には、hM4Diを発現するアデノ随伴ウイルス(AAV)(AAV8-DIO-hM4Di-mCherry)をPVH(ブレグマAPからの座標:-0.70mm;ML:±0.70mm)に約50-75nL注入し、両側から注入した。 70 mm; ML: ± 0.20 mm; DV: -4.60 mm)またはLHA(bregma APからの座標: -1.55 mm; ML: ± 1.10 mm; DV: -5.00 mm)にそれぞれ注射した。
脳室内カニュレーション。簡単に言うと、26ゲージのicvカニューレを、約10-12週齢のC57BL/6Nマウスの側脳室に、ブレグマからの座標、APを使用して定位的に配置した: -0.2 mm, ML: 1.0 mm, DV: -2.1 mm)。カニューレを頭蓋骨の表面に固定するために歯科用アクリル(スーパーボンドC&B)を使用した。カニューレはダミーカニューレで外部開口部を密閉した。動物は手術後個別に収容され、実験操作の前に1週間の回復期間を与えた。同様の手法で、老化研究のために15週齢と78週齢のC57BL/6Jマウスにグレリンの中枢投与が行われた。
In vivo光遺伝学的光刺激法
両側ウイルス注射および/または光ファイバー埋め込み後、マウスは術後1~3週間の回復期間を設けました。その後、実験ケージ(TSEシステム)にて、フードホッパーやウォーターディスペンサーへの最適な馴化を行った。実験日の1週間前に、ロータリージョイント(ドーリックレンズ)に接続した光ファイバーパッチコード(コア径200μm、数値AP0.48;ドーリックレンズ)にマウスを慣れさせた。実験当日、フードホッパーから食べこぼしを取り除き、マウスを清潔なケージに移し、ZT1で新しい光ファイバーパッチコードを取り付けた。ZT3.5(4時間刺激)およびZT5.5(2時間刺激)では、パルス列(20Hzの10msパルス;1秒オン、3秒オフ)からなる青色レーザー(473nm)光刺激を行った。ARHの光刺激には、約20mWのレーザー出力が採用された。PVH、LHA、BNSTの光刺激には、それぞれ約20mWと約10mWのレーザーを使用した。標的領域の放射照度は、オンラインツール(https://web.stanford.edu/group/dlab/cgi-bin/graph/chart.php)を用いて計算し、ChR2活性化の閾値(約1mW/mm2)以上とした。すべての光刺激マウスはZT7.5で断頭され、肝臓と血液サンプルは迅速に回収される。脳は4%PFAでポスト固定し、光ファイバーの配置をポストホックで検証した。
C57BL/6Nマウスへのグレリンの脳室内注射
マウスは、餌と水を自由に摂取することができた。実験日、食物摂取量と運動活性は、1時間(ZT0とZT1の間のグレリン注射前)、4時間(ZT1とZT5の間のグレリン刺激)、1時間(ZT5とZT6の間のグレリン注射後)の測定からなる6時間後に測定されました。グレリンの半減期が短いことから、AgRPニューロンの4時間の活性化を模倣するため、マウスはZT1とZT3にグレリン(1.5μg)または生理食塩水を最終容量1.5μLで静脈注射されました。その後の食物摂取と運動量の測定は、実験と実験の間に1週間のウォッシュアウト期間を設けてクロスオーバー方式で行った。犠牲の日、餌は除去され、マウスはZT0で清潔なケージに移され、餌へのアクセスがないことが確認された。同様に、ZT1およびZT3でそれぞれグレリンのicv注射を1回行った。ZT5で、マウスを深く麻酔し、肝臓サンプルを急速に取り出し、液体窒素でスナップ凍結した。その後、動物を経心的に灌流し、4%PFAで固定し、脳を摘出した。最後に、グレリン受容体発現AgRPニューロンの活性化を、RNAscopeを用いて検証した(図S3G参照)。
食物摂取量および運動活性の測定
餌、水、運動量の同時測定には、自動記録システム(PhenoMaster、TSE Systems)を使用した。マウスは、実験の1週間前にトレーニングケージに設置されたフードホッパーとウォーターディスペンサーに馴化させた。一貫性を保つため、実験日の光サイクル開始時(ZT0とZT2の間)にマウスの寝床を交換し、食べこぼしを除去した。光遺伝学実験では、1時間のレーザーオフ基礎記録(pre)の後、順応を促すために古いマウスの巣を各個体のマウスに戻した。その後、マウスは合計4時間の光遺伝学的レーザー刺激を受け、その後1時間の刺激後の記録(レーザーオフ)を行った。ipまたはicvグレリン実験については、上記を参照。
AgRPニューロンの化学遺伝学的活性化および抑制
CNOのIp注射。クロザピン-N-オキシド(CNO)粉末をDMSO(10 mg/mL)に溶解し、0.9%NaClで1:100に希釈した。マウスは、CNO注射の少なくとも1週間前に個別に収容した。hM3dGqWT、hM3dGqAgRP、hM3dGqNPY Δ/ΔおよびhM3dGqAgRP-NPY Δ/Δマウスには自由摂取させ、ZT3.5およびZT5.5にそれぞれCNO(1mg/kg体重)を腹腔内注射する前に1時間(ZT2.5)食物を取り出した。マウスは、実験日のZT7.5で犠牲とした(図2E参照)。PVHNPY1RおよびLHANPY1Rニューロンの阻害のために、マウスは、生理食塩水またはCNO(3mg/kg体重)のいずれかを受けた。
イベルメクチンのIp注射。mCherryまたはhGlyRを発現するAAVを注射した単独飼育のAgRP-IRES-CreCre/wtマウスは、ZT3,35でイベルメクチン(プロピレングリコール中5 mg/kg)のip注射を受け、マウスは餌と水に自由にアクセスできた。ZT11で餌を除去し、ZT15でマウスを犠牲にした(図4A参照)。
オートファジー フラックス アッセイ
リューペプチンのIp注入。オートファジー フラックスは、リソソーム阻害剤の存在下および非存在下でウェスタンブロッティングにより評価した LC3-II のターンオーバーに基づいて推測される。リューペプチンは、オートファゴソーム-リソソーム融合ステップをブロックするプロテアーゼ阻害剤である24。インビボでのオートファジー フラックス評価のために、夜間摂食サイクルへの短期断食(図S5参照)、AgRPニューロンへのオプトジェニック刺激(図1J参照)またはデキサメタゾンip投与(図6E参照)の1時間後にロイペプチン(40mg/kg 体重)をip投与した。その後、それぞれの実験パラダイムの後に、肝臓を抽出し、LC3Bについてイムノブロットした。運命の」オートファゴリソソーム融合の速度は、各LC3-IIデンシトメトリック値をLeu+処理+の平均LC3-II値で割ることにより決定された。オートファジーフラックスと呼ばれる正味のLC3-IIフラックスは、対応するLeu処理LC3-II値からLeu未処理LC3-IIの濃度測定値を差し引くことによって計算した。
遺伝子発現の解析
マウス肝臓の全RNAは、mirVana Isolation Kit(Ambion)を用いて、製造者の説明書に従って単離した。単離したRNAをHigh-Capacity cDNA RT Kitで逆転写し、Takyon LowRox MasterMix dTTP Blue (Eurogentec) で増幅した。QuantStudio 7 Flex Real-Time PCR Systemを用い、QuantStudio Real-Time PCR Software v1.7.1 (Life Technologies)を用いて定量的PCRを実施した。サンプルの相対発現は、全RNA含量について調整し、TATA結合タンパク質(Tbp)のmRNA発現レベルに対して正規化した。データは、2-ΔΔCt法を用いて解析した(プライマーのリストについては、主要リソース表を参照)。
トランスクリプトミクス
RNAの塩基配列を決定した。マウス肝臓RNA濃度は、Nanodrop ND-100 (Peqlab Biotechnology, France)で測定し、最終濃度200 - 250 ng/mLに希釈した。RNA integrity number (RIN) は、Agilent RNA 6000 Nano Kit (5067-1511, Agilent Technologies) と Agilent 2100 Bioanalyzer で分析しました。RNAライブラリーは、イルミナ® TruSeq® mRNA stranded sample preparation Kitを使用して、1μgのトータルRNAから調製しました。ポリA選択(ポリTオリゴ付着磁気ビーズを使用)後、mRNAを精製し、高温下で2価の陽イオンを使用して断片化しました。RNA断片は、ランダムプライマーを用いた逆転写を受けた。続いて、DNAポリメラーゼIとRNase Hを用いた第2鎖cDNA合成を行い、末端修復とA-tailingの後、インデキシングアダプターをライゲーションした。その後、生成物を精製し、増幅(14PCRサイクル)して、最終的なcDNAライブラリーを作成した。ライブラリーの検証および定量化(Agilentテープステーション)の後、等モル量のライブラリーをプールした。プールは、Peqlab KAPA Library Quantification KitとApplied Biosystems 7900HT Sequence Detection Systemを使用して定量化した。プールを、Illumina NovaSeq6000装置およびPE100配列決定プロトコルを用いて、3750万リード分配列決定した。
トランスクリプトミクス解析。コミュニティキュレーションのnfcore rnaseq解析パイプライン80 バージョン3.0を適用した81 遺伝子レベルの定量は、参照ゲノムGRCm38を使用してSalmon 1.4.0を用いて行った82 遺伝子発現差解析は、負の二項分布を用いたモデルに基づいて DESeq2 1.32.0 R パッケージを用いて行った83 P値はWald検定を用いてFDR調整を行った。遺伝子発現項解析は、超幾何分布モデリングを用いた過剰発現テストを実装したclusterProfiler Rパッケージを用いて実施した84 P値はBenjamini-Hochberg補正を用いてFDR補正した。
リン酸化プロテオミクス
タンパク質の消化。肝臓溶解液は、Tris 50 mM、NaCl 130 mM、EDTA 5 mM、NP-40 1%、PMSF 100 mM、NaF 100 mM、cOmplete mini protease inhibitor cocktail (1 tablet/10 mL) および PhosSTOP™ protease inhibitor (1 tablet/10 mL) を新鮮に添加して作成した。タンパク質をTCEPで還元し、CAAでアルキル化するために、最終濃度がそれぞれ10 mMと20 mMになるように両方の化学物質を同時に添加し、45℃で45分間行った。タンパク質濃度を測定し、4000μgのタンパク質をアセトン沈殿に供した(4x容量、-20℃で一晩)。ペレットは氷冷した80%アセトンを用いて2回洗浄した。Trypsin (Sigma Aldrich) / LysC (Wako) mixture in 100 mM HEPES pH=8.5 を酵素:基質=1:100でペレットに加え、37℃、ThermoMixer (shaking: 850rpm) にて一晩インキュベートした。生成したペプチドをSepPak (Waters, 186000308, 50 mg sorbent)を用いて脱塩した。80%アセトニトリル、0.1%ギ酸を用いてペプチドを溶出し、全プロテオーム測定のために30μgのペプチドを除去した。サンプルはSpeedVacで完全に乾燥させ、-20℃で保存した。
リン酸化ペプチドの濃縮。HighSelect TiO2 Phosphopeptide enrichment kit(Thermo Fisher Scientific、A32993)を用いて、製造元のプロトコルに従い、合計1500μgのタンパク質入力に相当するペプチドを用いて、リン酸化ペプチドを濃縮した。濃縮されたpサイトを含む溶出液をSpeedVacで乾燥し、8μLの2%ギ酸および2.5%アセトニトリルに再懸濁した。
液体クロマトグラフィーと質量分析。質量分析装置は、ナノエレクトロスプレーイオン化源を介してExploris480に結合されたnanoLC 1200(Thermo Fisher)から構成されていた。質量分析計は、データ非依存モードで動作した。MS1スペクトルは、60.000の分解能で取得されました。データ独立収集(DIA)によるカバー質量範囲は、48個のウィンドウを使用して320-1150 m/zであった。200m/zのMS2分解能は15,000、最大注入時間は23ms、AGCターゲットは3e6、コリジョンエネルギーは26、28、30(ステップモード)に設定した。MS2 Spectraはセントロイドモードで取得した。
データ解析。質量分析データは、Spectronaut directDIAアプローチを用いて、マウス参照プロテオーム(Mus Musculus Uniprot)に対して相関させた。リン酸化、タンパク質N末端のアセチル化、メチオニン酸化は可変修飾として定義された。PTMローカライゼーションは有効で、確率のカットオフは0.75に設定された。システイン残基のカラミドメチル化は固定修飾として設定された。PRIDEアップロード(下記参照)には、Spectronautの設定に関する詳細なパラメータファイルが含まれています。ペプチドのグループ分けは修飾配列で行い、MS2ペプチド強度は統計的検定に使用した。正規化ストラテジーは「グローバル正規化」に設定されましたが、統計的評価の前にデータは分位正規化されました。統計解析および可視化は、InstantClueソフトウェアを使用して実施した79。
メタボロミクス
極性代謝物および親油性代謝物の2相代謝物抽出。総脂質の抽出には、スナップ凍結したマウス肝組織9~22mgを2mL丸底エッペンドルフチューブに採取した。スナップ凍結した材料を抽出するために、10サンプルホルダーを備えたボールミル型粉砕機(Tissue Lyser2、qiagen)を使用して、細胞を微粉末にホモジナイズしました。細胞ペレットのホモジナイズには、液体窒素で冷却した5mmのステンレス鋼金属球を各エッペンドルフチューブに1個ずつ加え、25Hzで1分間、凍結材料を崩壊させた。
脂質は、あらかじめ冷却した(-20℃)抽出バッファー(メチルtert-ブチルエーテル(MTBE):メタノール)1mLを加えて抽出した: 内部標準として2μLのEquiSplash Lipidomix(avantilipids)を含むUPLCグレード水5:3:2[v:v:v])を加えた。チューブは、サンプルが抽出バッファーによく再懸濁するまで直ちにボルテックスされた。次に、ホモジナイズしたサンプルを、冷却(4℃)したオービタルミキサー上で1500rpmで30分間インキュベートした。このステップの後、磁石を使って金属球を取り除き、サンプルを冷却したテーブルトップ遠心分離機(4℃)で21.100×gで10分間遠心分離した。上清を新しい2mLエッペンドルフチューブに移し、250μLのMTBEと150μLのUPLCグレードの水を各サンプルに添加した。チューブを直ちにボルテックスした後、冷却した(15℃)オービタルミキサーで1500rpmでさらに10分間インキュベートし、15℃、16.000 x gで10分間遠心分離した。上部のMTBE相には脂質が含まれ、下部のメタノール-水相には極性代謝物および半極性代謝物が含まれています。
リピドーム解析のために、600μLの上部脂質相を新鮮な1.5mLエッペンドルフチューブに採取し、質量分析まで-80℃で保存した。残りの極性相(約800μL)は、SpeedVac濃縮機で直ちに乾燥させ、質量分析まで-80℃で乾燥保存した。
脂質の液体クロマトグラフィー-高分解能質量分析法ベース(LC-HRMS)分析。保存した(-80℃)脂質抽出物を分析直前にSpeedVac濃縮機で乾燥し、脂質ペレットを200μLのUPLCグレードのアセトニトリル:イソプロパノール(70:30[v:v])混合物に再懸濁し、ボルテックスを行い、4℃でサーモミキサーで10分間インキュベートした。10.000×gで5分間の遠心分離後、クリアした上清を200μLガラスインサート(Chromatography Zubehör Trott、ドイツ)付き2mlガラスバイアルに移し、これを6℃でAcquity iClass UPLC(ウォーターズ)サンプルマネージャに設置した。UPLCは、加熱ESI(HESI)源(ID-X、Thermo Fischer Scientific)を備えたTribrid Orbitrap HRMSに接続した。
各脂質サンプルのうち1μLを、1.7μm粒子(Waters)を充填した100 x 2.1 mm BEH C8 UPLCカラムに注入した。UPLCの流速は400μl/minに設定し、バッファシステムはバッファA(UPLCグレードの水に10mM酢酸アンモニウム、0.1%酢酸)およびバッファB(UPLCグレードのアセトニトリル/イソプロパノール7:3[v/v]に10mM酢酸アンモニウム、0.1%酢酸)からなる。UPLCの勾配は以下の通りであった: 0-1分 45% A、1-4分 45-25% A、4-12分 25-11% A、12-15分 11-1% A、15-20分 1% A、20-20.1分 1-45% A、20-24分 45% Aで再平衡化する、というもので、サンプルあたり合計24分のランタイムとなる。
ID-X質量分析計は、1回目の注入を正イオン化モードで、または2回目の注入を負イオン化モードで動作させました。どちらの場合も、分析質量範囲はm/z 150-1500の間であった。分解能は120.000に設定され、1秒間に約4回のスキャンが行われた。RFレンズは60%に設定し、AGCターゲットは250%に設定した。最大イオン時間は100msに設定され、HESIソースは正イオン化モードでは3.5kVのスプレー電圧で動作し、負イオン化モードでは3.2kVが適用されました。イオン管搬送キャピラリー温度は300℃、シースガス流量は60任意単位(AU)、補助ガス流量は20AU、スイープガス流量は340℃で1AUに設定した。
すべてのサンプルは、ランダムなランオーダーで分析した。
ターゲットデータ解析は、TraceFinder 4.1 software (Thermo Fischer Scientific)のquanモジュールとサンプル固有の社内生成化合物データベースを組み合わせて実施しました。
アミン含有代謝物のセミターゲット液体クロマトグラフィー-高分解能質量分析法ベース(LC-HRS-MS)分析。アミン含有化合物のLC-HRMS分析は、適応したベンゾイルクロリドベースの誘導体化法を用いて実施されました85。
簡単に説明すると 代謝物抽出物の極性画分を200μLのLC-MSグレードの水(Optima-Grade、Thermo Fisher Scientific)に再懸濁し、サーモミキサーで4℃、15分間インキュベートした。再懸濁した抽出物を4℃で21,100×gで5分間遠心分離し、クリアした上清の50μLを200μLのガラスインサート付きオートサンプラーバイアル(Chromatography Accessories Trott, Germany)内で混合した。水性抽出物を25μLの100mM炭酸ナトリウム(Sigma)と混合し、続いてアセトニトリル(Optima-Grade、Thermo Fisher Scientific)中の25μLの2%[v/v]ベンゾイルクロリド(Sigma)を添加した。サンプルはボルテックスし、分析まで20℃に保った。
LC-HRMS分析では、誘導体化したサンプル1μLを100 x 2.1 mm HSS T3 UPLCカラム(Waters)に注入した。流速は、LC-MSグレードの水(Optima-Grade、Thermo Fisher Scientific)中のバッファA(10 mMギ酸アンモニウム(Sigma)、0.15%[v/v]ギ酸(Sigma)からなる二元バッファ系を用いて400 μL/minに設定された。バッファBはアセトニトリル(Optima-grade, Thermo Fisher-Scientific)のみで構成されていた。カラム温度は40℃に設定し、LCグラジエントは、0%B 0 - 4.1min; 0-15%B 4.1 - 4.5min; 15-17%B 4.5-11min; 17-55%B 11 - 11.5min, 55-70%B 11.5 - 13min; 70-100%B 13 - 14min; 100%B 14 -14. 1 min; 100-0% B 14.1-19 min; 0% B. 質量分析計(Orbitrap ID-X, Thermo Fisher Scientific)は、質量範囲m/z 100-1000を記録する正イオン化モードで動作した。質量分析計の加熱ESIソースの設定は以下の通りであった: スプレー電圧3.5kV、キャピラリー温度300℃、シースガスフロー60AU、補助ガスフロー20AU、温度340℃、スイープガスを2AUに設定。RF-lensは60%の値に設定した。サンプルのセミターゲットデータ解析は、TraceFinderソフトウェア(Version 4.1, Thermo Fisher Scientific)を用いて実施した。各化合物の同一性は、各シーケンスの前後に実行された本物の参照化合物によって検証された。M + nBz + H]+イオンのピークエリアは、質量精度(<5 ppm)および保持時間の許容範囲(<0.05 min)を使用して抽出された。細胞プールの面積は、抽出バッファに添加した内部標準(U-15N;U-13C amino acid mix (MSK-A2-1.2), Cambridge Isotope Laboratories)に対して正規化し、続いて分析サンプルの新鮮重に対して正規化した。
陰イオン交換クロマトグラフィー質量分析法(AEX-MS)により陰イオン性代謝物を分析した。抽出した代謝物を200μLのOptima UPLC/MSグレードの水(Thermo Fisher Scientific)に再懸濁しました。サーモミキサーで4℃、15分間インキュベートし、4℃、21,100 x gで5分間遠心分離した後、上澄み100 μLをポリプロピレンオートサンプラーバイアル(Chromatography Accessories Trott, Germany)に移しました。
簡単に言うと、極性代謝物抽出物 5 μL を、オーバーフィル係数 1 のプッシュパーシャルモードで、Dionex IonPac AG11-HC ガードカラム (2 mm × 50 mm、4 μm, Thermo Fisher Scientific) を備えた Dionex IonPac AS11-HC カラム (2 mm × 250 mm、4 μm 粒度、 Thermo Fisher Scientific) に注入した。カラム温度は30℃に保持し、オートサンプラーは6℃に設定した。脱イオン水を供給する水酸化カリウムカートリッジ(Eluent Generator、Thermo Scientific)を用いて、水酸化カリウムのグラジエントを生成した。代謝物の分離は、380μL/minの流速で、以下のグラジエント条件を適用して行った: 0-3分、10 mM KOH、3-12分、10-50 mM KOH、12-19分、50-100 mM KOH、19-21分、100 mM KOH、21-22分、100-10 mM KOH。カラムは10mMで8分間再平衡化した。
代謝プールサイズの分析のために、溶出化合物は、Q-Exactive HF高分解能MS(Thermo Fisher Scientific)で質量範囲m/z 50〜750のフルスキャン測定を使用して、ネガティブイオンモードで検出された。質量分析計の加熱型エレクトロスプレーイオン化(ESI)ソースの設定は以下の通りである: スプレー電圧3.2kV、キャピラリー温度は300℃、シースガスフロー60AU、Auxガスフロー20AU、温度300℃、スイープガスグロー2AUに設定した。Sレンズの値は60に設定した。
Hepa1-6細胞培養
実験の48時間前に、細胞を3分間トリプシン処理し、自動セルカウンター(EVE automatic Cell counter NanoEnTek)を用いてカウントし、12ウェルプレートに2.0 × 105 cells/wellの密度でプレーティングした。
デキサメタゾンの経時投与 デキサメタゾン(D4902)を100%エタノールに溶解させた。各ウェルの細胞に、最終濃度5μMのデキサメタゾンを含む培地1mLを加え、5%CO2、37℃のインキュベーターに15'、30'、60'、120'、240'の間移した。0'では、細胞は未処理のままとした。
オートファージックフラックスアッセイ。オートファジックフラックスは、細胞をリューペプチン(100μM)と塩化アンモニウム(20mM)からなるリソソーム阻害剤のカクテルで処理したときのリソソームにおけるLC3-II蓄積を決定する。具体的には、hepa1-6細胞を、デキサメタゾン処理の60'前に、ライソゾーム阻害剤を含む培地と含まない培地で処理した。0'で、培地を5μMのDexamethasoneまたはPBSを含む培地に交換し、リソソームインヒビターの存在下および非存在下で行った。両実験とも、240'で細胞培地を急速に除去して停止し、冷たいPBSで1回洗浄した後、ドライアイスで凍結し、タンパク質抽出まで-80℃で保存した。テクニカルレプリケートには、3ウェルの平均値を使用した。少なくとも3つの独立した実験が行われた。
血清および血漿の調製と分析
血糖値の測定 血糖値は、Contour Nextストリップを用いた手持ち式グルコメーターContourXTで測定しました。
酵素結合免疫吸着法(ELISA)を用いた血清および血漿の分析。NPYおよび投射部位刺激(PVH、LHA、BNST)の存在下または非存在下でのAgRPニューロンのオプトジェニック活性化に関する実験、血清コルチコステロン、グルカゴンまたはインスリン濃度は、製造者のキットの説明に従って特定量の血清を用いて二重に測定した。血清の生成には、全血をRTで30分間凝固させ、その後4℃、4000×gで30分間遠心分離し、使用するまで-80℃で保存した。
AgRPニューロンの化学遺伝学的阻害、PVH標的NPY1R阻害、または老化コホートのマウスについては、血漿を使用して、基底時および暗黒サイクルでの短期4時間絶食後のコルチコステロンの濃度を決定した。∼同様の血漿採取戦略を用いて、中枢性グレリン投与後または短期間の絶食後の循環コルチコステロン濃度に対する加齢の影響を調査するために、EDTAコートチューブを用いて約100~500μLの心内血液を採取し、4℃、4000×gで30分間遠心分離した。
AgRPニューロンへの光遺伝学的刺激中の血漿ACTHの経時的測定には、レーザー開始前(0')とレーザー刺激後120'に尾から約30-50μLの血液を採取した。オプトジェネティック刺激240'後、マウスを断頭し、EDTAコートチューブを用いて体幹血を採取し、4℃、4000×gで30分間遠心分離した。血漿10μLを用い、メーカーのキット説明書に従って循環ACTH濃度を測定することができた。
マウス肝臓からのタンパク質の単離
セラミック(酸化ジルコニウム)ビーズを、50~100mgのマウス肝臓を含む2mL丸底チューブに加え、トータルRNA単離に使用した。肝臓は、500μLの以下のバッファー中でRTで100秒間ホモジナイズした: Tris 50 mM, NaCl 130 mM, EDTA 5 mM, NP-40 1%, PMSF 100mM, NaF 100mM, cOmplete mini protease inhibitor cocktail (1 tablet/10 mL) and PhosSTOP™ protease inhibitor (1 tablet/10 mL) を新たに添加しました。サンプルを氷上に5分間放置し、完全にホモジナイズされているか目視で確認した。試料が完全にホモジナイズされていない場合は、この手順を繰り返した。次に、サンプルを17,000 x gで30分間遠心分離し、上清をBSA標準に対するBCAアッセイ(Pierce)を用いてタンパク質濃度を決定するために採取した。タンパク質を、b-メルカプトエタノール(1:10)を含むLaemmliバッファー(Bio-Rad)(1:4)と混合し、H2Oを加えて最終濃度2mgタンパク質/mLとしました。
ウェスタンブロッティング
ウェスタンブロットは、BioRad社の26 well pre-cast 4%-15% gradient gelsを使用して実施した。電圧は50Vで5分、次いで120Vで65分に設定した。ランニングバッファーとして、10%SDSを含むTris/glycine溶液を使用した。タンパク質のPVDF膜への転写は、Trans-Blot Turboシステム(BioRad)で推奨される7分間のプロトコルを用いて行った。転写後、膜をTBST pH7.4中の1:10ウェスタンブロッティングブロッキング試薬(Roche 11829200)で60分間ブロックし、一次抗体中で4℃、一晩インキュベートした。翌日、メンブレンをTBST pH7.4で10分間3回洗浄した。次に、膜を、西洋ワサビペルオキシダーゼ(HRP)に結合した二次抗体中で60分間、RTでインキュベートし、その後、TBST pH 7.4で10分間の洗浄を4回行った。膜はペーパータオルで軽く叩き、残留する洗浄バッファーを除去してから、SuperSignal ECL Western Blotting Substrate (Thermo Scientific) で約1-2分間インキュベートした。発光は、Fusion SoloイメージングシステムとFusionCapt Advanceソフトウェア(Vilber、フランス)のいずれかで検出された。タンパク質バンドのデンシトメトリー分析は、imageJ (Fiji) - software package (National Institutes of Health, Bethesda, United States) を用いて行った。ローディングコントロールとして、すべての膜をGapdh抗体でプローブした。一次抗体は、抗LC3B(1:1000)、抗p62(1:1000)、抗GAPDH(1:4000)をTBS-T pH 7.4, 5% Western blotting blocking reagentで以下のように希釈した。二次抗体は、TBS-T pH7.4、5%ウェスタンブロッティングブロッキング試薬で1:4000に希釈した。LC3脂質化はLC3-II/LC3-I比として計算し、p62はGAPDHに正規化した。
RNAスコープおよび免疫組織化学、共焦点イメージング、定量化のための灌流
マウスを深く麻酔し、リン酸緩衝生理食塩水(PBS、pH7,4)に続いて4%パラホルムアルデヒド(PFA)で経心的に灌流した。脳を取り出し、4%PFAで4℃、一晩後固定し、0.1Mリン酸緩衝生理食塩水(PBS、pH7.4)中の20%スクロース溶液に移し、切断まで4℃としました。20μm厚の切片をクライオスタットで作成し、SuperFrost Plus Goldスライド(ThermoFisher)に移した。
免疫組織化学
脳スライドを0.1% Triton X-100を含む0,1M PBS(PBST)で洗浄(3x 10min)し、その後ブロッキング液(PBST、3%ロバ血清)で室温で60分間ブロッキングした。ブロッキング後、スライドを一次抗体溶液(Rabbit-anti-NPY, 1:1000, Cell-Signaling Technology, and mCherry-monoclonal, 1:1000, Invitrogen in SignalStain® Antibody Diluent, Cell-Signaling Technology)で4℃、一晩インキュベートした。その後、スライドを室温のPBSTで洗浄(3回10分)し、二次抗体溶液(Alexa 647 donkey anti-rabbit, 1:500, Invitrogen, and Alexa 594 donkey anti-rat, 1:500, Invitrogen in SignalStain® Antibody Diluent, Cell-Signaling Technology)で60分間インキュベートし、室温のPBSTで洗浄(3回10分)した。その後、Vectashield Antifade Mounting Medium(Vector Laboratories)を用いてDAPIをマウントし、カバースリップで覆い、4℃、暗所で保存した。
ChR2-EYFP検証のための免疫蛍光染色。成体ChR2AgRPマウスを麻酔し、4%パラホルムアルデヒドで経心的に灌流した。灌流した脳を凍結し、ARH、PVH、LHAおよびBNSTについて30μmで切開し、記載されているように免疫蛍光のために処理した9。簡単に言うと、一晩ブロッキングステップ(2%血清、0,3%トリトン)の後、切片(ウェルあたり4切片)を一次抗体(鶏抗GFP 1:1000;ウサギ抗AgRP:1:2000、フェニックス医薬品 #H-003-53 )で72時間インキュベートした。一次抗体は、Alexa-fluorophoresと結合した対応する親和性精製IgG(Life Technologies、1:500)で局在化した。画像は、10倍または20倍の対物レンズを装備した共焦点顕微鏡Leica TCS SP-8-Xを使用して取得した。
インサイチュハイブリダイゼーション
麻酔したマウスをPBS(pH7.4)で灌流した後、PBS(pH7.4)に溶解した4%PFAで灌流しました。脳を頭蓋骨から取り出し、4%PFAで4℃、一晩後固定し、切断まで4℃で20%スクロース溶液(1X PBS中)に移した。20μmの厚さの切片をクライオスタットで作成した。AgRP、POMC、cFos、GhsR、CRH、NPY1R、SLC17A6(VGLUT2)またはSLC32A1(VGAT)の検出は、蛍光in situハイブリダイゼーション技術(RNAscope, Advanced Cell Diagnostics)を用いて製造者の指示にしたがって行った。3プレックスネガティブコントロールプローブおよび3プレックスポジティブコントロールプローブは、ターゲットプローブと並行して処理された。切片をSuperFrost Plus Goldスライド(ThermoFisher)に取り付け、RTで乾燥させ、オートクレーブしたミリポア水で短時間すすぎ、空気乾燥し、60℃で一晩焼成した。その後、スライドを95.0〜99.0℃のTarget Retrieval(Cat番号322000)に9分間浸漬し、オートクレーブしたMillipore水で簡単にすすぎ、100%エタノールで脱水した。その後、ImmEdge疎水性バリアペン(Cat No.310018)を用いて切片の周囲に疎水性バリアを作成した。すべてのインキュベーションステップは、ACD HybEz hybridization system (Cat No. 321462)を用いて40℃で行われた。切片はプロテアーゼIII(Cat No.322340)と30分間インキュベートした。その後のハイブリダイゼーション、増幅、検出の各ステップは、メーカーの説明書に従って行った(Multiplex Fluorescent Detection kit v2, Cat No. 323110)。各実験内の遺伝子を同時に検出するために、使用したそれぞれのタイラミドベースのプローブは、以下のように希釈した:
実験遺伝子-チャンネル蛍光剤図イベルメクチン(IVM)注射後にAAVDIO-mCherryまたはAAV-Flex-hGlyRを両側ARH内注射した4時間絶食AgRP-IRES-CreマウスのARHにおけるAgRPおよびcFos mRNA発現 cFOS-C1
AgRP-C2Opal-520 (1:500)
Opal-690 (1:750)図5MicecFOS-C1の4時間および6時間の自由食または絶食のARHにおけるBagRP、POMCおよびcFos mRNA発現量
AgRP-C2
POMC-C3Opal-570 (1:750)
オパール-650(1000分の1)
Opal-520 (1:1000)Figure S1DAgRP, GhSR, cFos mRNA expression in ARH of C57BL/6N mice icv injected either saline or GhrelincFOS-C1
AgRP-C2
GhSR-C3Opal-570 (1:750)の場合。
オパール-650(1000分の1)
Opal-520 (1:1000)図S3C57BL/6NマウスのPVHおよびLHAにおけるGCRHおよびNPY1R mRNAの発現量CRH-C1
NPY1R-C3Opal-520 (1:750)
Opal-690(1:1000)図S13A
図S13生理食塩水またはCNOを注入したマウスのPVHにおけるBCRHおよびcFos mRNAの発現NPY1RCRH-C1
cFOS-C2Opal-520 (1:750)
Opal-690 (1:1000)図S13C57BL/6NマウスのPVHにおけるDNPY1R、SLC17A6 (VGLUT2) またはSLC32A1 (VGAT) mRNA発現NPY1R-C1
Slc17a6-C2
Slc32a1-C3Opal-520 (1:750)
オパール620(1:750)
Opal-690(1:1000)図S13C
図 S13F
その後、Vectashield Antifade Mounting Medium(Vector Laboratories)を用いてDAPIをマウントし、カバースリップで覆い、4℃の暗所で保存した。
画像処理と定量化
画像は共焦点ライカTCS顕微鏡で、20x/0.75または40x/1.30液浸対物レンズを使用して取得した。プローブチャンネルのレーザー強度は、イメージングプロセス中、一定に保たれた。ARH、PVH、LHAの画像は、吻側から尾側に向かって撮影し、1匹あたり約5~6枚の切片を作成した。画像はFiji ImageJ(NIH)にインポートし、DAPIとプローブチャンネルの明るさとコントラストを調整した。PaxinosとFranklinによって出版されたマウス脳アトラスは、ROIを特定するための参考資料として使用された。それぞれのターゲットに染色された細胞は、手動で定量化した。神経細胞の活性化は、個々のcFos陽性細胞を手動でカウントすることによって決定した;活性細胞は3つ以上のcFosドットを含む。
PVHおよびLHAにおけるCRHおよびNPY1Rの共局在化について。DAPI染色を用いて細胞を数えた。CRHの蛍光シグナルが50%以上ある細胞をCRH陽性細胞とした。そのうち、NPY1Rシグナルを持つ細胞、すなわちNPY1Rドットが3つ以上ある細胞をNPY1R陽性とみなした。LHAにおけるCRHおよびNPY1R-シグナルの定量化についても、同じ原理を採用した(図S13B参照)。
PVH内およびその周辺におけるNPY1R/VGLUT2/VGATまたはNPY1R/mCherry/VGLUT2/VGATの共局在化について。PVHの近傍内および近傍の個々の細胞を定義し、シグナルを使用して輪郭を描いた。細胞が標的化されているかどうかを判断するために、mCherry陽性細胞を数えた。NPY1RとmCherryの両方のシグナルを示す細胞を標的化されたとみなした。そのうち、VGATまたはVGLUT2シグナルを示す細胞、すなわち細胞の50%以上を、それぞれVGATまたはVGLUT2陽性と数えた。VGATおよびVGLUT2シグナルの両方を表示する細胞は、定量化に考慮しなかった(図S13CおよびS13F参照)。
透過型電子顕微鏡(TEM)によるオートファジー液胞の評価
1、2、4時間の光刺激後、ChR2AgRPマウスを深麻酔し、0.1Mカコディレートバッファー中の0,5%(w/v)プロカイン塩酸と0,2%(v/v)ヘパリンで心臓内をフラッシュし、0.15Mカコディレートバッファーの2%PFA、2,5%グルタルアルデヒドと0,2%(v/v)飽和ピカリンで灌流しました。コントロールの同腹子は4時間光刺激した。大肝葉から、薄く鋭利な剃刀で1x1x1 mmの組織立方体を作成し、肝臓サンプルを0.15 Mカコジル酸緩衝液(pH 7.2)中の2.5%グルタルアルデヒド/2%ホルムアルデヒドで4℃で一晩ポスト固定した。その後、サンプルを0.1Mカコジル酸緩衝液(pH7.2)で洗浄し、0.1Mカコジル酸緩衝液(pH7.2)中の1%OsO4および1%フェロシアン酸カリウムと4℃で3時間インキュベートした。その後、昇順エタノール系列を用いて、4℃で15分間ずつ組織を脱水した。組織は、昇順エタノール系列で脱水し、プロピレンオキシドに移し、最後にエポキシレジンに62℃で72時間埋め込んだ。超薄切片(70 nm)をダイヤモンドナイフ(Diatome, Biel,Switzerland)でウルトラミクロトーム(EM-UC6, Leica Microsystems)上で切り、銅グリッドに置いた。超薄切片は、1.5%酢酸ウラニルおよびクエン酸鉛(レイノルズ液)で造影した。透過型電子顕微鏡(JEOL JEM 2100Plus)、カメラOneView 4K 16bit(Gatan)、ソフトウェアDigitalMicrograph(Gatan)を用いて、80kV、室温で画像を取得した。画像は、ImageJ(Fiji)-ソフトウェアパッケージを使用して解析した。10,000倍の倍率で少なくとも20枚/肝臓のオートファジー空胞を無作為に採取した。
定量化および統計解析
グループサイズは、マウス研究で一般的に適用されているものを使用した。サンプルサイズは、グループごとの動物被験者の数であり、図の凡例(図1、2、3、4、5、6、7、およびS1-S14)内に注釈されている。独立した2つのグループを比較するために、対にならない両側Student's t testを実施した。2つ以上のグループからなるデータセットは、一元配置分散分析(ANOVA)後にTukeyのポストホック多重比較テストを用いて分析した。2つの変数(例:遺伝子型と治療)を比較するグループの統計解析には、二元配置分散分析に続いてŠídák post hoc多重比較検定を実施した。縦断的なデータは、二元配置反復測定(RM)ANOVAとŠídák post hoc多重比較検定を使用して分析した。3つの変数(遺伝子型、レーザー出力、時間など)でグループを比較する場合は、三元RM ANOVAに続いてŠídák post hoc多重比較検定を実施した。統計解析は、GraphPad Prism 9 Softwareを使用して実施した。データが統計的アプローチの前提を満たしているかどうかを判断するために、特別な方法は使用しなかった。
謝辞
Jens Alber、Nadine Evers、Nadine Spenrath、Pia Schollの各氏の技術協力に感謝する。細胞培養に関するアドバイスをしてくれたPeter WienandとJakob Nissenに感謝する。TEMによるオートファゴソームの評価をサポートしてくれたCECAD Imaging FacilityのAstrid Schauss博士とJanine Heiseに感謝する。AgRPニューロンの化学遺伝学的阻害のためにAAV-Flex-hGlyRa1AGウイルスを提供してくださったHenning Fenselau博士に感謝します。本原稿のすべての模式図は、www.biorender.com を用いて作成した。
W.C.は、Alexander Von Humboldt財団のフンボルト研究員プログラムの支援を受け、CECADからシニアポストドクター助成を受けた。このプロジェクトは、欧州連合のHorizon 2020研究・イノベーションプログラム(助成金協定番号742106)に基づく欧州研究会議(ERC)の資金援助、ドイツ糖尿病研究センター(DZD)を通じたBMBFの資金援助、欧州糖尿病協会(EASD)のEASD-ノボノルディスク財団糖尿病優秀賞による支援をJ.C.Bに受けています。
著者の貢献
W.C.とJ.C.B.は、本研究の構想、実験の設計、原稿の原案執筆を行った。共著者全員が原稿を確認し、編集した。最終的な原稿はすべての著者が同意した。W.C.は、in vivo手術/注射の大部分を行い、発表した実験の大部分を実施し、結果の大部分を分析した。O.M.は、本研究においてRT-PCR、in situハイブリダイゼーション、組織学的定量を実施した。A.S.は、RT-PCRとウェスタンブロッティングに関する結果を実行し、分析した。P.K.とL.S.は、RNA-seqデータを解析した。S.H.はリン酸化ペプチドの濃縮を行い、H.N.は肝臓のリン酸化プロテオミクスを実施し解析した。T.S.-H.はLHAとBNST投射部位での光遺伝学的ファイバーカニュレーションの実施に携わった。E.K.は、免疫組織化学染色に協力し、オートファジーのフラックスに関する貴重な意見を提供した。N.L.K.は、オートファゴソームの最適化と同定に協力し、貴重な議論と指導をしてくれた。P.G.はメタボロミクス実験の実施とデータ解析を行った。
利害関係の宣言
著者は競合する利害関係を宣言していない。
補足情報
すべての補足ファイルをダウンロードする
これは何でしょう?
ダウンロード アクロバットPDFファイル(2MB)ダウンロード
資料S1. 図S1〜S14
ダウンロード ZIPファイル(20MB)をダウンロードする
データS1. ソースデータおよびノンクロップウェスタンブロット。
ダウンロード: アクロバットPDFファイル(7MB)ダウンロード
ドキュメントS2。記事+補足情報
おすすめ記事
データおよびコードの利用可能性
質量分析プロテオミクスデータは、PRIDEパートナーリポジトリを通じてProteomeXchange Consortiumにデータセット識別子で寄託されました: PXD029247.1 RNAシーケンスデータは、NCBI Gene Expression Omnibusに識別子付きで寄託された: GSE188472
本論文はオリジナルコードを報告するものではありません。
本論文の代表的なウェスタンブロットのグラフおよび切り抜き画像の生成に使用したすべての値は、ファイルData S1 - Source dataで確認できます。本論文で報告されたデータの再分析に必要な追加情報は、合理的な要求があれば、リードコンタクトから入手できます。
参考文献
1
Y. Perez-Riverol, A. Csordas, J. Bai, M. Bernal-Llinares, S. Hewapathirana, D.J. Kundu, A. Inuganti, J. Griss, G. Mayer, M. Eisenacher, et al.
2019年のPRIDEデータベースと関連ツール・リソース:定量化データのサポートを改善するために
Nucleic Acids Res., 47 (2019), pp. D442-D450, 10.1093/nar/gky1106
ScopusGoogle Scholarで見る
2
K. ティンパー、J.C.ブリューニング
食欲とエネルギー恒常性を制御する視床下部回路:肥満への道筋
ディス。Model. Mech.、10 (2017), pp.679-689, 10.1242/dmm.026609
ScopusGoogle Scholarで見る
3
A. ジャイス、J.C.ブリューニング
弧状核依存的な代謝制御-肥満と糖尿病への道筋
Endocr. Rev., 43 (2022), pp.314-328, 10.1210/endrev/bnab025
ScopusGoogle Scholarで見る
4
E. Gropp、M. Shanabrough、E. Borok、A.W. Xu、R. Janoschek、T. Buch、L. Plum、N. Balthasar、B. Hampel、 A. Waisman、et al.
アグーチ関連ペプチドを発現するニューロンは摂食に必須である
Nat. Neurosci., 8 (2005), pp.1289-1291, 10.1038/nn1548
ScopusGoogle Scholarで見る
5
S. ルケ、F.A.ペレス、T.S.フナスコ、R.D.パルミター
NPY/AgRPニューロンは成体マウスでは摂食に必須だが、新生児では切除できる
Science, 310 (2005), pp.683-685, 10.1126/science.1115524
ScopusGoogle Scholarで見る
6
Y. アポンテ、D.アタソイ、S.M.スターンソン
AGRPニューロンは、訓練なしで摂食行動を迅速に組織化するのに十分である。
Nat. 神経科学, 14 (2011), pp.351-355, 10.1038/nn.2739
ScopusGoogle Scholarで見る
7
M.J.クラッシュス、S.コーダ、C.イェ、S.C.ローガン、A.C.アダムス、D.S.クッシャー、E.マラトス・フライア、B.L.ロート、B.B.ローエル
AgRPニューロンの迅速かつ可逆的な活性化が、マウスの摂食行動を駆動する
J. Clin. Invest.、121 (2011), pp.1424-1428, 10.1172/JCI46229
ScopusGoogle Scholarで見る
8
A.C. Könner, R. Janoschek, L. Plum, S.D. Jordan, E. Rother, X. Ma, C. Xu, P. Enriori, B. Hampel, G.S. Barsh, et al.
AgRP発現ニューロンにおけるインスリン作用は、肝グルコース産生の抑制に必要である
セル・メタブ, 5 (2007), pp.438-449, 10.1016/j.cmet.2007.05.004
PDFを見る記事を見るScopusGoogle Scholarで見る
9
S.M. Steculorum, J. Ruud, I. Karakasilioti, H. Backes, L. Engström Ruud, K. Timper, M.E. Hess, E. Tsaousidou, J. Mauer, M.C. Vogt, et al.
AgRPニューロンは褐色脂肪組織におけるミオスタチン発現を介して全身のインスリン感受性を制御する
Cell, 165 (2016), pp.125-138, 10.1016/j.cell.2016.02.044
PDFを見る記事を見るScopusGoogle Scholarで見る
10
Y. チェン、Y.C.リン、T.W.クオ、Z.A.ナイト
食物の感覚的検出は弧状摂食回路を急速に変調させる
Cell, 160 (2015), pp.829-841, 10.1016/j.cell.2015.01.033
PDFを見る記事を見るScopusGoogle Scholarで見る
11
C. ブラント、H. ノルテ、S. ヘンシュケ、L. エングストローム・ルード、粟澤正樹、D.A. モーガン、P. ガベル、H.G. シュプレガー、M.E. ヘス、 S. ガンター、他。
食物知覚はメラノコルチン依存的なmTOR活性化制御を介して肝小胞体ホメオスタシスを促進させる
Cell, 175 (2018), 10.1016/j.cell.2018.10.015
1321-1335.e20
Google Scholar
12
S. カウシク、I.タセット、E.アリアス、O.パンプリエガ、E.ウォン、M.マルティネス=ビセンテ、A.M.クエルボ
オートファジーと老化の特徴
エイジング・レッスン. Rev., 72 (2021), p. 101468, 10.1016/j.arr.2021.101468
PDFを見る記事を見るScopusGoogle Scholarで見る
13
C. ヘー、D.J.クリオンスキー
オートファジーの制御機構とシグナル伝達経路
Annu. Rev. Genet., 43 (2009), pp. 67-93, 10.1146/annurev-genet-102808-114910
Google Scholar
14
D.F. Egan, D.B. Shackelford, M.M. Mihaylova, S. Gelino, R.A. Kohnz, W. Mair, D.S. Vasquez, A. Joshi, D.M. Gwinn, R. Taylor, et al.
AMP活性化プロテインキナーゼによるULK1(hATG1)のリン酸化が、エネルギー感知とマイトファジーをつなぐ
Science, 331 (2011), pp.456-461, 10.1126/science.1196371
ScopusGoogle Scholarで見る
15
D.J. Klionsky, G. Petroni, R.K. Amaravadi, E.H. Baehrecke, A. Ballabio, P. Boya, J.M. Bravo-San Pedro, K. Cadwell, F. Cecconi, A.M.K. Choi, et al.
ヒトの主要疾患におけるオートファジー
EMBO J., 40 (2021), p. e108863, 10.15252/embj.2021108863
ScopusGoogle Scholarで見る
16
R. シン、S. カウシク、Y. ワン、Y. シャン、I. ノヴァク、小松正樹、田中健一、A. M. クエルボ、M. J. クザジャ
オートファジーが脂質代謝を制御する
Nature, 458 (2009), pp.1131-1135, 10.1038/nature07976
ScopusGoogle Scholarで見る
17
R.J. Schulze、K. Drižytė、C.A. Casey、M.A. McNiven
肝リポファジー:肝臓における脂質滴のオートファジー的異化に関する新たな知見
Hepatol. Commun., 1 (2017), pp.359-369, 10.1002/hep4.1056
ScopusGoogle Scholarで見る
18
T. 齋藤俊哉、久間敦子、杉浦康博、市村洋平、小幡正樹、北村英明、奥田聡、H.C. Lee、池田和彦、鐘ヶ江泰史、他。
オートファジーはNCoR1の選択的なターンオーバーを通じて脂質代謝を制御する
Nat. Commun.、10 (2019), p.1567, 10.1038/s41467-019-08829-3
ScopusGoogle Scholarで見る
19
S. カウシク、J.A.ロドリゲス・ナバロ、E.アリアス、R.キフィン、S.サフ、G.J.シュワルツ、A.M.クエルボ、R.シング
視床下部AgRPニューロンにおけるオートファジーは、食物摂取とエネルギーバランスを制御する
セル・メタブ, 14 (2011), pp.173-183, 10.1016/j.cmet.2011.06.008
PDFを見る記事を見るScopusGoogle Scholarで見る
20
B. クーペ、石井靖、M.O.ディートリッヒ、小松真一、T.L.ホーヴァス、S.G.ブーレ
プロオピオメラノコルチン神経細胞におけるオートファジーの喪失は、軸索の成長を阻害し、代謝異常の原因となる
セル・メタブ, 15 (2012), pp.247-255, 10.1016/j.cmet.2011.12.016
PDFを見る記事を見るScopusGoogle Scholarで見る
21
N. マルティネス-ロペス、M. ガルシア-マシア、S. サフ、D. アトンヴァランクル、E. リーブル、P. メルロ、F. チェッコーニ、G. J. シュワルツ、R. シング
中枢神経系と末梢神経系におけるオートファジーが、褐色脂肪組織と肝臓におけるリポファジーと脂肪分解を協調させる
Cell Metab., 23 (2016), pp.113-127, 10.1016/j.cmet.2015.10.008
PDFを見る記事を見るScopusGoogle Scholarで見る
22
A. Joly-Amado, R.G. Denis, J. Castel, A. Lacombe, C. Cansell, C. Rouch, N. Kassis, J. Dairou, P.D. Cani, R. Ventura-Clapier, et al.
視床下部AgRP-ニューロンによる末梢基質利用および栄養分配の制御
EMBO J., 31 (2012), pp. 4276-4288, 10.1038/emboj.2012.250
ScopusGoogle Scholarで見る
23
J.P.カヴァルカンティ・デ・アルバカーキ、J.ボバー、M.R.ジンマー、M.O.ディートリッヒ
Agrpニューロンによる基質利用および脂肪率の制御
Nat. Commun.、10 (2019), p.311, 10.1038/s41467-018-08239-x
ScopusGoogle Scholarで見る
24
D.J. Klionsky, A.K. Abdel-Aziz, S. Abdelfatah, M. Abdellatif, A. Abdoli, S. Abel, H. Abeliovich, M.H. Abildgaard, Y.P. Abudu, A. Acevedo-Arozena, and al.
オートファジーをモニタリングするためのアッセイの使用と解釈に関するガイドライン(第4版)1
オートファジー, 17 (2021), pp.1-382, 10.1080/15548627.2020.1797280
グーグルシュラー
25
M. 小島、細田、伊達、中里、松尾、姜川
グレリンは胃の成長ホルモン放出アシル化ペプチド
Nature, 402 (1999), pp.656-660, 10.1038/45230
ScopusGoogle Scholarで見る
26
M. ツェップ、D.L.スマイリー、M.L.ハイマン
グレリンはげっ歯類に脂肪を誘導する
Nature, 407 (2000), pp.908-913, 10.1038/35038090
ScopusGoogle Scholarで見る
27
M.A. Cowley, R.G. Smith, S. Diano, M. Tschöp, N. Pronchuk, K.L. Grove, C.J. Strasburger, M. Bidlingmaier, M. Esterman, M.L. Heiman, et al.
グレリンの中枢神経系における分布と作用機序は、エネルギー恒常性を制御する新しい視床下部回路を実証している
Neuron, 37 (2003), pp. 649-661, 10.1016/s0896-6273(03)00063-1
PDFを見る記事を見るScopusGoogle Scholarで見る
28
M.J. Krashes、B.P. Shah、S. Koda、B.B. Lowell
内因的に放出されるAgRPニューロンメディエーターGABA、NPY、AgRPによる摂食の急速な刺激と遅延した刺激の比較
セル・メタブ, 18 (2013), pp.588-595, 10.1016/j.cmet.2013.09.009
PDFを見る記事を見るScopusGoogle Scholarで見る
29
Y. チェン、R.A.エスナー、S.コサール、O.H.ミラー、Y.C.リン、S.メスガルザデ、Z.A.ナイト
持続的なNPYシグナルがAgRPニューロンの摂食駆動を可能にする
eLife, 8 (2019), 10.7554/eLife.46348
グーグルシュラー
30
L. エングストロム・ルード、M.M.A.ペレイラ、A.J.デ・ソリス、H.フェンセラウ、J.C.ブリュニング
NPYはAgRPニューロンの急速摂食とグルコース代謝調節機能を仲介している
Nat. Commun., 11 (2020), p.442, 10.1038/s41467-020-14291-3
ScopusGoogle Scholarで見る
31
J.C. エリクソン、K.E. クレッグ、R.D. パルミター
神経ペプチドY欠損マウスのレプチンに対する感受性と発作に対する感受性
Nature, 381 (1996), pp.415-421, 10.1038/381415a0
Google Scholar
32
J.N. Betley、Z.F. Cao、K.D. Ritola、S.M. Sternson
摂食行動の恒常性制御のための並列・冗長な回路構成
Cell, 155 (2013), pp.1337-1350, 10.1016/j.cell.2013.11.002
PDFを見る記事を見るGoogle Scholar
33
D. アタソイ、J.N.ベトリー、H.H.スー、S.M.スターンソン
飢餓の神経回路を分解する
Nature, 488 (2012), pp.172-177, 10.1038/nature11270
ScopusGoogle Scholarで見る
34
T. リナ、J.W.リンチ
定義された神経細胞集団の電気活動を抑制するための改良型イベルメクチン活性化クロライドチャネル受容体
J. Biol. Chem., 285 (2010), pp.14890-14897, 10.1074/jbc.M110.107789
PDFを見る記事を見るScopusGoogle Scholarで見る
35
W.D. Todd, H. Fenselau, J.L. Wang, R. Zhang, N.L. Machado, A. Venner, R.Y. Broadhurst, S. Kaur, T. Lynagh, D.P. Olson, et al.
攻撃性の概日制御のための視床下部回路
Nat. Neurosci., 21 (2018), pp. 717-724, 10.1038/s41593-018-0126-0
ScopusGoogle Scholarで見る
36
R.B. Gannaban、C. NamKoong、H.H. Ruiz、H.J. Choi、A.C. Shin
分岐鎖アミノ酸の中枢制御はAgRPニューロンを介する
糖尿病, 70 (2021), pp.62-75, 10.2337/db20-0510
ScopusGoogle Scholarで見る
37
S.M.スミス、W.W.ベール
ストレスに対する神経内分泌反応における視床下部-下垂体-副腎軸の役割について
ダイアログ Clin. 神経科学, 8 (2006), pp.383-395
CrossRefView in ScopusGoogle Scholar
38
E.L. Dimitrov、M.R. DeJoseph、M.S. Brownfield、J.H. Urban
神経内分泌系コルチコトロピン放出ホルモン神経細胞活性制御における神経ペプチドY Y1受容体の関与
内分泌学, 148 (2007), pp.3666-3673, 10.1210/en.2006-1730
ScopusGoogle Scholarで見る
39
J.P.ハーマン、N.K.ミューラー、H.フィゲイレド
視床下部-下垂体-副腎皮質ストレス統合におけるGABAおよびグルタミン酸回路の役割
Ann. NY Acad. Sci., 1018 (2004), pp. 35-45, 10.1196/annals.1296.004
ScopusGoogle Scholarで見る
40
Y. 袁、呉、陳、蔡、范、沈、孫、胡、J.
報酬が脳室傍CRHニューロンを抑制し、ストレスを解消させる
Curr. Biol., 29 (2019), 10.1016/j.cub.2019.02.048
1243e4-1251.e4
グーグル奨学生
41
M. ハンセン、D.C.ルビンステイン、D.W.ウォーカー
長寿の促進因子としてのオートファジー:モデル生物からの知見
Nat. Rev. Mol. Cell Biol., 19 (2018), pp. 579-593, 10.1038/s41580-018-0033-y
ScopusGoogle Scholarで見る
42
M. 小松真一、和栗聡、上野達男、岩田純一、村田聡、谷田一、江崎淳、水島直樹、大隅良典、内山靖之、et al.
Atg7欠損マウスにおける飢餓誘発性および構成的オートファジーの障害
J. Cell Biol., 169 (2005), pp. 425-434, 10.1083/jcb.200412022
ScopusGoogle Scholarで見る
43
G.E.モーティモア、B.R.ラルドー、C.E.アダムズ
ラット肝臓におけるマイクロオートファジーと基礎的なタンパク質回転の制御。短期間の飢餓の影響
J. Biol. Chem., 263 (1988), pp.2506-2512
PDFを見る記事を見るScopusGoogle Scholarで見る
44
O.B.コトゥーラス、S.A.カラミダス、D.J.コンドメルコス
グルコースホメオスタシスにおけるグリコーゲンオートファジー
Pathol. Res. Pract., 202 (2006), pp. 631-638, 10.1016/j.prp.2006.04.001
PDFを見る記事を見るScopusGoogle Scholarで見る
45
J. 江崎淳、松本直樹、武田絵里子、小松正樹、高橋恭子、平岡祐介、高浩二、藤村俊哉、竹花健一、吉田正人、他。
肝臓オートファジーは血糖値およびアミノ酸値の維持に寄与する
オートファジー, 7 (2011), pp.727-736, 10.4161/auto.7.7.15371
ScopusGoogle Scholarで見る
46
A. 高木、久米聡、近藤真也、中澤淳一、金崎真也、荒木宏、荒木聡、小屋大輔、羽田真一、茶野俊彦、他.
哺乳類のオートファジーは飢餓時の肝および腎ケトジェネシスに必須である
Sci. Rep., 6 (2016), p. 18944, 10.1038/srep18944
ScopusGoogle Scholarで見る
47
J.C. Yoon, P. Puigserver, G. Chen, J. Donovan, Z. Wu, J. Rhee, G. Adelmant, J. Stafford, C.R. Kahn, D.K. Granner, et al.
転写活性化因子PGC-1を介した肝グルコネシン生成の制御
Nature, 413 (2001), pp. 131-138, 10.1038/35093050
ScopusGoogle Scholarで見る
48
R.B.ベガ、J.M.ハス、D.P.ケリー
ミトコンドリア脂肪酸酸化酵素をコードする核内遺伝子の転写制御におけるコアクチベーターPGC-1とペルオキシソーム増殖剤活性化受容体αの協調関係
Mol. Cell. Biol.、20(2000)、1868-1876頁、10.1128/MCB.20.5.1868-1876.2000
ScopusGoogle Scholarで見る
49
J. Rhee, Y. Inoue, J.C. Yoon, P. Puigserver, M. Fan, F.J. Gonzalez, B.M. Spiegelman
PPARγコアクチベーター-1α(PGC-1)による肝絶食応答の制御:グルコネシン生成における肝細胞核因子4αの必要性
Proc. Natl. Acad. Sci. USA, 100 (2003), pp.4012-4017, 10.1073/pnas.0730870100
ScopusGoogle Scholarで見る
50
C.P. Najt, S.A. Khan, T.D. Heden, B.A. Witthuhn, M. Perez, J.L. Heier, L.E. Mead, M.P. Franklin, K.K. Karanja, M.J. Graham, et al.
脂質滴由来の一価不飽和脂肪酸はPLIN5を経由してSIRT1をアロステリックに活性化する
モル. セル, 77 (2020), 10.1016/j.molcel.2019.12.003
810-824.e8
グーグル・スカラー
51
B.N.フィンク、M.C.グロプラー、Z.チェン、T.C.レオーネ、M.A.クロース、T.E.ハリス、J.C.ローレンスJr.、D.P.ケリー
リピン1は、肝PGC-1α/PPARα制御経路の誘導性増幅器である
セル・メタブ, 4 (2006), pp.199-210, 10.1016/j.cmet.2006.08.005
PDFを見る記事を見るScopusGoogle Scholarで見る
52
J.M. Lee, M. Wagner, R. Xiao, K.H. Kim, D. Feng, M.A. Lazar, D.D. Moore
栄養を感知する核内受容体がオートファジーを調整する
Nature, 516 (2014), pp.112-115, 10.1038/nature13961
グーグルシュラー
53
J.L.ニエト=トレス、M.ハンセン
マクロオートファジーと老化:細胞のリサイクルが健康と長寿に与える影響
モル. Aspects Med., 82 (2021), p. 101020, 10.1016/j.mam.2021.101020
PDFを見る記事を見るScopusGoogle Scholarで見る
54
L.R.ラピエール、A.メレンデス、M.ハンセン
オートファジーがC. elegansの脂質代謝を長寿に導く
オートファジー, 8 (2012), pp.144-146, 10.4161/auto.8.1.18722
ScopusGoogle Scholarで見る
55
S.N. Ewbank, C.A. Campos, J.Y. Chen, A.J. Bowen, S.L. Padilla, J.L. Dempsey, J.Y. Cui, R.D. Palmiter
AgRPニューロンにおける慢性的なGqシグナルは、肥満の原因にならない
Proc. Natl. Acad. Sci. USA, 117 (2020), pp.20874-20880, 10.1073/pnas.2004941117
ScopusGoogle Scholarで見る
56
M.A.カウリー、J.L.スマート、M.ルビンシュタイン、M.G.セルダン、S.ディアノ、T.L.ホーヴァス、R.D. コーン、M.J.ロー
レプチンは弧状核の神経ネットワークを通じて食欲不振のPOMCニューロンを活性化する
Nature, 411 (2001), pp. 480-484, 10.1038/35078085
ScopusGoogle Scholarで見る
57
A.R. Rau、S.T. Hentges
AgRPニューロン由来のPOMCニューロンへのGABA入力の関連性は、自発的放出と誘発的放出で異なる
J. Neurosci., 37 (2017), pp. 7362-7372, 10.1523/JNEUROSCI.0647-17.2017
ScopusGoogle Scholarで見る
58
A. Jais, L. Paeger, T. Sotelo-Hitschfeld, S. Bremser, M. Prinzensteiner, P. Klemm, V. Mykytiuk, P.J.M. Widdershooven, A.J. Vesting, K. Grzelka, and al.
PNOC(ARC)ニューロンは高脂肪食摂取により食欲亢進と肥満を促進する
Neuron, 106 (2020), 10.1016/j.neuron.2020.03.022
1009-1025.e10
Google Scholar
59
J. デュリュー、S.ウォルフ、A.ディリン
電子輸送鎖を介した長寿の細胞非自律性
細胞, 144 (2011), pp.79-91, 10.1016/j.cell.2010.12.016
PDFを見る記事を見るScopusGoogle Scholarで見る
60
R.C.テイラー、A.ディリン
XBP-1はストレス耐性と長寿の細胞非自律的制御因子である
Cell, 153 (2013), pp.1435-1447, 10.1016/j.cell.2013.05.042
PDFを見る記事を見るScopusGoogle Scholarで見る
61
S. イマニキア、N.P.エズベー、C.クルーガー、M.O.カサヌエバ、R.C.テイラー
神経系XBP-1が腸内リソソームを活性化し、線虫のプロテオスタシスを改善する。
Curr. Biol., 29 (2019), 10.1016/j.cub.2019.06.031
2322-2338.e7
Google Scholar
62
S. イマニキア、M. シェン、C. カストロ、J.L. グリフィン、R.C. テイラー
XBP-1は脂質代謝をリモデリングして長寿を延ばす
セル・レップ, 28 (2019), 10.1016/j.celrep.2019.06.057
581-589.e4
グーグル・スカラー
63
R.C.テイラー、C.ヘッツ
小胞体プロテオスタシスネットワークで生体の老化をマスターする
Aging Cell, 19 (2020), p. e13265, 10.1111/acel.13265
ScopusGoogle Scholarで見る
64
N. マルティネス-ロペス、E. タラブラ、M. トレド、M. ガルシア-マシア、S. サフ、L. コレット、A. バティスタ-ゴンザレス、N. バルジライ、J. E. ペシン、G. J. シュワルツ、他。
食間断食がもたらすオートファジーによるシステム全体の利益
Cell Metab., 26 (2017), 10.1016/j.cmet.2017.09.020
856-871.e5
Google Scholar
65
B. Tiesjema、R.A. Adan、M.C. Luijendijk、A. Kalsbeek、S.E. la Fleur
アデノ随伴ウイルスによる視床下部傍室核および外側視床下部での神経ペプチドYの過剰発現が摂食行動に及ぼす影響の違いについて
J. Neurosci., 27 (2007), pp. 14139-14146, 10.1523/JNEUROSCI.3280-07.2007
ScopusGoogle Scholarで見る
66
A.M. van den Hoek, C. van Heijningen, J.P. Schröder-van der Elst, D.M. Ouwens, L.M. Havekes, J.A. Romijn, A. Kalsbeek, H. Pijl
神経ペプチドYの脳室内投与は交感神経を介した肝インスリン抵抗性を誘導する
糖尿病, 57 (2008), pp.2304-2310, 10.2337/db07-1658
ScopusGoogle Scholarで見る
67
M. フェレイラ=マルケス、C.A.アベレイラ、S.カルモ=シルバ、M.ボテーリョ、L.ペレイラ・デ・アルメイダ、C.カヴァダース
カロリー制限は神経ペプチドYおよびグレリン受容体の活性化を介してラット皮質神経細胞におけるオートファジーを刺激する
Aging (Albany, NY), 8 (2016), pp. 1470-1484, 10.18632/aging.100996
ScopusGoogle Scholarで見る
68
C.A. Aveleira, M. Botelho, S. Carmo-Silva, J.F. Pascoal, M. Ferreira-Marques, C. Nóbrega, L. Cortes, J. Valero, L. Sousa-Ferreira, A.R. Álvaro, et al.
神経ペプチドYは視床下部ニューロンのオートファジーを刺激する
Proc. Natl. Acad. Sci. USA, 112 (2015), pp.E1642-E1651, 10.1073/pnas.1416609112
ScopusGoogle Scholarで見る
69
B. マンモントリ、M.サリアメトグル、J.ドンコール、M.ブー・ハリル、M.サンダラム、Z.ヤオ、K.ロイエ、R.レーナ、D.N. ブリンドリー
グルココルチコイドとサイクリックAMPは選択的に肝リピン-1発現を増加させ、インスリンは拮抗的に作用する
J. Lipid Res., 49 (2008), pp. 1056-1067, 10.1194/jlr.M800013-JLR200
PDFを見る記事を見るScopusGoogle Scholarで見る
70
P. Zhang、L. O'Loughlin、D.N. Brindley、K. Reue
脂肪形成過程におけるグルココルチコイドによるlipin-1遺伝子発現の制御機構
J. Lipid Res., 49 (2008), pp.1519-1528, 10.1194/jlr.M800061-JLR200
PDFを見る記事を見るScopusGoogle Scholarで見る
71
M. 佐藤、上田詠美、今野敦子、平井秀夫、倉内由美子、久恒敦子、勝木宏、関貴之
グルココルチコイドはシャペロンを介したオートファジーとマイクロオートファジーを負に制御する
バイオケム(Biochem. バイオフィジックス.Res. Commun., 528 (2020), pp. 199-205, 10.1016/j.bbrc.2020.04.132
PDFを見る記事を見るScopusGoogle Scholarで見る
72
J. Deng, Y. Guo, F. Yuan, S. Chen, H. Yin, X. Jiang, F. Jiao, F. Wang, H. Ji, G. Hu, et al.
オートファジー阻害はBATの白色化抑制を介してグルココルチコイドによる脂肪率上昇を抑制する
オートファジー, 16 (2020), pp.451-465, 10.1080/15548627.2019.1628537
ScopusGoogle Scholarで見る
73
Y. 江、B.O.A.ボッチウェイ、Z.Hu、M.Fang
SIRT1の過剰発現はコルチコステロンによるオートファジーを抑制する
神経科学, 411 (2019), pp.11-22, 10.1016/j.neuroscience.2019.05.035
PDFを見る記事を見るGoogle Scholar
74
R. トロンコソ、F. パレデス、V. パラ、D. ガティカ、C. バスケス-トリンカード、C. キロガ、R. ブラボ-サグア、C. ロペス-クリソスト、A. E. ロドリゲス、A. P. オヤルズン、他.
デキサメタゾンによるオートファジーは、ミトコンドリアクリアランスを通じて筋萎縮を媒介する
Cell Cycle, 13 (2014), pp.2281-2295, 10.4161/cc.29272
ScopusGoogle Scholarで見る
75
Q. Tong, C.P. Ye, J.E. Jones, J.K. Elmquist, B.B. Lowell
AgRPニューロンによるGABAのシナプス放出は、エネルギーバランスの正常な調節に必要である。
Nat. Neurosci., 11 (2008), pp.998-1000, 10.1038/nn.2167
ScopusGoogle Scholarで見る
76
L. マディセン、マオ、コッホ、J.M.ズオ、ベレニイ、藤澤聡、シュー、ガルシア3世、グー、ザネラ、他。
光で活性化・抑制するCre依存型オプトジェネティックトランスジェニックマウスのツールボックス
Nat. 神経科学, 15 (2012), pp.793-802, 10.1038/nn.3078
ScopusGoogle Scholarで見る
77
S.L. Padilla、J. Qiu、M.E. Soden、E. Sanz、C.C. Nestor、F.D. Barker、A. Quintana、 L.S. Zweifel、 O. K. Rønnekleiv、 M.J. Kelly、 R.D. Palmiter
アグーチ関連ペプチド神経回路が飢餓状態での適応行動を媒介する
Nat. Neurosci., 19 (2016), pp. 734-741, 10.1038/nn.4274
ScopusGoogle Scholarで見る
78
J. シンデリン、C.T.ルーデン、M.C.ヒナー、K.W.エリセーリ
ImageJのエコシステム: バイオメディカル画像解析のためのオープンプラットフォーム
モル. Reprod. Dev.、82(2015)、518-529ページ
CrossRefView in ScopusGoogle Scholar
79
H. ノルテ、T.D.マクビカー、F.テルカンプ、M.クルーガー
インスタント・クリエイト インタラクティブなデータ可視化・解析のためのソフトウェア群
Sci. Rep., 8 (2018), p. 12648, 10.1038/s41598-018-31154-6
ScopusGoogle Scholarで見る
80
H. パテル、P.エウェルス、A.ペルツァー、R.ハマレン、O.ボトビニック、G.シュトルム、D.モレノ、P.べムリ、シルビアモリン、L.P.F.M. ガルシア、他。
nf-core/rnaseq: nf-core/rnaseq v3.0 - シルバーシャーク
ゼノド
(2020), 10.5281/zenodo.4323183
Google Scholar
81
P.A.エウエルス、A.ペルツァー、S.フィリンガー、H.パテル、J.アルネバーグ、A.ウィルム、M.U. ガルシア、P.ディ・トマソ、S.ナーンセン
コミュニティが管理するバイオインフォマティクス・パイプラインのためのnf-coreフレームワーク
Nat. バイオテクノロジー, 38 (2020), pp.276-278, 10.1038/s41587-020-0439-x
ScopusGoogle Scholarで見る
82
R. パトロ、G.ダグガル、M.I.ラブ、R.A.イリサリー、C.キングスフォード
Salmonは、転写産物の発現を高速かつバイアスを考慮した形で定量化します。
Nat. Methods, 14 (2017), pp. 417-419, 10.1038/nmeth.4197
Google Scholar
83
M.I.ラブ、W.フーバー、S.アンダース
DESeq2によるRNA-seqデータのフォールドチェンジと分散のモデレート推定
ゲノムバイオロジー, 15 (2014), p.550, 10.1186/s13059-014-0550-8
ScopusGoogle Scholarで見る
84
G. Yu, L.G. Wang, Y. Han, Q.Y. He
clusterProfiler: 遺伝子クラスター間の生物学的テーマを比較するためのRパッケージ
OMICS A J. Integr. Biol., 16 (2012), pp.284-287, 10.1089/omi.2011.0118
Google Scholar
85
J.M. Wong, P.A. Malec, O.S. Mabrouk, J. Ro, M. Dus, R.T. Kennedy
生体試料中の神経化学物質の標的メタボロミクスを目的とした液体クロマトグラフィー質量分析による塩化ベンゾイル誘導体化反応
J. Chromatogr. A, 1446 (2016), pp.78-90, 10.1016/j.chroma.2016.04.006
PDFを見る記事を見るScopusGoogle Scholarで見る
86
M. シュワイガー、E・ランプラー、G・ヘルマン、W・ミクロス、W・ベルガー、G・ケーレンスペルガー
陰イオン交換クロマトグラフィーと高分解能質量分析計の組み合わせ:ターゲットとノンターゲットのメタボロミクスを融合するための強力なツール
Anal. Chem., 89 (2017), pp. 7667-7674, 10.1021/acs.analchem.7b01624
ScopusGoogle Scholarで見る
引用元: (0)
7
リードコンタクト
© 2023 The Authors. 発行:エルゼビア・インク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
