STAT3経路を介した腸-脳軸の相互作用: ヘリコバクター・ピロリ由来の分泌物が炎症とアルツハイマー病に及ぼす影響
メインコンテンツへスキップ
テイラー・アンド・フランシス・オンライン・ホームページ
ログイン|会員登録
カート
病原性
第15巻 2024年 - 第1号
オープンアクセス
1,076
閲覧数
0
現在までのCrossRef被引用数
40
アルトメトリック
聞く
研究論文
STAT3経路を介した腸-脳軸の相互作用: ヘリコバクター・ピロリ由来の分泌物が炎症とアルツハイマー病に及ぼす影響
https://www.tandfonline.com/doi/full/10.1080/21505594.2024.2303853

Meenakshi KandpalORCID Icon,Budhadev BaralORCID Icon,Nidhi VarshneyORCID Icon,Ajay Kumar JainORCID Icon,Debi ChatterjiORCID Icon,Ajay Kumar MeenaORCID Icon, show all
記事 2303853|2023年10月18日受理、2024年01月04日受理、オンライン公開:2024年02月04日
この記事の引用
https://doi.org/10.1080/21505594.2024.2303853
クロスマークロゴクロスマーク
この記事で
PDF EPUB
共有アイコン
要旨
ヘリコバクター・ピロリは胃炎や胃癌を引き起こす病原性細菌である。胃の合併症だけでなく、腸脳軸の障害や神経疾患との関連も報告されている。本研究では、ピロリ菌が介在する腸-脳軸の破綻と神経炎症が、アルツハイマー病(AD)のような神経疾患につながるという、もっともらしい役割と、それに関連する分子メカニズムについて調べた。我々は、ピロリ菌の抗菌薬耐性株と感受性株をブロス希釈法に基づいて選択した。その結果、ヘリコバクター・ピロリ由来培地(HPCM)処理により、ピロリ菌が胃内および神経細胞コンパートメントにおいて炎症反応を亢進させることが確認された。さらに、HPCMで処理した神経細胞および神経細胞とアストロサイトの共培養細胞において、STAT1、STAT3、およびAD関連タンパク質であるAPPとAPOE4の発現上昇が観察された。これらの細胞では、過剰な活性酸素の発生が認められた。LN229へのHPCM処理は、グリア線維酸性タンパク質の増加によって証明されるアストログリオーシスを引き起こす。この結果は、STAT3が、ピロリ菌が介在する神経細胞の病態形成における重要な制御因子であることを示している。特に、STAT3の特異的阻害剤であるBP-1-102による阻害は、HPCMによって誘導された神経細胞コンパートメントにおけるpSTAT3およびADマーカーの発現を減少させた。このように、我々の研究は、ピロリ菌感染がAGS細胞における炎症を悪化させ、STAT3制御分子の活性を調節することを示している。ピロリ菌の分泌物は、STAT3の活性化を促進し、AD関連シグネチャーマーカーの発現を誘導することによって、神経区画に影響を及ぼす可能性がある。さらに、pSTAT-3の阻害は、ピロリ菌に関連した神経炎症とアミロイド病態を緩和する。
フルサイズ表示
keywords: 腸脳軸神経炎症ヘリコバクター・ピロリ抗生物質耐性アルツハイマー病腸内マイクロバイオーム
はじめに
ヘリコバクター・ピロリ(Helicobacter pylori)はらせん状のグラム陰性細菌病原体で、胃上皮に選択的に定着し、世界人口の半数以上に感染している[引用1,引用2]。この細菌は主に、胃炎、胃腺がん、MALT(粘膜関連リンパ組織)、その他の腸関連疾患と関連している[引用3]。ピロリ菌のウレアーゼは胃酸を中和し、胃粘膜内での細菌の定着を促進する[引用4]。細菌が宿主細胞に付着すると、T4SS(IV型分泌システム)によって形成されたピラスが、主要なエフェクター分子であるCagAの送達を促進する。そして、細胞の運動性を妨げ、細胞増殖を阻害し、アポトーシスに影響を及ぼす細胞変化を促す[引用5]。CagA以外にも、VacA、BabA、SabAのような他の因子も、宿主の反応と分子病態を大きく変化させる[引用6]。
ピロリ菌感染に対するアプローチは、標準的な3剤併用療法や4剤併用療法から、Vonoprazanをベースとした2剤併用療法など、より現代的な治療法へと発展している[引用7]。近年、ピロリ菌の多剤耐性(MDR)株の増加が顕著であり、病原体を効果的に除菌することが困難であるという一貫した報告がある[引用文献8]。耐性ピロリ菌に対処するために、医療従事者は、自然な腸内細菌叢の均衡を乱す可能性のある広域スペクトル抗生物質にシフトするかもしれない[引用9,引用10]。このような腸内細菌叢の組成の乱れは、腸内細菌異常症を引き起こす可能性があることが、いくつかの研究で明らかにされている[引用11,引用12]。そのうちの1つの研究では、ピロリ菌陽性者と陰性者の間で、胃内細菌叢の組成が顕著に変化することが示唆されている[引用13]。ここ数十年、腸内細菌異常症と神経学的異常を含む様々な健康問題との間に関連性が確立されている[引用14]。
ピロリ菌によって引き起こされる疾患のスペクトルは、胃腸に限定されるものではない。いくつかの研究では、ピロリ菌の胃コロニー形成が、さまざまな胃外疾患、特に神経奇形につながることが示唆されている[引用15-17]。Ubertiらは、アルツハイマー病(AD)などの胃外疾患の発症に、ピロリ菌のウレアーゼ酵素が大きく寄与していることを提唱した[引用18]。しかし、これらの神経病理学的状態を引き起こす正確なメカニズムやシグナル伝達経路は、まだ完全に解明されていない。
ピロリ菌に感染すると、病原因子が放出され、その後のシグナル伝達カスケードや関連プロセスが引き起こされる。これらには、核因子κB(NF-κB)経路の活性化[引用19]、ERK/MAPKシグナル伝達経路[引用20]、サイトカインを介するJAK-STATシグナル伝達系[引用21]が含まれる。JAK/STATカスケードは、ピロリ菌感染時の重要なシグナル伝達経路である[引用22]。複数のサイトカインがこの複雑な経路を調節し[引用23,引用24]、細胞増殖と細胞死を制御するという二重の役割を果たしている。脳の多くの領域で、これらの活性化サイトカインが細胞の炎症を促進し、細胞死を引き起こす。神経変性疾患の発症において、神経炎症の主要な促進因子としてJAK/STATシグナル伝達経路が重要な役割を果たすことを示唆する、確立された研究がある[引用25,引用26]。JAK/STAT経路の多様な調節は、主に骨髄系細胞やT細胞を病原性表現型に誘導し、極性化することによって、神経炎症性疾患の病理学的意味を伝えている[引用25]。
本研究では、抗菌薬耐性(AMR)ピロリ菌が脳生理学に及ぼす影響を評価した。我々は、胃上皮AGS細胞由来のH. pylori-conditioned培地(HPCM)が神経細胞および神経細胞-アストロサイト共培養モデルに及ぼす影響をin-vitroで調べた。正確には、本研究の目的は、ピロリ菌由来のセクレトームが神経炎症およびADに関連する神経学的様式に及ぼす影響を解読することである。その結果、ピロリ菌は神経炎症を悪化させ、STATs制御分子の発現の変化やADに関連する徴候も悪化させることが示唆された。本研究は、ピロリ菌が介在する病態における腸-脳軸の調節とそれに関連する神経学的合併症の分子的基盤を提供するかもしれない。
研究結果
ピロリ菌分離株におけるAMRの評価
第一選択抗菌薬に対する耐性の出現は、H. pylori感染症および関連する病態に取り組む上で大きな懸念事項である[Citation27]。我々の臨床株におけるAMRを理解するために、3種類の抗生物質(メトロニダゾール、アモキシシリン、クラリスロマイシン)に対するH. pylori分離株の感受性を評価した。その結果,3株(HB1,HB5,HJ17)を除き,すべての株がクラリスロマイシンに感受性を示し,MICは0.25 μg/mlから1 μg/mlであった。メトロニダゾールの場合、感受性であった1株(HJ9)を除き、ほとんどの分離株が耐性を示し、MICは4 μg/mlから16 μg/mlであった。試験したH. pyloriの分離株はすべてアモキシシリンにも耐性を示し、MICは0.0625 μg/mlから0.25 μg/mlの範囲であった。しかし、2株(HJ9とI10)はアモキシシリンに感受性を示した。興味深いことに、HJ10とHJ14はアモキシシリンに対してユニークな感受性パターンを示し、0.125μg/ml以上の濃度で感受性を示した(表S1)。このように、クラリスロマイシンは他の2種類の抗生物質と比較して、本研究で対象としたほとんどのH. pylori分離株に対して良好な有効性を示した。AMRの状態から、今後の実験対象として3株を選択した: HJ9-3倍感受性菌(-)、HB10-部分耐性菌(±+)、HB1-3倍耐性菌(++)である(表S1)。
ピロリ菌感染とその病原性は胃内環境の炎症反応と関連している
ピロリ菌の急性および慢性感染は、炎症とそれに続く胃炎の発症に重要である[引用28]。特に、ピロリ菌感染時の慢性炎症環境は、炎症シグナルを含む様々な宿主関連細胞内シグナルを誘発する。図(図1(a)、感染戦略I)に示すように、ピロリ菌分離株への曝露後の胃(AGS)細胞における炎症性遺伝子の転写プロファイルを理解するために、ピロリ菌関連遺伝子(16s rRNAとcagA)、重要な炎症性遺伝子(サイトカインとケモカイン)、および転写因子(STAT1、STAT2、STAT3)のセットについてqRT-PCRを行った。重要なことに、HB10、HJ9、HB1では、24時間後に16s rRNA(p<0.01)とcagA(p<0.05)の発現が有意に上昇していることが観察された(図2(a)および(b))。さらに、TNFα(p < 0.01)、IL6、IL16、IL-1β(p < 0.001)などの炎症性サイトカイン、CXCL1、CXCL3(p < 0.01)、CXCL5、CCL5(p < 0.05)などのケモカインの相対的な転写産物発現は、コントロールと比較してH. pylori感染胃細胞で有意に亢進していた。しかし、HB1株およびHJ9株に曝露した細胞では、非感染細胞と比較して最も強い炎症反応が観察された(図2(c))。さらに、必須転写因子および制御因子、すなわちSTATの発現も測定した。H.ピロリ感染胃細胞では、コントロールと比較してSTAT1およびSTAT3の発現が有意に上昇した(p < 0.001)が、STAT2の発現低下(p < 0.001)が観察された(図2(c))。
図1. 感染戦略は、ピロリ菌が胃疾患および神経学的異常の病態生理に寄与する複雑な分子メカニズムを明らかにする。感染戦略-IおよびIIの模式図。(a)AGS細胞を60mmプレートに播種し、H. pylori分離株(HB10、HJ9、HB1)をこれらの播種細胞と24時間直接インキュベートした。その間、調整培地(HPCM)と細胞ペレットを回収した(感染戦略I)。(b)AGS細胞をSTAT3iで2時間処理した後、それぞれの菌株によるピロリ菌感染を24時間行った。同様に、調整培地(STAT3i処理HPCM)と細胞ペレットを回収した(感染戦略II)。(c)神経細胞IMR-32細胞および神経細胞-アストロサイト共培養細胞を、HPCMまたはSTAT3i処理HPCMと7:3の割合で24時間インキュベートした(cDMEM:HPCMまたはSTAT3i処理HPCM)。
図1. 感染戦略により、ピロリ菌が胃疾患や神経学的異常の病態生理に関与する複雑な分子メカニズムが明らかになった。感染戦略-IおよびIIの模式図。(a)AGS細胞を60mmプレートに播種し、H. pylori分離株(HB10、HJ9、HB1)をこれらの播種細胞と24時間直接インキュベートした。その間、調整培地(HPCM)と細胞ペレットを回収した(感染戦略I)。(b)AGS細胞をSTAT3iで2時間処理した後、それぞれの菌株によるピロリ菌感染を24時間行った。同様に、調整培地(STAT3i処理HPCM)と細胞ペレットを回収した(感染戦略II)。(c)神経細胞IMR-32細胞および神経細胞-アストロサイト共培養細胞を、HPCMまたはSTAT3i処理HPCMと7:3の割合で24時間インキュベートした(cDMEM:HPCMまたはSTAT3i処理HPCM)。
フルサイズ表示
図2. ピロリ菌感染は胃上皮細胞に炎症を誘導する。ピロリ菌関連遺伝子(a)16s rRNA、(b)cagA、(c)ピロリ菌(HB10, HJ9, HB1)をAGS細胞に24時間感染させた後の様々な炎症性サイトカイン、ケモカイン、STATファミリーメンバーの相対転写発現を示すヒートマップ。AGS細胞にピロリ菌(HB10, HJ9, HB1)を24時間感染させた後、(di) STAT1、(diii) STAT3のウエスタンブロットをimage Jソフトウエアで定量した。 (e) tNFΑとカスパーゼ3の代表的ウエスタンブロット画像。AGS細胞にH. pylori株(HB10, HJ9, HB1)を24時間感染させた後の(ei)TNFα、(eii)カスパーゼ3のウエスタンブロットをimage Jソフトウェアで定量したもの。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図2. ピロリ菌感染は胃上皮細胞に炎症を誘導する。ピロリ菌関連遺伝子(a)16s rRNA、(b)cagA、(c)AGS細胞にピロリ菌(HB10、HJ9、HB1)を24時間感染させた後の様々な炎症性サイトカイン、ケモカイン、STATファミリーメンバーの相対転写発現を示すヒートマップ。AGS細胞にピロリ菌(HB10, HJ9, HB1)を24時間感染させた後、(di) STAT1、(diii) STAT3のウエスタンブロットをimage Jソフトウエアで定量した。 (e) tNFΑとカスパーゼ3の代表的ウエスタンブロット画像。AGS細胞にH. pylori株(HB10, HJ9, HB1)を24時間感染させた後の(ei)TNFα、(eii)カスパーゼ3のウエスタンブロットをimage Jソフトウェアで定量したもの。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
さらに、ウェスタンブロット分析によって炎症マーカーとSTATを調べたところ、ピロリ菌に感染したAGS細胞では、STAT1(p<0.01)、STAT3(p<0.05)、TNFα(p<0.01)、およびカスパーゼ-3(p<0.001)の発現が有意に亢進していることが示された(図2(d)および(e))。
ピロリ菌由来セクレトームへの曝露による脳細胞の免疫学的応答の増強
神経疾患の病態進行に神経炎症が関与していることは、数多くの研究で示唆されている。主に、炎症性分子は神経変性病態と共局在していることが判明している。神経炎症の誘発におけるピロリ菌の役割を理解するために、神経芽細胞腫(IMR-32)および神経細胞とアストロサイトの共培養細胞(IMR-32およびU-87 MG)をピロリ菌感染胃細胞の調整培地で処理し(図1(c)、処理方法)、種々のサイトカイン、ケモカインおよびSTAT転写因子の転写発現を調べた。HB1-CMで処理した神経芽腫細胞では、炎症性サイトカインの発現が有意に上昇していることが観察された: IL6、TNFα、IL16、IL-1β、IL8(p < 0.01);ケモカイン: ケモカイン:CXCL1、CXCL3、CXCL5、CCL5(p < 0.01)、STAT制御分子: ケモカイン:CXCL1、CXCL3、CXCL5(p < 0.01)、STAT制御分子:STAT1、STAT2、STAT3(p < 0.01)はコントロールと比較した。さらに、HB10およびHJ9-CMで処理した神経細胞では、IL-1βの発現が少なかった(p < 0.05)以外は、すべての炎症性マーカーおよび炎症制御マーカーの発現が亢進していた(p < 0.05)(図3(a))。同様に、HPCMに対する神経細胞-アストロサイト共培養モデルの炎症反応のパターンも観察された。その結果、3種類のHPCM処理共培養細胞すべてにおいて、IL6、TNFα、IL16、IL-1β、IL8、CXCL1、CXCL3、CXCL5、STAT1、およびSTAT3(p<0.01)の発現亢進が認められた(図3(b))。HPCMを神経細胞に曝露すると、炎症部位が一過性に増加することが示唆される。
図3. ピロリ菌由来分泌物は神経芽細胞腫および神経細胞-アストロサイト共培養細胞において炎症を促進する。(a)IMR-32細胞、(b)IMR-32+U-87 MG共培養細胞にHPCMを24時間処理した後の様々な炎症性サイトカイン、ケモカインおよびSTATファミリーメンバーの相対的転写産物発現を示すヒートマップ。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図3. ピロリ菌由来セクレトームは神経芽細胞腫および神経細胞-アストロサイト共培養細胞において炎症を促進する。(a)IMR-32細胞、(b)IMR-32+U-87 MG共培養細胞にHPCMを24時間処理した後の様々な炎症性サイトカイン、ケモカインおよびSTATファミリーメンバーの相対的転写産物発現を示すヒートマップ。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
ピロリ菌由来セクレトームは神経コンパートメントにおいて酸化ストレスを引き起こす
ピロリ菌感染は胃上皮細胞に酸化ストレスを引き起こすことが知られている。我々は、HPCMで処理した神経細胞と共培養細胞において同様の病態が生じる可能性を検討するため、活性酸素を評価した。酸化還元感受性の蛍光色素2′-7′-ジクロロジヒドロフルオレセインジアセテート(H2-DCFDA)を用いて、HPCM処理神経細胞および共培養系における活性酸素産生を測定した。その結果、HPCM処理は、コントロールと比較して、神経細胞において有意に活性酸素を誘導することが観察された(p < 0.01)(図4)。さらに、HPCMに曝露した共培養細胞では、より強固な酸化ストレスが認められた(p < 0.001)(図S1)。このことは、ピロリ菌の分泌物が脳細胞に酸化ストレスを誘導する能力を持つことを示唆している。
図4. ピロリ菌由来分泌物は神経芽腫細胞の酸化ストレスを誘導する。1行目は明視野像、2行目は蛍光顕微鏡像で、(a)IMR-32細胞にHPCMを12時間曝露した際の細胞内総ROSを示す。一方、有意に亢進した細胞内ROS産生をimage Jソフトウェアで定量し、変化率(fold change)で表した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図4. ピロリ菌由来セクレトームは神経芽腫細胞の酸化ストレスを促進する。1行目は明視野像、2行目は蛍光顕微鏡像で、(a)IMR-32細胞にHPCMを12時間曝露した際の細胞内総ROSを示す。一方、有意に亢進した細胞内ROS産生をimage Jソフトウェアで定量し、変化率(fold change)で表した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
ピロリ菌分泌物に関連するSTATs活性化とアルツハイマー病マーカーとの関連性
ピロリ菌感染は、胃腸疾患においてSTATs制御分子の発現を増加させることが示されている。我々はまた、HPCM処理した神経細胞および共培養細胞におけるSTAT1およびSTAT3の転写レベルの上昇を測定した。ピロリ菌分泌が介在する神経学的合併症におけるSTATの妥当な関連をさらに検証するために、HPCMで処理した神経細胞および共培養細胞におけるSTATファミリーメンバー(STAT1およびSTAT3)とADマーカー(APPおよびAPOE4)のタンパク質発現を評価した。HB10、HJ9およびHB1-CM処理IMR-32細胞において、STAT1(p<0.01、p<0.001、p<0.01)およびSTAT3(p<0.05、p<0.001、p<0.001)の発現が有意に亢進していることが観察された(図5(ai)および(aii))。さらに、それぞれのHPCMに24時間暴露したIMR-32細胞では、APP(p<0.01、p<0.01、p<0.001)およびAPOE4(p<0.01、p<0.001、p<0.01)のタンパク質発現に有意な増加が認められた(図5(bi)および(bii))。さらに、それぞれのHPCMに曝露したIMR-32細胞では、コントロールと比較して、炎症性タンパク質NF-κB(p<0.01、p<0.001)およびTNFα(p<0.001、p<0.01)の発現が有意に上昇していることがわかった(図5(ci)および(cii))。同様に、共培養モデルでは、STAT1、STAT3(p<0.001)(図S2 AIおよびAII)、APP(p<0.05、p<0.001、p<0.01)、APOE4(p<0. 01、p<0.001、p<0.01)(図S2 BIおよびBII)、NF-κB、およびTNFα(p<0.01 p<0.001、p<0.01)が対照細胞と比較して認められた(図S2 CIおよびCII)。
図5. H.ピロリ菌由来分泌物はSTAT活性化および関連するADマーカーを誘導する。HPCMで24時間処理した神経細胞のウェスタンブロットにより、炎症マーカー、STAT制御分子、およびAD関連ホールマークの相対的タンパク質発現を測定した。A (a) IMR-32細胞におけるSTAT1とSTAT3の代表的ウェスタンブロット像。(aiおよびaii)IMR-32細胞におけるSTAT1およびSTAT3の相対発現をグラフ化したもの。(b)IMR-32細胞におけるAD関連マーカー、APPおよびAPOE4の代表的ウエスタンブロット像。IMR-32細胞における(bi)APOE4、(bii)APPのウエスタンブロット画像の定量化。(c)IMR-32細胞におけるNF-κBやtNFΑなどの炎症マーカーの代表的なウェスタンブロット像。IMR-32細胞における(ci) NF-κB、(cii) TNFαのウエスタンブロット画像の定量化。データは、これらのマーカーのタンパク質発現が有意に亢進していることを示した。定量はimage Jソフトウェアで行い、fold changeで表した。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図5. H.ピロリ菌由来分泌物はSTAT活性化および関連するADマーカーを誘導する。HPCMで24時間処理した神経細胞について、炎症マーカー、STAT制御分子、およびAD関連ホールマークの相対的タンパク質発現をウェスタンブロット法で測定した。A (a) IMR-32細胞におけるSTAT1とSTAT3の代表的ウェスタンブロット像。aiおよびaii)IMR-32細胞におけるSTAT1およびSTAT3の相対発現のグラフ表示。(b)IMR-32細胞におけるAD関連マーカー、APPおよびAPOE4の代表的ウエスタンブロット像。IMR-32細胞における(bi)APOE4、(bii)APPのウエスタンブロット画像の定量化。(c)IMR-32細胞におけるNF-κBやtNFΑなどの炎症マーカーの代表的なウェスタンブロット像。IMR-32細胞における(ci) NF-κB、(cii) TNFαのウエスタンブロット画像の定量化。データは、これらのマーカーのタンパク質発現が有意に亢進していることを示した。定量はimage Jソフトウェアで行い、fold changeで表した。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
ピロリ菌由来セクレトーム処理によるLN229細胞のアストロサイト再活性化
アストロサイトは、神経変性疾患と関連した病態の進展に伴い、炎症プロセスに応答して活性化される。この活性化は、疾患の進行と病態形成に伴う反応性アストロサイトの出現につながる。アストロサイトの再活性化を調べるため、我々は、GFAP陽性アストロサイト細胞株LN229をHPCMに曝露し、反応性アストロサイトの特異的マーカーであるGFAP(Glial fibrillary acidic protein)のタンパク質発現をウェスタンブロットと免疫蛍光アッセイで調べた。その結果、HPCMで処理したLN229細胞では、未処理のLN229細胞と比較して、GFAPのタンパク質レベルが有意に増加した(p<0.05、p<0.01、p<0.001)(図6(a)および(b))。
図6. HPCMはLN229細胞のアストロサイト再活性化を誘導する。(a)HPCMで24時間処理した後のLN229細胞におけるGFAPの代表的なウェスタンブロット画像。(ai)ウェスタンブロットデータをimage Jソフトウェアで定量し、倍数変化で表したもの。(b)HPCMで24時間処理したLN229細胞におけるGFAPの代表的な共焦点顕微鏡像。1行目は未処理の細胞を表し、2~5行目はAGS-CM、HB10、HJ9、HB1-CMで処理したLN229細胞を表す。(bi)蛍光画像の強度をimage Jソフトウェアで定量化し、fold changeで表した。ウェスタンブロットと免疫蛍光のデータはいずれも、HPCM処理細胞におけるGFAP発現の有意な亢進を示した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図6. HPCMはLN229細胞のアストロサイト再活性化を誘導する。(a)HPCMで24時間処理した後のLN229細胞におけるGFAPの代表的なウェスタンブロット画像。(ai)ウェスタンブロットデータをimage Jソフトウェアで定量化し、fold changeで表したもの。(b)HPCMで24時間処理したLN229細胞におけるGFAPの代表的な共焦点顕微鏡像。1行目は未処理の細胞を表し、2~5行目はAGS-CM、HB10、HJ9、HB1-CMで処理したLN229細胞を表す。(bi)蛍光画像の強度をimage Jソフトウェアで定量化し、fold changeで表した。ウェスタンブロットと免疫蛍光のデータはいずれも、HPCM処理細胞におけるGFAP発現の有意な亢進を示した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
STAT3iはピロリ菌感染胃上皮細胞のpSTAT3レベルを低下させる
ピロリ菌感染時のSTAT3介在性胃炎を検証するために、ピロリ菌感染前の胃細胞でSTAT3を阻害した(図1(b)、感染戦略II)。その結果、BP-1-102を曝露したピロリ菌感染AGS細胞では、STAT3の転写産物発現が有意に減少した(p < 0.01)(図S3 A)。しかしながら、タンパク質レベルでは、H. pylori感染AGS細胞ではpSTAT3およびSTAT3の発現が有意に亢進し、阻害剤処理およびH. pylori感染AGS細胞ではコントロールと比較して発現が有意に減少した(p < 0.05)(図7(ai)および(aii))。さらに、pSTAT3の阻害は、3つの感染パネルすべてにおいて、TNFαタンパク質の発現低下ももたらした: HB10、HJ9、HB1(p < 0.01)(図7(aiii))。このように、炎症反応を制御する証拠が得られた。
図7. BP-1-102はH. pylori感染胃上皮細胞におけるSTAT3の発現を阻害した。(a)BP-1-102を2時間処理した後、HB10、HJ9、HB1で24時間ピロリ菌に感染させたAGS細胞におけるpSTAT3、STAT3、tNFΑの代表的なウェスタンブロット画像。(ai)pSTAT3、(aii)STAT3、(aiii)TNFαのウエスタンブロット画像をimage Jソフトウェアで定量し、データをfold changeで表した。データは、ピロリ菌感染AGS細胞に続いてSTAT3iを処理した細胞におけるpSTAT3、STAT3、TNFαの発現の有意な減少を表している。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図7. BP-1-102はH. pylori感染胃上皮細胞におけるSTAT3の発現を阻害した。(a)BP-1-102を2時間処理した後、HB10、HJ9、HB1で24時間ピロリ菌感染させたAGS細胞におけるpSTAT3、STAT3、tNFΑの代表的なウェスタンブロット画像。(ai)pSTAT3、(aii)STAT3、(aiii)TNFαのウエスタンブロット画像をimage Jソフトウェアで定量し、データをfold changeで表した。データは、ピロリ菌感染AGS細胞に続いてSTAT3iを処理した細胞におけるpSTAT3、STAT3、TNFαの発現の有意な減少を表している。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
BP-1-102で処理したピロリ菌由来分泌物は、神経区画におけるpSTAT3および関連する神経変性シグネチャー分子を減少させる
STATファミリーは、神経変性疾患、特にADの病態生理学において潜在的な役割を担っている。このことから、我々は、STAT3i処理HPCMとインキュベートしたIMR-32およびIMR-32+U-87 MG共培養細胞において、HPCMが介在するSTATの活性化と転写物およびタンパク質レベルでのADマーカーのアップレギュレーションの可能性を検討することにした(図1(c)治療方法)。その結果、STAT3i処理HPCMは、未処理の感染細胞と比較して、IMR-32細胞におけるSTAT3(p<0.05)(図S3 B)、およびAPP、BACE1(p<0.01);APOE4、PSEN1(p<0.05)などのAD関連遺伝子の転写レベルを有意に減少させた(図8(a))。さらに、STAT3iで処理したHB10、HJ9、HB1 CMでは、pSTAT3(p<0.05、p<0.01、p<0.001)、STAT3(p<0.01、p<0.001、p<0.01)、APP(p<0.01、p<0.001、p<0.01)、APOE4(p<0.05、p<0.01、p<0.001)のタンパク質発現が有意に低下した。さらに、STAT3i処理HPCMとインキュベートしたIMR-32細胞において、NF-κBの発現低下(p < 0.05, p < 0.01)も観察された(図9(ai)-(av))。
図8. STAT3i処理したH. pylori由来セクレトームは、神経コンパートメントにおけるSTAT3およびAD関連シグネチャー遺伝子の転写発現を減少させる。STAT3i処理HPCM(a)IMR-32細胞、(b)IMR-32-U-87 MG共培養細胞に24時間暴露した後の、APP、APOE4、PSEN1、BACE1などの様々な神経疾患マーカーの相対的転写産物発現。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図8. STAT3iで処理したピロリ菌由来の分泌物は、神経コンパートメントにおけるSTAT3およびAD関連シグネチャー遺伝子の転写発現を減少させる。STAT3i処理HPCM(a)IMR-32細胞、(b)IMR-32-U-87 MG共培養細胞に24時間曝露した後の、APP、APOE4、PSEN1、BACE1などの様々な神経疾患マーカーの相対的転写産物発現。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
図9. STAT3iで処理したピロリ菌由来セクレトームは、神経区画におけるpSTAT3および関連する神経変性シグネチャー分子を阻害する。(a)IMR-32細胞にSTAT3i処理HPCMを24時間曝露した後の、STAT3、pSTAT3、NF-κB、およびAPOE4やAPPなどのADマーカーの代表的なウェスタンブロット画像。IMR-32細胞における(ai)pSTAT3、(AII)STAT3、(AIII)NF-κB、(AIV)APOE4、(AV)APPをimage Jソフトウェアで定量し、倍数変化で表した。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを、、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図9. STAT3iで処理したピロリ菌由来セクレトームは、神経区画におけるpSTAT3および関連する神経変性シグネチャー分子を阻害する。STAT3i処理HPCMを(a)IMR-32細胞に24時間曝露した後の、STAT3、pSTAT3、NF-κB、およびAPOE4やAPPなどのADマーカーの代表的なウェスタンブロット画像。IMR-32細胞における(ai)pSTAT3、(AII)STAT3、(AIII)NF-κB、(AIV)APOE4、(AV)APPをimage Jソフトウェアで定量し、倍数変化で表した。実験は2生物学的複製と2技術的複製(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
同様に、共培養モデルでは、STAT3(p<0.01)(図S3 C)、およびAPOE4、BACE1(p<0.01)、APP、PSEN1(p<0.05)などのAD関連シグネチャー遺伝子の転写産物の発現低下が観察された(図8(b))。さらに、STAT3iで処理したHPCMとインキュベートした共培養細胞において、pSTAT3(p<0.01、p<0.001、p<0.01)、STAT3(p<0.01、p<0.001、p<0.01)、APP(p<0.01、p<0.001、p<0.01)、APOE4(p<0.05、p<0.01、p<0.001)のタンパク質発現が有意に低下していることがわかった(図S4 AI-AV)。
さらに、BP-1-102処理HPCMに曝露した神経および共培養モデルにおけるSTAT1およびpSTAT1の研究は、総STAT1の発現レベルの有意な減少(p < 0.01)を示した(図5(aii)および(bii))。さらに、pSTAT1のレベルは、神経細胞および共培養細胞のすべてのサンプルで変化しなかった(図S5 AIおよびBI)。
神経コンパートメントにおけるピロリ菌由来分泌物に誘導されたSTAT3の核移行
活性化されたSTAT3はリン酸化し、二量体化し、核内標的遺伝子の転写を誘発する。次に、HPCMがpSTAT3の核内転座を促進するかどうかを免疫蛍光アッセイで調べた。その結果、リン酸化STAT3は、HPCMで処理したIMR-32細胞の核周辺領域または核コンパートメント内に主に検出された(p<0.01)(図10(a))。驚くべきことに、HJ9-CMで処理したIMR-32細胞では、コントロールや他の処理した実験セットアップと比較して、pSTAT3の過剰な核転座が観察された(p < 0.001)。しかし、pSTAT3の核内転位は、STAT3iで処理したHPCMに暴露したIMR-32細胞では有意に減少した(p < 0.01)(図10(a))。
図10. ピロリ菌由来分泌物は神経芽腫細胞においてSTAT3の核内転座を誘導した。STAT3iに続いてHPCMを24時間処理した後のIMR-32細胞におけるpSTAT3の代表的な蛍光画像。1行目は未処理細胞を表し、2~9行目はAGS-CM、STAT3i CM、HB10 CM、STAT3i+HB10 CM、HJ9 CM、STAT3i+HJ9 CM、HB1 CM、STAT3i+HB1 CMで処理したIMR-32細胞を表す。(BII)画像の蛍光強度をimage Jソフトウェアで定量し、fold changeで表した。免疫蛍光データは、STAT3i-HPCM処理細胞においてpSTAT3の発現が有意に減少し、核転座が少ないことを示した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
図10. ピロリ菌由来分泌物は神経芽腫細胞においてSTAT3の核内転座を誘導する。STAT3iに続いてHPCMを24時間処理した後のIMR-32細胞におけるpSTAT3の代表的な蛍光画像。1行目は未処理細胞を表し、2~9行目はAGS-CM、STAT3i CM、HB10 CM、STAT3i+HB10 CM、HJ9 CM、STAT3i+HJ9 CM、HB1 CM、STAT3i+HB1 CMで処理したIMR-32細胞を表す。(BII)画像の蛍光強度をimage Jソフトウェアで定量し、fold changeで表した。免疫蛍光データは、STAT3i-HPCM処理細胞においてpSTAT3の発現が有意に減少し、核転座が少ないことを示した。実験は2生物学的反復と2技術的反復(4データポイント)について行い、結果は3データポイントの平均±SDで示した。p値<0.05、<0.01、<0.0001は、それぞれ有意なアップレギュレーションを*、**、***で表し、有意なダウンレギュレーションを#、#、##で表した。
フルサイズ表示
考察
大脳環境と消化管微生物叢との相互作用は、脳の恒常性の維持と大脳の発達の形成に極めて重要な役割を果たしている[引用文献17]。この軸に沿ったシグナル伝達は、様々な内因性および外因性の刺激によって変化し、中枢神経系と腸管神経系の活動を調節する[引用29]。この相互作用は、迷走神経、免疫系、腸内細菌の代謝産物などの経路によって促進される[引用30]。腸内細菌集団の組成の変化は、大脳の環境を調節する[引用31]。ピロリ菌は、世界人口の半数以上の胃に生息するεプロテオバクテリアである。ピロリ菌は、慢性胃炎や胃がんの原因となるほか、腸内環境の異常を引き起こすことが知られている。最近の研究では、認知症、脳卒中、ADなどの複数の神経学的合併症との関連が示唆されている[引用15,引用16,引用32]。しかし、ピロリ菌が介在する神経合併症の分子メカニズムや関連する病理学的変化については、いまだ解明されていない。
本研究では、ピロリ菌由来のセクレトームが神経炎症およびADマーカーに及ぼす影響を明らかにすることを試みた。これには、ピロリ菌感染AGS細胞のコンディショニング培地で処理した神経芽細胞腫細胞(IMR-32)を用いた。さらに、神経細胞はアストロサイトやミクログリアといった支持細胞によって育まれ、保護されている。これらの細胞は、神経炎症やその他の関連病態において重要な役割を果たしている。神経細胞とアストロサイトの共培養は、これまでにもさまざまな研究によって神経炎症を理解するために用いられてきた[引用33,引用34]。われわれはまた、IMR-32とU-87 MG細胞を含む直接接触型の神経-アストロサイト共培養モデルを用いて、HPCMの大脳区画に対するもっともらしい影響を理解した。
多剤耐性あるいは抗菌薬耐性のピロリ菌が増加し、除菌に失敗することが大きな課題となっている[引用文献8]。しかし、多剤耐性ピロリ菌が神経環境に及ぼす影響については、さらに詳しく調べる必要がある。複数の臨床分離株が、クラリスロマイシン、メトロニダゾール、アモキシシリンなどの抗生物質を含む最新の4剤併用療法に対して耐性を示し、ピロリ菌の除菌に大きな脅威をもたらしている。AMRピロリ菌が神経炎を誘発し、神経障害を引き起こす可能性のある機序をより深く理解するために、本研究では、AMRピロリ菌を用いた神経学的研究を行った。本研究では、クラリスロマイシン、メトロニダゾール、アモキシシリンに対して3重耐性(HB1)、3重感受性(HJ9)、部分耐性(HB10)の3種類のピロリ菌を用いた。
ピロリ菌は炎症マーカーを誘発し、胃腸の炎症を引き起こす [引用35]。ピロリ菌感染時のAGS細胞の転写プロファイルから得られた我々の結果も、炎症性分子の発現上昇を示した。サイトカインはJAK/STATシグナルの強力な誘導因子であるため、ピロリ菌感染に対するSTAT活性化をモニターした。JAK/STAT経路の持続的な活性化は、胃炎の発症に大きく関与している[引用36]。さらに、ピロリ菌感染はSTAT1とSTAT3の活性化も誘導する[引用37]。我々の研究でも、HB10、HJ9、HB1に感染した胃上皮細胞において、STAT1とSTAT3の発現が亢進していることが明らかになった。
腸内微生物の分泌物は迷走神経を介して脳に入り、さらに神経病理を誘発し、腸-脳軸を変調させるのかもしれない。パエナルカリゲネス・ホミニス(Paenalcaligenes hominis)由来の細胞外小胞は、血流と迷走神経を介して脳に侵入することが証明されている[引用38]。以前の報告では、マウスモデルにおいてピロリ菌感染による神経炎症の誘発が示唆されていた[引用39]。Regueiraらによる研究では、細菌感染に伴う炎症反応が認知機能障害を誘発することが示唆された[引用40]。認知機能障害を有する感染者は、認知的に正常な対照群と比較して、IL-6の血清レベルが高かった。実験的研究は、炎症がADの発症において基本的な役割を果たしていることを示唆している。同様に、IL-1、IL-6、TNFαを含むいくつかの炎症性遺伝子の多型は、AD発症の感受性の上昇と関連しており、それによって間接的に病気の進行に炎症反応が関与していることが示唆されている[引用41]。これまでの知見と同様に、我々はHPCMが神経環境において炎症カスケードを引き起こすことを発見した。また、HPCMで処理した神経細胞および共培養細胞では、IL6、TNFΑ、IL-1β、IL16、IL8の発現が亢進していることが示された。さらに、HPCMで処理した神経細胞のケモカイン・プロファイル(CXCL1、CXCL3、CXCL5、CCL5)が有意に増加していることもわかった。先行研究でも、ADおよびMCI患者の髄液および血液中のケモカイン(CCL1、CCL5、CCL15、CCL27、CXCL9、CXCL10、CXCL3)の発現が変化していることが見いだされている[引用42]。意外なことに、胃生検から分離され、トリプルレジスタンス(HB1)AMRの状態にあるピロリ菌は、他の2つの株と比較して、神経芽腫細胞でより炎症を悪化させることが観察された。これは、MDR株によって放出された毒素に対する免疫活性化が促進されたためかもしれない。不思議なことに、HPCMを行った場合、神経細胞アストロサイトの共培養細胞では、単独で処理した神経芽細胞腫細胞とは対照的に、炎症レベルが増大した。これは、細菌感染時にアストロサイトが介在する炎症反応と考えられる。先に、ピロリ菌由来のOMVがアストログリオーシス(反応性アストロサイト)を誘導することが証明されている。さらに、これは神経突起の退縮などの神経細胞障害を引き起こし、最終的には神経細胞死を増加させる可能性がある[引用43]。我々の研究では、HPCM処理LN229細胞において、ウェスタンブロットと免疫蛍光アッセイにより検出されたタンパク質レベルでのGFAP(アストログリオーシスのマーカー)の発現亢進も見いだした。同様に、GFAPの最も強固な発現は、他の2つの処理群と比較して、HB1-CMで処理したLN229細胞で認められた。JAK/STATシグナル伝達経路は、神経変性疾患において神経炎症を促進する重要な因子の一つである[引用25,引用44]。この複雑な経路の重要な制御因子の一つであるSTAT3の恒常的または異常な活性化は、神経奇形において極めて重要な役割を果たすことが証明されている[引用45]。STAT3活性化の亢進は、野生型マウスにおけるLPS誘発性炎症と関連していることが判明している[引用46]。我々のデータは、3種類のHPCM処理IMR-32および共培養細胞すべてにおいて、STAT1およびSTAT3のタンパク質発現の上昇を示した。このことは、OMVを含むHPCMが神経コンパートメントにおいてSTATの活性化を媒介することを示唆しているのかもしれない。HPCMで処理した神経細胞におけるSTAT1の活性化は、ピロリ菌の分泌成分によって引き起こされる著しいサイトカインの嵐に起因している可能性がある[引用47]。STAT3の活性化は、STAT3分子の二量体化と、リン酸化によるさらなる核移行によって特徴づけられる[引用48]。我々の研究では、HPCMで処理するとIMR-32細胞の核コンパートメントでpSTAT3の発現が亢進することを発見した。
さらに、以前の報告では、ピロリ菌濾液はラットの空間学習および記憶障害を引き起こし、シナプスの成熟を損なうことが判明している[引用49]。今回の研究では、ADに関連する特徴的な物質が顕著に発現していることも明らかになった: HPCMで処理したIMR-32と共培養細胞では、APP、APOE4、PSEN1、BACE1が顕著に発現していた。驚くべきことに、HB10およびHB1-CM(胃生検分離株)に暴露した細胞ではなく、HJ9-CM(胃液分離株)に暴露した細胞では、STAT3、APP、APOE4のタンパク質発現が顕著に増加することが観察された。これは、我々の以前の報告[引用2,引用50]で議論したように、他の2つのHB分離株と比較してHJ分離株の病原性が高いためかもしれない。我々の研究とは対照的に、先行研究の多くはMDR H. pyloriの病原性が感受性株に比べて高いことを示唆している[Citation51]。進化において、新しい性質の出現は、既存の性質の消滅という代償を伴う。細菌の場合、特定の抗生物質に対する耐性が病原性を損なうことがある。Beceiroらは、抗生物質耐性の増加が細菌の病原性と適性に有害な影響を及ぼすという複数の例を挙げている[引用52]。三重耐性HB1の病原性の低さは、同様の悪影響によるものかもしれない。さらに、APPとAPOE4の発現が共培養モデルで著しく上昇したことから、脳免疫細胞のアストロサイトが、神経病理学的状態において神経細胞とともに重要な役割を果たしていることが示唆された。神経障害では、ニューロンとアストロサイトの相互作用が調節されなくなる。
STAT3の阻害は、神経炎症とADに関連した病態から保護することが証明されている[引用46]。さらに、以前の研究では、STAT3がアミロイドβ(Aβ)産生における重要な酵素のひとつであるBACE1の転写制御因子であることが報告されている。さらに、STAT3の阻害は、BACE1の発現とアミロイド病態を選択的に減少させた[引用46]。私たちの結果は、HPCMで処理すると、神経芽細胞腫および神経細胞と星細胞腫の共培養細胞において、pSTAT3、APP、およびAPOE4の発現が亢進することを実証した。これらの効果は、STAT3を阻害することで減弱した(図11)。このことは、STAT3が炎症性およびAD関連マーカー(APPおよびAPOE4)の転写制御因子であることを示唆しているのかもしれない。以前の報告では、STAT3は炎症性マーカーの発現を増強することにより、反応性アストロサイトの転写制御因子であることが示唆されている[引用54]。同様に、別の研究では、LPSによって引き起こされたSTAT3阻害によって、脳内のサイトカインIL-6、IL-1β、TNFαのレベルが低下したことが報告されている[引用46]。興味深いことに、pSTAT3発現の抑制に続くAPPおよびAPOE4の発現の抑制は、H. pylori株とは無関係である。
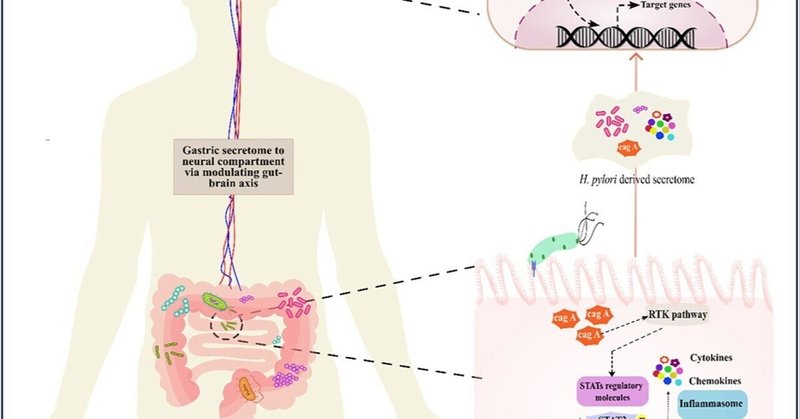
図11. ピロリ菌由来の分泌物は、STAT3シグナル伝達経路の調節を介して神経炎症と神経変性を引き起こす。胃AGS細胞へのピロリ菌感染は炎症反応を誘発し、STAT制御因子の発現を変化させる。腸-脳軸を変化させることにより、ピロリ菌由来のセクレトームは神経炎症を引き起こす。HPCMに暴露されたIMR-32および共培養細胞は、IL6、IL8、TNFα、ケモカインなどの炎症マーカーの発現の亢進を示した。炎症カスケード以外にも、HPCMは神経細胞環境においてSTATシグナル伝達経路を刺激する可能性がある。HPCMで処理した神経細胞では、APP、APOE4、BACE1、PSEN1のようなADに関連する徴候の発現増加が観察された。BP-1-102によるSTAT3の阻害は、STAT3iで処理したHPCMに曝露した神経細胞における炎症と神経病理学的マーカーを減少させた。
図11. ピロリ菌由来の分泌物は、STAT3シグナル伝達経路の調節を介して神経炎症と神経変性を引き起こす。胃AGS細胞へのピロリ菌感染は炎症反応を誘発し、STAT制御因子の発現を変化させる。腸-脳軸を変化させることにより、ピロリ菌由来のセクレトームは神経炎症を引き起こす。HPCMに暴露されたIMR-32および共培養細胞は、IL6、IL8、TNFα、ケモカインなどの炎症マーカーの発現の亢進を示した。炎症カスケード以外にも、HPCMは神経細胞環境においてSTATシグナル伝達経路を刺激する可能性がある。HPCMで処理した神経細胞では、APP、APOE4、BACE1、PSEN1のようなADに関連する徴候の発現増加が観察された。BP-1-102によるSTAT3の阻害は、STAT3iで処理したHPCMに曝露した神経細胞における炎症と神経病理学的マーカーを減少させた。
フルサイズ表示
結論として、我々の研究は、ADに関連する神経病理学と、ピロリ菌のセクレトームによって引き起こされるSTAT3を介した神経炎症の分子的洞察を提示した。ピロリ菌感染はAGS細胞の炎症を悪化させ、STAT3とその下流分子の活性を調節する。さらに、ピロリ菌分泌物は、STAT3のリン酸化と核局在を増加させることにより、神経区画におけるJAK/STAT経路を扇動する可能性がある。さらに解析を進めると、STAT3は炎症マーカーやアミロイドマーカー(APPとAPOE4)の転写制御因子として働く可能性が明らかになった。さらに、胃環境で選択的阻害剤BP-1-102を介してSTAT3を阻害すると、HPCM由来の炎症反応とアミロイド誘発病態が抑制された(図11)。
今後の課題
本研究は、ピロリ菌感染におけるSTAT3を介した腸脳軸の破綻に光を当てた。さらに、ピロリ菌由来のセクレトームを解析して、腸脳軸の破綻に関連する因子と神経学的合併症におけるその役割を理解する必要がある。現在進行中の研究では、それぞれのピロリ菌セクレトームの系統的なプロファイリングと特性解析を掘り下げている。液体クロマトグラフィー質量分析法(LC-MS)や高速液体クロマトグラフィー(HPLC)などの高度な方法論を用い、プロテオミクス、リピドミクス、メタボロミクスなどの複雑なランドスケープを精査する。この厳密な科学的アプローチは、神経学的複雑性に複雑に関連する特定の病原性因子の微妙な関与を解明することを目的としている。重要なことは、動物モデルにおける行動解析とともにin vivoでの検証を行うことで、ピロリ菌に関連するSTAT3を介した神経合併症の確実な証拠を提供することである。
材料と方法
哺乳動物細胞培養
ヒト胃腺癌細胞株(AGS, RRID: CVCL_0139)、ヒト神経芽腫細胞株(IMR-32, RRID: CVCL_0346)、ヒト膠芽腫細胞株(U-87 MG, RRID: CVCL_0022 and LN229, RRID: CVCL_0393)は、インド、プネーのNational Centre for Cell Scienceから調達した。細胞は、10%ウシ胎児血清(FBS;Gibco Laboratories Pvt. Limited、インド)、50U/mLのペニシリン、100μg/mLのストレプトマイシン、2mMのL-グルタミンを添加したダルベッコ改変イーグル培地(DMEM;Himedia Laboratories Pvt. Limited、インド)で培養した。細胞は37℃、5% CO2の加湿環境で維持した。
細菌培養
ピロリ菌臨床株(HB10、HJ9、HB1)は、前述のプロトコールに従って、胃炎が疑われる患者のヒト胃生検(HB)および胃液(HJ)サンプルから分離した[引用文献1]。最初に、10% FBSおよびバンコマイシン、セフスロジン、アムホテリシン、トリメトプリムなどのピロリ菌選択的抗生物質をそれぞれ10、5、5、5 mg/L添加したBrain Heart Infusion寒天プレート(BD-DIFCO、米国)に、それぞれの菌のグリセロールストックをループフルにストリークした(Sigma Aldrich、St Louis、MO、米国)。これらのプレートを微好気環境で、目に見える増殖が観察されるまで培養した。点状のコロニーを同定し、グラム染色に用いた(補足図S6)。ピロリ菌との形態学的比較によりコロニーをスクリーニングした。さらに、cBHIブロス培地中のH. pylori株を、嫌気性ワークステーション(Whitley DG250)内で37℃の微好気条件下(85%N2、10%CO2、5%O2)で培養した。
H. pylori分離株の抗生物質感受性試験
臨床ピロリ菌10株(HJ1、HJ9、HJ10、HJ17、HJ14、I10、HB10、HB14、HB1、HB5)のクラリスロマイシン、メトロニダゾール、アモキシシリンなどの4剤併用療法で使用される抗生物質に対する最小発育阻止濃度(MIC)を、前述のプロトコール[引用文献9]に従ってブロス微量希釈法を用いて評価した。感受性の確認には以下の抗生物質濃度を用いた: クラリスロマイシン(0、0.25、0.5、1ug/ml)、メトロニダゾール(0、4、8、16ug/ml)、アモキシシリン(0、0.0625、0.125、0.25ug/ml)。クラリスロマイシン(MIC>0.5μg/ml)、メトロニダゾール(MIC>4μg/ml)、アモキシシリン(MIC>0.125μg/ml)である。コントロールとして完全脳心筋注入(BHI)培地を用いた。
感染方法
感染手順は、60mmプレートに0.5百万個のAGS細胞を播種することから始めた。80-85%のコンフルエントに達した時点で、細胞をHB10、HJ9、HB1に感染多重度(MOI)100で感染させた。MOIは我々の以前の報告[引用1]に記載されているように計算した。培養物1mlあたりの細菌細胞数(CFU/mL)は最終ODを用いて決定し、感染に必要な細菌培養量はそれに応じて計算した。感染に先立ち、菌株は毎回、標準化されたプロトコールに従って二重のグラム染色によって確認された[引用1]。
ピロリ菌の感染は、感染戦略-I(図1(a))に従って行った。簡単に説明すると、ピロリ菌の3つの異なる臨床株(HB10、HJ9、HB1)に胃上皮細胞を曝露し、感染していないAGS細胞を対照とした。細胞を24時間培養し、それぞれの菌株に感染させた細胞から採取した調整培地を、原稿ではさらにH. pylori由来調整培地(HPCM)と命名した。さらに、神経細胞(IMR-32)および神経細胞-胃細胞共培養細胞(IMR-32+U-87 MG)を、cDMEMとHPCMを7:3の割合で24時間処理した(図1(c))。
BP-1-102の細胞毒性アッセイ
AGS細胞に対するBP-1-102の細胞毒性をMTTアッセイで測定した。簡単に言うと、AGS細胞を異なる濃度のBP-1-102で24時間処理した。さらに、50μlのMTT試薬(0.5mg/ml)を加え、CO2インキュベーター内で37℃で2時間インキュベートした。その後、MTT溶液を捨て、100μlのDMSOを加えた。プレートをシェーカーにかけ、紫色の結晶ホルマザンの形成を可溶化した。吸光度は、マイクロプレートリーダーを用いて波長570nmと590nmで測定した。その結果を用いて、濃度に対する細胞生存率のグラフを作成した。
AGSへのSTAT-3阻害剤(BP-1-102)の投与と感染方法
ピロリ菌感染がSTAT3を介した経路で作用するかどうかを理解するために、STAT3選択的阻害剤BP-1-102(STAT3i)を用いた。BP-1-102は、504 nMの親和性(KD)でSTAT3と結合し、STAT3-ホスホ-チロシン(pTyr)ペプチド相互作用を阻害し、STAT3の活性化を阻害する。BP-1-102はSelleckchem, Huston, USAから購入した(カタログ番号S7769)。150mMのストックをDMSOで調製し、さらに使用するまで-80℃で保存した。BP-1-102を処理するために、MTTアッセイを通してAGS細胞におけるBP-1-102の細胞毒性効果をチェックした。処理濃度は0.78μMから50μMの間で、すべての実験で1.1μMのBP-1-102を使用した(図S7)。
AGS細胞を60mmプレート当たり0.5百万個の密度で播種した。細胞は、80-85%のコンフルエントに達した時点で、1.1μMのBP-1-102で2時間処理し、続いてH. pylori感染(MOI 100)を24時間行った。培養終了後、コンディショニング培地を回収し、これをSTAT3i処理HPCMとした(図1(b))。神経細胞(IMR-32)および神経細胞-星細胞共培養細胞(IMR-32+U-87 MG)を、cDMEMとSTAT3i処理HPCMを7:3の割合で24時間処理した(図11(c))。
RNA単離とqRT- PCR(定量的リアルタイムポリメラーゼ連鎖反応)
定量的リアルタイムポリメラーゼ連鎖反応(qRT-PCR)は、先に述べたように、AGS、IMR-32、およびIMR-32+U-87 MG共培養細胞における様々な遺伝子のトランスクリプトームプロファイルを解析するために行った[引用50]。簡単に説明すると、培養後の期間中にペレットを回収し、TRI 試薬(Sigma, life sciences, Sigma-Aldrich, St. H.pylori関連遺伝子の相対発現を測定した。pylori関連遺伝子(16s-rRNAおよびcag A)、サイトカイン(IL6、TNFα、IL-1β、IL16、IL8、IL16)、ケモカイン(CXCL1、CXCL3、CXCL5、CCL5)を含む炎症マーカー、ならびに制御転写因子(STAT1、 STAT2、およびSTAT3)は、特異的プライマー(表S2)とSYBR green(Applied Biosystems、米国ウォルサム)を用いたqRT-PCRにより、Agilent AriaMXシステム(Agilent Technologies、米国サンタクララ)で測定した。PCRアンプリコンの特異性を確認するために、融解曲線分析を行った。すべての反応は3連で行い、少なくとも3回繰り返した。ヒトグリセルアルデヒド3-リン酸デヒドロゲナーゼ(GAPDH)を参照遺伝子として用いた。逆転写酵素コントロール(-RT)は、ゲノムDNAの混入をモニターするためにすべての実験に用いた。
ウェスタンブロット
ウェスタンブロットは、以前の研究[Citation50]で述べたように行った。簡単に述べると、H. pyloriの感染またはHPCMによる24時間の処理後、細胞を回収し、PBSで洗浄し、プロテアーゼおよびホスファターゼ阻害剤を含む放射免疫沈降アッセイ(RIPA)バッファー(VWR, Radnor, USA)で溶解した。上清中のタンパク質は、Bradford protein assay reagents (Himedia, Mumbai, India)を用いて定量した。各群から等量のタンパク質をSDS-PAGEで分離し、0.45μmのニトロセルロース膜(Bio-Rad, Hercules, USA)に転写した。膜は4.5%BSAでブロックし、一次抗体とともに4℃で一晩インキュベートした。インキュベーションと洗浄後、膜を1:3000希釈の西洋ワサビペルオキシダーゼ標識抗ウサギ抗体と抗マウス抗体で1時間処理した。STAT3(#9139、1:1000、RRID: AB_331757)、pSTAT3(Tyr705)(#9145、1:1000、RRID: AB_2491009)、STAT1(#14994、1:1000、RRID: AB_2737027)、pSTAT1(Tyr703)(#9167、1:1000、RRID: AB_561284)、Cleaved Caspase-3(#9664、1:1000、RRID: AB_2070042)、NF-κB p65(#8242、1:1000、RRID: AB_10859369)、APOE4(#8941、1:1000、RRID: AB_2797681)、TNFα(#8184、1:1000、RRID: AB_2797640)およびGFAP(#12389、1:1000、RRID: AB_2631098)は、Cell Signaling Technology, Danvers, USAから購入した。GAPDH(#MA5-15738、1:1000、RRID: AB_10977387)、APP(#51-2700、1:1000、RRID: AB_87659)は、米国ウォルサムのInvitrogen社から購入した。化学発光検出はPierce ECL Western blotting substrate (Bio-Rad, Hercules, USA)を用いた。ブロットはゲルドキュメント・システム(Biorad ChemiDoc™ XRS+ System with Image Lab™ Software, Bio-Rad, Hercules, USA)で観察した。画像解析と定量は、Image J software (National Institutes of Health, USA)を用いて行った。
免疫蛍光アッセイ
免疫蛍光アッセイを、先に記載したように実施した[引用55]。LN229およびIMR-32細胞をカバースリップに播種し、HPCMで24時間処理した。GFAP (#12389, 1:200, RRID: AB_2631098)およびpSTAT3 (Tyr 705) (#9145, 1:250, RRID: AB_2491009)に対する一次抗体を使用し、続いてDAPI (1:500)および異なる蛍光色素を結合させた二次抗体 (1:1000希釈)で染色した。スライドを共焦点蛍光顕微鏡(FluoView 1000、オリンパス、東京、日本)で観察し、結果をImage Jソフトウェア(米国国立衛生研究所)を用いて解析した。蛍光強度を計算し、コントロールとの比較でプロットした。
細胞の活性酸素種(ROS)の推定
細胞の活性酸素は、標準プロトコールに従ってH2-DCFDA染色を用いて評価した[引用50]。簡単に説明すると、IMR-32 細胞と共培養細胞を 24 ウェルプレートに播種し、前述の感染戦略(セクション 2.4)に従って HPCM で処理した。培養後、細胞をPBSで洗浄し、1ウェルあたり10 μg/mLのH2-DCFDAを200μL、25分間添加した。その後、細胞をPBSで洗浄し、Cell Sensイメージングソフトウェアを搭載したオリンパスI×83蛍光顕微鏡で、対物レンズ倍率10倍で可視化した。蛍光強度で表される活性酸素の量は、ImageJソフトウェアを用いて定量した。処理細胞における蛍光強度の変化は、対照細胞に対する倍数変化として表した。
統計解析
実験結果は、各セットについて3連で実施した。p値はGraphPad Prism version 7を用いて推定し、0.05、0.01、0.001のp値は統計的に有意とみなし、それぞれアップレギュレーション/ダウンレギュレーションを示す*/#、/##、*/##で表した。
ハイライト
ピロリ菌感染は胃内環境の炎症を悪化させる。
ピロリ菌由来条件培地(HPCM)は、神経区画においてJAK/STAT経路を誘導し、STAT3制御分子を調節する。
STAT3は転写制御因子として、APPやAPOE4などのADマーカーを活性化する。
抗生物質感受性のピロリ菌は神経学的な病原性が高い。
STAT3の阻害は、HPCMによって誘発される神経炎症とADのような神経疾患のマーカーを軽減する。
著者貢献
構想: Hem Chandra Jha、Meenakshi Kandpal]、[Meenakshi Kandpal、Nidhi Varshney]、[形式的解析と調査]: [執筆-原案作成: 執筆-原案作成:[Meenakshi Kandpal]、執筆-校閲・編集:[Meenakshi Kandpal]: [ミーナクシ・カンドパル、ブッダデヴ・バラル、ニディ・ヴァーシュニー、アジェイ・クマール・ミーナ、ラジャン・クマール・パンディ、ヘム・チャンドラ・ジャー]、執筆-図表作成: [Meenakshi Kandpal]、ピロリ菌分離の臨床的支援:[Ajay Kumar Jain、Debi Chatterji]、資金獲得: [Hem Chandra Jha、Ajay Kumar Meena]、監修: [Hem Chandra Jha]。すべての著者が最終的な承認を与え、本研究のすべての側面について責任を負うことに同意した。
補足資料
補足資料clean.docx
ダウンロード MS Word (2.1 MB)
謝辞
インドール工科大学の施設と支援に感謝する。洞察に満ちた議論と助言をいただいた研究室の同僚に感謝する。インド医学研究評議会(Grant no. BMI/12(82)/2021およびECD/CSTPU/Adhoc/COVID-19/28/2021-22)およびCentral Council for Research in Ayurvedic Sciences (Grant no. 1263/2022-23)の資金援助に感謝する。また、Meenakshi Kandpal氏、Budhadev Baral氏、Nidhi Varshney氏に研究奨学金を授与したインド政府MHRD、University Grants Commission、DST-Inspireにも感謝する。また、DST-FISTの支援プロジェクト番号SR/FST/LS-I/2020/621により、さまざまな機器を提供していただいた。
情報開示
著者による潜在的な利益相反は報告されていない。
補足資料
本論文の補足データは、https://doi.org/10.1080/21505594.2024.2303853 からオンラインでアクセスできる。
追加情報
資金提供
本研究は、インド医学研究評議会(Indian Council of Medical Research)[助成金番号:BMI/12(82)/2021]、中央アーユルヴェーダ科学研究評議会(Central Council for Research in Ayurvedic Sciences)[助成金番号:1263/2022-23]、インド政府、MHRD、Prime Minister's Research Fellowship [PMRF ID: 2102229]の支援を受けている。
参考文献
Sonkar C, Verma T, Chatterji D, et al. 胃がん細胞におけるエプスタイン・バーウイルスとヘリコバクター・ピロリの同時感染におけるキナーゼの状態。BMC Cancer. 2020年;20(1):925. doi: 10.1186/s12885-020-07377-0
[PubMed] [Web of Science ®], [Google Scholar].
胃液から分離されたヘリコバクター・ピロリは生検分離株よりも病原性が高い。Genes Dis. 2023;S2352304223001162. doi: 10.1016/j.gendis.2023.03.003
[Web of Science ®], [Google Scholar].
Wroblewski LE, Peek RM, Wilson KT. Helicobacter pylori and gastric cancer: factors that modulate disease risk. 2010;23(4):713-21。
[PubMed] [Web of Science ®], [Google Scholar].
Baj J, Forma A, Sitarz M, et al. Helicobacter pylori virulence factors-mechanisms of bacterial pathogenicity in the gastric microenvironment. 細胞。2020;10(1):27. doi: 10.3390/cells10010027
[PubMed] [Web of Science ®], [Google Scholar].
ピロリ菌の病原性因子CagAとVacAの発現は宿主細胞との接触により毛皮依存的に誘導される。Helicobacter. 2014;19(1):17-25. doi: 10.1111/hel.12087.
[PubMed] [Web of Science ®], [Google Scholar].
Sijmons D, Guy AJ, Walduck AK, et al. Helicobacter pylori and the role of lipopolysaccharide variation in innate immune evasion. Front Immunol. ヘリコバクター・ピロリと自然免疫回避におけるリポ多糖の役割.
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリ治療法の開発:抗菌薬耐性をいかに管理するか?WJG. 2019;25(16):1907-1912. doi: 10.3748/wjg.v25.i16.1907.
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリにおける抗生物質耐性:潜在的生体分子メカニズムから臨床まで。Clinical Laboratory Analysis. 2023;37(7):e24885。
[PubMed] [Web of Science ®], [Google Scholar].
カメルーンにおける消化不良患者の胃生検から分離されたヘリコバクター・ピロリにおける広域スペクトル耐性、およびMDR分離株における排出を介した多重耐性検出。BMC Infect Dis. 2019;19(1):880. doi: 10.1186/s12879-019-4536-8
[PubMed] [Web of Science ®], [Google Scholar].
Patangia DV, Anthony Ryan C, Dempsey E, et al. 抗生物質のヒトマイクロバイオームへの影響と宿主の健康への影響。Microbiologyopen. 2022;11(1):e1260. doi: 10.1002/mbo3.1260
[PubMed]、[Web of Science ®]、[Google Scholar].
腸内細菌叢の組成に影響を与える因子とその調節。PeerJ. 2019;7:e7502. doi: 10.7717/peerj.7502.
[PubMed] [Web of Science ®], [Google Scholar].
Carding S, Verbeke K, Vipond DT, et al. Dysbiosis of the gut microbiota in disease. Microbial Ecology In Health & Disease [Internet]. 2015 [cited 2022 Oct 9];26. http://www.microbecolhealthdis.net/index.php/mehd/article/view/26191 から入手可能。
[Google Scholar].
Yang L, Zhang J, Xu J, et al. Helicobacter pylori infection aggravates dysbiosis of gut microbiome in children with gastritis. Front Cell Infect Microbiol. 2019;9:375. doi: 10.3389/fcimb.2019.00375.
[PubMed] [Web of Science ®], [Google Scholar].
Mitrea L, Nemeş S-A, Szabo K, et al. Guts imbalance imbalances the brain: a review of gut microbiota association with neurological and psychiatric disorders. Front Med. doi: 10.3389/fmed.2022.813204.
[Web of Science ®], [Google Scholar].
Huang W-S, Yang T-Y, Shen W-C, et al. ヘリコバクター・ピロリ感染と認知症の関連性。J Clin Neurosci. 2014;21(8):1355-1358. doi: 10.1016/j.jocn.2013.11.018.
[PubMed] [Web of Science ®], [Google Scholar].
Kountouras J, Tsolaki F, Tsolaki M, et al. H elicobacter pylori-related ApoE 4 polymorphism may be associated with dysphagic symptoms in older adults. Dis Esophagus. 2016;29(7):842-842。
[PubMed] [Web of Science ®], [Google Scholar].
Kandpal M, Indari O, Baral B, et al. 腸脳軸から見た腸内細菌叢のディスバイオシス:神経疾患の誘発における役割。Metabolites. 2022;12(11):1064.DOI:10.3390/メタボ12111064
[PubMed】【Web of Science ®】【Google Scholar
Uberti AF, Callai-Silva N, Grahl MVC, et al. Helicobacter pylori Urease: potential contributions to alzheimer's disease. IJMS. doi: 10.3390/ijms23063091.
[Google Scholar]
ヘリコバクター・ピロリ菌CagAタンパク質によるNF-κB活性化と炎症反応の増強。Proc Natl Acad Sci, USA. 2005;102(26):9300-9305。
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリ菌CagAはPAR1/MARKキナーゼを標的とし、上皮細胞の極性を破壊する。Nature. 2007;447(7142):330-333.
[PubMed] [Web of Science ®], [Google Scholar].
STAT3は構成的に活性化され、胃がん細胞におけるサバイビン発現と関連して細胞生存をサポートする。Oncogene. 2004;23(28):4921-4929. doi: 10.1038/sj.onc.1207606.
[PubMed] [Web of Science ®], [Google Scholar].
胃癌におけるJAK/STATシグナルカスケード(総説)。Int J Oncol. 2015;47(5):1617-1626. doi: 10.3892/ijo.2015.3160.
[PubMed] [Web of Science ®], [Google Scholar].
サイトカインシグナル伝達におけるJAKの制御と疾患におけるその破綻。Cytokine. 2019;118:48-63. doi: 10.1016/j.cyto.2018.03.041
[PubMed] [Web of Science ®], [Google Scholar].
Tヘルパー細胞の運命におけるJAK-STATシグナル伝達経路とその制御因子の役割。Cell Commun Signal. 2017;15(1):23. doi: 10.1186/s12964-017-0177-y
[PubMed] [Web of Science ®], [Google Scholar].
神経炎症におけるJAK/STATの役割と神経疾患との関連。Ann Neurosci. 神経炎症におけるJAK/STATの役割と神経疾患との関連.
[PubMed] [Web of Science ®], [Google Scholar].
Lashgari N-A, Roudsari NM, Momtaz S, et al. パーキンソン病治療におけるJAK/STATシグナル伝達経路の関与。J Neuroimmunol. (1)パーキンソン病治療におけるJAK/STATシグナル伝達経路の関与,(2)パーキンソン病治療におけるJAK/STATシグナル伝達経路の関与,(3)パーキンソン病治療におけるJAK/STATシグナル伝達経路の関与.
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリにおける抗菌薬耐性と病原性:ゲノムからの考察。Genomics. 2021;113(6):3951-3966。doi: 10.1016/j.ygeno.2021.10.002
[PubMed] [Web of Science ®], [Google Scholar].
Malfertheiner P, Camargo MC, El-Omar E, et al. Helicobacter pylori infection. Nat Rev Dis Primers. 2023;9(1):19. doi: 10.1038/s41572-023-00431-8
[PubMed] [Web of Science ®], [Google Scholar].
Baj A, Moro E, Bistoletti M, et al.微生物叢-腸-脳軸に沿ったグルタミン酸作動性シグナル伝達。IJMS. 2019;20(6):1482. doi: 10.3390/ijms20061482
[Google Scholar】。]
Rutsch A, Kantsjö JB, Ronchi F. The gut-brain axis: how microbiota and host inflammasome influence brain physiology and pathology. Front Immunol. 2020;11:604179。
[PubMed] [Web of Science ®], [Google Scholar].
アルツハイマー病患者における腸内細菌叢の変化。JAD. 2018;63(4):1337-1346. doi: 10.3233/JAD-180176.
Google Scholar] [Google Scholar] [Google Scholar] [Google Scholar] [Google Scholar] [Google Scholar
Gravina AG, Zagari RM, Musis CD, et al. Helicobacter pylori and extragastric diseases: a review. WJG. 2018;24(29):3204-3221. doi: 10.3748/wjg.v24.i29.3204
[PubMed] [Web of Science ®], [Google Scholar].
神経毒性化合物の急性細胞毒性を試験するための神経細胞とアストロサイトのヒト共培養モデル。Int J Toxicol. 2017;36(6):463-477。
[PubMed] [Web of Science ®], [Google Scholar].
神経炎症におけるニューロン、アストロサイト、ミクログリアの相互作用を研究するための初代神経細胞培養モデル。J Neuroinflammation. 2020年;17(1):155. doi: 10.1186/s12974-020-01819-z
[PubMed] [Web of Science ®], [Google Scholar].
Wang J, Yao Y, Zhang Q, et al. Helicobacter pyloriが胃上皮GES-1細胞の発癌に誘導する炎症反応。Int J Oncol [Internet]. 2019 [cited 2023 Aug 30]; Available from. doi: 10.3892/ijo.2019.4775
[Web of Science ®], [Google Scholar].
Piao J-Y, Kim S-J, Kim D-H, et al. Helicobacter pylori infection induces STAT3 phosphorylation on Ser727 and autophagy in human gastric epithelial cells and mouse stomach. ヘリコバクター・ピロリ感染胃上皮細胞およびマウス胃におけるSTAT3の727番セリン酸化およびオートファジーの誘導.
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリのヒト一次単球への感染は、その後のLPSに対する免疫応答を高める。Front Immunol. 2022;13:847958。
[PubMed] [Web of Science ®], [Google Scholar].
腸内細菌paenalcaligenes hominisの細胞外小胞は迷走神経介在性認知障害の危険因子である。Microbiome. 2020年;8(1):107. doi: 10.1186/s40168-020-00881-2
[PubMed] [Web of Science ®], [Google Scholar].
アルツハイマー病とヘリコバクター・ピロリ感染:胃から脳への炎症?JAD. 2020;73(2):801-809。
[Googleスカラー]
Regueira P, Silva AR, Cardoso AL, et al. 認知機能障害のある高齢患者とない高齢患者における急性細菌感染時の末梢炎症マーカー:症例対照研究。脳、行動、免疫-健康。2022;25:100503. doi: 10.1016/j.bbih.2022.100503
[PubMed], [Google Scholar].
炎症マーカーとアルツハイマー病のリスク:フラミンガム研究。Neurology. 2007;68(22):1902–1908. doi: 10.1212/01.wnl.0000263217.36439.da
[PubMed] [Web of Science ®], [Google Scholar].
アルツハイマー病と軽度認知障害における血中および髄液中ケモカイン:系統的レビューとメタ解析。Alz Res Therapy. 2023;15(1):107. doi: 10.1186/s13195-023-01254-1
[PubMed] [Web of Science ®], [Google Scholar].
ヘリコバクター・ピロリ外膜小胞は、核因子κBの活性化を通じてアストロサイトの反応を誘導し、マウスモデルにおいてin vivoで神経細胞障害を引き起こす。J Neuroinflammation. 2023;20(1):66. doi: 10.1186/s12974-023-02728-7
[PubMed] [Web of Science ®], [Google Scholar].
JAK-STAT1シグナル伝達経路はヘリコバクター・ピロリ感染に対する初期反応であり、免疫逃避と胃がん発生に寄与する。IJMS. doi: 10.3390/ijms23084147.
[Google Scholar]
STAT3 阻害は、全身性炎症によって誘発される神経炎症とAβ代謝を逆転させる:分子細胞生物学/神経炎症。Alzheimer's & Dementia [Internet]. 2020;16(S2). [cited 2023 Aug 30]. https://onlinelibrary.wiley.com/doi/10.1002/alz.041019
[Google Scholar]
STAT3 阻害は、全身性炎症によって誘発される神経炎症とBACE1アップレギュレーションから保護する。Immunol Lett.
[PubMed] [Web of Science ®], [Google Scholar].
Pertovaara M, Silvennoinen O, Isomäki P. Cytokine-induced STAT1 activation is increased in patients with primary Sjögren's syndrome. Clin Immunol. 2016;165:60-67. doi: 10.1016/j.clim.2016.03.010.
[PubMed] [Web of Science ®], [Google Scholar].
Hu X, Li J, Fu M, et al. JAK/STATシグナル伝達経路:ベンチから臨床へ。Sig Transduct Target Ther. 2021;6(1):402. doi: 10.1038/s41392-021-00791-1
[PubMed] [Web of Science ®], [Google Scholar].
Wang X-L, Zeng J, Feng J, et al. Helicobacter pylori filtrate impairs spatial learning and memory in rats and increases Î2-amyloid by enhancing expression of presenilin-2. Front Aging Neurosci [Internet]. 2014;6 [cited 2023 Aug 30]. Available from: http://journal.frontiersin.org/article/10.3389/fnagi.2014.00066/abstract
[Web of Science ®], [Google Scholar].
Kashyap D, Varshney N, Baral B, et al. Helicobacter pylori感染胃上皮細胞は、癌蛋白質Gankyrinを介して細胞死経路を迂回する。Adv Cancer Biol Metastasis. doi: 10.1016/j.adcanc.2023.100087.
[Google Scholar]
病原性と抗生物質耐性の複雑な関係。Genes. 2017;8(1):39. doi: 10.3390/genes8010039
[PubMed] [Web of Science ®], [Google Scholar].
Beceiro A, Tomás M, Bou G. Antimicrobial resistance and virulence: a successful or deleterious association in the bacterial world? Clin Microbiol Rev. 2013;26(2):185-230.
[PubMed] [Web of Science ®], [Google Scholar].
神経健康および疾患におけるニューロン-アストロサイトの全方向性シグナル伝達。Front Mol Neurosci. 2023;16:1169320. doi: 10.3389/fnmol.2023.1169320.
[PubMed] [Web of Science ®], [Google Scholar].
脊髄アストロサイトにおけるケモカイン発現の転写制御を介して、Stat3阻害が機械的アロディニアを減弱させる。PloS One. 2013;8(10):e75804. doi: 10.1371/journal.pone.0075804.
[PubMed】【Web of Science ®】【Google Scholar
Kashyap D, Baral B, Jakhmola S, et al. Helicobacter pylori and Epstein-Barr virus coinfection stimulates aggressiveness in gastric cancer through the regulation of gankyrin. 2021;6:e00751-21.
[PubMed] [Web of Science ®], [Google Scholar].
PDFダウンロード
関連研究
こんな記事も読まれています
おすすめ記事
引用元
情報提供者
著者
研究開発関係者
編集者
図書館員
学会
オープンアクセス
概要
オープンジャーナル
オープンセレクト
Dove Medical Press
F1000Research
機会
別刷りとe-prints
広告ソリューション
早期出版
企業アクセスソリューション
ヘルプと情報
ヘルプ&コンタクト
ニュースルーム
すべてのジャーナル
書籍
最新情報
ご登録いただくと、個別のリサーチやリソースをEメールでお届けします。
登録する
テイラー・アンド・フランシス・グループのFacebookページテイラー・アンド・フランシス・グループXのTwitterページテイラー・アンド・フランシス・グループのLinkedinページ
テイラー・アンド・フランシス・グループYoutubeページテイラー・アンド・フランシス・グループWeiboページ
著作権 © 2024 インフォマUKリミテッド
プライバシーポリシー
クッキー
利用規約
アクセシビリティ
イングランド&ウェールズ登録第3099067号
5 ハウィック・プレイス|ロンドン|SW1P 1WG
テイラー・アンド・フランシス・グループ
×
この記事が気に入ったらサポートをしてみませんか?
