腸内細菌叢の種間相互作用がClostridioides difficileの臨床関連抗生物質に対する反応を形成する
研究論文
腸内細菌叢の種間相互作用がClostridioides difficileの臨床関連抗生物質に対する反応を形成する
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002100






スーザン・ヒロマダ、オフィーリア・S・ヴェンチュレリ
要旨
ヒトの腸内では、病原体Clostridioides difficileの増殖は、ヒトの腸内細菌叢のメンバーとの複雑な種間相互作用の網によって影響される。我々は、ヒト腸内細菌群集のボトムアップアセンブリを用いて、臨床的に重要な抗生物質に対するC. difficileの抗生物質反応に対する種間相互作用の寄与を調査した。その結果、C. difficileの抗生物質感受性を変化させる微生物間相互作用には、高濃度の抗生物質でC. difficileの増殖能力を高める相互作用(稀)と低濃度の抗生物質でC. difficileの増殖を促進する相互作用(一般)の2種類があることがわかりました。ゲノムワイド転写プロファイリングデータに基づき、腸内常在菌であるDesulfovibrio pigerによる硫化水素生成による金属隔離が、C. difficileに対するメトロニダゾールの最小阻害濃度(MIC)を上昇させることを実証した。C.difficileよりも高い抗生物質感受性を示す種との競合により、低抗生物質濃度でのC.difficileの増殖が促進され、競合的な放出が生じる。動的計算モデルにより、この効果をもたらす生態学的原理が明らかにされた。この結果は、抗生物質に対するC. difficileの反応を形成する生態学的および分子生物学的原理をより深く理解するものであり、治療介入に役立つと考えられる。
引用者注 Hromada S, Venturelli OS (2023) Gut microbiota interspecies interactions shape the response of Clostridioides difficile to clinically relevant antibiotics. PLoS Biol 21(5): e3002100. doi:10.1371/journal.pbio.3002100.
アカデミックエディター サム・ポール・ブラウン、ジョージア工科大学、米国
Received(受理)された: 2022年9月7日; 受け入れられました: 2023年3月30日; 公開された: 2023年5月11日発行
著作権:©2023 Hromada, Venturelli. 本論文は、原著者および出典をクレジットすることを条件に、あらゆる媒体での無制限の使用、配布、および複製を許可するCreative Commons Attribution Licenseの条件の下で配布されるオープンアクセス論文である。
データの利用可能性 本研究で使用したデータセットとコンピュータコードは、以下のデータベースで利用可能である: - 種数データ、CFUデータ、硫化水素データ、qRT-PCRデータはZenodo: https://doi.org/10.5281/zenodo.7626486 - RNA-seqデータはZenodo: https://doi.org/10.5281/zenodo.7049035 and https://doi.org/10.5281/zenodo.7049027 - モデリングコンピュータースクリプトはZenodo: https://doi.org/10.5281/zenodo.7726490 から入手可能です。
資金提供 研究は、National Institutes of Healthの支援を受け、助成金番号R35GM124774およびR21AI159980の下で達成された。S.H.は、米国国立衛生研究所のNational Institute of General Medical Sciencesから、賞番号T32GM008349で一部支援を受けています。資金提供者は、研究デザイン、データ収集と分析、発表の決定、原稿の作成に関与していない。
競合する利益 著者らは、競合する利益は存在しないことを宣言している。
略語 CFU、コロニー形成単位、DEG、差次発現遺伝子、GSEA、遺伝子セット濃縮解析、KEGG、京都遺伝子百科事典、MIC、最小阻害濃度、PFOR、ピルビン酸フェレドキシン/フラボドキシン酸化還元酵素、PMF、プロトン運動量、RPKM、キロベース百万あたりのリード数、subMIC、サブミニマム阻害濃度
はじめに
クロストリジオイデスディフィシル(Clostridioides difficile)という細菌は、ヒトの消化管に感染し、その環境は濃密な微生物相で溢れている。腸内細菌叢は、C. difficileの増殖やヒトの腸内に長期間留まる能力を抑制することができ、これはコロニー形成抵抗性と呼ばれる現象である[1]。コロニー形成抵抗性の重要な役割は、微生物叢を減少させる抗生物質による治療後のC. difficile感染リスクの増加 [2]や、健康なヒトドナーからの糞便微生物叢移植がC. difficile感染症の再発をなくす効果を示すことからも明らかです [3] 。これまでの研究により、腸内細菌叢とC. difficileの相互作用について、より深い理解が得られています。例えば、個々の腸内細菌とC. difficileの種間相互作用がin vitroで研究され、ヒトマイクロバイオームデータの解析により、その存在または不在がC. difficile感染症の転帰の変化に関連する腸内細菌が特定されています[4-6]。二次胆汁酸の産生を介したClostridium scindensによるC. difficileの発芽阻害 [6] や、コハク酸の相互摂取を介したBacteroides thetaiotaomicronによるC. difficile増殖促進 [7] など、複数の相互作用メカニズムが明らかにされています。微生物相がC. difficileの増殖にどのように影響するかについては多くのことが知られていますが、微生物相がC. difficileの抗生物質感受性にどのように影響するかはほとんど知られていません。
他の病原体と同様に、C. difficileの抗生物質感受性は、モノカルチャー増殖のin vitro実験を使って研究されてきました。しかし、単培養実験では、居住するコミュニティメンバーとの相互作用が、病原体の抗生物質感受性をどのように変化させるかを考慮していません。例えば、病原体である緑膿菌の単種抗生物質感受性は、多菌感染症に対する治療効果と必ずしも相関していませんでした[8]。微生物の相互作用によって病原体の抗生物質感受性が大幅に低下する場合、抗生物質に対する単一培養の感受性に基づく治療は、病原体を根絶するのに有効でない可能性があります。また、微生物の相互作用によって病原体の抗生物質感受性が高まった場合、標準的な抗生物質の投与量が病原体の根絶に必要な量を超えてしまい、本来の微生物相に不必要かつ回避可能な混乱が生じる可能性があります。微生物叢の構成メンバーがどのように抗生物質に対する病原体の感受性を変化させるかを理解することは、病原体を根絶するための治療法の設計の指針として利用できるかもしれません。
これまでの研究で、種間相互作用は、単培養に比べて感受性を増減させることで、抗生物質に対するある微生物の反応を変化させることが示されています[9]。その一例が暴露防御で、感受性が高い微生物は、抗生物質を分解する種によって抗生物質から保護されます[10]。さらに、以前の研究では、耐性微生物の増殖が抗生物質に感受性のある他の生物との交配食に依存する場合、抗生物質感受性の増加が起こることが示されました[11]。
これまでの研究で、抗生物質の感受性に影響を与える特定のタイプの種間相互作用が特定されていますが、異なる微生物群集における感受性を変化させる微生物間相互作用の有病率はよく理解されていません。ヒトの尿路感染症コミュニティでは、使用済み培地実験に基づき、種間の相互作用の約3分の1が2種類の抗生物質に対する感受性の変化をもたらすと推定された[12]。ミバエのマイクロバイオーム、多種の創傷感染バイオフィルム、多種の醸造所バイオフィルムの研究では、それぞれ単種と比較して、コミュニティ内の特定の種の抗生物質感受性が変化することが確認されました[13-15]。一方、ヒトの腸内細菌群集やブタのマイクロバイオームに導入された大腸菌の病原体では、15種の特徴的な種について抗生物質感受性に有意な変化は観察されませんでした[16,17]。異なるシステム間で抗生物質感受性に対する種間相互作用の寄与にこのようなばらつきが観察されたことに基づいて、微生物の相互作用がC. difficileの抗生物質感受性に影響を与えるかどうかはわかっていません。
私たちは、C. difficileの抗生物質感受性に及ぼす微生物間相互作用の影響を調べるために、多様なヒト腸内コミュニティを使用しました[4]。我々は、C. difficile感染症の治療に用いられる2種類の抗生物質、バンコマイシンとメトロニダゾールに焦点を当てました。Vancomycinは、細胞壁の合成を阻害する糖ペプチドで、その活性はグラム陽性菌に特異的である[18]。メトロニダゾールは、グラム陽性およびグラム陰性の嫌気性細菌に有効なDNA損傷剤である。メトロニダゾールはプロドラッグであり、嫌気性菌の細胞質内でニトロ基がニトロソラジカルに還元されるまで不活性である[19]。メトロニダゾールの還元機構は、還元酵素、ヒドロゲナーゼ、ピルビン酸フェレドキシン/フラボドキシン酸化還元酵素(PFOR)などの複数の酵素が触媒となり、補酵素のフェレドキシンやフラボドキシンによるものと考えられています[20〜22]。以前は第一選択薬として推奨されていたメトロニダゾールは、その臨床効果の低下が観察されたため、現在では稀なケースでのみ推奨されています[23,24]。
我々は、ボトムアップアプローチにより、ヒトの腸内細菌がこれらの抗生物質に対するC. difficileの反応にどのような影響を及ぼすかについて、詳細かつ定量的な特徴を明らかにした。その結果、腸内細菌がC. difficileの最小発育阻止濃度(MIC)を変化させることはほとんどないが、腸内細菌がC. difficileの発育阻止濃度以下の抗生物質に対する反応に頻繁に影響を与えることがわかった。C.difficileと競合する抗生物質感受性種が存在する群集では、低濃度の抗生物質の存在下でC.difficileの増殖が競合解除により促進されることが確認された。抗生物質を表現した動的生態系モデルは、これらの傾向を再現している。さらに、Desulfovibrio pigerがC. difficileのメトロニダゾールに対するMICを大幅に上昇させることを明らかにした。転写プロファイリングと培地摂動を用いて、C. difficileのMIC上昇を決定するメカニズムを検討した。その結果、D. pigerが環境に与える影響により、C. difficileに金属飢餓の転写反応が引き起こされ、メトロニダゾールを活性型に還元するのに必要な酵素の発現が低下することが示唆された。以上のことから、生物間相互作用は、C. difficileの抗生物質感受性を、亜抑制濃度および最小抑制濃度領域において、それぞれ異なるメカニズムで形成していることが明らかとなった。これらの結果は、病原体を根絶するための将来の治療法の設計において、生物学的相互作用を考慮する必要性を強調するものである。
結果
C. difficileのメトロニダゾールまたはバンコマイシンに対する最小発育阻止濃度は、腸内細菌のペアワイズコミュニティのサブセットによって変化する。
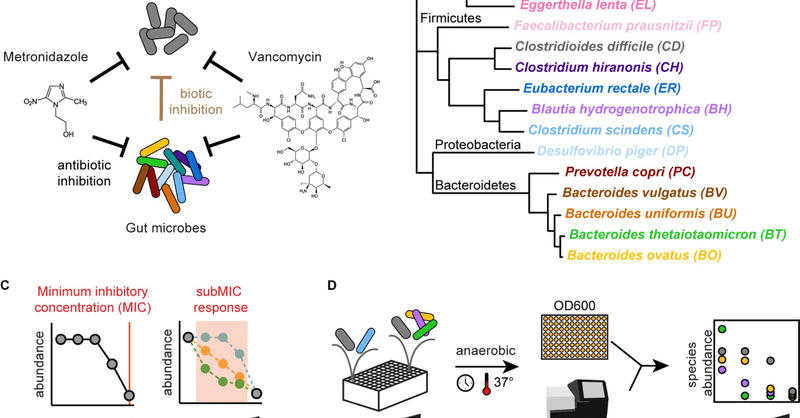
C. difficile感染症は、複雑な腸内常在コミュニティを背景に発生する。しかし、C. difficile感染を除去するための抗生物質治療は、C. difficileの単培養での感受性に基づいて設計されており、抗生物質感受性の形成における種間相互作用の役割が無視されています。腸内細菌叢がC. difficileの抗生物質感受性をどのように変化させるかを理解することは、抗生物質によるC. difficileの治療に役立つと考えられます。この疑問を解決するため、我々は腸内細菌の合成群集の存在下でC. difficileの抗生物質に対する反応を評価した(図1A)。13名のヒト腸内コミュニティは、ヒト腸内細菌の系統的多様性にまたがるように設計された。これらの腸内細菌とC. difficileの相互作用は、抗生物質の非存在下で解読されています[4](図1B)。我々は、C. difficile感染症の治療における臨床的関連性と、その活性スペクトルの違いから、抗生物質のメトロニダゾールとバンコマイシンを選択しました。メトロニダゾールは13種類の腸内細菌に対して幅広いスペクトラム活性を持つのに対し、バンコマイシンの活性はグラム陽性種に特異的である。ヒトの腸内で抗生物質の濃度が低くても高くても、C. difficileがどのように反応するかを明らかにするため、さまざまな生態学的背景を考慮して、C. difficileのMICと阻害濃度以下の存在下での増殖を特徴付けました(図1C)。
拡大する
図1. ヒトの腸内コミュニティにおけるC. difficileの臨床的に重要な抗生物質反応に対する種間相互作用の影響を調査する。
(A)抗生物質メトロニダゾールまたはバンコマイシンの存在下、合成腸内コミュニティにおけるC. difficileの増殖に影響を与える要因の模式図。DNA損傷抗生物質メトロニダゾールと細胞壁阻害剤バンコマイシンは、C. difficileと腸内細菌を阻害することができる(黒矢印)。腸内細菌による生物学的阻害(茶色の矢印)はC. difficileを阻害する。(B)14名のヒト腸内コミュニティーの系統樹。腸内細菌叢の4つの主要な門と病原体C. difficileにまたがっている。黒字は門名。色付きのテキストは種名を示す。37個のマーカー遺伝子の連結アライメントに基づく系統樹[25]。(C)抗生物質に対する微生物集団の反応の2つの側面、すなわちMIC反応とサブMIC反応の模式図。(D) 多種の微生物群集の抗生物質感受性を決定する方法の概略図。マイクロタイタープレートで嫌気的に培養する。絶対量は、光学密度(OD600)に16S rRNA遺伝子配列決定に基づく相対量を乗じることによって決定される。MICは最小発育阻止濃度、subMICはサブ最小発育阻止濃度。
doi:10.1371/journal.pbio.3002100.g001
詳細 "
コミュニティにおけるC. difficileの抗生物質感受性を調べるために、Clinical and Laboratory Standards Institute [26]が詳述する臨床法に基づくブロス希釈法を用いた(Methods)。抗生物質の2倍希釈シリーズを含む液体培養液にコミュニティを接種した。培養後、600nmの光学密度(OD600)に16S rRNA遺伝子配列決定による相対存在量を乗じることで、一定時間(48時間)の群集における各種の絶対量を決定した(図1D)。コミュニティ内の各生物種のMICは、48時間後の増殖が閾値を下回る最低の抗生物質濃度として決定した(Methods)。
この方法を用いて、単培養(図2A)およびC. difficileを含む各ペアワイズコミュニティ(図2Bおよび2C)における各菌種のMICを決定しました。抗生物質のメカニズムに一致して、すべての種が試験した抗生物質の範囲でメトロニダゾールに感受性を示したが、グラム陰性種(BacteroidetesおよびProteobacteria phyla、図1D)はバンコマイシンに感受性がなかった(図2AおよびS1AおよびS1B)。
拡大する
図2. メトロニダゾールまたはバンコマイシンに対するC. difficileの応答は、特定のペアワイズコミュニティで修正される。
(A) メトロニダゾール(MTZ)またはバンコマイシン(VAN)存在下での単培養のMICのヒートマップ。種は2文字の種コードで示した(図1B)。(B, C) 単培養のC. difficileまたはペアワイズコミュニティのC. difficileについて、48時間後の種の絶対量を抗生物質濃度の関数として線プロットした。各x軸は半対数スケールである。y軸の値は、計算されたOD600(OD600に16S rRNA遺伝子配列決定からの相対存在量を乗じたもの)である。データポイントは、個々の生物学的複製を示す。線は、n = 1からn = 8の生物学的反復の平均を示す。灰色の縦線と太字の数字は、各条件におけるC. difficileのMICを示す。色は種を示す(図1B)。この図のすべてのパネルの基礎となるデータは、DOI: 10.5281/zenodo.7626486 に掲載されています。MIC、最小発育阻止濃度。
doi:10.1371/journal.pbio.3002100.g002
もっと見る "
ほとんどのペアワイズコミュニティにおいて、C. difficileのメトロニダゾールとバンコマイシンのMICは、単培養と比較して変化していなかった。メトロニダゾールとバンコマイシンの条件を超えて、C. difficileのMICは15対のコミュニティで不変であり、5対のコミュニティで単一種と比較して中程度の差(2倍)を示した(図2Bおよび2C)。しかし、C. difficileはD. pigerとの共培養でMICが大きく変化(4倍以上)した(メトロニダゾールMICは6μg/mLから24μg/mL以上に増加)(Fig 2B)。残りの4つのペアワイズコミュニティでは、すべての濃度でC. difficileの増殖が強く抑制され、MICは算出できなかった(Fig 2C、「NG」と表示)。つまり、C. difficileのMICは、ヒトの腸内コミュニティにおける一対の種間相互作用によって影響を受けることはほとんどないことがわかった。
選択したペアワイズコミュニティについて、OD600ベースの絶対量法を検証するために、OD600に16S rRNA遺伝子配列の相対量を乗じたものと、C. difficile選択寒天プレート上のコロニー形成単位(CFU)のカウントの両方を用いてC. difficile存在量を定量した(S2A Fig)。その結果、12条件中11条件において、CFUカウントとOD600ベースの絶対量法から同じMIC値が得られた(S2BおよびS2C Fig)。1つの条件では、すべての濃度でC. difficileの増殖がMICの閾値以下で強く阻害された。そのため、CFU法ではMICを明らかにすることができたが、OD600に基づく方法ではMICを決定することができなかった。全体として、これらの傾向は、2つの方法は感度に差があるものの、OD600ベースの絶対量法はC. difficileのMICを測定する信頼できる方法であることを示しています。
低抗生物質濃度の存在下でのC. difficileのペアワイズコミュニティにおける存在量の増加
病原体は、抗生物質治療中にMICよりも低い濃度の抗生物質に遭遇することがあります。病原体が抗生物質に対する耐性を獲得している場合、全投与量レジメンが抑制未満になる可能性があります。あるいは、目標投与量がMICより多くても、投与レジメンの開始時や終了時、1日の投与量の間にサブミニマム抑制濃度(subMIC)が発生することもある[27]。そこで、抑制下抗生物質濃度(C. difficileのMICまたはsubMICより低い濃度)に対するC. difficileの反応に対する微生物間相互作用の役割を調査しました。
多くのペアワイズコミュニティにおいて、C. difficileの存在量は、サブMICの範囲では抗生物質の非存在下と同等か減少していました(図2Bおよび2C)。しかし、一部のペアワイズコミュニティでは、サブMIC範囲におけるC. difficileの存在量は、抗生物質がない場合に比べて増加した(図2Bと2C)。例えば、C. difficileの単一種の存在量は、0.75μg/mLメトロニダゾールの存在下と抗生物質の非存在下で同等であった。しかし、B. thetaiotaomicronの存在下では、C. difficileの存在量は、0.75μg/mLメトロニダゾールの存在下で抗生物質の非存在下に比べて有意に高かった(図2B)。さらなる洞察を得るために、各サブMICにおけるサブMICフォールドチェンジを計算した。これは、与えられたサブMICにおける種の絶対量を抗生物質非存在下における種の絶対量で割ったものとして定義した(図3A)。この指標を用いると、C. difficileの増殖は、バンコマイシン存在下の1つのペアワイズコミュニティとメトロニダゾール存在下の11のペアワイズコミュニティにおいて、少なくとも1つのサブMICで増強された(図3BおよびS3AおよびS3B)。7つのペアワイズコミュニティにおいて、メトロニダゾール存在下でのC. difficileの増殖促進は、メトロニダゾール存在下でのC. difficile単細胞培養で観察された促進よりも有意に大きかった(図3B)。つまり、約半数の種が低濃度のメトロニダゾールに対するC. difficileの反応を変化させることが示された。
拡大する
図3. C. difficileの増殖は、MICより低い濃度の抗生物質が存在する場合、抗生物質感受性の高い生物学的阻害因子を持つコミュニティで促進される。
(A) 例題データを用いたsubMIC fold change metricの模式図。X軸は半ログスケール。表は、この例における3つのサブMIC(2、4、8μg/mL)についてのサブMICフォールドチェンジを示す。最大subMICフォールドチェンジ(**で示す)は、すべてのsubMICにわたる最大のフォールドチェンジと定義される。(B)48時間後の各濃度におけるペアワイズコミュニティにおけるC. difficileのsubMIC fold changeのヒートマップ。陰影はsubMIC fold changeを示す。サブMIC倍率変化は、サブMICにおける平均C. difficile絶対量を抗生物質非存在下における平均C. difficile絶対量で割ったものとして計算され、平均はn = 1からn = 8生物学的複製物である。アスタリスクは、対にならないt検定による、subMICでのC. difficile OD600と抗生物質非存在下でのC. difficile OD600の間の有意差(*P < 0.05, **P < 0.01, ***P < 0.001) を示しています。黒い星は、最大subMIC倍率がC. difficile monospeciesの最大subMIC倍率よりも有意に大きいペアを示す(p < 0.05 based on an unpaired t test)。(C)抗生物質感受性および耐性インヒビターの存在下でのC. difficileの増殖の模式図。(D) メトロニダゾール(MTZ、丸)およびバンコマイシン(VAN、三角)に対する、一対のコミュニティにおけるC. difficileの生物学的阻害の度合いの関数としての一対のコミュニティにおける最大C. difficile subMIC fold changeの散布図である。C. difficileの生物学的阻害度(x軸)は、抗生物質無添加の条件下で、単系統の平均C. difficile OD600から一対のコミュニティにおける平均C. difficile OD600を引いたものとして定義した。最大C. difficile subMIC fold change(y軸)は、48時間におけるすべてのsubMICにわたるC. difficile subMIC fold changeの最大値である。 subMIC fold changeは、パネルBと同様に、n=1〜n=8の生物学的複製で計算する。種は、種単独MICがC. difficileの単独MICより小さければ感受性、種単独MICがC. difficileの単独MIC以上であれば耐性として分類される。各ポイントはメトロニダゾールまたはバンコマイシンの1対の共同体を表す。スピアマン相関は、すべてのデータポイント(黒)および感受性の高い腸内細菌のみを含むペアワイズコミュニティ(緑)について注釈されている。(E) 48時間後のメトロニダゾールとバンコマイシンの各濃度における、多種のコミュニティにおけるC. difficileのsubMIC fold changeのヒートマップ。陰影はsubMIC fold changeを示している。サブMICフォールドチェンジは、パネルBと同様に、n = 1からn = 4の生物学的複製で計算される。アスタリスクは、対にならないt検定による、サブMICでのC. difficile OD600と抗生物質非存在下でのC. difficile OD600の間の有意差(*P < 0.05, **P < 0.01, **P < 0.001) を示しています。ユークリッド距離による階層的クラスタリングを用いて、subMICのフォールドチェンジによってクラスタ化されたコミュニティ。「Full」は14人のコミュニティ、「Full-DP」はDP以外のすべての種を含む13人のコミュニティを示す。(F)メトロニダゾール(円)およびバンコマイシン(三角)に対する、多種のコミュニティにおけるC. difficileの生物学的阻害の度合いの関数としての、多種のコミュニティにおける最大C. difficile subMIC fold changeの散布図である。C. difficileの生物学的阻害度(x軸)はパネルDと同様に計算し、最大C. difficile subMIC fold change(y軸)はパネルBと同様に、n=1〜n=4の生物学的複製で計算した。C.difficileを除くすべての種が感受性阻害剤である場合、コミュニティタイプは感受性(「Sens.」)である。C.difficileを除くすべての種が中級阻害剤または耐性阻害剤である場合、コミュニティタイプは耐性または中間(「Resis.またはIntermed.」)とする。コミュニティタイプは、あるコミュニティが感受性の阻害剤と耐性または中間の阻害剤の両方を含む場合、「混合」とみなされる。生物学的阻害物質として分類されるのは、この種が存在する場合のC. difficileの絶対量が、抗生物質が存在しない場合のC. difficileの絶対量(単一種)よりも有意に低い場合であり、これは対のないt検定によって決定される。C.aerofaciensは中間種に分類された(本文参照)。各ポイントは、メトロニダゾールまたはバンコマイシンの存在下での1コミュニティを表す。スピアマン相関は、すべてのデータポイント(黒)および感受性コミュニティのみ(緑)について注釈されている。この図のパネルBDEFの基礎となるデータは、DOI: 10.5281/zenodo.7626486 に掲載されています。MICは最小発育阻止濃度、subMICは亜最小発育阻止濃度。
doi:10.1371/journal.pbio.3002100.g003
詳細 "
単培養において、C. difficileの増殖は単一のsubMIC(1.5μg/mLメトロニダゾール、subMIC fold change of 1.6, S3A Fig)存在下で中程度に促進された。C. difficile単培養体の時系列OD600測定により、この中程度の増殖促進は、測定時点(48時間)における抗生物質存在時と非存在時の増殖相の違いによることが判明した(S3CおよびS3D Fig)。一方、C. difficileの増殖は、2対のコミュニティにおいて、複数の時点において無処理と比較してsubMICの存在下で増強されましたが、これは増殖期の違いによるものではありませんでした(S3EとS3F Fig)。このように、単培養の成長段階の違いにより、1つのsubMICに反応してC. difficileの成長が適度に促進される一方で、2対のコミュニティで観察されたより大きく持続的な成長促進は、別のメカニズムで決定された。
我々は、ある一対のコミュニティにおける抗生物質の作用がC. difficileの生物学的阻害を緩和し、その結果、C. difficileの成長が促進され、競争的放出が起こるという仮説を立てた [28,29] 。この競争的放出は、C. difficileよりも抗生物質に対する感受性が高い競合物質(すなわち、生物学的阻害物質)が存在する二者間コミュニティで起こるであろう。一方、C. difficileよりも抗生物質に対する耐性が高い生物阻害物質が存在する場合、生物阻害の程度はsubMICsで変化しないため、C. difficileの成長は抗生物質がない場合の成長と比較して大きく変化しない(図3C)。この仮説を裏付けるように、C. difficileの最大サブMIC倍率は、共培養パートナー存在下での生物阻害の程度と強い正の相関を示した(図3D)。さらに、この相関は、抗生物質に感受性のある腸内細菌を含むペアワイズコミュニティで高まった(図3D)。個々の抗生物質の両方が存在する場合、C. difficileの最大サブMICフォールド変化は、C. difficileよりも抗生物質に対する感度が高い生物阻害剤とペアリングした場合に有意に高くなった(S3G Fig)。以上のことから、抗生物質に感受性の高い生物学的阻害物質がsubMICに反応してC. difficileの増殖を促進した。このことから、患者が抗生物質感受性の生物学的阻害物質を保有している場合、SubMIC体制においてC. difficileの腸管内での増殖が促進される可能性があることが示唆された。
我々は、OD600ベースの絶対量法を用いて測定したC. difficileのsubMICでの増殖促進が、細胞形態の変化などの他の要因ではなく、C. difficileの存在量の増加によるものかどうかを調査した。この目的のために、CFU計数を用いて特徴づけられた選択的なペアワイズコミュニティにおけるC. difficileのサブMIC倍率変化を測定した(S2BおよびS2C Fig)。その結果、C. difficile-B. thetaiotaomicronとC. difficile-D. pigerのペアにおいて、メトロニダゾール存在下でCFU法とOD600ベースの絶対量法が有意なサブMICフォールドチェンジを同定した(S2D Fig)。また、メトロニダゾールまたはバンコマイシンの存在下で、他の10組のペアワイズコミュニティにおいて、有意なサブMICフォールド変化を検出しなかった点でも、両手法は一致した(S2D Fig)。しかし,CFU法は,OD600ベース法が有意なフォールド変化を検出した3つのペアワイズコミュニティ(C. difficile-C. hiranonis vancomycin and metronidazole condition,C. difficile-C. scindens metronidazole condition,S2D図)において,サブMICの有意変化を検出しなかった.これらの不一致は、スポット希釈CFU法(Methods)では小さな倍数変化を区別できない(技術的複製の平均変動は2倍)ため、2つの方法の感受性の違いに起因すると思われる。
感度の低いCFU法を用いてサブMICのフォールドチェンジを識別できるかどうかを調べるため、試験したサブインヒビター濃度の分解能を向上させた。分解能を上げることで、CFU法で検出可能なほど大きなフォールドチェンジを持つサブMICを捕らえることができるかもしれない。さらに、分解能を上げることで、有意なフォールドチェンジを示す複数のsubMICが得られ、結果の信頼性が高まる可能性がある。我々は、抗生物質濃度の分解能がより高いCFU法を用いて、メトロニダゾール存在下でのC. difficile-B. vulgatusペアワイズコミュニティの増殖促進を測定した(図3B)。このコミュニティでは、OD600ベースの方法でC. difficile増殖促進が顕著に見られた。その結果、ペアワイズ・コミュニティでは複数の濃度で有意なC. difficile subMIC fold changeを示したが、C. difficileモノカルチャーでは有意なfold changeは観察されなかった(S4 Fig)。このことは、OD600ベースの方法(図3B)を用いて観察されたC. difficileの増殖促進が、CFUカウントと一致していることを示しています。全体として、我々の結果は、C. difficile subMICの増殖促進は、CFUベースの絶対量法でも検出できることを実証しています。
低抗生物質濃度存在下での多種のコミュニティにおけるC. difficileの存在量の増強
我々は、ヒトの腸内細菌叢をより代表する多種類のコミュニティにおいて、2つのコミュニティで観察されたOD600ベースの絶対存在量の傾向が持続するかどうかを調査した。コミュニティは、以前に開発した本システムの動的計算モデル[4]により、C. difficileの生物学的阻害が最小限であると予測された2メンバーおよび3メンバーのコアコミュニティ(CC)で構成された(CC-2:D. pigerおよびFaecalibacterium prausnitzii. CC-3:D.piger、F.prausnitzii、Eggerthella lenta)です。このコアコミュニティに加えて、この2つのグループに少なくとも1種の抗生物質感受性阻害剤、抗生物質耐性阻害剤、またはその組み合わせを導入し、メトロニダゾールで10コミュニティ、バンコマイシンで12コミュニティ(3~6人)を作成しました。抗生物質の擾乱に対するコミュニティの挙動をさらに調べるため、一貫したコアメンバーを持たない3、4、5、13、または14メンバーのコミュニティ(合計19)のメトロニダゾールに対する応答を特徴付けた。
メトロニダゾール存在下で特徴づけられた29のコミュニティのうち6つで、C. difficileのMICは単細胞培養の場合よりも4倍大きく、6μg/mLから24μg/mLまで増加しました。残りのコミュニティは、中程度(2倍、14コミュニティ)または変化なし(9コミュニティ)を示した(S5A Fig, S1 Table)。バンコマイシン存在下で調べた12コミュニティ中4コミュニティでは、C. difficileの増殖はすべての濃度で強く阻害され、MICは算出できなかった(S5B Fig, S2 Table, indicated as "NG" )。残りの8つのコミュニティは、MICの中程度の増加(2倍、2コミュニティ)または変化なし(6コミュニティ)のいずれかを示した(S5B Fig, S2 Table)。また、C. difficileのメトロニダゾールMICは特定のコミュニティで変化したが、C. difficileのバンコマイシンMICはどのコミュニティでも大きく変化していなかった(Pairwise Community Dataと一致する)。
そこで、抗生物質感受性の高い生物阻害物質を含む多種の群集が、C. difficileのサブMICでの増殖の促進を示すかどうかを検証した。メトロニダゾールまたはバンコマイシンに対して、ほとんどのコミュニティで少なくとも1つのsubMICに対してC. difficileの増殖が促進された(メトロニダゾールは29コミュニティ中21コミュニティ、バンコマイシンは12コミュニティ中9コミュニティ、図3EおよびS6)。ペアワイズコミュニティのデータと一致して、C. difficileの生物学的阻害の程度は、最大subMICのフォールド変化の大きさと正の相関があった(図3F)。さらに、この相関は、抗生物質感受性の高い生物学的阻害物質のみで構成されるコミュニティでより強くなった(図3F)。これらの傾向と一致して、コミュニティ内の感受性阻害剤の数と感受性阻害剤の絶対量は、最大subMICフォールド変化と正の相関を示した(S7A Fig)。抗生物質感受性の生物学的阻害剤を含むコミュニティは、耐性阻害剤のみを含むコミュニティや両方の阻害剤タイプの混合物よりも、平均サブMICフォールド変化が有意に高かった(S7B Fig)。
腸内細菌叢の構成を反映して、抗生物質感受性阻害剤と耐性阻害剤の混合物を含むコミュニティは、耐性生物阻害剤コミュニティと同様の大きさの低いサブMICフォールド変化を示した(S7B Fig)。耐性生物インヒビターの存在量がゼロではないコミュニティでは、C. difficileの増殖促進効果と感受性インヒビターの数または存在量の間の相関は消失した(S7A Fig)。これらのデータは、耐性生物阻害物質が、感受性生物阻害物質によって引き起こされるC. difficileの増殖促進を抑制できることを示唆している。多種の生物群集におけるC. difficileの増殖促進は、2つの生物群集におけるC. difficileの増殖促進量の合計から予測できるかどうかを解析した。その結果、中程度の相関を示したものの、加法的な関係ではなかった(S7CおよびS7D図)。このことから、コミュニティを構成するメンバー間の種間相互作用や耐性阻害剤による増殖抑制などのコミュニティ効果が、subMICにおけるC. difficileの増殖抑制の大きさを決定する上で重要な役割を果たすことが示されました。これらの結果から、C. difficileのsubMICsでの増殖促進は、多種類の群集で起こりうることが示され、この反応はヒトの腸内細菌叢でも起こる可能性が示唆されました。
C.difficileのsubMICsに対する反応を、一対一の相互作用と単一種の抗生物質感受性を表す動的生態系モデルで捉えることができる。
我々は、種の成長、種間相互作用、および単種抗生物質感受性のダイナミクスを表現するモデルが、subMICsにおけるC. difficileの成長促進で観察された傾向を再現できると仮定した。抗生物質非存在下での推定される種間相互作用は、抗生物質に対する群集の反応に寄与すると仮定した。抗生物質依存の複雑な種間相互作用を無視したモデルで、subMICsにおけるC. difficile増殖の定性的傾向を予測できるかどうかを検証した。
gLVモデルは、個々の種の成長速度と各コミュニティメンバーとの対の相互作用を捉える連立常微分方程式系である。私たちは、抗生物質の摂動を取り込んだ一般化ロトカ・ヴォルテラモデル(gLV)の拡張版を使用しています[30](図4A)。この拡張モデルでは、各生物種の成長は、抗生物質の濃度と各生物種の感受性(Bi)からなる抗生物質項によって修正される(Methods, Fig 4A)。
拡大する
図4. 抗生物質に反応する群集ダイナミクスの修正一般化ロトカ-ボルテラモデルは、抗生物質に敏感な生物阻害物質の存在下で、MICより低い抗生物質濃度の傾向を捉える。
(A) 上:gLVモデルの抗生物質展開の模式図。下図: パネルBで使用した精度指標の模式図。 (B) 一対一および多種類の群集に対する複数のモデルの定性的精度。モデルには、(1)抗生物質項を含まない標準gLVモデル、(2)抗生物質感受性パラメータをランダムにシャッフルしたgLVモデル(100回の順列の平均)、100個のシャッフル値を点として示し、シャッフルしたC. difficileの間の差異の絶対値にしたがって陰をつけている。difficileの抗生物質感受性パラメータと元のC. difficileの抗生物質感受性パラメータとの差の絶対値によって陰影が付けられた。(C)代表的なパラメータセットについて、48時間のペアワイズコミュニティにおける対象種の最大サブMIC倍率変化をシミュレーションした。2種の成長率は等しく(ui = uj = 0.25)、種内相互作用は等しく(aii = ajj = -0.8)、初期ODは等しい(xi(0) = xj(0) = 0.0022)。種間相互作用係数ajiは0、Biは-2に設定。 D)ランダムにサンプリングした1,000個のパラメータセットについて、一対のコミュニティにおける焦点種の最大サブMIC倍率変化をシミュレートする。パラメータBjとaijはそれぞれ0または-6、0または-1.25の定数値に設定されている。その他のパラメータは上界と下界の間でランダムにサンプリングした。各パラメータ値の下界と上界は、aji (-1.25, 1.25), 成長率 (0, 1), 種内相互作用 (-1.25, 0), Bi (-6, 0). y = 1のグレーの水平線は、抗生物質無添加の条件と比較して成長に変化がないことを示す。この図のパネルBCDの基礎となるデータとモデリングスクリプトは、DOI: 10.5281/zenodo.7726490 で見ることができます。MICは最小発育阻止濃度、subMICはサブ最小発育阻止濃度。
doi:10.1371/journal.pbio.3002100.g004
詳細 "
単種抗生物質感受性パラメータは、様々な抗生物質濃度(2倍希釈)の存在下での個々の種の成長の測定値から推測した(Methods, S1 Fig)。抗生物質非存在下での159の単種および群集(2~14人)の絶対量測定に基づいて以前に推定された成長率と種間相互作用パラメータを使用した[4]。
このモデルが、サブMIC領域におけるC. difficileの増殖促進傾向を定性的に予測できるかどうかを評価した(S8およびS9図)。各抗生物質濃度に対するC. difficileの反応を3つのカテゴリーに分類した(C. difficile subMIC fold-change > 1, C. difficile subMIC fold-change ≤ 1, or no growth of C. difficile, Fig 4A).拡張gLVモデルは、71%の抗生物質条件に対するC. difficileの定性的反応を正しく予測した(図4BおよびS10A)。拡張gLVモデルの異なる項がモデル性能に与える寄与を評価するために、一連のヌルモデルを設計しました。フルモデルは、抗生物質感受性の項がない、または抗生物質感受性パラメータをランダムにシャッフルしたヌルモデルよりも高い精度を示した(47%と53%の精度、図4C)。これらのデータは、モデルの予測性能において、適合した単系統の感受性が主要な役割を果たすことを強調している。また、フルモデルは、種間相互作用項を含まないヌルモデルを上回った(65%、図4C)。これは、推測される種間相互作用が、subMICに反応したC. difficileの増殖促進に寄与していることを示す。これらの結果から、微生物群集において、生物学的阻害と単一種の抗生物質感受性が、subMICに応答したC. difficileの増殖を決定する主要な変数であることが示された。
我々は、サブMICにおけるC. difficileの増殖の促進には、実験的に特徴付けられた群集以外にも、多種多様な群集において感度の高い生物学的阻害剤が必要かどうかを判断するために、モデルシミュレーションを行った。この目的のために、幅広い成長速度、種間相互作用、抗生物質感受性を持つ1,000のペアワイズコミュニティをシミュレーションしました。感受性の高い生物阻害剤と組み合わせた場合、実験で観察された傾向と一致し、サブMICで成長が促進された(図4D)。一方、対象種の抗生物質感受性の高い生物阻害剤を持たない模擬群集では、成長の促進は観察されなかった(図4D)。この傾向は、より大きなコミュニティでも見られる(S10B Fig)。サブMICにおける中心種の成長促進は、生物学的阻害と阻害種の抗生物質感受性に伴って増加する(図4E)。全体として、これらのモデルシミュレーションは、ヒトの腸内コミュニティにおけるC. difficileで観察された抗生物質感受性阻害剤の傾向は、豊かさ、相互作用ネットワーク、抗生物質感受性が変化する他の種やコミュニティにも一般化可能であることを示唆しています。
D. pigerはC. difficileのメトロニダゾールに対する最小発育阻止濃度を大幅に上昇させる。
微生物の著しい相互作用による病原体の抗生物質感受性の変化は、抗生物質による治療の効果を低下させる可能性があります。D. pigerの存在下では、サブMICでのC. difficileの中程度の増殖促進に加えて、C. difficileのMICの大幅な増加が観察された(図2B)。提案されている抗生物質感受性生物阻害機構と一致して、D. pigerはC. difficileの弱い生物阻害剤であり、C. difficileよりもメトロニダゾールに感受性が高かった(図2Aおよび図3C)。しかし、D. pigerの存在下と非存在下におけるC. difficileのMICの大幅な増加(6μg/mLに対して24μg/mL以上)は、提案された抗生物質感受性生物阻害機構では説明できず、拡張gLV抗生物質モデルもこの傾向を予測できなかった(S8A図)。観察されたサブMIC成長反応には競争的相互作用(すなわち、資源競争または生物戦)が寄与しているが、D. pigerの存在下でメトロニダゾールのMICが増加するメカニズムは不明であった。
我々は、異なる環境条件や異なるC. difficile分離株に対して、この傾向の頑健性を調査した。C. difficileは、D. pigerとの共培養およびD. pigerの使用済み培地での単培養で、MICの増加を示した(MICの8倍以上の増加)(図5A)。これらのデータから、C. difficileのメトロニダゾールMICの上昇は、D. pigerとの細胞間接触やD. pigerのメトロニダゾールへの事前曝露に依存しないことが示された。C. difficileは、指数期後期/定常期初期に採取したD. pigerの使用済み培地で、指数期の早い時期に採取した使用済み培地よりも高いメトロニダゾールMICを示した(S11AおよびS11B Fig)。さらに、複数のC. difficile臨床分離株は、D. piger使用済み培地においてMICが増加した(S11C図)。最後に、C. difficileは、異なる化学的に定義された増殖培地においてD. pigerとの共培養でより高いメトロニダゾールのMICを示した(S11D Fig)。これらのデータから、メトロニダゾールに対するC. difficileの反応に対するD. pigerの保護効果は、C. difficileの菌株背景、培地組成、D. pigerの成長段階の変動に対して強固であることが示されました。
拡大する
図5. D. pigerはC. difficileのメトロニダゾールMICを上昇させ、金属飢餓のゲノムワイド転写反応を誘導する。
(A) 異なるメトロニダゾール濃度に反応した41時間後のC. difficileの存在量。D. piger存在下でのC. difficileのOD600値は、計算OD600(OD600に16S rRNA遺伝子配列決定からの相対存在量を乗じた値)。X軸は半ログスケール。データポイントは生物学的複製を表す。線はn = 2からn = 4の生物学的複製の平均を示す。(B) ゲノムワイド転写プロファイリング実験の模式図。X軸はメトロニダゾール(MTZ)濃度の半対数スケールである。線は、14時間後のC. difficileの平均OD600を示し、n = 4生物学的複製である。円は、RNA-Seqのためにサンプリングされた条件を示す。(C) C. difficileの培養条件間のDEGs。DEGは、2倍以上の変化を示し、p値が0.05未満である遺伝子として定義される。(D) C. difficileの各遺伝子(行)および各サンプル(列)におけるRPKMのクラスター化ヒートマップ。各列は、n = 2生物学的複製の平均を表す。階層的クラスタリングは、Python SciPyクラスタリングパッケージの単一連結法を用いて、ユークリッド距離に基づいて行われました。(E) D. piger存在下でのC. difficileの対数変換された転写倍数変化のボルケーノプロット。灰色の縦線は2倍変化を示し、灰色の横線は統計的有意性の閾値(p = 0.05)を示す。青色は金属輸入に関与すると注釈された遺伝子を示す。赤はMetalPredator [31]によって鉄-硫黄クラスターを含むと予測された遺伝子を示す。(F) D. pigerの存在下で増殖したC. difficileにおいて、新鮮な培地で増殖したC. difficileと比較して濃縮された遺伝子セットを示す。GSEAから有意な濃縮スコアを得たすべての遺伝子セットを示す。遺伝子セットはKEGGのモジュールを用いて定義されている。 (G) 異なる条件下での遺伝子セットの対数変換されたフォールドチェンジの棒グラフである。グレーの水平線は2倍変化を示す。この図のパネルABの基礎となるデータはDOI: 10.5281/zenodo.7626486に、パネルCDEFGの基礎となるデータはDOI 10.5281/zenodo.7049035 および 10.5281/zenodo.7049027 とS3およびS4 Tablesに記載されています。DEG、差次発現遺伝子、GSEA、Gene Set Enrichment Analysis、KEGG、Kyoto Encyclopedia of Genes and Genomes、MIC、minimum inhibitory concentration、RPKM、reads per kilobase million.
doi:10.1371/journal.pbio.3002100.g005
詳細 "
D. pigerは、メトロニダゾールの効力を低下させる直接的な化学的相互作用(分解や隔離など)、あるいはC. difficileの細胞内ネットワークの活動を変化させ、メトロニダゾールのMICを上昇させる間接効果によって、C. difficileのメトロニダゾールのMICを変化させると考えられた。直接的な化学的相互作用を検証するため、D. pigerの使用済み培地または新鮮な培地でメトロニダゾールを培養し、新鮮な培地でそれぞれの条件に対するC. difficileの増殖反応を評価しました。C. difficileのメトロニダゾールMICはこれらの条件下で等しく、D. pigerの使用済み培地に存在する化合物はメトロニダゾールと直接相互作用してその活性を低下させないことを示している(S11E Fig)。
C. difficileは、D. pigerに応答して、金属制限のゲノムワイド転写シグネチャーを表示する。
D. pigerがC. difficileの細胞内ネットワーク活動に及ぼす間接的な影響について検討したところ、それがC. difficileのメトロニダゾールに対する反応を変化させる可能性があることがわかった。資源競争は微生物群集における種間相互作用を促進する一般的なメカニズムであるため、まず資源競争を間接的効果として検討した。C. difficileの存在量は、D. pigerの使用済み培地では、単培養に比べて実質的に低下しなかったことから(図5A)、資源競争がMIC上昇の主要因ではないことが示唆されました。また、D. pigerの使用済み培地に濃縮した新鮮な培地を補充することで、資源競争を緩和することができるが、C. difficileのメトロニダゾールMICは変化しなかった(S11F Fig)。したがって、これらのデータは、D. pigerが資源競合を介してC. difficileのメトロニダゾールMICに影響を与えないことを示唆している。
そこで、D. pigerが遺伝子発現のパターンを変化させることで、C. difficileのメトロニダゾールMICに影響を与えるかどうかを検討した。指数期後期のC. difficileについて、以下の環境でゲノムワイドなトランスクリプトームプロファイリングを実施した: (1) 新鮮な培地での単培養、(2) D. pigerの使用済み培地での単培養、(3) D. pigerとの共培養。これらの培養は、それぞれメトロニダゾールのsubMICに暴露され、約50%の成長を減少させるか、または無処置とした(図5B)。抗生物質の濃度は、転写プロファイリングに必要な十分な増殖ができるように選択されました。
D. piger条件(すなわち、D. piger使用培地およびD. pigerとの共培養)におけるC. difficileの遺伝子発現プロファイルは、C. difficile単独培養と比較して有意に変化した(表1およびS3)。微分発現遺伝子(DEG)は、2倍以上の変化があり、p値が0.05未満である遺伝子と定義された。抗生物質非存在下において、C. difficileの3,535遺伝子のうち36%と21%が、新鮮培地でのC. difficile単培養と比較して、D. piger共培養と使用済み培地でそれぞれ差次発現した(図5C、白と青の棒)。これらの遺伝子のうち、D. piger共培養で72個、D. piger使用済み培地で47個が8倍以上の変化を示し、D. pigerの存在がC. difficileの遺伝子発現プロファイルに大きな影響を与えることが示された。メトロニダゾールの存在下では、D. pigerと新鮮な培地の条件間で発現が異なる遺伝子の割合はより少なかった(8%と6%、図5C、グレーと黒のバー)。C. difficileの遺伝子発現はメトロニダゾールの添加により大きく変化し、25%から49%の遺伝子が差次的に発現した(図5C、茶色の棒グラフ)。3つのメトロニダゾールの条件は密接にクラスタリングされ、培地条件や生態学的背景に関わらず、抗生物質が遺伝子発現に同様の変化を引き起こすことが示された(図5D)。
条件によって異なる特定の遺伝子についてより深く理解するために、D. pigerの条件で最も大きな発現変化を示した遺伝子を分析した。D. pigerおよびD. piger抗生物質条件下で新鮮培地と比較して発現が増加した遺伝子の多くは、金属獲得における役割が注釈されていた(図5EおよびS12の青い点)。鉄を獲得するために、C. difficileは鉄ペルミアーゼを使って遊離の第一鉄を細胞内に取り込みます[32,33]。D. pigerとD. piger metronidazoleの条件下で、2つの第一鉄トランスポーター(feoAB1、feoAB3)で10倍以上のアップレギュレーションを観察した(表1、図5G)。また、フェリクロム系シデロフォアの取り込み遺伝子(fhuB、fhuD)やカテコール系シデロフォア(CDR20291_1545-1548、CD630のyclNOPQのオルソログ)、亜鉛トランスポーター遺伝子(zupT)といった代替トランスポーターの発現量も増加した。これらの遺伝子(feo、fhu、ycl、zupT)は鉄調節因子furによって制御されており[32]、鉄飢餓や亜鉛飢餓に反応して発現が上昇することが示されており[34-36]、D. piger条件における金属制限が観察された変化に関与していると考えられる。金属制限のサインと一致して、アップレギュレーションされなかった第一鉄輸送体(feoAB2)は、鉄制限に反応しないことが記録されている [32,34]。
拡大する
表1. 16倍以上の発現差がある遺伝子について、新鮮培地と比較したD. piger条件でのC. difficile遺伝子発現。
doi:10.1371/journal.pbio.3002100.t001
詳細 "
金属輸送に直接関連する遺伝子に加え、C. difficileのDEGの多くは鉄代謝に関連していた。フラボドキシン(fldX)は、D. pigerの条件下で最もアップレギュレートされた遺伝子であった(表1、図5G)。フラボドキシンは、鉄が制限された条件下で、鉄を必要とする電子伝達タンパク質(フェレドキシンなど)を置き換えることができる[37]。フラボドキシンは非金属の補酵素であるフラビンを使っており、その生合成遺伝子(ribACH)はD. piger条件下でアップレギュレートされていた(表1)。これまでの研究で、フラボドキシンは鉄制限条件および亜鉛制限条件でファーが制御され、脱抑制されることが示されており[32,34-36]、リボフラビンの生合成遺伝子は鉄制限条件で発現が上昇した[35]。鉄を含むタンパク質は、鉄制限条件下で発現量が低下することが示されている[35]。バイオインフォマティクス解析を用いて、D. piger共培養条件下でC. difficileのダウンレギュレーション遺伝子の9%(678遺伝子中62遺伝子)が鉄硫黄クラスターを含むと予測された(図5E、S4表中の赤点)ことを明らかにした。つまり、金属に依存しないフラボドキシンの遺伝子はアップレギュレートされ、鉄を必要とするタンパク質の転写物はダウンレギュレートされており、D. pigerが作り出すC. difficileの金属制限環境と一致する。
D. piger条件下で有意に変化した他の生物学的経路を特定するため、Kyoto Encyclopedia of Genes and Genomes (KEGG) モジュールを使って遺伝子セット濃縮分析 (GSEA) を行った (Figs 5F and S12)。同定された経路の多くは、金属と関連している可能性がある。例えば、ダウンレギュレーションされたWood-Ljungdahl経路の酵素の多くは鉄-硫黄クラスターを持ち、すなわち一酸化炭素脱水素酵素(coCS、CDR20291_0653、CDR20291_0655)およびギ酸脱水素酵素H(fdhF) [38-40] である。また、Wood-Ljungdahl経路の[NiFe]ヒドロゲナーゼ(hydAN1N2)は、ニッケル-鉄クラスターを含んでいます。これらの酵素は、鉄が制限された条件下でダウンレギュレーションされることが示されている[35]。カチオン性抗菌ペプチド耐性と脂肪酸生合成の経路はアップレギュレートされたが、これは以前から鉄制限に起因するとされていた[35]。同様に、V型ATPase、D-ガラクツロン酸分解、トレハロース生合成の経路のダウンレギュレーションは、鉄の制限に関連している(図5F)[35]。D. pigerは、C. difficileの毒素(tcdA、tcdB、バイナリー毒素遺伝子CDR20291_2491とCDR20291_2492)の発現にも影響を与え、D. piger条件では4〜27倍ダウンレギュレートした(S3 Table)。
C. difficileの遺伝子発現パターンに対する鉄制限の寄与についてさらなる洞察を得るために、D. piger存在下でのC. difficileの遺伝子発現変化と、別の研究で以前に特徴付けられた鉄制限培地でのC. difficileの遺伝子発現変化の関係を評価した [35]. すべてのDEGについて、D. piger共培養のC. difficileとメトロニダゾール非存在下の単培養のC. difficileの間のlog2倍変化を、以前の研究で鉄制限培地と鉄過剰培地のC. difficileの間で観察したlog2倍変化と比較しました。これらのフォールド変化は有益な関係を示し、2つの研究間で89%の遺伝子について定性的に一致していた(S13A Fig, Pearson r = 0.61, p = 810-54)。同様に、D. pigerの使用済み培地で培養したC. difficileのフォールド変化は、C. difficileの鉄制限研究におけるフォールド変化と87%の定性的一致を示した(S13B Fig)。これらのデータセット間の有益な関係は、D. piger条件におけるC. difficileの遺伝子の大半の遺伝子発現のシフトが、金属制限によって説明できることを示唆しています。
全体として、これらのデータは、D. pigerがC. difficileにとって金属制限環境を作り出したことを示唆している。金属獲得とフラビン代謝に関わる代替遺伝子がアップレギュレートされたのに対し、金属要求性タンパク質の転写物はダウンレギュレートされた(図5G)。これらの傾向は、D. piger共培養とD. piger使用済み培地の両方で観察され、メトロニダゾールを添加したD. piger条件での傾向とも一致した(図5G)。
D. piger存在下でのC. difficileの差次的発現遺伝子はメトロニダゾール耐性に関連している。
C. difficileのDEGの大部分は金属制限で説明できるため、金属制限とC. difficileのメトロニダゾールMICの関連性を調べた。潜在的な関連を特定するために、D. piger存在下でのDEGsのセットを、C. difficileのメトロニダゾール耐性に役割を果たすと以前に示された遺伝子と比較した。
メトロニダゾール耐性C. difficile変異体に関する2つの研究では、鉄関連遺伝子がメトロニダゾール耐性に関与していた。C. difficile ATCC 700057株の研究では、メトロニダゾール耐性が向上した複数の変異体がfeoB1の切断を獲得し、その結果、細胞内鉄が減少してフラボドキシンへ移行した [41]. 同様に、NAP1株のメトロニダゾール耐性変異体では、鉄取り込み遺伝子がダウンレギュレーションされ、フラボドキシンへのシフトが観察された[42]。これらの研究では、メトロニダゾール耐性のメカニズムとして、メトロニダゾールを活性型に還元すると予測される酵素のダウンレギュレーションが提唱されている。D. pigerの条件では、メトロニダゾールを還元すると仮定される酵素、すなわちフェレドキシン遺伝子(fdxA、CDR20291_0114、CDR20291_3444)、ピルビン酸フェレドキシン/フラボドキシン酸化還元酵素(PFOR)(nifJ)、ヒドロゲナーゼ(hydA、hydN1、hydN2)も低下した(表1、図 5G)[20、21]。D. pigerの条件下でこれらの酵素のダウンレギュレーションを行うと、メトロニダゾールの活性型への変換速度が低下し、C. difficileの耐性が高まると考えられる。ダウンレギュレーションされた酵素はそれぞれ鉄クラスターを含むと予測され(S4表)、ヒドロゲナーゼはニッケル補酵素を含むことが知られており[39]、これらのダウンレギュレーションとその後のメトロニダゾール感受性の低下は金属制限に起因する可能性が示唆されている。
このような耐性メカニズムは、C. difficile以外の種でも提案されている。例えば、Bacteroides fragilisのメトロニダゾール耐性変異体は、PFORの発現が低下していた[21]。したがって、このメカニズムがD. pigerによるC. difficileのメトロニダゾールMICの上昇に関与しているとすれば、Bacteroides属もより高いMICを示すはずである。実際、B. thetaiotaomicronはD. pigerの使用済み培地において、新鮮培地と比較して高いメトロニダゾールMICを示した(S14 Fig)。
また、D. pigerの条件下(表1、図5G)および鉄制限培地で発現量が低下した推定コバルトトランスポーターであるcbiN(35)は、以前にメトロニダゾール耐性に関与していることが確認されました[35]。cbiNに存在する単一のSNPは、C. difficileのメトロニダゾール耐性R010分離株と、同じ患者から分離されたメトロニダゾール感受性R010分離株とを区別しました[43]。我々のデータでは、cbiNはD. piger共培養で10倍、D. pigerの使用済み培地で4倍ダウンレギュレートされていた。
D. pigerの環境下でダウンレギュレートされたもう一つの酵素、アルトロン酸ヒドロラーゼ(uxaA)は、メトロニダゾール耐性と関連する可能性がある。特に、アルトロネートヒドロラーゼはD. pigerとの共培養で大幅に発現量が減少し、その減少幅はトランスクリプトームで2番目に大きかった(1000倍以上減少、表1、図5G)。アルトロン酸ヒドロラーゼは、ガラクツロン酸分解の一環として、炭素数6のアルトロン酸の脱水を触媒する[44]。メトロニダゾール耐性NAP1 C. difficile株とメトロニダゾール感受性C. difficile参照株を区別した17の変異の1つは、アルトロネートヒドロラーゼ遺伝子に生じた。アルトロネートヒドロラーゼの変異は、変異体の3つのフレームシフト変異のうちの1つであり、おそらくアルトロネートヒドロラーゼを非機能化させたと思われる[45]。大腸菌での研究により、この酵素は触媒活性に鉄またはマンガンを必要とすることが示され[46]、金属制限培地での強いダウンレギュレーションと一致している[35]。
メトロニダゾール耐性C. difficile分離株におけるcbiNとuxaAの変異は、金属制限に反応して観察されるcbiNとuxaAのダウンレギュレーションが、C. difficileのメトロニダゾールMIC上昇に寄与する可能性を示唆する。これらの遺伝子は、メトロニダゾールを活性型に変換することが予測される金属含有酸化還元酵素、ヒドロゲナーゼ、フェレドキシンの発現低下に加えて、金属制限とメトロニダゾール感受性を結びつける可能性がある。
D. pigerによる硫化水素生産は金属隔離を促進する
C. difficileの遺伝子発現プロファイルのグローバルな変化は、D. pigerが金属制限環境を作り出したことを示唆しています。このような金属制限は、D. pigerが産生する硫化水素によって引き起こされた可能性があると考えた[47]。D. pigerの培養液では、鉄が生成された硫化水素と結合してできる特徴的な黒い沈殿物(硫化鉄)が観察された[48]。他の2価の金属も硫化物と一緒に沈殿することがあり [49,50]、D. pigerの存在下では硫化第一鉄に加えて沈殿している可能性があります。
D. pigerが生成した硫化物によってどれだけの金属が沈殿するかを推定するために、D. pigerの単一培養における硫化物の量を経時的に定量化した(Methods)。硫化物の量は、指数期後期に1.4 mMでピークに達した(図6A)。硫化水素は揮発性であり、成長中に逃げてしまう。したがって、生成された硫化水素の総量は、測定された濃度よりも高い可能性が高い。C. difficileも少量の硫化水素を生成するが、C. difficileとD. pigerの共培養における硫化水素の量は、D. pigerの単培養における量と同程度だった(S15A Fig)。D. pigerの使用済み培地とD. pigerの共培養で生成された硫化水素(>1.4 mM)は、培地中の全二価金属濃度(1.2 mMの鉄とマイクロモル濃度の他の金属、S15B Fig)を超えていた。したがって、生成された硫化水素は培地中のすべての二価金属を沈殿させ、C. difficileの金属制限環境を作り出すことができた。このことは、C. difficileの遺伝子発現プロファイルに見られる金属制限の特徴を説明することになる。この仮説を裏付けるように、過剰な硫化物の沈殿による鉄の枯渇は、C. difficileのFur制御遺伝子を誘導することが以前に示されている [51]。
拡大する
図6. D. pigerの使用済み培地に金属を補充すると、メトロニダゾール存在下でのC. difficileに対する保護作用が消失する。
(A) 単培養におけるD. pigerの絶対量(黒)と硫化水素生産量(赤)の線図。データポイントは生物学的複製を表す。各生物学的複製は、2つの技術的複製の平均値である。線は、n = 4生物学的複製の平均を示す。(B) D. pigerの使用済み培地(SM)に金属を添加した場合としない場合のC. difficileメトロニダゾール(MTZ)感受性の48時間後の線図と棒グラフ。金属添加条件は、1mMのCo、Mn、Ni、ZnおよびFeを含む。X軸は半対数スケール(折れ線グラフ)。データポイントは生物学的複製を表す。線は、n = 4生物学的反復の平均を示す。アスタリスクは、非対称t検定により、金属補給の有無による有意差(*P < 0.05, **P < 0.01, ***P < 0.001)を示し、「ns」は有意ではない。統計的有意性は、2つのMICのうち低い方、および2つの条件のMIC間の濃度で実施した。棒グラフは、線グラフに示したデータのMICを表示する。データポイントは、n = 4生物学的複製のMICを表す。バーは、n = 4生物学的反復の平均OD600に基づいて決定されたMICを表す。(C) D. pigerの使用済み培地(SM)において、48時間後に各金属を添加した場合と添加しない場合のC. difficileの抗生物質感受性の線図と棒グラフ。各x軸は半ログスケール。データポイントは生物学的複製を表す。線は、n = 4生物学的反復の平均を示す。棒グラフは、線グラフに示されたデータのMICを示す。データポイントは、n = 4生物学的反復のMICを示す。バーは、n = 4生物学的反復の平均OD600に基づいて決定されたMICを示す。2つの条件間でMICが変化した金属については、2つのMICのうち低い方、および2つの条件のMICの間の任意の濃度で統計的有意性をテストした。(D) 新鮮な培地、D. piger使用済み培地(DP SM)、および金属を補充したD. piger使用済み培地で増殖したC. difficileにおける3遺伝子の相対遺伝子発現を、qRT-PCRで検出したバープロット。倍率は、2-ΔΔCt法(Methods)を用いて算出した。データポイントは生物学的複製を表し、各ポイントは3つの技術的複製の平均値として計算される。バーは、n = 4生物学的複製の平均を示す。統計的有意性は、ΔCt値に基づいて決定した(S15 Fig)。(E) D. pigerがC. difficileのメトロニダゾール感受性を変化させるメカニズムの提案の模式図。(左)単培養では、環境中に金属が存在し、C. difficileの金属含有酵素が発現し、プロドラッグであるメトロニダゾールを活性型に還元する。(右)D. pigerとの共培養では、D. pigerが生成する硫化水素が金属を隔離し、硫化金属沈殿を形成する。金属制限に対応して、C. difficileでは、メトロニダゾールのプロドラッグから活性型への変換を抑制する金属結合タンパク質の発現が減少する。その結果、メトロニダゾールの不活性型から活性型への変換速度が低下し、C. difficileの耐性が向上する。この図のパネルABCDの基礎となるデータは、DOI: 10.5281/zenodo.7626486 に掲載されています。MIC、最小発育阻止濃度。
doi:10.1371/journal.pbio.3002100.g006
詳細 "
D. piger使用済み培地に金属を組み合わせて補充するとC. difficileのメトロニダゾールからの保護作用がなくなる
硫化水素による金属沈殿がC. difficileのメトロニダゾールMICの上昇につながるという仮説に基づき、D. pigerの使用済み培地から硫化水素を除去するとこの保護効果がなくなるかどうかを検証した。窒素ガスで15分間パージすることにより、D. pigerの使用済み培地から硫化水素の大部分が除去された(S16A Fig)。窒素パージした使用済み培地は、未処理の使用済み培地よりも硫化第一鉄の沈殿物の形成が少ないことが目視で確認された(S16B Fig)。提案されたメカニズムと一致して、C. difficileのメトロニダゾールMICは、未処理の使用済み培地と比較して、窒素パージした使用済み培地で低下した(S16CおよびS16D Fig)。このことから、硫化水素が金属沈殿を介してC. difficileのメトロニダゾールMICの上昇に寄与していることが示唆された。
さらに、D. pigerの使用済み培地に沈殿した金属を補充すると、C. difficileのメトロニダゾールMICに対する保護効果が低下するという仮説も立てた。複数の二価金属が硫化物沈殿を形成し[49,50]、複数の二価金属の制限はC. difficileの同様の遺伝子発現変化を引き起こす可能性がある[35,36]ので、コバルト、鉄、マンガン、ニッケル、亜鉛を添加した培地でC. difficileのメトロニダゾールMICの特性を調べた。我々は、補充した金属を沈殿させる可能性のある未反応の硫化水素を考慮し、これらの金属を高濃度(ミリモル範囲)でD. pigerの使用済み培地に導入した。その結果、5種類の金属を添加したD. piger使用済み培地では、これを添加していないD. piger使用済み培地と比較して、C. difficileのメトロニダゾールMICが大幅に減少した(MICは48μg/mLから3μg/mLに減少、図6B)。一方、C. difficileの抗生物質MICは、5種類の金属を添加した新鮮な培地では変化せず、この効果はD. pigerによる環境改変に依存していることが示された(S17A Fig)。D. pigerの使用済み培地に個々の金属を補充したところ、どの金属も金属の組み合わせほどにはメトロニダゾールのMICを低下させなかった(図6C)。
これらの結果と一致して、金属制限を示す3つの遺伝子(fldX、feoB1、zupT)の発現は、金属を補充していない使用済み培地に比べて、金属の組み合わせを補充したD. piger使用済み培地で培養したC. difficileで著しく減少した(図6D及びS17B)。全体として、このデータは、D. piger使用済み培地での金属制限により、C. difficileのトランスクリプトームがグローバルにシフトし、メトロニダゾール感受性が大幅に低下したことを示唆している。注目すべきは、これらの効果の両方が、金属を補充することで解消されたことである。これらのデータを総合すると、D. pigerがC. difficileのメトロニダゾール感受性に影響を与える生物学的メカニズムが提案された(図6E)。このメカニズムでは、D. pigerが生成する硫化水素が培地中の2価の金属を隔離する。その結果、C. difficileは金属に制限された環境となり、金属補酵素を必要とする酵素の活性が低下する。ダウンレギュレーションされた遺伝子には、メトロニダゾールを活性型に還元する酸化還元反応を行う酵素が含まれています。したがって、D. pigerとの共培養では、メトロニダゾールの活性化濃度が低下し、DNA損傷が減少する結果、抗生物質のMICが大幅に上昇する。
考察
基本的な問題は、マイクロバイオームにおける抗生物質感受性を形成する生物間相互作用の役割を明らかにすることである。特に、微生物の相互作用がC. difficileのようなヒトの主要な病原体の抗生物質感受性をどのように変化させるかを理解することで、生態学的背景に基づいたテーラーメイドの抗生物質治療が可能になると考えられる。この理解は、健康な腸内細菌叢の破壊を最小限に抑え、抗生物質耐性の獲得を最小限に抑えながら、ヒトの病原体を選択的に駆除する新しいマイクロバイオーム介入につながる可能性があります。我々は、ヒトの主要な腸内病原体であるC. difficileの抗生物質感受性に対する種間相互作用の寄与について調査した。その結果、C. difficileの抗生物質感受性には、C. difficileのMICの変化と、抑制濃度以下でのC. difficile量の変化という2種類の変化が観察されました。C. difficileのMICの大幅な変化は、我々の条件ではまれで、ごく一部のコミュニティで発生しただけでした(S18A図)。対照的に、サブMICでのC. difficileの存在量の増強はより頻繁に観察され、特徴付けられたコミュニティの52%で発生した(S18B Fig)。この結果は、幅広い抗生物質濃度範囲において、病原体の増殖が種間相互作用によって変化する可能性があることを示しており、抗生物質治療の設計において考慮されるべきものであることを示しています。
抗生物質の単独投与に対して、C. difficileのMICが単種菌に比べて4倍以上増加することが、ペアワイズ・コミュニティの4%(図2)、マルチスペシフィック・コミュニティの16%で観察された(S1およびS2表参照)。これは、他の微生物群集で感受性を変化させることが示されている種間相互作用のごく一部と定性的に一致する[12-15]。我々はC. difficileの治療に使用される抗生物質に焦点を当てたが、今後の研究では、我々のアプローチを応用して、クリンダマイシン、セファロスポリン、フルオロキノロンなどのC. difficile感染症発症の危険因子である抗生物質に対するC. difficileの反応に腸内微生物が与える影響を調べることができる[52]。
特定の腸の存在下でC. difficileのメトロニダゾールMICの増加が観察されたことは、ヒトの大腸におけるC. difficile感染症の治療におけるメトロニダゾールの無効性に寄与しているかもしれない。ヒトの大腸におけるメトロニダゾールの達成濃度が低いため[53]、C. difficileメトロニダゾールのMICが控えめに増加しても、病原体が生存できる可能性があります。我々の結果に基づき、C. difficileの抗生物質感受性の将来の試験には、生理学的に適切な微生物群集で培養したC. difficileの条件を含めることができる。例えば、C. difficileは、ヒト腸内細菌叢の組成が異なる複数のドナーからの糞便サンプルを再懸濁したパネルで培養することができる。抗生物質の投与は、健康な腸内細菌叢の破壊を最小限に抑えることと、ドナーサンプル間のC. difficileのMICのばらつきを最小限に抑えることのバランスを取ることでスコア化することができる。
我々は、D. pigerが環境中の生物学的利用可能な二価金属を枯渇させ、その結果、金属補因子を必要とするC. difficileの酵素の転写制御が低下するというメカニズムを提案する。これらの酵素はメトロニダゾールを活性型に還元することが示唆されている。このことは、これらの酵素の発現レベルが低いほど、C. difficileが抗生物質の作用から保護されることを示唆している(図6E)。鉄の制限は、PMFの生成に重要な鉄-硫黄複合体の減少により、プロトン運動力(PMF)に依存した取り込みを行う抗生物質に対する微生物の耐性を高めることが示されている [54]。メトロニダゾールはPMFとは無関係に受動的に細胞内に拡散するため[55]、鉄の制限はメトロニダゾールの初期取り込み速度ではなく、プロドラッグから活性化阻害剤への変換速度に影響を与えると考えられる。我々の結果は、細胞内鉄レベルの低下とC. difficileのメトロニダゾール耐性との関連を明らかにした先行研究 [41,42] によって支持されている。興味深いことに、ヘム制限はC. difficileをメトロニダゾールに感作することが以前に示されている[56]。これは、今回観察された金属制限によるメトロニダゾール保護とは対照的であり、ヘムおよび非ヘム鉄とメトロニダゾール感受性の間に複雑な関係があることが示唆された。
金属補充実験では、5種類の金属のカクテルはC. difficileのMICの大幅な低下を引き起こしたが、鉄単体を含む個々の金属の添加ではこの効果はなかった。我々は、メトロニダゾールの還元に寄与する酵素活性には、複数の金属補酵素が必要であると仮定している。メトロニダゾールの還元に寄与するとされる酵素の中には、PFORのように鉄の補酵素のみを必要とするものもあるが、ヒドロゲナーゼのように鉄とニッケルの補酵素を必要とするものもあり、この仮説が支持される[20,21,39,57]。別の仮説として、メトロニダゾールを還元する酵素が必要とする主要な補酵素は鉄であるが、鉄と他の二価金属の相互調節により、鉄と非鉄の二価金属の両方がこれらの酵素の転写調節に関与していると考えられる。黄色ブドウ球菌では、亜鉛と鉄の飢餓応答のクロスレギュレーションが証明されている[58]。
私たちが提案するメトロニダゾールの保護機構は、D. pigerやC. difficile以外にも示唆を与えている。D. pigerの他にも、硫化水素を生成することができる複数の常在種が存在する [59] 。これらの種は、同様のメカニズムでC. difficileのメトロニダゾールMICを増加させる可能性がある。C. difficile以外にも、メトロニダゾールは嫌気性細菌感染症の治療に広く使われている抗生物質であり[19]、硫化水素生産菌が二価金属の隔離を介してメトロニダゾールの作用から他の病原体を守る可能性が示唆されている(S14図)。
大腸の硫化物濃度の推定値(10-3Mの範囲[60,61])は、生物学的利用可能な鉄の推定値(糞便濃度に基づいて約10-3M、30%が生物学的利用可能な形で存在すると推定[62,63])より高い。硫化物の過剰は、生理的濃度の鉄が結腸内の硫化物によって沈殿している可能性を示唆している。しかし、C. difficile感染時には、上皮細胞の損傷によりヘムが環境中に放出され [64] 、利用可能な鉄が増加するため、鉄濃度は大きく変化する。しかし、宿主の免疫システム [65] による金属封鎖は、同時に利用可能な鉄を減少させる可能性があります。したがって、哺乳類の腸内感染における生物学的利用可能な金属プールに対する硫化物の効果は不明である。今後の研究では、マウス腸内感染モデルにおいて、C. difficileのメトロニダゾール感受性に対する硫化水素の影響を調べることができる。もしこのメカニズムがin vivoでも持続するのであれば、メトロニダゾール治療中に食事性タンパク質を減らすことが考えられる。食事性タンパク質を減らすと、腸内細菌叢による硫化水素生産が減少することが示されている[60,66]。
我々は、特徴付けられたコミュニティの約半数において、C. difficileのsubMIC応答における変化を観察した(図3Bおよび3E)。私たちのCFU実験は、一部の条件における増殖の促進が、C. difficileの存在量の変化によって説明できることを示した(S2DおよびS4 Figs)。このことは、OD600法に基づき観察されたC. difficile増殖増強の何割かが、細胞形態の変化による影響を受けている可能性を排除するものではない。とはいえ、感受性競合菌による生物学的阻害の程度と、サブインヒビター抗生物質濃度における焦点株成長促進との間の関係は、我々の計算モデルにおいて一貫している。このモデルは、細胞形態の変化を捉えていませんが、C. difficileの成長促進における全体的な傾向を再現することができます(図4)。
サブMICで観察されたC. difficileの増殖促進は、抗生物質に感受性のある競争相手を排除した後に耐性種が拡大するという、競争的放出の生態学的原則の一例です [28]。競争的放出は、嚢胞性線維症による肺感染症の10人のモデルコミュニティ[29]、2人と4人のビール工場コミュニティ[14]でこれまでに観察されています。ここでは、一対一の相互作用と多種の群集の両方における競争的解放と、ヒトの主要な腸内病原体C. difficileの増殖への影響について系統的に研究した。その結果、焦点となる菌株の成長促進の大きさは、生物学的阻害の程度に依存することが示された(図3Dおよび図3F)。さらに、耐性阻害物質が、抗生物質に敏感な生物学的阻害物質による増殖促進を抑制できることも示しました(図3D、3F、S7A、S7B)。さらに、我々の計算モデルにより、subMICの成長促進を促す一般的な生態学的原理が明らかになり、これは他の抗生物質処理された群集に適用することが可能である。
この結果は、ヒトの腸内細菌叢のような高濃度群集において、耐性阻害物質が存在しない場合、亜抑制濃度の抗生物質の存在下で病原体の増殖促進が起こりうることを示唆しています。メトロニダゾールおよびバンコマイシンの大腸内濃度は、糞便濃度に基づいて推定されている。したがって、これらの抗生物質の抑制下濃度が大腸で発生するかどうかは不明である。糞便濃度に基づき、メトロニダゾール治療中にC. difficileが抑制下濃度に遭遇する可能性が示唆されている [67] 。抑制下濃度でのC. difficileや他の病原体の成長促進を避けるために、抗生物質治療を、病原体の成長促進を抑制するための耐性生物阻害剤のカクテルからなる細菌治療薬と組み合わせることができる。耐性常在菌のこのような利点は、以前に示唆されている[68]。我々のデータは、バンコマイシン治療の場合、Bacteroides thetaiotaomicronとPrevotella copriは、すべての抗生物質濃度においてコミュニティ内のC. difficileを阻害する耐性生物学的阻害剤であるため、このようなカクテルに適していることを示している(S5A Fig)。病原体を特異的に阻害するナロースペクトル抗生物質や選択的バクテリオファージ[69]の使用も、生物学的競合相手の混乱を最小限に抑えることで、サブMICにおける病原体の成長促進のリスクを減らすことができる。
全体として、抗生物質存在下でC. difficileの増殖促進をもたらす2つのクラスの相互作用が見出されました。これらの結果は、C. difficileを抗生物質に感作する相互作用の発見が困難であることを示唆している。したがって、将来的には、C. difficileを抗生物質に感作する相互作用とは対照的に、抗生物質に耐性を持つヒト腸内細菌の多様な種[4]によるC. difficileの強い生物的競合を利用した生態学情報に基づく治療戦略が考えられます。
方法
菌株および培養情報
本研究で使用した菌株の情報は、S5 Tableに記載されている。各菌株の単回使用グリセロールストックは、以前に記載したように作成した[70]。すべての培養は、2.5 ± 0.5% H2、15 ± 1% CO2、バランスN2(Coy Lab製品)の雰囲気を持つ嫌気性チャンバー内の嫌気性Basal Broth(ABB, Oxoid)中で行った。スターター培養は、100μLの単回使用グリセロールを5mLのABBに接種することで調製した。D. pigerスターター培養液は、28mM乳酸ナトリウム(Sigma-Aldrich)および2.7mM硫酸マグネシウム(Sigma-Aldrich)を添加した。E. rectaleのスターターカルチャーは、33mMの酢酸ナトリウム(Sigma-Aldrich)を添加した。実験セットアップ時に生物が同様の成長段階にあることを確認するため、生物の成長速度に応じて、スターター培養物を16時間または41時間前に接種した(S5表参照)。培養液は37℃で振盪せずにインキュベートした。
抗生物質滴定
抗生物質感受性は、Clinical and Laboratory Standards Institute protocol for antibiotic susceptibility of monospecies anaerobic organisms [26]に従って測定し、この方法を多種の生物群集に適用するために修正した。また,Bacteroides属の菌が含まれ,Broth Microdilution法が推奨されているため,すべての条件下でBroth Microdilution法を使用するように変更された.また、ABB培地を使用することで、すべての群集の増殖をサポートするように変更した。最後に、この条件では複数の種が含まれていたため、光学密度と16S rRNAシーケンスからの相対量の積として種の絶対量を決定するようにプロトコルを変更した。
メトロニダゾール(Sigma-Aldrich M1547)およびバンコマイシン(Sigma-Aldrich V1130)の1 mg/mLのストックを水で作り、0.2 μMフィルターでフィルター滅菌し、単回使用のアリコートとして-20℃で保存した。ストックを2倍希釈系列で10×所望の濃度で希釈した。96枚の深井戸プレートのABBに培養液を接種した。単一種はOD600が0.0022になるように接種した。ペアは、C. difficileは0.00022、その他の種は0.00198のOD600で開始した。多種のコミュニティは、OD600が0.0066、均等性が1になるように接種した。接種後すぐに、10×抗生物質希釈シリーズをコミュニティ内で1:10に希釈した。プレートをガス透過性シール(Breathe-Easy)で覆い、37℃で振盪させずにインキュベートした。
48時間後、培養液をピペッティングで混合し、200μLのアリコートをシーケンスとOD600の測定用に取り出した。シーケンス用アリコートを1,739gで15分間スピンダウンした後、上清を除去し、ペレットを-80℃で保存した。各サンプルの2希釈液についてOD600を測定し、装置(Tecan Infinite Pro 200)の線形範囲内の希釈液を選択し、16S rRNA配列決定を行い、以下に記載するように相対存在量を決定した。種の絶対量は、各種の相対量にコミュニティOD600を乗じることで算出した。MICは、1標本t検定により決定された、0.05 OD600または5,000 CFU/mLよりも有意に少ない(p < 0.05)生物の成長を制限する、それ以上のすべての濃度の最低濃度として定義されました。
コミュニティ組成の決定
DNA抽出、ライブラリー調製、およびシーケンシングは、以前に説明したように実施した[4]。簡単に言うと、細胞ペレットは、96ウェルプレート用に修正したグラム陽性リゾチーム前処理を伴うQiagen DNEasyプロトコルを使用してゲノム抽出された。ゲノムDNAを水中で2ng/μLに標準化し、96ウェルプレートに配列されたデュアルインデックスプライマーを用いて、16S v3-v4領域を増幅させた。サンプルはDNA Clean and Concentrator kit(Zymo)で洗浄し、Illumina MiSeqで配列決定した。
シーケンスデータは、以前に記述したように解析した[4]。簡単に説明すると、リードはBasespace FastQ Generationでデマルチプレックスされ、ペアエンドはPEAR v0.90 [71]でマージされ、ブートストラップカットオフ値60%のWang法でmothur v1.40.5 command classify.seqsを用いて我々の種のカスタムデータベースにマッピングされた [72]. 生物の相対的存在量は、その生物にマッピングされたリードの数をそのサンプルのリードの総数で割ることによって計算された。絶対量は、相対量にそのサンプルのOD600を乗じることによって計算された。リードの1%以上がサンプルに含まれないと予想される生物種にマッピングされた場合(汚染を示す)、サンプルはさらなる分析から除外されました。
C. difficileコロニー形成単位カウント
C. difficile選択プレートは、C. difficile寒天(Oxoid CM0601)をオートクレーブし、培地を55℃に冷却した後に馬血(Lampire 7233401、70 mL/1L培地)、ノルフロキサシン(サンタクルーズ215586、120 μg/mL)、モキサラクタム(サンタクルーズ250419、320 μg/mL)およびエリスロマイシン(サンタクルーズ204742、100 μg/mL)を加えて作成しました。48時間のインキュベーション後、培養物を混合し、PBSに希釈した。各サンプルの4希釈液をC. difficile選択寒天プレートにスポットし、サンプルごとに2テクニカルレプリケートとした。プレートは37℃で48時間培養し、その時点で、5~50個のコロニーを含む希釈スポットのコロニーをカウントした。各サンプルのCFU/mLは、2つのテクニカルレプリケートの平均値に希釈倍率をかけた値として計算されました。このアッセイの検出下限は5,000 CFU/mLであった。
抗生物質摂動による一般化ロトカ=ボルテラモデル
一般化 Lotka-Volterra モデル [30] の抗生物質摂動拡張は,N 連立一階常微分方程式 (Eq 1) のセットである.
ここで、Nは種の数、Xiは種iの存在量、riは種iの基礎成長率、αijは種jによる種iの成長修正、Xjは種jの存在量である。パラメータαijはi = jのときに負となるように制約され、種内競争を表す。抗生物質の項では、Biは抗生物質に対する種iの感受性であり、aは抗生物質の濃度である。抗生物質の濃度を時間的に一定に修正するようにモデルを修正する。
成長率パラメータriと相互作用パラメータaijの値は、我々の以前の研究[4]から得たものである。抗生物質感受性パラメータBiの値は、本研究では、カスタムPythonスクリプトを使用して、単一種の抗生物質滴定の時系列測定から推論したものである。Scipyのoptimizeパッケージのminimize関数を使用して、滴定におけるすべての抗生物質濃度にわたって抗生物質gLVモデルと時系列測定値の間のコストが最も低くなる、各種xiの最適Biを決定した。抗生物質濃度は0から1の範囲になるようにスケーリングした。最適化におけるコストは、ODEソルバーで各抗生物質条件における種の存在量をシミュレーションし、各抗生物質濃度における各時点でのシミュレーションにおける種の存在量とデータにおける種の存在量の間の平均二乗誤差を合計することによって計算された。
ヌル計算モデルの開発
ヌルモデル1(以下、「gLV」)は、一般化ロトカ=ボルテラモデルである。これは、抗生物質の項を除いた抗生物質摂動付き一般化Lotka-Volterraモデル(Eq 1)と同じものである。これは、すべての種の抗生物質感受性をゼロ(感受性なし)に設定した抗生物質摂動付き一般化ロトカ・ヴォルテラと考えることもできる。ヌルモデル1は、すべての種についてBi=0とした式1である。
Null model 2(「gLV + shuffled antib. suscept.」)は、抗生物質感受性パラメータをシャッフルした抗生物質摂動を伴う一般化Lotka-Volterraモデル(Eq 1)です。メトロニダゾール条件では、14個のメトロニダゾール感受性パラメータをシャッフルし、バンコマイシン条件では、14個のバンコマイシン感受性パラメータをシャッフルした(種iのシャッフルしたBiは、14種のうちいずれか1種のシャッフルしていないBと等しい)。Null モデル 2 の精度は、シャッフルされたパラメータの 1,000 セットで平均化された。C. difficileのシャッフルされたBとC. difficileのシャッフルされていないBとの間の距離は、シャッフルされたBCDとシャッフルされていないBCDとの間の差の絶対量として計算されました。
Null model 3("gLV + monosp. Antib. Susceptibility, aijs = 0")は、種間相互作用のない抗生物質摂動(Eq 1)による一般化Lotka-Volterraモデルである。ヌルモデル3は、すべてのj!=iについてαij=0としたEq1である。
使用済み培地の調製
D. pigerスターター培養物を48時間培養した後、OD600が0.0022になるようにABBに希釈した。培養物は、37℃で振盪せずにインキュベートした。インキュベーション後、培養物を1,739gで15分間スピンダウンした。上清を除去し、Steriflip 0.2μMフィルターでフィルター滅菌した。
メトロニダゾールインキュベーション実験
D. pigerの使用済み培地を上記の手順で調製した。メトロニダゾールのアリコートをD. piger使用済み培地またはリッチ培地(ABB)中で37℃にてインキュベートした。12時間の培養後、培養したメトロニダゾールを、上述の抗生物質滴定法に従って、新鮮な培地(ABB)のC. difficile培養物に希釈した。
鉄-硫黄クラスター予測
C. difficile R20291参照ゲノム(GenBank assembly accession GCF_000027105.1)からのタンパク質FASTA配列は、Metal Predator web-server [31]で実行しました。
金属の定量と補充
新鮮な培地(Anaerobic Basal Broth)中の金属量は、Wisconsin State Lab of HygieneによってInductively Coupled Plasma Mass Spectroscopyを介して分析された。
金属補給実験では、上清に硫酸鉄(II)(Alfa Aesar)、硫酸マンガン(II)一水和物(Sigma-Aldrich)、硫酸ニッケル(II)六水和物(Sigma-Aldrich)、硫酸亜鉛(II)ヘプタヒドレート(Alfa Aesar)、および/または塩化コバルト(II)六水和物(Sigma-Aldrich)が補給されました。金属化合物は、水中で100×ストックとして調製し、0.2μMフィルターでフィルター滅菌した。
硫化水素の定量化
硫化水素は、Cline Assayを使用して定量した。アッセイを行う直前に、硫化ナトリウム(Alfa Aesar)を窒素パージした水に加え、密閉したバイアルに入れた。その後、このストックを1%酢酸亜鉛で1mMに希釈し、さらに1%酢酸亜鉛で希釈して所望の濃度にし、標準曲線を作成した。試料は嫌気槽から取り出し、直ちに1%酢酸亜鉛に5倍希釈した。あらかじめCline試薬(1.6 g N,N-dimethyl-p-phenylenediamine sulfate (Acros Organics), 2.4 g iron (III) chloride (Spectrum Chemical), 50 mL concentrated hydrochloric acid, 50 mL water, stored in the dark)を用意し、3 μLを標準試料とサンプルに添加した。サンプルはピペットで混合し、暗所で20分間インキュベートした後、670nmで吸光度を測定した。サンプルが細胞を含む場合は、インキュベーション後、サンプルを1,739 gで10分間スピンダウンし、上清を新しいプレートに移し、OD670を測定した。
全ゲノムトランスクリプトミクス
D. pigerの使用済み培地は、上記の手順で調製した。C. difficileとD. pigerのスターターカルチャーを48時間培養し、C. difficileの単培養条件とCD-DP共培養条件をスターターカルチャーから96ディープウェルプレートに接種した。単培養条件では、C. difficileはOD600が0.0022となるように接種した。CD-DP共培養では、C. difficileはOD600が0.0022に、D. pigerはOD600が0.0198になるように接種した。接種後すぐに、抗生物質を10×抗生物質ストックの1:10希釈液として添加した。プレートをガス透過性シール(BreathEasy)で覆い、37℃で無振動でインキュベートした。14時間後、800μLのRNAprotect(Qiagen)を400μLの培養物に加え、その後培養物をピペッティングで混合し、室温で5分間インキュベートした。その後、培養液を室温で1,739g、10分間遠心分離し、上清を注意深く取り除いた。ペレットは-80℃で保存した。
RNAは酸性フェノールビーズビート法を用いて抽出した。ペレットを500μLの2×Buffer B(200mM塩化ナトリウム、20mMエチレンジアミン四酢酸)に再懸濁し、500μL Phenol:Chloroform:IAA (125:24:1, pH 4.5) および210μL 20%ドデシル硫酸ナトリウムを含む2mLマイクロ遠沈管に移し、酸洗浄ビーズ(Sigma G1277)で3分間ビーズビート処理した。すべての溶液はRNAseフリーであった。サンプルを4℃で5分間、8,000rpmで遠心分離し、上水相600μLを60μL 3M酢酸ナトリウムと660μL冷イソプロパノールに加え、氷上で5分間冷却してから-80℃で5分間冷凍保存した。サンプルを4℃で18,200g、15分間遠心分離し、上清をデカンテーションし、ペレットを冷たい100%エタノールで洗浄した。ペレットをバイオセーフティキャビネットで10分間乾燥させ、100μLのRNAseフリー水に再懸濁した。サンプルはRNeasy Mini Kit(Qiagen)を用いて精製し、ゲノムDNAはRNAse-Free DNase Set(Qiagen)を用いて除去した。各条件の2つのレプリケートは、配列決定のためにGENEWIZ(米国ニュージャージー州)へ送られた。GENEWIZは、NEBNext Ultra RNA Library Prep(NEB)を用いたcDNAライブラリー調製の前に、Ribozero rRNA Removal Kit(Illumina)を用いてrRNAを枯渇させた。GENEWIZは、ライブラリをIllumina HiSeqで配列決定しました。データは、イルミナのbcl2fastq 2.17ソフトウェアを用いてデマルチプレックスされ、インデックス配列の識別のために1つのミスマッチが許容された。
データはFastQCを使用して品質チェックされた。BBToolsスイートのBBDuk、BBSplit、およびBBMapツールを使用して、アダプターをトリミングし、rRNAを除去し、残りのmRNAリードを参照ゲノム(C. difficile: GenBank assembly accession GCF_000027105.1. D. piger: Genbank assembly accession GCA_000156375.1) にマッピングした。ゲノム上の特徴にリードをマッピングするためにFeatureCountsを使用した。Reads per kilobase million (RPKM)の値は、カスタムpythonスクリプトを使用して計算した。DESeq2 Bioconductor library v4.0.3 を R v4.0.4 で使用し、apeglm shrinkage estimator を用いた負の二項一般化線形モデルで遺伝子発現の差分を定量した。C. difficile-D. piger共培養におけるC. difficile遺伝子のRPKMを算出する際、分母の「reads mapped」はC. difficileゲノムにマッピングされたリードの数である。同様に、C. difficile-D. piger共培養におけるC. difficile遺伝子の差分遺伝子発現を定量する場合、C. difficileゲノムにマップされたリードのみがDeSeq2に提供された。
リアルタイム定量逆転写PCR (qRT-PCR)
C. difficile培養液はトランスクリプトームサンプルと同じように調製し、同じ時間(14時間)インキュベートした。RNAはトランスクリプトームサンプルと同じ方法で抽出し、RNeasy Mini Kit (Qiagen)を用いて精製した。ゲノムDNAはRNAse-Free DNase Set (Qiagen)を用いて除去した。iScript Select cDNA Synthesis Kit(Bio-rad)を用いて、1ugのtotal RNAでcDNA合成を実施した。SsoAdvanced Universal SYBR Green SuperMix(Bio-rad社製)を用いてqRT-PCR(Bio-rad CFX Connect)を実施した。fldX、feoB1、zupT、rrs遺伝子のプライマーは既報のものを使用した[32,73]。2-ΔΔCt法[74]を用いて、ここで、フォールド変化を計算した:
ここで、「targ」は標的遺伝子fldX、feoB1、またはzupTを指し、rrsは参照遺伝子を指す[73]。Sampleは培地の種類を意味する。Ctcontrolのコントロール条件として、新鮮な培地を使用した。各Ct値は3テクニカルレプリケートの平均値である。
遺伝子セット濃縮解析
GSEA は、ClusterProfiler R package (v4.2.2) の GSEA 法を用いて行った[75]。C. difficile R20291のKEGGモジュール(KEGG T番号T00998)を遺伝子セットとして使用し、TERM2GENEフィールドを持つユーザー定義のアノテーションとして供給された。解析は、DeSeq2で算出したlog2FCで実行した。使用したp値カットオフは0.05、使用した最小遺伝子セットサイズは3であった。
参考情報
謝辞
参考文献
1.Buffie CG, Pamer EG. 腸内病原体に対する微生物叢を介したコロニー形成抵抗性。Nat Rev Immunol. 2013;13:790-801. doi: 10.1038/nri3535. pmid:24096337.
2.Brown KA, Khanafer N, Daneman N, Fisman DN. 抗生物質と市中感染型クロストリジウム・ディフィシル感染症のリスクに関するメタアナリシス。Antimicrob Agents Chemother. 2013;57:2326-2332. doi: 10.1128/AAC.02176-12. pmid:23478961.
3.Dowle C. Faecal microbiota transplantation: a review of FMT as an alternative treatment for Clostridium difficile infection. Biosci Horizons Int J Student Res. 2016;9:hzw007.
4.Hromada S, Qian Y, Jacobson TB, Clark RL, Watson L, Safdar N, et al. Negative interactions determine Clostridioides difficile growth in synthetic human gut communities. Mol Syst Biol. 2021;17:e10355. doi: 10.15252/msb.202110355. pmid:34693621
5.Schubert AM, Rogers MAM, Ring C, Mogle J, Petrosino JP, Young VB, et al. Microbiome data distinguish patients with Clostridium difficile infection and non-C. difficile-associated diarrhea from healthy control. MBio. 2014;5:e01021-e01014. doi: 10.1128/mBio.01021-14. pmid:24803517.
6.Buffie CG, Bucci V, Stein RR, McKenney PT, Ling L, Gobourne A, et al. Precision microbiome reconstitution restores bile acid mediated resistance to Clostridium difficile. Nature. 2015;517:205-208. doi: 10.1038/nature13828. pmid:25337874.
7.Ferreyra JA, Wu KJ, Hryckowian AJ, Bouley DM, Weimer BC, Sonnenburg JL. 腸内細菌叢が産生するコハク酸は、抗生物質治療または運動障害後にC. difficile感染を促進する。Cell Host Microbe. 2014;16:770-777. doi: 10.1016/j.chom.2014.11.003. pmid:25498344.
8.Smith AL, Fiel SB, Mayer-Hamblett N, Ramsey B, Burns JL. 緑膿菌分離株の感受性試験と非経口的抗生物質投与に対する臨床的反応: 嚢胞性線維症における関連性の欠如:Chestic Fibrosis. Chest. 2003;123:1495-1502. doi: 10.1378/chest.123.5.1495. pmid:12740266.
9.Bottery MJ, Pitchford JW, Friman V-P. 細菌群集における抗菌薬耐性の生態と進化。ISME J. 2021;15:939-948. doi: 10.1038/s41396-020-00832-7. pmid:33219299
10.Perlin MH, Clark DR, McKenzie C, Patel H, Jackson N, Kormanik C, et al. Otherwise lethal drug concentrations in the presence of ampicillin-resistant Escherichia coliによるサルモネラの保護.Proceedings Biol Sci. 2009;276:3759-3768.
11.Adamowicz EM, Muza M, Chacón JM, Harcombe WR. Cross-feeding modulates the rate and mechanism of antibiotic resistance evolution in a model microbial community of Escherichia coli and Salmonella Enterica. PLoS Pathog. 2020;16:e1008700. doi: 10.1371/journal.ppat.1008700. pmid:32687537.
12.de Vos MGJ, Zagorski M, McNally A, Bollenbach T. Interaction networks, ecological stability, and collective antibiotic tolerance in polymicrobial infections. Proc Natl Acad Sci U S A. 2017;114:10666-10671. doi: 10.1073/pnas.1713372114. pmid:28923953.
13.Aranda-Díaz A, Obadia B, Dodge R, Thomsen T, Hallberg ZF, Güvener ZT, et al. Bacterial interspecies interactions modulate pH-mediated antibiotic tolerance. Elife. 2020;9:e51493. doi: 10.7554/eLife.51493. pmid:31995029
14.Parijs I, Steenackers HP. 競争的な種間相互作用が、多種の醸造所バイオフィルムにおける抗菌剤耐性の向上の根底にある。ISME J. 2018;12:2061-2075. doi: 10.1038/s41396-018-0146-5. pmid:29858577
15.Dalton T, Dowd SE, Wolcott RD, Sun Y, Watters C, Griswold JA, et al. An In Vivo Polymicrobial Biofilm Wound Infection Model to Study Interspecies Interactions. PLoS ONE. 2011;6:e27317. doi: 10.1371/journal.pone.0027317. pmid:22076151.
16.Klümper U, Recker M, Zhang L, Yin X, Zhang T, Buckling A, et al. 抗菌薬耐性の選択は、自然の微生物群に組み込まれると減少する. ISME J. 2019;13:2927-2937. doi: 10.1038/s41396-019-0483-z. pmid:31384011.
17.Aranda-Díaz A, Ng KM, Thomsen T, Real-Ramírez I, Dahan D, Dittmar S, et al. 腸内細菌叢をモデル化する安定で多様な糞便由来in vitro微生物コミュニティの確立と特徴づけ. Cell Host Microbe. 2022;30:260-272.
18.Butler MS, Hansford KA, Blaskovich MAT, Halai R, Cooper MA. グリコペプチド系抗生物質: バック・トゥ・ザ・フューチャー。J Antibiot (Tokyo). 2014;67:631-644. doi: 10.1038/ja.2014.111. pmid:25118105.
19.Löfmark S, Edlund C, Nord CE. Metronidazole Is Still the Drug of Choice for Treatment of Anaerobic Infections. Clin Infect Dis. 2010;50:S16-S23. doi: 10.1086/647939. pmid:20067388
20.Church DL, Rabin HR, Lalshley EJ. メトロニダゾールの還元におけるclostridium pasteurianumのhydrogenase 1の役割。Biochem Pharmacol. 1988;37:1525-1534. doi: 10.1016/0006-2952(88)90014-7. pmid:3282518.
21.Diniz CG, Farias LM, Carvalho MAR, Rocha ER, Smith CJ. Bacteroides fragilisメトロニダゾール耐性変異体における遺伝子発現の差違。J Antimicrob Chemother. 2004;54:100-108. doi: 10.1093/jac/dkh256. pmid:15150173.
22.Leitsch D, Kolarich D, Binder M, Stadlmann J, Altmann F, Duchêne M. Trichomonas vaginalis: metronidazole and other nitroimidazole drugs are reduced by the flavin enzyme thioredoxin reductase and disrupt the cellular redox system. ニトロイミダゾールの毒性および耐性への示唆。Mol Microbiol. 2009;72:518-536. doi: 10.1111/j.1365-2958.2009.06675.x. pmid:19415801
23.Johnson S, Lavergne V, Skinner AM, Gonzales-Luna AJ, Garey KW, Kelly CP, et al. 米国感染症学会(IDSA)および米国医療疫学学会(SHEA)による臨床実践ガイドライン:2021 Focused Update Guidelines on Management of Clostridioides difficile Infection in Adults. Clin Infect Dis. 2021;73:e1029-e1044. doi: 10.1093/cid/ciab549. pmid:34164674
24.McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66:e1-e48. doi: 10.1093/cid/cix1085. pmid:29462280
25.Darling AE, Jospin G, Lowe E, Matsen FA IV, Bik HM, Eisen JA. PhyloSift:ゲノムとメタゲノムの系統解析。PeerJ. 2014;2:e243. doi: 10.7717/peerj.243. pmid:24482762.
26.CLSI. 嫌気性菌の抗菌薬感受性試験方法。承認された標準。CLSI Doc. 2018:M11-A9.
27.Paterson IK, Hoyle A, Ochoa G, Baker-Austin C, Taylor NGH. 細菌感染症を治療するための抗生物質使用量の最適化(Optimising Antibiotic Usage to Treat Bacterial Infections). Sci Rep. 2016;6:37853. doi: 10.1038/srep37853. pmid:27892497.
28.de Roode JC, Culleton R, Bell AS, Read AF. Plasmodium chabaudi混合感染症の薬物治療後の薬剤耐性の競合的な放出。マラーJ. 2004;3:33. doi: 10.1186/1475-2875-3-33. pmid:15367331
29.Varga JJ, Zhao CY, Davis JD, Hao Y, Farrell JM, Gurney JR, et al. Antibiotics Drive Expansion of Rare Pathogens in a Chronic Infection Microbiome Model. mSphere 2022;7:e00318-22. doi: 10.1128/msphere.00318-22.pmid:35972133
30.Stein RR, Bucci V, Toussaint NC, Buffie CG, Rätsch G, Pamer EG, et al. Time-Series Inferenceからの生態学的モデリング: Insight into Dynamics and Stability of Intestinal Microbiota(腸内細菌叢の動態と安定性に関する洞察)。PLoS Comput Biol. 2013;9:31-36. doi: 10.1371/journal.pcbi.1003388. pmid:24348232.
31.Valasatava Y, Rosato A, Banci L, Andreini C. MetalPredator: a web server to predict iron-sulfur cluster binding proteomes. Bioinformatics. 2016;32:2850-2852. doi: 10.1093/bioinformatics/btw238. pmid:27273670
32.Ho TD, Ellermeier CD. Clostridium difficileにおける推定鉄獲得システムのFerric uptake regulator fur control of putative iron acquisition systems. J Bacteriol. 2015;197:2930-2940. doi: 10.1128/JB.00098-15. pmid:26148711.
33.Lau CKY, Krewulak KD, Vogel HJ. バクテリアの第一鉄輸送:Feoシステム. FEMS Microbiol Rev. 2016;40:273-298. doi: 10.1093/femsre/fuv049. pmid:26684538.
34.Hastie JL, Hanna PC, Carlson PE. 低鉄条件に対するClostridium difficileの転写応答。Pathog Dis. 2018;76:fty009. doi: 10.1093/femspd/fty009. pmid:29390127.
35.Berges M, Michel A-M, Lassek C, Nuss AM, Beckstette M, Dersch P, et al. Clostridioides difficileにおける鉄の制御. Front Microbiol. 2018;9:3183. doi: 10.3389/fmicb.2018.03183. pmid:30619231.
36.Lopez CA, Beavers WN, Weiss A, Knippel RJ, Zackular JP, Chazin W, et al. The Immune Protein Calprotectin Impacts Clostridioides difficile Metabolism through Zinc Limitation. MBio. 2019;10:e02289-e02219. doi: 10.1128/mBio.02289-19. pmid:31744916.
37.ヨッチDC、バレンタインRC. バクテリアのフェレドキシンとフラボドキシン。Annu Rev Microbiol. 1972;26:139-162. doi: 10.1146/annurev.mi.26.100172.001035. pmid:4562807
38.Dobbek H, Svetlitchnyi V, Gremer L, Huber R, Meyer O. 一酸化炭素脱水素酵素の結晶構造から[Ni-4Fe-5S]クラスターを見出した。Science. 2001;293:1281-1285.
39.Shafaat HS, Rüdiger O, Ogata H, Lubitz W. [NiFe] ヒドロゲナーゼ: 多様な条件下での水素代謝に共通する活性部位。Biochim Biophys Acta-Bioenerg. 2013;1827:986-1002. doi: 10.1016/j.bbabio.2013.01.015. pmid:23399489.
40.Constanze P, Gary SR, Valley S. Anaerobic Formate and Hydrogen Metabolism. エコサル・プラス. 2016:7.
41.Aditi D, Xiaoqian W, Wenwen H, Palmer KL, Hurdle JG. Clostridioides difficileにおけるメトロニダゾールに対する染色体耐性は、鉄ホメオスタシスと酸化還元酵素の間のエピスタシスによって媒介され得る。Antimicrob Agents Chemother. 2020;64:e00415-e00420. doi: 10.1128/AAC.00415-20. pmid:32457109.
42.Chong PM, Lynch T, McCorrister S, Kibsey P, Miller M, Gravel D, et al. Proteomic Analysis of a NAP1 Clostridium difficile Clinical Isolate Resistant to Metronidazole. PLoS ONE. 2014;9:e82622. doi: 10.1371/journal.pone.0082622. pmid:24400070.
43.Boekhoud IM, Hornung BVH, Sevilla E, Harmanus C, Bos-Sanders IMJG, Terveer EM, et al. Plasmid-mediated metronidazole resistance in Clostridioides difficile. Nat Commun. 2020;11:598. doi: 10.1038/s41467-020-14382-1. pmid:32001686.
44.Smiley JD, Ashwell G. Uronic Acid Metabolism in Bacteria: III. エシェリヒア・コリにおけるd-アルトロニック・アシッドおよびd-マンノニック・アシッド・デヒドラセスの精製と特性(PURIFICATION AND PROPERTIES OF d-ALTRONIC ACID AND d-MANNONIC ACID DEHYDRAS IN ESCHERICHIA COLI. J Biol Chem. 1960;235:1571-1575.
45.Lynch T, Chong P, Zhang J, Hizon R, Du T, Graham MR, et al. 安定したメトロニダゾール耐性Clostridium difficile臨床分離株の特性. PLoS ONE. 2013;8:e53757. doi: 10.1371/journal.pone.0053757. pmid:23349739.
46.Dreyer JL. マンノニック酸およびアルトロン酸ヒドラターゼ、2つの鉄を必要とする加水分解酵素の活性化における鉄の役割。Eur J Biochem. 1987;166:623-630. doi: 10.1111/j.1432-1033.1987.tb13559.x. pmid:3038546.
47.Loubinoux J, Valente FMA, Pereira IAC, Costa A, Grimont PAD, Le Faou AE. Desulfomonas属の唯一の種であるDesulfomonas pigraをDesulfovibrio piger comb. novとして再分類する。 Int J Syst Evol Microbiol. 2002;52:1305-1308. doi: 10.1099/00207713-52-4-1305. pmid:12148644.
48.Loubinoux J, Bronowicki J-P, Pereira IAC, Mougenel J-L, Le Faou AE. ヒト糞便中の硫酸還元菌と炎症性腸疾患との関連性。FEMS Microbiol Ecol. 2002;40:107-112. doi: 10.1111/j.1574-6941.2002.tb00942.x. pmid:19709217
49.Azabou S, Mechichi T, Sayadi S. 重金属耐性硫酸還元細菌がリンゴ石膏を硫酸源として濃縮することによる亜鉛の沈殿。Miner Eng. 2007;20:173-178.
50.Foucher S, Battaglia-Brunet F, Ignatiadis I, Morin D. Chessy酸性鉱山排水の硫酸還元細菌による処理と金属回収。Chem Eng Sci. 2001;56:1639-1645.
51.Dubois T, Dancer-Thibonnier M, Monot M, Hamiot A, Bouillaut L, Soutourina O, et al. Clostridium difficile Physiopathology in Response to Cysteine Availabilityの制御. Infect Immun. 2016;84:2389-2405. doi: 10.1128/IAI.00121-16. pmid:27297391.
52.Eze P, Balsells E, Kyaw MH, Nair H. Clostridium difficile infections-an overview of the evidence base and challenges in data synthesis. J Glob Health. 2017;7:10417. doi: 10.7189/jogh.07.010417. pmid:28607673.
53.Bolton RP, Culshaw MA. クロストリジウム・ディフィシルによる抗生物質関連大腸炎に対する経口療法および静脈内療法中の糞便メトロニダゾール濃度。Gut. 1986;27:1169 LP- 1172. doi: 10.1136/gut.27.10.1169. pmid:3781329.
54.Ezraty B, Barras F. The 'liaisons dangereuses' between iron and antibiotics. FEMS Microbiol Rev. 2016;40:418-435. doi: 10.1093/femsre/fuw004. pmid:26945776.
55.Müller M, Lindmark DG. トリコモナドおよびEntamoeba invadensにおける嫌気的および好気的条件下でのメトロニダゾールの取り込みとその生存率への影響。Antimicrob Agents Chemother. 1976;9:696-700. doi: 10.1128/AAC.9.4.696. pmid:1083712.
56.Boekhoud IM, Sidorov I, Nooij S, Harmanus C, Bos-Sanders IMJG, Viprey V, et al. Haem is crucial for medium-dependent metronidazole resistance in clinical isolates of Clostridioides difficile. J Antimicrob Chemother. 2021;76:1731-1740. doi: 10.1093/jac/dkab097. pmid:33876817.
57.Chabrière E, Charon M, Volbeda A, Pieulle L, Hatchikian EC, Fontecilla-Camps J. 嫌気性酵素ピルビン酸:フェレドキシン酸化還元酵素の結晶構造、フリーおよびピルビン酸との複合体。Nat Struct Biol. 1999;6:182-190. doi: 10.1038/5870.
58.Fojcik C, Arnoux P, Ouerdane L, Aigle M, Alfonsi L, Borezée-Durant E. FurとZurによるスタフィロピン生合成および輸送の独立した協調的制御。Mol Microbiol. 2018;108:159-177. doi: 10.1111/mmi.13927. pmid:29431891.
59.Wolf PG, Cowley ES, Breister A, Matatov S, Lucio L, Polak P, et al. ヒト腸内細菌叢における硫黄代謝遺伝子の多様性と分布、大腸がんとの関連。Microbiome. 2022;10:64. doi: 10.1186/s40168-022-01242-x. pmid:35440042
60.Magee EA, Richardson CJ, Hughes R, Cummings JH. 大腸における硫化物生成に対する食事性タンパク質の寄与:ヒトにおけるin vitroおよび対照摂食試験. Am J Clin Nutr. 2000;72:1488-1494. doi: 10.1093/ajcn/72.6.1488. pmid:11101476.
61.Deplancke B, Finster K, Graham WV, Collier CT, Thurmond JE, Gaskins HR. マウスにおける硫酸塩添加飲料水に対する胃腸および微生物の反応。Exp Biol Med. 2003;228:424-433. doi: 10.1177/153537020322800413. pmid:12671187.
62.Kortman GAM, Raffatellu M, Swinkels DW, Tjalsma H. Nutritional Iron turned inside out: intestinal stress from a gut microbial perspective. FEMS Microbiol Rev. 2014;38:1202-1234. doi: 10.1111/1574-6976.12086. pmid:25205464.
63.Lobo AR, Gaievski EHS, De Carli E, Alvares EP, Colli C. 貧血ラットのフラクトオリゴ糖と鉄のバイオアベイラビリティ:盲腸の鉄種分布、フェロポルチン-1発現、クリプト分岐およびクリプト細胞増殖への影響。Br J Nutr. 2014;112:1286-1295. doi: 10.1017/S0007114514002165. pmid:25192308.
64.Knippel RJ, Zackular JP, Moore JL, Celis AI, Weiss A, Washington MK, et al. HatRTによるヘムの感知と解毒はClostridium difficile感染時の病原性に寄与する。PLoS Pathog. 2018;14:e1007486. doi: 10.1371/journal.ppat.1007486. pmid:30576368
65.Zygiel EM, Nolan EM. 宿主防御タンパク質カルプロテクチンによる遷移金属セクレストレーション。Annu Rev Biochem. 2018;87:621-643. doi: 10.1146/annurev-biochem-062917-012312. pmid:29925260
66.Lobel L, Cao YG, Fenn K, Glickman JN, Garrett WS. Diet posttranslationally modifies the mouse gut microbial proteome to modulate renal function. Science. 2020;369:1518-1524. doi: 10.1126/science.abb3763. pmid:32943527.
67.Kuijper EJ, Wilcox MH. クロストリジウム・ディフィシル感染症の治療におけるメトロニダゾールの有効性の低下?Clin Infect Dis. 2008;47:63-65. doi: 10.1086/588294. pmid:18491959
68.Waldetoft KW, Sundius S, Kuske R, Brown SP. Commensals における抗生物質耐性の利点の定義と耐性最適化の範囲。MBio. 2022;14:e01349-e01322. doi: 10.1128/mbio.01349-22. pmid:36475750
69.Nale JY, Spencer J, Hargreaves KR, Buckley AM, Trzepiński P, Douce GR, et al. Bacteriophage Combinations Significantly Reduce Clostridium difficile Growth In Vitro and Proliferation In Vivo. Antimicrob Agents Chemother. 2016;60:968-981. doi: 10.1128/AAC.01774-15. pmid:26643348.
70.Clark RL, Connors BM, Stevenson DM, Hromada SE, Hamilton JJ, Amador-Noguez D, et al. 合成ヒト腸内細菌群の組み立てと酪酸産生の設計. Nat Commun. 2021;12:3254. doi: 10.1038/s41467-021-22938-y. pmid:34059668
71.Zhang J, Kobert K, Flouri T, Stamatakis A. PEAR: a fast and accurate Illumina Paired-End reAd mergeR. Bioinformatics. 2014;30:614-620. doi: 10.1093/bioinformatics/btt593. pmid:24142950
72.Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, et al. Introducing mothur: 微生物群集を記述し比較するためのオープンソース、プラットフォーム非依存、コミュニティ支援型ソフトウェア。Appl Environ Microbiol. 2009;75:7537-7541. doi: 10.1128/AEM.01541-09. pmid:19801464.
73.Metcalf D, Sharif S, Weese JS. 遺伝子発現の正規化のためのClostridium difficileの候補参照遺伝子の評価。Anaerobe. 2010;16:439-443. doi: 10.1016/j.anaerobe.2010.06.007. pmid:20599622.
74.Livak KJ, Schmittgen TD. Real-Time Quantitative PCRと2-ΔΔCT法を用いた相対的遺伝子発現データの解析. Methods. 2001;25:402-408.
75.Wu T, Hu E, Xu S, Chen M, Guo P, Dai Z, et al. clusterProfiler 4.0: オミックスデータを解釈するためのユニバーサルエンリッチメントツール。Innovation. 2021;2:100141. doi: 10.1016/j.xinn.2021.100141. pmid:34557778.
図を見る (7)
ビューリーダーコメント
View著者について
ビューメトリクス
Viewメディア掲載情報
記事をダウンロードする (pdf)
引用文献をダウンロードする
この記事をメールで送る
PLOSジャーナルPLOSブログ
トップページへ戻るトップページへ戻る
会社概要
フルサイト
フィードバック
連絡先
個人情報保護方針
ご利用規約
メディアからのお問い合わせ
PLOSは非営利の501(c)(3)法人で、#C2354500、米国カリフォルニア州サンフランシスコに本拠地を置いています。
この記事が気に入ったらサポートをしてみませんか?
