マリアナ海溝に生息する深海性バクテロイデーテス(Bacteroidetes)は、通常陸上系で見られるヘミセルロースとペクチンの分解に特化している
オープンアクセス
公開日: 2023年8月7日
マリアナ海溝に生息する深海性バクテロイデーテス(Bacteroidetes)は、通常陸上系で見られるヘミセルロースとペクチンの分解に特化している
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-023-01618-7

朱 暁宇, 李 楊, ...Jiwen Liu 著者を表示する
マイクロバイオーム第11巻、論文番号:175(2023) この記事を引用する
3 Altmetric
メトリクス詳細
要旨
背景
ハダルトレンチ(6000 m以上)は地球上で最も深い海洋領域であり、有機物の貯蔵庫でもある。しかしながら、これらの謎めいた微生物生態系がどのように燃料を供給されているのか、特に上方の光水性表層水からの沈着によって導入される複雑な多糖類の重要性がどの程度なのか、ほとんど分かっていない。表層水においてバクテロイデーテスは、様々な藻類由来の多糖類の循環と、光帯を介した炭素のフラックスの要となる分類群である。しかし、ハダル微生物ループにおける彼らの役割はほとんど知られていない。
研究結果
ここでは、マリアナ海溝水域におけるバクテロイデーテスの多様な多糖類異化の可能性を調べるために、培養依存的および培養非依存的な方法を用いた。表層水と比べて、深海底(1000-4000 m)とハダル(6000-10,500 m)では、メソフラビバクター(Mesoflavibacter)が4000 m以上で、バクテロイデス(Bacteroides)とプロボテラ(Provotella)が10,400-10,500 mで濃縮され、それぞれ異なるバクテロイデス属細菌群集を保有していた。さらに、これらの深海性細菌群集は、炭水化物活性酵素(CAZymes)をコードする異なる遺伝子プールを保有しており、これらの2つのゾーンで異なる多糖源が利用されていることが示唆された。深海のバクテロイデーテスは、表層のバクテロイデーテスと比較して、藻類/植物細胞壁多糖類(すなわち、ヘミセルロースとペクチン)を標的とする多糖類利用遺伝子座(PULs)に頻繁に組織化されるCAZyme遺伝子の著しい濃縮を示した。ハダールメソフラビバクター単離株(MTRN7)を用いて、このユニークな遺伝的可能性を機能的に検証した。MTRN7は、一般的に陸上植物や光栄養藻類に付随するペクチン性アラビナンを、模擬深海条件下で炭素源として利用することができた。興味深いことに、沿岸/陸上バクテロイデーテスから水平方向に獲得されたと考えられるPULが、アラビナン上での増殖中に活性化され、深海でアラビナンを加水分解する酵素をコードしていることが実験的に示された。
結論
我々の研究は、ハダルバクテロイデーテスは、拡大したCAZyme遺伝子プールを介して、表層個体群ではあまり利用されない多糖類を利用していることを示唆している。我々は、光帯で生成される沈降性細胞壁残骸が、ハダール従属栄養細菌にとって重要な炭素源となり、彼らの群集と代謝を形成する役割を果たすことを提案する。
ビデオ
はじめに
海洋の水柱は、表層(0-200 m)、中層(200-1000 m)、深層(1000-4000 m)、深海底(4000-6000 m)、そして深海底/ハダル(>6000 m)で構成されている。ハダル領域は、その極端な深さのため、地球上で最も探査されていない水生生物圏であり、ほとんど海溝のみで構成されている [1] 。西太平洋に位置するマリアナ海溝は地球上で最も深い海溝で、チャレンジャー海溝の最大深度は11,000 mに達する。恒久的な暗闇とは別に、ハダル生物はこの生態系を特徴づける超高静水圧(~110Mpa)と安定した低温(~2℃)に対処し、適応しなければならない[1, 2]。ハダル海洋の微生物代謝は、主に従属栄養であり、沈降粒子(植物プランクトンの集合体や動物プランクトンの糞便など)や動物の死骸を介して堆積した、太陽光を浴びた表層水からの有機物によって維持されている [1, 3, 4]。また、陸上からの有機炭素の供給やその場での化学合成も重要であると考えられる [5,6,7,8]。隣接する海底平野や斜面と比較して、ハダル海溝堆積物では微生物細胞の存在量と呼吸率の増加が検出されている [9, 10]。これは、ハダル海溝の独特の漏斗状の地形が、海溝底での有機物の収集を加速させ [3]、事実上、海溝を堆積場にしているためと考えられる [7]。鉛直堆積の間、難分解性化合物が広範囲に分解されるため、ハダル海中の微生物従属栄養生物は、味気ない「残りもの」を利用するためのユニークな異化能力を持つと考えられている。これを裏付けるように、マリアナ海溝のハダル水と堆積物の先駆的研究では、複雑な高分子、炭化水素、ヒ素やセレンのような重金属のリサイクルに関与する微生物が豊富であることが報告されている[11,12,13,14,15]。しかし、バクテロイデーテスのようなハダル海に生息する優占的な従属栄養微生物の詳細な代謝特性は、まだ十分に理解されていない。
バクテロイデーテス類は、マリアナ海域[2]、日本海域[16]、ケルマデック海溝[17]の海底にある海底珪藻/海底珪藻海域よりもハダル海域に多く生息していることが分かっており、これらの細菌がハダルの炭素循環に重要な役割を果たしている可能性が示唆されている。バクテロイデーテス(Bacteroidetes)は、世界の表層海洋で最も豊富な門の一つであり [18]、そのメンバーは高分子化合物、特に多糖類の分解に特化していると推測されている [19]。海洋生態系において、多糖類は植物プランクトンや大型藻類のエネルギー貯蔵産物であり、細胞壁の構成成分であり、バイオマスの大部分を占めている [20] 。これに対応して、植物プランクトンのブルーム時やその前後には、豊富なバクテロイデーテス類、特にフラボバクテリア綱のメンバーが頻繁に検出される [21,22,23]。グリコシドヒドロラーゼ(GH)やポリサッカライドリアーゼ(PL)などの糖質活性酵素(CAZymes)は、多糖類の分解に必要な重要な酵素である。BacteroidetesのゲノムにコードされているCAZymesは通常、多糖利用遺伝子座(PULs)と呼ばれる遺伝子クラスターに共局在しており、この遺伝子クラスターは多糖の結合遺伝子や取り込み遺伝子もコードしている。従って、典型的なPULには多数のCAZymesに加えて、それぞれStarch Utilization System (Sus) components DとCと名付けられた糖鎖結合タンパク質とTonB依存性トランスポーターをコードする遺伝子、さらにペプチダーゼ(糖タンパク質を標的とする)、スルファターゼ(硫酸化多糖を標的とする)[24]、最近報告されたホスファターゼ(リン酸化多糖を標的とする)[25]などの様々なアクセサリータンパク質が含まれる。CAZymesは炭水化物部分とグリコシド結合のタイプを区別する絶妙な特異性を示す。それゆえ、PUL内のCAZyme遺伝子組成はその標的多糖の構造に関する情報を提供することができる [19, 21, 23]。基質の利用可能性が異なる異なる生態学的ニッチに生息するバクテロイデテスは、しばしば異なるPULリザーバーを備えており [26,27,28]、後方に獲得されたCAZyme遺伝子はニッチの拡大において重要な役割を果たす可能性がある [29,30,31]。
ここで我々は、表層に生息するバクテロイデーテス属細菌は、表層に生息するバクテロイデーテス属細菌と比較して、深い海溝に蓄積される可能性の高い半活性多糖類のリサイクルに特化しているという仮説を立てた。この仮説を検証するために、マリアナ海溝の異なる層から採取したバクテロイデーテスの多糖利用能を比較するために、マルチオミクスと培養に基づいた方法を用いた。その結果、ハダルゾーンには、特に藻類や陸上植物に由来すると思われる細胞壁ヘミセルロースやペクチンを分解する多糖代謝能が著しく向上した、豊富でユニークなバクテロイデーテス類が生息していることが明らかになった。
結果と考察
表層海域と海底海域のバクテロイデーテス群集の違い
我々が以前に発表した研究から収集した、水深0~10,500 mの異なる水深にまたがる17種類の海水メタゲノム(表S1)を解析した[6, 11]。マリアナ海溝におけるバクテロイデーテス(Bacteroidetes)群集の深度分布を明らかにするために、メタゲノムから16S rRNA遺伝子のリードを抽出し、分類した(図1)。以前の報告[32]と一致するように、バクテロイデーテスは、ほとんどの深度で、自由生活サンプル(0.2~3 µm)よりも粒子関連サンプル(>3 µm)で高い相対存在量を示した(図1A)。バクテロイデーテス(主にフラボバクテ リア科)の相対存在量が最も高かったのは0, 4000, 9600 mで、原核生物群集全体の最大5%を占めた。バクテロイデーテスの相対存在量は、表層から2000 mの海域にかけて減少し、4000-9600 mの海域で増加し、最終的に底に近いサンプル(10,400 mと10,500 m)で減少した。マリアナ海溝の先行研究[2]でも同様の分布パターンが報告されているが、表層と6000 m以上のサンプルでは、ハダル原核生物群集に占めるバクテロイデーテスの存在率がより高かった(図S1)。相対的な存在量にこのような違いがあるにもかかわらず、どちらの研究でも、バクテロイデーテスが表層とハダル水の微生物群集のかなりの部分を構成できることを示している。
図1
図1
メタゲノムを用いたバクテロイデーテスの科(A)および属(B)レベルの相対存在量(16S rRNA遺伝子)。サンプル名はサイズフラクション、サンプリング深度、サンプリング年によって定義され、例えばMR16_P0は2016年に採取された0m海水の粒子付着サンプルである。Fは自由生活性(0.2~3 µm)、Pは粒子会合性(>3 µm)。サンプルは深度別にグループ分けした(表層: 0 m; 深海底: 2000および4000 m; ハダル: 8000、9600、10400、および10500 m)。
フルサイズ画像
バクテロイデーテス属の群集は水深によって異なることが観察された(図1B、図S2)。驚くべきことに、メソフラビバクター(Mesoflavibacter)は4000 m以深で濃縮され、NS4/NS5/NS2b海洋性グループとマリノスキラム(Marinoscillum)の相対的な多さは表層水と関連していた。マリアナ海溝のハダル水域の培養に依存した以前の研究から分離されたバクテロイデーテスのほとんどはメソフラビバクターとムリカウダであり、これらの深海環境におけるそれらの高い存在量と一致していた[33]。興味深いことに、好気性の海底近傍水域では、ヒトの腸や食物繊維の豊富なルーメンの主要嫌気性菌として知られるPrevotella属とBacteroides属が、宿主のために植物性多糖類を分解することが知られている[34,35,36](図1B)。この2つの属は、沈み込む有機物の凝集体に付着している可能性があり、そこでは呼吸が集中するため、局所的に酸素が枯渇していると推測される[37]。
バクテロイデーテス属のCAZyme遺伝子プールは、海底漠水域とハダル水域に存在する。
多糖類を分解するバクテロイデーテス類の特殊な能力[25]を考慮して、我々は水深の異なるバクテロイデーテス類のCAZyme遺伝子を調査した(図2、表S2)。これらの遺伝子のほとんどはフラボバクテリウム科に属するものであった。Bacteroidetesが介在する多糖の循環の重要性は、表層水においてよく報告されているが[21, 23, 38, 39]、BacteroidetesのCAZyme遺伝子の相対的な存在量は、水底付近で大きく減少する以外は、一般的に水深とともに増加することが観察された(図2A)。このことは、バクテロイデーテスも深海の炭素循環に大きな影響を与えている可能性を示唆している。バクテロイデーテス属CAZyme遺伝子のアルファ多様性(シャノン指数)は水層間で有意な差はなかったが(図2B)、CAZyme遺伝子プールの全体的な組成は、深海底/表層水(以下BH)と表層水で有意な差があった(ANOVA、p < 0.05)(図2C)。これにはGH/PL(2つの代表的な分解型CAZymeファミリー)遺伝子プールも含まれ(図S3;ANOVA,p < 0.05),分類群に依存するCAZymeの変動を反映して,これら2つのゾーンの間の明確な群集組成と一致していた(図1,図S2;ANOVA,p < 0.05)。CAZyme遺伝子リザーバーは炭水化物供給の生物地理学的パターンを反映している可能性が高いことから[40]、今回の結果は、マリアナ海溝の表層とBH海域に異なる多糖プールが存在することを示唆しており、地球規模の海洋の他の地域で観察された違い[41]と一致している。
図2
図2
マリアナ海溝の異なる水深におけるBacteroidetes CAZyme遺伝子の比較。A 各水深におけるBacteroidetes CAZyme遺伝子の相対的存在量(100万リードあたりのコピー数、CPM)。B 表層、深海底、ハダルゾーンにおけるBacteroidetes CAZyme遺伝子のシャノン多様性。統計はウィルコクソン検定に基づく。NS.は有意性なし。C 各サンプルのBacteroidetes CAZyme遺伝子組成のBray-Curtis非類似度に基づく非計量多次元尺度法(NMDS)解析。網掛け楕円は80%信頼区間を表す。
フルサイズ画像
BH Bacteroidetesの多糖代謝の多様性の増加
さらに、PUL遺伝子とCAZyme遺伝子の含有量を解析することにより、表層とBH Bacteroidetes MAG間の潜在的な多糖基質の違いを調べた。全深度から合計36のBacteroidetes MAGが回収され[42]、そのうち1つは表層から、19は深海底、16はハダルゾーンからであった(表S3)。表層とBHのMAGの比較を可能にするために、太平洋の表層海水(Tara Oceanプロジェクト)[43]のMAG(n = 35)と、藻類の多糖類が豊富なBacteroidetesを刺激する北海の珪藻のブルームからのMAG(n = 35)を追加分析した(表S3)[21]。これらのMAGのほとんど(86%、92/106)は、完全性が75%以上、汚染が5%未満であった。系統学的解析から、これらのMAGは幅広いバクテロイデーテス科をカバーしていることが示された(図3A)。これらのMAGの相対的な存在量を推定すると、それらはほとんど常に回収された環境に特異的であることが示され(図S4、表S4)、密接に関連するグループ内での海洋バクテロイデーテスのニッチ分割が示唆された。BH MAGのCAZyme遺伝子の平均数(129.7遺伝子と135.8遺伝子)は、表層水から回収されたMAG(65.9遺伝子)のほぼ2倍であった。これは、BH MAGのゲノムサイズが大きい(ウィルコクソン、p<0.05)だけでなく、CAZyme遺伝子密度が高い(ウィルコクソン、p<0.05)結果でもあった(図3B、表S3)。このことはBH Bacteroidetesの多糖分解能力の高さを浮き彫りにした。メタゲノムサンプル(Fig. S2)とは異なり、BH MAGsのCAZyme遺伝子とGH/PL遺伝子プールの一部は、系統的に分離されていないためか(Fig. 3C、Fig. S5)、表面のものと類似していなかった。
図3
図3
本研究で使用したBacteroidetes MAGs、その系統樹とゲノム比較。GTDB-Tk v1.7.0[44]によって同定された120の保存されたシングルコピー遺伝子に基づくBacteroidetes MAGsの系統樹。ゲノムは分離環境(形)と分離水層(色)に従ってグループ分けした。70%以上のブートストラップは黒いノードで示されている。ツリーのスケールは部位ごとの置換率として進化距離を示す。B 表層(n = 71)、深海底(n = 19)、ハダル(n = 16)MAG間の推定ゲノムサイズ、CAZyme遺伝子数、CAZyme遺伝子密度の比較。統計はウィルコクソン検定に基づく。*p < 0.05; ****p < 0.0001; NS.は有意差なし。C バクテロイデス属MAGのBray-Curtis非類似度は、各MAGにおけるCAZyme遺伝子の構成に基づくNMDS解析によって示された。網掛け楕円は80%信頼区間を表す。
フルサイズ画像
BH Bacteroidetes MAGsはヘミセルロースとペクチンを標的とするCAZymesに富んでいる。
生息環境は、海洋性バクテロイデーテス(Bacteroidetes)において糖質異化の主な原動力のひとつと考えられている[45]。従って、BH型バクテロイデテスの多糖利用能の向上は、BHゾーンの複雑な有機物からエネルギーを獲得する必要性から発展した可能性がある [4]。個体群間の多糖利用能の違いを決定するために、MAGの潜在的な多糖基質を示すPULを予測した[21, 23]。我々は厳格なPUL予測基準を採用し、特にGHまたはPLファミリーから少なくとも1つのsusCD遺伝子ペアと少なくとも2つの分解性CAZyme遺伝子の存在を必要とした。誇張の可能性を避けるため、マリアナ海溝の3つの水域それぞれから、重複するMAGを取り除いた。藻類ブルームと表層太平洋のMAGはすでに重複していなかった。BHのMAGの約70%(27個中19個)がPULを含むと予測され、表層のMAG(71個中39%、28個)よりはるかに多かった(図4A、表S5)。これらのPULは、予測される基質に従って14種類に分類された(図4A、表S5)。BHのMAGは、表面のものと比較して、より豊富で多様なPULを特徴としていた。
図4
図4
予測されたPULと関連する主要CAZyme遺伝子から明らかになったBacteroidetes MAGsの多糖利用能。A すべてのMAGにおける予測されたPULの分布。PULは潜在的基質に基づいて分類された。括弧内のGHまたはPLファミリーはそれらの糖鎖の分解に関与する共通遺伝子を表す。B すべてのMAGにおける主要なPUL遺伝子の分布。MAGは孤立した環境と孤立した水層によってグループ分けされた。BH、深海底、ハダル
フルサイズ画像
いくつかのMAGではPULが存在せず(おそらくゲノムが非常に断片化されていることがPUL予測の妨げになっているため)(図4A、表S5)、ゲノム全体にCAZyme遺伝子が散在していることから、同定された無傷のPULの鍵と考えられる比較的保存されたCAZyme遺伝子の各MAGにおける分布も評価した(図4B、表S6)。その結果、それらはBH MAGsにおいてもより広く分布していることが判明した(図4B)。α-1,4-グルカン(GH13 α-アミラーゼ/α-グルカナーゼ)、β-1,3-グルカン/ラミナリン(GH16 β-1,3-グルカナーゼ)、β-1,4-グルカン/セルロース(GH5、ほとんどがβ-グルカナーゼのファミリー)、α-マンナン(GH92 α-マンノシダーゼ)を標的とすると予測されるPUL/遺伝子、 フコース含有糖鎖(GH29 α-L-フコシダーゼ)、シアル酸オリゴ糖(GH33 シアリダーゼ)、およびβ-ガラクタン(GH2、多様な機能を持つファミリー)は、表面またはBH MAGにおいて濃縮を示さなかった(Fig. 4A, B)。逆に、ヘミセルロース系(キシログルカン、キシラン、β-マンナン)およびペクチン系(アラビナン、ラムノガラクツロナン-Iとホモガラクツロナンを含むペクチン主鎖)糖鎖を標的とするPUL/遺伝子は、BH MAGにほぼ限局していた。
ヘミセルロースとペクチンのCAZyme遺伝子はマリアナ海溝深海でより豊富である。
我々が調査したMAGのみに基づく差分分析は、1つの表層MAGを除き、すべてが他の海域に由来するものであったため、マリアナ海溝表層海水のサンプルを確実に反映していない可能性がある。そこで、メタゲノミックデータセット全体を用いて、マリアナ海溝の水柱全体における主要なPUL遺伝子の相対的な存在量をさらに調査した(図5、表S2)。MAG解析(図4)と一致して、ヘミセルロースとペクチンの分解遺伝子は、表層水メタゲノムではほとんど検出されなかったが(キシラン分解遺伝子GH10を除く)、BH水域では強く濃縮されていた(図5)。しかし、GH115(キシランα-1,2-グルクロニダーゼ)をコードする遺伝子はBHゾーンでのみ検出され、キシランは表層水では部分的に分解され、地下では完全に分解される可能性が示唆された。ペクチンとヘミセルロースは、植物や大型藻類の細胞壁の主要成分である [20, 46]。最近、これらの多糖類が珪藻のブルーム時に表層水中で検出され [47]、関連するバクテロイデーテス属がこれらの分解に必要なPULを持つことが示された [21, 23, 39]。藻類の細胞壁は、酵素による加水分解のような様々な生物ストレスに対して高い耐性を持つように進化してきたため、ペクチンやヘミセルロース系の糖鎖成分は、ラミナリンのような内部蓄積型糖鎖よりも長く存在し[47]、深海に沈みやすいと考えられる。マリアナ海溝のバクテロイデーテスは、上層海域で分解されにくい細胞壁多糖類をリサイクルする「スカベンジャー」として機能している可能性がある。この仮説は、深海性バクテロイデーテスの一種であるMaribellus comscasis [48]が高いヘミセルロース分解活性を持つという観察結果や、マリアナ海溝の有機物は主に海藻由来で陸上からの投入は少ないと考えられていることから支持される[7]。このことは、ハダール・バクテロイデーテスが幅広い多糖類分解能を有し、ヘミセルロースとペクチンを分解する能力が著しく高いという我々のゲノム観察と一致している。分析した海水サンプルの多糖組成は不明であるが、検出されたCAZymesは特定の多糖の存在を示している可能性があり[19]、さらなる調査が必要である。
図5
図5
マリアナ海溝の水柱全体における主要なバクテロイデーテスPUL遺伝子の相対的存在量。これらの遺伝子の基質となりうるものは、図4に示されている。BH、深海底、ハダル
フルサイズ画像
逆に、α-1,4-グルカン(GH13)、β-1,3-グルカン/ラミナリン(GH16)、β-1,4-グルカン/セルロース(GH5)、α-マンナン(GH92)、β-ガラクタン(GH2)分解酵素をコードすると予測される遺伝子は、表層水と海底水域の両方で多く見られ(図5、表S2)、これらの化合物は、どの深度でもバクテロイデーテスにとって必須の栄養源である可能性が高いことが示された。アルギン酸を標的とする遺伝子(PL6/PL7/PL17、アルギン酸リアーゼ)はどのサンプルでもほとんど検出されなかったが、これはアルギン酸が沿岸の大型藻類に由来するため、遠洋海域ではほとんど見られないためと考えられる。β-1,2-グルカンを標的とするPUL遺伝子産物(GH144エンド-β-1,2-グルカナーゼ)は、表層とBH MAGの両方で予測されたが(図4A)、BH海域で有意に濃縮されており(ウィルコクソン検定、p < 0.05;図5、表S2)、β-1,2-グルカンがBH海域でより豊富であることを示唆している。
ハダールに局在するメソフラビバクターMTRN7株では、ペクチン性多糖類アラビナンの利用が可能である。
BH海域のバクテロイデーテス類におけるCAZymeの発現に関する我々の遺伝学的予測を補完するために、我々はメソフラビバクターMTRN7株の多糖利用能を調べるために、生理学的実験と異種生産合成実験を組み合わせた(図6)。MTRN7株は標高8727 mのマリアナ海溝から分離され(表S7)、同じくマリアナ海溝の深海から分離されたメソフラビバクター・プロファンディ株(図6A、図S6)と近縁(99.7%、16S rRNA遺伝子の同一性)である(表S7)[49]。予想通り、MTRN7 は栄養豊富な 2216E 培地上で、室温で生理学的に適切な圧力(60 MPa、6000 m に相当)で増殖することができ(図 S7)、高圧に強く適応していることが示された。単離深度に匹敵する耐圧性(~87 Mpa)は得られなかったが、これはおそらく培養条件の限界、例えば、高い静水圧に対する耐性を与える潜在的な浸透溶質の欠如によるものであろう。
図6
図6
M. profundi MTRN7の多糖利用能。GTDB-Tk v1.7.0[44]によって同定された120の保存単一コピー遺伝子に基づくMTRN7の系統推定。菌株 MTRN7 を赤で、回収された MAG を青で示す。MTRN7のTEM観察を示した。B メソフラビバクターMAGの予測PUL。C グルコース、アラビノース、アラビナンを添加した海洋ミネラル培地(MMM)でのMTRN7と2つの参照株(M. zeaxanthinifaciens DSM 18436 と M. sabulilitoris KCTC 42117)の大気圧下での増殖アッセイ。糖類や多糖類を添加していないMMMをコントロールとして用いた。D MTRN7を基礎培地+アラビナンで培養した場合、基礎培地および基礎培地+グルコースと比較して、すべての遺伝子が有意に発現上昇した(|log2FC|>1、FDR調整p<0.05)。アラビナンPULに位置するいくつかの遺伝子をRT-qPCRでさらに調べた。灰色のレンガは定量化されなかった遺伝子を示す。
フルサイズ画像
MTRN7、4000-10,500 mから回収した4種類のメソフラビバクターMAG、および他の環境から公的に入手可能なメソフラビバクターゲノムから、4種類のPULを同定した(図6B、表S7)。β-1,3-グルカン/ラミナリン、β-1,2-グルカン、α-1,4-グルカンを標的とすると予測されるPULは、ほとんどのメソフラビバクター株で比較的一般的であったが、ペクチン性多糖アラビナンを標的とするPULはMTRN7で特異的であった。予測されたアラビナンPULは水柱全体でメソフラビバクター属と一貫した分布を示し(図1B、図S8)、MTRN7がマリアナ海溝におけるメソフラビバクターの重要なメンバーであることを示している。ゲノム解析を裏付けるように、予測されたアラビナン PUL を持たない表面由来のメソフラビバクター 2 株(DSM 18436 と KCTC 42117)ではなく、MTRN7 だけがアラビナンとアラビノースを炭素源として利用できた(図 6C)。無糖およびグルコースと比較して、アラビナンを供給すると21の遺伝子が発現上昇した(図6D)。このPULの全遺伝子がアラビナン上での生育中に強く活性化されたことから、このPULがこの多糖の利用に関与していることが強く示唆された(図6D)。このPULはアラビノキシランアラビノフラノヒドロラーゼ(XynD)、2つのα-L-アラビナナーゼ(Abn43AとAbn43B)、3つのα-L-アラビノフラノシダーゼ(Abf51A、Abf43A、Abf51B)、1つのβ-L-アラビノフラノシダーゼ(HypBA)を特徴とする(図6D、図S9)。これらの酵素はアラビナンをアラビノースに分解するのに重要である[51, 52]。以前に報告されたアラビナン分解のためのPUL [51, 52]とは対照的に、MTRN7で新たに見つかったアラビナンPULは、アラビノースをキシルロース-5-Pに変換し、中枢代謝に入ることができる酵素もコードしていると予測された(図S9)。したがって、このアラビナンPULはMTRN7に完全なアラビナン代謝経路を付与している可能性が高い。
MTRN7におけるアラビナン利用は、沿岸のフラボバクテリウム科菌株から水平獲得されたようである。
アラビナンPULがなぜMTRN7にのみ観察されるのかを解明するため、他の6つのM. profundi株とMTRN7とのゲノム比較解析を行った。興味深いことに、これらの菌株すべてにおいて、開始(susC)遺伝子と終了(susB)遺伝子の間に欠失事象が観察され、残りの上流および下流領域は強く保存されていた(97.8%以上の塩基配列同一性)(図7A)。このことから、アラビナンPULはこれらすべてのM. profundiゲノムに存在していた可能性が高いが、MTRN7だけがこの遺伝子クラスターを保持していたことが示唆される。さらに興味深いことに、予測されたアラビナンPULは、MTRN7ゲノム全体のGC含量(31.2%)に比べて高いGC含量(34.3%)を有していた(図7A)。このことは、アラビナンPULが以前は水平転移事象に由来していたことを示唆している。NCBI nrデータベースに対するBLASTp解析の結果、この予測されたアラビナンPULのタンパク質は、マレーシアの陸と海の境界に位置するマングローブ林から分離された別のフラボバクテリウム科の菌株Mangrovimonas sp. ST2L15(図7A、表S8)で同定された同じ遺伝子含量と遺伝子順序を持つPULのタンパク質と最も高い相同性(アミノ酸同一性49-93%、平均79%)を有していた[53]。MTRN7とST2L15のアラビナンPUL類似度(平均79%)は、2つのゲノムから得られた他のすべての遺伝子ペアの平均アミノ酸類似度(平均61.8%)よりもはるかに高かった。MTRN7とは異なり、ST2L15のアラビナンPULのGC含量(37.3%)は全ゲノム(36.2%)と同様であった。ファージインテグラーゼ、具体的にはチロシン組換え酵素(遺伝子ID: APDGNPDO_02609)がアラビナンPULの約30遺伝子上流に位置し、転移の原因となっている可能性がある。同様のファージインテグラーゼは、他の2つの側方獲得PULの周辺にも報告されており、外部PULのゲノムDNAへの統合に重要な要素であることが示唆されている[29, 30]。最後に、系統解析により、MTRN7アラビナンPULは沿岸/陸上バクテロイデーテスから獲得された可能性が高いことが検証された(詳細な結果は補足データ、図S10を参照)。
図7
図7
M. profundi MTRN7が獲得したアラビナンPUL。A マングローブ(海辺)株Mangrovimonas sp.ST2L15とハダル株M. profundi MTRN7に見られる2つの類似したアラビナンPULの模式図。遺伝子は縮尺で示され、推定される機能に従って色分けされている。各遺伝子の完全名称を表S3に示す。水色のバーは40%以上のアミノ酸配列同一性を、薄緑色のバーは97%以上の塩基配列同一性を示す。MTRN7 PULとM. profundiの他のゲノム(例えばYC1039)との比較で、開始(susC)および終了(susB)遺伝子に保存された領域が詳細に示されている。赤いハサミは、残りのPULが失われた部位を示す。MTRN7のGC含量は遺伝子の上に示されており、2000bpの非重複スライディングウィンドウを用いて計算した。B MTRN7アラビナンPULから予測されるα-L-アラビノフラノシダーゼ(Abf51A)の切断部位。C Abf51Aの精製。pNP-α-L-アラビノフラノースに対するAbf51Aの特異的活性を、0〜70℃の温度範囲(D)および2℃および25℃における0.1〜80Mpaの圧力範囲(E)で試験した。
フルサイズ画像
アラビナンPULの起源が沿岸/陸上である可能性を考慮し、次にMTRN7 CAZymesがハダル極限条件下(低温、高圧など)で機能するように進化してきたかどうかを調べた。これを解決するために、PUL内の精製アラビナンの複数の結合(α-1,2、α-1,3、α-1,5)を切断すると予測される分泌型α-L-アラビノフラノシダーゼ(Abf51A)を不均一に発現させ(図S9、図7B、C)、0〜70℃での活性を調べた(図7C)。Abf51Aの至適温度範囲は25〜35℃であり、低温下(0〜10℃)では最高活性の約30%を維持した。さらに、Abf51Aは高圧にも耐性があり、80 Mpaまで機能することが示された(図7D)。これらの知見は、MTRN7が高圧・低温下でアラビナンを炭素源として利用できることを示す増殖実験によって支持される(図S11)。
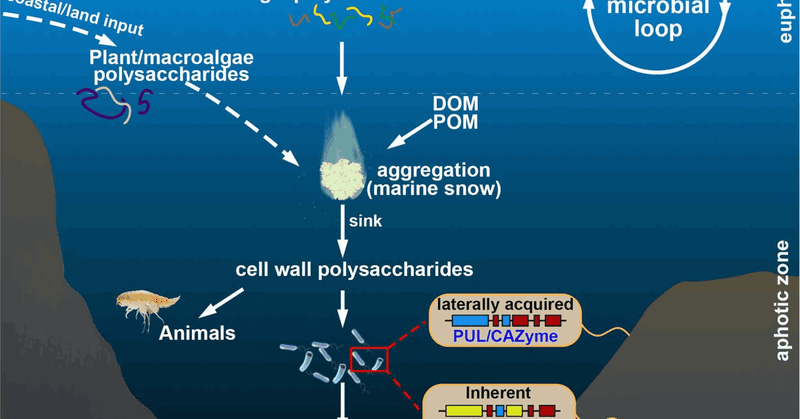
ハダル海溝における多糖循環モデルの提案
深海の大部分は未開拓であるため、この環境に生息する微生物の多糖類分解能力については比較的知られていない[20, 48]。本研究では、ハダル炭素循環の理解を深めるために、マリアナ海溝の全深度にわたって潜在的な多糖源を調査するためにメタゲノミクスを利用した。得られた知見に基づいて、マリアナ海溝における多糖類循環のモデルを提案した(図8)。マリアナ海溝海域における多糖類の供給源は、沿岸や陸上からの潜在的なインプット[7]と共に、植物プランクトンのバイオマス(特に渦鞭毛藻類)[54]に由来するものが主であると考えられる。沈降過程でグルカンのような難分解性の形態が利用された後、ヘミセルロースやペクチンを含む構造的に複雑な細胞壁多糖類がBH海域に蓄積し、現地の従属栄養微生物 [2, 12, 13, 15] や動物 [1, 55] に重要な炭素源を提供する。遺伝的要素は、もともと存在していたもの、あるいは後方から移入されたものの両方によって、ハダール微生物に特殊な多糖類分解能力を付与している。全体として、われわれのデータは、特殊化したバクテロイデーテス属細菌が、ハダルの炭素循環において、表面炭素循環 [56]と同様に重要な役割を果たしていることを示唆しているが、細胞壁多糖類の分解を優先している。
図8
図8
マリアナ海溝の全水深にわたる潜在的な多糖類循環の概略図。植物プランクトンと潜在的な沿岸/陸地由来の多糖類の両方が、ハダル微生物と動物を支えている可能性が高い。長距離降下中に上層水域で大部分の有責貯蔵多糖が広範囲に分解された後、豊富な細胞壁多糖がハダルゾーンに残される。これらの細胞壁多糖類は、まずバクテロイデーテス属のような特殊な多糖類分解生物によって消費され、その後PULを獲得する可能性がある。DOMは溶存有機物、POMは粒子状有機物。
フルサイズ画像
材料と方法
データ収集
マリアナ海溝のさまざまな深度(0~10,500 m)のメタゲノミックデータは、我々の最近の研究[6, 11, 57]から入手した(表S1)。各水深の海水は、粒子付着サンプル(3 µm以上)と自由生活サンプル(0.2~3 µm)に分画した。2000m、8000m、9600mの粒子付着サンプルは、DNAの品質が不十分であったため、塩基配列の決定には成功しなかった。本研究では、マリアナ海溝の36個のMAG、北海南部の春の珪藻の開花の中期と後期の35個のMAG [21]、および太平洋表層の35個のMAG [43]を含む、合計106個のBacteroidetes MAGを収集した(表S3)。それぞれのMAGの原位置環境における相対的な存在量を推定するために、関連するメタゲノミックデータもダウンロードした(表S1)。
メタゲノミックデータの処理
生データは、まずTrimmomatic v0.36[58]で「SLIDINGWINDOW:4:15 LEADING:3 TRAILING:3 MINLEN:75」オプションでクオリティトリミングし、次にMEGAHIT v1.0.2[59]でデフォルトパラメーターを用いてアセンブルした。アセンブルされたコンティグは、Prodigal [60]の"-meta "オプションを使用して遺伝子を予測するために使用された。すべてのメタゲノムから得られた遺伝子配列を結合し、CD-HIT(95%以上の配列同一性と90%以上のカバレッジ)を行い、冗長性のない遺伝子カタログを作成した。次に、CoverM (v0.6.1, https://github.com/wwood/CoverM)を用いて、ペアエンドリードに基づく非冗長遺伝子の推定相対存在量(CPM, copies per Million mapped reads)を求めた。各遺伝子のコピー数は、CoverMに統合された "jgi_summarize_bam_contig_depths "モジュールによって計算され、さらに各メタゲノムの総マップリードで正規化された。CAZymesのアノテーションは、run_dbCAN v3.0.5[61]とhmmerモジュールおよびdiamondモジュールを用いて行った。両方の方法で同定されたCAZymesのみを考慮した。各遺伝子の分類学的割り当ては、MEGAN v6.21.7 [62]を用いて行った。コミュニティプロファイルは、抽出した16S rRNA遺伝子リードに基づいてPhyloflash [63]で作成した。Rの "vegan "パッケージ[64]を用いて、異なるサンプルにおけるバクテロイデス群集とCAZymes組成のアルファ多様性(Shannon)分析とベータ多様性(NMDS)分析を行った。
MAG解析
ゲノムの完全性とコンタミネーションは、CheckM v1.0.12 [65]で推定した。各 MAG の分類学的割り当ては、120 個の細菌マーカー遺伝子に基づき、GTDB-Tk v1.7.0 [44]の "classify "モジュールによって決定した。GTDB-Tk v1.7.0[44]の出力から120のマーカー遺伝子を連結した最尤系統樹をFastTree v2.1.10 (options-gamma) [66]で決定し、インタラクティブな生命の木(iTOL) [50]で可視化した。MAGの相対存在量(マップされたリードの割合)は、CoverM(v0.6.1, https://github.com/wwood/CoverM)を用いて計算した。CoverMは、デフォルトのパラメータでメタゲノム配列をMAGにマップする。
遺伝子予測とアノテーションは Prokka v1.12 [67]を用いて行った。CAZymes のアノテーションは上記のように行った。ペプチダーゼとスルファターゼはそれぞれ、MEROPS v12.1[68]とSulfAtlas v1.0[69]のデータベースに対してBLASTp検索を行い、<1e-5 E値、30%以上の同一性、70%以上の対象カバレッジでアノテーションした。susC-likeおよびsusD-like遺伝子は、特定のPfamドメイン(susCはPF00593、PF13715、PF07715、SusDはPF07980、PF12741、PF12771、PF14322)に従って同定した。PULは、タンデムsusCD-likeペアと、GHまたはPLファミリーの少なくとも2つの分解性CAZyme遺伝子の存在に基づいて、以前の研究よりも厳しい7遺伝子スライディングウィンドウを用いて手動で予測された[70]。各PULの推定基質は、PUL遺伝子の機能アノテーションに基づいて予測され、さらにdbCAN-PUL [71]で実験的に検証されたPULとクロスチェックされた。各サンプル中のアラビナンPULの相対存在量(RPKM、マップされた100万リードあたりのキロ塩基あたりのリード数)は、CoverM(v0.6.1、https://github.com/wwood/CoverM)によって推定した。
M. profundi MTRN7の単離、基質利用、高圧適応
M. profundi MTRN7はマリアナ海溝の水深8727mで貧栄養R2A培地で培養することにより単離した。海洋2216E寒天培地で28℃、24時間培養後、細胞を1 % (w/v) リンタングステン酸でネガティブ染色し、透過型電子顕微鏡(JEM-1200EX、日本電子)で細胞形態を観察した。
MTRN7株と2つの参照株(DSM 18436とKCTC 42117)の基質利用アッセイを大気圧で行った。簡単に説明すると、1 ml の MTRN7 培養物(OD600=0.5)を、糖または炭水化物を添加または無添加(対照)した 50 ml の MMM(表 S9)に接種した: 5g/Lグルコース、5g/Lアラビナン、5g/Lアラビノース、28℃で20時間培養した。紫外線分光光度計を用いて、5時間ごとにMTRN7の増殖をモニターした。すべてのアッセイは3連で行った。
高圧に対する耐久性を調べるために、単離株の3連培養物(50μl、OD600=0.8)を450μlの新鮮な2216E培地に加え、1mLの滅菌シリンジに移し、蓋をして密封した。シリンジをステンレス製リアクター(南通飛油科技探索、中国)に入れ、室温で7日間、0.1、10、20、40、60、80MPaに加圧した。細菌コロニーは、連続希釈した培養物を28℃で24時間、2216Eプレートに広げてカウントした。
高圧および低温条件下でのアラビナンの利用を調べるため、分離株の3連培養物(50 μl、OD600=0.8)を、高濃度のアラビナン(20 g/L)を添加した450 μlのMMMに加え、異なる圧力条件(すなわち、0.1、10、20、30、40、および50 Mpa)で2℃でインキュベートした。MTRN7は60Mpa以上の栄養豊富な2216E培地では増殖できないようであることから、アラビナンと培養する際の最大圧力は50Mpaとした。高圧培養とコロニー計数は、上記と同じ条件で行った。
MTRN7の比較ゲノム解析
MTRN7のゲノム配列は、Majorbio Biopharm Technology Co. (中国、上海)で行われ、イルミナのショートリードとPacBioのロングリードをUnicycler v0.4.8[72]を用いてデフォルトパラメータで組み合わせてアセンブルした。比較ゲノム解析のために、メソフラビバクターの系統的に閉じたゲノムをNCBIデータベースからダウンロードした(表S7)。メソフラビバクターゲノムの品質評価、ゲノムアノテーション、PUL予測、系統学的解析は上記のように行った。16S rRNA 遺伝子に基づいて系統樹を再構築するために、まず RNAmmer [73]を用いて各ゲノムの 16S rRNA 遺伝子を予測した。次に16S rRNA遺伝子の配列をMAFFT [74]でアライメントし、TrimAl [75]でトリミングした。最後に、FastTree v2.1.10 (options-gamma) [66]により最尤系統樹を推定した。
トランスクリプトミクスと定量的RT-PCR
グルコース添加または無添加の基礎培地で培養したMTRN7の細胞懸濁液を2つの対照群として用い、アラビナン添加の基礎培地で培養した細胞懸濁液を実験群とした。培養はすべて28℃で5時間、3回に分けて行い、直ちに液体窒素で凍結した。TRIzol®試薬を用いて全RNAを抽出し、DNase I処理(TaKaRa)によりゲノムDNAを除去した。その後、TruSeqTM RNAサンプル調製キット(Illumina, San Diego, CA)を用いて、2μgの高品質トータルRNAを用いてRNA-seqトランスクリプトームライブラリーを調製した。その後、ペアエンドRNA-seqライブラリーを、Shanghai Majorbio Bio-pharm Biotechnology Co. (Ltd.(中国、上海)で行った。社内のperlスクリプトを用いて品質管理を行った後、各サンプルの高品質リードをBowtie2 v2.2.3[76]を用いてMTRN7のゲノムにマッピングした。遺伝子発現レベル(FPKM, fragments per kilobase of transcript per million mapped reads)は、RSEM [77]によって定量した。対照群と実験群間の差次的発現遺伝子はedgeR [78]によって同定し、FDR-adjusted p < 0.05および|log2FC| > 1を有意差発現のカットオフ値とした。
目的の遺伝子の発現レベルは、定量的RT-PCRによって検証した。トランスクリプトーム配列決定に用いた抽出RNAは、PrimeScript RT Reagent Kitを用いてcDNAに変換した。qRT-PCRは、表S10に示した遺伝子特異的プライマーに基づき、QuantStudio™ 5 Real-Time PCR System(Applied Biosystems, Foster City, CA, USA)を用いて行った。各遺伝子の遺伝子転写の倍数変化は、ハウスキーピング遺伝子recAを基準として正規化した。すべてのアッセイは3連で行った。
Abf51Aの異種発現、精製および特性解析
abf51A遺伝子は、最初に自己設計したプライマー対(表S11)で増幅し、pET28(+)にクローニングした。得られたabf51Aを含むベクター(シグナルペプチドを含まない)を、下流の発現および精製のために大腸菌BL21(DE3)に導入した。精製したAbf51Aを12%硫酸-ポリアクリルアミドゲル電気泳動(SDS-PAGE)で評価した。合成pNP-α-L-アラビノフラノース(シグマ社製)に対するAbf51Aの酵素活性は、マイクロタイタープレート吸光度リーダーを用いてpNP-OHの放出を分光光度法(405nm)でモニターすることにより測定した。10μlの酵素と10μlのpNP-α-L-アラビノフラノース(20mM)を180μlのリン酸カリウム緩衝液(50mM、pH6.2)に加え、反応系を形成した。異なる温度下での酵素活性を調べるため、反応は4、10、16、28、37、45、50、60、70℃で操作した。高圧・低温条件下での酵素活性を調べるため、2℃(ハダルゾーンのその場温度)と25℃(至適温度)で、異なる圧力(0.1、10、20、30、40、50、60、70、80Mpa)下でも反応を行った。高圧は、上記のようにシリンジを使って水を供給することによってかけた。10分間の反応後、600μLの冷1M Na2CO3を加えて反応を止め、マイクロタイタープレート吸光度リーダーで吸光度を測定した。比活性は、0~1mMのpNP-OH標準曲線と実験吸光度値を比較することで求めた。活性の1単位は、1分間に1μmolのpNP-OHを放出するのに必要な酵素量と定義した。
データおよび材料の入手
M. profundi MTRN7の全ゲノム配列はGenBankにアクセッション番号PRJNA898768で寄託されている。トランスクリプトーム解析用の生シーケンスリードはNCBI Short Read Archiveに寄託した(アクセッション番号:PRJNA898788)。本研究で使用したメタゲノムおよびMAGの情報は、それぞれ表S1および表S3に示した。
参考文献
Jamieson AJ、Fujii T、Mayor DJ、Solan M、Priede IG. ハダルトレンチ:地球上で最も深い場所の生態学。Trends Ecol Evol.
論文
PubMed
グーグル奨学生
布浦崇史、高木陽介、平井雅人、島村聡、真壁昭夫、小出大、他。ハダル生物圏:地球最深部の海洋における微生物生態系への洞察。Proc Natl Acad Sci U S A. 2015;112:E1230-6.
論文
論文
PubMed
パブメドセントラル
Google Scholar
ハダル海溝における底生生物量の分布:海底への有機物の垂直・水平輸送の影響を調べるためのモデリングアプローチ。Deep Sea Res 1 Oceanogr Res Pap. 2015;100:21-33.
論文
グーグル・スカラー
Liu R, Wang L, Wei Y, Fang J. The hadal biosphere: recent insights and new directions. Deep Sea Res 2 Top Stud Oceanogr.
Wang Y, Huang JM, Cui GJ, Nunoura T, Takaki Y, Li WL, et al. Genomics insights into ecotype formation of ammonia-oxidizing archaea in the deep ocean. Environ Microbiol. 2019;21:716-29.
論文
CAS
PubMed
グーグル奨学生
Zhong H, Lehtovirta-Morley L, Liu J, Zheng Y, Lin H, Song D, et al. Novel insights into the Thaumarchaeota in the deepest oceans: Their metabolism and potential adaptation mechanisms. Microbiome. 2020;8:78.
論文
論文
PubMed
パブメドセントラル
Google Scholar
マリアナ海溝南縁と斜面における有機物の産状、分布、蓄積:炭素循環とハダル海溝への埋没の意味。Mar Geol. 2017;386:98-106.
論文
CAS
グーグル・スカラー
Gallo ND, Cameron J, Hardy K, Fryer P, Bartlett DH, Levin LA. マリアナ海溝とニューブリテン海溝における潜水艇と着陸船で観測された群集パターン:表層性群集と掃海性群集に対する生産性と深度の影響。Deep Sea Res 1 Oceanogr Res Pap. 2015;99:119-33.
論文
グーグル・スカラー
Glud RN, Wenzhöfer F, Middelboe M, Oguri K, Turnewitsch R, Canfield DE, et al. 地球上で最も深い海溝の堆積物における微生物炭素回転率の高さ。Nat Geosci. 2013;6:284-8.
論文
CAS
グーグル・スカラー
Luo M, Glud RN, Pan B, Wenzhöfer F, Xu Y, Lin G, et al. ハダルトレンチにおける底生炭素無機化:底生酸素消費のその場測定からの洞察。Geophys Res Lett.
論文
CAS
グーグル・スカラー
Liu J, Zheng Y, Lin H, Wang X, Li M, Liu Y, et al. マリアナ海溝底における炭化水素分解微生物の増殖。Microbiome. 2019;7:47.
論文
CAS
PubMed
パブメドセントラル
グーグル奨学生
エベレストとマリアナ海溝の原核生物の比較。Microbiome. 2022;10:215.
論文
論文
PubMed
パブメドセントラル
グーグル奨学生
周YL、マラP、崔GJ、エドコムVP、王Y. チャレンジャー海淵の斜面堆積物と底軸堆積物の微生物群。Nat Commun. 2022;13:1515.
論文
論文
PubMed
パブメドセントラル
Google Scholar
海洋深層堆積物における生物圏の全構造と多彩な代謝機能を明らかにした。Genome Biol.
論文
論文
PubMed
パブメドセントラル
Google Scholar
深海に生息するクロロフレキシーのゲノムから、深海に適応するための代謝戦略が明らかになった。Microbiome. 2022;10:75.
論文
論文
PubMed
パブメドセントラル
グーグル奨学生
日本海溝の富栄養化海域における表層から底層までの水柱における浮遊性微生物群集の分布とニッチ分離. Front Microbiol. 2016;7:1261.
論文
PubMed
パブメドセントラル
Google Scholar
Peoples LM, Donaldson S, Osuntokun O, Xia Q, Nelson A, Blanton J, et al. マリアナ海溝とケルマデック海溝における垂直的に異なる微生物群集。PLoS One. 2018;13:e0195102.
論文
PubMed
パブメドセントラル
グーグル奨学生
Sunagawa S, Coelho LP, Chaffron S, Kultima JR, Labadie K, Salazar G, et al. Structure and function of the global ocean microbiome. Science. 2015;348:1261359.
論文
PubMed
グーグル奨学生
バクテロイデスは何千もの酵素の組み合わせで糖鎖を分解する。Nat Commun. 2019;10:2043.
論文
PubMed
PubMed Central
グーグル奨学生
Arnosti C, Wietz M, Brinkhoff T, Hehemann JH, Probandt D, Zeugner L, et al. The biogeochemistry of marine polysaccharides: sources, inventories, and bacterial drivers of the carbohydrate cycle. Annu Rev Mar Sci. 2021;13:81-108.
論文
CAS
Google Scholar
Kruger K, Chafee M, Ben Francis T, Glavina Del Rio T, Becher D, Schweder T, et al. 海洋バクテロイデーテスにおいて、藻類ブルーム時の糖鎖分解の大部分は、制限された遺伝子セットを用いた少数のクレードによって媒介される。ISME J. 2019;13:2800-16.
論文
PubMed
パブメドセントラル
Google Scholar
Teeling H, Fuchs BM, Bennke CM, Kruger K, Chafee M, Kappelmann L, et al. 沿岸の春の藻類大発生時の細菌プランクトン動態の繰り返しパターン。Elife. 2016;5:e11888.
論文
PubMed
PubMed Central
Google Scholar
Kappelmann L, Kruger K, Hehemann JH, Harder J, Markert S, Unfried F, et al. SusC/D-タンパク質発現を用いた主要植物プランクトン糖鎖予測の基礎となる北海フラボバクテリウムの多糖利用遺伝子座。ISME J. 2019;13:76-91.
論文
CAS
PubMed
Google Scholar
Bjursell MK, Martens EC, Gordon JI. ヒト成人腸内共生細菌Bacteroides thetaiotaomicronの哺乳期適応に関する機能ゲノムおよび代謝研究。J Biol Chem. 2006;281:36269-79.
論文
論文
パブコメ
グーグル奨学生
植物に共生するバクテロイデーテス(Bacteroidetes)のニッチ適応は有機リンの無機化に特化している。ISME J. 2021;15:1040-55.
論文
論文
パブコメ
Google Scholar
フラボバクテリアは海洋性から非海洋性へと進化を繰り返してきた。Environ Microbiol. 2019;21:648-66.
論文
CAS
PubMed
グーグルスカラー
Xing P, Hahnke RL, Unfried F, Markert S, Huang S, Barbeyron T, et al. 春の珪藻の開花期における北海の2つの多糖類分解ポラリバクター分離株のニッチ。ISME J. 2015;9:1410-22.
論文
CAS
PubMed
Google Scholar
北海の春に藻類が大発生した際のポラリバクター・クレードの多糖類ニッチ分割。北海の春季藻類大発生時におけるPolaribacterクレードの多糖ニッチ分割。2020:14:1369-83。
論文
論文
PubMed
パブメドセントラル
Google Scholar
ヘーマンJH、ケリーAG、プードロNA、マルテンスEC、ボラストンAB。ヒト腸内細菌叢の細菌は、外来微生物からの糖鎖活性酵素の更新で紅藻類の糖鎖を異化する。Proc Natl Acad Sci U S A. 2012;109:19786-91.
論文
論文
PubMed
パブメドセントラル
Google Scholar
海洋性ガンマプロテオバクテリアにおけるペクチン分解経路の水環境への適応。Environ Microbiol. 2017;19:2320-33.
論文
論文
PubMed
Google Scholar
Hehemann JH, Correc G, Barbeyron T, Helbert W, Czjzek M, Michel G. 海洋細菌から日本人の腸内細菌叢への糖質活性酵素の移入。Nature. 2010;464:908-U123.
論文
論文
パブコメ
Google Scholar
海洋バクテロイデーテスの生態:比較ゲノム学的アプローチ。2013:7:1026-37。
論文
論文
パブコメ
パブメドセントラル
グーグル奨学生
マリアナ海溝で培養可能な従属栄養細菌の多様性と高分子分解能力. Mar Life Sci Tech. 2020;2:181-93.
論文
Google Scholar
Tett A, Pasolli E, Masetti G, Ercolini D, Segata N. プレボテラの多様性、ニッチ、ヒト宿主との相互作用。Nat Rev Microbiol. 2021;19:585-99.
論文
論文
パブコメ
Google Scholar
Seshadri、Leahy SC、Attwood GT、Teh KH、Lambie SC、Cookson AL、et al. Hungate1000 Collectionからのルーメンマイクロバイオームメンバーの培養と配列決定。Nat Biotechnol. 2018;36:359-67.
論文
論文
PubMed
パブメドセントラル
Google Scholar
Flint HJ, Bayer EA, Rincon MT, Lamed R, White BA. 腸内細菌による多糖利用:ゲノム解析による新たな知見の可能性。Nat Rev Microbiol. 2008;6:121-31.
論文
論文
パブコメ
Google Scholar
粒子微小環境による海洋嫌気性代謝のグローバルニッチ拡大:Bianchi D, Weber TS, Kiko R, Deutsch C. Nat Geosci. 2018;11:263-8.
論文
CAS
グーグル・スカラー
オレリャーナLH、フランシスTB、フェラーロM、ヘヘマンJH、フックスBM、アマンRI。珪藻のブルーム時に、疣贅菌は硫酸化メチルペントースの専門消費者である。ISME J. 2021;16:630-41.
海洋バクテロイデテスは、保存された酵素カスケードを用いて珪藻β-マンナンを消化する。ISME J. 2022;17:276-85.
論文
日本農芸化学会誌
パブメドセントラル
Google Scholar
アルノスティC、スティーンAD、ツィアーヴォーゲルK、ゴブリアルS、ジェフリーWH. 海洋溶存有機炭素の分解における緯度勾配。PLoS One. 2011;6:e28900.
論文
論文
パブコメ
パブメドセントラル
グーグル奨学生
Zhao Z, Baltar F, Herndl GJ. 細胞外酵素と系統樹との関連から、深海の原核生物は主に粒子に関連した生活様式をとることが明らかになった。サイ・アドバンス2020;6:eaaz4354.
論文
論文
PubMed
パブメッドセントラル
グーグル奨学生
地球上で最も深い海水カラムにおける微生物生態学的役割の垂直成層に関する洞察。Microorganisms. 2020;8:1309.
論文
論文
PubMed
パブメドセントラル
Google Scholar
表層海洋のメタゲノムには、窒素固定を行うPlanctomycetesとProteobacteriaの集団が豊富に存在する。Nat Microbiol. 2018;3:804-13.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
ゲノム分類データベース(GTDB-Tk)。GTDB-Tk:ゲノム分類データベースでゲノムを分類するためのツールキット。Bioinformatics. 2019;36:1925-7.
論文
PubMed
パブメドセントラル
Google Scholar
Barbeyron T, Thomas F, Barbe V, Teeling H, Schenowitz C, Dossat C, et al. 海洋従属栄養細菌における炭水化物異化作用の原動力としての生息地と分類群:モデル藻類付随細菌Zobellia galactanivorans Dsij(T)の例。Environ Microbiol. 2016;18:4610-27.
論文
CAS
PubMed
Google Scholar
植物細胞壁の進化と多様性:藻類から顕花植物まで。Annu Rev Plant Biol. 2011;62:567-90.
論文
論文
パブコメ
Google Scholar
Vidal-Melgosa、Sichert A、Francis TB、Bartosik D、Niggemann J、Wichels A、他。珪藻のフカン多糖体は藻類が繁殖する際に炭素を沈殿させる。Nat Commun. 2021;12:1150.
論文
論文
PubMed
パブメドセントラル
Google Scholar
セルロース分解能を有する新規深海性バクテロイデス属細菌Maribellus comscasis sp. Environ Microbiol. 2021;23:4561-75.
論文
論文
パブコメ
グーグル奨学生
Wang DY, Wang Q, Liu J, Zhang DC. 深海海山から分離されたMesoflavibacter profundi sp. Curr Microbiol. 2018;75:1142-6.
論文
CAS
PubMed
Google Scholar
Letunic I, Bork P. Interactive Tree Of Life (iTOL) v5: A online tool for phylogenetic tree display and annotation. 日本学術振興会特別研究員。
論文
論文
パブコメ
パブメドセントラル
Google Scholar
好熱菌Caldanaerobius polysaccharolyticusにおけるアラビナン分解と輸送の酵素機構。Appl Environ Microbiol. 2017;83:e00794-17.
論文
CAS
PubMed
パブメドセントラル
Google Scholar
腸内細菌Bacteroidestaiotaomicronにおける多糖の利用は複数のシグナルによって制御されている。腸内細菌Bacteroides thetaiotaomicronにおける多糖の利用は複数のシグナルに支配されている。2016;7:e01342-16.
論文
論文
PubMed
パブメドセントラル
Google Scholar
河口域のマングローブ堆積物から分離された新規Mangrovimonas類似株の比較ゲノム解析から、キシランとアラビナンの利用遺伝子が明らかになった。Mar Geonomics. 2016;25:115-21.
論文
Google Scholar
Zhu X-Y, Liu J, Xue C-X, Tian J, Zhang X-H. Shift and metabolic potentials of microbial eukaryotic communities across the full depths of Mariana Trench. Front Microbiol. 2021;11:603692.
論文
PubMed
パブメドセントラル
グーグル奨学生
小林秀行、畑田康弘、坪内孝夫、長濱政治、高見英樹. 深海底に埋もれた木くずを消化するユニークなセルラーゼを持つハダル両生類Hirondellea gigas。PLoS One. 2012;7:e42727.
論文
論文
PubMed
パブメドセントラル
グーグル奨学生
植物プランクトンの開花によって引き起こされる海洋細菌プランクトン集団の基質制御による継代。Science. 2012;336:608-11.
論文
論文
パブコメ
グーグル
鄭YF, 王JY, 周S, 張YH, 劉J, 薛CX, et al. 海洋の無酸素・高圧環境において細菌はジメチルスルホニオプロピオン酸を生産する重要な細菌である。Nat Commun. 2020;11:4658.
論文
論文
PubMed
パブメドセントラル
Google Scholar
Bolger、Lohse、Usadel、B. Trimmomatic:イルミナ配列データ用の柔軟なトリマー。Bioinformatics. 2014;30:2114-20.
論文
論文
パブコメ
パブメドセントラル
Google Scholar
MEGAHIT v1.0:先進的な方法論とコミュニティーの実践による高速でスケーラブルなメタゲノムアセンブラー。Methods. 2016;102:3-11.
論文
論文
PubMed
Google Scholar
Hyatt D, Chen G-L, LoCascio PF, Land ML, Larimer FW, Hauser LJ. Prodigal: 原核生物の遺伝子認識と翻訳開始部位の同定。BMC Bioinf. 2010;11:1-11.
論文
Google Scholar
dbCAN2: a meta server for automated carbohydrate-active enzyme annotation. Nucleic Acids Res. 2018;46:W95-101.
論文
CAS
PubMed
PubMedセントラル
Google Scholar
MEGANコミュニティ版-大規模マイクロバイオームシーケンスデータのインタラクティブな探索と解析。PLoS Comput Biol.
論文
PubMed
パブメドセントラル
Google Scholar
メタゲノムからの迅速なsmall-subunit rRNAプロファイリングとターゲットアセンブリ。Msystems. 2020;5:e00920-20.
論文
論文
論文
パブメドセントラル
Google Scholar
Dixon P. VEGAN, a package of R functions for community ecology. J Veg Sci. 2003;14:927-30.
論文
Google Scholar
Parks DH, Imelfort M, Skennerton CT, Hugenholtz P, Tyson GW. CheckM: 分離株、単細胞、メタゲノムから回収した微生物ゲノムの品質評価。Genome Res.
論文
論文
PubMed
パブメドセントラル
Google Scholar
(注1)この論文では、「alignment(アラインメント)」と「alignment(アラインメント)」の2つの分類法を用いている。大規模アラインメントのためのFastTree 2-近似最尤木。PLoS One. 2010;5:e9490.
論文
論文
パブメドセントラル
Google Scholar
Prokka: 迅速な原核生物ゲノムアノテーション。Bioinformatics. 2014;30:2068-9.
論文
論文
パブコメ
Google Scholar
MEROPS データベース、基質、阻害剤、および PANTH のペプチダーゼとの比較。2017年のタンパク質分解酵素、その基質および阻害剤のMEROPSデータベース、およびPANTHERデータベースのペプチダーゼとの比較。Nucleic Acids Res. 2017;46:D624-32.
論文
PubMed中央
Google Scholar
硫酸化生体分子の多様性のマッチング:基質特異性を反映した硫酸化酵素の分類データベースの作成。PLoS One. 2016;11:e0164846.
論文
PubMed
PubMed Central
グーグル奨学生
Alejandre-ColomoC、Francis B、Viver T、Harder J、Fuchs BM、Rossello-Mora R、et al.栽培可能なWinogradskyella種は、同所的に豊富な候補種とはゲノム的に異なる。ISME Commun. 2021;1:51.
Ausland、Zheng J、Yi H、Yang B、Li T、Feng X、et al. dbCAN-PUL:実験的に特徴付けられたCAZyme遺伝子クラスターとその基質のデータベース。Nucleic Acids Res.
論文
論文
パブコメ
Google Scholar
Wick RR, Judd LM, Gorrie CL, Holt KE. Unicycler: 短いシーケンスリードと長いシーケンスリードから細菌ゲノムアセンブリを解決する。PLoS Comput Biol.
論文
PubMed
パブメドセントラル
Google Scholar
筑波大学大学院医学系研究科・医学博士課程修了。RNAmmer:リボソームRNA遺伝子の一貫した迅速なアノテーション。Nucleic Acids Res.
論文
論文
医学・薬学
パブメドセントラル
グーグル奨学生
加藤和彦, Rozewicki J, 山田耕平. MAFFTオンラインサービス:多重配列アライメント、対話的配列選択、可視化。Briefings Bioinf. 2017;20:1160-6.
論文
グーグル・スカラー
Capella-Gutiérrez S, Silla-Martínez JM, Gabaldón T. TrimAl: a tool for automated alignment trimming in large-scale phylogenetic analyses. Bioinformatics. 2009;25:1972-3.
論文
論文
パブメドセントラル
Google Scholar
ラングミードB, サルツバーグSL. Bowtie 2による高速ギャップドリードアライメント。Nat Methods. 2012;9:357-9.
論文
論文
パブコメ
パブメドセントラル
グーグル奨学生
Li B, Dewey CN. RSEM:参照ゲノムの有無にかかわらず、RNA-Seqデータからの正確な転写産物定量。BMC Bioinf. 2011;12:323.
論文
CAS
Google Scholar
edgeR:デジタル遺伝子発現データの差分発現解析のためのバイオコンダクターパッケージ。Bioinformatics. 2010;26:139-40.
論文
論文
パブコメ
グーグル
参考文献ダウンロード
謝辞
R/V Dong Fang Hong 2のすべての科学者と乗組員に感謝する。
資金提供
本研究は、中国国家自然科学基金(第41976101号、第92051115号、第92251303号)、老山実験室(LSKJ202203206号)、山東省自然科学基金(ZR2022YQ38号)、中央大学基礎研究基金(No. 202141009および202172002)、英国生物工学・生物科学研究評議会(BB/X005968)、英国自然環境研究評議会(NE/P012671、NE/S001352、NE/X000990およびNE/X014428、DLSと共同)、およびLeverhulme trust(RPG-2020-413)の助成金をJDTの研究室で受けた。
著者情報
著者ノート
Xiao-Yu ZhuとYang Liは本論文に等しく貢献した。
著者および所属
中国海洋大学海洋生命科学学院深海多圏・地球システムフロンティア科学センター(〒266003 中国青島市玉山路5号
朱暁宇、李楊、薛春薛、張暁華、劉継文
中国青島市老山実験室 海洋生態環境科学実験室 〒266273
朱暁宇、李楊、薛春薛、張暁華、劉継文
中国海洋大学進化・海洋生物多様性研究所、青島、266003、中国
朱暁宇、李楊、薛春薛、張暁華、劉継文
イースト・アングリア大学生物科学部、ノリッジ・リサーチ・パーク、ノリッジ、NR4 7TJ, UK
朱暁宇、ジョナサン・D・トッド、デビッド・J・リースミス
分子微生物学: シェフィールド大学バイオサイエンス学部、シェフィールド、S10 2TN, UK
イアン・D・E・A・リドベリー
中国教育部海洋大学海洋物理学重点実験室、青島、266100、中国
Jiwei Tian
貢献
JWLとX-HZが研究の構想を練った。X-YZはバイオインフォマティクス解析を行い、YLはウェット実験を行った。原稿はX-YZ、YL、JWLが執筆。X-HZ、C-XX、IDL、JDT、DJL-S、JTが査読を行った。
責任著者
Jiwen Liuまで。
倫理申告
倫理承認および参加同意
該当なし。
出版に関する同意
該当なし
競合利益
著者らは、競合する利害関係がないことを宣言する。
その他の情報
出版社ノート
シュプリンガー・ネイチャーは、出版された地図の管轄権の主張および所属機関に関して中立を保つ。
補足情報
追加ファイル1:
図S1. Nunoura et al.[2]の16S rRNA遺伝子配列決定に基づく、マリアナ海溝の水柱におけるバクテロイデーテスの分布。図S2. 全サンプルにわたるバクテロイデーテス群集のNMDS(Non-metric Multi-Dimensional Scaling)解析。網掛け楕円は80%信頼区間を表す。図S3. 全サンプルにわたるBacteroidetesのGHおよびPL遺伝子のNMDS解析。網掛け楕円は80%信頼区間を表す。図S4. マリアナ海溝、北海南部(藻類ブルーム)、太平洋表層におけるBacteroidetes MAGsの相対存在量(マップされたリードの割合)。図S5. 各MAGにおけるGH遺伝子とPL遺伝子の構成に基づくNMDS解析によって示されたBacteroidetes MAGのBray-Curtis非類似度。網掛け楕円は80%信頼区間を表す。図S6. Olleya aquimaris DSM 24464をアウトグループとした16S rRNA遺伝子配列に基づくMTRN7と近縁種の系統樹。図S7. 栄養豊富な2216E培地を供給した場合のMTRN7株の室温での高圧耐久性。図S8. マリアナ海溝の全水柱におけるMTRN7株アラビナンPULの相対存在量。図S9. MTRN7株におけるアラビナン分解経路の予測。ローカスタグ(APDGNPDO_#)は括弧内の番号で示す。SignalP [3]の結果に基づき、シグナルペプチドを持つ酵素はペリプラズム空間および/または外膜に関連する分泌酵素とみなし、シグナルペプチドを持たない酵素は細胞質タンパク質とみなした。アラビナン類はまずアラビノオリゴ糖に分解され、SusC/D輸送系を通してペリプラスムへ移行する。これらのオリゴアラビノースはさらに分解され、より低レベルのオリゴアラビノースあるいはアラビノースとなり、MFSトランスポーターによって細胞質に輸送される。細胞質では、すべてのオリゴアラビノースはアラビノースに分解される。最後に、アラビノースイソメラーゼがアラビノースをリブロースに変換し、リブロースはペントースリン酸経路に入るリブロース-5-リン酸に変換される。XynD(アラビノキシランアラビノフラノヒドロラーゼ、APDGNPDO_02643)は、アラビノキシランのO-2-またはO-3-一置換キシロース残基からアラビノース単位を切断する機能を考慮し、このプロットには示されていない。SSF(ナトリウム/糖共輸送体、APDGNPDO_02653)とSusB(α-グルコシダーゼ、APDGNPDO_02654)も含まれていないが、これらはどちらもグルカンの分解と吸収に関与していると考えられる。図S10. MTRN7アラビナンPULに位置するGH43、GH51、GH127ファミリーのCAZymes、アラビナンPULの30遺伝子上流に位置するGTPase(APDGNPDO_02636)、アラビナンPULの外側に位置するGH43_28酵素(APDGNPDO_01973)の最尤樹。各酵素のツリーはNCBIからダウンロードした100のホモログを用いて構築した。MTRN7由来の酵素は赤文字で示した。これらの酵素は分離された環境に基づいてグループ分けされた: 黒は陸上または淡水、青は海洋。図S11. 2%アラビナンを炭素源とする海洋最小培地(MMM)を用い、2℃で異なる圧力下でMTRN7を増殖させた。
追加ファイル2:
表S1. 本研究で使用したメタゲノム。表S2. 異なるサンプルにおけるBacteroidetes CAZyme遺伝子の相対存在量(100万リードあたりのコピー数)。表S3. 本研究で使用したMAGのゲノム情報。表S4. メタゲノムサンプル中の全MAGのゲノム相対存在量(マップされたリードの割合)。表S5. 本研究で使用した全てのMAGにおける予測PUL。表S6. すべてのMAGにおけるCAZyme遺伝子の分布。表S7. 本研究で使用したメソフラビバクターゲノムのゲノム情報。表S8. Mangrovimonas sp. ST2L15とMesoflavibacter profundi MTRN7におけるアラビナンPUL遺伝子の一対比較。表S9. 海洋ミネラル培地(MMM)の成分。表S10. RT-qPCRに用いたプライマー。表S11.遺伝子クローニングに用いたプライマー。切断部位には下線を引いた。
権利と許可
オープンアクセス この記事はクリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを与え、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合を示す限り、いかなる媒体または形式においても使用、共有、翻案、配布、複製を許可する。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表記に別段の記載がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。この記事のクリエイティブ・コモンズ・ライセンスに含まれていない素材で、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを閲覧するには、http://creativecommons.org/licenses/by/4.0/。クリエイティブ・コモンズ・パブリック・ドメインの権利放棄(http://creativecommons.org/publicdomain/zero/1.0/)は、データへのクレジット表記に別段の記載がない限り、この記事で利用可能となったデータに適用されます。
転載と許可
この記事について
アップデートを確認する。CrossMarkで最新性と真正性を確認する。
この記事の引用
Zhu,XY.,Li,Y.,Xue,CX.他:マリアナ海溝に生息する深海性バクテロイデーテスは、通常陸上系と関連するヘミセルロースとペクチンの分解に特化している。Microbiome 11, 175 (2023). https://doi.org/10.1186/s40168-023-01618-7
引用文献のダウンロード
受領
2023年06月07日
受理
2023年7月11日
掲載
2023年08月07日
DOI
https://doi.org/10.1186/s40168-023-01618-7
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアティブSpringer Nature SharedItにより提供されています。
キーワード
ハダル海溝
メタゲノミクス
沈殿物
細胞壁多糖利用
バクテロイデーテス
マイクロバイオーム
ISSN: 2049-2618
お問い合わせ
投稿に関するお問い合わせ: lyndie.manicani@springernature.com
一般的なお問い合わせ: info@biomedcentral.com
ブログを読む
BMCニュースレターを受け取る
記事アラートの管理
言語校正
著者のための科学的校正
ポリシー
アクセシビリティ
プレスセンター
サポートとお問い合わせ
フィードバックを残す
採用情報
BMCをフォローする
BMCツイッターページ
BMC Facebookページ
BMC微博ページ
このウェブサイトを使用することで、当社の利用規約、お客様の米国におけるプライバシー権、プライバシーステートメント、およびクッキーポリシーに同意したものとみなされます。プライバシーに関する選択/プリファレンスセンターで弊社が使用するCookieを管理する。
シュプリンガー・ネイチャー
別段の記載がない限り、© 2023 BioMed Central Ltd. シュプリンガー・ネイチャーの一部です。
この記事が気に入ったらサポートをしてみませんか?
