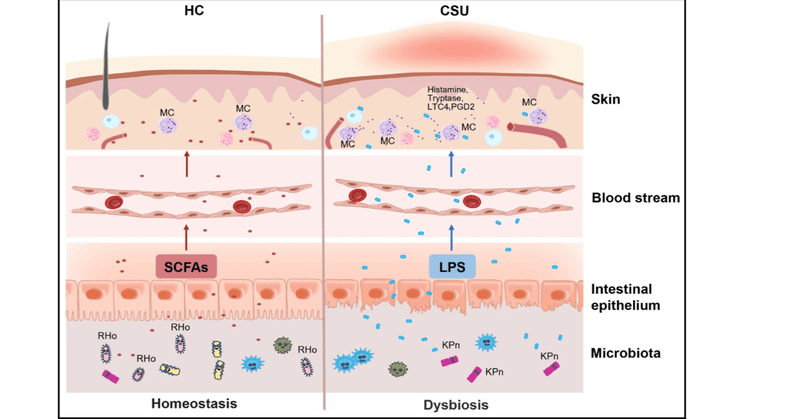
腸内細菌叢は慢性自然じんま疹を促進する
本文へスキップ
ネイチャー・コミュニケーションズ
検索
ログイン
コンテンツ
Natureについて
掲載
記事
PDFダウンロード
記事
オープンアクセス
出版:2024年01月02日
腸内細菌叢は慢性自然じんま疹を促進する
https://www.nature.com/articles/s41467-023-44373-x

Lei Zhu, Xingxing Jian, ...Jie Li 著者一覧を見る
ネイチャーコミュニケーションズ15巻、記事番号:112(2024)この記事を引用する
1 Altmetric
メトリクス詳細
要旨
慢性自然じんま疹(CSU)には腸内細菌異常症が伴うが、その関連性はいまだ不明である。ここでは、メタゲノミクスシークエンシングと短鎖脂肪酸メタボロミクスを用いて、ヒトCSU糞便微生物移植、Klebsiella pneumoniae、Roseburia hominis、および代謝産物の生体内における影響を評価する。CSUの腸内細菌叢は多様性と短鎖脂肪酸産生が低いが、腸内Klebsiella pneumoniaeレベルは高く、血中短鎖脂肪酸レベルと負の相関を示し、高い疾患活動性と関連している。血中リポポリサッカライド濃度は上昇し、急速な疾患再発と関連し、条件付き病原性細菌の腸内濃度が高い。CSUマイクロバイオーム移植とKlebsiella pneumoniae移植は、レシピエントマウスにおいて、IgEを介した肥満細胞(MC)駆動性の皮膚炎症反応を促進し、腸管透過性と血中リポ多糖蓄積を増加させる。Roseburia hominisの移植とカプロン酸の投与は、レシピエントマウスをMC駆動性の皮膚炎症から保護した。ここでは、CSUにおける腸内細菌叢の変化が、それぞれ短鎖脂肪酸を減少させ、リポ多糖レベルを増加させ、MC駆動性皮膚炎症を促進する可能性を示している。
他の人が見ている類似コンテンツ
トランスバクセン酸はCD8+T細胞と抗腫瘍免疫を再プログラムする
論文公開 2023年11月22日
ハオ・ファン、シユアン・シャ、...ジン・チェン
個別化医療におけるマイクロバイオームの活用
論文 2023年12月18日
カリーナ・ラティナー、ドラゴス・シオカン、...エラン・エリナフ
健康と疾患における微生物叢
論文オープンアクセス 2022年4月23日
ホウ・カイジャン, ウー・ズーシュン, ... チェン・チェシェン
はじめに
慢性蕁麻疹(CU)は、再発性の膨疹と血管浮腫を特徴とする一般的で衰弱性の炎症性皮膚疾患である1。最近のシステマティックレビューでは、CUの有病率は0.7%であったが、地域差がかなりあり、ラテンアメリカとアジアで有病率が高かった2。ごく最近の全国横断研究では、中国におけるCUの有病率は2.6%と推定されている2,3。
慢性自然じんま疹(CSU)は最も一般的なタイプのCUである。CSUの罹病期間は平均1~4年と長く、1年以上、5年以上、20年以上罹病する患者はそれぞれ83%、55%、27%である1,4。CSUの再発率、すなわちコントローラー療法5を中止して完全寛解した患者にCSUの徴候や症状が再び出現する率は約13%である6。
患者および社会にとってCSUの負担は大きい。ほとんどのCSU患者は、睡眠、学校や職場でのパフォーマンス、性的健康、感情的・身体的幸福感に有害な影響を及ぼし、著しいQOL障害を経験する4,7。CSUの1次治療として推奨されている抗ヒスタミン薬や2次治療として推奨されているオマリズマブによる治療では、患者の半数までが十分な反応を示さない。より良い治療法が必要であり、そのためにはCSUの病態をより深く理解することが重要である8,9。
CSUの病態は完全には解明されていない。膨疹および血管浮腫の発症は、皮膚マスト細胞(MC)とその活性化、脱顆粒およびメディエーターの放出によって引き起こされ、IgEおよびIgG自己抗体は、CSUの亜集団において皮膚MCを活性化することが知られている10,11。CSUの皮膚MCは、活性化に対する感受性が増加している12,13。これが、活性化閾値を低下させるシグナルによるものなのか、抑制性シグナルへの曝露が減少したためなのかは、現在のところ不明である。
MCの活性化閾値を低下させるシグナルには、IL3314のような炎症性サイトカインや、リポ多糖(LPS)15のような細菌産物がある。対照的に、Siglec6や817,18などの抑制性受容体16や、プロピオン酸や酪酸などの短鎖脂肪酸(SCFA)の関与は、MCの活性化を抑制する19。LPS、SCFA、およびMCの活性化閾値に影響を及ぼすその他の因子は、腸内細菌叢によって産生される20。
腸内細菌叢は腸のホメオスタシスを維持し、腸壁の完全性を確保する上で重要な役割を果たし、免疫バランスを調整している21。腸内細菌のホメオスタシスは、クロストリジウム・レプタム属やロゼブリア属を含むファーミキューテス属によって産生・放出されるSCFAに部分的に依存している22,23。SCFAは腸内病原体、例えば大腸菌やクレブシエラ菌24の増殖と病原性を制御する。SCFAはまた、上皮細胞増殖の支援、低酸素誘導因子の安定化、タイトジャンクション分子(オクルディン-1、ゾヌラ・オクルデンス-1[ZO-1]、ムチン2[MUC-2]など)の発現のアップレギュレーション25、腸管上皮細胞を保護する抗菌ペプチドの産生23などにより、上皮バリア機能を促進し、病原性細菌による破壊やLPSなどの有害物質が血液中に流入するのを防ぐ25,26。グラム陰性菌の細胞壁の構成成分であるLPSは、Toll様受容体4(TLR4)27を介して、IgEによるMCの脱顆粒を促進する。さらに、LPSはTLR4を介してMCを直接活性化し、TNFαやIL628などの炎症性メディエーターの放出を誘導する。
重要なことは、SCFAは抗炎症作用もあるということである。SCFAは、プロスタグランジンE2の放出と抗炎症性サイトカインIL10の発現を誘導し、エピジェネティックな制御を介してIgEおよび非IgE媒介刺激後のMCの活性化を抑制する。これらの作用は、アレルギー性疾患や他のMC媒介性疾患において有益であると提唱されている19,29。
腸内細菌叢がCSUの病因に関与していることは、いくつかの独立した証拠によって裏付けられている30,31,32,33,34。第一に、最近の研究で、CSUでは腸内細菌叢の組成が変化し、アレルギー疾患のリスク因子として知られる細菌の多様性が低下していることが示された35。第2に、CSUにおける血清メタボローム解析では、MC活性化の阻害因子として知られるSCFAsのレベルが低下していることが示された35。第3に、CSU患者における腸内細菌叢の変化は、炎症レベル、罹病期間、治療反応性と相関していた36,37。第4に、CSU患者にはプロバイオティクス治療が有効である38。現在のところ、CSUにおける腸内細菌叢の正確な役割と関連性、およびそのメカニズムについては、まだ十分に解明されていない。
このアンメット・ニーズを解決するために、われわれはCSU患者と健常対照者の腸内細菌叢をメタゲノム解析とメタボローム解析によって調べ、その差異を機能的関連性として評価した。まず、血中SCFAおよびLPSレベルや臨床的特徴との相関を検証した。次に、腸内細菌叢の変化、LPSの血中濃度、疾患の再発との相関を評価した。次に、糞便微生物移植(FMT)によりCSU患者のマイクロバイオームをマウスに養子移入し、腸管透過性、血中LPS濃度、IgEを介したMC依存性皮膚炎症反応である受動的皮膚アナフィラキシー(PCA)の変化を評価した。最後に、Roseburia hominisまたはSCFA、あるいはKlebsiella pneumoniaeまたはLPSをマウスに養子移入し、受動的皮膚アナフィラキシーを誘発・評価することで、CSUマイクロバイオームがin vivoでMC依存性皮膚炎症に及ぼす影響の根本的なメカニズムを明らかにした。
結果
CSU患者のマイクロバイオームは、多様性の低下とSCFA産生腸内細菌レベルの顕著な低下によって特徴づけられる
CSU患者26名と年齢・性別をマッチさせた健常対照者26名から新鮮な便サンプルを採取し、メタゲノムシークエンシングを行った。CSU患者29例および健常対照38例の血漿サンプルを採取し、代謝シーケンシングを行った。CSU患者16人および年齢・性別をマッチさせた健常人16人の血漿サンプルを採取し、LPS検出を行った(補足図1、補足表1)。CSU患者では、腸内細菌叢の組成が健常対照者と比べて著しく異なっていた(図1a左パネル)。まず、腸内細菌叢のα多様性、すなわちシャノン指数とシンプソン指数が有意に減少していた(P < 0.05、図1a右パネル)。これは、糞便サンプル(n = 26ずつ、補足表2)のメタゲノム配列決定によって評価された。第二に、CSU患者はHCと比較して、科レベルではRikenellaceae、属レベルではAlistipes(補足図2a、b)、種レベルではRoseburia hominis(図1b)のような主要なSCFA産生菌のレベルが著しく低かった。
図1:CSUは、腸内細菌叢の多様性の低下、SCFA産生腸内細菌のレベルの低下、条件付き病原性腸内細菌のレベルの上昇、SCFAの血中濃度の低下、LPSの血中濃度の上昇を伴い、これらが疾患の再発を促進する。
図1
a PCoAは、PERMANOVAによって決定されたBray-Curtis非類似度に基づくβ-多様性と、シャノン指数およびシンプソン指数によるα-多様性を示す。b MaAsLin2によって同定された15種のBH補正による差異。#c HCとCSUのSCFA産生菌の比較。 d ターゲットメタボロミクスによる酢酸、プロピオン酸、カプロン酸の存在量。 e SCFAと差分菌種の間のスピアマンの相関。赤と青のブロックはそれぞれ正と負の相関を示す。h LPS関連代謝経路とHCとCSUのLPSレベルの比較。 i 血漿中LPSとSCFA産生菌または日和見病原体の総和とのスピアマンの相関。線は全体的な線形適合の中心を表し、灰色の部分は95%信頼区間の標準誤差を表す。 j 無再発性解析は、15種の差分または血漿中LPSに基づき、log-rank検定により行った。データは平均値±SEMで示した。a右、c、g右、h左には両側Wilcoxon検定を用いた。d, h右については両側t検定を用いた。バイオリンプロットの形とひげはそれぞれ、a, bではデータの密度分布と全体の範囲を表し、箱の中心と境界はそれぞれ、a-c, g, hでは中央値、下位四分位値(Q1)、上位四分位値(Q3)を表す。 SCFAs short-chain fatty acids, HC healthy controls, CSU chronic spontaneous urticaria, BMI body mass index, UAS7 weekly urticaria activity score, DLQI Dermatology Life Quality Index, UCT Urticaria Control Test。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
全対象者の少なくとも50%に存在する15種の中核菌種を差分比較したところ、CSUでは10種の存在量が減少し、そのすべてがSCFA産生菌であった(図1b、補足表2)。CSU患者は全体として、SCFA産生腸内細菌叢がHCより有意に少なく(図1c)、酢酸、プロパン酸、カプロン酸を含むSCFAの血中濃度が有意に低かった(図1d)。CSUでは、カプロン酸の血中濃度が低く、SCFA産生菌のレベルが低いことが、クレブシエラ肺炎や大腸菌などの日和見病原体のレベルの上昇と関連していた(図1e、補足図2c、補足表2)。
CSU患者のマイクロバイオームでは日和見病原性腸内細菌が高レベルであった
HCの主要ハブ種はすべてSCFA産生菌であった(Dorea longicatena、Lachnospiraceae菌、Ruminococcus obeum、Ruminococcus sp.など、補足図2d)。一方、CSUの主要ハブ菌種はすべて日和見病原体であった(Klebsiella pneumoniae、Streptococcus salivarius、Streptococcus parasanguinis、Veillenella parvulaなど(補足図2d、e))。CSU患者のHCに対する比較では、腸内細菌科、ペプトストレプトコッカス科(補足図2a、f)のような条件付き病原性細菌の腸内レベルが著しく上昇した。属および種レベルでは、CSU患者はKlebsiella(補足図2b)およびKlebsiella pneumoniae、Bacteroides stercoris、Escherichia coli(図1b)の相対量の増加をそれぞれ示した。さらに、ROC解析による肺炎桿菌の腸内レベルは、CSUとHCを診断上区別し(AUC>0.7、補足図2g)、CSUの疾患活動性と相関した(図1f)。
特にCSU患者では、腸壁の完全性に害を及ぼす日和見病原体、例えばLPSの主要産生菌であるKlebsiella pneumoniae、Escherichia coli、Ruminococcus gnavusが多かった(P = 0.002、図1g)。差次分析により、CSUにおいて6つの代謝経路が顕著に発現上昇していることが同定され、中でもLPS生合成のスーパー経路が顕著であった(図1h左パネル)。CSU患者の血中LPS濃度はHCより高く(P < 0.05、図1h右パネル)、SCFA産生菌とは負の相関があり(P < 0.05、図1i左パネル)、日和見病原性細菌とは正の相関があった(P < 0.05、図1i右パネル)。菌種レベルでは、血中LPS濃度は、主要なSCFA産生菌であるRuminococcus obeumおよびRoseburia hominisと負の相関を示した(P<0.05、図1f)。
メタゲノムシークエンシングを受け、寛解と再発の追跡調査を受けた22人のCSU患者のうち、17人は最近5年間に自然寛解を示し、7人は再発を経験した。この再発は、SCFA産生菌の低レベルと日和見病原細菌の高レベル(それぞれP = 0.024、P = 0.047、補足図2h)、LPS血中濃度の高さ(P = 0.0123、図1j右パネル)、および15種の鑑別種(図1j左パネル)と関連していた。
CSUのマイクロバイオームは、肥満細胞主導性の皮膚炎症、腸管透過性、および血中LPS濃度を増加させる
次に、CSU腸内細菌叢がMC駆動性皮膚炎症反応に及ぼす影響を評価した。この目的のために、CSU患者またはHCのマイクロバイオームを、糞便微生物移植(FMT)によって、抗生物質による細菌枯渇を起こしたマウスに養子移入した(図2a、補足図3)。メタゲノムシークエンシングで評価したところ、CSU FMTはHC FMTとは異なり、レシピエントマウスのマイクロバイオームを著しく変化させた(補足図4a、b)。さらに重要なことに、HC FMTではなくCSU FMTは、レシピエントマウスの受動的皮膚アナフィラキシー(PCA)反応を有意に増加させた。 0001, 図2b)、MC脱顆粒(+240%, P < 0.0001, 図2c)、さらにFACSで検出された皮膚組織中のMC(CD45+CD117+FcεRIα+細胞)39の割合が有意に増加した(P < 0.001, 図2d)。さらに、CSU FMTは、HC FMTと比較して、レシピエントマウスの腸管透過性を増加させた(+20%、P < 0.01、図2e)。CSU FMTが粘膜の完全性に及ぼす影響をより明確にするために、レシピエントマウスの結腸における上皮タイトジャンクション分子の発現を評価した。CSU FMTは、ZO-1、MUC-2、オクルディン、TJP2、およびCGNを含むバリア機能マーカーのmRNA発現およびタンパク質レベルを低下させた(図2f、g)。さらに、CSU FMTは、IL4、IL13、Tnfa、およびIL10のmRNA発現(P < 0.01、図2h)、IL4、IL13、およびヒスタミンの皮膚または血漿レベル(図2i、j)、ならびに血漿LPSレベル(図2k)を上昇させた。
図2:CSUのマイクロバイオームは肥満細胞主導性の皮膚炎症、腸透過性、および血中LPS濃度を増加させる。
図2
b 代表的な耳の画像とエバンスブルー色素の定量(n = 8/群。コントロール vs PCA、P < 0.0001;FMT-HC_PCA vs FMT-CSU_PCA、P < 0.0001)。 c マウスの耳におけるMCの代表的な画像(400倍)と脱顆粒したMCの割合。コントロール(n = 6)対PCA(n = 6)、P < 0.0001;PCA対FMT-HC_PCA(n = 5)、P < 0.0001;FMT-HC_PCA対FMT-CSU_PCA(n = 5)、P < 0.0001。 d マウス皮膚におけるフローサイトメトリーの代表画像とMCの割合(n = 5/群。コントロール vs PCA、P = 0.0071;FMT-HC_PCA vs FMT-CSU_PCA、P = 0.0008)。 e 血清中に検出されたFITC-デキストランの量(n = 7/群、コントロール vs FMT-CSU、P = 0.0053;FMT-HC vs FMT-CSU、P = 0.0075)。 f 免疫組織化学の代表的画像(400倍)とマウス結腸におけるZO1とMUC2の定量。FMT-HC vs FMT-CSU、P = 0.0132(ZO1)、0.0371(MUC2)。 g マウス結腸におけるZo1、Occludin、Tjp2、CgnのmRNA発現。FMT-HC vs FMT-CSU、それぞれP = 0.0421(Zo1)、<0.0001(Occludin)、P = 0.0228(Tjp2)、0.0215(Cgn)。h 耳の皮膚におけるIl4、Il13、TnfαおよびIl10のmRNA発現(コントロール vs PCA、P = 0.0388、0.0050、0.0109、0.0191;FMT-HC_PCA vs FMT-CSU_PCA、P = 0. FMT-HC_PCA対FMT-CSU_PCA、P = 0.0018、0.0020、<0.0001、0.0002(それぞれIl4、Il13、Tnfα、Il10);PCA対FMT-HC_PCA、P = 0.0235(Il13)、0.0215(Tnfα) i マウス耳介皮膚におけるIL4、IL13、ヒスタミンのレベル(n = 6/群。コントロール vs PCA、P = 0.0019、0.0033、0.0032;FMT-HC_PCA vs FMT-CSU_PCA、それぞれIL4、IL13、ヒスタミンについてP = 0.0321、0.0410、0.0405)およびj ELISAによって検出された血漿(n = 6/群。コントロール vs PCA、P = 0.0003、0.0012、<0.0001;FMT-HC_PCA vs FMT-CSU_PCA、IL4、IL13、ヒスタミンについてそれぞれP = 0.0012、0.0023、0.0019)。 k ELISAで検出された血漿中のLPS(n = 8/グループ。) *P<0.05、***P<0.01、***P<0.001、***P<0.0001、Tukeyの多重比較検定による一元配置分散分析(b-f、g、Zo1/Occludin/Tjp2、h-k)またはBrown-Forsythe and Welch ANOVA検定(g、CGN)に基づく。データは3回の独立実験の平均値±SEMで示した。コントロール: 溶媒;PCA:溶媒+IgE/DNP-HSA;FMT-HC_PCA:健常対照からのFMT+IgE/DNP-HSA;FMT-CSU_PCA:CSU患者からのFMT+IgE/DNP-HSA。FMT糞便微生物移植、MC肥満細胞。gとhで使用した生物学的に独立したサンプルの数は図に描かれている。ソースデータはソースデータファイルとして提供される。
フルサイズ画像
Roseburia hominisと短鎖脂肪酸はマスト細胞による皮膚炎症を抑制し、一方Klebsiella pneumoniaeとLPSはマスト細胞による皮膚炎症を悪化させる。
RT-PCR(図3b)によって確認されたように、SCFA産生菌Roseburia hominis(図3a)をマウスに移植すると、標的メタボロミクス(図3c)によって評価されたように、腸内SCFAレベル(酪酸、イソ酪酸、イソカプロン酸、カプロン酸)が著しく上昇した。3c)、血管透過性(図3d)、MCの脱顆粒(図3e)、皮膚組織のMC集団(CD45+CD117+FcεRIα+細胞)(図3f)、皮膚/血漿IL4、IL13、ヒスタミンレベル(図3g、h、i)などのPCA反応を改善した。さらに、カプロン酸塩は、GPR41(Gタンパク質共役型受容体4;図4a、b;補足図5)とは無関係に、in vitroでIgEを介したMCの活性化と細胞移動を阻害し、その経口投与は、in vivoでIgEを介したMCの活性化を有意に抑制した(図4c-f)。
図3:Roseburia hominisは肥満細胞による皮膚炎症を抑制する。
図3
a Roseburia hominis投与実験デザイン。 b RT-PCRによるRoseburia hominisの存在量。(n=4/グループ。非Abx+PCA vs 非Abx+RHo_PCA、P = 0.0050;Abx+PCA vs Abx+RHo_PCA、P < 0.0001)。 c SCFAの量は、マウスの糞便内容物から標的メタボロミクスによって検査した。Abx(n=3)対Abx+RHo_PCA(n=4)、それぞれP=0.0316(イソ酪酸)、0.0034(酪酸)、0.0390(イソカポレート)、0.0014(カポレート)。Abx+PCA(n = 4) vs Abx+RHo_PCA(n = 4)、P = 0.0116(酪酸)、0.0140(イソカポレート)、0.0036(カポレート)。 d 代表的な耳の画像とエバンスブルー色素の定量。Abx (n = 6) vs Abx+PCA (n = 9), P < 0.0001; Abx+PCA vs Abx+RHo_PCA (n = 10), P < 0.0001; Non-Abx_PCA (n = 9) vs Non-Abx+RHo_PCA (n = 10), P = 0.0106. e マウス皮膚における代表的な画像(倍率400倍)と脱顆粒したMCの割合。Abx(n=5)対Abx+PCA(n=5),P<0.0001;Abx+PCA対非Abx+PCA(n=5),P=0.0042;Abx+PCA対Abx+RHo_PCA(n=4),P<0. 0001;Abx+RHo_PCA vs 非Abx+RHo_PCA(n=4)、P=0.0157。 f フローサイトメトリーの代表画像と皮膚におけるMCの割合(n=5/群。Abx vs Abx+PCA、P < 0.0001;Abx+PCA vs 非Abx+PCA、P = 0.0376;Abx+PCA vs Abx+RHo_PCA、P < 0.0001;非Abx+PCA vs 非Abx+RHo_PCA、P = 0.0408)。 g マウス耳皮膚におけるIl4、Il13、Tnfα、Il10のmRNA発現(各群のnはSource Dataに記載。Abx vs Abx+PCA:それぞれ、P = 0.0011(Il4)、0.0002(Il13)、0.0004(Tnfα)、<0.0001(Il10);Abx+PCA vs 非Abx+PCA:それぞれ、P = 0.0005(Il4)、0.0333(Il10)。Abx+PCAとAbx+RHo_PCAの比較では、それぞれP<0.0001(Il4とIl13)、0.0005(Tnfα)、<0.0001(Il10)。非Abx+PCA vs 非Abx+RHo_PCA、P = 0.0434(Il10)。 h マウス耳介皮膚におけるIL4、IL13およびヒスタミンのレベル(n = 6/群。Abx対Abx+PCA、P<0.0001、0.0009、0.0021;Abx+PCA対Abx+RHo_PCA、P=0.0002、0.0077、0.0008、それぞれIL4,IL13,ヒスタミン)およびi ELISA法で検出した血漿(n=6/群。Abx対Abx+PCA、すべてP<0.0001;Abx+PCA対Abx+RHo_PCA、P=0.0004、0.0005、0.0007、それぞれIL4、IL13、ヒスタミンについて)。Abx:Abx入り飲料水;Abx+PCA:Abx入り飲料水+IgE/DNP-HSA;Non-Abx+PCA:溶媒入り飲料水+IgE/DNP-HSA;Abx+RHo_PCA:Abx入り飲料水+RHo入り経口投与+IgE/DNP-HSA;Non-Abx+RHo_PCA:溶媒入り飲料水+RHo入り経口投与+IgE/DNP-HSA。b、c、d-f右、g-iについては、Tukeyの多重比較検定を用いた一元配置分散分析を行った。データは3回の独立した実験の平均値±SEMで示した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。Abx抗生物質、RHo roseburia hominis。gに使用した生物学的に独立したサンプルの数は図に描かれている。ソースデータはSource Dataファイル(347/350)として提供される。
フルサイズ画像
図4:SCFAは肥満細胞駆動性の皮膚炎症と肥満細胞機能を減衰させる。
図4
a β-ヘキソサミニダーゼの放出(左:n=3/群。IgE vs IgE+DNP, IgE+DNP vs IgE+DNP+5uM Cap, いずれもP<0.0001)およびヒスタミン濃度(右:n=3/group. b BMMCの細胞遊走(n = 3/群、IgE vs IgE+DNP, P = 0.0007; IgE+DNP vs IgE+DNP+5uM Cap, P = 0.0005)。 c カプロン酸投与PCAモデルマウスの実験デザイン。 d PCA後の代表的な耳の画像とエバンスブルー色素の定量。コントロール(n = 5)対PCA(n = 6)、P < 0.0001;PCA対Cap_PCA(n = 6)、P = 0.0115。 e マウス耳における代表的な画像と脱顆粒したMCの割合。コントロール(n = 5) vs PCA(n = 6)、P = 0.0001; PCA vs Cap_PCA(n = 6)、P = 0.0001 f マウス耳介皮膚におけるIl4、Il13、TnfαおよびIl10のmRNA発現(n = 3/グループ。コントロール vs PCA、P = 0.0392、0.0133、0.0136、0.0070;PCA vs Cap_PCA、P = 0.0020、0.0005、0.0128、0.0025(それぞれIl4、Il13、Tnfα、Il10)。コントロール:溶媒を用いた経口投与;PCA:溶媒+IgE/DNP-HSAを用いた経口投与;Cap_PCA:カプロン酸+IgE/DNP-HSAを用いた経口投与。データは3回の独立実験の平均値±SEMで示した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
対照的に、肺炎桿菌のマウス腸管への養子移入は、レシピエントマウスにおいてPCA反応を増加させ、LPSの血中濃度を上昇させた(図5a-e)。LPSはin vitroではIgE誘導活性化を促進し(図5f)、in vivoではPCA炎症反応を増加させた(図5g-j)。LPSによるMC活性化のメカニズムをさらに評価するため、重要なLPS受容体TLR4を欠損したTlr4-/-マウスを用いた(図6a;補足図6a、b)。
図5:肺炎桿菌とLPSは肥満細胞主導性の皮膚炎症を悪化させる。
図5
a Klebsiella pneumoniae投与実験デザイン。 b 代表的な耳の画像とエバンスブルー色素の定量化。コントロール(n=9)対PCA(n=8)、P<0.0001;FMT-HC_PCA(n=8)対FMT-CSU_PCA(n=8)、P=0.0027;FMT-HC_PCA対KPn_PCA(n=10)、P<0. 0001; FMT-CSU_PCA vs KPn_PCA, P = 0.0314. c マウス耳におけるトルイジンブルー染色(倍率400倍)と脱顆粒したMCの割合の代表的な画像。コントロール(n = 5) vs PCA(n = 5)、P = 0.0018、PCA vs FMT-HC_PCA(n = 5)、P = 0.0174、FMT-HC_PCA vs FMT-CSU_PCA(n = 4)、P = 0.0028、FMT-HC_PCA vs KPn_PCA(n = 5)、P = 0.0012。 d 耳の皮膚におけるIl4、Il13のmRNA発現。Il4:PCA対FMT-CSU_PCA、P = 0.0150;PCA対KPn_PCA、P = 0.0002;FMT-HC_PCA対FMT-CSU_PCA、P < 0.0001。FMT-HC_PCA vs KPn_PCA、P < 0.0001。IL13:PCA vs KPn_PCA, P = 0.0088; FMT-HC_PCA vs KPn_PCA, P = 0.0002; FMT-HC_PCA vs FMT-CSU_PCA, P = 0.0247. e マウス血漿中のIL4、IL10、LPSのレベル。IL4:コントロール(n = 6)対KPn_PCA(n = 6)、P = 0.0250;FMT-HC_PCA(n = 7)対FMT-CSU_PCA(n = 7)、P = 0.0139。IL10:FMT-HC_PCA(n=6) vs FMT-CSU_PCA(n=8)、P=0.0371。LPS:PCA(n=5)対FMT-CSU_PCA(n=8)、P=0.0426;PCA対KPn_PCA(n=8)、P=0.0080;FMT-HC_PCA(n=6)対FMT-CSU_PCA(n=8)、P=0. 0469; FMT-HC_PCA vs KPn_PCA (n = 8), P = 0.0099. f BMMCにおけるβ-ヘキソサミニダーゼ遊離(n = 3/群。コントロール vs IgE+DNP, P = 0.0170; IgE vs IgE+DNP, P = 0.0170; IgE+DNP vs IgE+DNP + 100 ng/ml LPS, P = 0.0251)。 g LPS投与実験デザイン。 h 代表的な耳介画像とエバンスブルー色素の定量。コントロール(n = 5) vs PCA(n = 10)、P < 0.0001;PCA vs LPS_PCA(n = 10)、P = 0.0260。 i トルイジンブルー染色の代表的な画像(倍率400倍)と耳における脱顆粒したMCの割合。j マウス耳介皮膚におけるIl4、Il13、TnfαおよびIl10のmRNA発現。コントロール vs PCA、P = 0.0145(Il4)、0.0015(Il13)。PCA vs LPS_PCA、P = 0.0360(Il4)、0.0024(Il13)、0.0147(Tnfα)、0.0050(Il10)。コントロール 溶媒;FMT-HC_PCA:健常対照からのFMT+IgE/DNP-HSA;FMT-CSU_PCA:CSU患者からのFMT+IgE/DNP-HSA;KPn_PCA:KPn+IgE/DNP-HSAによる経口投与;LPS_PCA:LPS+IgE/DNP-HSAによる経口投与。一元配置分散分析とTukeyの多重比較検定 a-d、e IL4/LPS、f-jには一元配置分散分析を用いた。e IL10にはBrown-Forsythe and Welch ANOVA testを用いた。データは3回の独立した実験の平均値±SEMで示した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。KPn Klebsiella pneumonia、LPS lipopolysaccharides。dとjで使用した生物学的に独立したサンプルの数は図に描かれている。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
図6:TLR4は、LPSによって増悪した肥満細胞主導性の皮膚炎症において重要な役割を果たしている。
図6
a Tlr4+/+およびTlr4-/-マウスへのLPS投与実験デザイン。 b 代表的な耳の画像とエバンスブルー色素の定量。コントロール(n = 6)対PCA(n = 9)、P = 0.0004;PCA対Tlr4+/+-LPS_PCA(n = 9)、P = 0.0203;Tlr4+/+-LPS_PCA対Tlr4/-LPS_PCA(n = 7)、P = 0.0006。 c マウスの耳の皮膚におけるトルイジンブルー染色(倍率400倍)と脱顆粒したMCの割合の代表的な画像。コントロール(n = 4)対PCA(n = 5)、P = 0.0002; PCA対Tlr4+/+-LPS_PCA(n = 5)、P = 0.0110; Tlr4+/+-LPS_PCA対Tlr4/--LPS_PCA(n = 5)、P < 0.0001. d フローサイトメトリーの代表画像とマウス耳介皮膚における活性化MCの割合(n = 5/群。コントロール vs PCA、P = 0.0009;Tlr4+/+-LPS_PCA vs Tlr4-/--LPS_PCA、P = 0.0439)。 e マウス耳介皮膚におけるIl4、Il13、TnfαのmRNA発現(Il4:コントロール vs PCA、P = 0. 0030; PCA vs Tlr4+/+-LPS_PCA, P = 0.0094; Tlr4+/+-LPS_PCA vs Tlr4-/--LPS_PCA, P < 0.0001。Il13: PCA vs Tlr4+/+-LPS_PCA, P = 0.0007; Tlr4+/+-LPS_PCA vs Tlr4-/--LPS_PCA, P = 0.0005. Tnfα: f マウス耳介皮膚におけるIL4、IL13、ヒスタミンのレベル(コントロール、n=5;PCA、Tlr4+/+-LPS_PCA、Tlr4-/--LPS_PCA、n=6/群。コントロール対PCA、P = 0.0181(IL4)、0.0006(IL13);PCA対Tlr4+/+-LPS_PCA、P = 0.0152(IL-4)、0.0076(IL-13)、0.0166(ヒスタミン);Tlr4+/+-LPS_PCA対Tlr4/--LPS_PCA、P = 0.0017(IL4)、0. 0003(IL13)、および<0.0001(ヒスタミン)、それぞれ)およびELISAによって検出されたg血漿(コントロール、IL4についてn=6、IL13およびヒスタミンについてn=5;PCA、Tlr4+/+-LPS_PCA、Tlr4-/--LPS_PCA、n=6/グループ。コントロールとPCAの比較では、それぞれP = 0.0132(IL4)、0.0105(IL13)、0.0011(ヒスタミン);PCAとTlr4+/+-LPS_PCAの比較では、それぞれP = 0.0001(IL-4)、0.0297(IL-13)、0.0378(ヒスタミン);Tlr4+/+-LPS_PCAとTlr4/--LPS_PCAの比較では、それぞれP < 0. 0001 (IL4)、0.0003 (IL13)、<0.0001 (ヒスタミン)。h LPSで処理したTlr4+/+マウスおよびTlr4-/-マウスのBMMCにおけるβ-ヘキソサミニダーゼ遊離、細胞遊走およびヒスタミン濃度(n = 3/群)。Tlr4+/+IgE+DNP vs Tlr4-/-IgE+DNP, Tlr4+/+IgE+DNP + 10 ng/ml LPS vs Tlr4-/-IgE+DNP + 10 ng/ml LPS, Tlr4+/+IgE+DNP + 100 ng/ml LPS vs Tlr4-/-IgE+DNP + 100 ng/ml LPS, all P < 0. β-ヘキソサミニダーゼとヒスタミン放出については0001、細胞遊走についてはTlr4+/+IgE+DNP vs Tlr4-/-IgE+DNP、P = 0.0001。b-d右、e-gについては、Tukeyの多重比較検定を用いた一元配置分散分析を用いた。データは3つの独立した実験の平均値±SEMで示した。*eとgで使用した生物学的に独立したサンプルの数は図に描かれている。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
WTマウスとは対照的に、Tlr4-/-マウスのLPS処理では、PCA誘発血管透過性(図6b)、MC活性化(図6c、d)、皮膚や血漿中のIL4、IL13、ヒスタミンのアップレギュレーション(図6e-g)は増加しなかった。
また、Tlr4-/-マウス由来のMC(補足図6b、c)は、Tlr4+/+マウス由来のMC(図6h)と比較して、LPSとIgEを介したインキュベーション後の活性化および細胞運動性のレベルが低かった。最後に、KPNを移植したマウスを、肺炎桿菌40を駆除するセフォペラゾン/スルバクタム(CPZ/SBT)で処理したところ、PCA反応、LPSの血漿中濃度が著しく低下し、いくつかの示差的細菌の相対量が変化した(図7a-e、補足図6d)。
図7:セフォペラゾン/スルバクタムは肺炎桿菌増悪型PCA反応における肥満細胞の活性化を抑制した。
図7
a セフォペラゾン/スルバクタム処理肺炎桿菌移植マウスの実験デザイン。 b 代表的な耳の画像とエバンスブルー色素の定量。コントロール(n=4) vs KPn_PCA(n=7), P < 0.0001; KPn_PCA vs KPn_CPZ/SBT_PCA(n=7), P = 0.0006. c トルイジンブルーの代表画像(倍率400倍)と耳における脱顆粒したMCの割合。コントロール(n = 3)対KPn_PCA(n = 4)、P = 0.0021;KPn_PCA対KPn_CPZ/SBT_PCA(n = 4)、P = 0.0164。 d マウス耳皮膚におけるIl4、Il13、TnfαおよびIl10のmRNA発現。コントロール vs KPn_PCA、それぞれP = 0.0034(Il4)、0.0003(Il13)、0.0003(Tnfα)、0.0185(Il10);KPn_PCA vs KPn_CPZ/SBT_PCA、それぞれP = 0.0037(Il4)、0.0002(Il13)、0.0064(Tnfα)、0.0080(Il10)。 e ELISAによって検出されたLPSの血漿レベル。コントロール(n = 4)対KPn_PCA(n = 6)、P = 0.0003;KPn_PCA対KPn_CPZ/SBT_PCA(n = 6)、P = 0.0010。 f 慢性自然じんま疹を促進する腸内細菌叢の模式図。データは3回の独立実験の平均値±SEMで示した。*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。CPZ/SBT cefoperazone/sulbactam。dで使用した生物学的に独立したサンプルの数は図に描かれている。ソースデータはSource Dataファイルとして提供される。
フルサイズ画像
考察
本研究では、CSU患者の腸内細菌叢が健常対照者の腸内細菌叢とは著しく異なっていること、また、Roseburia hominisのようなSCFA産生菌の減少やKlebsiella pneumoniaeのような条件付き病原体の増加といった重要な違いが、in vivoにおけるIgEを介した皮膚肥満細胞駆動性の炎症反応の有意な増加と関連していることを示した(図7f)。
腸内細菌叢のアンバランスは、炎症性腸疾患や代謝障害を含むいくつかの慢性疾患の病因に関与していると考えられている41,42が、CSUにおける微生物叢の役割は不明である。すべてではないがいくつかの研究35と一致して、我々の結果は、CSU患者では腸内細菌叢のα多様性が減少していることを示している。さらに重要なことは、CSU患者では有益なSCFA産生菌が減少していることである。我々の知見は、CU30,31またはCSU35,43患者においてClostridium leptum、Ruminococcus bromii、Bacteroidesの濃度が低いという以前の報告と一致している。さらに、以前の研究では、ラクトバチルス菌やラクトバチルス菌とビフィドバクテリウムの組み合わせなどのSCFA産生菌の投与は、蕁麻疹のリスクを低下させ26、CUの重症度を低下させる44,45ことが示されており、SCFAはCSUを含むCUからの保護に重要な役割を果たしていることが示唆されている。
腸内細菌叢の主要かつ有益な代謝産物であるSCFAは、Gタンパク質共役受容体やヒストン脱アセチル化酵素47と相互作用することにより、重要な生理学的機能を有し、免疫学的ホメオスタシス46を維持する。これまでの研究では、食物繊維を多く摂取すると血中プロピオン酸濃度が上昇し、GPCR4148を介してアレルギー性炎症が抑制され、酪酸およびプロピオン酸はIgEまたは非IgEを介する肥満細胞の活性化を抑制した19,49。さらに、酪酸およびプロピオン酸は、CSU52,53の病因に関与するCD4(+)Th2細胞とIL4およびIL13を含むサイトカインを制御する制御性T細胞50,51の分化を促進する可能性がある。我々の結果は、SCFAが少なくとも部分的には、クローディン-1、ZO-1、MUC2などのタイトジャンクションタンパク質の発現を促進することによって腸管バリア機能を確保し、それによって条件付き病原体から保護していることを示唆している25。これらの知見は、本研究の他の結果と合わせて、SCFA産生腸内細菌およびSCFAレベルの低下がCSUの病因に関与しているという考えを支持するものである。このことは、食物繊維とレジスタントスターチ54から酢酸、プロピオン酸、酪酸などのSCFAを生成するプロバイオティクス、Roseburia hominisに関する我々の知見によってさらに裏付けられた。Roseburia hominisは、腸管上皮のバリア機能と自然免疫恒常性の維持55、病原性細菌によるコロニー形成の防止、栄養吸収の促進56において重要な役割を担っている。
我々の研究では、Roseburia hominisはCSU患者の血中LPS濃度と負の相関を示した。さらに、Roseburia hominisは、養子縁組したマウスの腸内SCFAレベルを著しく上昇させ、皮膚肥満細胞の脱顆粒を抑制した。一方、クレブシエラ肺炎はCSUの疾患活動性(UAS7)と正の相関があり、おそらくSCFA産生菌とSCFAの減少がCSUの病因に寄与していることが示唆された。有益な細菌と有害な細菌が相互作用することはよく知られている。ラクトバチルス・ロイテリ(Lactobacillus reuteri)やクロストリジウム・オルビスシンデンス(Clostridium orbiscindens)のようなSCFA産生菌は、クレブシエラ・ニューモニエ(Klebsiella pneumoniae)の増殖を抑制する57。従って、CSUにおける腸内SCFA産生菌の減少は、肺炎クレブシエラを増殖させる重要な原因であると考えられる。
腸内細菌叢の重要な代謝産物であるLPSは、CSU血漿中で有意に増加し、CSU FMTマウスでは腸管透過性を増加させた。LPSは大腸菌や肺炎桿菌を含むグラム陰性桿菌によって合成される。正常な状態では、腸上皮はLPSに対する効果的なバリアーである。腸管透過性の亢進や上皮障害などの病原性状態では、LPSは腸管腔から血液循環に移行する58,59。特に、CSU患者では腸管透過性が有意に亢進していることが、in vivo三重グルコース試験で評価された60。LPSは、TLR(TLR4)を介してMCを活性化し、TNFaやIL1361,62などの様々な炎症性メディエーターを産生させ、IgEを介したMCの脱顆粒63を促進・亢進させる。しかし、LPSによる免疫制御は複雑なプロセスであり、免疫原性やエンドトキシン耐性に関連する大腸菌LPSとバクテロイデスLPSの違いがあることを念頭に置く必要がある64。さらに、Sudhirらは、低用量のLPS曝露はOVA感作マウスにおいてアレルギー性気道炎症を増強し、Th2サイトカイン産生レベルを高め、IFNγ産生を低下させたが、高用量のLPSはTregを上昇させることでアレルギー性免疫寛容の維持に寄与したと報告している65。CSUにおける腸管透過性の亢進をもたらすメカニズムや、LPSの血流への移行がCSU疾患の活動性や持続期間にどのような影響を及ぼすかについて、詳細な解明にはさらなる研究が必要である。興味深いことに、LPSはZO-1やオクルジン66を含む腸管上皮タイトジャンクション分子への影響を介して、腸管バリアをさらに損傷し、腸管透過性を増加させる可能性がある。このことは、LPS高値のCSU患者がコントローラー療法中止後に急速に再発しやすいという我々の研究の結果を説明し、LPSがCSU再発のドライバーである可能性を示唆している。われわれの研究では、セフォペラゾン/スルバクタム系抗生物質投与は、おそらくLPS産生菌であるKlebsiella pneumoniaeの除菌により、IgEを介した皮膚肥満細胞活性化の促進を抑制した。
我々の研究にはいくつかの長所といくつかの限界がある。その長所とは、包括的なデザイン、in vitro、ex vivo、in vivoの相補的な調査、メタゲノミクスシークエンシングとメタボロミクスの使用、腸内細菌叢所見と臨床転帰の相関、そして最も重要なこととして、ヒトからマウスへの糞便微生物移植を含む養子移入アプローチによる腸内細菌叢変化のin vivoでの関連性を実証する概念実証戦略である。
限界としては、我々の研究ではLPSとSCFA以外の代謝細菌産物のレベルと影響を評価していないが、免疫・炎症疾患の重要な調節因子であるアリール炭化水素受容体(AhR)のリガンドなど、CSUに関与する可能性のある産物は他にも数多く存在する68。腸内細菌は、一次胆汁酸を修飾し、デオキシコール酸、リトコール酸、ウルソデオキシコール酸などの二次胆汁酸(SBA)を生成することによってもCSUに影響を及ぼす可能性があり、これらは自然免疫反応と適応免疫反応の両方に関与している69。1型糖尿病などの自己免疫疾患では、SBAを産生する細菌の存在が顕著に増加する70。エレナらは、喘息を患う小児では対照群と比べて胆汁酸(特にタウロコール酸)の存在量が多いことを報告している。胆汁酸レベルの上昇は、喘息の表現型発現や発症に関連している可能性がある71。CSUに対するマイクロバイオームの影響について、これらのメカニズムやその他の潜在的なメカニズムについて、今後の研究で調査する必要がある。マウスへの糞便微生物移入は、アルツハイマー病72、大うつ病73、慢性腎臓病74など、ヒトの腸内微生物の病原的役割を研究するためのモデルとして確立され、広く用いられている。しかし、マウスとヒトでは胃腸の生理機能が大きく異なるため、マウスの微生物移植研究の結果をヒトのシステムに外挿することには注意が必要である。慢性自然じんま疹における腸内細菌叢の役割を確認し、より明確にするためには、ヒトにおける糞便移植研究を含むさらなる研究が必要である。ヒトの糞便組成は腸内細菌叢の組成を部分的にしか代表しておらず、ほとんどの栄養素は生理的状態では小腸から吸収される。また、われわれの研究は単施設でのものであり、多様な患者集団を対象とした多施設共同研究で結果を確認する必要がある。最後に、ヒトからヒトへの糞便移行試験は行われなかったが、CSU患者におけるマイクロバイオーム正常化の臨床的有用性を実証するためには必要である。
まとめると、本研究は、CSUにはSCFA産生菌のレベルの低下やLPS産生菌のレベルの上昇など、重要かつ臨床的に関連性のある腸内細菌叢の変化が伴うことを示している。これらの腸内細菌叢の変化は、SCFAおよびLPSレベルをそれぞれ低下および上昇させることにより、MC依存性の皮膚炎症を促進し、CSU患者の徴候および症状の発現を促す可能性がある。
研究方法
倫理声明と参加同意
本研究は、仙谷病院の倫理委員会(承認番号201904112)により承認され、ヘルシンキ宣言を遵守した。すべての参加者は、本研究に参加する前に署名入りのインフォームド・コンセントを提供した。性別は、自己申告、外見、身分証明書によって決定された性別情報と一致した。動物実験は、中国の実験動物に関する法規:(1)実験動物倫理審査弁法(2003)、(2)実験動物福祉要求(2016)、(3)実験動物使用倫理指針(2019)に従って行った。動物実験は中南大学実験動物福祉倫理委員会の承認を得た(承認番号2021sydw0124)。3R原則(Reduce, Reusing, Recycling)を適用し、動物の苦痛をできる限り軽減した。すべての動物実験は、病原体フリーの特定施設である中南大学実験動物学科で行った。マウスの飼育環境は、温度21~23℃、相対湿度50~70%、12時間明暗交代制、標準飼料と滅菌水を自由に摂取できるようにし、マウスの飼料には滅菌マウス維持飼料、特定病原体フリー(SPF)グレード(Cat#: MD17122, Jiangsu Medison Biopharmaceutical Co.
研究参加者および実施
CSU患者は、2018年10月から2019年10月の間に、中南大学湘雅病院皮膚科から募集した。CSUの診断は、蕁麻疹の国際ガイドライン75に従って行った(参加者のスクリーニングと研究過程の詳細については、補足方法、補足図1、補足表1)。CSU患者の組み入れ基準は以下の通りである: 1) 年齢18-65歳、2) 検体採取前1ヵ月以内に抗ヒスタミン薬の内服および外用をしていない、3) 検体採取前3ヵ月以内に抗生物質、プレバイオティクス、プロバイオティクス、グルココルチコイド、オマリズマブおよびその他の薬剤を内服していない、4) 検体採取前3日以内にヨーグルト、漬物およびその他の発酵食品を摂取していない、6) 検体採取前1年以上長沙市に居住している。除外基準は以下の通りである: 1)症候性ダーモグラフティズム、急性蕁麻疹などの他の蕁麻疹亜型、またはアレルギー性疾患に罹患している者、2)自己免疫疾患(全身性エリテマトーデス、シェーグレン症候群、甲状腺障害、糖尿病など)および/または消化器症状を合併している者、3)必要な糞便サンプルを採取できなかった者、4)授乳中または妊娠中の者。年齢と性別を一致させた健常対照者(HC)を、中南大学湘雅病院の健診センターから募集する際にも同じ基準を適用した。患者は5年間、CSUの再発について評価された。CSUの再発とは、完全に寛解し、コントローラー療法を中止した後にCSUの症状が再び出現することと定義された5。
糞便および血漿サンプルの採取と保存
便サンプルは、便保存液を含み、蓋に滅菌スプーンを取り付けた滅菌便保存チューブ(Tinygene Biologicals社、上海、中国、製品番号GWF01-A)を用いて、排便後3分以内に採取した。便サンプルは、その後のメタゲノム配列決定および糞便微生物叢移植(FMT)のために-80℃で保存した。血液は、エチレンジアミン四酢酸(Becton, Dickinson and company)を含む抗凝固チューブを用いて立方静脈から採取し、室温で30分間静置した後、402gで10分間遠心分離した。血漿を分離し、-80℃で保存した。
ヒト糞便サンプルのメタゲノム配列決定とデータ解析
MasterPure DNA Extraction Kit (Epicentre Co., Ltd., UK)を用いて、ヒト糞便サンプルから製造者の指示に従って全ゲノムDNAを抽出した。総 DNA の純度と濃度は、それぞれ NanoDrop2000 と TBS-380 で評価した。DNAの品質は1%アガロースゲルで調べた。ゲノムDNAをBioruptor非接触超音波破砕機(Diagenode Co., Ltd.、ベルギー)を用いて平均〜400 bpの断片に切断し、Hiseq 2500プラットフォームとHiseq PE Cluster Kit V4およびHiseq SBS Kit V4 250 Cycle Kit(Illumina Co.)
オフラインの生データは、KneadDataソフトウェア(バージョン0.10.0)により品質管理およびクリーニングされ、Trimmomatic(バージョン0.33)とBowtie2(バージョン2.2)が統合され、低品質配列の除去とヒトゲノムのフィルタリングが行われた。その後、HUMAnN2ソフトウェアを用いて、クリーンデータを分類学的プロファイリングと機能アノテーションにかけた76。
Rプラットフォーム(バージョン4.0.3)上で、種レベルの相対存在量マトリックスに基づき、RパッケージVegan(バージョン2.5-7)により、Shannon指数やSimpson指数のようなα-多様性を評価し、2つのグループ間の種の豊かさを比較した。同様に、Rパッケージade4(バージョン1.7-18)とVegan(バージョン2.5-7)をβ多様性の評価に適用し、2群間の種群集を比較した。有意性を推定するために、Bray-Curtis距離に基づいて並べ替え多変量分散分析(PERMANOVA)を行った。β多様性を可視化するために、Bray-Curtis非類似度行列に基づいてPCoAを行った。機能遺伝子ファミリーにおける2群間のβ多様性も評価した。ここで、3サンプル以下で検出された微生物はノイズとして扱い、少なくとも半分のサンプルで検出された微生物を、種、属、科など複数のレベルでコア微生物と定義した。そして、コア微生物をWilcoxon検定による差分解析に用い、存在量に差のあるコア微生物のクラドグラムをRパッケージのmicrobiomeViz(バージョン0.1.0)で可視化した。さらに、HC患者とCSU患者における同定されたコア種の相対存在量に基づいて、RパッケージNetCoMi(バージョン1.0.2)77を用いて、それぞれコア種間の相互関係ネットワークを構築し、2群間の差分ネットワークも構築した。Rパッケージのpsych(バージョン2.1.9)を用いて、差分種と臨床的特徴との間のスピアマンの相関を解析した。Rパッケージrandom Forest(バージョン4.6-14)およびRパッケージpROC(バージョン4.6-14)による受信者動作特性(ROC)曲線の構築には、存在量に差のある中核種を使用して分類モデルを構築した。
同様に、HUMAnN2パイプラインを実行した後、各サンプルの機能アノテーションファイルを、genefamiliesとpathabundanceを含めて別々にマージした。次に、マージした2つのファイルを層別化して相対存在量を計算した。さらに、コア微生物が寄与する遺伝子とパスウェイを抽出し、その後の解析に利用した。
ヒト血漿サンプル中の短鎖脂肪酸のターゲットメタボロミクス
7種類のSCFA標準物質のストック溶液を50%アセトニトリル水溶液で個別に調製した。次に、各SCFAを1 mM含む混合標準溶液を同じ溶媒で調製し、検量線用に希釈した。血漿サンプルについては、あらかじめ冷却したメタノール/アセトニトリル(2:1)を用いて20 ulの血漿からSCFAを抽出した。遠心後、上清をすべての検量線サンプルの誘導体化に使用し、7 種類の SCFA の同位体標識内部標準物質を標準化に使用した78。
Waters UPLCシステム(Waters、米国)を、ESIソースを装備したQTRAP6500(SCIEX、カナダ)にカップリングし、マイナスイオンモードで操作した。クロマトグラフィ分離はWaters BEH C18 (2.1 × 50 mm, 1.7 mm) UPLCカラムで行い、グラジエント溶出の移動相として溶媒A(水:ギ酸;100:0.01, v/v)と溶媒B(アセトニトリル:ギ酸;100:0.01, v/v)を用いた。カラム流速は0.35 mL/分であった。すべての定量データは、MultiQuant 2.0 ソフトウェア(SCIEX、カナダ)を使用して処理した。
ヒト血漿サンプル中のLPSの検出
血漿中のLPS濃度は、Bacterial endotoxin test kit(中国、Dynamiker Biotechnology Co.)
FMT用ヒト糞便懸濁液の調製
糞便400mgをシステイン溶液(0.1%)10mlに溶解し、100μMのスクリーンを通過させ、同量のグリセロール溶液(30%)を加えた。全患者の等量の糞便液を混合し、最終糞便懸濁液を1.5ml EPチューブに入れて4℃で保存した。
マウスへの糞便微生物移植
FMTを実施する前に、すべてのマウスにアンピシリン(1 mg/ml)、コリスチン(1 mg/ml)、ストレプトマイシン(5 mg/ml)による抗生物質(Abx)投与を無菌飲料水経由で2週間行った。ヒトFMTは、Abx投与終了2日後にマウスに投与した。マウスを無作為に3群(すなわち、コントロール、HC、CSU)に分け、別々にCSU患者またはHCの糞便懸濁液または糞便懸濁液の溶媒を経口経口投与(200 ul)した。FMTは1日1回、2週間行った。
マウスの糞便サンプルの収集とメタゲノム配列決定
マウスの糞便は、抗生物質投与前後およびFMTまたは特定菌株経口投与後に採取した。抗生物質投与前後の糞便は16S rDNA配列決定により変化を評価した。FMT後の糞便はメタゲノム配列決定に供した。
E.Z.N.A. Soil DNA Kit(Omega Bio-tek, Norcross, GA, U.S.)を用い、製造者の指示に従ってマウスの糞便サンプルから全ゲノムDNAを抽出した。全 DNA の純度と濃度はそれぞれ NanoDrop2000 と TBS-380 で検出した。DNAの品質は2%アガロースゲルで調べた。ゲノムDNAはCovaris M220 (Gene Company Limited, China)を用いて平均400 bpの断片に切断した。その後、16S rRNA遺伝子のv3-v4領域をコネクターマーカー付き特異的プライマーで増幅し、Illumina NovaSeq6000プラットフォームとNovaSeq試薬キット(Illumina Co.)
オフラインリードは、以下に記載するように、Majorbioクラウドプラットフォーム(cloud.Majorbio.Com)で解析した。ヒトDNA配列の除去にはBWA(バージョン0.7.9a)を使用し、50bp未満のリードとアダプター配列を除去して高品質のペアエンドリードを得るにはfastp(バージョン0.20.0)を使用した。MEGHIT (version 1.1.2)80を用いて、最適化された配列をアセンブルし、300 bp以上のカウントをスクリーニングした。次にmetagene (http://metagene.cb.k.u-tokyo.ac.jp/)を用いてORFを予測し、100 bp以上の遺伝子を選択した。CD-HIT(バージョン4.6.1)81を用いて遺伝子配列をクラスタリングし(パラメータ:同一性90%、カバー率90%)、最長配列を代表配列として非冗長遺伝子セットを構築した。SOAPaligner (version 2.21)を用いて、各サンプルの高品質リードとnon-redundant gene set (95% identity)を比較し、対応するサンプルの遺伝子量を求めた。Diamond (version 0.8.35)を用いて、non-redundant gene setとNR database (blastp alignment parameterは期待値E-value 1e-5に設定)を比較し、種の分類学的アノテーションを取得し、種の存在量を計算した。
種レベルでの相対存在量に基づいて、Rパッケージade4(バージョン1.7-18)とVegan(バージョン2.5-7)を用いてα-多様性(すなわち、シャノン指数とシンプソン指数)とβ-多様性を推定した。コアとなる種を選択し、Wilcoxon検定により異なるグループのマウス間の差分分析に用いた。
実験マウスの糞便サンプルの16S rDNAシーケンスデータの解析
ペアデータのアセンブルと品質管理を行い、バーコードやプライマー配列、重複配列を除去して有効配列を得た。次に、UparseソフトウェアでOTUクラスタリングと種のアノテーションを行った。類似度が97%以上の配列を同一OTUとみなし、最も頻度の高い配列をOTUの代表配列とした。各代表配列は、Mothurアルゴリズムに基づくSilvaデータベースを用いて種のアノテーションに使用した。OTUの存在量は、最も少ない配列のサンプルに対応する配列数で標準化した。
標準化されたOTU存在量に基づいて、各サンプルのα-多様性、例えばシャノン指数をqiimeソフトウェア(バージョン1.7.0)で評価し、Rソフトウェアパッケージ(バージョン2.15.3)で表示した。qiimeソフトウェア(バージョン1.9.1)によるBray-Curtis距離に基づいて、CSU群とHC群間のβ-多様性を計算し、主座標分析(PCoA)で表示した。さらに、LEfSeソフトウェア(バージョン1.0)を用いて線形判別分析を行い、群間で統計的な差異があるバイオマーカーを検出した。
マウス糞便中短鎖脂肪酸のターゲットメタボロミクス
短鎖脂肪酸(SCFA)を測定するために、ターゲットガスクロマトグラフィー質量分析(GC-MS)分析を行った。マウスの糞便サンプル(25 mg)を2 mL粉砕チューブに入れ、0.5%リン酸を含む水500 µLを加えた。サンプルを凍結し、50 Hzで3分間粉砕し、これを2回繰り返した後、超音波を10分間照射し、4℃、13000 gで15分間遠心分離した。上清(400 μL)を1.5 mL遠心チューブに移し、内部標準物質2-エチル酪酸(10 μg/mL)を含むN-ブタノール溶媒(0.2 mL)を加えた。10秒間ボルテックスし、低温で10分間超音波をかけ、4℃、13000 gで5分間遠心した後、上清を分析用のサンプルバイアルに移した。
分析は、Agilent 8890BガスクロマトグラフィーとAgilent 5977B/7000D質量選択検出器、不活性電子衝撃(EI)イオン化源、イオン化電圧70eV(Agilent、米国)を用いて行った。HP-FFAP(30m×0.25mm×0.25μm)キャピラリーカラムを用い、99.999%ヘリウムをキャリアガスとして、一定流速(1mL/分)で分析対象化合物を分離した。GCカラム温度は、80 °Cで保持し、毎分40 °Cの速度で120 °Cまで昇温し、毎分10 °Cの速度で200 °Cまで昇温し、230 °Cで3分間保持するようにプログラムした。サンプルの注入量は1 µLで、注入口温度は180 °C、スプリッティングモード(10:1)で導入した。イオン源温度は230℃、四重極温度は150℃。スキャンモードはSelected ion Monitorであった。化合物の同定と定量は、Masshunter (v10.0.707.0, Agilent, USA)のソフトウェアで行った。分析対象物の質量スペクトルのピーク面積を縦軸に、分析対象物の濃度を横軸にとり、試料濃度算出用の一次回帰標準曲線を描きました。試料分析対象物の質量スペクトルのピーク面積を一次方程式に代入し、濃度結果を算出しました。
Masshunter 定量ソフトウェア(Agilent、米国、バージョン番号:v10.0.707.0)のデフォルトパラメータを使用して、目的の短鎖脂肪酸の各イオンフラグメントを自動的に同定および統合し、手作業による検査を支援しました。
マウスにおける腸管透過性の評価
In vivoでの腸管透過性は、4000 Da FITC-デキストラン(46944、Sigma-Aldrich)66を用いて評価した。簡単に説明すると、マウスを6時間以上絶食させ、4000 Da FITCデキストラン作業溶液(200 ul、50 mg/ml)を経口投与した。2時間後、全血を採取し、遠心分離して血清を得た。血清を同量のPBSで希釈し、分光光度計で吸光度を測定した。標準曲線は、異なる希釈濃度の作業溶液と対応する吸光度値で得られた。
マウスにおける受動的皮膚アナフィラキシー(PCA)
マウスの両耳に10 ug/ml IgE (25ul, D8406, Sigma-Aldrich)を皮内注射した。16時間後、尾静脈に1 mg/ml DNP-HSA (100ul, D-5059, Biosearch Technologies)を注射した。30分後、右耳の全層生検を固定し、トルイジンブルー染色用に包埋した。右耳の残存皮膚組織からエバンスブルーを65℃で16時間抽出し、その吸光度を610nmで測定した。12時間後、血液を採取し、血漿/耳組織中のIL4、IL13、IL10の濃度を、製造元の説明書(Jianglai Biotechnology Co.) 血漿中のLPS濃度および血漿/耳組織中のヒスタミン濃度は、ELISA法(USCN Life Science and Technology社、中国)により測定した。左耳組織は液体窒素で凍結し、その後のqPCR検出のために-80℃で保存した。
細菌株および培養条件
Klebsiella pneumoniae(BNCC 102997 = ATCC 10031)は、栄養ブロス培地を用い、37℃で16~18時間、220rpmの恒温振盪機で培養した。Roseburia hominis(DSM 16839)は、PYG MEDIUM(改良型)を用いて、嫌気性インキュベーター内で37℃、16~18時間培養した。細胞ペレットは2回洗浄し、1.0×109コロニー形成単位(CFU)/mLに調整した。
動物と実験デザイン
特定病原体フリー(SPF)の雌性BALB/cマウス(6-8週齢、体重約20-23g)をHunan SJA Laboratory Animal Co. Ltd.から入手した。各ケージには5匹以下のマウスを入れた。1週間実験環境に慣らした後、マウスを動物実験に供した。Jie LiとCong Pengは、実験のさまざまな段階でグループ分けを意識した。
マウスは無作為に5群に分けられ、アンピシリン(1mg/ml)、コリスチン(1mg/ml)、ストレプトマイシン(5mg/ml)を含む広域抗生物質のカクテルで2週間前治療した。その後、KPn群にはKlebsiella pneumoniae(1.0×109CFU/mLの200μL/マウス)を2週間毎日経口投与した。対照群には200μLのPBSを経口投与した。29日目にマウスの糞便サンプルを滅菌チューブに採取し、液体窒素でスナップ凍結し、さらに分析するまで-80℃で保存し、マウスをPCAに供した。
Toll様受容体4(TLR4)はLPSによる生体機能に重要な役割を果たしていることから、LPSによるMCの活性化に対するTLR4の影響を検討した。LPS_PCA群のTlr4-/- C57BL/6マウスとTlr4+/+ C57BL/6マウス83(中国湖南省、敗血症トランスレーショナル医学研究所のBen Lu博士の好意により提供された)に、LPS(200 ul、Sigma、米国セントルイス)を1mg/kgの用量で1週間毎日投与した(対照マウスには200 ulのPBSを投与)。
動物には2週間広域抗生物質のカクテルで前処置した後、2週間Klebsiella pneumoniaeを投与した(同上)。22-28日目に、300 mg/kg/dの濃度で100 uLのcefoperazone/sulbactam(1:1)を1日2回、最後の1週間マウスに腹腔内注射した。対照群には100 ulの滅菌生理食塩水を投与した。
PCA反応に対するRoseburia hominisの影響を評価するため、抗生物質前投与マウスに生きたRoseburia hominis(2×108 CFU、200 ul)を2週間毎日経口投与した。対照群には200 ulのPBSを投与した。
カプロン酸の経口投与では、Caproate_PCA群のマウスにカプロン酸ナトリウム(400 mg/kg、200 ul)を2週目から4週目まで毎日経口投与した(対照群には200 ulの滅菌生理食塩水を投与)。
マウスにおける全RNA抽出、逆転写およびqPCR
total RNA Isolation Kit(Trizol, Bio Teke, China)を用いてtotal RNAを抽出し、HifairTM III 1st Strand cDNA Synthesis SuperMix for qPCR(gDNA digester plus, Yeasen, China)を用いて試薬メーカーの指示に従って逆転写した。qPCRは、50 °Cで2分間、95 °Cで10分間、続いて40回のPCRサイクル(95 °Cで15秒間、60 °Cで1分間)を行い、95 °Cで15秒間、60 °Cで1分間で溶解曲線を得て反応を終了させた。この実験で使用したプライマーを補足表3に示す(Sangon Biotech、中国)。
組織学と免疫組織化学(IHC)
ZO1とMUC2の免疫組織化学的解析は、コントロールマウスとFMTマウスの結腸から採取した4μm厚のパラフィン包埋切片を用いて行った。簡単に説明すると、切片を正常羊血清アルブミン(ZSGB-BIO、中国)でブロックし、抗体、ZO1(ABclonal Technology、中国、希釈度1:100、Cat#、A0659、Lot、5500020603)およびMUC2(ABclonal Technology、中国、希釈度1:50、Cat#、A4767、Clone、ARC1012)を加え、4℃で12時間インキュベートした。抗体希釈バッファーがネガティブコントロールとして用いられた。PV-9000 universal two-step detection kit(ZSGB-BIO、中国)とDAB発色剤(ZSGB-BIO、中国)を用い、切片をヘマトキシリン(ZSGB-BIO、中国)で染色した。無作為に3つの高倍率顕微鏡視野(倍率400倍)から顕微鏡写真を得、Image-Pro-Plusソフトウェア(バージョン6.0)で評価した。平均密度は、積分光学密度和と面積の割合に基づいて決定した。
フローサイトメトリー(FCM)
耳組織から単細胞懸濁液を調製し、調製したZombie Aqua Fixable Viability Kit(anti-BV510, BioLegend, USA)を1μl加え、室温で15分間インキュベートした後、調製した表面抗体[Anti-mouse CD45-APC/cy7, (BioLegend; Cat#: 103116; Clone: 30-F11), Anti-mouse FcεRlα-PE/cy7, (BioLegend; Cat#: 334620; Clone: AER-37 (CRA-1))、抗マウスCD117 (Kit)-APC, (BioLegend; Cat#: 161505; Clone: S18020A)、Zombie Aqua™ Fixable Viability Kit, (BioLegend; Cat#: 423101)] を加え、4℃で30分間インキュベートした39。染色した細胞をFACS LSRFORTESSA(BD、USA)で分析し、データをFlowjoソフトウェアで解析した。
細胞培養
骨髄由来MC(BMMC)は、RPMI1640培地[+ウシ胎児血清(FBS、10%)、ペニシリン(100U/mL)、ストレプトマイシン(100mg/mL)、L-グルタミン(2mM)、ピルビン酸ナトリウム(1mM)、HEPES(10mM)、組換えサイトカイン(幹細胞因子、20ng/mL; IL3、20 ng/mL)]を添加し、5% CO284中、37℃で21日間培養した。分化は、蛍光活性化セルソーティング(FACS)によるCD117(c-kit)とFcεRIαの発現でモニターした。RBL-2H3はATCC(CRL-2256)から購入し、10%ウシ胎児血清を添加したMEM-EBSS培地(Hyclone、SH30024.01)中、37℃、5%CO2中で培養した。RBL-2H3の認証は、ATCC番号に従ってATCCのウェブサイトから取得できる。
IgEを介した肥満細胞の活性化
肥満細胞の活性化は、BMMCにおけるβ-ヘキソサミニダーゼ遊離によって評価した84,85。つまり、BMMCを96ウェルプレートに1ウェル当たり8*103個の細胞で接種し、無血清培地で調製した0.1ug/ml IgE(D8406、シグマアルドリッチ)で感作した。24時間感作後、培地を廃棄し、LPS(L2630、Sigma-Aldrich)完全培地を添加した。6時間後、培地を捨て、1 ug/ml DNP-HSA(D-5059, Biosearch Technologies)を30分間添加した。
各ウェルの上清を回収し、NP40 Lysis Bufferを各ウェルに加え、5分間細胞を溶解した。溶解液(50 μL)と上清(50 μL)をそれぞれ基質溶液(50 μL)(3 mM 4-Nitrophenyl N-acetyl-β-D-glucosaminide, N9376, Sigma-Aldrich)と37℃で90分間インキュベートした後、150 μLのNa2CO3/NaHCO3(pH = 10. 6)を加えて反応を終了させ、Cytation 5 multifunctional enzyme marker (BioTek, USA)により405 nmの吸光度を読み取り、上清/(上清+溶解液)の吸光度値から肥満細胞の脱顆粒率を求めた。
統計解析
正規分布のデータは両側t検定またはANOVAで解析し、結果は平均値±s.e.m.で示した。正規分布でないデータはWilcoxon検定で解析し、結果は中央値(25%パーセンタイル-75%パーセンタイル)で示した。P値<0.05は統計的に有意とみなされた。
報告の要約
研究デザインに関する詳細は、この論文にリンクされているNature Portfolio Reporting Summaryを参照されたい。
データの入手可能性
本研究の結果を裏付けるデータは、論文およびその補足情報内で入手可能である。本研究で得られたヒト糞便サンプルのメタゲノムシーケンスファイルおよび実験マウスの糞便サンプルの16S rRNA遺伝子シーケンスファイルは、National Omics Data Encyclopedia (NODE)に寄託されている。ヒト糞便サンプルのメタゲノムシーケンスファイルはプロジェクトOEP002960 (http://www.biosino.org/node/review/detail/OEV000435?code=K4MN2WY7)、抗生物質投与前後の実験マウスの糞便サンプルの16S rRNA遺伝子シーケンスファイルはプロジェクトOEP002997 (http://www.biosino.org/node/review/detail/OEV000436?code=TN2WICKS)で利用可能である。本研究で得られた質量分析データは、China Nucleic Acid RepositoRy Database (CNGBdb, https://db.cngb.org/cnjb/)のアクセッションCNP0005021に登録されている。本研究で得られた実験データはSource Dataファイルに記載されている。ソースデータは本論文とともに提供される。
参考文献
Kolkhir, P. et al. Nat. Rev. Dis. Prim. 8, 61 (2022).
論文
PubMed
Google Scholar
世界中の小児および成人における慢性蕁麻疹の有病率: メタアナリシスによる系統的レビュー。アレルギー 75, 423-432 (2020).
論文
PubMed
Google Scholar
中国における慢性蕁麻疹の有病率と危険因子:全国横断研究。アレルギー 77, 2233-2236 (2022).
論文
PubMed
Google Scholar
慢性蕁麻疹の患者と社会に対する世界的負担。Br. J. Dermatol 184, 226-236 (2021).
論文
PubMed
Google Scholar
Giménez-Arnau, A. M. et al. 慢性蕁麻疹におけるコントロールと寛解の定義に関するコンセンサス。J. Investig. Allergol. Clin. Immunol. 32, 261-269 (2022).
論文
PubMed
Google Scholar
慢性蕁麻疹の再発:発生率と関連因子。J. Allergy Clin. Immunol. Pr. 6, 582-585 (2018).
論文
Google Scholar
Tawil, S. et al. 慢性蕁麻疹と心理的苦痛との関連:多施設横断研究。Acta Derm. Venereol. 103, adv00865(2023).
Kolkhir, P., Elieh-Ali-Komi, D., Metz, M., Siebenhaar, F. & Maurer, M. Understanding human mast cells: Lesson from therapies for allergic and non-allergic diseases. Nat. Rev. Immunol. 22, 294-308 (2022).
論文
論文
パブコメ
Google Scholar
慢性自然じんま疹における治療効果予測因子。アレルギー 76, 2965-2981 (2021).
論文
CAS
PubMed
Google Scholar
マウラー、M.、カーン、D.、エリエ・アリ・コミ、D.&カプラン、A. 慢性自然じんま疹に使用する生物学的製剤:いつ、どのような場合に。J. Allergy Clin. Immunol. Pract. 9, 1067-1078 (2021).
論文
CAS
パブコメ
Google Scholar
慢性自然じんま疹の発症における免疫細胞のクロストークの役割。Front. Immunol. 13, 879754 (2022).
論文
論文
PubMed
パブメドセントラル
Google Scholar
MRGPRX2の活性化は慢性自然じんま疹患者の皮膚反応性を亢進させる。J. Invest. Dermatol. 141, 678-681.e672 (2021).
論文
論文
パブコメ
Google Scholar
Bédard, P. M., Brunet, C., Pelletier, G. & Hébert, J. 慢性蕁麻疹患者の非病変性皮膚からの化合物48/80による局所ヒスタミン放出の増加。J. Allergy Clin. Immunol. 78, 1121-1125 (1986).
論文
PubMed
グーグル奨学生
Wang, Z. et al. IL-33とMRGPRX2が誘発するヒト皮膚肥満細胞の活性化-慢性暴露では受容体発現が消失するが、急性プライミングでは脱顆粒が強化される。Cells 8, 341 (2019).
Halova, I. et al. Change the threshold-Signals and mechanisms of mast cell priming. Immunol. Rev. 282, 73-86 (2018).
論文
CAS
PubMed
Google Scholar
マスト細胞活性化におけるポジティブシグナルとネガティブシグナル(Bulfone-Paus, S., Nilsson, G., Draber, P., Blank, U. & Levi-Schaffer, F. Trends Immunol. 38, 657-667 (2017).
論文
CAS
PubMed
Google Scholar
Robida, P. A. et al. ヒト肥満細胞におけるSiglec-6の機能的および表現型的特徴づけ。Cells 11, 1138 (2022).
Korver, W. et al. 抑制性受容体シグレック-8はFcεRIと相互作用し、初代肥満細胞の活性化に伴って細胞内シグナル伝達をグローバルに抑制する。Front. Immunol. 13, 833728 (2022).
論文
論文
PubMed
パブメッドセントラル
Google Scholar
Folkerts, J. et al. 酪酸塩はFcεRIを介したシグナル伝達のエピジェネティック制御を介してヒト肥満細胞の活性化を阻害する。アレルギー 75, 1966-1978 (2020).
論文
PubMed
Google Scholar
健康と疾患における微生物叢。Signal Transduct. Target Ther. 7, 135 (2022).
論文
PubMed
パブメッドセントラル
Google Scholar
Spivak、I., Fluhr、L. & Elinav、E. 微生物由来代謝産物の局所的および全身的作用。EMBO Rep. 23, e55664 (2022).
論文
論文
PubMed
パブメドセントラル
Google Scholar
食物繊維の微生物相依存的および非依存的なヒトの健康への影響。Br. J. Pharm. 177, 1363-1381 (2020).
論文
CAS
Google Scholar
Parada Venegas, D. et al. 短鎖脂肪酸(SCFAs)を介した腸上皮および免疫制御と炎症性腸疾患との関連性。Front. Immunol. 10, 277 (2019).
論文
PubMed
パブメドセントラル
Google Scholar
Zhang, S. et al. 短鎖脂肪酸は、病原性共生細菌エシェリヒア・コリの増殖と病原性、および宿主応答を調節する。Antibiotics 9, 462 (2020).
腸管バリア機能、炎症、酸化ストレス、大腸発がんにおける短鎖脂肪酸の役割。Pharm. Res. 165, 105420 (2021).
論文
CAS
Google Scholar
Paradis, T., Bègue, H., Basmaciyan, L., Dalle, F. & Bon, F. 腸管上皮細胞における病原体侵入の鍵としてのタイトジャンクション。Int. J. Mol. Sci. 22, 2506 (2021)。
IgE依存性感作は、LPSに対する反応性を増加させるが、肥満細胞におけるエンドトキシン耐性の発達を修飾しない。Inflamm. Res. 60, 19-27 (2011).
論文
CAS
PubMed
Google Scholar
Poplutz, M. et al. 肥満細胞におけるエンドトキシン耐性、IgEを介したシグナル伝達への影響、およびBCL3欠損の影響。Sci. Rep. 7, 4534 (2017).
論文
PubMed
PubMed Central
Google Scholar
肥満細胞の活性化と肥満細胞関連疾患に対する食物繊維と代謝産物の影響。Front. Immunol. 9, 1067 (2018).
論文
PubMed
パブメドセントラル
Google Scholar
Nabizadeh, E., Jazani, N., Bagheri, M. & Shahabi, S. Association of changing gut microbiota composition with chronic urticaria. Annals of allergy, asthma & immunology: official publication of the American College of Allergy. Asthma Immunol. 119, 48-53 (2017).
論文
グーグル・スカラー
Rezazadeh, A., Shahabi, S., Bagheri, M., Nabizadeh, E. & Jazani, N. 慢性蕁麻疹に対する腸内細菌叢メンバーとしての乳酸桿菌とビフィズス菌の保護効果。Int. Immunopharmacol. 59, 168-173 (2018).
論文
CAS
PubMed
Google Scholar
Yüksekal, G. et al. 慢性自然じんま疹患者における腸内細菌叢の調査。Int J. Dermatol 61, 988-994 (2022).
論文
PubMed
Google Scholar
Widhiati, S., Purnomosari, D., Wibawa, T. & Soebono, H. The role of gut microbiome in inflammatory skin disorders: a systematic review. Dermatol Rep. 14, 9188 (2022).
CAS
Google Scholar
Krišto, M. et al. 慢性蕁麻疹患者における腸内細菌叢の構成:現在のエビデンスとデータのレビュー。生命。13, 152 (2023).
Wang, D., Guo, S., He, H., Gong, L. & Cui, H. 腸内細菌叢と血清メタボローム解析により、慢性自然じんま疹患者における腸内細菌叢が誘導する不飽和脂肪酸とブタン酸代謝が同定された。Front. Cell Infect. Microbiol. 10, 24 (2020).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Song, Y. et al. H1-抗ヒスタミン薬抵抗性の慢性自然じんま疹における腸内細菌叢の変化は、全身性炎症と関連している。Front. Cell Infect. Microbiol. 12, 831489 (2022).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Lachnospiraは慢性自然じんま疹における抗ヒスタミン薬効果のサインである。Exp. Dermatol. 31, 242-247 (2022).
論文
論文
パブコメ
Google Scholar
慢性蕁麻疹の補助療法としてのプロバイオティクス:盲検ランダム化比較臨床試験。Eur. Ann. Allergy Clin. Immunol. 54, 123-130 (2022).
論文
CAS
パブコメ
Google Scholar
Hamey, F. K. et al. 単一細胞分子プロファイリングによる好塩基球と肥満細胞の高解像度発生マップ。アレルギー76, 1731-1742 (2021).
論文
CAS
PubMed
Google Scholar
Shi, L. et al. 中国の肝硬変患者における院内および市中獲得自然発症細菌性腹膜炎:比較微生物学と治療的意義。Sci. Rep. 7, 46025 (2017).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
IBDにおける恒常性と腸内細菌叢の相互作用における腸管上皮のグリコシレーション。Nature reviews. Gastroenterol. Hepatol. 17, 597-617 (2020).
CAS
Google Scholar
Agus, A., Clément, K. & Sokol, H. 代謝性疾患における中心的調節因子としての腸内細菌叢由来代謝産物。Gut 70, 1174-1182 (2021).
論文
CAS
PubMed
Google Scholar
慢性自然じんま疹および症候性ダーモグラフィーにおける腸内細菌叢のバイオマーカー。Front. Cell Infect. Microbiol. 11, 703126 (2021).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
Berni Canani, R. et al. 乳酸菌ラムノサスGGを含む広範囲加水分解カゼインミルクは、牛乳アレルギーの小児における他のアレルギー症状の発現を減少させる:3年間のランダム化比較試験。J. Allergy Clin. Immunol. 139, 1906-1913.e1904 (2017).
論文
CAS
PubMed
Google Scholar
Bi, X., Lu, B., Pan, X., Liu, S. & Wang, J. Adjunct therapy with probiotics for chronic urticaria in children: Randomised placebo-controlled trial. Allergy Asthma Clin. Immunol. 17, 39 (2021).
論文
論文
PubMed
パブメドセントラル
Google Scholar
健康および疾患における酸化還元シグナル伝達の調節因子としての短鎖脂肪酸。レドックスバイオロジー 47, 102165 (2021).
論文
PubMed
パブメドセントラル
グーグル奨学生
微生物SCFAの腸管耐性および食物アレルギーに対する保護効果の根底にある分子メカニズムを探る。Front. Immunol. 11, 1225 (2020).
論文
論文
パブコメ
パブメドセントラル
Google Scholar
食物繊維の腸内細菌叢代謝はアレルギー性気道疾患と造血に影響を及ぼす。Nat. Med. 20, 159-166 (2014).
論文
論文
パブコメ
Google Scholar
短鎖脂肪酸は肥満細胞の活性化を調節する。アレルギー 75, 1848-1849 (2020).
論文
PubMed
Google Scholar
腸内細菌由来の酪酸は大腸制御性T細胞の分化を誘導する。Nature 504, 446-450 (2013).
論文
論文
PubMed
Google Scholar
微生物の代謝産物である短鎖脂肪酸が、大腸Treg細胞のホメオスタシスを制御する。Science 341, 569-573 (2013).
論文
CAS
PubMed
Google Scholar
慢性自然発症(「特発性」)蕁麻疹の病変皮膚におけるT-helper-2開始サイトカイン(インターロイキン-33、インターロイキン-25、胸腺間質リンパポエチン)の上昇。Br. J. Dermatol. 172, 1294-1302 (2015).
論文
CAS
PubMed
Google Scholar
Chen, Q. et al. 血漿中のTh1、Th2、Th17およびTh22関連サイトカインの異なる発現パターンは、慢性自然じんま疹における血清自己反応性およびアレルゲン感受性と相関する。J. Eur. Acad. Dermatol Venereol. 32, 441-448 (2018).
論文
CAS
PubMed
Google Scholar
宋 麗澤(Song, L.)ら、Roseburia hominisはヒストン脱アセチル化酵素阻害を介して短鎖脂肪酸を介した神経炎症を緩和する。Mol. Nutr. 66, e2200164 (2022).
論文
PubMed
グーグルスカラー
Patterson, A. M. et al. ヒト腸内共生生物roseburia hominisは自然免疫を促進・制御する。Front. Immunol. 8, 1166 (2017).
論文
PubMed
パブメドセントラル
Google Scholar
代謝性疾患の潜在的治療標的および予測ツールとしての新規プロバイオティクスの次世代有益作用。J. Food Drug Anal. 30, 1-10 (2022).
論文
PubMed
パブメドセントラル
Google Scholar
Bengoechea, J. A. & Sa Pessoa, J. Klebsiella pneumoniae感染生物学:宿主の防御に対抗する生き方。FEMS Microbiol. Rev. 43, 123-144 (2019).
論文
CAS
PubMed
グーグルスカラー
Di Lorenzo, F., De Castro, C., Silipo, A. & Molinaro, A. Lipopolysaccharide structures of Gram-negative populations in the gut microbiota and effects on host interactions. FEMS Microbiol. Rev. 43, 257-272 (2019).
論文
PubMed
Google Scholar
Lipopolysaccharides modulate intestinal epithelial permeability and inflammation in a species-specific manner. Gut Microbes 11, 421-432 (2020).
論文
PubMed
グーグル奨学生
慢性蕁麻疹における偽アレルギー反応は胃十二指腸透過性の変化と関連している。Allergy 59, 1118-1123 (2004).
論文
CAS
PubMed
Google Scholar
リポ多糖を介した炎症はOAに関与するか?Nature reviews. Rheumatology 12, 123-129 (2016).
CAS
PubMed
グーグル奨学生
Supajatura, V. et al. アレルギーと自然免疫における肥満細胞Toll様受容体2および4の反応の違い。J. Clin. Investig. 109, 1351-1359 (2002).
論文
論文
PubMed
パブメドセントラル
Google Scholar
FcεR1を介した肥満細胞反応性は、Toll様受容体リガンドの長期投与により増幅される。PLoS One 7, e43547 (2012).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Vatanen, T. et al.マイクロバイオームLPS免疫原性の変異はヒトの自己免疫に寄与する。Cell 165, 842-853 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
アレルギー性気道炎症におけるエンドトキシンの用量依存的免疫調節効果。Innate Immun. 23, 249-257 (2017).
論文
論文
PubMed
Google Scholar
Zhou, S. et al. FODMAP食はリポ多糖を介した腸管炎症とバリア機能障害により内臓侵害受容を調節する。J. Clin. Investig. 128, 267-280 (2018).
論文
PubMed
Google Scholar
Kim, H. J. et al. 系統的レビューとメタ解析:慢性自然じんま疹に対するヘリコバクター・ピロリ除菌の効果。Helicobacter 24, e12661 (2019).
論文
PubMed
Google Scholar
de Vos, W. M., Tilg, H., Van Hul, M. & Cani, P. D. 腸内マイクロバイオームと健康:メカニズム的洞察。Gut 71, 1020-1032 (2022).
論文
PubMed
Google Scholar
腸内細菌叢と宿主免疫のクロストーク:炎症と免疫療法への影響。Biomedicines 11, 294 (2023).
二次胆汁酸代謝異常は膵島の自己免疫と1型糖尿病に先行する。Cell Rep. Med. 3, 100762 (2022).
論文
論文
PubMed
パブメドセントラル
Google Scholar
Crestani, E. et al. 非標的メタボロームプロファイリングにより、食物アレルギーと喘息における疾患特異的シグネチャーが同定された。J. Allergy Clin. Immunol. 145, 897-906 (2020).
論文
論文
パブコメ
Google Scholar
腸内細菌叢はPUFA関連神経炎症を介してアルツハイマー病の病態と認知障害を制御する。Gut 71, 2233-2252 (2022).
バクテロイデス属細菌は、腸-脳代謝シグナルを介してうつ病様行動を異なって調節する。Brain Behav. Immun. 102, 11-22 (2022).
論文
論文
パブコメ
Google Scholar
腸内細菌叢の異常は宿主のメタボロームを変化させ、ヒトおよびげっ歯類の腎不全に影響を及ぼす。Gut 69, 2131-2142 (2020).
Zuberbier, T. et al. EAACI/GA(2)LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. アレルギー 73, 1393-1414 (2018).
論文
CAS
PubMed
Google Scholar
メタゲノムとメタトランスクリプトームの種レベルでの機能プロファイリング。Nat. Methods 15, 962-968 (2018).
論文
論文
PubMed
パブメドセントラル
Google Scholar
微生物ゲノムデータのネットワーク構築と比較(R. NetCoMi, Brief Bioinform. 22, bbaa290 (2021).
ヒト糞便中の短鎖脂肪酸を液体クロマトグラフィー-タンデム質量分析で定量するための同位体標識化学誘導体化法。Anal. Chim. Acta 854, 86-94 (2015).
論文
論文
PubMed
Google Scholar
Planer, J. D. et al. 双生児およびgnotobioticマウスにおける腸内細菌叢の発達と粘膜IgA応答。Nature 534, 263-266 (2016).
論文
CAS
PubMed
パブメドセントラル
Google Scholar
MEGAHIT: an ultra-fast single-node solution for large and complex metagenomics assembly via succinct de Bruijn graph. Bioinformatics 31, 1674-1676 (2015).
論文
論文
PubMed
Google Scholar
Cd-hit:大規模なタンパク質配列や塩基配列のクラスタリングと比較のための高速プログラム。バイオインフォマティクス 22, 1658-1659 (2006).
論文
論文
パブコメ
Google Scholar
DJ-1は肥満細胞の活性化とIgEを介したアレルギー反応を制御する。J. Allergy Clin. Immunol. 131, 1653-1662 (2013).
論文
論文
パブコメ
Google Scholar
細菌が放出する外膜小胞は播種性血管内凝固を促進する。Thromb. Res. 178, 26-33 (2019).
論文
CAS
PubMed
Google Scholar
Li, J. et al. Integrated lipidomic features identify plasma lipid signatures in chronic urticaria. Front. Immunol. 13, 933312 (2022).
論文
論文
PubMed
パブメドセントラル
Google Scholar
ORAI1遺伝子多型と慢性自然じんま疹および非鎮静性H1抗ヒスタミン薬デスロラタジンの有効性との関連。J. Allergy Clin. Immunol. 139, 1386-1388.e1389 (2017).
論文
CAS
PubMed
Google Scholar
参考文献のダウンロード
謝辞
Klebsiella pneumoniaeの提供および実験技術支援をしていただいた中南大学基礎医学部腫瘍学研究所のWen Zhou博士およびYinghong Zhu博士に感謝する。TLR4 +/+およびTLR4 -/-マウスを提供してくれた湖南省敗血症トランスレーショナル医学重点実験室および中南大学湘雅第三病院重症治療医学・血液内科のBen Lu博士に感謝する。さらに、本研究は、中国国家自然科学基金(National Natural Science Foundation of China)の助成金(助成番号:81974476(J.L.)、82173424(J.L.)、82073458(C.P.)、81830096(X.C.))の支援を受けた。本研究は、湖南省科学技術革新プログラム2021RC4013(C.P.)、福栄研究室科学研究プログラム(2023SK2103号)、大学分野別人材導入プログラム111プロジェクトB20017(X.C.)、中南大学大学院生革新プログラムCX20220338(L.Z.)の支援も受けている。
資金提供
Projekt DEALによるオープンアクセス資金提供。
著者情報
著者メモ
これらの著者は同等に貢献した: Xiang Chen、Cong Peng、Marcus Maurer、Jie Li。
著者および所属
中国湖南省長沙市、中南大学湘雅病院皮膚科
Lei Zhu、Bingjing Zhou、Xiang Chen、Cong Peng & Jie Li
中国・湖南省長沙市、湖南省皮膚癌・乾癬重点実験室、芙蓉実験室
朱磊、周秉晶、陳翔、彭聡、李傑
中国湖南省長沙市、中南大学湘雅病院、国立老人病臨床研究センター
Lei Zhu、Bingjing Zhou、Xiang Chen、Cong Peng & Jie Li
中国湖南省長沙市、中央南大学湘雅病院バイオインフォマティクスセンター
江興興・謝魯
中国江蘇省塩城市徐州医科大学塩城臨床学院塩城市第一人民病院皮膚科
劉潤秋
ベルリン・シャリテ大学アレルギー学研究所、ベルリン自由大学およびベルリン・フンボルト大学法人会員、ドイツ、ベルリン
メルバ・ムニョス&マーカス・マウラー
フラウンホーファーITMPトランスレーショナル医学・薬理学研究所、アレルギー・免疫学、ベルリン、ドイツ
メルバ・ムニョス&マーカス・マウラー
中国深圳市塩田区北山工業区複合ビルBGI
孫完
貢献
L.Z.、X.J.、B.Z.およびR.L.は本研究に等しく貢献した。R.L.、B.Z.、J.L.、M.Maは原稿を作成した。L.Z.、J.L.、M.Maは修正原稿を作成した。L.Z.は細胞実験、動物実験、データ解析、データ収集、図2-4、6、補足図5、6の作成を行った。B.Z.は動物実験、データ解析、図3-7、補足図4、補足表1-3を作成した。X.J.はメタゲノム配列解析を行い、図1および補足データ図1を作成した。R.L.は動物実験の一部を実施し、16 S rRNA遺伝子のシーケンスデータを解析した。W.S.はデータ管理を行った。M.Ma.とM.Mu.はデータの解釈に貢献した。L.X.はバイオインフォマティクスのサポートに貢献した。J.L.とM.Maは研究の立案と監督を行った。J.L.、M.Ma、C.P.、X.C.、M.Muは研究デザインを指導した。J.L.、M.Ma.、C.P.は原稿を作成・修正し、データ発表に貢献した。著者全員が原稿を査読した。
対応する著者
Marcus MaurerまたはJie Liまで。
倫理申告
利益相反
M. Maは、Astria, Allakos, Alnylam, Amgen, Aralez, ArgenX, AstraZeneca, BioCryst, Blueprint, Celldex, Centogene, CSL Behring, Dyax, FAES、 Genentech、GIInnovation、GSK、Innate Pharma、Kalvista、協和キリン、Leo Pharma、Lilly、Menarini、Moxie、Novartis、Pfizer、Pharming、Pharvaris、Roche、Sanofi/Regeneron、Shire/Takeda、Third Harmonic Bio、UCB、Uriach。他のすべての著者は、競合する利害関係はないと宣言している。
査読
査読情報
Nature Communications誌は、金井孝典氏、および本論文の査読にご協力いただいた他の匿名の査読者に謝意を表します。
追加情報
出版社注:Springer Natureは、出版された地図の管轄権の主張および所属機関に関して中立を保っています。
補足情報
補足情報
査読ファイル
報告概要
ソースデータ
ソースデータ
権利と許可
オープンアクセス この記事は、クリエイティブ・コモンズ表示4.0国際ライセンスの下でライセンスされている。このライセンスは、原著者および出典に適切なクレジットを付与し、クリエイティブ・コモンズ・ライセンスへのリンクを提供し、変更が加えられた場合にその旨を示す限り、いかなる媒体または形式においても、使用、共有、翻案、配布、複製を許可するものである。この記事に掲載されている画像やその他の第三者の素材は、その素材へのクレジット表記に別段の記載がない限り、記事のクリエイティブ・コモンズ・ライセンスに含まれています。この記事のクリエイティブ・コモンズ・ライセンスに含まれていない素材で、あなたの意図する利用が法的規制によって許可されていない場合、あるいは許可された利用を超える場合は、著作権者から直接許可を得る必要があります。このライセンスのコピーを見るには、http://creativecommons.org/licenses/by/4.0/。
転載と許可
この記事について
アップデートを確認する。CrossMarkで通貨と真正性を確認する
この記事を引用する
Zhu, L., Jian, X., Zhou, B. et al. 腸内細菌叢は慢性自然じんま疹を促進する。Nat Commun 15, 112 (2024). https://doi.org/10.1038/s41467-023-44373-x
引用のダウンロード
受理
2023年3月21日
受理
2023年12月11日
発行
2024年01月02日
DOI
https://doi.org/10.1038/s41467-023-44373-x
この記事を共有する
以下のリンクをシェアすると、誰でもこのコンテンツを読むことができます:
共有可能なリンクを取得
コンテンツ共有イニシアチブSpringer Nature SharedItにより提供されています。
テーマ
ヘルスケア
炎症
マイクロバイオーム
粘膜免疫学
コメント
コメントを投稿することで、利用規約とコミュニティガイドラインを遵守することに同意したものとみなされます。誹謗中傷や規約・ガイドラインに反する投稿があった場合は、不適切な投稿としてフラグを立ててください。
ネイチャー・コミュニケーションズ(Nat Commun) ISSN 2041-1723(オンライン)
サイトマップ
ネイチャー・ポートフォリオについて
ネイチャーについて
プレスリリース
プレスオフィス
お問い合わせ
コンテンツを見る
ジャーナルA-Z
テーマ別記事
プロトコル交換
ネイチャー・インデックス
出版ポリシー
Natureポートフォリオポリシー
オープンアクセス
著者・研究者サービス
別刷りと許可
研究データ
言語編集
科学編集
ネイチャー・マスタークラス
エキスパートトレーナーによるワークショップ
研究ソリューション
図書館・機関
図書館員サービス&ツール
図書館ポータル
オープンリサーチ
図書館への推薦
広告とパートナーシップ
広告
パートナーシップとサービス
メディアキット
ブランドコンテンツ
プロフェッショナル育成
ネイチャー・キャリア
ネイチャーコンファレンス
地域ウェブサイト
ネイチャー・アフリカ
ネイチャー・チャイナ
ネイチャー インド
ネイチャー・イタリア
日本のネイチャー
ネイチャー 韓国
ネイチャー 中東
プライバシーポリシー クッキーの使用 お客様のプライバシーに関する選択/クッキーの管理 法的通知 アクセシビリティに関する声明 利用規約 お客様の米国におけるプライバシー権
シュプリンガー・ネイチャー
© 2024 シュプリンガー・ネイチャー
この記事が気に入ったらサポートをしてみませんか?
