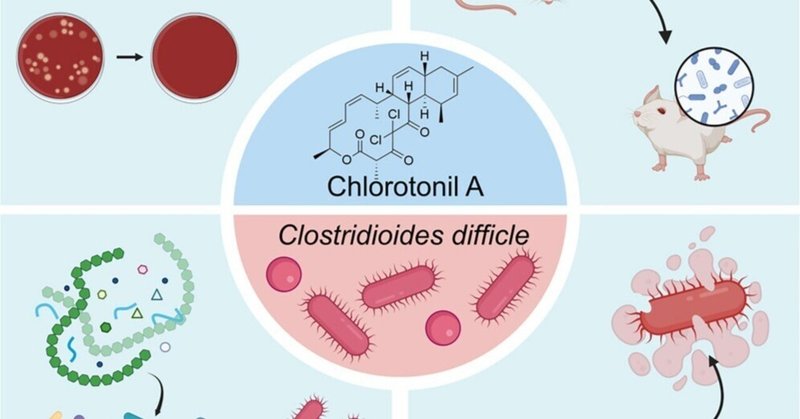
天然物クロロトニルAはコロニー形成抵抗性を保持し、Clostridioides difficile感染症の再発を予防する
細胞宿主と微生物
2023年4月24日オンライン公開
In Press, Corrected Proofこれは何ですか?
記事
天然物クロロトニルAはコロニー形成抵抗性を保持し、Clostridioides difficile感染症の再発を予防する
https://www.sciencedirect.com/science/article/pii/S1931312823001476?via%3Dihub
著者リンク open overlay panelArne Bublitz 1, Madita Brauer 2 3 16, Stefanie Wagner 4 16, Walter Hofer 5 15, Mathias Müsken 6, Felix Deschner 5 15, Till R. Lesker 1, Meina Neumann-Schaal 7 8, Lena-Sophie Paul 4, Ulrich Nübel 8 9 10, Jürgen Bartel 11, Andreas M. Kany 5 15、Daniela Zühlke 2、Steffen Bernecker 12、Rolf Jansen 12、Susanne Sievers 2、Katharina Riedel 2 3、Jennifer Herrmann 5 10 15、Rolf Müller 5 10 15、Thilo M. Fuchs 4・・・Till Strowig 1 10 13 14 17
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.chom.2023.04.003Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
ハイライト
Chlorotonil A(ChA)がClostridioides difficileに対して抗菌活性を有する。
ChAがマウスモデルにおけるC. difficile感染症の再発を予防することを確認
バンコマイシンと異なり、ChAはC. difficileに対するコロニー形成抵抗性を保持する。
ChAがC. difficileの芽胞に保持され、植物細胞の成長を妨げる
概要
Clostridioides difficile感染症(CDI)は、再発性CDI(rCDI)の割合が高く、依然として医療上の問題である。クロストリジウム・ディフィシル感染症は、広域抗生物質によるコロニー形成抵抗性の破壊と芽胞の持続がrCDIの一因とされています。今回、我々は天然物であるクロロトニルのC. difficileに対する抗菌活性を実証した。バンコマイシンとは対照的に、クロロトニルA(ChA)はマウスにおいて効率的に病気を抑制し、rCDIを予防する。注目すべきは、ChAがマウスおよびブタの微生物叢に与える影響がバンコマイシンに比べて小さく、微生物叢の組成をほぼ維持し、腸内代謝系に与える影響を最小限に抑えられることである。そのため、ChAを投与してもC. difficileに対するコロニー形成抵抗性は壊れず、CDI後の微生物叢の回復が早いとされています。さらに、ChAは胞子内に蓄積し、C. difficileの胞子の成長を阻害するため、rCDIの発生率の低下に寄与する可能性がある。我々は、クロロトニルはC. difficileの感染サイクルの重要なステップを標的としたユニークな抗菌特性を有すると結論付けた。

図解抄録
ダウンロード 高解像度画像ダウンロード(215KB)
ダウンロード フルサイズ画像をダウンロードする
キーワード
クロロトニル
腸内細菌叢
クロストリジョイデスディフィシル
しょくみんちょくせい
胞子
はじめに
Clostridioides difficileは、ヒトおよび動物の嫌気性腸管病原体である。哺乳類の腸管には無症状のC. difficileが生息していますが1、C. difficileは抗生物質関連下痢の最も頻繁な原因菌として浮上し、軽度から重度の大腸炎を引き起こします2。3)現在、C. difficileは、臨床的に重要な抗生物質であるメトロニダゾール、バンコマイシン、フィダクソマイシンに対する抗生物質耐性率は低いものの、C. difficile感染症(CDI)の治療は依然として困難である。さらに、C. difficileの抗生物質耐性株の出現と拡散の可能性は、CDIに対する新しい治療法の探索によって先制的に対処されるべきです。
CDIの前提条件として、年齢や免疫不全などの他の危険因子とともに、抗生物質などによってC. difficileに対するコロニー形成抵抗性(CR)が破壊されることが挙げられます5、6、7。逆に、腸内細菌群集の回復と同時にCRが回復すれば、CDIと戦い、残ったC. difficile芽胞やバイオフィルム関連細胞から再発を防ぐことができます8、9。その結果、微生物叢の多くのメンバーに付随的なダメージを与える抗生物質は、高いCDI再発率と関連している。10,11,12 C. difficileに対するCRに寄与することが確認されている微生物叢の代謝特性は、微生物酵素による共役一次胆汁酸(BA)の二次BAへの変換であるが、最近の研究では、BA非依存の方法でCDIから完全に保護されていた。13,14,15 同様に、C. difficileは代謝的に汎用性が高いが、プロリン発酵がない生体内では他の微生物と競合できないことが強く証明されている16, 18, 19, 20 微生物叢の保護機能とは対照的に、常在菌からの交差摂食は感染を強化することもある17, 19...
また、このような背景から、C. difficileに対して高い抗菌活性を有するfidaxomicinなどの狭域抗生物質が開発されているが22、fidaxomicinに対する耐性はすでに確認されている23。CDIの治療は、C. difficileが休眠芽胞を形成し、抗生物質に対して耐性があり、特定の消毒剤タイプの化学物質によってのみ死滅させることができるため複雑である24。芽胞形成を誘導するシグナルは、栄養飢餓やクオラムセンシングなどの多様な環境刺激で、CDI中に芽胞が継続的に生産される25。芽胞は他の患者へのCDI伝播だけでなく患者内のrCDIに寄与することもある。胞子形成と同様に、胞子の発芽は、特定の発芽体受容体が発芽体の存在を感知することで誘導される複雑なプロセスです26。胞子形成、発芽、および腸内での植物細胞の成長が、既存の抗生物質では断ち切ることが困難なC. difficileの悪循環感染サイクルの中心となっています。
Chlorotonil A(ChA)は、Sorangium cellulosumから単離されたポリケチドで、グラム陽性菌に対して強い抗菌活性と中程度の抗真菌活性を有し、さらにマラリア原虫に対して生物活性を示す30。最近、ChAの誘導体であるChB1-Epo2が、限られた水溶性を改善するためにエポキシド結合を導入し、塩素原子を除去することによって生成され、それぞれin vivo安定性と全身バイオアベイラビリティを改善した31。その抗菌活性がグラム陽性病原体に限定されていることから、我々は、バンコマイシンと比較して腸内微生物への影響が少ないC. difficileによる感染症を取り除くクロロニルは良い候補だと推測している。さらに、他の抗生物質との交差耐性はこれまで報告されておらず31、ChAが抗菌薬として有力な候補となる。
結果
クロロトニルは多様なC. difficile株に対して抗菌活性を示す
そこで、ChAとその半合成誘導体であるChB1-Epo2(図1A、1B)のC. difficileに対する有効性と抗菌活性の可能性を検討した。この病原体の幅広いゲノム多様性をカバーするため、スクリーニングパネルには、よく特徴付けられたC. difficile株630、VPI10463、DSM1296(typestrain)、R20291、およびメトロニダゾール(CD-22-00115)またはfidaxomicin(CD-22-00001)に対する耐性株またはバンコマイシンに対する感受性が低下した株(CD-10-00484、CD-15-00638)を使用しました。菌株は、最小阻害濃度(MIC)と最小殺菌濃度(MBC)を決定するために、濃度を下げたChAとChB1-Epo2を用いた標準化液体ブロス希釈アッセイでスクリーニングされました(6.4 μg/mLから3.125 ng/mL)。
ダウンロード 高解像度画像ダウンロード(729KB)
ダウンロード フルサイズ画像をダウンロードする
図1. クロロトニルはC. difficileに対して抗菌活性を示す
(A) ChAと半合成エポキシ化誘導体ChB1-Epo2の化学構造。
(B) ChA(左)およびChB1-Epo2(右)の濃度が増加した状態でのC. difficile株VPI10463の増殖曲線。点線は検出限界値を示す。
(C)C.difficile株のパネルに対するChA、ChB1-Epo2、バンコマイシン、メトロニダゾール、フィダキソミシンのMICとMBC.
予想通り、4つの抗生物質耐性/回復性株は、耐性のない株や他の抗生物質に対する耐性を持つ株と比較して、MIC/MBC値の増加を示した(図1C)。一方、クロロトニルはいずれもバンコマイシン(0.4~0.8μg/mL)と同等以上のMIC・MBC値を示し、ChAでは0.4~1.6μg/mL、ChB1~Epo2では0.05~0.2μg/mLの範囲で、系統や抗生物質に応じた違いが見られた(図1B、1C)。メトロニダゾールまたはフィダキソミシンに耐性を持つ株、またはバンコマイシンへの感受性が低下している株は、クロロトニルに同等の感受性を示し、抗生物質間の交差耐性がないことが示された。古典的な殺菌性抗生物質の定義、すなわちMICとMBCの比が4未満であることに基づき、我々は両クロロトニルを殺菌性抗生物質と分類した。
ChB1-Epo2は亜致死濃度において代謝のリプログラミングと金属ホメオスタシスの撹乱を強制する
亜致死濃度における生理的・生化学的変化をさらに検討するため、レギュロンと代謝ネットワーク構造の点で最も特徴的な分離株の一つである C. difficile 630 株の転写反応を調べた32。両クロロトニルは株間で同様の阻害パターンを示し(図 1B と 1C)、かつ ChB1-Epo2 の方が高い活性を持っていたので ChB1-Epo2 に注目することにした。具体的には、C. difficileを指数関数期半ばまで増殖させ、著しい増殖遅延を引き起こす亜致死濃度である4.7 ng/mL のChB1-Epo2で30分間ストレスを与えた。DMSO処理した細胞はコントロールとして使用した。検出された3,774遺伝子のうち、コントロールと比較して、213遺伝子が有意に発現量が少なく(log2fold change [FC] ≦ -1.0)、207遺伝子が有意に発現量が多い(log2FC ≧ 1.0)ことが示された。アップレギュレートされた遺伝子の多くは、エネルギー生産・変換のカテゴリーと細胞壁生合成のカテゴリーに属している(図2A)。プロリン還元酵素をコードするprdABの転写産物がストレス細胞でより多く存在することを見出した。さらに、誘導された遺伝子は、リン酸化酵素系や代替糖質の取り込みと利用に関与すると推定される酵素をコードしていた。さらに、CcmA様薬剤耐性トランスポーター、推定スーパーオキシド還元酵素、ピリミジン二量体修復酵素、炭素飢餓タンパク質CstA、胞子形成因子をコードする遺伝子を特徴とするC. difficileの典型的なストレス応答の誘導も観察された。一方、脂肪酸などの高分子の生合成、鞭毛などの細胞構造の形成、プリン生合成を担う遺伝子の転写レベルは低下していた。つまり、ChB1-Epo2に対する病原体の応答は、エネルギー、AA、炭水化物代謝の大幅なリプログラミング、高分子およびポリアミン合成の減少、ストレス応答関連遺伝子の転写量の増加によって主に特徴付けられた(図S1;表S1)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図2. ChB1-Epo2は、亜致死濃度において、代謝のリプログラミングと金属ホメオスタシスの撹乱を強いる。
(A-C) C. difficile 630の亜致死量ChB1-Epo2 (4.7 ng/mL)に対するストレス応答シグネチャーを、処理30分後のトランスクリプトームレベル(A)、処理90分後のプロテオームレベル (B) および細胞内金属濃度のICP-MS分析 (C) で解析した。
(A) ストレス処理した細胞とDMSO処理した細胞でlog2FCが1.5以上異なる転写産物を、C. difficileの遺伝子目録をそれぞれのタンパク質の機能的役割に従ってクラスター化したヒートマップ上にマッピングしました。100万個あたりの遺伝子転写の数を色でスコア化した。タンパク質と機能的なカテゴリーが示されている。
(B) 62個のタンパク質が差次的に豊富であり、DMSOコントロールと比較して、ChB1-Epo2ストレス細胞で有意に高い豊富さ(log2FC≥1.5)、または唯一同定されたか、またはその逆であった。タンパク質の存在量は色でスコア化されている。
(C) 亜鉛、銅、カドミウムの細胞内濃度。エラーバーは平均値±標準偏差(s.d.)を表す。(*p < 0.05, **p < 0.01)。
図S1、表S1、S2も参照。
このアプローチを補完するために、同じ亜致死量のChB1-Epo2(4.7ng/mL)存在下で90分間増殖したC. difficile 630のプロテオームをLC-MS/MSで解析した結果、1,513個のタンパク質が特定され、62個のタンパク質がストレス後に有意に多くなるか少なくなることが分かりました。そのうち、3つのタンパク質が有意に多く、29のタンパク質がChB1-Epo2ストレス細胞にのみ同定されました(「ON」タンパク質)。一方、1つのタンパク質は有意に発現量が少なく、29のタンパク質はDMSOコントロールにのみ同定され、ChB1-Epo2ストレス細胞には同定されなかった(「OFF」タンパク質)。32個の高濃度タンパク質とONタンパク質のうち、11個は保存されたシステイン動機上で一過性の金属または鉄硫黄クラスターと結合すると予測されている(表S2)。ChB1-Epo2の存在によって影響を受ける金属含有タンパク質の数が多いことから、ChB1-Epo2が金属のホメオスタシスに障害を与えているのではないかという仮説が立てられた。この仮説を調べるために、誘導結合プラズマ質量分析(ICP-MS)分析を用いて、ChB1-Epo2で処理した細胞と未処理の細胞の金属含有量を分析しました。ICP-MSの結果、2価の陽イオンである銅、亜鉛、カドミウムの有意な増加が確認されました(図2C)。
これらの相補的なアプローチにより、ChB1-Epo2がC. difficileの主要な代謝機能を、MIC以下の濃度でも阻害することが明らかになり、今後の作用機序の研究の方向性が示されました。
ChAが確立したCDIに拮抗し、再発性感染を防ぐことに成功した
次に、CDIを治療するためのクロロトニルの可能性を評価した。この目的のために、クリンダマイシンによる微生物叢の破壊に基づく確立された感染モデルを適用した33。簡単に言うと、クリンダマイシンで前処理した後、特定病原体フリー(SPF)マウスにC. difficile VPI10463の104芽胞(0日)を接種した(図3A)。この株は、マウス感染研究34によく使用され、バンコマイシン、ChA、およびChB1-Epo2に感受性がある。翌2日(1日目および2日目)に、感染マウスを40mg/kgのChA、40mg/kgのChB1-Epo2、または20mg/kgのバンコマイシンで処理した(図3A)。抗菌効果の持続性を監視し、再発性感染症の発症の可能性を考慮し、2日目以降に抗生物質治療を中止した。予想通り、感染から24時間後(1日目)、マウスは激しい体重減少に見舞われ(図3B)、病気が急速に進行したことが示された。驚くべきことに、2回目の投与後の数日間で、バンコマイシンおよびChAを投与したマウスのほとんどが回復し始め、最終的な生存率は66.6%(6/9匹)であった。意外にも、ChB1-Epo2投与マウスは感染に屈し始め、最終的な生存率は22.2%(2/9匹)となり、車両投与したコントロールグループと同じになった(図3C)。バンコマイシン投与マウスは、初期に回復した後、再び体重が減少し始め、おそらく感染症が再発した結果であると考えられる(図S2AおよびS2B)。一方、ChAを投与したマウスは、疾患の再発を観察することなく、体重を着実に回復させた。バンコマイシン処理マウスはChA処理マウスよりも早い体重回復を初期に示したが、3日目のC. difficile数には2群間で有意差は見られなかった(図3D)。5日目にバンコマイシン治療群で観察された再発表現型は、ChA治療群と比較してC. difficileの植物細胞と芽胞の数が有意に多いという特徴があり、ChA治療が重症感染後のC. difficileをより効率的に除去することを示しています。実際、バンコマイシン治療群の16.6%(1/6)と比較して、ChA治療群の生存マウスの83.3%(5/6)は7日目までC. difficileを完全に除去し(図S2C)、すなわち、これらのマウスの糞便中には増殖細胞および芽胞は存在しなかった(図3)。腸の炎症のマーカーであるリポカリン-2のレベルを比較すると、体重差が最初に再び検出可能になった時点である5日目に有意差が認められた(図3E)。さらに、バンコマイシン処理マウスは3日目に低い毒素レベルを示したが、ChA処理マウスでは5日目にバンコマイシン処理マウスと比較して約100倍の毒素が検出されることが確認された(図3F)。
ダウンロード 高解像度画像ダウンロード(893KB)
ダウンロード フルサイズ画像をダウンロードする
図3. ChAは確立したCDIにうまく拮抗し、再発性感染を予防する
(A-F)SPFマウス(n = 9/グループ)をクリンダマイシン(10 mg/kg)で前処理し(day -1)、VPI10463の104個の芽胞を感染させ(day 0)、その後抗生物質を投与した(day 1 and 2).
(B)感染マウスまたは未感染/未処理マウスの1日平均体重。
(C)感染マウスのカプランマイヤー生存曲線、p値はログランク(Mantel-Cox)検定で決定した。
(D) 感染の異なる時点におけるC. difficile芽胞および植物細胞の糞便負担。点線は検出限界値を表す。
(EおよびF)糞便サンプルからのリポカリン-2および総C. difficile毒素(TcdAおよびTcdBプール)ELISA。(D)-(F)のp値は、ChAおよびバンコマイシン処理間のマン-ホイットニーノンパラメトリックランク比較を示す。
(G)ChA(40mg/kg)およびバンコマイシン(20mg/kg)による処理の前(0日目)および後(1、3、5、7日目)の異なる時点の糞便サンプルからのChA(左)およびバンコマイシン(右)の定量化(n=5〜8/日/抗生物質)。
(H)SPFマウス(n=9/グループ)をクリンダマイシン(10mg/kg)およびChA(40mg/kg)または大豆油で前処理し(day -1)、VPI10463の104芽胞で感染した(day 0)。左:感染マウスの1日平均体重。p値は、示された日数における処理間のMann-Whitneyノンパラメトリック順位比較を表す。右側: Kaplan-Meier生存曲線。
(I)GFマウス(n=7/グループ)に103芽胞のC. difficile VPI10463を感染させ、その後1日目のp.i.で抗生物質処理を行い、感染したGFマウスの1日の平均体重を示した。エラーバーは±平均の標準誤差(SEM)を表す。 (*p < 0.05, **p < 0.01, ***p < 0.0001).
図S2も参照。
バンコマイシンとChAはin vitroで同等の抗菌効果を示すことから、抗生物質の通過時間や微生物叢を介したCRなど、他の要因がChA処理マウスからC. difficileを効率的に除去することに寄与していると仮定した。そこで、ChAとバンコマイシンを投与したSPFマウスの糞便サンプル中の抗生物質濃度を縦断的に定量化した。投与後1日目にバンコマイシンと比較して、より高いレベルのChAが検出された(図3G)。具体的には、ChAはバンコマイシンの2倍高い濃度で投与されたが、バンコマイシンの約25倍高い濃度のChAが検出された。さらに、バンコマイシンの濃度は翌日以降検出限界以下となったが、ChAは3日目と5日目にも検出されたが、1日目と比較して10倍から500倍低い濃度であった。このChA濃度の持続が、in vivoでのCDI発症を抑制するのに十分かどうかを調べるため、SPFマウスにクリンダマイシン(10 mg/kg)とChA(40 mg/kg)または大豆油(対照)を前投与し、その後CDIを発症させました。驚くべきことに、ChA前処理は、コントロールと比較して、有意に遅い発症と軽度の重症化をもたらし、体重減少および高い生存率によって特徴付けられた(図3H)。これらの結果は、持続的なChAが長期間にわたってC. difficileに拮抗できることを示し、クリアランスを促進する可能性があることを示しています。再生する微生物叢の存在が治療結果に重要であるかどうかを評価するために、健康な微生物叢が存在しない場合、すなわち、無菌(GF)マウスにC. difficileを感染させ、感染後1日目から抗生物質を投与することにより、ChAおよびバンコマイシンの治療効果を評価した(p. i. )。このように、ChAもバンコマイシンもGFマウスのCDIをうまく予防することができず、CDIの治療には回復した微生物叢が生理的に重要であることが示唆された。
マウスにおいて、ChAは、ChB-Epo2およびバンコマイシンと比較して、異なる微生物叢の変化を誘導する。
ChAとバンコマイシンが微生物叢組成に異なる影響を与え、それがChA処置マウスからのC. difficileの良好なクリアランスと関連しているかもしれないという仮説を検証するために、感染実験の内腔結腸サンプルの微生物叢分析を実施した。感染マウスとChA処理マウスは、バンコマイシン処理マウスと比較して、3日目の微生物叢組成に強い違いが見られた(図4A)。特に、ChA処理マウスのより多様な微生物叢は、C. difficileのクリアランス向上に寄与すると考えられるグラム陰性菌のファミリーであるPorphyromonadaceae、Verrucomicrobiaceae、Bacteroidaceaeのメンバーを特徴とした35。しかし、α-diversity(図4B)、weighted unifrac distance(wUnifrac)、すなわち、系統間距離には有意な差が認められました(図4C)、 は、3日目のChA投与マウスとバンコマイシン投与マウスの間のβ多様性(図4C)の系統的距離36の指標であり、ChA投与後の微生物叢の回復が早いことを示している。5日目では、処置間の差はあまり顕著ではなくなった。しかし、Muribaculaceae、Lachnospiraceae、およびVerrucomicrobiaceaeのメンバーのレベルは、未感染マウスおよび無処置マウスと比較して、依然として顕著に区別されていた(図4A)。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像をダウンロードする
図4. マウスでは、ChAがChB-Epo2およびバンコマイシンと比較して、明確な微生物叢の変化を誘導する
(AおよびB)感染マウスおよびChAまたはバンコマイシン処理マウスの3日目および5日目のp.i.における大腸微生物叢組成およびα-多様性の変化。未処理および非感染マウスをコントロールとして使用した(n = 3-5/グループ)。
(A)最も豊富な12種類の細菌ファミリーの単一サンプル相対存在量(%);U、未処理/未感染;V、バンコマイシン;A、ChA。
(B)観察された種の豊かさ(アンプリコンシークエンスバリアント、ASV)とシャノンインデックスを用いた糞便微生物叢からのα-多様性の定量化。
(C) wUnifrac距離を用いたβ-diversityを示すNMDSプロット。(B)と(C)のp値は、ChA処理とバンコマイシン処理の間のMann-Whitneyノンパラメトリック順位比較を表している。
(D-F)SPFマウス(n = 4-5/グループ)の抗生物質処理後の糞便サンプルの縦断的な微生物相分析である。(EおよびF)抗生物質投与後(0日目)の(E)観察された種の豊かさ(ASVs)を用いたα-多様性および(F)wUnifrac距離を用いたβ-多様性の経時変化の定量化。棒グラフ(右)は、各マウスの0日目と1日目の値の間で計算されたペアごとの(E)倍率変化と(F)wUnifrac距離をそれぞれ表しています。
(G-L) SPFマウス(n = 4-5)の抗生物質処理24時間後のセカールサンプルの微生物相解析。(G) 最も豊富な12種類の細菌ファミリーの単一サンプル相対存在量(%)。(H) wUnifrac距離を用いたβ-diversityを示すNMDSプロット。各抗生物質サンプルとそれぞれの対照群サンプル(バンコマイシン未処理、クロロトニルス-大豆油)の各サンプルとの間のセントロイドwUnifrac距離(右)を算出した。(I)観察された種の豊かさ(ASVs)とシャノンインデックスを用いた、セカール微生物叢からのα-多様性の定量化。
(J-L)線形判別分析(LDA)効果量(LEfSe)による、ファミリーレベルでの(J)ChA、(K)ChB1-Epo2、(L)バンコマイシン処理後のセカール微生物叢の変化の比較。(E)-(I)のp値は、すべての抗生物質処理間のKruskall-Wallis検定。エラーバーは±SEMを表す。(*p<0.05、*****p<0.01、******p<0.0001)。
図S3および表S3も参照。
次に、前処理や感染を伴わないバンコマイシン、ChA、およびChB1-Epo2投与が、腸内細菌叢に類似または異なる影響を及ぼすかどうかという疑問に取り組んだ。この目的のために、マウスを2つの濃度(40および20 mg/kg)のChAまたはChB1-Epo2のいずれかで単回経口投与した(図4D)。糞便サンプルは、異なる時点(0日目、1日目、3日目、5日目、7日目)に同じマウスから縦断的に採取し、16S rRNA遺伝子配列決定に供した。予想通り、バンコマイシンは微生物叢に強い影響を与え、観察された種の豊かさ、および投与24時間後のシャノン多様性指数を著しく減少させ(図4EおよびS3A)、その後、1週間以内にゆっくりと回復した。同様に、ChAおよびChB1-Epo2は、観察された種数およびシャノン多様性指数を一過性に減少させた(図4EおよびS3A)。シャノン多様性指数に差は見られなかった(図S3A)。β-多様性解析を行った後、縦断データセットのwUnifrac距離を初期状態(0日目)と比較して計算した。その結果、1日目では、高濃度のChB1-Epo2(0.26)およびChA(0.26)と比較して、バンコマイシンがそれぞれ強い効果を発揮した(平均距離=0.29)(*p<0.05)(図4F)。3日目から、wUnifrac距離の有意差はグループ間で検出されなかった。この傾向は、非計量多次元尺度法(NMDS)分析でも見られ、バンコマイシン-およびChB1-Epo2-治療24時間後の明確なクラスタリングを示し、3日目以降からコントロールおよびChAサンプルに収束した(図S4B)。ファミリーレベルでの微生物叢の変化の特徴から、常在菌の異なるグループが抗生物質によって一時的に影響を受けることが示されました(図S4C)。
糞便サンプルからの縦断的な分析に加えて、処理後24時間のセカルサンプルも分析した。バンコマイシン処理では、デスルホビブリオナ科などの通常では稀な微生物が拡大し、再び最大の変化を示した(図4G;表S3)。対照群と比較して、ChAおよびChB1-Epo2は、Lachnospiraae科の存在量の部分的な減少をもたらした(大豆油の相対存在量、36%;ChA、28.8%;ChB1-Epo2、15.9%;およびバンコマイシン、2。 7%)、一方、ChB1-Epo2とvancomycinは、用量依存的にMuribaculaceae科の存在量も減少させた(大豆油, 29.0%; ChA, 28.5%; ChB1-Epo2, 6.0%; and vancomycin, 6.4 )。β-ダイバーシティの解析とwUnifrac距離の算出により、抗生物質が微生物叢に与える影響が明確になり、ChB1-Epo2 (0.33, p = 0.12) またはChA (0.10, *****p < 0.0001) と比較してバンコマイシンの影響が強いことが裏付けられた(図4H)。この観察に伴い、α多様性の有意な変化は、それぞれの対照群と比較して、ChB1-Epo2およびバンコマイシンによる治療後(図4I)のみ検出された(*****p<0.0001)。次に、クロロトニルとバンコマイシン投与後の微生物相の変化を、線形判別分析(LDA)効果量(LEfSe)によりファミリーレベルで解析した。ChAでは、主にVerrucomicrobiaceae(増加)、Peptococcaceae、Erysipelotrichaceae(ともに減少)のレベルで変化が観察された(図4J)。ChB1-Epo2処理により、Lachnospiraceae、Rikenellaceae、Muribaculaceaeは減少したが、Bacteroidaceae、Prevotellaceae、Verrucomicrobiaceaeを含むいくつかの細菌ファミリーが増加し、マウス腸内細菌叢の主要なグラム陰性フィラを代表した(図4K)。バンコマイシンは、ChB1-Epo2に同様の変化をもたらし、同時にDesulfovibrionaceaeとAlcaligenaceaeを増加させました(図4L)。
まとめると、これらの結果は、ChA処理により、バンコマイシンと比較してCDI中の微生物叢の回復が早く、ChAの単回投与により、ChB1-Epo2またはバンコマイシンと比較して、微生物叢に明確かつ深刻ではない変化が引き起こされるという証拠を提供します。
ChAが子豚の微生物叢に及ぼす影響は軽微である。
クロロトニルがネズミの微生物叢に及ぼす影響を裏付けるため、遺伝学、生理学、微生物叢の構成がネズミと比較してヒトとより類似しているモデルであるブタを用いて摂食試験を行った37。ChAを含むピーナッツバター製剤と含まないものを6週齢のブタに与えた(20 mg/kg、n = 6/グループ)24時間間隔で2回)(図5A)。各動物から、2回目の抗生物質処理の前(0日目)と6時間後(1日目)、および次の3日間(2日目、3日目、4日目)に、糞便サンプルを採取した。糞便サンプルのα-diversityに経時的な有意な変化は見られなかったが(図5B)、マウスと比較して子豚の個体間変動が大きく、実験終了まで値はほぼ回復していた。
ダウンロード 高解像度画像ダウンロード(836KB)
ダウンロード フルサイズ画像をダウンロードする
図5. ChAが子豚の微生物相に及ぼす影響は小さい
(A)抗生物質投与前(0日目)と投与後(1、2、3、4日目)の子豚の糞便微生物叢の変化をモニターするための子豚実験のスキーム。
(B)種の豊富さとシャノン指数によるα-多様性の定量化(n = 6/グループ)。
(C)最も豊富な12種類の細菌ファミリーの絶対量(cells/g feces)を、子豚について別々に描いた。有意に変化した属は、対照群とChA処理群のボックスプロットで示した。p値はそれぞれの日間で計算した(*p < 0.05 ペアのWilcoxon符号付き順位和検定、*p < 0.05 ペアのFisherの正確検定)。
(DおよびE)(D)ChA処理群についてボックスプロットで示した絶対量(cells/g feces)が有意に変化した科および(E)属の値。
図S4、表S4およびS5も参照。
次に、フローサイトメトリーにより絶対量を決定したところ、定量的な細菌細胞数は、対照群においても、サンプル間、個体間、および時点間で有意に変化していた(図5C)。例えば、子豚01は、2日目から3日目にかけて、糞便1gあたり50%の細菌細胞の減少を示した。乳酸菌の初期細胞数にはばらつきがあるものの、すべてのChA処理動物でこのファミリーの減少が観察された(図5D)。微生物叢組成の高い個体間変動にかかわらず、Erysipelotrichaceaeの存在量は、0日目と比較して3日目と4日目にChA処理子豚で著しく減少し、Eubacteriaceae ChA処理子豚の1日目と比較して2日目に著しく減少したことと合わせて。その他、科レベルでの変化は検出されなかった(表S4およびS5)。属レベルの分析では、検出された138属のうち、ChA処理後に有意に減少したのは2属のみであった。Clostridium sensu stricto 1属は4日目に、Terrisporobacter属は3日目と4日目にそれぞれ減少し(図5E)、いずれもC. difficileと同様、ペプトストレプトコックス科に属する属である。
ChAが豚の微生物叢に与える影響は小さいという観点から、豚の糞便サンプルにおいてChAが検出可能であり、生物学的に活性であるかどうかを評価した。その結果、3日目までChAが検出され、1日目と2日目に最も高い濃度が検出された(図S4A)。ChAの生物活性は、コントロールまたはChA処理動物の糞便サンプルを異なる濃度(10%および25%)で添加したLB培地でChA感受性の指標株Stapylococcus aureusを培養することで評価した。黄色ブドウ球菌の増殖は、処理した動物の糞便の希釈液の存在下で阻害されたが、対照動物の糞便の希釈液の存在下では阻害されなかった(図S4BおよびS4C)。
これらのデータから、ブタの微生物叢では、グラム陽性菌のいくつかのグループがChAによって影響を受けるが、これらの影響は、密接に関連する2つの属TerrisporobacterとClostridioidesを除いて、一過性であることが判明した。したがって、マウスモデルと同様に、ChA処理は、α-多様性と細胞密度に影響を与えることなく、子豚の多様なマイクロバイオームの組成にわずかな影響しか与えませんでした。
クロロトニル投与は、腸内代謝を維持し、C. difficileに対する天然のCRを維持する。
抗生物質の投与は、マウスの微生物叢の構成に異なる影響を与えるため、微生物叢の機能性に影響を与える可能性があるため、C. difficileに対するCRに寄与する代謝物を定量化した15、38、39 総BAsについては、クリンダマイシンおよびバンコマイシン投与マウスで有意な減少(10倍以上)が観察されたが、ChAまたはChB1-Epo2投与後には見られなかった(図S5Aおよび図S5B)。クリンダマイシンおよびバンコマイシン処理により、C. difficile阻害性の二次BA(デオキシコール酸[DCA]、リトコール酸[LCA]、オメガムリコール酸[ω-MCA])の存在量はそれぞれ100〜1000倍まで減少した(図6A)。個々のBAの変動は検出されたが、DCA、LCA、ω-MCA、およびウルソデオキシコール酸(UDCA)のレベルには、ChA-およびChB1-Epo2処理とそれぞれのコントロールとの間で大きな変化は認められなかった(図6AおよびS5B)。注目すべきことに、これらの実験では、微生物叢の構成に与える影響が異なるにもかかわらず、ChAとChB1-Epo2の区別は明らかになりませんでした。対照的に、BA代謝に対するChAと比較したバンコマイシンの影響が明らかになり、観察されたrCDIの違いを説明するのに役立つと考えられる。そこで、CDIとバンコマイシンおよびChAによる治療後3日目と5日目に、一次BA、脱共役BA、二次BAを定量化した(図3A)。予想通り、未感染マウスとC.ディフィシル感染・治療マウスとの間で、C.ディフィシル阻害BA(LCA、DCA、iso-DCA、チェノデオキシコール酸[CDCA]、UDCA、⍵-MCA)に強い変化が見られた(図S5C)。バンコマイシン処理マウスと比較してChA-では、C. difficile阻害BAsの濃度が高くなる傾向が観察されたが、有意ではなかった。この実験ではマウスをクリンダマイシンで前処理してC. difficileのコロニー形成を可能にしたため、その後のバンコマイシンまたはChA処理にかかわらず、腸内BAプールは深刻な障害を受けたままであり、結果としてrCDIの差を説明できないと結論付けた。
ダウンロード 高解像度画像ダウンロード(734KB)
ダウンロード フルサイズ画像をダウンロードする
図6. クロロトニルの投与により腸内代謝が維持され、C. difficileに対する天然のCRが保たれる
(A) 抗生物質処理24時間後の大腸胆汁酸の標的化定量化。C. difficileを阻害する胆汁酸の処理ごとの変化量を、それぞれのコントロールサンプル(バンコマイシンおよびクリンダマイシン対未処理、クロロトニル対大豆油)に対して計算したもの(n = 4-5/グループ)。クリンダマイシンおよびバンコマイシン処理後のiso-LCA/LCAおよびiso-DCAの濃度は、検出限界以下(bdl)であった。
(BおよびC)ChA(40 mg/kg)、クリンダマイシン(10 mg/kg)またはバンコマイシン(20 mg/kg)処理後24時間のマウスの糞便サンプルからのC. difficile関連代謝物の標的化定量化;(n = 5/グループ)。
(B)ベースライン(0日目)および抗生物質投与24時間後(1日目)に描かれた、検出されたすべての代謝物にわたるユークリッド距離を用いた非計量多次元尺度法(NMDS)。各ベースラインサンプルと各処理サンプルの間で一対のユークリッド距離を計算した。
(C) ベースライン(0日目)と治療(1日目)の各サンプル間でそれぞれ計算した特定代謝物のペアワイズフォールドチェンジ。
(D-F)SPF(n=9/グループ)マウスを抗生物質で前処理し(day -1)、104個の芽胞VPI10463で感染させた(day 0)。
(E)感染マウスまたは未処理/未感染マウスの1日平均体重を測定した。
(F)異なる感染時点におけるC. difficile芽胞および植物細胞(プール)の糞便負担。(C)および(F)のp値は、処理間で計算したKruskall-Wallis一元配置分散分析を表す。エラーバーは±SEMを表す。(*p<0.05、***p<0.01)。
図S5も参照。
栄養競合とスティックランド発酵は、C. difficileに対するCRに同様に寄与するので、17,40我々は、ベースライン(0日目)とChA、バンコマイシン、またはクリンダマイシン処理後24時間(1日目)の糞便サンプルからAA、短鎖脂肪酸(SCFA)、スティックランドメタボライトからなる代謝物の追加パネルを定量化した。解析の結果、3種類の抗生物質がいずれも代謝物濃度の変化を引き起こすことが明らかになりました。しかし、ユークリッド距離に基づくNMDSで定量化すると、ChA処理によって形成されたサンプルクラスタは、すべてのベースライン・サンプルに最も近い(図6BおよびS5D)。具体的には、0日目と1日目のサンプル間の平均距離は、クリンダマイシン(dist:0.094)およびバンコマイシン(dist:0.092)と比較して、ChA処理後(dist:0.04)は有意(*p<0.05)に低くなっています。特に、C. difficileからの保護を誘導することが示されているSCFA39は、クリンダマイシンまたはバンコマイシン処理後に著しく減少しているが、ChA処理後の濃度はほとんど変化していない(図6C)。さらに、プロリン、4-ヒドロキシプロリン、またはグリシンの濃度が、バンコマイシンまたはクリンダマイシン処理後に増加したが、ChA処理後には増加しなかったことが確認されている。これら2つの代謝物は還元的なスティックランド代謝に必須であり、腸管内で利用可能なため、C. difficileのコロニー形成と疾患発生を促進する41,42。一方、スティックランド代謝物は、腸内の代謝関連細菌の存在を反映して、C. difficileに対する保護と関連している17。ChA処理後、5-アミノバレレートとインドール-3-アセテートを除く検出スティックランド生成物のほとんどは、変化しないか上昇した(図S5d)。一方、クリンダマイシンおよびバンコマイシン処理では、これらの特定の代謝物の出力に強く影響し、スティックランド発酵により強い影響を与え、C. difficileに好ましい栄養ニッチを提供することが示唆された。これらの結果から、ChA処理はバンコマイシンやクリンダマイシン処理と比較して、腸内メタボロームへの影響が低いことが示されました。そこで、我々は、ChA処理後もC. difficileの栄養ニッチは占有されたままであり、したがって、CDIに対するCRはそのまま維持されるはずであると推測した。
この仮説を検証するために、SPFマウスのグループを、それぞれChAまたはChB1-Epo2(40 mg/kg)、あるいはコントロールとしてクリンダマイシン(10 mg/kg)またはバンコマイシン(20 mg/kg)で単回投与し、翌日(0日)に104芽胞C. difficile VPI10463を感染させた(図6D)。以前の知見と同様に、クリンダマイシン-33およびバンコマイシン処理43マウスは、1日p.i.から急な体重減少に苦しみ、両方の抗生物質がCRを破壊してCDIへの感受性を引き起こすことを実証した(図6E)。驚くべきことに、ChA-およびChB1-Epo2-処置は、表現型疾患に至らなかった。さらに、クリンダマイシンおよびバンコマイシン処理によってC. difficileのコロニー形成が可能になったが、クロロトニル処理マウスでは植物細胞や芽胞は検出されなかった(図6E)。これらの結果から、バンコマイシンやクリンダマイシンとは異なり、ChAとChB1-Epo2は、C. difficileと栄養ニッチを共有する常在菌やCRに関連する代謝産物に対する有害作用が少ないため、C. difficileに対するCRを維持できることが示されました。
ChA、およびより低い程度にクロロトニルB1-Epo2は、C. difficileの芽胞が植物細胞に伸長するのを抑制する。
芽胞は通常、既知の抗生物質に対して耐性があるが、ChAによってrCDIが減少したことから、ChAが芽胞の発芽または植物細胞への伸長に影響を与え、それによってrCDIを防止しているのではないかという仮説が立てられた。この仮説を検証するために、C. difficile(VPI10463株)の芽胞を抗生物質と1時間インキュベートした後、タウロコール酸(TCA)を添加した寒天培地にプレーティングして芽胞の発芽を誘発した(図7A)。驚くべきことに、ChA処理により、すでに0.1μg/mLから胞子の伸長とコロニー形成が阻害された(図7B)。注目すべきは、0.4μg/mLのChA以上の濃度で、コロニー形成が完全に阻害されたことである。ChB1-Epo2は、植物細胞に対してはChAより約4〜8倍活性が高かったが、芽胞に対してはあまり強力ではなかった(図1Cおよび7B)。検出可能なコロニー数は徐々に減少し、0.1μg/mLで8倍、0.4μg/mLで68倍に減少したが、最高濃度でも一部のコロニーが検出された(図7B)。胞子を事前にインキュベートせずにクロロトニルと一緒にプレーティングした場合、CFU数の変化は観察されず(図S6A)、クロロトニルがアッセイにおいて単に持ち越されていないことが示された。一方、バンコマイシンまたはメトロニダゾールは、試験したすべての濃度で芽胞の伸長を阻害することができなかった(図S6B)。高濃度での芽胞への残留性が報告されているフィダキソミシンは、我々のアッセイでは409.6μg/mLという非常に高い濃度までコロニー形成を阻害することができなかった(図7B)。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像をダウンロードする
図7. クロロトニルはC. difficileの芽胞に残留し、植物細胞への伸長を抑制する。
(A) (B)~(J)の広範な胞子抑制アッセイの実験セットアップ。
(B) ChA、ChB1-Epo2およびfidaxomicinでインキュベートした後のC. difficile胞子伸長の濃度依存的阻害を、プレート上のCFU数で判定した。6.4μg/mLを超える濃度は、ChAの水溶性を超えるため、除外された。
(C) C. difficile芽胞を濃度の低いChAで処理し、十分に洗浄した後、液体培地+0.1%TCAでインキュベートした。アウトグロウに使用した培地には、抗生物質は含まなかった。点線は検出限界を示す。
(D) 6.4 μg/mL ChAまたはChB1-Epo2の存在下で、1時間の時間経過に伴うOD600の損失によって決定される発芽アッセイ。
(E) 6.4 μg/mL ChAまたはChB1-Epo2処理による胞子伸長の阻害、次いで1×PBS、70% EtOH、および10% EtOHで広範囲に洗浄し、プレート上のCFUで決定した。
(FおよびG)ChAおよびChB1-Epo2の持続性は、枯草菌とプレインキュベートした脳心筋梗塞(BHI)-寒天上に(F)濃縮または(G)希釈した(E)の芽胞を加えることによって検証された。バイオアッセイプレートは、37℃で24時間好気的に増殖させた。
(H)SPF(n=9/グループ)マウスをクリンダマイシン(10mg/kg)で前処理し(day -1)、104個のChA処理またはコントロール処理およびPBS洗浄したC. difficile芽胞で感染した(day 0)。
(I)コントロール処理またはChA処理芽胞のいずれかに感染させたマウスの1日平均体重。
(J) 異なる感染時点におけるC. difficileの植物細胞および芽胞の糞便負担。点線は検出限界。(B)と(E)のp値は、サンプルとDMSOコントロール間のKruskall-Wallis一元配置分散分析を表す。 (I)と(J)のp値は、特定の感染時点での治療グループ間のMann-Whitneyノンパラメトリック順位比較。エラーバーは±SEMを表す。(*p<0.05、**p<0.01、**p<0.001、****p<0.0001)とした。
図S6も参照。
コロニー形成の阻害は、寒天プレートでの培養を72時間まで延長した後にも観察された(図S7C)。プレーティング条件がこの阻害の原因である可能性を排除するために、処理および洗浄後の胞子をTCAを含む液体培地でインキュベートし、発芽を誘導した。同様に、濃度依存的な効果が観察され、ChA(図7C)はChB1-Epo2(図S6D)よりも強い効果を示した。0.4μg/mL以上のChAで処理した胞子は、その後48時間以内に液体培養で増殖できなくなった。ChB1-Epo2処理後、C. difficileは最終的に初期濃度6.4μg/mLまで増殖可能となり、この結果は、2化合物の異なる作用をさらに裏付けた(Figure 7C)。
次に、クロロトニルが二次BAと同様に胞子の発芽を阻害し、休眠を維持することができるかどうかを調べた。胞子の発芽は、胞子発芽剤と抗生物質の存在下で、芯の再水和46,47による光学密度(OD)の損失によって特徴付けられた。胞子は、ChAまたはChB1-Epo2処理(6.4μg/mL)後でも発芽することができた。このことは、クロロトニルがC. difficileの胞子の発芽そのものではなく、胞子の伸長を阻害することを示唆している(図7D)。
クロロトニルはC. difficile胞子上に残留し、マウスにおける致死的感染を防止する
クロロトニルは胞子とインキュベートすることが阻害に必要であることから、その高い疎水性31によりC. difficileの胞子に残留しているのではないかと考えた。そこで、親水性溶液と親油性溶液による洗浄工程を含むように、阻害アッセイを改良した。PBSで繰り返し洗浄した後、ChA(p < 0.001)およびChB1-Epo2(p = 0.15)で処理した芽胞の成長は、以前(図7B)より低い効果ではあるものの、依然としてかなり減少していた(図7E)。一方、70%エタノールで洗浄すると、C. difficileの胞子伸長の阻害は完全に否定された。10%エタノールで洗浄しても胞子発育阻害効果は低下せず、胞子からChAを除去するには高濃度の有機溶媒が必要であることが示された。この結果をさらに検証するため、ChAおよびChB1-Epo2に感受性のある枯草菌(MIC: ChA, 0.4 μg/mL, ChB1-Epo2, 0.2 μg/mL)とあらかじめインキュベートしたBHI-寒天上にクロロニルで処理・洗浄した胞子を添加しました。驚くべきことに、PBSと10%エタノールで洗浄した胞子の周囲に大きなB. subtilis阻害ゾーンが観察されたが、70%エタノールでは観察されず、C. difficile胞子にクロロトニルが残留することが示された(図7F)。さらに胞子を希釈したところ、ChAとChB1-Epo2が高濃度で胞子上に残留することが示唆された(図7GおよびS6E)。
次に、ChAがin vivoでも胞子の伸長を抑制することができるかどうかを評価した。そこで、マウスをクリンダマイシンで前処理して感受性を誘導し(1日目)、その後、104個のChA処理または未処理のC. difficile VPI10463胞子で感染させた(図7H)。驚くべきことに、1日目と2日目のp.i.において、ChA処理芽胞に感染したマウスは、未処理の芽胞に感染したマウスと比較して有意に低い体重減少を示し、病気の進行がより遅く、より深刻ではないことを実証した(図7I)。実験終了時には、生存率に顕著な差が見られ、ChA芽胞感染マウスは、対照群の33.3%(3/9匹)と比較して、100%と有意に高い生存率を示した(図S6F)。注目すべきは、ChA-spore感染マウスでは、実験(1、3、5、7日目)p.i.にわたって、植物細胞のCFUが著しく減少していることである(図7J)。さらに、ChA-spore感染マウスでは、1日目のp.i.でC. difficileの胞子を検出しなかったことから、ChAがin vivoでC. difficileの集団動態を有意に変化させることがわかった。
以上の結果から、クロロトニン、特にChAがC. difficileの胞子上に残留し、低生理濃度でも植物細胞への生育を抑制できることが示された。さらに、ChAがC. difficileの芽胞に残留することで、致死的な感染結果を防ぐことができ、ChAは理想的な薬剤候補となる。
考察
CDIは、ほとんどの場合、無関係の感染症に対して広域抗生物質を投与した後に発症します48。腸内細菌叢が意図せず損傷することで、C. difficile芽胞の発芽、植物成長、そして最終的には腸の損傷を許容する内腔環境となります。CDIの治療に現在使用されている抗生物質、すなわちバンコマイシンやメトロニダゾールは、機能的に損なわれた微生物叢を維持するため、CDIは依然として大きな医療問題である。エンドスポアの持続と相まって、全患者の約20%に高率の感染症が再発する。49,50 より新しく、よりコストのかかる治療法はfidaxomicinで、多くの臨床分離株の高い感染症再発率なしにC. difficileに対して有効である。しかし、rCDIの治療効果は、いくつかのC. difficileの流行に関連した超強力な変異体であるRT 027の感染に対して、fidaxomicinとvancomycinの間で差がなかった22,51。したがって、C. difficileに対するCRにほとんど影響を与えないC. difficile標的抗生物質の必要性が高まっており、正しい治療を確保し、感染症の再発や微生物相にあまり影響を与えないで起こるその他の副作用のリスクを低減させる。
驚くべきことに、クロロトニル、特にChAはこの条件を満たしている。まず、ChAとChB1-Epo2の両方が、一般的に使用されている抗生物質に耐性を持つ株を含むC. difficile株の植物細胞に対して活性を持つ。第二に、ChA31はバンコマイシン52と同様に、経口投与後の全身バイオアベイラビリティが低く、CDIの治療に望まれる腸内に多く存在する特性を示す。興味深いことに、ChAはバンコマイシンよりも通過時間が長く、これは最終的に臨床的な投与計画に有益となる可能性がある。第三に、ChAはin vivoで微生物叢の機能を維持する。注目すべきは、バンコマイシンをマウスに投与するとC. difficileに対するCRが破壊されるが、クロロトニルはin vivoでCRを維持したことである。これは、クロロトニルの場合は腸内BA代謝の維持、ChAの場合はSCFA、スティックランド発酵基質および生成物のホメオスタシスレベルと関連していた。第四に、ChAと、より低い程度ではあるがChB1-Epo2は、生物学的に適切な濃度で、植物細胞への胞子の伸長を阻害することができる。以上のことから、ChAは、植物細胞に対する直接的な活性、C. difficileの芽胞に対する持続性、および腸内細菌叢の迅速な再生によって、(r)CDIを阻害することが示唆された。
特に、C. difficileの芽胞に対するChAの持続性と、rCDIを予防するためのその潜在的な影響は高い関心を集めている。ChAは、化学消毒剤タイプの分子と同様に、C. difficile芽胞の直接的な溶解や破壊を誘導しなかったが24、植物細胞のMIC値に近い、生物学的に関連する濃度の範囲内で、クロロトニルが芽胞の成長を阻害したことは、予想外のことだった。特に、C. difficileの芽胞に対する抗生物質の持続性は、以前、fidaxomicinについて、植物細胞のMICをはるかに超える濃度、すなわち、その芽胞結合阻害活性のMICの1,000倍を超える濃度で観察されました44。興味深いことに、クロロトニルの阻害活性は、有機溶媒による一連の洗浄工程によってのみ除去された。このことは、クロロトニルのような疎水性抗生物質が疎水性胞子被膜に残留することを示し、ChAを添加した胞子と洗浄胞子を共存させた後のChA感受性細菌の阻害が証明されている。さらに、ChAで処理した胞子は、生体内で発芽してCDIを引き起こす能力が強く損なわれており、このクラスの分子がさまざまな形態のC. difficileに対して有効であることが強調された。胞子の種特異的な組成の違いが、ChAが胞子に保持される能力に影響を与える可能性があるため、CRに重要な機能を提供する他の胞子形成性常在菌の胞子にChAが残留することを明らかにするためには、さらなる研究が必要であろう。
本研究では、多様なモデル系におけるクロロトニルの抗菌特性について説明したが、この天然物クラスの正確な作用様式と分子標的は依然として不明である。特に、抗生物質が殺菌的に作用するか、静菌的に作用するかは、種によって異なる可能性があることを明らかにした最近の研究に照らして、ChAが本当に殺菌的に作用するか、むしろ静菌的に作用するかは、まだ結論が出ていない53。クロロトニル処理のトランスクリプトーム、プロテオーム、メタロームの統合解析により、亜致死濃度でもエネルギー、AA、炭水化物代謝の大幅なリプログラミングが明らかになり、ChB1-Epo2がC. difficileの主要細胞プロセスを阻害して腸内コロニー形成に寄与することを支持した。特に、金属ホメオスタシスは、in vitroおよびin vivoでC. difficileの競争力に重大な影響を与え54、ChB1-Epo2によるその調節がクロロトニルの治療効果に寄与する可能性があります。ChAとChB1-Epo2の植物細胞に対する活性と芽胞への結合に見られる違いは、それぞれの物理化学的特性、特に疎水性、植物成長時と芽胞からの成長時に異なる存在量のタンパク質を標的とすることで説明できると考えられる。重要なことは、標的の同定により、C. difficileが他の常在菌と比較して生体内でクロロトニルに特に感受性が高い理由、特に、あるグラム陽性ファミリーが減少し、他のファミリーが濃縮または変化しない理由についてさらなる洞察を得ることができる。例えば、子豚のChA処理では、Clostridium属とTerrisporobacter属に特異的な有害作用が見られた。これは、C. difficileのターゲットとChAおよびChB1-Epo2が、他の常在菌のターゲットと比較して、それぞれ特に強い親和性を持つ結果、あるいはC. difficileのターゲットの主要機能により、MIC以下の濃度であっても、影響を受けない、あるいは影響の少ない常在菌に対して競合的に不利になる可能性があります。
以上のことから、本研究では、マウスおよびブタの微生物叢に対して穏やかで特異的な作用を持つ、未開拓の抗菌性化合物クラスについて述べる。特に、ChAは、バンコマイシン治療後に観察されるように、確立したCDIに拮抗し、再発を防止する能力を持つことから、CDIの治療薬として有望な候補である。異なる代謝経路に依存する有益な常在菌は、クロロトニル処理に抵抗するか、急速に成長を回復することができるため、CRを再確立することができます。その結果、病原体は、その代謝ニッチから腸内常在菌に容易に置き換わることになる。今後、このクラスの天然物によって影響を受ける分子標的およびプロセスを特定するための調査が必要である。クロロトニルのような化合物は、感染症に対する防御や宿主との相互作用に重要な微生物叢の重要な機能性を維持し、治療介入のための幅広い可能性を開くと結論付けています。
STAR★メソッド
キーリソース表
試薬または資源識別子細菌およびウイルス株C. difficile 630DSMZDSM 27543C. difficile VPI10463ATCCATCC43255C. difficile 1780DSMZDSM 1296C. difficile R20291DSMZDSM 27147C.difficile CD-10-00484 (バンコマイシン耐性)PMID 26444881N/AC. difficile CD-22-00115 (メトロニダゾール耐性)PMID 32001686N/AC. difficile CD-22-00001 (フィダキソマイシン耐性) Schwanbeck et al.23 N/AC. difficile CD-15-00638 (vancomycin resilient)PMID 32726198N/AC化学物質、ペプチド、組換えタンパク質Chlorotonil A, B1-Epo2Helmholtz Institute for Pharmaceutical Research SaarlandN/AMenadione crystalline (vitamin K)Sigma-AldrichCat# M5625Brain Heart InfusionOXOIDCat#CM1135BDMSOCharl RothCat#A994. 2Vancomycin HClCarl RothCat# 0242.3MetronidazoleSigmaCat# 443-48-1FidaxomicinMedChemExpressCat# HY-17580EthanolJ. T. BakerCat# 64-17-5Clindamycin HClSigmaCat# 21462-39-5CaCl2 × 2H2OMerckN/AGlycineCarl RothCat# 0079.1Triz-BaseSigmaCat# 741883TCA sodium saltCarl RothCat# 8149. 2L-システインL-システインCat#1693.1大豆油CaeloCat#8001-22-7重要なコマーシャルアッセイMouse lipocalin-2/NGAL DuoSet ELISAR&D SystemsCat#DY1857セパレート検出C.difficile toxins A and BtgcBIOMICSCat#TGC-E002- 1ZymoBIOMICS 96 MagBead DNA KitZymo ResearchCat#D4302寄託データマウスの16S rRNA遺伝子シーケンス本研究PRJNA80968516S rRNA遺伝子シーケンス本研究PRJNA800240RNAシーケンスデータ本研究PRJNA949940質量分析プロテオミクスデータ本研究PXD029243実験モデル: 生物/系統WT C57BL/6N 6~30週、ドイツ・ヘルムホルツ感染研究所の動物施設にて、強化型特定病原体フリー条件で飼育Janvier LabsN/AGermフリーWT C57BL/6NTac マウス 16週、 ヘルムホルツ感染研究所(ドイツ)の無菌施設にて、gnotobiotic isolatersで飼育されたものN/APiglets 4週間、Friedrich-Loeffler-Institute(ドイツ)の動物施設にて飼育されたものMörsdorfer Agrar GmbHN/AOligonucleotides16 S sequencing用プリマー
16S_V4Seq_515F: 5'AATGA
タッグガックアックガガット
ctacactatggtaattgtg
TGCCAGCGCCGGTAA
16S_V4Seq_806R:5' GGACT
ACNNGGTATCTAATSigmaCaporaso et al.55ソフトウェアとアルゴリズムGraphpad Prism 9.4GraphPad Software, Inc.N/AR Studio 2022.07.01R Studiohttps://cran.r-project.org/Quantitative Insights into Microbial Ecology (QIIME) v1.8.0Caporaso et al.55 N/AFastTreePriceら56N/ARibosomal Database Project (RDP) classifierWangら57N/AOTU picking with UCLUSTEdgar58N/APyNAST alignmentPriceら56N/APhyloseqMcMurdie and Holmes59N/A
リソースの確保
リードコンタクト
詳細については、リードコンタクトであるProf. Dr. Till Strowig (till.strowig@helmholtz-hzi.de)にお問い合わせください。
材料の入手方法
この研究で使用されたすべての菌株は、必要であれば、DSMZまたはリードコンタクトから、材料譲渡契約書に記入して入手できます。
実験モデルおよび研究参加者の詳細
倫理観の表明
すべての動物実験は、Helmholtz-Zentrum für Infektionsforschung, Braunschweig, Germanyのガイドライン、国内の動物保護法(Tierschutzgesetz (TierSchG) )、動物実験規則(Tierschutz- Versuchstierverordnung (TierSchVersV) )および欧州実験動物科学連盟(FELASA)の勧告に従って行われました。マウス試験は、Lower Saxony State Office for Nature, Environment and Consumer Protection (LAVES), Oldenburg, Lower Saxony, Germany; permit No.33.19-42502-04-19/3266 によって承認されました。ブタの試験プロトコルは、Thüringer Landesamt für Verbraucherschutz, Bad Langensalza, Germany(承認番号22-2684-04-BFI-17-001)により承認されています。
マウス
C57BL/6N SPFマウスはJanvier-Labsから購入し、ヘルムホルツ感染研究センター(HZI)の動物施設にて、実験開始前2週間以上、強化型特定病原体フリー(SPF)条件で飼育(ハウジング含む)した。6~30週齢の雌雄マウスを使用した。無菌のC57BL/6NTacマウスは、HZIの無菌施設内のアイソレーター(Getinge)で飼育した。滅菌した餌と水を自由摂取させた。マウスは12時間の厳格な光サイクル(午前7時に点灯、午後7時に消灯)で飼育し、当施設のバイオセーフティガイドラインに従って、交差汚染とC. difficile芽胞の拡散を防ぐためにHEPAフィルター(Techniplast)を含む気密で個別換気のISOケージにケージあたり最大6匹のマウス群で収容された。マウス実験中、ケージ間でマウスを移動させることはなく、すべての実験グループは自分のケージで管理された。すべてのマウスは、CO2による窒息と頸椎脱臼により人道的に安楽死させた。
豚
4週齢の雌子豚(Sus scrofa domestica)をMörsdorfer Agrar GmbH(ドイツ、チューリンゲン州Mörsdorf)から入手し、実験開始前にFriedrich-Leffler研究所(ドイツ、イェナ)の動物施設で2週間検疫を受けた。子豚には飼料と水を自由摂取させた。動物は、条件付きボックスあたり最大4匹の子豚のグループで飼育され、エンリッチメントと赤色光が提供された。健康状態は毎日測定した。すべての子豚はRelease(0.9mL/5kg体重)の適用により安楽死させた。
細菌株と増殖条件
本研究で使用した全菌株の起源は、主要リソース表に記載されている。菌株は、Brain Heart Infusion Broth(BHI、Oxoid)またはBHIS培地(BHI 37g/L、酵母エキス5%、L-システイン1%、ビタミンK 1mg/l、ヘミン5mg/l)で、DG250嫌気性ワークステーション(Don Whitley Scientific、Bingley、英国;98% N2、2% H2)またはCoy Laboratories嫌気室(85% N2、10% CO2 、5% H2)、37℃の条件で定期的に培養した。60 C. difficileの芽胞は4℃で保存し、0.1%のタウロコール酸を加えたBHI培地(Oxoid)に接種し、芽胞の発芽をさせた。その他の菌株は-70℃で保存し、グリセロールストックからBHIで接種した。
メソッドの詳細
クロロトニルのMIC/MBC判定
新鮮な培養液を指数期(OD600= 0.2 - 0.5)まで増殖させ、細胞密度を1x106 CFU/mLに調整してから植菌した。クロロトニル、フィダクソマイシン、メトロニダゾールをDMSOに、バンコマイシンをddH2Oに溶解し、12.8μg/mLから25ng/mLまで(フィダクソマイシンについては6.4μg/mLから6.25ng/mL)2倍の希釈系列で100μL BHIS培地に希釈した。その後、抗生物質含有培地に100μLの細菌培養液を接種し、最終濃度5x105 CFU/mL、抗生物質濃度6.4 μg/mL~12.5 ng/mL(Fidaxomicin 3.2 μg/mL~3.125 ng/mL)のウェルあたり総量200μL BHISとなる。MBCの判定には、目に見える増殖のない(およびコントロールとして増殖のある)各ウェルの50μLをBHIS寒天培地にプレーティングし、さらに37℃で24時間インキュベートした。成長曲線のOD600値は、LogPhase 600 4-plateリーダー(BioTek)を用いて24時間取得し、BHISに対してブランキングした。0.005以下のOD600値は0.005に調整し、検出限界とした。すべてのMIC/MBC値は、3つの独立した生物学的複製で、それぞれ4つの技術的複製で決定された。
細菌胞子の調製と精製
細菌胞子は、マイナーな変更を加えて以前に記載されたとおりに生成した61。簡単に言うと、C. difficileを嫌気性条件下で一晩培養した。遠心分離により細胞を回収し、1x PBSで2回洗浄し、OD600を0.2まで調整した。細胞をBHIS寒天培地(+ 0.1% TCA)上に広げ、嫌気条件下で37℃、7日間インキュベートした。胞子は、1mLの1xPBSをプレートに加えることで収穫し、セルスプレッダーを用いて集め、2mLの反応管に移した。胞子を14,000×gの遠心分離でペレット化し、上清を捨て、2mLの1xPBSで2回再懸濁・洗浄した。残存するすべての植物細胞を死滅させるため、胞子を65℃で20分間熱処理した。胞子数は、BHIS寒天+0.1%TCAにプレーティングした10倍希釈系列で決定した。胞子精製は、50%スクロース勾配遠心分離後、滅菌1xPBSで5回洗浄することにより行った。胞子はグラスチューブで4℃に保存した。C. difficile VPI 10463胞子株の純度と濃度は、精製を繰り返しても、高感度の「OD600の損失」と持続性アッセイを実施するには十分ではありませんでした。したがって、これらの実験にはC. difficile 630の胞子を利用した。
胞子伸長の阻害
精製C. difficile芽胞を、異なる濃度のChA、ChB1-Epo2、vancomycin、metronidazole、fidaxomicinで37℃、800rpmで1時間振とうした。CFUを測定するために、処理した胞子の連続希釈液を、0.1%TCAを添加したBHIS寒天培地にプレーティングし、実験に応じて24~72時間インキュベートした。少なくとも10個のコロニーを持つ2つの最低希釈液を使用して、CFUを決定した。液体培地でのインビトロ発芽については、処理した胞子を1xPBSで3回洗浄し、BHIS + 0.1% TCA培地に接種し、LogPhase 600 4-プレートリーダーで48時間成長をモニターした(BioTek)。0.005以下のOD600値は0.005に調整し、検出限界とした。C. difficileの芽胞を異なる溶媒で洗浄することは、以下のように行った: 抗生物質のインキュベーション後、胞子ペレットを1mLの1x PBS、10% EtOHまたは70% EtOHで5回洗浄し、洗浄4と5の間に胞子を新しいEppendorfチューブに移し、抗生物質のキャリーオーバーを防止しました。その後、胞子ペレットを1x PBSで2回洗浄し、残存するEtOHによる増殖阻害を防ぎ、連続希釈してBHIS + 0.1% TCA寒天培地にプレーティングしました。
OD600発芽喪失アッセイ
Hopkins and Wilsonから引用した。46 精製したC. difficile 630芽胞をペレット化し、50mM Tris-HCL(pH7.4)に再懸濁し、ODを≈0.5 に調整した。胚芽の添加後、BioTek Synergy H1マイクロプレートリーダーで37℃、60分の時間にわたって1分ごとにOD600を測定することにより、胚芽を決定した。発芽は、最終濃度0.1%TCA、50mMグリシンおよび60mM CaCl2により誘導した。結果は、初期OD600の%として報告されている。
大型プレートB. subtilisバイオアッセイによるクロロトニルの難分解性の決定
Dharbhamulla et al.44およびMullish and Williams45より引用 新鮮な枯草菌培養液をBHIS培地で37℃、指数期後期(OD600 = 0.5 - 1.0 )まで好気的に培養した。OD600を0.5に調整し、1mLの培養液を30mLのBHIS-Agar(50℃)に接種し、245mm×245mmのバイオアッセイディッシュに注いだ。発芽したC. difficileの胞子がB. subtilisの成長を阻害する可能性を防ぐため、プレートからTCAは省略した。プレートが乾燥したら、ChA、ChB1-Epo2またはfidaxomicin(6.4μg/mL)処理および洗浄した胞子液10μLを枯草菌寒天の上に接種した。コントロールとして、濃度を下げた10μLの抗生物質溶液(DMSO中)を同じプレートに接種した(空間的に分離)。バイオアッセイプレートは24時間好気的に培養され、阻害帯の写真を撮った。
子豚の飼育試験
子豚(予備試験では1群あたりn=2、本試験では1群あたりn=4)にピーナッツバターまたはピーナッツバターに混ぜたChA(体重1kgあたり10mg)を24時間の間隔をおいて2回摂取させた。サンプルの収集と取り扱いは、以下のように行った: 24時間ごとに個々の便を採取し、直ちにホモジナイズして分割した。アリコートは、16S rRNA遺伝子アンプリコンの配列決定用にDNA安定化溶液(STRATEC SE, Birkenfeld, Germany)中に保存した。残りのサンプル量は、添加物を加えずに-20℃で保存した。
マウスの抗生物質処理
SPFマウスの体重を測定し、新鮮な糞のサンプルを採取した。ChAおよびChB1-Epo2を大豆油(Oleum Sojae raffinatum, Caesar & Loretz GmbH)に40℃で3×5分間超音波浴で溶解させた。クロロトニルの溶液は、毎回の投与前にピペットで上下させて混合した。クロロトニルは40mg/kgおよび20mg/kgの濃度で経口ガベージにより、バンコマイシンは20mg/kgの濃度で1xPBSに100〜200μLの溶媒で溶解し、マウスの体重に応じて投与された。
C.difficileによるマウスの感染
すべての感染実験は、C. difficile株VPI 10463で実施した。各実験グループは、感染実験前および感染実験中に別々のケージに収容された。感染したマウスは、毛皮、皮膚、誘発行動、体重減少、糞便の一貫性、および姿勢を含む臨床的に重度のCDIの症状について毎日監視し、採点した。CDIの兆候を示すマウスを1日2回モニターし、最初の体重の20%を失うか、または上記の特徴の重度の臨床症状を発症した後に人道的に安楽死させ、カプランマイヤー生存プロットで「死亡」としてカウントした。胞子を65℃で20分間熱処理し、毎回の感染の24時間前にプレーティングでカウントして、感染量を決定した。異なる時点の後、マウスはCO2による窒息と頸椎脱臼によって人道的に安楽死させ、さらなる解析のためのサンプルを抽出した。
SPFマウス
SPFマウスを体重測定し、感染24時間前に10 mg/kgのクリンダマイシンを腹腔内注射で投与し、C. difficile感染に対する感受性を誘導した62。ChA前処理実験では、マウスにChA(40 mg/kg)または大豆油(コントロール)をクリンダマイシン投与と並行して投与し、経口ガベージで投与した。翌日、マウスにC. difficileの104個の芽胞を200μLの1xPBSに入れ、経口投与で感染させた。ChA処理した感染用芽胞は、以下のように作製した: C. difficile VPI10463芽胞を6.4μg/mL ChAで37℃、800rpmで1時間振盪処理した。インキュベーション後、芽胞を1x PBSで5回洗浄し、洗浄4と5の間に芽胞を新しいエッペンドルフチューブに移し、抗生物質のキャリーオーバーを防止した。
無菌マウス
胚性C57BL/6Nマウスは、HZIの胚性施設内のアイソレーター(Getinge)で飼育された。GFマウスにはコロニー形成抵抗性がないため、感染前に抗生物質の前処理は行わず、マウスは200μLの1xPBSに103個のC. difficile芽胞を減量して経口投与されたものを感染した。
C.difficileコロニー形成の定量化
異なる感染時点において新鮮な糞便サンプルを採取し、重量を記録した。その後、糞便サンプルを5mLの1xPBSで希釈し、Polytron PT 2500E分散装置を用いて30,000rpmで30秒間均質化した。図7におけるC. difficile定量化は、改良されたプロトコルで、さらにd1 p.i.からの糞便サンプルから実施し、図3および6Fの実験と比較して、この実験の検出限界を低くすることにつながった。簡単に言うと、糞便サンプルを1mLの1xPBSで希釈し、約100mgの0.1mmジルコニアビーズを含み、Mini-BeadBeater-96を用いて50秒間均質化した。CFUを測定するために、ホモジナイズしたサンプルの連続希釈液をbioMérieuxTM C. difficile寒天培地にプレーティングしました。胞子の定量には、植物細胞を65℃で20分間熱死させ、発芽を誘導するために0.1%TCAで前処理したC. difficile寒天培地にプレーティングした。プレートは37˚Cで48時間、嫌気性ボックスで培養した後、カウントした。C.difficileのCFUは、糞便重量で正規化した後に算出した。
リポカリン-2/C. difficile トキシンELISA法
マウスの糞便サンプルを秤量し、ELISA測定前に-80℃で保存した。糞便サンプルを2mLスクリュートップ反応管に移し、0.1mmジルコニア/シリカビーズ(Roth)を約100mg入れ、500μL Dilution Bufferと混合し、氷上に30分間置いた。その後、サンプルをMini-BeadBeater-96(BioSpec)を用いて10秒間ホモジナイズし、2500×gで5分間遠心分離して粒子状物質を除去した。上清は、以下のELISAキット「Mouse lipocalin-2/NGAL DuoSet ELISA (DY1857)」(R&D Systems)と「Separate detection of C. difficile toxins A and B (TGC-E002-1)」(tgcBIOMICS) を用いて便中リポカリン2または C. difficile toxin レベルの決定に用いられた。ELISAキットは、以下の変更を加えて、製造元の指示に従った: Lipocalin-2アッセイは、96ウェルCostarアッセイプレート(CORNING)に合わせてスケールダウンした。
マウス糞便からの胆汁酸抽出
糞便サンプルをメタノール(mgサンプルあたり20μL)と混合し、ビーズビーターで20秒を2サイクルとして細胞破砕を行った。サンプルを17,000×gで5分間遠心分離し、添加したメタノール量の50%を新しい反応管に移した。残りのバイオマスを再びメタノールと混合し(mgサンプルあたり20μL)、ビーズビーターで2回目の抽出を行った(20秒の2サイクル)。遠心分離(17,000×gで5分間)後、添加したメタノール量の100%を取り、最初の抽出物と合わせた。合わせた抽出物の350μLを真空濃縮機を用いて蒸発乾固し、乾燥した抽出物をさらなる処理まで-20℃で保存した。
HPLC-MS/MSによる胆汁酸分析
乾燥抽出物を35μLメタノール(LC-MSグレード)に溶解し、17,000×gで2分間遠心分離してセルロースアセテートスピンフィルターでろ過した。ろ過抽出物の20μLを4μLの内部標準混合溶液(GCDCA-d4およびLCA-d4、各0.5mM)と混合してHPLC分析用プラスチックバイアルに移した。BAを、エレクトロスプレーイオン化インターフェースを備えたAgilent 6545 Quadrupol-time-of-flight mass spectrometer (Agilent Technologies) に結合したAgilent 1290 Infinity II LC-System で分析しました。1μLのサンプルを注入し、Supelco Ascentis Express C18 カラム (75 × 2.1 mm、粒子径 2.7 μm) を用いて、22℃で300μL/minの一定流量で分離しました。溶媒A:5mM蟻酸アンモニウム、pH4、B:メタノール:アセトニトリル(3:1 v/v)を用いて、以下のグラジエントを適用した:0分 55% B 2分 68% B 5分 69% B 9.50 分 85% B 10.5 分 85% B 12分 100% B 14分 100% B 15分 55% 18分 55% B MS分析はマイナスイオン方式で、毛管電圧4000Vで実施した。質量スペクトルは300-1000m/zの範囲で記録された。生データは、Mass-Hunter Qualitative Navigator Software (version B.08.00, Agilent Technologies) で処理し、[M-H]- および/または [M+FA-H]- イオンの精密質量と、市販の BA 標準物質の保持時間を使用して BA を同定しました。データは重水素化内部標準のピーク面積で正規化し、共役BAにはGCDCAを、非共役BAにはLCAを使用しました。定量には、0-1000 mMの濃度範囲をカバーする各BAの14点検量線が用いられた。
マウス糞便からの短鎖脂肪酸の検出
抽出およびGCメソッドは、Suら55から採用し、Neumann-Schaalら60で修正した。簡単に言うと、サンプルは、内部標準としてo-クレゾールをスパイクした水に再懸濁し(30μl/mgサンプル)、ホモジナイズした。400μlの混合物を50μlのH2SO4(HPLCグレード)で酸性化し、激しく混合して200μlのtert-methylbutyletherで抽出した。エーテル相は、高効率源(HES)、四重極質量分析計およびGerstel RTCシステムを備えたAgilent GC-MSDシステム(7890Bを5977GCに結合)を使用して分析した。クロマトグラフィーは、Agilent VF-WAX-ms カラム(長さ 30 m、内径 0.25 mm、Agilent, Santa Clara, CA, USA)を用いて、1 mL/min のヘリウム定流を適用して実施しました。温度プログラムは以下の通りである: 55 °Cで1分、10 °Cで2分、250 °Cで一定に温度上昇。溶媒遅延時間は2.4分であった。保持時間を保持指数に変換するために、保持指数マーカー(シクロヘキサン中のC10...C22の範囲のn-アルカン)を使用した。定量は、真正な標準物質による外部検量線を用いて行った。データ解析は既報の通り実施した。60,58
マウス糞便からの不揮発性代謝物の検出
不揮発性有機酸およびアミノ酸は、Will et al.63に記載された方法で分析した。簡単に言うと、サンプルを水(湿重量1mgあたり20μl)に懸濁し、超音波浴で室温で10分間ホモジナイズし、サンプルの20μlに内部標準としてリボトールを含む100μlメタノールをスパイクさせた。遠心分離後、清澄な上清を真空濃縮機で1時間乾燥し、高効率源(HES)、四重極質量分析計、Gerstel RTCシステムを備えたAgilent GC-MSD システム(7890Bを5977GCに結合)で分析を行った。メトキシアミン塩酸塩溶液(ピリジン中20 mg ml-1)とN-メチル-N-(トリメチルシリル)-トリフルオロアセトアミドによる2段階の誘導体化は、RTCシステムで自動的に行われた。サンプル1マイクロリットルをマルチモードインレットを用いて、パルススプリットレスモード(0.75分まで30psi、1分で50ml min-1)およびスプリット比10:1のパルススプリットモード(12ml min-1の分割流)で注入した。分離は、Agilent VF-5ms カラムで、1.2 ml min-1 のヘリウムフローで行いました。オーブン温度は70℃で6分間保持し、その後325℃まで6℃min-1で直線的に昇温した。イオンはスキャンモードで70から700 m/zまで、2.3 scans s-1で検出された。定量は、真正な標準物質による外部検量線を用いて行った。データ解析は既報の通り実施した60,58。
糞便からのクロロトニルAおよびバンコマイシンの抽出と測定
すべての糞便サンプルは、抽出前に凍結乾燥させた。クロロトニル抽出のため、糞を各量のMilli-Q水(乾燥糞35mgあたり1mL)に懸濁し、次いで同量のジクロロメタン(DCM、HPLCグレード)を添加した。ホモジナイズのために、サンプルをボルテックス(2x10秒)し、超音波浴に少なくとも5分間入れた。その後、サンプルをロータリーシェーカーに1時間放置し(180rpm)、遠心分離(100rpm、5分)して相分離を促進した。下層(有機)相をガラスピペットを用いて回収し、DCM抽出を繰り返した。サンプルは定常窒素フロー下で乾燥させ、150μLのイソプロパノール(HPLCグレード)に再懸濁し、HPLC-MS/MS分析に備えた。なお、d7マウスのサンプルは、タンパク質含量が高いため、抽出工程を変更する必要があった。ここでは、糞を分離漏斗に移し、より大量のMilli-Q水とDCMを用いて抽出した(糞35mgあたり5mL)。クロロトニルと多くの沈殿物を含む下相を、ヘプタンと飽和食塩水を含む追加の分離漏斗に移した。ヘプタン/DCM/クロロトニルは上相を形成し(密度シフト)、沈殿物は下層の水相に留まり、適切な分離が可能でした。有機相を回収し、ロータリーエバポレーターで乾燥させた。抽出物はDCMに再懸濁し、窒素蒸発とHPLC-MS分析の準備の前に新しいガラスバイアルに移した。バンコマイシン抽出は、Huら57から引用した。簡潔に言えば、乾燥した糞を、Milli-Q(v/v)中の10%アセトニトリル(35mgあたり1mL)を使用して抽出した。その後、遠心分離(15000rpm、10分、4℃)後に上清を回収し、さらなる分析まで-80℃で保存した。校正用標準物質(n=2)については、未処理マウスの糞便を抽出し、マトリックス効果を避けるために、異なる濃度のChAまたはVancomycinをスパイクした。未処置の動物のサンプルは抽出ブランクとした。糞のサンプルは、Hypersil Gold C18カラム(1.9μm、50x2.1mm、Thermo Fisher、Dreieich、ドイツ)と溶離液A水+0.1%ギ酸、溶離液Bアセトニトリル+0.1%ギ酸を用いてTSQ Altis Plus(Thermo Fisher、Dreieich、ドイツ)に連結したVanquish UHPLCシステムで分析しました。HPLCおよびMSの条件は以下の通りである: バンコマイシン:HPLC:0 - 0.25 min 90% A, 0.25 - 0.6 min 90% A - 10% A, 0.6 - 1.5 min 10% A, 1.5 - 2. 0 min 90% A; MS: SRM、ポジティブモード、スプレー電圧3791 V、シースガス圧力35 psi、補助ガス圧力30 psi、スイープガス圧力2 psi、Ion Transfer Tube 380℃、Vaporizer温度325℃、Q1 mass 725.25 Da、Q3 mass 1307 Da、衝突エネルギー 14.8 V、RF レンズ71 V。LOD <0.001 ng/ml。Chlorotonil A: HPLC: 0 - 0.7 min 90% A, 0.7 - 1.4 min 90% A - 10% A, 1.4 - 4.2 min 10% A, 4.2 - 5. 0 min 90% A; MS: SRM, positive mode, Spray Voltage 1546 V, Sheath gas pressure 35 psi, Auxiliary gas pressure 30 psi, Sweep gas pressure 2 psi, Ion Transfer Tube 380°C, Vaporizer Temperature 350°C, Q1 mass 479.05 Da, Q3 mass 267.13 Da, Collision Energy 16.1 V; 295.05 Da, Collision Energy 13.9 V, RFレンズ 123 V. LOD:100ng/ml。
S. aureus指標株を用いたバイオアッセイによる糞便中のChA生理活性の解析
子豚の糞からのChAの生理活性を測定するために、0.1gの糞サンプルを10mLのNaClに懸濁し、十分にボルテックスした後、0.5μmの膜で濾過しました。得られた懸濁液は0.2μmのフィルターで滅菌した。黄色ブドウ球菌の一晩培養液を、10%(v/v)の濃度で滅菌した糞便懸濁液を含むLB培地に1:1,000で希釈した。アリコートを96ウェルマイクロタイタープレートに接種し、自動プレートリーダー(Epoch2T; BioTek, Bad Friedrichshall, Germany)で37℃、少なくとも18時間インキュベートした。増殖はOD600で判定した。標準化のために、S.aureusを、未処理の動物の糞の濾過された懸濁液を10%含むLB培地に希釈した。この懸濁液には、異なる濃度のChAをスパイクした。
マウスの糞便サンプルの16S rRNA遺伝子の増幅と配列決定
糞のサンプルを採取し、処理するまで-20℃で保存した。DNA は Zymo Research 社の 96-well DNA 抽出キットを用いて単離した。簡単に言うと、糞サンプルを96ウェルバッシングビーズライシスラックに移し、650μLのライシスバッファーで希釈し、Mini-BeadBeater-96を使用して3回5分間ホモジナイズした。サンプルは、ビーズビーターステップの間に5分間氷中に保った。その後、ホモジネートを4000×gで20分間遠心分離した。上清400μLを2mL 96ディープウェルプレート(Nunc™)に移し、再度20分間遠心分離して、破片、粒子、ビーズを徹底的に除去した。上清の200μLをDNA分離精製に使用した。サンプルは、TECAN Fluent® Automation Workstation上の96ウェルZymo Magkitを使用して精製した。V4領域(F515/R806)の16S rRNA遺伝子増幅は、以前に記載された確立されたプロトコルに従って行われた56。簡単に言うと、DNAは25 ng/μlに正規化され、特定のプライマー(Sigmaから入手)により組み込まれた固有の12ベースのGolaryバーコードで配列決定PCRに使用した。PCRは、Q5ポリメラーゼ(NewEnglandBiolabs)を用いて、各サンプルについて3連で行い、PCR条件は、98˚Cで30秒間の初期変性、その後25サイクル(98˚Cで10秒、55℃で20秒、72℃で20秒)である。プールして10 nMに正規化した後、PCRアンプリコンをIllumina MiSeqプラットフォームで250 bpペアエンドシーケンス(PE250)によりシーケンスした。Usearch8.1ソフトウェアパッケージ59を使用して、得られたリードをアセンブル、フィルタリング、クラスタリングした。QIIME v1.8.0を使用して、低品質リードのフィルタリングとサンプル固有のバーコードに基づくビニングを実施した。品質フィルターは、fastq_filter (-fastq_maxee 1)を用いて、最小リード長250bp、サンプルあたりの最小リード数=1000で実施した。リードは、オープンリファレンスOTUピッキングにより97%IDのOTUにクラスタリングし、UPARSEアルゴリズムを用いて代表配列を決定した59。 個体数フィルタリング(OTUs cluster > 0.5%) と分類学的分類は、80%ブートストラップ信頼度で実行したRDP Classifierを用いて行った65。OTU間の系統関係は、PyNASTアライメントにFastTreeを使用して決定した66。得られたOTU絶対量表とマッピングファイルは、R統計プログラミング環境パッケージphyloseqで統計解析とデータの可視化に使用された67。
子豚糞便サンプルの16S rRNA遺伝子アンプリコンの塩基配列決定とデータ解析
子豚の糞は600μLのDNA安定化溶液(STRATEC SE)に集め、RTで保存した。染色体DNAの分離はLagkouvardosらに従って行った。生リードをUPARSEに基づくIntegrated Microbial Next Generation Sequencing(IMNGS)パイプライン69で処理した。サイズ<250、>650ヌクレオチド、または期待誤差>3のアセンブリは除外された。残ったリードは、塩基組成が歪んだ領域の解析を防ぐため、両端を5ヌクレオチドずつ切り詰めた。キメラの存在はUCHIMEでテストした。70 オペレーショナル分類単位(OTU)は97%の配列同一性でクラスタリングし、少なくとも1つのサンプルで相対存在量≧0.5%のものだけを保持した。分類学は、RDP分類器65とSINA(v1.2.11)の両方の結果を考慮し、信頼度80%で割り当てた。72 PERMANOVA検定(vegan::adonis)は、サンプルグループの分離が全体およびペアとして有意であるかどうかを判断するために、それぞれのケースで実行される。カウントは、標準では、単純にサンプルサイズに割り、次に小さいサンプルのサイズを乗じることで正規化し、ランダムな分散の導入やデータの損失を回避している。β-多様性は、一般化されたUniFrac距離に基づいて計算された73。α-多様性は、Rheaで詳しく説明されているように、種の豊かさとシャノン有効多様性74に基づいて評価された。P値はBenjamini-Hochberg法に従って多重比較のために補正された。あるグループにおける有病率≧30%(与えられた分類群に対して陽性となるサンプルの割合)の分類群のみを統計的検定に考慮した。
トランスクリプトーム、プロテオーム、ICP解析のためのサンプルの調製
C. difficile 630株をCDMMでエクスポネンシャル期半ばまで培養し、亜致死濃度の4.6875 ng/mL ChB1-Epo2または同量のDMSOでストレスをかけた。トランスクリプトーム解析のために、培養物をさらに30分間成長させ、遠心分離によって収穫した。得られた細胞ペレットをTRIS-EDTA(TE)バッファー(Roth, Karlsruhe, Germany)で1回洗浄し、RNAlater™ Stabilization Solution(ThermoFisher Scientific, Waltham, Massachusetts, USA)に懸濁し、4℃に保温した。プロテオーム解析のために、培養物を抗生物質の存在下で90分間培養し、遠心分離により収穫した。細胞ペレットはTEバッファーで1回洗浄し、そのまま-70℃で保存した。メタローム解析用のサンプルは、プロテオミクスサンプルと同様に調製したが、洗浄と細胞破砕にはEDTAフリーのTRISバッファーを適用した。
C. difficileからのRNA単離
RNeasy Kit(QIAGEN GmbH, Hilden, Germany)を用いて、C. difficile培養物15 mLから、製造者の指示に従い、RNAを抽出・精製した。簡単に言うと、細菌ペレットを200μLのPBS(メーカー)で洗浄した。ペレットを、3mg/mLリゾチームを含む200μL TEバッファーに溶解し、RTで15分間インキュベートした。さらなる細胞溶解のために、700μLのRTLバッファーと50mgの0,1mmジルコニアビーズを加え、懸濁液を45秒間3回ボルテックスさせた。溶解液を11,000gで2分間遠心分離し、450μLのエタノールを添加した。10,000gで15秒間遠心分離してRNAをカラムに結合させ、350μLのRW1バッファーを加えてシリカ膜を脱塩し、続いて10,000gで15秒間遠心分離した。10μL DNase Iと70μLバッファRDD(ともにQiagen)を含む80μLの反応混合物をカラムのシリカ膜上に適用して15分間 RTでインキュベートした。メンブレンを350μLのRW1バッファーで洗浄し(10,000gで15秒)、再びDNase I反応混合物で15分間インキュベートした。その後、メンブレンを350μLのバッファRW1(10,000gで15秒)、500μLのバッファRPE(10,000gで15秒、11,000gで2分)で連続的に洗浄した。最後に、RNAを30μLのRNAseフリーH2Oで溶出した。RNAの品質は、2100 Bioanalyser(Agilent, Waldbronn, Germany)を用いて評価した。
トランスクリプトーム解析
単離したRNAを用いた全トランスクリプトームRNAライブラリー調製は、以下のように実施した。簡単に説明すると、Ribominus Transcriptome isolation Kit(Invitrogen/ Thermo Fisher Scientific)を用いてリボソームRNAを枯渇させ、キットNEBNext Ultra II RNA Library Prep(New England Biolabs, Ipswich, Massachusetts, USA)を用いてライブラリを構築した。ライブラリーを希釈し、MiSeq Reagent Kit v2(50サイクル)を用いてMiSeqシーケンサー(Illumina, Munich, Germany)でシーケンスし、50 bpシングルエンドリードを得た。イルミナのFASTQファイルは、Galaxyに実装されたBowtie for Illuminaを使用してC. difficileの参照ゲノム(NC_009089)にマッピングした。75 Galaxyも使用して、各遺伝子にマッピングしたリードの数を可視化および計算した。各ライブラリーの遺伝子数を比較対象の最小のライブラリーに正規化し、RPKM(100万マッピングリードあたりのキロベースあたりのリード数)値を算出した。異なる条件間のFold changeを計算した。統計解析は、すべての実験について説明したように行った。P値≦0.05は本文中に記載したとおりとした。
タンパク質の抽出
タンパク質は、前述したように、細胞ペレットから抽出した76。簡単に説明すると、細胞ペレットを1mLのTEバッファに懸濁し、FastPrep-24TM 5G homogenizer(MP Biomedicals, Santa Ana, California, USA)で500μLのガラスビーズ(0.1~0.11 mm, Satorius Stedim Biotech, Göttingen, Germany)により、3サイクル、30秒、 6.5 m/秒で機械的に破壊して溶解した。ガラスビーズと細胞残骸は20000×g、4℃で3段階の遠心を行い、除去した。得られたタンパク質抽出物は、-70℃で保存した。タンパク質濃度は、Roti®-Nanoquant (Roth, Karlsruhe, Germany) を用いて、製造者の指示に従って測定した。
プロテオーム解析のためのLC-MS/MSサンプル調製
それぞれのタンパク質サンプル50μgを、製造者の指示に従ってS-trap™マイクロカラム(ProtiFi, Huntington, New York, USA)で消化した。簡単に説明すると、タンパク質サンプルを最終濃度5% SDSに調整した後、10 mM ジチオスレイトール (Sigma Aldrich, St. Louis, USA) でタンパク質を還元し、20 mM ヨードアセトアミドでタンパク質をアルキル化した。S-trap™マイクロカラムにロードする前に、サンプルをリン酸(Roth, Karlsruhe, Germany)で酸性化し、100 mMトリエチルアミン重炭酸塩(TEAB)と90%メタノールで1:7の割合で希釈した。タンパク質を捕捉したカラムを100mMのTEAB、90%メタノールで4回洗浄した。その後、トリプシン(Promega, Madison, USA)を酵素対タンパク質比1:50で加え、47℃で3時間消化した。消化ペプチドの溶出は、溶出バッファ1〜3(①50mM TEAB, ②0.1% 酢酸、③60%アセトニトリル, 0.1% 酢酸)をカラムに加え、ペプチドは遠心分離により溶出をした。溶出したペプチドは、真空遠心分離で乾燥させた。ペプチドの精製と分画のために、消化ペプチドを0.1トリフルオロ酢酸(TFA, Sigma Aldrich, St.Louis, USA)300μLに懸濁し、以前に行ったようにセルフパックC18カラム(Reprosil Gold 300 C18, 5μm; Dr.Maisch HPLC GmbH, Ammerbruch-Entringen, Germany)にロードした77。C18カラムをMS純水で1回洗浄し、0.1 %トリメチルアミン(Carl Roth GmbH, Karlsruhe, Germany)中のアセトニトリルの濃度を上げてペプチドを溶出し、8つのフラクションを得た。in vitroサンプルのLC-MS/MS測定では、各個別サンプルのフラクション1と5、2と6、3と7、4と8がプールされました。最後に、アセトニトリルを真空遠心分離で除去し、サンプルをLC-MS/MS分析の前に直接0.1%酢酸に懸濁しました。
プロテオーム解析のためのLC-MS/MS分析
LC-MS/MS分析のために、Q Exactive™ HF Hybrid Quadrupole-Orbitrap™質量分析計(Thermo Fisher Scientific, Waltham, Massachusetts, USA)に直接結合したEASY nLC 1200を用いて液体クロマトグラフィーによりペプチドを分離した。ペプチドは、C18逆相材料(3 μm, Dr. Maisch HPLC GmbH, Ammerbruch-Entringen, Germany)を含むエミッター内蔵のセルフパック分析カラム(100 μm × 20 cm)にロードし、300 nL/minの一定流速で5~50%のアセトニトリル、0.1%酢酸の85分間グラジエントを使用して溶出しました。フルサーベイスキャンは、333 - 1650 m/zの範囲で60,000の分解能で実施した。MS/MSスキャンは、未割り当ての電荷状態および単一荷電イオンを除き、スキャンサイクルごとに最も豊富な15個のプリカーサーイオンについて実行し、動的排除を30秒間有効にしました。
プロテオームデータのLC-MS/MSデータ解析
データベース検索とラベルフリー定量化(LFQ)は、MaxQuantプロテオミクスソフトウェアパッケージ(バージョン:2.0.1.0)を用いて行った78。データは、NCBI, August 2021から得たC. difficile strain 630のタンパク質配列データベース(NC_009089;3560エントリ)と検索した。一般的な汚染物質と逆配列は、MaxQuantソフトウェアによって追加された。タンパク質の同定には、最大2回のミス切断を想定し、メチオニンの酸化を可変修飾、システインのカルバミドメチル化を固定修飾とし、必要最小限のユニークペプチドの数を1つとした。ユニークペプチドとレイザーペプチドは、ラベルフリータンパク質定量のために、最小限の比率カウントを2として考慮されました。各条件のサンプルにおいて、"Match between runs "オプションを有効にした。C. difficileタンパク質は、3つの生物学的複製のうち少なくとも2つでユニークペプチドが確認された場合に解析に含めました。タンパク質強度の有意な変化は、Rパッケージ「DEqMS」79を用いた統計解析により特定し、Rパッケージ「pheatmap」84を用いたヒートマップとして可視化した。
ICP-MS分析
細胞内元素濃度を測定するために、20μLの細胞抽出液をSuperose 6 Increase 3.2x300 ゲルろ過カラムで、10mM Tris-HCl, pH 7.4で100μL min-1の流速で等速溶出させ分離しました。溶出液を、スコット型スプレーチャンバーとPFAμ-flowネブライザーを備えたAgilent 7500c ICP-MS装置に直接注入し、100分間にわたっていくつかの元素同位体に対する強度をモニターした。プラズマは1600Wで運転し、他のすべてのパラメータは、チューニング溶液の元素について安定したシグナルを得るために毎日最適化した(10ppbの: 6Li - ∼8.0e4 cps, 89Y - ∼1.3e5 cps, 140Ce - ∼1.3e5 cps, 205Tl - ∼9.6e4 cps)、およびゲルろ過カラムからの溶離液注入時の13C、23Na、39Kのバックグラウンド信号が安定に得られるように、毎日プラズマを1600 Wで運転し、その他のパラメーターを最適化した。
得られた各同位体のクロマトグラムは、Rスクリプトを用いて、装置メーカーが提供する自然同位体存在量と、平滑化した13Cベースラインによる感度ドリフトを補正しました。ChB1-Epo2処理サンプルとコントロールサンプルの比較を可能にするため、各サンプルについてブラッドフォードアッセイ(外部キャリブレーションとしてBSA)によりタンパク質含有量を測定し、注入したタンパク質量に応じてクロマトグラムをスケーリングした。ベースラインを超えるピーク面積をFityk 1.3.185で各同位体ごとに積分し、まとめたピーク面積として総元素量を算出した。統計的検定と可視化は、Rパッケージ "rstatix "と "ggplot2 "を用いて行った86,87。
定量化・統計解析
統計解析は、GraphPad Prismバージョン9.4.0、R studioソフトウェアバージョン2022.07.01、またはMicrosoft excel 2016のいずれかを使用して実施した。エラーバーと統計検定は各図の下に示し、p値<0.05は有意とみなし、異なる有意水準に分類した:✱p<0.05,✱p<0.01,✱p<0.001,✱✱p<0.0001
謝辞
HZIとFLIの動物施設のスタッフに感謝する。Ina Schleicher、Vera Junker、Gesa Martens、Anika Wasnerの技術協力に謝意を表します。TUM Core Facility Microbiome for NGSのKlaus NeuhausとCaroline Zieglerに感謝する。C. difficile strain IB136を提供してくださったWiep Klaas Smits、fidaxomicinを提供してくださったKarl Gademannに感謝します。子豚の糞の抽出を手伝ってくれたAnastasia Andreas、原稿を読んでくれたFranziska FaberとCaroline Taoukに感謝します。本研究は、BMBF(ドイツ連邦教育研究省)のInfectControl 2020枠によるKRとTMFへの助成金(FKZ 03ZZ0823A/B)、ドイツのExcellence Strategy-EXC 2155 "RESIST"-project ID 390874280によるドイツ連邦研究所の助成金によって支援されている。化合物の改良と評価は、クロロクリナリアプロジェクト(16GW0204K)において、BMBFからR.M.への助成金によって支援されました。図の一部はBioRender.comと "Inkscape "を使用して作成した。
著者による寄稿
A.B.、M.B.、S.W.は実験の設計、実施、分析、原稿執筆、W.H.はChB1-Epo2の合成、実験の実施と分析、M.M.、F.D、M.N.-S、L.-S.P., J.B., A.M.K.,、 およびD.Z.が実験の実施と解析を行った。T.R.L.が実験の解析とバイオインフォマティクス解析をサポートした。 S.S.はChAの生産を調整し、R.J.はChAの分離と分析を最適化し、S.S.は実験の設計と分析を行い、K.R.とR.M.は研究をデザインし、J.H.は研究のデザインと調整を行い、T.M.FとT.Sは研究のデザインと調整、データ分析と原稿執筆をした。
利害関係の宣言
S.B.、R.J.、J.H.、R.M.は、クロロトニルの抗菌剤としての使用特許(WO/2019/092030)の発明者として記載されています。このことは、本試験のデザインおよび結果の解釈に支障をきたすものではありません。
インクルージョンと多様性
私たちは、包括的で多様な、そして公平な研究実施を支援します。
補足情報
すべての補足ファイルをダウンロードする
これは何でしょう?
ダウンロード アクロバットPDFファイル(861KB)ダウンロード
資料S1. 図S1〜S6
ダウンロード 表計算ソフトのダウンロード (97KB)
表S1. 図2に関連する、トランスクリプトームデータ。
ダウンロード スプレッドシートのダウンロード (148KB)
表S2. プロテオームデータ、図2に関連する。
ダウンロード スプレッドシートのダウンロード(1MB)
表S3. 図4に関連する、ネズミの糞便・腸内細菌叢解析のASV表。
ダウンロード: スプレッドシートのダウンロード (23KB)
表S4. 図5に関連する子豚の微生物叢解析、家族構成。
ダウンロード: スプレッドシートダウンロード (593KB)
表S5. 図5に関連する、子豚の微生物叢解析のOTU表。
ダウンロード アクロバットPDFファイル(5MB)ダウンロード
ドキュメントS2。記事+補足情報
おすすめ記事
データおよびコードの利用可能性
マウスの16S rRNA遺伝子配列データは、NCBI(Bioproject Database)にアクセッション番号で寄託されています: PRJNA809685。子豚の16S rRNA遺伝子シーケンスデータは、Sequence read archive (SRA)にBioProject accession number PRJNA800240で寄託されています。in vitro実験のRNAシーケンスデータは、Sequence read archive (SRA)のBioProjectアクセッション番号PRJNA949940で入手できます。質量分析プロテオミクスデータは、PXD029243のデータセット識別子でPRIDEパートナーリポジトリを通じてProteomeXchange Consortiumに寄託されています。
本論文はオリジナルコードを報告するものではありません。
本作品で報告されたデータの再分析に必要な追加情報は、要求に応じてリードコンタクトから入手できます。
参考文献
1
D.R.ナイト、T.V.ライリー
Clostridium difficileの人獣共通感染症起源に関するゲノム解析
Front. Public Heal., 7 (2019), Article 164, 10.3389/fpubh.2019.00164
ScopusGoogle Scholarで見る
2
E. バルセルズ、T. シー、C. リース、I. ライエル、J. バローズ、C. ウィーフ、H. キャンベル、M. H. キョウ、H. ナイア
クロストリジウム・ディフィシル感染症の世界的な負担: システマティックレビューとメタアナリシス
J. Glob. Health, 9 (2019), Article 010407, 10.7189/jogh.09.010407
ScopusGoogle Scholarで見る
3
E. フィン、F.L.アンダーソン、M.マディン=ウォーバートン
Clostridioides difficile感染症(CDI)の負担-原発性および再発性CDIの疫学に関するシステマティック・レビュー
BMC Infect. Dis., 21 (2021), Article 456, 10.1186/s12879-021-06147-y
ScopusGoogle Scholarで見る
4
M. ショレ、M.クルトワ、M.フォロウゼシュ、S.ミロノフ、N.サデギファード、L.モライプール、A.マレキ、E.コウサリ
ヒト由来のクロストリジウム(Clostridioides)ディフィシルにおける抗菌薬耐性:システマティックレビューとメタアナリシス
Antimicrob. Resist. Infect. コントロール, 9 (2020), Article 158, 10.1186/s13756-020-00815-5
ScopusGoogle Scholarで見る
5
C.H. van Werkhoven, A. Ducher, M. Berkell, M. Mysara, C. Lammens, J. Torre-Cisneros, J. Rodríguez-Baño, D. Herghea, O.A. Cornely, L.M. Biehl, et al.
広域抗生物質投与中の入院患者におけるClostridioides difficile感染症の発生率と予測バイオマーカー
Nat. Commun., 12 (2021), Article 2240, 10.1038/s41467-021-22269-y
ScopusGoogle Scholarで見る
6
C.M.セリオット、M.J.ケーニヒスクネヒト、P.E.カールソン、G.E.ハットン、A.M.ネルソン、B. Li、G.B. Huffnagle、 J.Z. Z Li、 V.B.Young
抗生物質によるマウス腸内細菌叢とメタボロームのシフトがClostridium difficile感染症への感受性を高める
Nat. Commun.、5(2014)、記事3114、10.1038/ncomms4114
ScopusGoogle Scholarで見る
7
R.A.ブリトン、V.B.ヤング
Clostridium difficileによるコロニー形成に対する抵抗性における腸内細菌叢の役割について
消化器病学, 146 (2014), pp.1547-1553, 10.1053/j.gastro.2014.01.059
PDFを見る記事を見るScopusGoogle Scholarで見る
8
L. Martinez-Gili, J.A.K. McDonald, Z. Liu, D. Kao, J.R. Allegretti, T.M. Monaghan, G.F. Barker, J. Miguéns Blanco, H.R.T. Williams, E. Holmes, et al.
再発性Clostridioides difficile感染症の治療における糞便微生物移植の有効性のメカニズムの解明とその後:腸内細菌由来の代謝物の寄与について
腸内細菌, 12 (2020), 記事 1810531, 10.1080/19490976.2020.1810531
ScopusGoogle Scholarで見る
9
N.A. Lesniak, A.M. Schubert, H. Sinani, P.D. Schloss
Clostridioides difficileのコロニー形成の解消は抗生物質特異的な細菌変化と関連する
mSphere, 6 (2021), 10.1128/mSphere.01238-20
e01238-e01220
Google Scholar
10
O.A.コーネリー、M.A.ミラー、T.J.ルイ、D.W.クルック、S.L.ゴーバッハ
クロストリジウム・ディフィシル感染症の初回再発の治療:フィダキソマイシン対バンコマイシンの比較
Clin. Infect. Dis., 55 (2012), pp. S154-S161, 10.1093/cid/cis462
ScopusGoogle Scholarで見る
11
S. アイザック、J.U.シャー、A.ジュコビッチ、N.ヒメネス、D.R.リットマン、S.B.アブラムソン、E.G.パマー、C.ウベダ
経口バンコマイシンのヒト腸内細菌叢に対する短期および長期的影響について
J. Antimicrob. Chemother.、72 (2017), pp.128-136, 10.1093/JAC/DKW383
ScopusGoogle Scholarで見る
12
C.A. Warren、E.J. van Opstal、M.S. Riggins、Y. Li、J.H. Moore、G. L. Kolling、R. L. Guerrant、P. S. Hoffman
バンコマイシン投与による腸管組織損傷の遅延、クロストリジウムの過剰増殖、Clostridium difficile感染症の再発との関連について(マウス)。
Antimicrob. Agents Chemother., 57 (2013), pp.689-696, 10.1128/AAC.00877-12
ScopusGoogle Scholarで見る
13
A.D.リード、C.M.セリオット
常在クロストリジウムによるClostridioides difficileに対するコロニー形成抵抗性への阻害代謝物および栄養素の競合の寄与
微生物, 9 (2021), pp.1-14, 10.3390/microorganisms9020371
Google Scholar
14
A.D.リード、M.A.ネザリー、A.スチュワート、R.バランゴウ、C.M.セリオット
胆汁酸誘導性(bai)オペロンを持つ常在クロストリジウムによるClostridioides difficileの菌株依存的な抑制
J. Bacteriol., 202 (2020), 10.1128/JB.00039-20
e00039-e00020
Google Scholar
15
C.G. Buffie, V. Bucci, R.R. Stein, P.T. McKenney, L. Ling, A. Gobourne, H. Liu, M. Kinnebrew, A. Viale, et al.
精密なマイクロバイオーム再構成により、胆汁酸を介したClostridium difficileに対する耐性が回復した。
Nature, 517 (2015), pp. 205-208, 10.1038/nature13828
ScopusGoogle Scholarで見る
16
E.J. Battaglioli, V.L. Hale, J. Chen, P. Jeraldo, C. Ruiz-Mojica, B.A. Schmidt, V.M. Rekdal, L.M. Till, L. Huq, S.A. Smits, and al.
Clostridioides difficileは、下痢患者のサブセットで腸内細菌異常と関連するアミノ酸を使用する
Sci. Transl. Med., 10 (2018), pp.139-148, 10.1126/scitranslmed.aam7019
Google Scholar
17
B.P. Girinathan, N. DiBenedetto, J.N. Worley, J. Peltier, M.L. Arrieta-Ortiz, S.R.C. Immanuel, R. Lavin, M.L. Delaney, C.K. Cummins, M. Hoffman, et al.
クロストリジョイデス ディフィシルの病原性を生体内でコントロールする
Cell Host Microbe, 29 (2021), pp.1693-1708.e7, 10.1016/J.CHOM.2021.09.007
PDFを見る記事を見るScopusGoogle Scholarで見る
18
C. ジャノワール、C.ドゥネーブ、S.ブーティエ、F.バルブット、S.ホイズ、L.カリーチャム、D.シャペトン-モンテス、F.C. ペレイラ、A.O. アンリケス、A. コリーノン、他。
In vivoトランスクリプトミクスから見たClostridium difficileの適応戦略と病原性
Infect. Immun., 81 (2013), pp.3757-3769, 10.1128/IAI.00515-13
ScopusGoogle Scholarで見る
19
J・R・フレッチャー、C・M・パイク、R・J・パーソンズ、A・J・リベラ、M・H・フォーリー、M・R・マクラーレン、S・A・モンゴメリ、C・M・セリオット
Clostridioides difficileは毒素を介した炎症を利用して宿主の栄養状態を変化させ、腸内細菌叢から競合を排除する。
Nat. Commun., 12 (2021), Article 462, 10.1038/s41467-020-20746-4.
ScopusGoogle Scholarで見る
20
I. ポッケ、L. ソージェ、A. カネット、M. モノ、J. ミハイロビッチ、J.M. ギゴ、O. ソウトゥリーナ、R. ブリアンデ、I. マルタン=ヴァースラテ、 B. デュピイ
Clostridium difficileバイオフィルム:代謝と細胞表面をリモデリングして疎な異質な凝集構造を構築する
Front. Microbiol., 9 (2018), Article 2084, 10.3389/fmicb.2018.02084
ScopusGoogle Scholarで見る
21
A. チャール、P.フォイエルシュタット
Clostridioides difficile感染症に対する抗菌薬管理に関する臨床ガイドラインの変遷
Ther. Adv. Gastroenterol., 14 (2021), Article 17562848211011953, 10.1177/17562848211011953
Google Scholar
22
T.J. Louie, M.A. Miller, K.M. Mullane, K. Weiss, A. Lentnek, Y. Golan, S. Gorbach, P. Sears, Y.K. Shue, OPT-80-003 クリニカルスタディグループ
クロストリジウム・ディフィシル感染症に対するFidaxomicinとvancomycinの比較試験
N. Engl. J. Med., 364 (2011), pp. 422-431, 10.1056/NEJMoa0910812
ScopusGoogle Scholarで見る
23
J. シュヴァンベック、T.リーデル、F.ラウキエン、I.ショーバー、I.オーエミッグ、O.ジマーマン、J.オーバーマン、U.グロース、A.E. ザウトナー、W.ボーン
fidaxomicin感受性が著しく低下し、rpoBにV1143D変異を有するClostridioides difficile臨床分離株の特性評価
J. Antimicrob. Chemother.、74 (2019), pp.6-10, 10.1093/jac/dky375
ScopusGoogle Scholarで見る
24
A.D.ラッセル
細菌芽胞と化学的殺胞子剤
Clin. Microbiol. Rev., 3 (1990), pp. 99-119, 10.1128/CMR.3.2.99
ScopusGoogleスカラーで見る
25
D. パレデス・サブジャ、A.シェン、J.A.ソルグ
クロストリジウム・ディフィシルの胞子生物学:胞子形成、発芽、胞子構造タンパク質
Trends Microbiol., 22 (2014), pp.406-416, 10.1016/j.tim.2014.04.003
PDFを見る記事を見るScopusGoogle Scholarで見る
26
M. バロー、J.A.ソルグ
Clostridioides difficileの胞子発芽:イニシエーションからDPA放出まで
Curr. Opin. 微生物学, 65 (2022), pp.101-107, 10.1016/j.mib.2021.11.001
PDFを見る記事を見るScopusGoogle Scholarで見る
27
M. Miethke, M. Pieroni, T. Weber, M. Brönstrup, P. Hammann, L. Halby, P.B. Arimondo, P. Glaser, B. Aigle, H.B. Bode, et al.
新規抗生物質の持続的な発見と開発に向けて
Nat. Rev. Chem., 5 (2021), pp. 726-749, 10.1038/s41570-021-00313-1
ScopusGoogle Scholarで見る
28
K. Gerth、H. Steinmetz、G. Höfle、R. Jansen
Sorangium cellulosum由来のユニークなジェムジクロロ-1,3-ジオン機能を持つマクロライド「Chlorotonil A」、So CE1525
Angew. Chem. Int. Ed. Engl.、47 (2008), pp.600-602, 10.1002/anie.200703993
ScopusGoogle Scholarで見る
29
K. Jungmann、R. Jansen、K. Gerth、V. Huch、D. Krug、W. Fenical、R. Müller
クロロトニルとアントラサイクマイシンの生合成経路について
ACS Chem. Biol.、10(2015)、2480-2490頁、10.1021/ACSCHEMBIO.5B00523
ScopusGoogle Scholarで見る
30
J. ヘルド、T. ゲブル、M. カレッセ、R. ヤンセン、K. ゲルト、R. ミュラー、B. モルドミュラー
ミクソバクテリア系マクロライド「クロロトニルA」の抗マラリア活性
Antimicrob. Agents Chemother., 58 (2014), pp.6378-6384, 10.1128/AAC.03326-14
ScopusGoogle Scholarで見る
31
W. Hofer, E. Oueis, A.A. Fayad, F. Deschner, A. Andreas, L.P. de Carvalho, S. Hüttel, S. Bernecker, L. Pätzold, B. Morgenstern, et al.
抗菌・抗プラズマ剤クロトニルの位置・立体選択的エポキシ化および酸性エポキシド開環により高活性な誘導体が得られた。
Angew. Chem. Int. Ed. Engl., 61 (2022), Article e202202816, 10.1002/anie.202202816
ScopusGoogle Scholarで見る
32
C. ロズポーン、R.ナイト
UniFrac:微生物群集を比較するための新しい系統分類法
Appl. Environ. Microbiol., 71 (2005), pp.8228-8235, 10.1128/AEM.71.12.8228-8235.2005
ScopusGoogle Scholarで見る
33
L. シャオ、J. エステレ、P. キレリッチ、Y. ラマヨカルダス、Z. シャ、Q. フェン、S. リャン、A. Ø. Pedersen、N.J. Kjeldsen、C. Liu、et al.
ブタの腸内細菌叢の参照遺伝子カタログ
Nat. Microbiol., 1 (2016), Article 16161, 10.1038/nmicrobiol.2016.161
ScopusGoogle Scholarで見る
34
M.T.ソルバラ、E.G.パマー
コロニー形成抵抗性の細菌間メカニズムとそれを克服するための病原体の戦略
Mucosal Immunol., 12 (2019), pp.1-9, 10.1038/s41385-018-0053-0
PDFを見る記事を見るGoogle Scholar
35
A.L.グレゴリー、D.A.ペンシンガー、A.J.フリッコウイアン
短鎖脂肪酸を中心としたClostridioides difficileの病原体形成に関する考察
PLoS Pathog., 17 (2021), Article e1009959, 10.1371/journal.ppat.1009959
ScopusGoogle Scholarで見る
36
A.M. Aguirre、N. Yalcinkaya、Q. Wu、A. Swennes、M.E. Tessier、P. Roberts、F. Miyajima、T. Savidge、 J. A. Sorg
胆汁酸非依存的なClostridioides difficile感染症に対する保護作用
PLoS Pathog., 17 (2021), Article e1010015, 10.1371/journal.ppat.1010015
ScopusGoogle Scholarで見る
37
L. ブイヨー、W.T.セルフ、A.L.ソネンシェン
プロリン依存的なClostridium difficile sticklandの代謝制御について
J. Bacteriol., 195 (2013), pp.844-854, 10.1128/JB.01492-12
ScopusGoogle Scholarで見る
38
A.D. Reed, J.R. Fletcher, Y.Y. Huang, R. Thanissery, A.J. Rivera, R.J. Parsons, A.K. Stewart, D.J. Kountz, A. Shen, E.P. Balskus, et al.
Stickland反応前駆体trans -4-hydroxy- l -prolineがClostridioides difficileおよびCommensal Clostridiaの代謝に異なる影響を与える。
mSphere, 7 (2022), Article e0092621, 10.1128/msphere.00926-21
ScopusGoogle Scholarで見る
39
L.T. Erikstrup, M. Aarup, R. Hagemann-Madsen, F. Dagnaes-Hansen, B. Kristensen, K.E.P. Olsen, K. Fuursted
マウスにおけるClostridium difficile感染症のバンコマイシン単独による治療は、バンコマイシンとメトロニダゾールの併用による治療と同程度の有効性を示す
BMJ Open Gastroenterol., 2 (2015), Article e000038, 10.1136/BMJGAST-2015-000038
ScopusGoogle Scholarで見る
40
C.H. チルトン、G.S. クラウザー、H. アシュウィン、C.M. ロングショー、M.H. ウィルコックス
FidaxomicinとC. difficile芽胞との結合:その後の芽胞の回復、成長および毒素産生に対する持続性の影響
PLoS One, 11 (2016), Article e0161200, 10.1371/journal.pone.0161200
ScopusGoogle Scholarで見る
41
C.H. チルトン、H. アシュウィン、G.S. クラウザー
P0799 C. difficile芽胞からのfidaxomicinの持続性・除去性、回復への影響
欧州臨床微生物学・感染症会議(ECCMID)(2014)、1-2頁。
CrossRefView in ScopusGoogle Scholar
42
T.J. Kochan, M.J. Somers, A.M. Kaiser, M.S. Shoshiev, A.K. Hagan, J.L. Hastie, N.P. Giordano, A.D. Smith, A.M. Schubert, P.E. Carlson, et al.
腸内カルシウムと胆汁酸塩がClostridium difficile芽胞の発芽を促進する。
PLoS Pathog., 13 (2017), Article e1006443, 10.1371/journal.ppat.1006443
ScopusGoogle Scholarで見る
43
M.B.フランシス、C.A.アレン、J.A.ソルグ
Clostridium difficile胞子発芽時の胞子皮質加水分解はジピコリン酸の放出に先行する
J. Bacteriol., 197 (2015), pp. 2276-2283, 10.1128/JB.02575-14
ScopusGoogle Scholarで見る
44
N. ダルバムーラ、A.アブデルハディ、M.ドマディア、S.パテル、J.ゴーガン、S.ロイ
Clostridium difficile感染症の再発に関連する危険因子について
J. Clin. Med. Res., 11 (2019), pp.1-6, 10.14740/jocmr3531w
ScopusGoogle Scholarで見る
45
B.H.マリシュ、H.R.T.ウィリアムズ
Clostridium diffi cile感染症と抗生物質関連下痢症
クリンです。Med. (Lond), 18 (2018), pp. 237-241, 10.7861/clinmedicine.18-3-237
ScopusGoogle Scholarで見る
46
R.J.ホプキンス、R.B.ウィルソン
再発性Clostridium difficile大腸炎に対する治療:ナラティブレビュー
ガストロエンテロール Rep., 6 (2018), pp.21-28, 10.1093/gastro/gox041
ScopusGoogle Scholarで見る
47
L. ヤコブ、T.V.ライリー、D.L.パターソン、J.マーケス、R.J.S.マガリャエス、古屋金森、A.C.A. クレメンツ
Hypervirulent Clostridium difficileリボタイプ027の流行株への置き換えのメカニズム:疫学的モデル
Sci. Rep.、5(2015)、記事12666、10.1038/srep12666
ScopusGoogle Scholarで見る
48
S. パテル、C.V.プレウス、F.ベルニス
バンコマイシン - StatPearls - NCBI bookshelf. StatPearls
(2022)
https://www.ncbi.nlm.nih.gov/books/NBK459263/
Google Scholar
49
L. Maier, C.V. Goemans, J. Wirbel, M. Kuhn, C. Eberl, M. Pruteanu, P. Müller, S. Garcia-Santamarina, E. Cacace, B. Zhang, et al.
抗生物質が腸内細菌に与える副作用を解明する
Nature, 599 (2021), pp. 120-124, 10.1038/s41586-021-03986-2
ScopusGoogle Scholarで見る
50
C.A.ロペス、W.N.ビーバーズ、A.ワイス、R.J.クニペル、J.P.ザックラー、W.チャズン、E.P.スカール
免疫タンパク質カルプロテクチンは亜鉛の制限を通じてClostridioides difficileの代謝に影響を与える
mBio, 10 (2019), pp.1-19
CrossRefGoogle Scholar
51
M. ノイマン-シャール、J.D.ホフマン、S.E.ウィル、D.ションバーグ
Clostridium difficile 630Δermの時間分解アミノ酸取り込みとそれに伴う発酵産物および毒素の生成について
BMC Microbiol., 15 (2015), p.281, 10.1186/s12866-015-0614-2
ScopusGoogle Scholarで見る
52
A.N. Edwards、J.M. Suárez、S.M. McBride
Clostridium difficileの嫌気性環境での培養と維持管理
J. Vis. Exp., 79 (2013), Article e50787, 10.3791/50787
ScopusGoogle Scholarで見る
53
C.M.セリオット、A.A.ボウマン、B.ヤング
抗生物質による大腸菌Difficile Sporeの発芽と伸長の変化について
mSphere, 1 (2016), pp.1-16, 10.1128/mSphere.00045-15.Editor
ScopusGoogle Scholarで見る
54
W.J. Su, M.J. Waechter, P. Bourlioux, M. Dolegeal, J. Fourniat, G. Mahuzier
Gnotobiotic マウスにおけるClostridium difficileのコロニー形成抵抗性における揮発性脂肪酸の役割
Infect. Immun., 55 (1987), pp.1686-1691, 10.1128/iai.55.7.1686-1691.1987
ScopusGoogle Scholarで見る
55
J.G.カポラソ、C.L.ラウバー、W.A.ウォルターズ、D.バーグライオン、C.A.ロズポーン、P.J.ターンボー、N.フィーアラー、R.ナイト
サンプルあたり数百万配列の深さで16S rRNAの多様性をグローバルにパターン化する。
Proc. Natl. Acad. Sci. USA, 108 (2011), pp.4516-4522, 10.1073/pnas.1000080107
ScopusGoogle Scholarで見る
56
M.N.プライス、P.S.デハル、A.P.アーキン
FastTree 2--大規模アラインメントのための近似的な最尤ツリー
PLoS One, 5 (2010), Article e9490, 10.1371/journal.pone.0009490
ScopusGoogle Scholarで見る
57
Q. ワン、G.M.ガリティ、J.M.ティエディエ、J.R.コール
ナイーブベイズ分類法によるrRNA配列の新細菌分類法への迅速な割り当て
Appl. Environ. Microbiol., 73 (2007), pp.5261-5267, 10.1128/AEM.00062-07
グーグルシュラー
58
R.C.エドガー
検索とクラスタリングはBLASTより桁違いに高速です。
バイオインフォマティクス, 26 (2010), pp.2460-2461, 10.1093/bioinformatics/btq461.
グーグルシュラー
59
P.J. McMurdie、S. Holmes
phyloseq: マイクロバイオームセンサスデータの再現性の高いインタラクティブな解析とグラフィックスのためのRパッケージ
PLoS One, 8 (2013), Article e61217, 10.1371/journal.pone.0061217
ScopusGoogle Scholarで見る
60
J.D.ホフマン、A.オットー、M.ベルゲス、R.ビーデンディエック、A.M.ミシェル、D.ベッチャー、D.ヤーン、M.ニューマン-シャール
毒素産生誘導を伴う定常期におけるClostridioides difficileの代謝リプログラミング
Front. Microbiol., 9 (2018), Article 1970, 10.3389/fmicb.2018.01970
ScopusGoogle Scholarで見る
61
S.E. Will, P. Henke, C. Boedeker, S. Huang, H. Brinkmann, M. Rohde, M. Jarek, T. Friedl, S. Seufert, M. Schumacher, et al.
昼と夜:6つの軸性非海洋性シアノバクテリアの代謝プロファイルと進化的関係
ゲノム・バイオル. Evol., 11 (2019), pp. 270-294, 10.1093/gbe/evy275
ScopusGoogle Scholarで見る
62
C. フー、N.D.ベイダ、K.W.ガレー
腸内細菌叢研究で使用されるバンコマイシンHPLCアッセイ
Microbiol. Spectr., 10 (2022), Article e0168821, 10.1128/spectrum.01688-21
ScopusGoogle Scholarで見る
63
J.G. Caporaso, J. Kuczynski, J. Stombaugh, K. Bittinger, F.D. Bushman, E.K. Costello, N. Fierer, A.G. Peña, J.K. Goodrich, J.I. Gordon, et al.
対応 QIIMEによるハイスループットなコミュニティシーケンスデータの解析 強度の正規化により、SOLiDシーケンスのカラーコールを改善した。Nat
Publ. Gr., 7 (2010), pp.335-336, 10.1038/nmeth0510-335
グーグルシュラー
64
I. Lagkouvardos, K. Kläring, S.S. Heinzmann, S. Platz, B. Scholz, K.-H. Engel、P. Schmitt-Kopplin、D. Haller、S. Rohn、T. Skurk、et al.
健康な成人男性を対象とした亜麻仁の試験的介入研究における腸内代謝物および細菌群集のネットワーク
Mol. Nutr. Food Res., 59 (2015), pp.1614-1628, 10.1002/mnfr.201500125
ScopusGoogle Scholarで見る
65
I. ラグクーヴァルドス、D・ジョセフ、M・カプファマー、S・ギリトリ、M・ホーン、D・ハラー、T・クラーベル
IMNGS 生態学および多様性研究のための16S rRNA微生物プロファイルを処理した包括的なオープンリソースです。
Sci. Rep.、6 (2016), Article 33721, 10.1038/srep33721
ScopusGoogle Scholarで見る
66
R.C.エドガー、B.J.ハース、J.C.クレメンテ、C.クィンス、R.ナイト
UCHIME、キメラ検出の感度と速度を向上
バイオインフォマティクス, 27 (2011), pp.2194-2200, 10.1093/bioinformatics/btr381
Google Scholar
67
E. プルース、J.ペプリ、F.O.グロクナー
SINA:リボソームRNA遺伝子の正確なハイスループット多重配列アライメント
バイオインフォマティクス, 28 (2012), pp.1823-1829, 10.1093/bioinformatics/bts252
Google Scholar
68
I. ラグクーヴァルドス、S.フィッシャー、N.クマー、T.クラヴェル
Rhea 16S rRNA遺伝子アンプリコンに基づく微生物プロファイリングのための透明でモジュール化されたRパイプライン
PeerJ, 2017 (2017), Article e2836, 10.7717/PEERJ.2836/SUPP-2
ScopusGoogle Scholarで見る
69
J. チェン、ビッティンガー、チャールソン、ホフマン、ルイス、ウー、コルマン、ブッシュマン、リーの各氏
一般化UniFrac距離を用いたマイクロバイオーム組成と環境共変量との関連付け
バイオインフォマティクス, 28 (2012), pp.2106-2113, 10.1093/bioinformatics/bts342
ScopusGoogle Scholarで見る
70
L. ヨスト
多様性を独立したαβ概念に分割する
エコロジー, 88 (2007), pp.2427-2439
CrossRefView in ScopusGoogle Scholar
71
J. ゲックス、A.ネクルーテンコ、J.テイラー、ギャラクシーチーム
Galaxy:生命科学におけるアクセス可能、再現可能、透明な計算機研究を支援するための包括的アプローチ
ゲノムバイオロジー, 11 (2010), Article R86, 10.1186/gb-2010-11-8-r86
ScopusGoogle Scholarで見る
72
A.C.グラフ、A.レナード、M.ショイブレ、L.M.リエックマン、J.ホイヤー、S.マース、M.ラルク、D.ベッチャー、J.パネ・ファレ、K.リーデル
黄色ブドウ球菌のバイオフィルムが産生する病原性因子は、バイオフィルムの完全性に寄与する月光機能を有する
Mol. Cell. プロテオミクス, 18 (2019), pp.1036-1053, 10.1074/mcp.RA118.001120
PDFを見る記事を見るScopusGoogle Scholarで見る
73
P.-A. ミュッケ、S.マース、T.P.コーラー、S.ハマーシュミット、D.ベッハー
ヒト抗菌ペプチドLL-37に対するStreptococcus pneumoniaeのプロテオーム適応について
微生物, 8 (2020), 第413回, 10.3390/microorganisms8030413
ScopusGoogle Scholarで見る
74
S. ティアノヴァ、T.テム、J.コックス
質量分析に基づくショットガンプロテオミクスのためのMaxQuant計算機プラットフォーム
Nat. Protoc., 11 (2016), pp.2301-2319, 10.1038/nprot.2016.136
Google Scholar
75
Y. Zhu、L.M.Orre、Y.Z. Zhou Tran、G. Mermelekas、 H.J. Johansson、A. Malyutina、S. Anders、J. Lehtiö
DEqMS:タンパク質発現差分解析における正確な分散推定を行うための手法
Mol. Cell. プロテオミクス, 19 (2020), pp.1047-1057, 10.1074/mcp.TIR119.001646
PDFを見る記事を見るScopusGoogle Scholarで見る
76
R. コルデ
pheatmap(ヒートマップ): プリティヒートマップ。Rパッケージバージョン1.0.12
(2019)
https://cran.r-project.org/web/packages/pheatmap/index.html
Google Scholar
77
M. ヴォイディル
Fityk: 汎用ピークフィッティングプログラム
J. Appl. Crystallogr., 43 (2010), pp.1126-1128, 10.1107/S0021889810030499
Google Scholar
78
A. カッサンバラ
rstatix: 基本的な統計検定のためのパイプフレンドリーなフレームワーク version 0.7.0
(2021)
https://rdrr.io/github/kassambara/rstatix/
Google Scholar
79
H. ウィッカム
ggplot2. データ解析のためのエレガントなグラフィックス
(第2版),Springer (2016), 10.1007/978-0-387-98141-3
Google Scholar
引用元: (0)
16
これらの著者は同じように貢献した。
17
リードコンタクト
© 2023 The Authors. 発行:エルゼビア・インク
ScienceDirectについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
