
1-3. イオン結晶の構造
こんにちは。おのれーです。またしても絵に手こずってしまい、前回の更新から1週間以上が過ぎてしまいました…。と言い訳をしましたが、まだ始まったばかりなので気を引き締めて頑張ります。
さて、1-1. 化学結合と結晶の種類で確認した通り、「固体」はそれを構成する原子やイオン、分子などの粒子が、粒子間の引力によって、一定の位置に固定されているものだということができます。また、その中でも粒子が規則正しく配列してできたものを「結晶」ということを確認しました。
前回は「金属結晶」について見ていきましたが、今回は「イオン結晶」について考えていきたいと思います。
なお、イオン結晶がどのようにできるかは"化学基礎"で学んでいますので、もう一度確認したい方は下の記事をご覧ください。
では、今回も始めていきたいと思います。
■イオン結合とイオン結晶
イオン結晶では、たくさんの陽イオンと陰イオンが、静電気力によってイオン結合をつくり、規則正しく配列しています。
このとき単位格子は、陽イオンと陰イオンの価数や大きさの違いによって、いろいろな構造をとります。
ここでは、イオン結晶の中でも代表的な、塩化ナトリウム型、塩化セシウム型、硫化亜鉛型、フッ化カルシウム型について見ていきたいと思います。
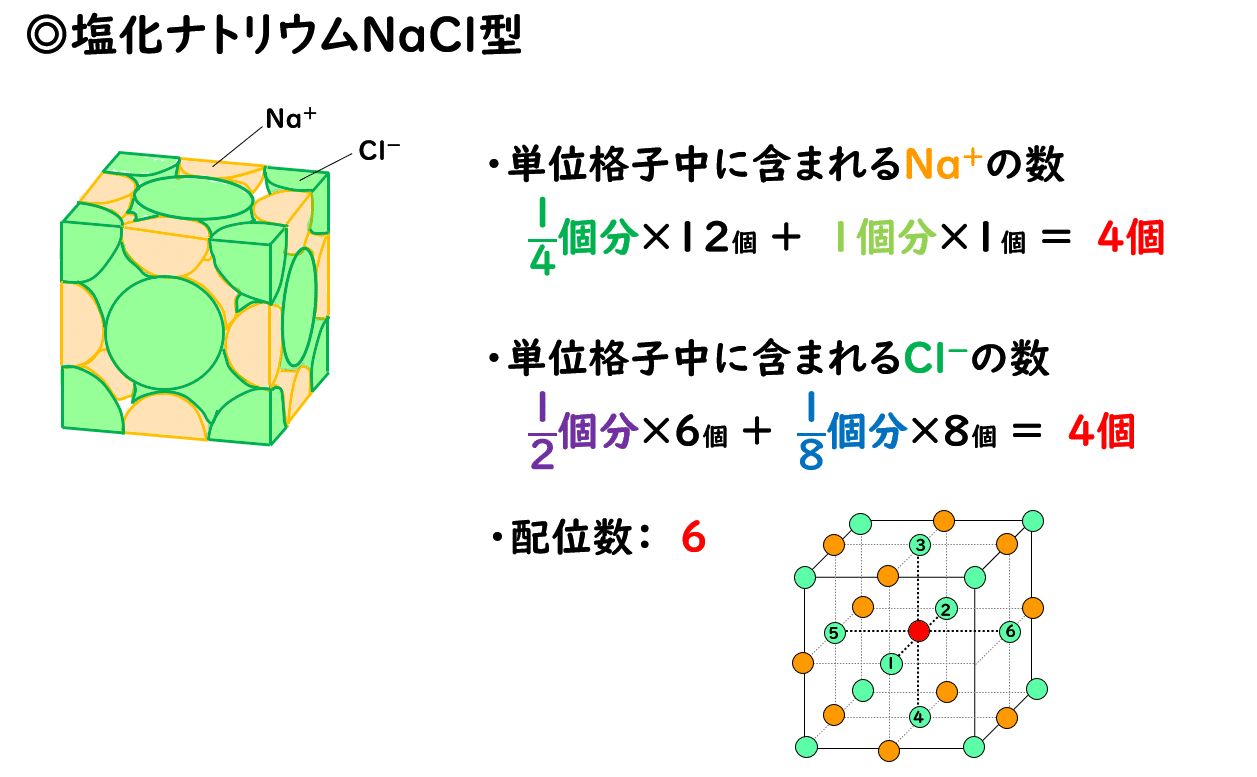
◎塩化ナトリウムNaCl型
塩化ナトリウムNaClのほか、ヨウ化カリウムKI、酸化マグネシウムMgO、塩化銀AgClなどのイオン結晶は、塩化ナトリウム型と呼ばれる構造をとります。
塩化ナトリウム型の単位格子は、陽イオンと陰イオンが1:1の割合で集まってできています。このとき、どちらかのイオンに注目をすると、その構造は金属結晶の面心立方格子と同じです。
したがって、単位格子に含まれるイオンの数は、陽イオン、陰イオン共に、金属結晶の面心立方格子と同じく4個となります。
また単位格子の中央にある1個のイオンに注目すると、そのまわりにある6個のイオンと接しているので、配位数は6です。
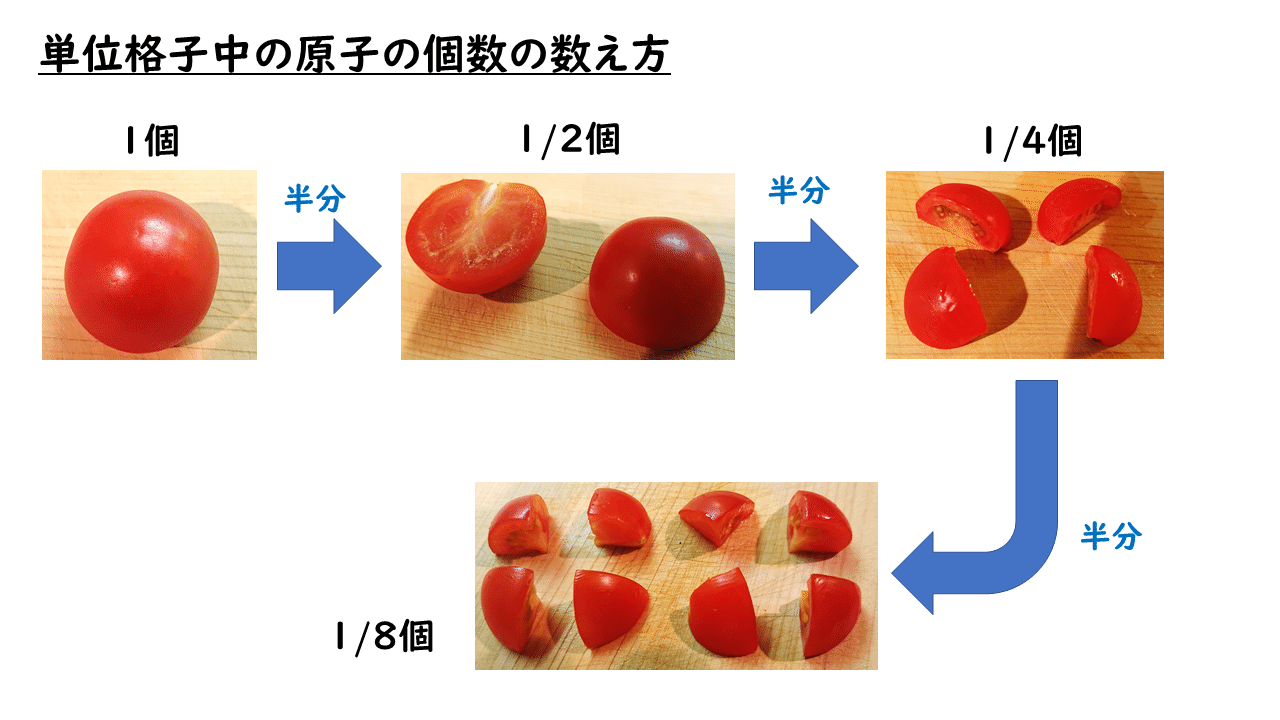
※参考:粒子の数の数え方
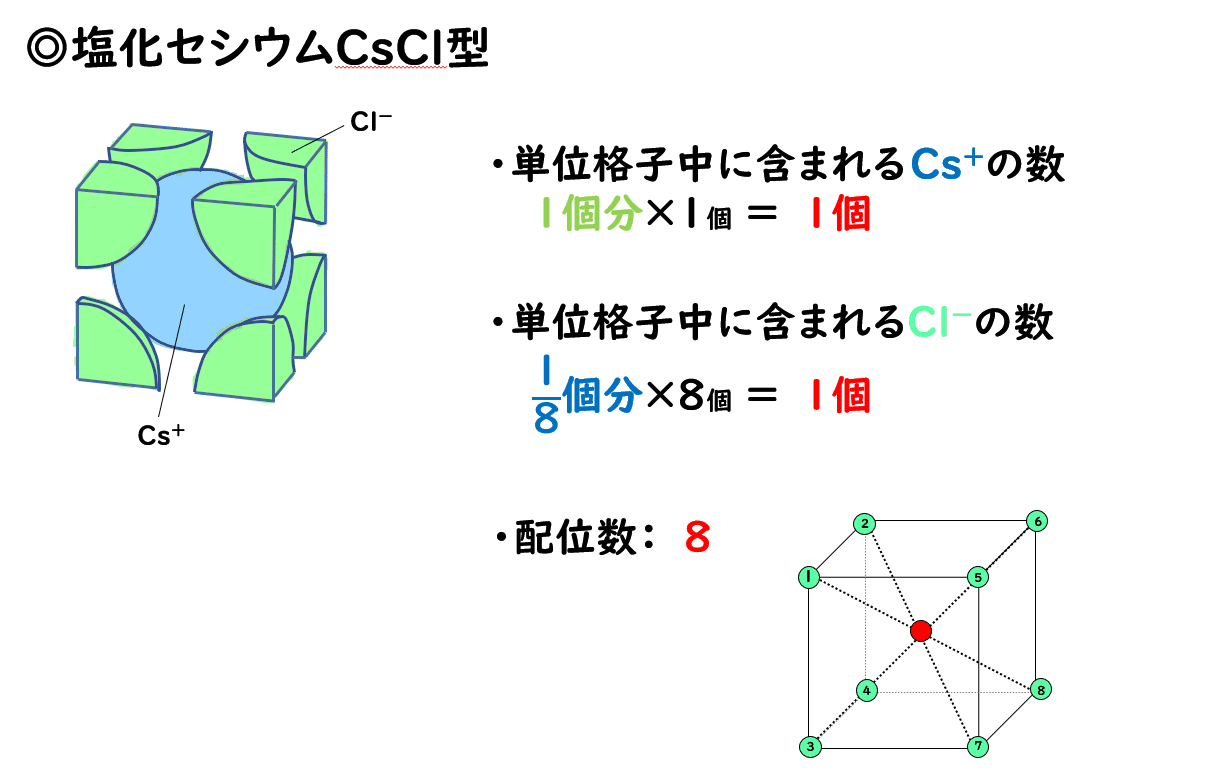
◎塩化セシウムCsCl型
塩化セシウムCsClのほか、臭化セシウムCsBrや塩化アンモニウムNH4Clなどのイオン結晶は、塩化セシウム型と呼ばれる構造をとります。
塩化ナトリウム型の単位格子は、陽イオンと陰イオンが1:1の割合で集まってできていますが、全体の構造を見てみると、金属結晶の体心立方格子と同じ構造をしています。
このとき、陽イオンは1個だけ中心に存在し、陰イオンは立方体の頂点に1/8×8=1個だけ存在しています。
また単位格子の中央にある1個のイオンに注目すると、そのまわりにある8個のイオンと接しているので、配位数は8です。
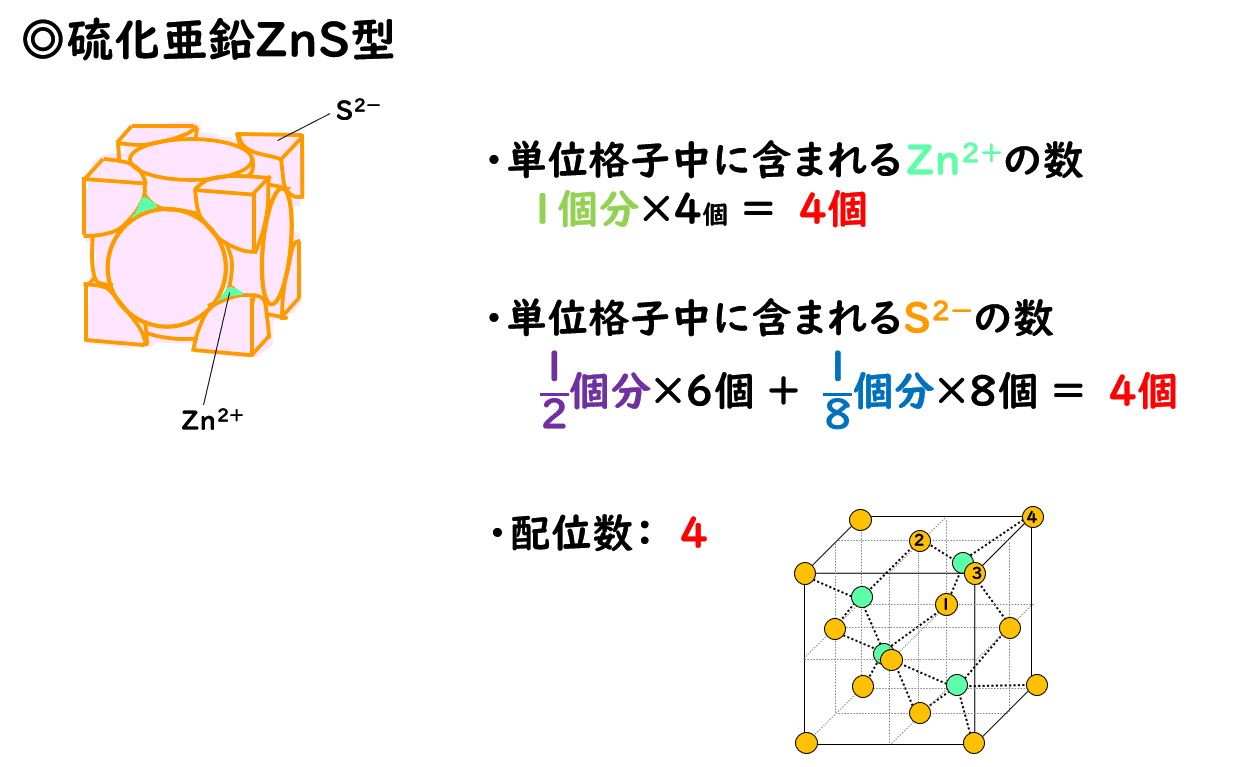
◎閃亜鉛鉱(硫化亜鉛ZnS)型
硫化亜鉛ZnSのほか、硫化カドミウムCdS、ヨウ化銀AgIなどのイオン結晶は、閃亜鉛鉱(せんあえんこう)型と呼ばれる構造をとります。
閃亜鉛鉱型の単位格子は、陽イオンと陰イオンが1:1の割合で、正四面体形をつくるように集まってできています。また、硫化亜鉛ZnSの場合、陰イオンであるS2-に注目をすると、その構造は金属結晶の面心立方格子と同じです。したがって、陰イオンの数は面心立方格子と同じく4個になります。そして、陽イオンであるZn2+は、その隙間に均一に入り込んでおり、単位格子中には同じく4個含まれます。
また下図のように1つの亜鉛イオンZn2+に注目すると、そのまわりにある4個のイオンと接しているので、配位数は4です。
■イオン結晶と組成式
イオン結晶の構造がわかると、その結晶を構成する陽イオンと陰イオンがどのような割合で結びついてできているものなのか、つまり組成式を知ることができます。
言い換えると、単位格子に含まれる陽イオンと陰イオンの数の比は、組成式で示される陽イオンの数と陰イオンの数の比に等しくなると言えます。
ここでは、フッ化カルシウムCaF2を例にして考えてみましょう。
◎ホタル石(フッ化カルシウムCaF2)型
フッ化カルシウムCaF2のほか、フッ化バリウムBaF2、フッ化銅(Ⅱ)CuF2は、ホタル石型と呼ばれる構造をとります。
フッ化カルシウムの単位格子では、陽イオンであるカルシウムイオンCa2+が面心立方格子をつくり、単位格子を1/8にした空間のすべてにフッ化物イオンF-が入るという構造をとります。したがって、陽イオンは面心立方格子と同じく単位格子中に4個のイオンを含みますが、陰イオンは単位格子中に8個含まれます。
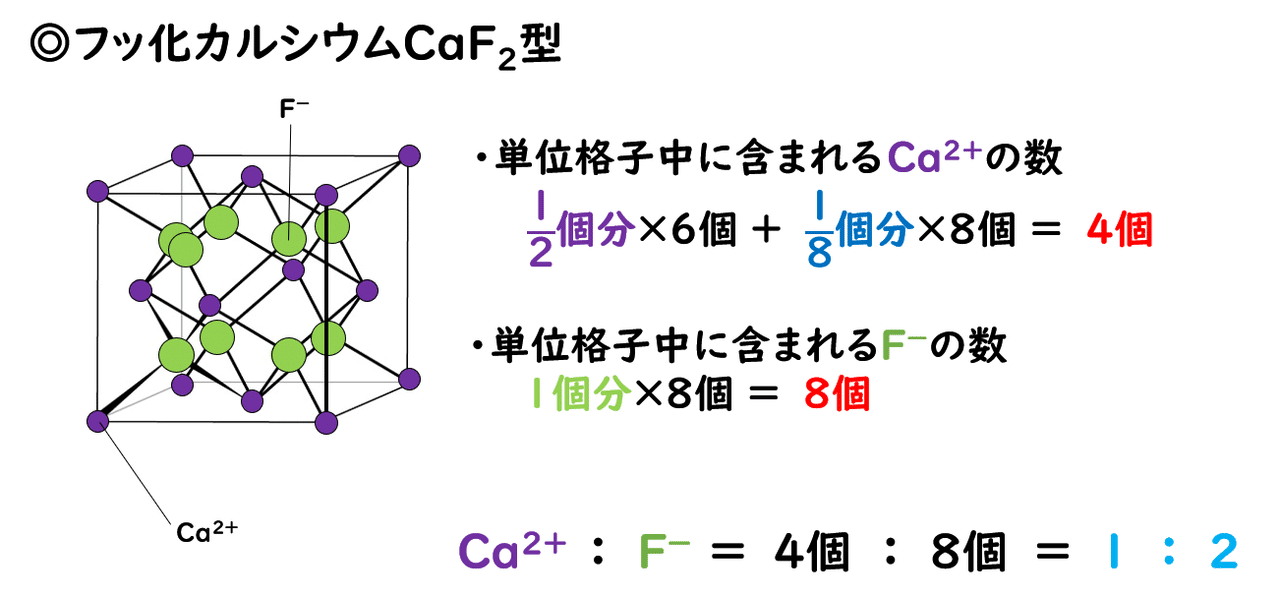
したがって、陽イオンの数と陰イオンの数の比は1:2となり、組成式はCaF2と表されます。
■静電気力
陽イオンと陰イオンの間にはたらく静電気力の大きさは、その組み合わせによっても異なります。そのため、イオン結合にも強さの違いがあり、イオン結晶の安定性(硬さ、水への溶解性など)も、その組み合わせによって異なります。
では、静電気力の大きさはどのようにして求められるのでしょうか。
陽イオンとイオンイオンの間にはたらく静電気力の大きさは次のようにして求めることができます。
両イオンの電荷の席の絶対値|q+×q-|に比例し、イオン間距離(陽イオンと陰イオンのイオン半径の和)に反比例する。
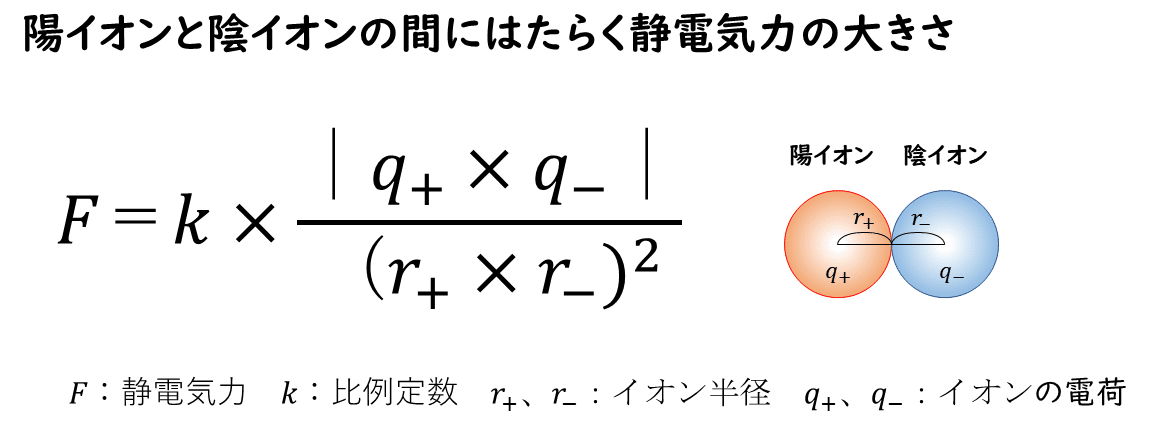
つまり、静電気力の大きさは、陽イオンの電荷と陰イオンの電荷をかけあわせた積が大きいほど大きくなり、陽イオンの半径と陰イオンの半径をかけあわせた積(の2乗)が大きいほど小さくなります。
ざっくり言ってしまうと、もともと持ち合わせている電気の量がたくさんあって、イオンの中心どうしの距離が近く密接な関係にあるほど、静電気力の大きさは大きくて、互いに結びつく力が強いということですね。
また、イオンの配列が似たイオン結晶であれば、イオン間の静電気力が大きいものほど、結合を断ち切るために多くのエネルギーが必要になるので、融点が高くなることが知られています。
例えば、酸化物MgO、CaO、SrOとハロゲン化物NaF、NaCl、NaBrは同じ塩化ナトリウム型構造をとりますが、酸化物の方は陽イオンも陰イオンも2価のイオンであるのに対し、ハロゲン化物は陽イオンも陰イオンも1価のイオンですので、酸化物の方が両イオンの電荷の積が大きくなります。そのため、酸化物の方がイオン間にはたらく静電気力が大きく、融点も高くなります。
一方で、両イオンの電荷の積が等しい場合には、両イオン間の距離が小さいほど静電気力が大きくなり、融点も高くなることが知られています。
例えば、同じ塩化ナトリウム型構造をとるNaClとKClは、いずれも1価の陽イオンと1価の陰イオンからできているので、両イオンの電荷の積は等しくなります。しかし、NaはイオンになるとNe型の構造をとり最外殻はL殻であるのに対し、KはイオンになるとAr型の構造を撮り最外殻はM殻であるので、イオン半径はKの方が大きくなります。よって、陽イオンと陰イオン間の距離はNaClの方が小さいので、静電気力もNaClの方が大きくなり、融点もNaClの方が高くなります。
■イオン結晶の安定性と半径比 [発展]
ここまで、陽イオンと陰イオンの関係性に注目をしてきましたが、イオン結晶の安定性を考えるとき、実はさらに別の要素も考える必要があります。
なぜかというと、陽イオンと陰イオンの間には静電気力という互いに引かれあう力がはたらくのに対して、陽イオンどうし、または陰イオンどうしの間には、反発力がはたらくからです。
このことも踏まえてイオン結晶の安定性について考えてみると、次のような時、イオン結晶はより安定になる(陽イオンと陰イオンどうしが安心してくっついていられる)と考えることができます。
①陽イオンと陰イオンは、できるだけ多く接する。
②同符号のイオンは反発するため、陽イオンどうしまたは陰イオンどうしは、接しない。
たとえば、下図のように、陽イオンが4個の陰イオンで取り囲まれている場合を考えると、陽イオンと陰イオンの半径と、結晶の安定性の関係は、次のように説明することができます。
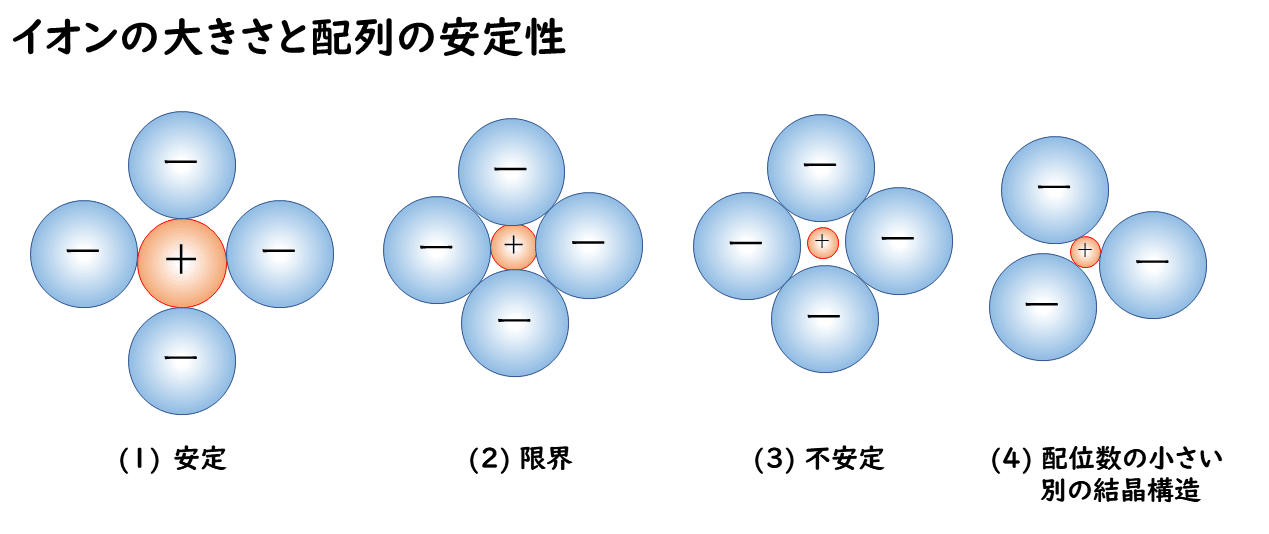
(1)では、陽イオンと陰イオンが接して強い引力で引き合っていますが、陰イオンどうしは離れているため反発力は小さく、結晶は安定だといえます。
しかし(2)のように、陽イオンの半径が小さく、陰イオンどうしが接する場合では、陰イオンどうしの反発力が大きくなってしまいます。
(3)のように、(2)よりもさらに陽イオンが小さい場合では、陽イオンと陰イオンの引力よりも、陰イオンどうしが接することによる反発力の方が大きくなって、結晶は不安定になります。この場合、不安定なままでは存在することができず、配位数の小さい別の結晶構造(4)をとるようになります。
このように結晶の安定性は、陽イオンの半径r+と、陰イオンの半径r-との半径の比に左右されており、
半径比=r+/r-
で表します。
また(2)のように、陰イオンどうしがギリギリ接するようなときの半径比のことを「限界イオン半径比」と呼んでいます。実際の陽イオンと陰イオンの半径比が、この限界イオン半径比の範囲外になると、そのイオン結晶は不安定となり、配位数の異なる違う結晶構造に変化します。

◎イオン半径比の求め方
では、具体的に塩化セシウム型と塩化ナトリウム型のイオン結晶について、限界イオン半径比の値を求めていきましょう。
●塩化セシウム型の半径比の限界
塩化セシウムCsCl型の結晶では、通常は次の図のようにCs+とCl-が接し、Cl-どうしは離れて存在しています。
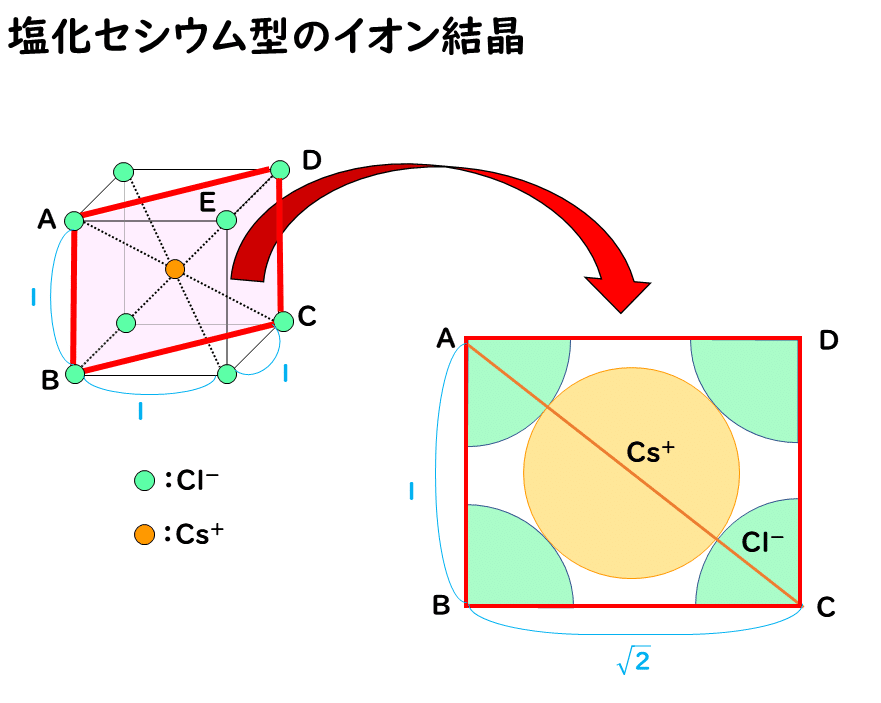
ここで、仮に陽イオンを小さくしていき、ちょうど陰イオンどうしが接した場合の陽イオンと陰イオンの半径比 r+/r- を考えてみます。
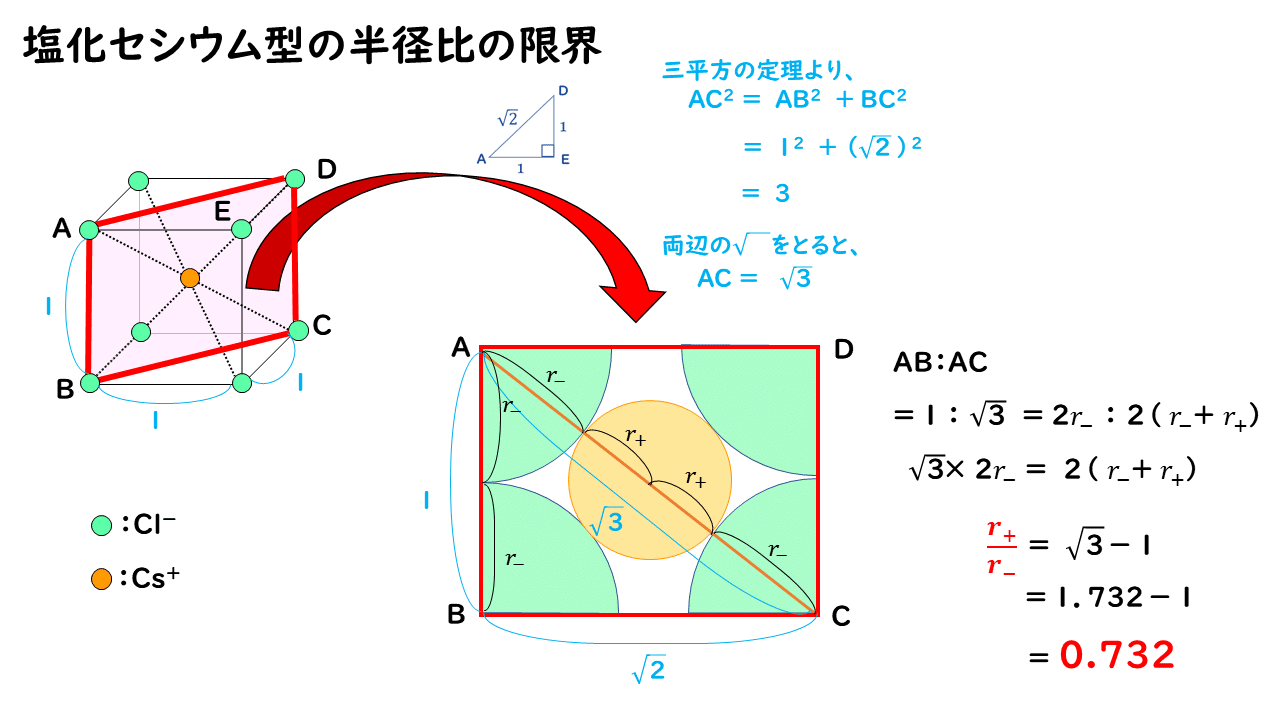
このイオンの半径比が r+/r- =0.732が、塩化セシウム型構造における限界イオン半径比になります。したがって、陽イオンがさらに小さくなっていき、実際のイオン半径で求めた比の値 r+/r- が0.732 よりも小さくなると、安定な構造を保てなくなります。
●塩化ナトリウム型の半径比の限界
塩化ナトリウムNaCl型の結晶では、通常は次の図のようにNa+とCl-が接し、Cl-どうしは離れて存在しています。
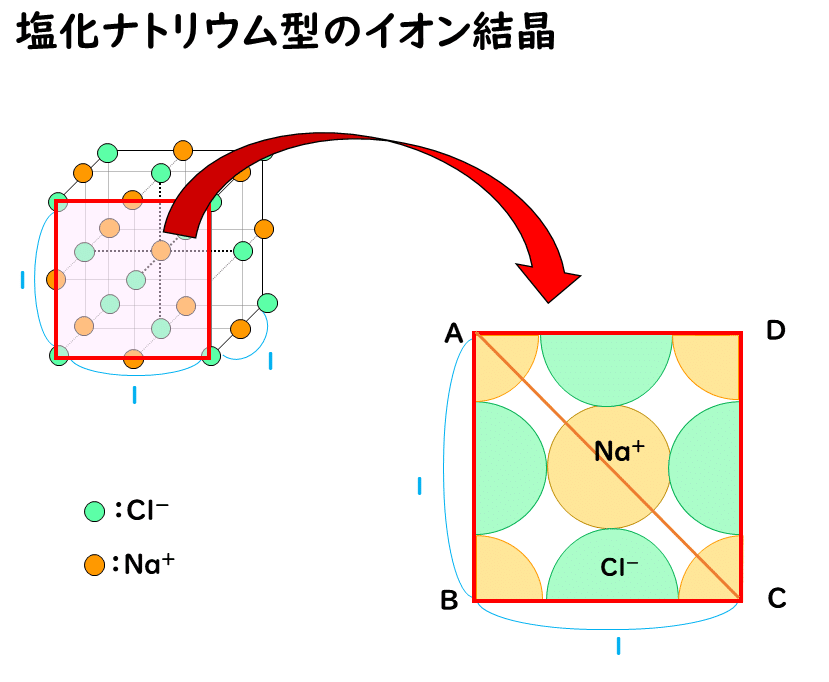
ここで、仮に陽イオンを小さくしていき、ちょうど陰イオンどうしが接した場合の陽イオンと陰イオンの半径比 r+/r- を考えてみます。
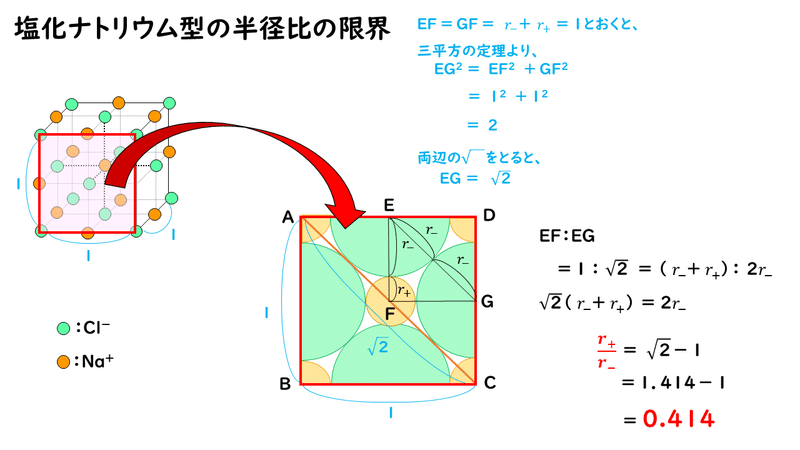
このイオンの半径比が r+/r- =0.414が、塩化セシウム型構造における限界イオン半径比になります。したがって、陽イオンがさらに小さくなって、実際のイオン半径で求めた比の値 r+ / r- が0.414 よりも小さくなると安定な構造を保てなくなります。
今回も少し計算が多くて大変だったかもしれませんが、計算で求めた値によって、どのような構造をとるのかが分かったり、その構造がどの程度安定しているのかが分かったり、どのような性質があるのかを推測できたりるのは、とても面白いところだと思います。その上で、実際に物質の性質を調べてみて、差異があったとしたらそれはどのような原因によるものなのかを考えてみたり、「こんな性質の物質を作ってみたい」というところから逆算をして物質を合成する研究をしてみたり…というロマンがどんどん広がって行くのだと思います。
ぜひ、そんなロマンを感じながら勉強をしていってもらえたらなと思います。
最後にワンポイントチェック
1.イオン結晶にはどのような種類があるか?
2.塩化ナトリウム型構造、塩化セシウム型構造、閃亜鉛鉱構造について、
単位格子中に含まれるイオンの数、配位数は求められるか?
3.陽イオンと陰イオンの間にはたらく静電気力の大きさは、どのような
ことに影響があるか?
この記事が気に入ったらサポートをしてみませんか?
