
1-5. 分子間力と分子結晶
こんにちは。おのれーです。もう「2週間ごとの更新」を目指した方がいいのではないかというペースになりましたが、何とか頑張っていきます。
ここまでのところで、「金属結晶」「イオン結晶」「共有結合の結晶」についてみてきました。今回は「結晶」とよばれる分類の中では最後となる「分子結晶」についてです。
なお分子結晶については、"化学基礎"と重なるところも多いので、もう一度初めから確認したい方は下の記事をご覧ください。
では、始めていきます。
■分子間力
分子結晶は、多数の分子同士が分子間力によって集合してできています。とは言っても、分子間力とよばれる力には種類がいくつかあり、「分子間力」という名称は、それらの総称だと考えてください。
さて、そもそも「分子間力」とは何者なのでしょうか。
分子間力とは、
分子間にはたらく引力
のことをいいます。分子と分子が互いに引かれ合う力や作用のことを、全部ひっくるめて「分子間力」とよぶのです。したがって、分子間力は固体(分子結晶)だけでなく、液体や気体の状態でも生じていると考えることができます。
では、分子間力にはどのようなものがあるのでしょうか。
分子間力には、次のようなものがあることが知られています。
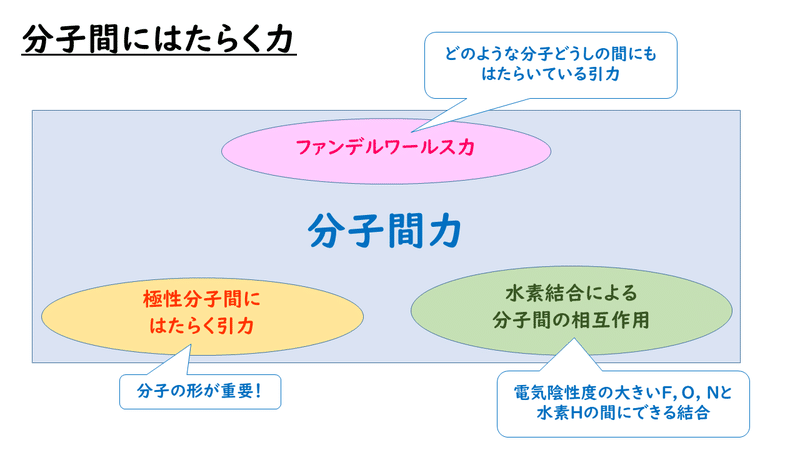
今回は、この3つの力・作用についてみていきます。
◎ファンデルワールス力
分子と分子の間にはたらく弱い引力のことをファンデルワールス力(van der Waals Force)といいます。化学基礎の記事でも書いたのですが、ファンデルワールス"力(りょく)"を、カタカナの「カ」だと間違えられることが多いので気を付けてください。あと、吹奏楽部の人は、作曲家のヴァン=デル=ロースト(van der Roost)さんと間違えやすいので気をつけましょう。
このファンデルワールス力は、分子の極性(電荷の偏り)に関わらず、すべての分子にはたらいています。また、化学結合をしていない分子同士、例えば気体として1個1個の分子がバラバラに存在している状態にあっても、分子間ではたらいている力です。
ではなぜ、どのような分子にもファンデルワールス力がはたらいているのでしょうか?(ちょっと難しい話になるので、---で囲った部分は読み飛ばしてもらっても大丈夫です)
---
その原因は、"電子の動き"にあります。
電子は原子核に比べて非常に質量が小さいので、原子核からうける引力に逆らいながら、非常に高速で動き回っています。実際には電子がその瞬間瞬間でどこにいるのかを特定することはできないのですが、統計を取ってみると、「平均的に電子はこのあたりに存在していることが多い」ということを導き出すことができます。
化学基礎で、いわゆるK殻、L殻、M殻…というような電子殻を学んだと思いますが、実は確固たる「殻」があるわけではなく、「何となくその辺に電子がいることが多い場所」だと考えた方が現実的かと思います。例えるならば、「電子ちゃん、毎朝9時には"K殻"駅にいるらしいよ」ではなくて、「電子ちゃんて、”K殻”駅周辺によく出没するよね~」くらいの感じでしょうか。
無極性分子の場合、長い時間で平均をとれば、電子が分子全体にまんべんなく存在しているので、全体として電荷を帯びていない状態と考えることができ、後述する極性分子間にはたらくような静電気的な引力は生じません。
しかし、無極性分子であったとしても、分子内に存在している電子はランダムに動き回っているため、偶然電子が偏ってしまうことがあります。つまり、瞬間的に"極性分子もどき"になることがあるのです。人々が互いに約束をしているわけでもないのに、週末になると繁華街に集まってしまうのと似ているかもしれませんんね。
このように瞬間的に"極性分子もどき"になったことで、分子同士の間には、+と-の電荷が引かれ合うことで生じる静電気力(クーロン力)がはたらき、互いに引き付け合います。これがファンデルワールス力です。
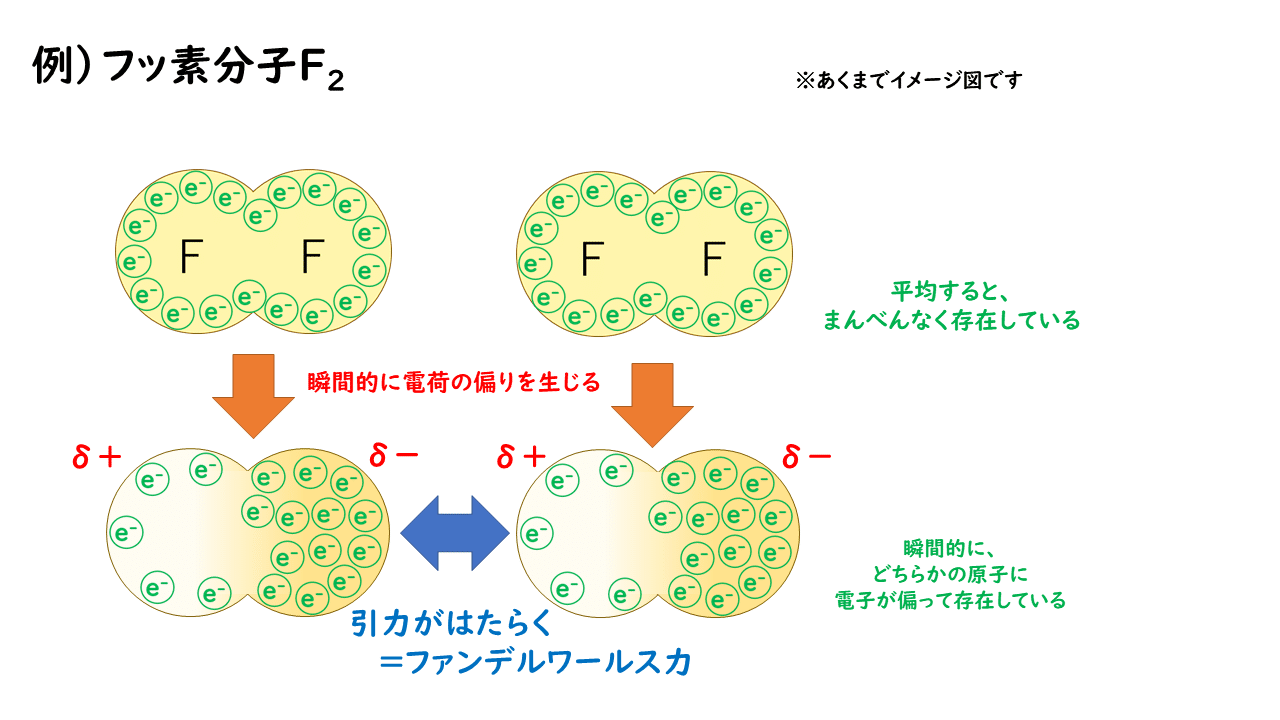
ファンデルワールス力は言い換えると、「瞬間的なクーロン力による引力」ということができるでしょう。実際にはこれが分子間では絶えず起こっているので、どんな分子にもファンデルワールス力がはたらいているのです。
---
一般に、分子量が大きくなるほど、ファンデルワールス力が強くなります。分子量が大きいということは、陽子や電子をたくさん持っているということであり、電荷をたくさんもっているということです。そうすると、瞬間的に生じる電荷の偏りも全体的に大きくなり、ファンデルワールス力も大きくなります。
したがって、分子量が大きい分子ほど、ファンデルワールス力を振り切って気体になるには、より多くのエネルギーを必要とするため、沸点は高くなります。
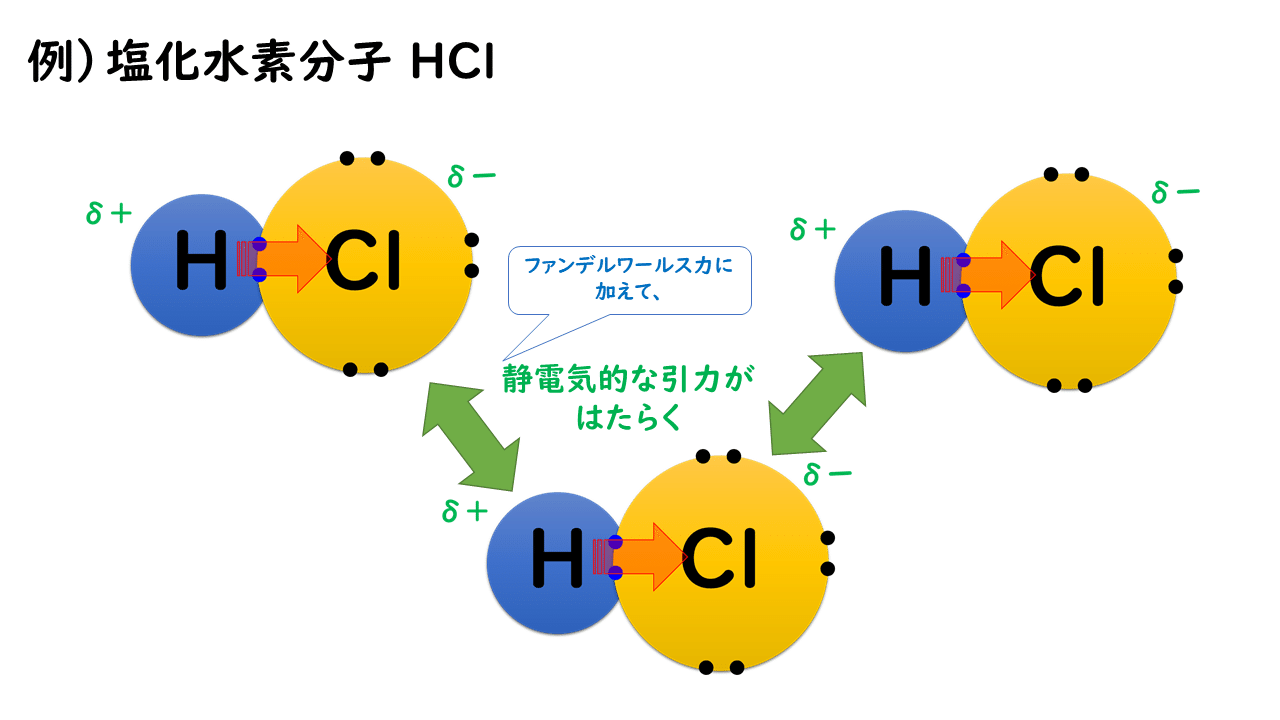
◎極性分子間にはたらく静電気的な引力
分子量がほぼ等しい場合、極性分子からなる物質の沸点の方が、無極性分子からなる物質の沸点よりも高くなります。これは、極性分子間では、ファンデルワールス力に静電気的な引力も加わり、分子同士がより強く引き合うためです。
◎水素結合
フッ素F、酸素O、窒素Nなどの原子は、電気陰性度が大きいため、水素原子と共有結合を形成した際に共有電子対が強く引き寄せられ、分子内に強い電荷の偏り(極性)が生じます。そのため、分子間にはたらく静電気的な引力は強くなり、ファンデルワールス力や通常の極性分子間にはたらく静電気的な引力による結合よりも強い結合で結びつくようになります。この結合を特別に「水素結合」と呼んでいます。
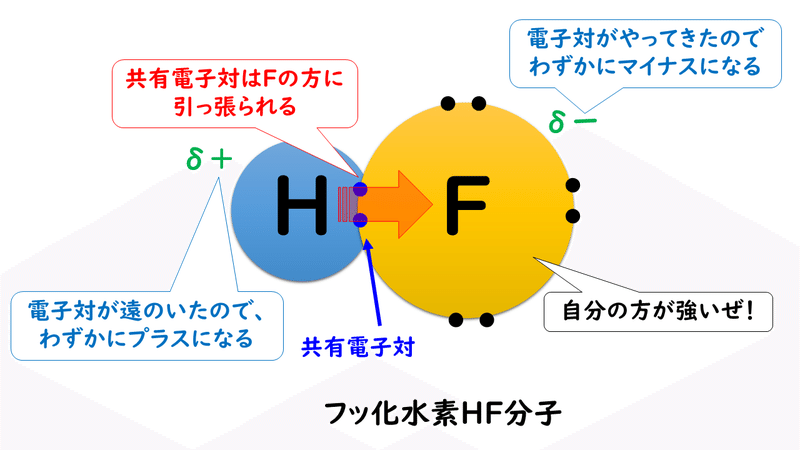
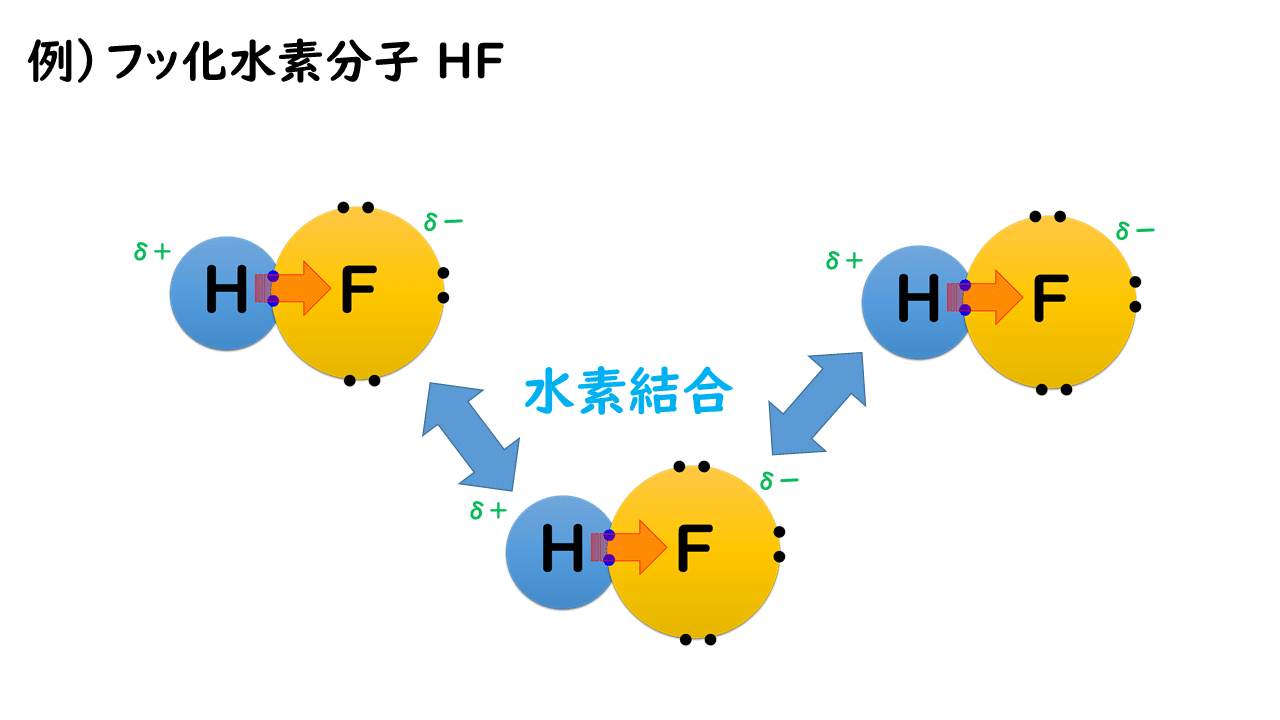
したがって、一般に同族元素では分子量の大きい元素からなる分子の方がファンデルワールス力が大きく沸点が高いのですが、水素結合を形成するものでは、同族元素であっても、分子量の小さい元素の水素化合物の沸点の方が高くなることがあります。
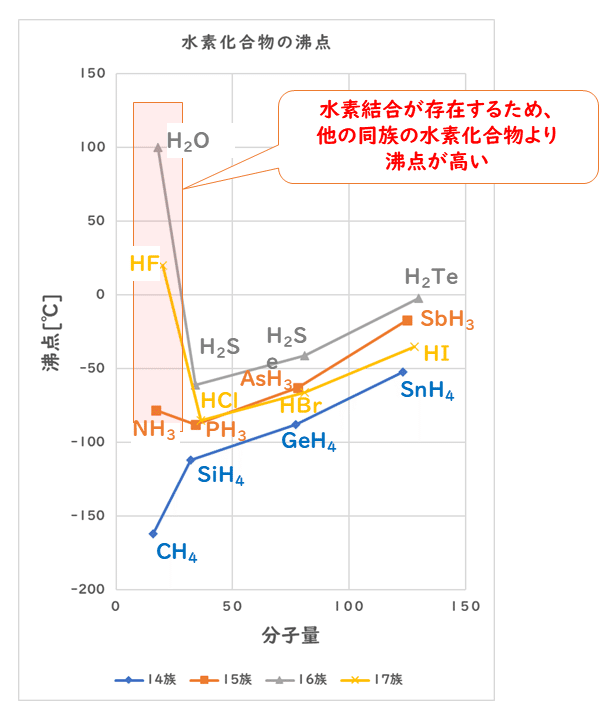
とはいっても、水素結合は、共有結合やイオン結合に比べると、はるかに弱い力なので、共有結合の結晶であるダイヤモンドCや、イオン結晶である塩化ナトリウムNaClなどと比べると、水素結合を形成するフッ化水素HF、水H2O、アンモニアNH3の融点・沸点は低くなっています。
水素結合はこのほか、エタノールC2H5OHや酢酸CH3COOHなどの分子間にも見られます。また、同種の分子間だけでなく、異種の分子間にも存在し、有機化合物の水への溶解性などにも深くかかわっています(詳しくは、4-1で書く予定)。
ちなみに水素結合は、私たちの体内でも重要なはたらきをしています。タンパク質の立体構造や、DNAの二重らせん構造を保っているのも水素結合だったりします。恐るべし、水素結合。

(イラストACより)
■分子結晶
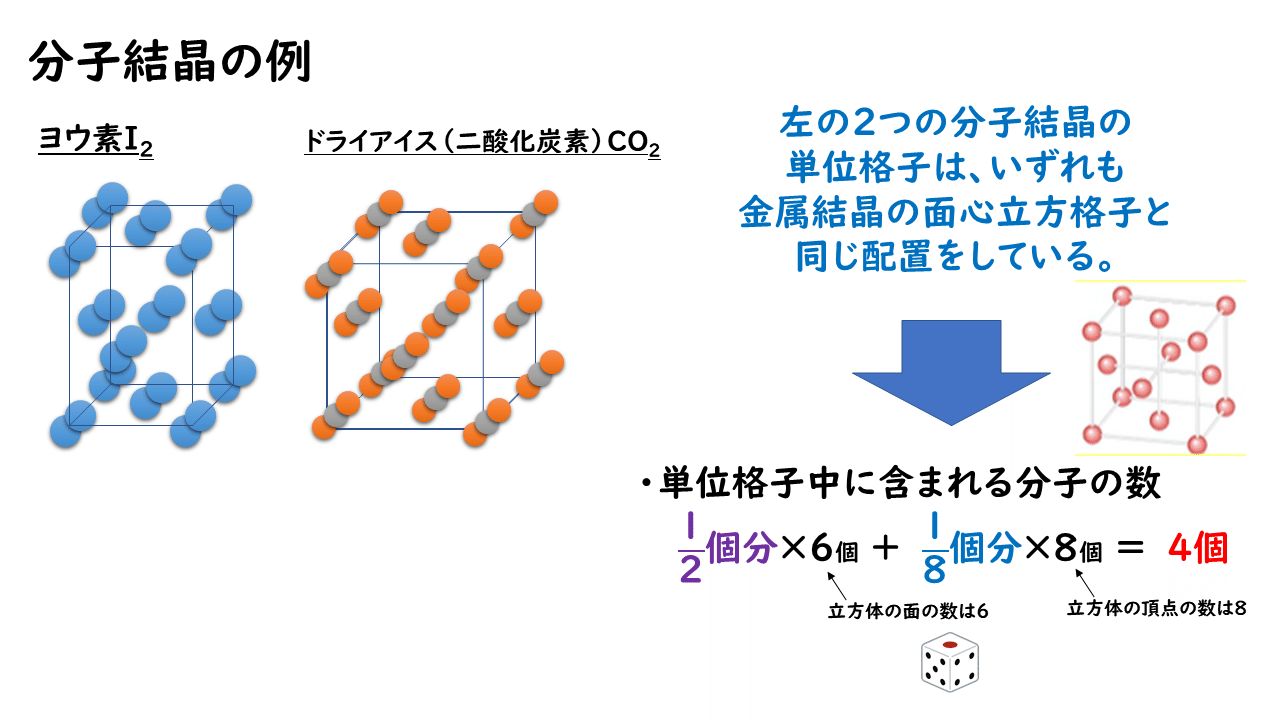
ドライアイスやヨウ素の結晶は分子結晶の代表例です。二酸化炭素分子CO2もヨウ素分子I2も無極性分子であり、分子間にはファンデルワールス力だけがはたらいています。そのため、分子同士は非常に弱く結びついているので、分子結晶はやわらかく、融点が低いという特徴があります。
また、分子結晶の単位格子に含まれる分子の数も、金属結晶の場合と同じようにして求めることができます。ドライアイスやヨウ素の単位格子において、二酸化炭素分子やヨウ素分子は、金属結晶の面心立方格子での原子の配列と同じなので、次のようにして4個と求められます。
◎氷の構造
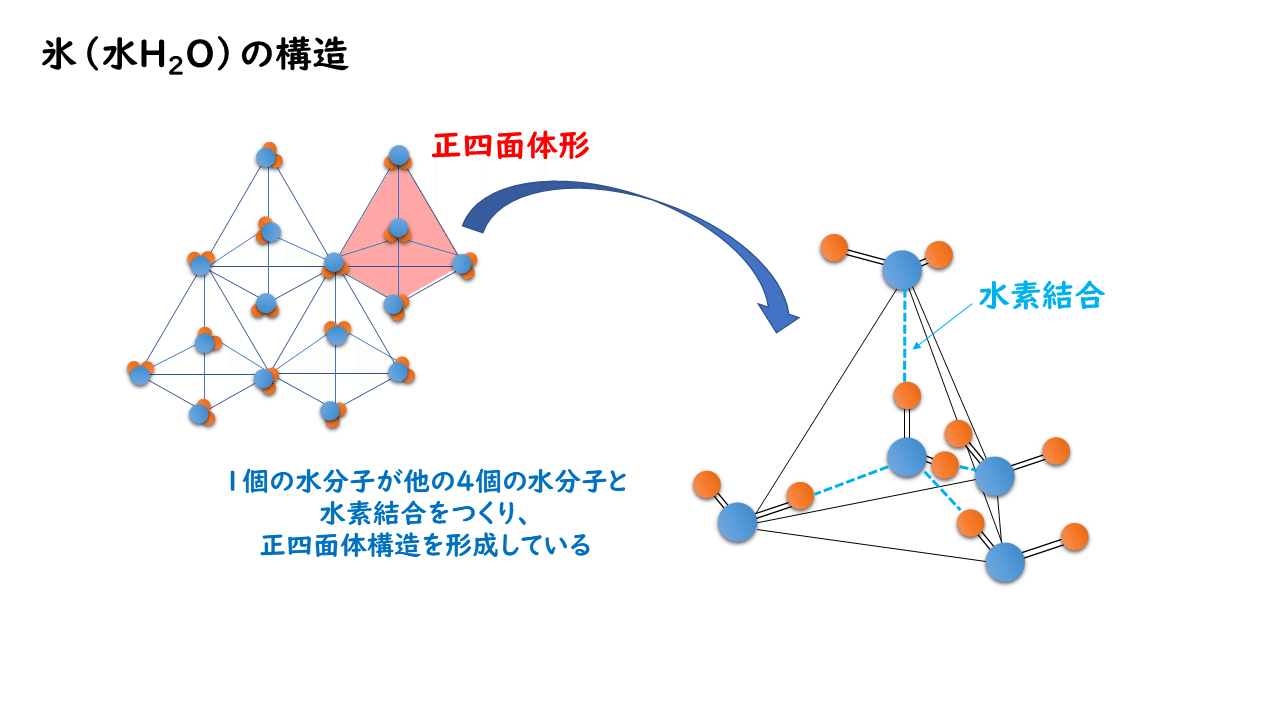
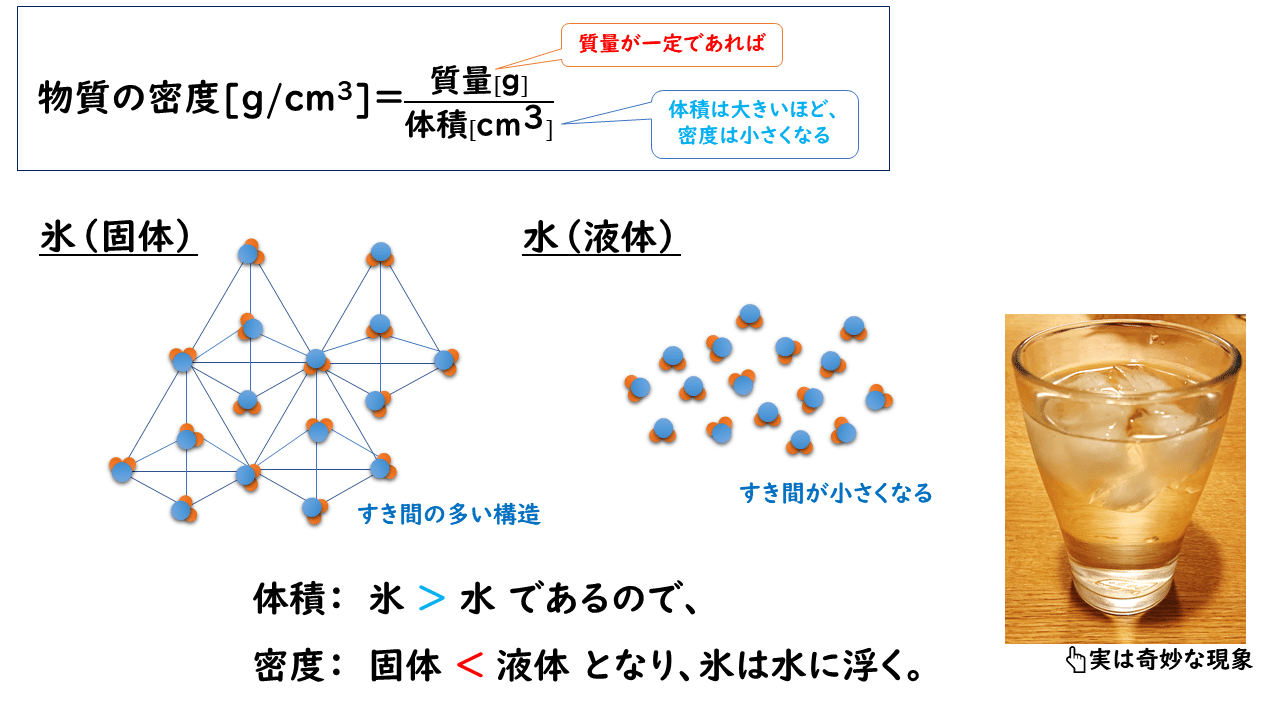
氷も分子結晶の代表例の一つです。しかし氷では、水分子H2O分子の間に、ファンデルワールス力に加えて、水素結合も形成して配列され、すき間の多い構造をとっています。分子量のわりに沸点が高い(100℃)のも特徴です。
氷の結晶構造は、1個の水分子が他の4個の水分子と水素結合をつくることで、正四面体構造をしています。なお、1 本の水素結合は、 2 個の水分子の間にはたらいているので、氷を昇華してバラバラの水蒸気にするためには、水分子の数の 2 分の 1 の数の水素結合を切断する必要があります(2021年度大学入学共通テスト 第1日程に出題)。
また一般に、同じ質量で比較すると、物質の体積は温度が高くなるほど熱運動が激しくなるため、大きくなります。したがって物質の密度(単位体積当たりの質量)も、温度の低い固体の方が、液体よりも大きくなり、同じ物質の液体に固体は沈みます。
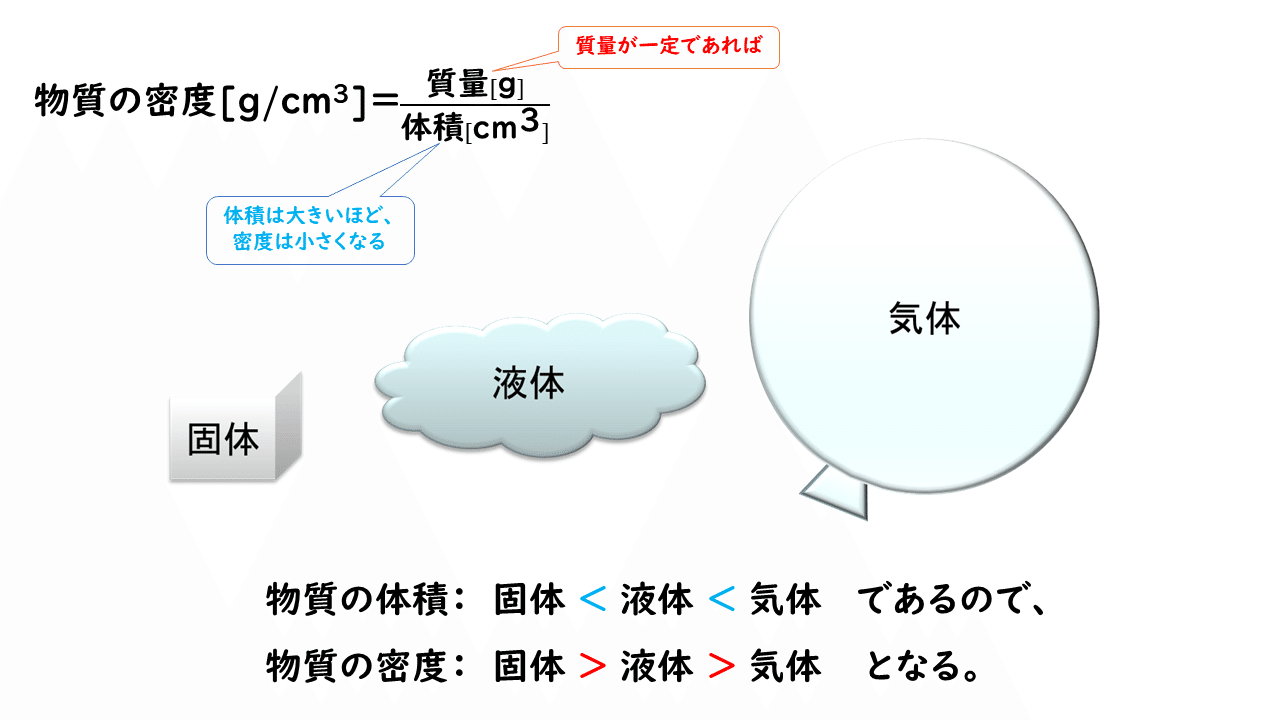
しかし、水の場合は固体の方が密度が小さく、氷は液体の水に浮きます。これは、氷は水素結合の働きですき間の多い構造をしているため、氷が融解して液体の水になると、水分子の配列がくずれ、すき間の少ない構造となって体積が減少するからです。ちなみに水の密度が最も大きくなるのは4℃であることが知られています。
このように、水はとても身近な物質でありながら、化学の目で見ると、めちゃくちゃ異端児というか、変り者なのです。そこがかわいいところでもあるのです(以上、水ヲタクの戯言でした)。
ということで、今回は分子結晶についてでした。次回は、ついに1章も最終回。近日公開!(予定…)
最後にワンポイントチェック
1.分子間にはたらく力にはどのようなものがあるか。
2.ファンデルワールス力の強さはどれくらいか。
3.ファンデルワールス力と分子量の関係はどうなっているか。
4.水素結合とは何か。
5.水素結合をつくる分子を3つあげよ。
6.分子結晶の特徴はどのようなものか。
この記事が気に入ったらサポートをしてみませんか?
