
85 全身性エリテマトーデスの臨床的特徴
キーポイント
•全身性エリテマトーデス(SLE)は多臓器にわたる自己免疫疾患であり、再発寛解型の経過をとり、予後が非常に不安定であることが特徴である
・SLEは広範な自己抗体の産生を特徴とする。
・診断には抗核抗体が最も感度が高く、抗二本鎖DNA抗体と抗Sm抗体が特異性が高い。
・出産適齢期の女性、アフリカ系アメリカ人、アジア系、ヒスパニック系が最も罹患率が高く、有病率も高い。
・全身症状、発疹、粘膜潰瘍、炎症性多発性関節炎、光線過敏症、血清炎が本疾患の最も一般的な臨床症状である。
・ループス腎炎は、生命を脅かす可能性のある症状の中で最も一般的なものである。
・動脈硬化は長期にわたるSLEの合併症であり、積極的な危険因子の修正が必要である。
Pearls:亜急性皮膚エリテマトーデスは腫瘍随伴症候群として関与している。
・SCLEの説明の最後にしれっと、”Finally, SCLE has been implicated as a paraneoplastic syndrome.”と記載があります。
・引用文献はClin Exp Dermatol . 2005 Nov;30(6):655-8.ですがそれ以外にも多数のparaneoとSCLEの報告があります。
・亜急性皮膚エリテマトーデス(SCLE)は、(1)乾癬に似た丘疹-扁平上皮性病変( papulosquamous lesions that resemble psoriasis)(2)末梢に鱗屑を認め、中心部に透明のある環状-多環状病変(annular-polycyclic lesions with peripheral scale and central clearing)の2つの異なる病型をとる、非瘢痕性の光線過敏性病変の存在を特徴とする。
・SCLEは背部、頚部、肩、腕の伸側に好発し、通常顔面中央部にはみられない。病変は通常数週間から数ヵ月持続し、瘢痕を残すことなく治癒する。
・日光暴露後にSCLE病変から重度のTEN様発疹が進展することがある。
・いくつかの薬剤がSCLEを誘発することが知られており、アンジオテンシン変換酵素阻害薬、テルビナフィン、ヒドロクロロチアジド、カルシウム拮抗薬などがよくみられる原因である。薬剤に暴露してから皮膚病変が発生するまでの期間は、数日から6年まで様々である。
・薬剤性SCLEに関与する薬剤は、薬剤性SLEを引き起こす薬剤とは異なる。
Myths: Jaccoud arthropathyはSLEに特有の関節症状である。
Reality: Hand deformities can occur as a result of ligamental and/or joint capsule laxity and joint subluxation. This manifestation is referred to as Jaccoud’s-like arthropathy because it resembles the arthropathy that develops in patients with rheumatic fever.
・手の変形は、靭帯および/または関節包の弛緩と関節亜脱臼の結果として起こりうる。この症状は、リウマチ熱患者に発症する関節症に似ているため、Jaccoud様関節症と呼ばれている。
・Jaccoudって誰なんだ…と思ったら和文で上野先生がまとめられていました。
https://webview.isho.jp/journal/detail/pdf/10.11477/mf.1402102102
Jaccoudは1869年にリウマチ熱の患者でスワンネック変形が残ったことを観察しています。
・そのためKelleyにはSLEの非びらん性関節炎をJaccoud-like arthropathyと記載しています。
・Lupus arthropathy: historical evolution from deforming arthritis to rhupus (Clin Rheumatol (2004) 23: 523–526)によれば、最初にSLEにおけるびらんを伴わない関節症(正確には屈曲の拘縮と立方骨の偏位と伴う関節症?)を1962年にZvaiflerという人が報告し、1975年にBywatersがZvaiflerが報告したこの関節炎を1867年頃にリウマチ熱の特徴的な症状であるJaccoud arthropathyとの類似性を報告しています。(このLG BywatersはAOSDの名付け親です)。
・この文献は非常に面白く、大昔には関節症はSLEの症状としてよいか、という論争があったことにも触れられています。Libman-Sacks心内膜炎で知られるLibmanとSacksは致死的な心臓・腎臓病変の4例を報告しその際関節症状にも触れられていたようです。Jaccoud arthropathyとLibman-Sacks心内膜炎の発症には関連があるという報告もあり、当時からLibmanとSacksは強い関節炎がSLEには存在する、ということを認識していたのかもしれません。
・またKelleyには、”Erosive arthritis is commonly a feature of MCTD. ”という記載もありました。あまり自分は経験ないですが皆さんどうでしょうか。
Pearls: 腎病理所見におけるtubuloreticular inclusion body(TRI)はIFN-αレベルの上昇と関連している。
Comments: The finding of tubuloreticular inclusion bodies within endothelial cells is strongly suggestive of the diagnosis of lupus nephritis. Nevertheless, because tubuloreticular inclusion bodies are associated with increased levels of interferon (IFN)-α, chronic viral infections such as hepatitis B/C and HIV must be ruled out.
・内皮細胞内に尿細管性封入体が認められることは、ループス腎炎の診断を強く示唆する。しかし、尿細管性封入体はインターフェロン(IFN)-αレベルの上昇と関連しているため、B/C型肝炎やHIVなどの慢性ウイルス感染を除外しなければならない。
・TRIは細胞質の拡張した粗面小胞体内に存在する20~30nmの環状構造が不規則に網目状に広がった細胞内構造体で、その形がパラミクソウイルスやミクソウイルスに似ていることからvirus-like particleと呼ばれることもありました。
・SLE以外ではHIV関連腎症などでも報告があるようです。
・Kelleyでは上記のような記載はありますが、引用文献が書かれていません。
”Tubuloreticular Inclusions in the Absence of Systemic Lupus Erythematosus and HIV Infection: A Report of Three Pediatric Cases(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5567081/”)のIntro部分に同様の記載があります。
・type 1 IFNが活性化するSLEがどのような症例か、を見極める一つのヒントになりえるのでしょうか?
Pearls: SLEでは”acute reversible hypoxemia”という特殊な低酸素血症を生じることがある
Comments: Last, a syndrome known as “acute reversible hypoxemia” has been observed in patients with active SLE. This syndrome is characterized by hypoxemia and an abnormal alveolar-arterial pO2 gradient in the absence of parenchymal lung disease. Pulmonary vascular endothelial cell injury and leukoagglutination secondary to complement activation is thought to be one potential mechanism.
・活動性のSLE患者では「急性可逆性低酸素血症」と呼ばれる症候群が観察されている。
・この症候群は、肺実質に病変がないにもかかわらず、低酸素血症と肺胞-動脈pO2勾配の異常を特徴とする。
・補体活性化による二次的な肺血管内皮細胞傷害と白血球凝集がその機序の一つと考えられている。
・文献ではこちら(https://pubmed.ncbi.nlm.nih.gov/8528221/)、Lupusからの古いケースレポートです。
****************************************
In 1991, Abramson et al reported a new syndrome of acute reversible hypoxemia (ARH) in patients with severe SLE (systemic lupus erythematosus). This syndrome was characterized by an unexplained abnormal value of arterial blood gases (ABG) without obvious parenchymal lung disease, and a good response to high-dose corticosteroid therapy. After we became aware of this entity, four of 16 patients admitted to our unit because of a SLE flare presented respiratory symptoms and abnormal ABG consistent with ARH. In none of our patients were the pulmonary manifestations a prominent clinical feature of the disease. Furthermore, in two of them, treatment with high-dose aspirin and moderate to low doses of corticosteroids was sufficient to improve the pulmonary manifestations, but not to control the systemic activity of the disease. Therefore, we believe that this new pulmonary finding more than a clinically independent syndrome represents an index of disease activity in patients with SLE.
****************************************
・こちらも引用が書いてあるわけではないです。個人的には抗MDA5抗体の急性期、治療中に一過性に悪化するフェーズがあり、何らかのvasculopathyが生じているのではないかと邪推しています。
・実はもしくはただのPAHだったのではないか、なども考えますがどうでしょう。
Myths: Libman-Sacks心内膜炎はSLEの活動性が高い症例ほど発症しやすい。
Reality: Several valvular abnormalities have been described in patients with SLE, including Libman-Sacks endocarditis (also known as atypical verrucous endocarditis), valvular thickening, valvular regurgitation, and valvular stenosis. One transesophageal echocardiographic (TEE) study demonstrated a prevalence of valvular abnormalities of 61% in patients with SLE compared with 9% of controls, with vegetations present in 43% of patients with SLE compared with none of the controls. Valvular thickening with a predilection for the mitral and aortic valves was the most common abnormality, occurring in 50% of patients with SLE. Valvular regurgitation and stenosis were detected in 25% and 4% of patients, respectively. In this study, the presence and progression of valvular disease were not associated with SLE disease activity or treatment. During a follow-up period of as long as 5 years, some valvular abnormalities resolved and some new lesions occurred. The combined incidence of stroke, peripheral embolism, congestive heart failure, infective endocarditis, need for valve replacement, and death was 22% among patients with valvular disease compared with 15% in patients without valvular disease.
・SLE患者では、Libman-Sacks心内膜炎(非定型疣状心内膜炎)、弁膜肥厚、弁逆流、弁膜狭窄など、いくつかの弁膜異常が報告されている。
・ある経食道心エコー(TEE)検査では、SLE患者の弁膜異常の有病率は61%であったのに対し、対照群では9%であった。
・僧帽弁と大動脈弁に好発する弁膜肥厚が最も多く、SLE患者の50%にみられた。
・弁逆流と弁狭窄はそれぞれ25%と4%の患者にみられた。この研究では、弁膜症の有無と進行はSLEの疾患活動性や治療とは関連していなかった。
・年という長い追跡期間中に、いくつかの弁膜症異常は消失し、いくつかの新しい病変が発生した。脳卒中、末梢塞栓症、うっ血性心不全、感染性心内膜炎、弁置換術の必要性、死亡の合計発生率は、弁膜症がない患者では15%であったのに対し、弁膜症がある患者では22%であった。
・上記以外にもいくつかの面白い記述がKelleyにありました。
◯Libman-Sacks疣贅は典型的には小豆大の平坦または隆起した粒状の病変として現れ、僧帽弁後葉(mitral valve posterior leaflet)の心室側に最も多く発生する。
◯疣贅は通常、多形核細胞を含まない;したがって、このような細胞の存在は、感染性心内膜炎を考慮すべきである。
◯TTEが診断不能であった場合や血栓塞栓症が疑われる場合には、TEEを行うべきである。TEEはLibman-Sacks心内膜炎の検出においてTTEよりも優れている。
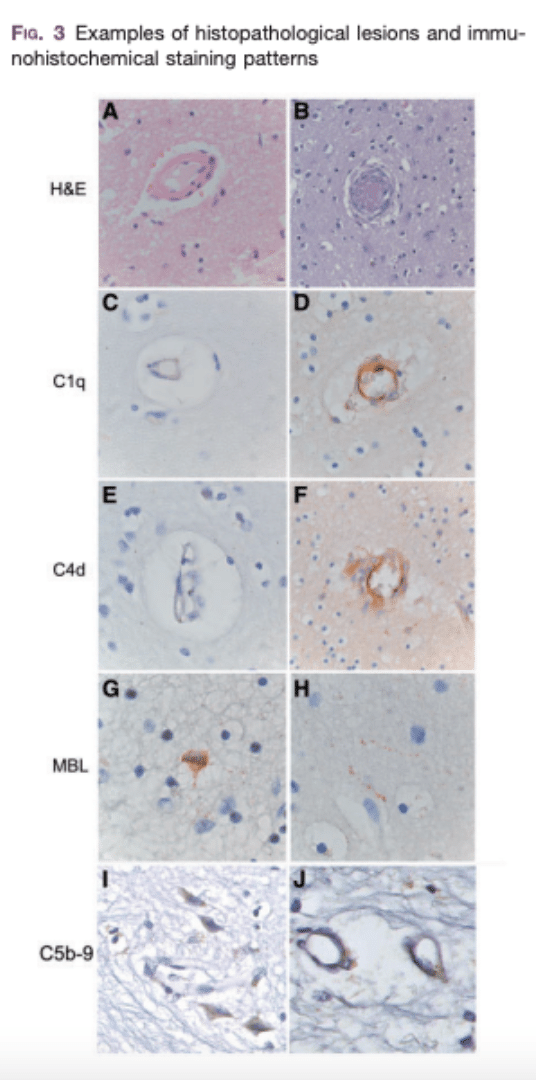
Pearls: NPSLE患者の脳血管にはC1qやC5b-C9などの古典的補体経路の沈着物が存在しており、これらの所見は補体の活性化が抗体を介した血管の炎症と微小血栓傷害の最終結果とを結びつけている可能性を示唆している。
Comments: Deposits of the classical complement pathway, including C1q, C4d, and C5b-9, are present in cerebral vessels of patients with CNS lupus. This finding suggests that complement activation may link antibody-mediated vascular inflammation with the end result of microthrombotic injury.
・Brain histopathology in patients with systemic lupus erythematosus: identification of lesions associated with clinical neuropsychiatric lupus syndromes and the role of complement, Rheumatology (Oxford). 2017 Jan;56(1):77-86ではLeiden大学のHuizinga先生がまとめています。

Myths: PMLは免疫抑制療法を受けているSLE患者で見られる中枢神経感染症である。
Reality: 進行性多巣性白質脳症(PML)はまれな感染症であり、中枢神経系機能障害の症状を呈するSLE患者においても考慮すべき感染症である。PMLは他のリウマチ性疾患患者よりもSLE患者において、たとえ免疫抑制療法を行っていない場合でも頻繁に起こる。したがって、原因不明の新しい神経症状を呈するSLE患者では、髄液のPCRを行ってジョン・カニンガム(JC)ウイルスの存在を確認すべきである。PCRが陰性の場合、診断の確定には脳生検が必要である。
・Progressive multifocal leukoencephalopathy: a national estimate of frequency in systemic lupus erythematosus and other rheumatic diseases(Arthritis Rheum. 2009 Dec;60(12):3761-5.), Progressive multifocal leukoencephalopathy associated with immunosuppressive therapy in rheumatic diseases: evolving role of biologic therapies(Arthritis Rheum. 2012 Sep;64(9):3043-51.)が引用文献となります。両方ともCleavelandのCalabrase先生が報告を行っています。
・前者は米国でのPML発生者の中から、どんな患者背景が多かったか検証、自己免疫性疾患の中ではSLE>RAでした。
・後者ではrheumatic diseaseの中でどんな患者背景が多かったか、で、SLEが最多でRTXの併用患者が多かったことが報告されています。全くの無治療でPMLを生じるかはわかりませんが高用量GCやCYの使用がなくともPMLを発症することは確かなようです。
Pearls: SLEにおける脊髄症は胸髄に多発する。
Comments: Myelopathy is a syndrome of spinal cord dysfunction characterized by bilateral lower extremity paresthesia, numbness, and weakness that can rapidly progress to involve the upper limbs and the muscles of respiration. A sensory level is usually noted, and auto- nomic involvement of the bowel and bladder is common. Band-like pain or discomfort around the abdomen is a characteristic symptom. The thoracic cord is most commonly involved because of a less robust vascular supply in that region of the cord.
・脊髄症は、両側の下肢知覚麻痺、しびれ、脱力感を特徴とする脊髄機能障害症候群であり、急速に進行して上肢や呼吸筋を侵すことがある。通常、感覚レベルの異常が認められ、腸や膀胱の自動神 経的関与が一般的である。腹部周囲の帯状の疼痛や不快感が特徴的な症状である。胸髄の血管供給が少ないため、胸髄が最もよく侵される。
・なぜ血液の供給が少ないから脊髄症を起こしやすいんでしょうか?ちょっとよくわからないです。
・SLE脊髄炎には以下の2つのタイプがあるとされています。
◯灰白質脊髄炎は弛緩と反射低下が特徴で、灰白質脊髄炎サブグループの患者は、6時間以内に急速に悪化し、発熱、吐き気または嘔吐、赤血球沈降速度(ESR)高値、その他活動性SLEの症状を呈することが多かった。特筆すべきは、これらの患者の大多数が尿閉の初期症状を呈していたことである。
◯白質サブグループの患者は、白質脊髄炎は痙性と反射亢進のパターン。脊髄炎の再発、視神経炎の併発、aPLおよび/または抗NMO抗体陽性の可能性が高かった。最後に、灰白質脊髄炎患者は、好中球増加を伴う高白血球数、高蛋白、低グルコースを特徴とする炎症性髄液を有する傾向が強かった。→いわゆるNMOSDのようなpresentationでしょうか。
Myths: SLE患者におけるGCやアザチオプリンの使用は膵炎の発症と関連している。
Reality: Although glucocorticoids and azathioprine have been associated with the development of pancreatitis in non-SLE patients, these medications do not seem to play a major role in the development of pancreatitis in patients with SLE.
・グルココルチコイドやアザチオプリンはSLE以外の患者では膵炎の発症に関係しているが、SLE患者ではこれらの薬は膵炎の発症に大きな役割を果たしていないようである。
・Semin Arthritis Rheum. 2006 Feb;35(4):260-7.によれば、GCやAZAは膵炎のmortalityとは関連なく、むしろ使用している方が予後がいいかも、とのことでした。厳密には膵炎の発症との関連を検討されているわけではないようですが、悪さはしないようです。
Myths: ループス肝炎と自己免疫性肝炎の肝臓病理所見は区別することが難しい。
Reality: Lupus hepatitis is believed to be a distinct entity from autoimmune hepatitis.Lupus hepatitis is typically characterized by the presence of lobular inflammation with a paucity of lymphoid infiltrates. These findings contrast with those of autoimmune hepatitis, in which periportal (interface) inflammation and dense lymphoid infiltrates predominate. Although ANA is frequently seen in both disorders, anti–smooth muscle and anti-LKM antibodies are more frequently noted in autoimmune hepatitis than in lupus hepatitis.
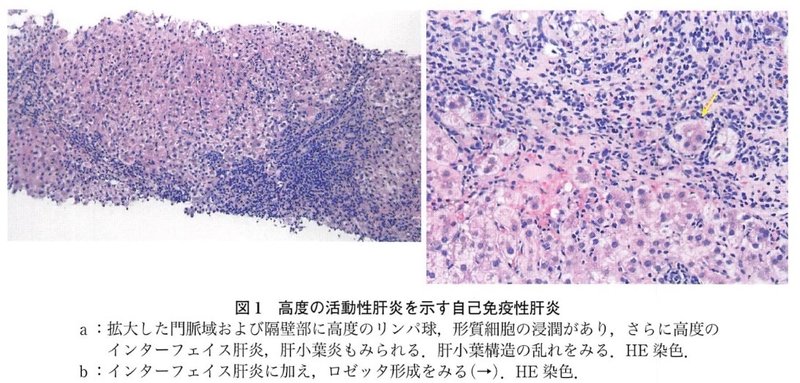
・ループス肝炎は、自己免疫性肝炎とは異なる病態であると考えられている。ループス肝炎の典型的な特徴は、リンパ球浸潤の多い小葉性炎症の存在である。これらの所見は、自己免疫性肝炎の所見とは対照的であある(AIHでは肝周囲(界面)の炎症と密集したリンパ球浸潤が優勢である)。ANAは両疾患で頻繁に認められるが、抗平滑筋抗体と抗LKM抗体はループス肝炎よりも自己免疫性肝炎でより頻繁に認められる。
AIHの特徴的な所見として,肝限界板領域での肝細胞の壊死,障害像高度のリンパ球浸潤を伴うインターフェイス肝炎が強く,さらに肝小葉,肝実質にも壊死炎症反応が目立ち,巣状壊死が多発し,類洞内へのリンパ球,形質細胞浸潤があり,さらに高度の肝小葉炎を呈する例が多く,帯状壊死や架橋形成性壊死もみられる(図la)5).AIHでは肝細胞が標的組織であり,肝細胞の障害像に加え,再生像があり,肝炎性ロゼッタ形成が少なからず見られる
(https://core.ac.uk/reader/196712540)
・薬剤性の肝障害の頻度も多く、狭義のlupus hepatitisの検討は簡単ではないように思います。https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4130189/には lupus hepatitisの病理所見のレビューがありますが、何でもありな感じがしてそこまで参考にならなさそうです。
・SLEにおける肝機能障害はDeboisの記載が詳しいです。以下まとめます。
◯SLEの初期症状としての肝機能障害がありえる
◯原因は多岐に渡り、薬剤性もあり、疾患活動性にリンクするときもある
◯liver disease(LD)はAST・ALTが正常値の2倍以上と定義した場合に21%のSLEの患者で見られ、男性に多い
◯肝腫大や肝叩打痛はLFTsの異常に関わらず生じうる、しかも肝腫大してても組織は正常のこともある
◯Deboisは1953年に肝臓の血管炎を報告しているが、他に同様の報告はかなりすくない
◯SLEでの肝血管炎は15%程度に見られる、がその後同様の結果は再現されておらず、血管炎自体は極めて珍しく、一部で肝動脈瘤破裂と関連する
◯以下の5つの病態はaPLに関連
1)budd-chiari 2)HVOD 3)NRH 4)肝梗塞 5)フィブリン血栓による一時的な上昇
◯NRHは肝硬変なしのPHの原因になる、生検すると隔壁のないしかし平坦な肝細胞のつらなりに囲まれた多発結節が見られ、fibrocyte bandの所見が見られる、sampling errorの観点で可能ならedge biopsyを、MRIではT1WI高信号、T2WIでisoに見れるかもしれない
・またDeboisには”lupus hepatitis”について以下の記載があります。
◯SLEをきっかけに発症するlupus hepatisという病態が存在することは色々な意見がある◯lupus hepatitisは無症候性で、疾患活動性の改善とともに解決する
◯生検では孤立した壊死病変と門脈域周囲にリンパ球浸潤がある場合はlupus hepatitisが疑う所
◯活動性が高いほうが見られやすい(11.8% vs 3.2%)
◯多くは中等度の肝機能障害(76.6%はULNの5倍以下、19.1%は5倍を超える)、高ビリルビン血症は12.8%にしかみられない、肝炎を伴わないSLEと比較して、低補体や白血球減少は低下が多い
◯肝機能障害を伴う34のSLE患者で、16人はSLE関連hepatitisが、そのうち11人はリボソーマルP抗体が陽性、一方AIHの20人ではこの抗体は陰性、抗リボソーマルP抗体陽性とSLE関連hepatitsは関係があるのだろう、pathogenicと予想されている
◯ループス肝炎の10回の肝生検と他の肝疾患の16例を比較、C1qの沈着はlupus hepatitisの7/10に見られた、他の疾患では見られない
◯SLEのの464人中22人で4.7%にAIHの所見が見られた、他の慢性肝疾患の中ではSLEはかなり稀
・NRHについて簡単にKelleyにも記載があります。
・まれに結節性再生過形成がSLEに合併する。この疾患は、線維化の少ないびまん性の結節性肝炎を引き起こし、門脈圧亢進症を起こすことがある。結節性再生過形成は、一部の患者ではaPLの存在とも関連している。 バッド-キアリ症候群、肝静脈閉塞性疾患、肝梗塞などの肝血管障害が、特にaPLの設定において報告されている。
・個人的にはAPS合併SLEに”原因不明の腹水貯留で明らかな肝硬変の所見がない何をやってもよくならない”という例を2,3例みたことがあります。NRHによるPHは結構多いのかもしれません。
Myths: SLEの眼病変ではぶどう膜炎の頻度が高い。
Reality: Episcleritis and scleritis can occur in SLE. Uveitis is extremely rare.
・SLEの眼病変としてはDLEが下眼瞼や結膜に出現することがあるようです。
・SLEに限ったことではありませんが、GCによる中心性漿液性脈絡網膜症も頻度が多いようです。
Myths: SLEにおける血小板減少はITPと同様に免疫介在性の血小板破壊であることがほとんどである。
Reality: Mild thrombocytopenia is noted in as many as 50% of patients with SLE, but severe thrombocytopenia can also occur. Thrombo- cytopenia can be the result of immune-mediated platelet destruc- tion similar to immune thrombocytopenic purpura (ITP). The platelet IIb/IIIa antigen is the primary target. Thrombocytopenia can also be caused by a consumptive process such as TTP or splenomegaly. Anti-thrombopoietin antibodies have been found in the sera of some patients with SLE and have been correlated with lower platelet counts. Chronic, low-level thrombocytopenia is a characteristic feature of APS. Similar to AIHA, isolated ITP may predate the development of complete SLE by several years.
・軽度の血小板減少症はSLE患者の50%にみられるが、重症の血小板減少症も起こりうる。
・血小板減少症は免疫性血小板減少性紫斑病(ITP)と同様に免疫介在性の血小板破壊の結果である可能性がある。血小板IIb/IIIa抗原が主要な標的である。
・血小板減少症は、TTPや脾腫のような消耗性の過程によっても引き起こされる。
・抗トロンボポエチン抗体はSLE患者の血清中にみられ、血小板数の低下と相関している。
・慢性的な低レベルの血小板減少はAPSの特徴である。
・AIHAと同様に、孤立性ITPは完全なSLEの発症より数年先に発症することがある。
Myths: SLEにおけるリンパ節病理は非特異的な所見しか見られない。
Reality: Lymph node histopathology demonstrates reactive hyperplasia and varying degrees of coagulative necrosis. The presence of hematoxylin bodies is specific for SLE.
・リンパ節の病理組織学的には、反応性過形成とさまざまな程度の凝固壊死が認められる。ヘマトキシリン小体の存在はSLEに特異的である。
・稀にキャッスルマン病に見られるリンパ節病理所見が見られることもある。
・こちらが引用先です。https://pubmed.ncbi.nlm.nih.gov/10849316/
・21例のSLE患者のリンパ節を採取しています。そのうち6例はCastleman病様のリンパ節病理のようでした。Castleman病様のリンパ節病理がいかなるものかは読み取れません。Sjogren症候群ではTAFRO様の症状を起こす例があります。これはSLE/Sjogrenの亜型なのか、TAFROでたまたまANAなどが陽性となったととみなすべきか、悩ましいときがあります。
Myths: 抗核抗体の測定は間接蛍光抗体法以外には存在しない。
Reality: ANA is indirect immunofluorescence by using a human epithelial cell tumor line (HEp2 cell line). With this method, the ANA test is highly sensitive; it is positive in more than 95% of people with SLE. Nevertheless, the ANA can sometimes become negative in individual patients during the course of their disease and after therapy. Because of a desire for automation and cost savings, some laboratories use the enzyme-linked immunosorbent assay (ELISA) or multiplex assays as their method of testing for ANA. The ELISA and multiplex methods, however, are less accurate than the immunofluorescence method, resulting in a higher false-negative rate. Importantly, there is variation in the performance characteristics of different immunofluorescence kits, leading to varying rates of ANA negativity.
・ANAはヒト上皮細胞腫瘍株(HEp2細胞株)を用いた間接免疫蛍光法である。この方法ではANA検査は高感度で、SLE患者の95%以上で陽性となる。それにもかかわらず、ANAは個々の患者で、病気の経過中や治療後に陰性になることがある。
・自動化とコスト削減のため、一部の検査室ではANAの検査法として酵素結合免疫吸着法(ELISA)やマルチプレックス法を用いている。しかし、ELISA法やマルチプレックス法は免疫蛍光法よりも精度が低く、偽陰性率が高くなる。重要なことは、免疫蛍光キットの性能にばらつきがあり、ANA陰性率が異なることである。
・Assay variation in the detection of antinuclear antibodies in the sera of patients with established SLE, Ann Rheum Dis. 2018 Jun;77(6):911-913.ではSLEの診断がついた患者でIFAの3つの手法とELISAやmultiplexのassayで検討を行っています。IFでもばらつきはありますが、ELISAやmultiplexのassayの方が陰性率が高かったようです。
・ELISAやEIAはIFと比較して90%以上の精度があるようですが、90%の一致を低いと考えるか高いと考えるかは悩ましいところです。
・JCRのHPには以下のような説明があります。
◯ELISAでは膠原病に特異的な9種類の抗原(RNP、Sm、SS-A、SS-B、CENP-B、Scl-70、Jo-1、dsDNA、ssDNA、リボゾーマルP)に反応する抗体を検出します。FEIAではELISAの9種に4種の抗原(PM-Scl、PCNA、Mi-2、フィブリラリン)を加え、かつssDNAを除いた12種類の抗原に反応する抗体を検出します。
・個人的にはFEIAでの特異性はどうなのかと思いますが、IFも主観的な検査であることは間違いないので悩ましいところです。
Pearls: ANA陰性のSLEは報告はあるが、IF法でのANAが真に陰性となることは極めて稀である。
Comments: Although ANA negative SLE has been reported, it is very rare with the immunofluorescence method of testing. In those rare instances, other tests (e.g., anti-Ro/SS-A) usually confirm the presence of lupus-associated autoantibodies.
・先日どうしてもANA陰性SLEとしか言えない症例に遭遇しましたが、なんだったのでしょうか…
Pearls: LGLはSLEの症状に似ている。
Comments: Large granular lymphocytic (LGL) leukemia is a clonal disorder of large granular lymphocytes that mimics SLE because of its association with cytopenias (most commonly neutropenia), fevers, splenomegaly, positive ANA, and positive RF.
・大顆粒リンパ球性(LGL)白血病は大顆粒リンパ球のクローン性疾患で、細胞減少症(最も一般的なものは好中球減少症)、発熱、脾腫、ANA陽性、RF陽性を伴うことからSLEを模倣する。
・SLEと似ている、という眼でLGLを見たことはなかったです。どちらかというとAITLなどのT細胞性リンパ腫をmimicする気がします。
Pearls: 抗ヒストン抗体は薬剤誘発性ループスで95%以上陽性となる。
Reality: Anti-histone antibodies are present in more than 95% of cases of drug-induced lupus with the exception of those cases caused by minocycline.
・抗ヒストン抗体は、ミノサイクリンによる場合を除きdrug-induced lupusの95%以上に認められる。
・drug-induced LEでは被疑薬によっても少し症状が異なるようです。特に高齢者では注意しましょう。
◯ヒドロクロロチアジドは薬剤誘発性SCLEと関連している。
◯ミノサイクリンは時に抗dsDNA抗体や核周囲染色抗好中球細胞質抗体(P-ANCA)と関連◯TNF阻害薬は抗dsDNA抗体陽性になる
この記事が気に入ったらサポートをしてみませんか?
