筋膜と癒着・線維化プロセス
腹膜は、単細胞の被覆とその下にある結合組織からなる 2 層の組織で、腹腔の内側を覆い、胃腸管を含む腹腔内臓器を覆っています1。損傷(例:外科手術)または感染(例:憩室炎)がある場合、壁側腹膜と腹腔内臓器の内臓腹膜を接続したり、腹腔内臓器を互いに接続したりする癒着が形成されます。癒着は小腸閉塞の最大の原因であり、不妊症や慢性疼痛の原因となり、その後の手術を複雑にする可能性もあります。すべての開腹手術の 50 ~ 90% で術後に癒着が発生するため、毎年数億人の患者に影響を与える重大な臨床課題となっています。癒着の規模にもかかわらず、現時点では癒着の形成を防ぐ効果的な治療法はありません。
癒着の評価と管理に関する文献は全体的に限られています。さまざまな臓器系における線維症を調査した最近の研究では、JUNシグナル伝達が線維形成において最も重要であることが示されました。JUN は、VEGF、FGFR、PDGFR、TGFBR などのいくつかの既知の線維症関連経路を介してシグナルを伝達します。これらのよく知られた下流の線維症関連経路の阻害剤、たとえば MEK 阻害剤トラメチニブは、マウスにおける癒着形成の調節にある程度の効果を示していますが、癒着病態の上流の転写調節因子が何であるかは不明のままです。さらに、腹部癒着線維芽細胞は、関与する機能的不均一性を理解するために、単細胞レベルでの特徴付けがまだ行われていない。
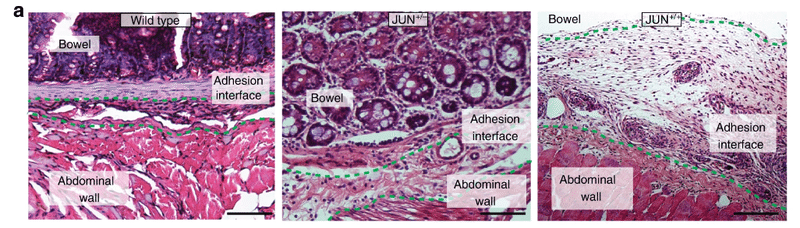
この研究では、癒着形成細胞の起源を調査し、癒着が主に内臓腹膜に由来することを生体内モデルを使用して示します。これは、腸の操作を伴う開腹外科手術後に癒着が最も重度になるという私たちの臨床観察と一致しています。バルクおよび単一細胞の RNA-seq を使用して、マウスとヒトの組織標本に由来する腹部癒着線維芽細胞間の遺伝子発現パターンと不均一性を調査します。これらのデータは、JUN が腹部癒着の状況における線維芽細胞の転写マスター調節因子であることを示唆しています。さらに、我々は、JUNがJAK - STATおよび上皮間葉移行(EMT)経路を介してシグナルを伝達し、接着線維芽細胞におけるPDGFRA発現の上方制御をもたらすことを示す。in vivo でJUNを抑制すると、癒着形成が劇的に減少します。JUNノックダウンをヒト初代接着線維芽細胞に適用すると、線維化促進性シグナル伝達、増殖、およびコラーゲン産生が大幅に減少します。私たちの発見は、抗JUN療法が臨床的に癒着を予防するのに効果的である可能性を示唆しています。
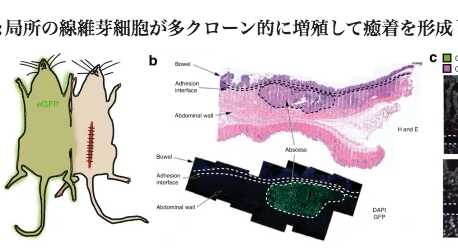
局所の線維芽細胞が多クローン的に増殖して癒着を形成する
我々は、癒着形成細胞には 2 つの考えられる発生源があると仮説を立てました。腹部手術の状況で活性化された局所組織常在細胞、または損傷後にその部位に動員された全身循環細胞です。これを調査するために、我々は、eGFP (ACTIN GFP ) マウスと並列配置された野生型マウスに癒着を作成しました。POD 14では、循環間葉細胞(GFP+)から接着界面への有意な寄与はないことが組織学的にわかりましたが、腹壁の近くに形成された腹壁の膿瘍ではGFP+細胞の密な寄与が見られました。サンプルの 1 つにおける接着界面を観察し、モデルをさらに検証しました。これらのデータは、接着形成細胞の主な供給源が局所組織であることを示しています。
接着線維芽細胞は主に内臓に由来します
臨床的に、癒着の形成は、腹腔鏡検査(多くの場合、壁側腹膜のみを損傷する)後ではなく、腸を操作する開腹術後に最も顕著です。これは、内臓 (腸壁) 腹膜が癒着形成の主な原因である可能性があるという考えを裏付けています。内臓腹膜由来の細胞と壁側腹膜(腹膜)由来の細胞のどちらが癒着形成においてより活発であるかを判断するために、腹壁移植手順を設計しました。すべての細胞が膜 (m) トマトを発現し、PDGFRA+ 細胞は m-トマトと GFP の両方を発現します。切除し、PDGFRA GFPマウスの腹壁に迅速に移植しました。次いで、天然の腸と移植された壁との間に癒着が形成された。POD 14では、接着界面の線維芽細胞の大多数はGFP+であり、壁側腹膜ではなく内臓腹膜に由来していた。これに関連して、ASMA発現はPDGFRA発現と密接に相関することが判明した。要約すると、腹部癒着は主に内臓腹膜に由来しており、よく知られた臨床所見を裏付けています。
JUNの機能調節が癒着形成を調節する
これらの発見を踏まえて、我々は、JUNシグナル伝達の機能的調節が癒着形成に影響を与えるのではないかと考えました。T-5224 は、選択的小分子 AP-1 阻害剤であり、さまざまな線維性病態で研究され、AP-1 誘発の初期および後期サイトカイン応答をブロックすることが示されています。マウス接着線維芽細胞におけるJUNシグナル伝達がT-5224(JUN阻害剤)を使用して抑制された場合、ホスホ-JUNおよびホスホ-STAT5の発現は、新たに単離されたマウス接着線維芽細胞を使用してインビトロで有意に減少した。
この阻害剤をインビボで腹腔内に適用した場合(野生型マウスおよびJUNマウス)、ホスホ-JUNおよびホスホ-STAT5の発現は有意に減少した。
全体として、この JUN 阻害剤の適用により癒着形成が劇的に減少することがわかりました。組織学的には、JUN 阻害により癒着は大幅に薄くなり、線維化も少なくなりました 。このモデルでは、JUNとPDGFRAの共抑制が確認され、JUN阻害剤の適用によるJUN発現の減少は組織レベルで有意でした。
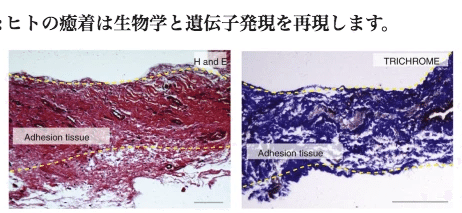
ヒトの癒着は生物学と遺伝子発現を再現する
次に、ヒトの腹部癒着におけるこれらの結果を調査しました。以前に1つ以上の腹部外科手術の履歴がある患者から24個の癒着組織標本を収集し、以前に手術を受けていない患者から10個の対照腹膜標本を収集しました。ヒトの癒着は組織学的に、H&E 上のマウスの癒着に似ています。JUNは、マウス組織で見られるものと同様に、ヒト接着組織でも発現される。
要約すると、腹部癒着は何百万もの患者にとって大きな医学的問題となっており、効果的な治療選択肢が必要とされています。この研究では、マウスとヒトを対象に、in vivo での腹部癒着生物学を組織、トランスクリプトーム、タンパク質レベルで並行して系統的に調査しました。われわれは、JUN発現が腹部癒着の初期促進因子であり、 JAK - STAT 、EMT、 PDGFRA発現など、線維症を引き起こすことが知られているいくつかの経路のシグナル伝達を上方制御することを発見した。マウスとヒト組織の両方において、JUN、PDGFRA、ASMA、およびFSP1の発現に基づいて単離できる接着線維芽細胞の正体を解明しました。
接着は局所の線維芽細胞によって形成され、傷害後に多クローン的に増殖することから、この臨床現象には前駆体型細胞の活性化が関与していることが示唆されます。我々は、腹壁移植のモデルを開発し、癒着線維芽細胞集団が主に内臓腹膜に由来することを示し、癒着が腸の操作を伴う開腹手術の後に最も顕著であるという臨床外科での観察を裏付けた(腹腔鏡検査では頻繁に腹膜移植のみが行われる)。壁側腹膜が影響を受けます)。私たちの腹壁移植モデルに関連する制限の 1 つは、移植されたポーションへの血液供給が移植によって中断されるため、移植は皮膚移植と同様に、移植後の最初の 48 時間は血漿吸収に依存することです。
筋膜が筋骨格のダイナミクスに影響を与える可能性
運動器系のより個別の要素(筋肉、骨、椎間板、靱帯など)と比較すると、一般に筋膜と呼ばれる袋状または平面状のコラーゲン結合組織構造は、筋骨格研究ではあまり注目されていません(Grimm、2007 ; Guimberteau) et al.、2010 ; Kwong および Findley、2014)。最近の研究では、筋力学における必須の力伝達物質としての筋膜の役割が詳しく説明されています ( Stecco et al., 2006 , 2009 ; Huijing, 2009 ; Maas and Huijing, 2012 ; Pavan et al., 2015 ; Krause et al., 2016 ) 。しかし、筋膜は通常、筋骨格系の生体力学においてのみ受動的な役割を果たすと考えられている比較的不活性な組織であると考えられています。
この一般的な仮定とは対照的に、積極的に収縮する固有の能力により、筋膜のより積極的な役割を示す散発的な兆候があります。これらの兆候には、 in vitro での等尺性緊張の繰り返し適用に応じたヒト腰部筋膜の「靱帯収縮」の報告された現象( Yahia et al., 1993 )、ヒトの下腿筋膜における平滑筋様の外観を有する点在細胞の存在の文書化が含まれます。
手掌線維腫症、レッダーホースモルバス、肥厚性瘢痕、および同様の筋膜線維症状態などの特定の病状において、筋膜組織が数日以上の時間枠で短縮する能力についての十分な証拠が存在する( Desmoulière et al., 2005 )。一般に、これらの病理学的状況で観察される組織の短縮と硬化は筋線維芽細胞(MFB)によって引き起こされ、その結果生じる組織の拘縮は、細胞の収縮、コラーゲンの架橋、およびスリップとマトリックスのリモデリングの段階的な組み合わせによって達成されると考えられています。したがって、刺激後数分間の時間枠内で観察される活性な組織収縮が、これらの病理学的組織のいくつかで薬理学的刺激に応答してインビトロで首尾よく記録されたことは驚くべきことではない( Hurst et al., 1986 ; Naylor et al. , 1986)。ら、1994 ; Irwin ら、1997 ; Raykha ら、2013 ; Türker ら、2013)。
MFB の発見後の最初の数年間は、これらの細胞は主に病理学的状態の指標として考えられていましたが、その後の研究により、正常な (すなわち、非病理学的) 靱帯 ( Murray および Spector、1999 )、腱 ( Ralphs)にもそれらの細胞が存在することが明らかになりました。他のいくつかのコラーゲン結合組織(Tomasek et al ., 2002 )などである。それにもかかわらず、正常な筋膜における収縮特性の研究はほとんど行われていない。Hinzらによるラットの筋膜片の少量サンプルを用いた予備調査。(2001) は、MFB が存在せず、この組織ではin vitro収縮を誘導できないことを示唆しました。一方、他の研究では、ヒト深部筋膜におけるMFBの存在( Bhattacharya et al., 2010 ; Dawidowicz et al., 2015 )と、インビトロでの薬理学的MFB刺激に応答したラット筋膜の測定可能な組織収縮( Irwin et al., 1997)が記載されている。 ; Pipelzadeh および Naylor、1998 ; Schleip et al.、2016 )。
人間の筋膜組織における筋線維芽細胞の存在
MFB の存在を示す ASMA 応力線維束が、検査されたすべてのヒト組織で見つかりました 。細胞密度は体の部位間で大きく異なりました [ H (2) = 14.0、p < 0.01]。人間の腰部筋膜 [中央値 1.52% (IQR 0.17 ~ 4.89%)、n = 12] では、人間の足底筋膜および大腿筋膜 [0% (0 ~ 0%、 n = 12)よりもかなり高いことが判明しました。11、p = 0.003) 対 0% (0–0.03%、n = 12、p = 0.003)]。ラット標本と比較した場合、ヒト腰部筋膜の密度は統計的に高くなる傾向を示しました ( p = 0.059、ヒト腰部筋膜中央値 1.52%、IQR: 0.16 ~ 5.58%、ラット腰部筋膜: 0.95%、IQR: 0.01 ~ 0.40%)。
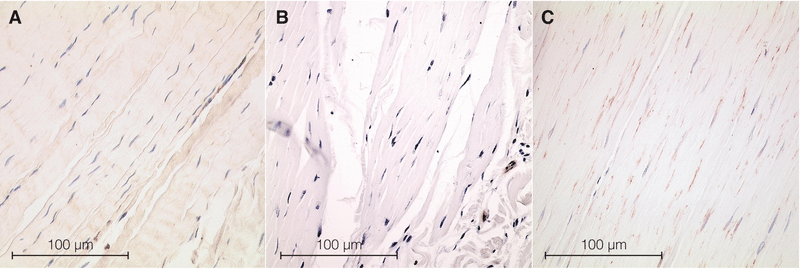
ヒトの腰部筋膜サンプル内では、30歳未満のドナーと比較して60歳以上のドナーの密度が高い(中央値4.40%(IQR 0.36~6.38%)、n = 5)ことから、高齢のドナーではMFB密度が高くなる傾向があった。年 [中央値 2.26% (IQR 1.12 ~ 6.65%)、n = 3] ですが、この傾向は有意ではありませんでした。一致して、ヒトの腰部筋膜における MFB 密度とドナーの年齢との間の全体的な相関関係は有意ではありませんでした。他の 2 つのヒト組織領域内またはすべてのヒト組織内では、年齢に関連した傾向は認められませんでした。ラットの腰部筋膜サンプル内では、MFB 密度と年齢の間に中程度の正の相関関係があり ( r s = 0.60、p < 0.007)、これは、150 日を超える年齢の動物では MFB 密度が高くなる傾向にも表れていました [中央値 1.67% (IQR 0.46% ~ 2.92%)、n = 6] は 100 日未満の患者 [中央値 0.03% (IQR 0.00 ~ 0.09%)、n = 11] と比較しましたが、この差は有意ではありませんでした。観察レベルでは、筋周膜に高 MFB 密度領域が頻繁に存在するという驚くべき傾向が認められました。
人間の筋骨格のダイナミクスに対する潜在的な影響
関連する筋外筋膜の CSA は 199 平方mm であることがわかりました。傍脊椎筋肉内筋膜の CSA (脊柱起立筋、腰筋、腰方形筋から; 筋肉 CSA の合計は 12140 mm 2 )によって補完され、すべての筋肉内および筋外筋膜の合計 CSA は 1413 mm 2になりました。我々のメカノグラフィック力記録(TGF-β1に対する力反応中央値)で観察された最大収縮力と組み合わせると、0.95 Nの仮説上の収縮力が得られました。
2 番目の計算モードでは、潜在的な収縮力の基礎として MFB の細胞密度を使用しました。ここで、我々は、上で報告した人間の腰部筋膜における ASMA 密度の中央値に相当する167 細胞/mm 2という推定 MFB 密度を発見しました。あるいは、腰部筋膜で観察された ASMA 密度が最も高い人の細胞 MFB 密度は 454 細胞/mm 2であると推定されました。これらの密度に基づいて、我々の調査で判明した腰部筋膜の MFB 密度の中央値として 0.97 N、最大 MFB 密度として 2.63 N の予測収縮力が導出されました。
これらの予測された力はどれも、機械的関節の安定性に影響を与える閾値を超えていません ( Cholewicki と McGill、1995 )。しかし、これらの予測された力の値はすべて、機械感覚刺激のはるかに低い閾値を上回っています。
筋膜組織におけるMFBの存在
我々の研究の免疫組織化学的所見は、さまざまな筋膜組織における収縮細胞、すなわちMFBの存在の証拠を提供する。それでも、関連する密度は、検査した組織間でかなり異なるようです。我々の検査で使用した他のすべてのヒトまたはマウスの組織源と比較して、ヒトの腰部筋膜におけるMFBの密度の増加は、ヒトの腰部領域における筋膜性疼痛の有病率との関連の可能性を示唆している( Furlan et al., 2012 ; Edwards et al., 2012) al.、2017)。実際、ヒトの腰部の結合組織に微小損傷が存在し、その結果生じる他の下流の影響に加えて神経筋の調整が損なわれることが、腰痛の一部の症例に対する新たな説明として示唆されている(Panjabi, 2006 ; Langevin and Sherman, 2007 ; Willard et al.、2012 ; Karayannis et al.、2016 )。人間の腰部筋膜における明らかに侵害受容性の神経終末の発見により、その可能性がさらに裏付けられる( Tesarz et al., 2011 ; Mense and Hoheisel, 2016 )。さらに、慢性腰痛患者では健康な対照者と比較して胸腰のせん断運動が減少していることが報告されている( Langevin et al., 2011 )。我々の研究でヒトの腰部筋膜で観察されたMFBの密度は、おそらくヒトの腰部筋膜における(微小)損傷の発生の増加と関連する細胞修復プロセスに関連している可能性があります。我々の組織学的検査には、腰部筋膜、足底筋膜、および大腿筋膜のみからの筋膜組織切片が含まれていたことに留意すべきである。これらの限られた組織領域の選択は、私たちの研究グループのアクセスオプションの影響を受けました。したがって、今後の研究では、より大きな地域変動から異なる筋膜間の潜在的な地域 MFB 密度の違いの調査を含めることは興味深いでしょう。
この研究で予想外に観察された、筋周膜におけるMFBの密度の明らかに増加したことは、臨床的に重要である可能性がある。食品科学では、肉の靭性は筋周膜の厚さと相関しており ( Bendall, 1967 ; Rowe, 1974 )、最近では老化と筋周膜の組織の複雑さの増加が並行していることが判明しています ( Mikkelsen et al., 2017 )。筋周膜のコラーゲン密度の増加は、より位相性の筋肉では密度が低いのとは対照的に、緊張性筋では観察されているため(An et al., 2014 ; Roy et al., 2018)、これは、関連する筋周膜の硬化が実際に筋膜に寄与している可能性があることを示唆しています。例えば、人間の脊柱起立筋、特に深層多裂筋の緊張性 ( Mannion et al., 1997 ; MacDonald et al., 2006 )。さらに、筋膜の硬さの増加に関連するいくつかの筋膜病理は、筋周膜の変化に関連しています(Williams and Goldspink, 1984 ; De Deyne et al., 2000 ; de Bruin et al., 2014)。対照的に、記載されているこれらの変化は筋内膜では見つかっていません。同様に、加齢は速筋線維の割合の減少、および筋周膜の厚さの増加と関連する傾向があります ( Nishimura, 2010 ; Csapo et al., 2014 )。私たちの調査で部分的に観察された、高齢患者の筋膜MFB密度が高くなる傾向が一般的に確認できるかどうかを、より大きなサンプルサイズでの将来の組織学的研究を通じて調査することは興味深いでしょう。もしそうなら、この増加は前世の筋膜組織の(微小)損傷の総量の増加と関連しており、それが影響を受けた組織のMFB密度の増加を誘発する可能性があるかどうか。つまり、我々の現在の発見は、MFBの細胞密度と活性がこれらの組織変化に寄与する役割を果たしている可能性があることを示唆しています。
同様に、筋周膜に関する我々の発見は、Stecco らの仮説に興味深い視点を加える可能性があります。(2013) - 筋紡錘の感受性は、紡錘体被膜の大部分が埋め込まれている筋周膜結合組織の硬さに影響されるということ ( Maier、1999 ; Boyd-Clark et al.、2002 )。α運動ニューロンの活性化に対する紡錘体由来の機械感覚の影響に基づいて、この相互作用は活発な筋緊張に寄与している可能性があります ( Giuriati et al., 2018 )。この概念によれば、いくつかの筋筋膜性疼痛症候群は筋周膜の硬さの変化によって影響を受ける可能性があります ( Stecco et al., 2016 )。私たちの発見は、MFB の存在と活動がこの相互作用の重要な要因である可能性があることを示唆しています。
私たちの予想に反して、私たちのデータは、MFB 密度に対する年齢と性別の重大な影響を示していません。これが本当であれば、高齢者の側頭領域で観察される筋膜硬化(Trindade et al., 2012)は、むしろ結合組織構造の変化、コラーゲン架橋の形成、または水和状態の変化に起因する可能性があります。しかし、我々の組織学的検査には広い年齢範囲(17~91歳、n = 31)が含まれているため、それぞれの解釈を制限する要因と見なされるべきである。性別の役割に関しては、私たちのサンプルが主に男性の献体者から得られたものであることを強調しておく必要があります。したがって、年齢と性別の潜在的な影響、およびMFB密度の修飾因子としての他の要因の影響を最終的に特定するには、追加の研究が必要です。身体活動の程度と筋肉量は 2 つの重要な候補であり、どちらも収縮細胞の数と正の相関がある可能性があります ( Szczodry et al., 2009 )。
筋膜組織の収縮挙動
ラットを使ったメカノグラフィー測定では、いくつかの物質に対する収縮反応が示されました。興味深いことに、私たちの検査での力の登録により、同じ物質で刺激した場合でも、筋膜組織には大きなばらつきがあることが明らかになりました。これは、組織学的検査で見つかったMFB密度の同様の大きな変動の所見と一致すると思われます。
我々は、これら 2 つの特徴が互いに関連していること、つまり、MFB の局所密度が、観察された組織収縮の背後にある駆動因子であると思われることを示唆しています。これは、試験した組織サンプルに MFB 細胞がまったく含まれていない、またはごくわずかしか含まれていない場合、反応において収縮力がまったく発現されないか、または非常にわずかしか示されないのに対し、MFB 密度が高いサンプルでは明確な収縮反応が観察されたことを意味します。私たちの検査では、少数の反応者組織サンプルと「非反応者」組織サンプル ( n = 7) の比較しかできませんでしたが、この比較から報告された予備結果は、将来的には同様の検査が有用であり、保存しておく価値があることを示唆しています。その後の免疫組織化学分析のために、 in vitro収縮試験から得られたすべての使用済み組織サンプルを評価します。
TGF-β1 に応答して我々が観察した組織収縮は、この物質が MFB を用いた細胞培養検査や瘢痕組織における収縮剤として成功していることを考えると、驚くべきことではありません ( Hinz et al., 2012 )。私たちの知る限り、これは正常な筋膜組織の収縮反応を誘導する能力を示す最初の実験結果です。細胞培養物中での TGF-β1 に応答した収縮力のほぼ直線的な増加が、物質添加後の最初の 20 時間にわたって実証されています ( Brown et al., 2002 )。これはおそらく最大 6 倍高い収縮力 (我々の測定で使用した 3 時間と比較して) を示唆している可能性がありますが、時間の経過とともに同様の力の増加が in vitro および in vivo の巨視的組織にどの程度存在するかを解明するにはさらなる検査が必要です。TGF-β1発現に対する交感神経系のシグナル伝達の影響が報告されている( Bhowmick et al., 2009 ; Liao et al., 2014 )ことを考えると、我々の発見はおそらくStaubesand and Li (1996 , 1997 )の仮説を支持する可能性がある。筋膜の硬さと交感神経の活性化の間には密接な関係があります。腰痛における心理社会的要因の大きな寄与を考慮すると ( Yang et al., 2016 ; Burgel and Elshatarat, 2017 )、これは将来の研究の興味深い方向性を示していると思われます。
筋骨格系のダイナミクスへの潜在的な影響
生体内での潜在的な収縮力の計算では、所定の閾値 18.2 N を使用した場合、人間の脊椎の機械的関節の安定性に直接的な短期効果 (つまり、数分から数時間以内に発生) を及ぼすには不十分と思われる力の範囲が予測されます。Cholewicki と McGill (1995)による、方向付けとしての中立的な立位姿勢での脊椎座屈の予防に関するもの。筋膜組織の潜在的な短期収縮力は、(同等の CSA の)筋肉組織の収縮力よりも少なくとも 2 桁低いため、身体に直接的な機械的影響を最小限に抑えることができることは明らかです。したがって、活発なMFB収縮は脊椎の安定性や人間の生体力学の他の重要な側面に重大な影響を及ぼさない可能性があると実際に考えられます。
それにもかかわらず、我々が予測した人間の腰部の筋膜収縮力は、機械感覚に影響を与えるためのはるかに低い閾値を上回っています。シェーランダーらによると、機械感覚の変化は、筋肉の調整と関節の機能的安定性の反射制御を修正できる可能性があります。したがって、筋膜の短期的な硬さの変化は、おそらく神経筋の調整に影響を与えるのに十分である可能性があることを示唆しています。交感神経系活性化の変化やサイトカイン発現の変化などにより、筋膜の硬さが一時的に増加すると、固有受容や調整の精度が変化したり混乱したりする可能性があり、これが損傷や亜不全損傷の可能性に寄与する可能性があります。 (パンジャビ、2006 ; Tong et al.、2017 )。
私たちは、筋膜収縮性の局所的および/または一時的な増加も、マトリックスリモデリングを含む長期的な組織拘縮に寄与する可能性があることを示唆しています。これは、この細胞型の最初の説明 ( Gabbiani et al., 1971 )以来の MFB 生物学の理解の進歩に基づいています。特に、古典的な平滑筋とは異なり、MFB は比較的長期間持続する Rho/ROCK/ミオシン軽鎖ホスファターゼ経路依存性の収縮活性を発揮し、最終的には永久的な組織拘縮をもたらすことが示されています ( Bochaton-Piallat et al., 2016年)。MFB収縮のロックステップラチェットモデル( Tomasek et al., 2002 ; Follonier Castella et al., 2010 ; Hinz, 2013 )に基づくと、組織の硬化は単一のMFB細胞の収縮とその後の分泌された細胞外マトリックス分子による組織の安定化によって引き起こされます。 。これは、長期にわたる強力な RHO 依存性および ROCK 依存性の MFB 収縮がコラーゲン原線維の弛みを生成する一方、同じ細胞の弱くて短い範囲の連続的な微小収縮 (Ca 2+ ) がそのような弛緩した原線維を再構築する漸進的なプロセスとして起こります。その後、おそらく局所コラーゲンの消化、新しいコラーゲン原線維の沈着、および架橋によって、新しい原線維の構成がさらに安定化されます。
このメカニズムの複合作用により、月に約 1 cm の重度の組織拘縮 (例、五十肩またはデュピュイトラン拘縮) が発生する可能性があります ( Follonier Castella et al., 2010 )。これは、MFBの密度の違い(たとえば、私たちの研究で調査されたような)と、交感神経の活性化または他の生化学的要因の慢性的な変化が、運動ニューロンの調整に影響を与える短期的な変化を引き起こす可能性があるだけでなく、神経系への長期的な影響にも寄与する可能性があることを示唆しています。健康的によく調節された硬さの適応と病的な拘縮の形態です。
腰の安定性に関する考慮事項
人間の腰部筋膜における MFB 密度の増加に関する我々の発見と、これらの仮説的な力の計算は、観察された腰部筋膜の硬さの小さな変化が、背部の安定性と腰痛の一因となっている可能性があることを示唆しています。人間の胸腰筋膜のさまざまな層は、体幹の安定性に大きく寄与することが示されています ( Vleeming et al., 1995 , 2014 ; Willard et al., 2012 )。胸腰筋膜の後層の超音波検査では、慢性腰痛患者においてこの筋膜組織の厚さが増加し、せん断運動が減少していることが示されました(Langevin et al.、2009、2011)。以前の研究では、五十肩で見られるものと同等の増加したMFB密度を有する腰痛患者の腰部筋膜切片の2つの例がすでに実証されている( Willard et al., 2012 )。筋膜の特性と腰の安定性および腰痛の間の潜在的な関係を明らかにするには、さらなる研究が必要です。MFB および追加の生化学的因子の存在に関するヒト腰部筋膜生検の分析 ( Klingler et al., 2014 ) は、この方向での貴重な検査経路として機能する可能性があります。
この記事が気に入ったらサポートをしてみませんか?
