
Nephrology Secrets, Chapter 73 DYSNATREMIAS
N. Winn Seay and Arthur Greenberg
1. What are dysnatremias?
「dysnatremias」は血漿Na濃度の異常がある場合に使用される.血漿Na濃度の変化は、細胞内外の区画の間で、水分がシフトすることで起こる.健康な状態では、体の浸透圧調節システムにより、血漿Na濃度は135-145mEq/Lに保たれる.このシステムの障害により、自由水の摂取と排泄のバランス異常を生む(baget).自由水の摂取が排出を超える場合に、血漿Na濃度が135以下になり、低Na血症の状態である.一方、高Na血症は145mEq/L以上と定義されるが、電解質freeの水の排泄が、摂取を上回ると起きる.一般的ではないが(less commonly)、水のバランスの障害がない状態で、純粋なNaの喪失や負荷によっても、低Na血症や高Na血症が起こるかもしれない.
2. How is plasma osmolality determined?
血漿浸透圧は以下の式で計算される
(2*[Na+] (mEq L)+blood urea nitrogen (mg dL)/2.8+glucose(mg dL) 18 = Plasma osmolality (mOsm kgH2O)
式に示されるように、血清Naは血漿浸透圧の主な決定因子である.血漿浸透圧は浸透圧計を用いて直接測定される.もし計算された浸透圧値と測定された浸透圧値の間に10mOsm/kg H2O以上解離がある場合、浸透圧ギャップが存在し、測定されない溶質の存在が示唆される.
3. Can osmolality be normal despite an abnormal serum sodium concentration?
血清Na濃度は普通、希釈サンプルを用いて間接イオン選択性電極を用いて測定される(これは水が血漿の93%を占めるという仮定に基づいている).しかし、血漿に脂質や蛋白が高濃度に存在する場合、血漿量に対する水分の割合が減少する.結果として測定される血清Na濃度は偽性低値を示す.この状況は偽性低Na血症と言われる.超遠心を行い、脂質層を分離することで脂質異常によるlab artifactを補正することができる.直接イオン選択性電極は、高脂血症や高蛋白血症により邪魔されないが、この手法による分析装置は全体の1/3で使用されているのみである.血液ガス装置はイオン選択性電極を用いており、このartifactの影響を受けない.
4. Is plasma osmolality the same as plasma tonicity?
NO、血漿の高張度は高浸透圧を示すが、高浸透圧の血漿は必ずしも高張度ではない.有効浸透圧(血漿の張度と呼ばれるが)は、細胞膜を通して自由に移動しない血漿中の溶質の濃度を指す.そのような溶質が、細胞膜間で濃度の差を生み、細胞の区画の内外で水の移動を誘導する.Naとグルコースが有効浸透圧物質として張度に貢献し、尿素とエタノールは非有効浸透圧物質であり、細胞膜を自由に移動する.後者の物質の濃度が高いと高浸透圧となるが、張度には影響しない.エタノールや他の予期されない物質が存在しない場合、有効浸透圧は測定された浸透圧から、BUN(mg/dL)/2.8を引いた数値となる.
5. In what states of tonicity and osmolality can dysnatremias occur?
Naは有効浸透圧物質なので、高Na血症は高浸透圧、高張度の状態である.しかし低Na血症は、様々な浸透圧と張度の状況で起こる.
6. In what hyponatremic states can a patient be hyperosmolar or hypertonic?
高浸透圧性低Na血症に関連する2つの状況は、高尿素窒素血症と高血糖である.腎機能障害がある場合に、窒素に由来する老廃物=尿素が蓄積すると、血漿浸透圧が上昇する.腎機能障害単独では血清Na値の変化をもたらさない.しかし、低Na血症につながる水バランスの障害が同時に存在する場合、血清浸透圧が正常または上昇した低Na血症が結果として起こるかもしれない.そのような患者では真に低張度である一方で(有効浸透圧物質であるNaが減少することで、張度が低下する)、尿素は非浸透圧物質であるので(細胞膜を自由に移動できるので)張度を上昇させない.
高血糖では、血糖値が上昇すると有効血漿浸透圧が上昇し、高張度の状態になる.高張度になると、細胞内から細胞外に水を引き込み、血清Na値は低くなる.血糖値が正常値から100mg/dLずつ上昇すると、高血糖による張度の上昇により、血清Na値は1.6mEq/Lずつ低下する.著明な高血糖の場合(血糖値>400mg/dL)は血糖値100mg/dL上昇するごとに、血清Na値は2.4mEq/L低下する.同様のプロセスはマンニトールの投与でも起こる.
7. What causes hypotonic hyponatremia?
低張性低Na血症の様々な原因があるが、3つの一般的なプロセスがある
1. 溶質摂取不足
2. 電解質のない水の過剰摂取
3. 電解質のない水の保持
2と3が併存することは稀ではない
8. What are the clinical manifestations of hyponatremia?
全ての低Na血症の患者に症状があるわけではない.ニューロンは浸透圧ストレスに特に感受性が高いが、アストロサイトを介する細胞外液(ECF)への電解質の放出が2-3時間で起こり、その後24-48時間にわたり有機浸透圧物質(タウリンやグルタミン)を放出することで細胞内浮腫を防ぐ.故に48時間かけて血清Na濃度125-135mEq/Lになった患者では症状がほとんどないか全くない.しかしながら、観察研究ではたとえ軽度の低Na血症(130-134mEq/L)でも院内死亡率の上昇、転棟、骨密度の低下と関連すると報告されている.他の研究では、血清Na値の軽度の低下がある場合、運動機能や歩行機能の低下と関連すると報告されている.認知機能の低下、歩行の不安定、転倒の増加、骨粗鬆症は、骨折の発症に関連する「最悪の事態=perfect storm」である.血漿Na濃度の急激な低下(48時間以内で125-134mEq/L)は、細胞内の溶質の代償的な喪失より進行が早いので、高張状態の細胞内区画が浸透圧性に水を吸収する.この細胞浮腫は、強固に覆われた頭蓋内の拡張に限界があることをふまえ、特に脳に影響を与える.このように、低Na血症の症状は主に神経学的なもので、嘔吐、嘔気、倦怠感、頭痛、傾眠、筋痙攣などがある.重症例では、痙攣、昏睡、テント切痕ヘルニア、神経原性の肺水腫が起きる.
1. What is the initial diagnostic approach to hypotonic hyponatremia?
有効浸透圧が275mOsm/kg以下であることが確認された後に、尿浸透圧を見ると、腎臓から電解質freeの水を吸収しているかの評価に役立つ.CKDがない場合、100mOsm/kg以下の尿浸透圧は、正常の希釈能力であることを示唆し、最大限に電解質を含まない水を排泄していることを示す.逆に100mOsm/kg以上であれば電解質を含まない水の吸収が起きている=これは張度の観点から見ると不適切である.CKD患者では尿を最大限に希釈する能力に障害があり、尿浸透圧が200mOsm/kg以下であれば最大の自由水の排出が行われていると考えられる.低Na血症の診断アプローチはFig. 73.1に示される.
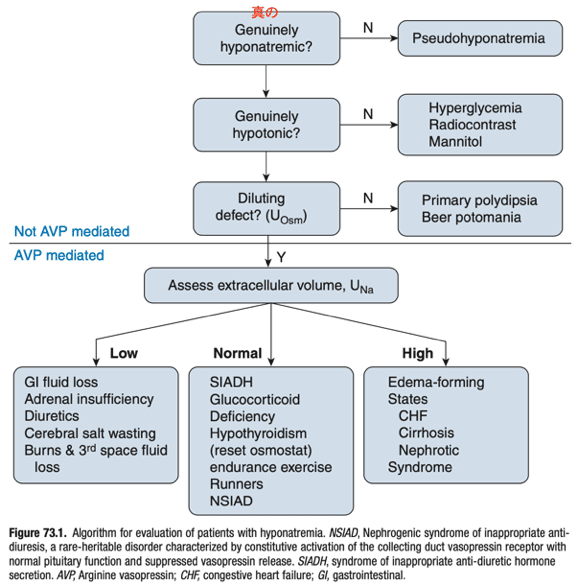
10. How is hypotonic hyponatremia with dilute urine further assessed?
尿が最大限に希釈されていたら、下垂体-腎臓系は期待されるように機能しており、低張性低Na血症は、腎が排泄できる量を超える電解質を含まない水の摂取により起こると考えられる.典型的な西洋食では、摂取した電解質とタンパク質に由来する約800mOsmの溶質が日々消費または生成され、尿に排泄される.最大尿希釈能が50mOsm/kg H2Oであることを考慮すると、そのような溶質の負荷(800mOsm)は最大16Lの尿の排泄を可能にするのに十分である.もし電解質を含まない水をこの限界を超えて摂取すると、腎臓の電解質freeの水の排泄能力を超えてしまい、低張性低Na血症が出現する.この状況は心因性多飲症として知られ、典型的には精神疾患の患者で起こる.溶質の摂取が不十分の場合、自由水の排泄に障害が起こる.もし溶質の摂取が200mOsm/日に減少するときや、尿素産生につながるタンパク質摂取が減少する場合(tea and toast食やBeer potomania)、腎の最大希釈尿の量は4Lまで少なくなる.この量(4L)を超える水摂取は比較的容易に可能で、結果として低Na血症を引き起こす.
11. What causes hyponatremia with concentrated (less than maximally dilute) urine?
電解質freeの水の吸収.水吸収はバソプレシン(ADH)が、集合管主細胞のbasolateral membrane(側基底膜)のバソプレシン2レセプターに結合することによって仲介される.バソプレシンの結合により、アクアポリン水チャネルがluminal membrane(尿細管側)に挿入される.その後水はアクアポリンチャネルを通して細胞内に流入し、basolateral membraneに存在する活性化したアクアポリンチャネル(AQP3や4)を介して、高張な髄質間質へと運ばれる.ADHの放出は視床下部の浸透圧受容体により調節される.普通、血清Na値が135mEq/L以下になると、バソプレシン分泌が抑制される.しかし、有効循環容量が低下している時、-頸部の容量受容体で動脈圧の低下を感知され-浸透圧性には抑制されているにもかかわらず、ADHの分泌が強力に刺激される.Hypovolemiaの状況での低Na血症は、循環動態により刺激されたADHの作用によって起き、容量の保持により改善する.動脈の充満不全(arterial underfilling)の状況下でのADH分泌は、心不全の場合のlow output stateか肝硬変における内臓の血管拡張によって起きるが、同様の循環動態障害の機序によって起こる.これらの患者は診察では、逆にhypervolemeの所見を示す.彼らは体内の総Na量が明確に過剰なのにも関わらず、低張性低Na血症になる.
12. How is hypervolemic hyponatremia managed?
Hypovolemic低Na血症とは異なり、hypervolemic低Na血症(心不全か肝硬変による)の治療の中心は水制限である.ループ利尿薬も心不全に関連した低Na血症には有効である.ヘンレの上行脚でのNaの再吸収を阻害することにより、ループ利尿薬は髄質の張度を下げ、集合間でのADHを介した水吸収の駆動力を低下させる.(サイアザイドは、皮質の遠位尿細管に働き、水とは関係なくNaが吸収される場所でNaの再吸収を阻害する) さらに(サイアザイドにより)高張度の髄質間質が作り出されることで、電解質freeの水吸収が持続的に行われる状態になる.そのようにサイアザイドは低Na血症を誘導する.)水吸収とループ利尿薬で治療がうまくいかない場合、バソプレシン受容体阻害剤であるバプタンが有効である.コニバプタン(非選択性V1/V2アンタゴニスト)とトルバプタン(V2アンタゴニスト)は軽度から中等度の有症状の低Na血症を伴う容量負荷にある心不全患者で水利尿を促進する.コニバプタンは、肝硬変患者で用いる場合、(V1 pressor 受容体の阻害効果による)低血圧と内臓出血のリスクが理論的に高まるので注意すべきである.トルバプタンは肝障害のリスクのため肝硬変の患者に禁忌になる場合がある.他の副作用として口渇と口腔乾燥がある.
13. What etiologies give rise to euvolemic hyponatremia with less than maximally dilute urine?
最大希釈尿になっていないEuvolemicな低Na血症の最も多い病因は、SIADHである.他の原因として、運動に関連した低Na血症(EAH)、MDMAやecstasyの摂取、甲状腺機能低下症、副腎不全がある.EAHは典型的にはマラソンランナーで観察され、非浸透圧性のADH分泌による水排泄障害と、水摂取が多いことが合わさった水過剰状態である.MDMAはセロトニン経路を活性化することでADH分泌と多飲を促進し、急性で重症の低Na血症を引き起こし、適切に対処しないと死に至ることもある.機序は完全には解明されていないが、重度の甲状腺ホルモン不足はcardiac outputと末梢血管抵抗を低下させるので、非浸透圧性のADH分泌とそれに伴う低Na血症の原因となる.コルチゾールはADH分泌を抑制するので、グルココルチコイド単独欠損はバソプレシンが抑制されず低Na血症になることがある.
14. What is the SIADH?
SIADHは浸透圧性または循環動態による刺激がない状況下でのADHの分泌をいう.他の低Na血症の原因として、副腎不全、心不全、肝不全、甲状腺機能低下症、進行した腎障害、利尿薬(通常サイアザイド)を除外すべきである.CHFと肝硬変の患者は、張度が低いにもかかわらずADH分泌が持続するが、腎不全と同様に慣例により(SIADHの診断から)除外される.SIADHの患者は古典的に、張度が低く、循環血液量が正常で、尿浸透圧>100mOsm/kg H20.尿浸透圧は血清浸透圧より必ずしも高い必要はないが、最大希釈尿より高い必要がある.ADHによる水の保持による中等度の血管容量の拡大により、RAAS系の活動とNa再吸収が低下する.普通の食事摂取をしていると考えられる場合、尿Na濃度はSIADHにより30mmol/L以上になっている.さらに血清尿酸値は尿中への尿酸塩排泄増加を反映して4mg/dL以下になる.BUNとCreは正常下限か正常になる.正常上限やBUNの上昇は、体液量低下(voleme depletion)や有効動脈容量の低下を示唆する.バソプレシン値を測定することは、一般的に有用性が限られる、よって尿浸透圧がADH活性の代用となる.さらにADH値はhypervolemicかhypovolemicな低Na血症の患者でも上昇するので、これらの疾患の区別はできない.SIADHは悪性腫瘍、肺疾患、中枢神経疾患など様々な要因で起こる.多くの薬剤、ほとんどのSSRI、麻薬、抗精神病薬がSIADHを起こしうる.
15. How is SIADH managed?
SIADHは原因となる疾患が取り除かれれば解除されるが、言うは易し、行うは難し(something often easier said than done)、である.原因となる薬剤の中止、肺や中枢神経感染症の治療、原疾患となる悪性腫瘍の治療はSIADHの治療に役立つ.それがなされない場合、低Na血症が慢性化どうか、症状の重症度により治療が決定される.無症状か、最小限の症状しかない慢性のSIADHの患者はまず水分制限を行うべきである.水分制限の程度は、血漿Na濃度に対する尿中KとNaの合計の比を計算することで見積もることができる.比が1より小さい時(血漿Na値>尿Na+K)は、ゆるい水制限(1L/day)でよく、比が1より大きい場合は、厳しい対策(500ml/day以下)が必要となる.当然のことながら、水制限の有効性は、患者の遵守度に左右される.その代わりに、蛋白や塩分を多く摂取することは有効かもしれない.経口の尿素の摂取(30g/day)=溶質摂取を増やし、尿量を増やすことは有効であるが、かねてから忍容性が低いとされてきた(最近の製剤は口当たりが良いとされているが).これらの治療がうまくいかない場合、バプタンが体液量正常で、軽度-中等度の低Na血症の治療に使用できる.バプタンは必ずしも急速に血清Na値を上昇させるわけではない.RCTのメタ解析では、トルパプタンが投与された症例の数日間における血漿Na濃度の平均の上昇値は5mEq/Lであった.このように、これらの薬剤は、重度の神経学的症状を伴う低Na血症では投与されるべきではない(それらはより迅速な補正が必要である).そのような症例では、高張食塩水を使用すべきである.
16. When and how fast should hypertonic saline be given?
SIADHの患者で、血漿Na濃度に対する尿Na+Kの比が1以上の場合、NaClはより濃縮された少量の尿として排泄され、残った電解質を含まない水が体内に保持されるため、生理食塩水の投与により低Na血症は悪化するかもしれない.しかし、3%高張食塩水は、低Na血症の原因に関わらず、血清Na値を素早く上昇させる.重篤な症状の低Na血症の症例(特に低Na血症が48時間以内に発症した場合)、それらの患者は痙攣やテント切痕ヘルニアの最高リスクとなるため、急速な補正が正当化される.たとえ非常に少ない血清Na濃度の上昇であっても、脳浮腫の程度を著しく改善させ、命に関わるイベントのリスクを減らすことができる.これらの合併症を防ぐために、血清Na濃度を急激に4-6mEq/L上昇させるのみで十分である.これは、高張食塩水100mlを10分かけて、最大3回まで行うことで達成される.もし緊急の補正が不要であれば、最初のボーラス投与なしに高張食塩水を持続投与すればよい.血清Na濃度の上昇率を予測するいくつかの公式がある.しかしながら、それらの公式は、血清Na値の上昇率に影響を与える水や電解質排泄などの因子を無視している.それゆえ、我々はシンプルな予測公式の使用を好む:1mg/kgの高張食塩水を(1時間に1mEq/L上昇させることを期待して)、1時間かけて投与することを推奨.どれほど血清Na濃度を上昇させるべきかは、低Na血症の発症速度による.慢性の低Na血症では、過度に急速な補正による合併症を避けるために、厳密な補正速度の制限が守られるべきである.どの公式も大雑把な推定にすぎないため、治療の初期段階で血清ナトリウム濃度を頻繁に測定し、上昇率が目標に一致することを確認することが不可欠である.
17. What complications of treatment can occur?
Question 8で議論したように、神経細胞は低張性低Na血症に反応し、電解質と有機浸透圧物質を放出し細胞内張度を下げ、脳浮腫を制限する.血清Na濃度が、細胞が浸透圧を回復し代償を取り戻すための時間より速く上昇しすぎる場合、水はその浸透圧勾配を下り細胞外の比較的高張な間質に流れ出て、細胞の収縮そして場合によっては神経細胞の脱髄を引き起こす場合がある.この状況はosmotic demyelination syndrome (ODS)と呼ばれ、構音障害、嚥下障害、運動障害(特に痙性)、四肢麻痺、行動異常、痙攣、せん妄、昏睡などの不可逆的な神経異常を呈する.より重症な場合、患者は”locked in”の状態となり、意識はあるが動いたり、話したり、飲み込んだりできない状態となる.この古典的な兆候は、血清Na濃度が補正されるにつれて最初意識状態が良くなった後に、数日して状態が悪化する.
18. Who is at risk for ODS?
24-48時間以内に発症した急性の低Na血症の場合、ODSの低リスクであり、従って低Na血症を急激に補正しても害がない.ODSはまた、血清Na濃度が>125mEq/Lの患者の治療では生じない可能性が高い.逆に、初期の血清Na値<105mEq/L、低K血症、アルコール依存症、低栄養、進行した肝疾患を有する慢性低Na血症患者はODSの高リスクである.ODSを防ぐためのNa補正の戦略をTable 73.1に示す.特に、発症が48時間以内であることが明確でない限り、その低Na血症は慢性と考えられるべきである.
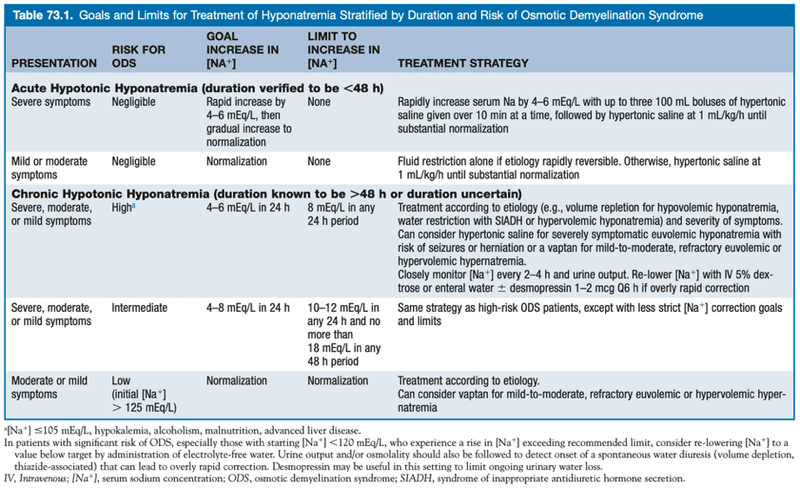
19. How should correction be monitored?
高張食塩水を投与している間は血清Na値を2-4時間間隔でモニターすべきである.この間、尿量も細かくチェックする.循環血液量減少性、サイアザイド関連の低Na血症では容量減少が補正されると(時に生理食塩水が適度な量投与されただけなのに)自発的な水利尿が起こるかもしれない.このような水利尿の出現は、ODSのリスクとなる.患者の中には、この自然に起こってしまうNaの補正がとても早いため、主たる治療の懸念事項は血清Na濃度の上昇をいかに制限するか、になる.重症の症状を有する低Na血症患者に対する高張食塩水の開始はICUに入室するまで遅らせるべきではないが、1時間ごとの尿量測定、2時間ごとの血清Na値の測定はICUで最も効率的に実践できる.
20. What should be done if correction is too rapid?
ODSの症状の出現は過度に早い補正の後数日してから起こるので、それ以上(過度な補正が起こってしまった場合に)尿からの電解質を含まない水の排泄を防ぎ、ODSを起こさない血清Na値まで再低下させるために、先手を取った電解質を含まない水の投与(±デスモプレシン)を行う.
21. What are the clinical manifestations of hypernatremia?
生来健康である場合、高Na血症は口渇を引き起こし、電解質を含まない水の摂取を促し、血清Na濃度の正常化を助ける.しかし高Na血症が悪化するにつれて、口渇は消失してしまう(dissipate).口渇を除き、血清Na値が160mEq/L付近まで上昇しなければ患者は無症状なことが多い.より重症な症例では、高Na血症による脳萎縮は血管の緊張につながり、破裂し脳出血を起こす時がある.胎児や小児では、特にこの悲劇的な合併症のリスクがある.混迷、昏睡、筋力低下が高Na血症に関連する一方で、これらの症状は高Na血症単独ではなく、他の合併症の所見であることもある.臨床医はしばしば血液量減少の患者を脱水であると呼んでいるが、厳密には、dehydrationという単語はNaと比較して電解質を含まない水の真の欠乏がある高Na血症患者に使用させるべきである.
22. What causes hypernatremia?
高張輸液の急速な投与は-しばしば心肺蘇生の場面で、Na2HCO3のアンプルを投与することで起こるが-、他には乳児の粉ミルク(bady formula)の混合のミスは純粋な溶質の負荷により高Na血症になる.圧倒的に多いのは、口渇の自覚または水分摂取へのアクセスができない状況で高Na血症は起こる.病院外では、高Na血症は、水分摂取が他人により行われる施設入所中の高齢者や、乳児でよく起こる.発熱がある状況で不感蒸発(insensible water loss)が増加すると、高齢者では高Na血症を誘導する.他には、ループ利尿薬による尿濃縮障害や尿崩症で高Na血症になることがある.入院患者では、医原性の高Na血症が多く、特に挿管された患者や下痢や胃管チューブからの廃液が多い患者において低張性輸液の量が不十分な場合に高Na血症が起こる.ループ利尿薬は、腎髄質の張度を下げることで、ADHを介した水吸収を低下させるため、高Na血症になることがある.
23. What is DI?
DI(Diabetes Insipidus:尿崩症)はバソプレシンを介した電解質を含まない水の再吸収が欠損してしまう疾患である.DIには、下垂体のバソプレシンの障害(神経学的あるいは中枢性DI)またはバソプレシンの作用の障害(腎性DI)がある.DIでは多尿の症状をきたし、毎日の尿量が3L以上になる.尿は、過剰に電解質を含まない水が排泄されているので希釈されている.ほとんどの患者では、正常に口渇の自覚があり、電解質を含まない水の摂取が可能であるため、血清Na濃度の上昇は妨げられる.しかし、もし自由な水分摂取が制限されると高Na血症が起こる.多飲を伴う多尿はDIの特徴である.
中枢性DIはさまざまな病因から起こる:外傷、肉芽腫性疾患、腫瘍、感染、動脈瘤など視床下部や下垂体に影響を与える疾患.腎性DIは先天性か後天性の原因どちらもあり、後者は内因性腎疾患、高Ca血症、低K血症、リチウムやデメクロサイクリンがある.腎性DIとは異なり、中枢性DIの患者はバソプレシンアゴニストの投与で明確な反応を示し、濃縮した尿を排出するようになる.
24. How is hypernatremia managed?
高Na血症の治療では、原因疾患への対応が必要である.つまり原因薬剤(下剤、リチウム、デメクロクロルサイクリン、ループ利尿薬)を中止、低K血症や高Ca血症の補正、発熱性疾患の治療を含む.さらに電解質を含まない水を経腸、または経静脈的に投与する.中枢性DIがデスモプレシン(バソプレシンアナログ)で治療される一方で、腎性DIの治療は難しく、原因薬剤(offending agents)の除去が優先となる.サイアザイドは(集合管より)近位でのNaと水の吸収を刺激することで(体液量減少=volume contractionを誘導することで)、ADHに敏感ではない(ADH-insensitiveと記載されているが、ADH-sensitiveの間違いでは?)集合管への水の到達を減少させるのに有用である.
25. Are there complications of treatment?
高Na血症による脳萎縮を防ぐために、神経細胞はわずか数時間で電解質を蓄積し、その後数日かけて細胞内張度を上昇させるために有機物質を蓄積する.この適応により、慢性高Na血症の急速な補正は理論的には脳浮腫の原因になる.この減少は小児では起こるとされるが、成人では滅多に起こらない.
26. How rapidly should electrolyte-free water be administered for hypernatremia?
ほとんどの高Na血症のケースは数日かけてゆっくり起こる.慢性高Na血症の治療の推奨は、慢性低Na血症の治療ほど確立されていない.専門家の中には、高Na血症は48時間以上かけて起こるため、血清Na濃度の低下は1日あたり10mEq/Lにとどめ、脳浮腫のリスクを最小限にすべきであると推奨する.補液の一般的な投与方法として、その患者の水の欠乏量の半分を最初の1時間で投与し、残りの半分をその後の24-48時間で投与する.もし高Na血症が48時間以内に起こっていれば、補正はもっと速くてもいい.患者の自由水の欠乏量は以下の公式で見積もられる.
Electrolyte-free water deficit=Total body water×[1-(Desired serum Na/Current serum Na)]
体内総水分量は患者の体重に女性なら0.5、男性なら0.6をかけることで計算される.これらの分画は、肥満や高齢の場合は少なくなる.この計算式によると、血清Na値167mEq/Lの挿管された女性の電解質を含まない水分の欠乏量は、約4.8Lである(60*0.5*[1-140/167]=4.8L).この欠乏量の半分(2.4L)を、3時間ごとに胃管チューブから300mlずつ投与することで補充し、次の48時間は150mlを3時間ごとに移管チューブから水を入れて補正する.注意すべきことは、もし彼女が電解質を含まない水分を0.45%の食塩水のみで補充される場合、2倍の量の補液が必要であることだ.この計算は概算なので、補正中は血清Na濃度を注意してモニターする.最後に、公式はまさに現在排出している電解質を含まない水については考慮に入れていない.補液の投与量は、そのような水分の喪失に合わせて増やす必要がある.上記の例に戻ると、患者の尿量が1日に1600mlであるとすると、最初の24時間に、400mlの水を胃管チューブから3時間毎に投与すると(total 3200ml)、尿から排泄されている水分(800ml)と、彼女の自由水の欠乏量のうち2400mlを補充できる.続く48時間は、250mlの水を3時間毎に投与することで(4000ml)、排泄された尿からの水分と、彼女の自由水欠乏の残りを補充することができる(この計算はおかしい?1日尿量800mlなら合うのではないか、、、).もし患者の尿量が3L/日である場合、さらに700mlの水の投与が日々必要である(電解質を含まない水の排出量が尿排出量の半分であるという仮定で).特に尿量が多い場合やDIの患者では、尿Naと尿Kを測定し、尿中への電解質を含まない水の排泄を正確に見積もる方が良い.下痢は低張性なので、CD腸炎などのように大量の下痢が出ている患者では、電解質を含まない水分を追加で投与する必要がある.
KEY POINTS
1. 高Na血症があるときは、高張性の状態であるはずだが、低Na血症では張度は様々である.
2. 低張性低Na血症は、不十分な溶質摂取、電解質を含まない水分の過度な摂取、電解質を含まない水の排出の減少、から起きる.尿浸透圧は、後者(電解質を含まない水の排出の減少)と、前2つの原因を鑑別するために利用できる.
3. SIADHの典型的な兆候は、euvolemic、低張性低Na血症で尿浸透圧>100mOsm/kg H2O、尿Na濃度>30mmol/Lで副腎不全、心不全、肝不全、甲状腺機能低下症、進行した腎障害、利尿薬がないこと.
4. 急性発症の低張性低Na血症は、急速に補正してもリスクは低い.慢性低Na血症の過度に早い補正は、ODSを引き起こすことがあるので、補正は適正に制限されるべき.もし過度に早い補正になってしまった場合、(場合によりデスモプレシンを併用して)低張性輸液を投与することでNaを下げる方向へ戻す必要があるかもしれない.
5. 高Na血症の症例の大半は、口渇の自覚や水分摂取が十分できない場合に起きる.もし尿が最大濃縮尿(あるいはそれに近い状態)でなければ、浸透圧利尿か、中枢性・腎性尿崩症を考慮すべきである.
この記事が気に入ったらサポートをしてみませんか?
