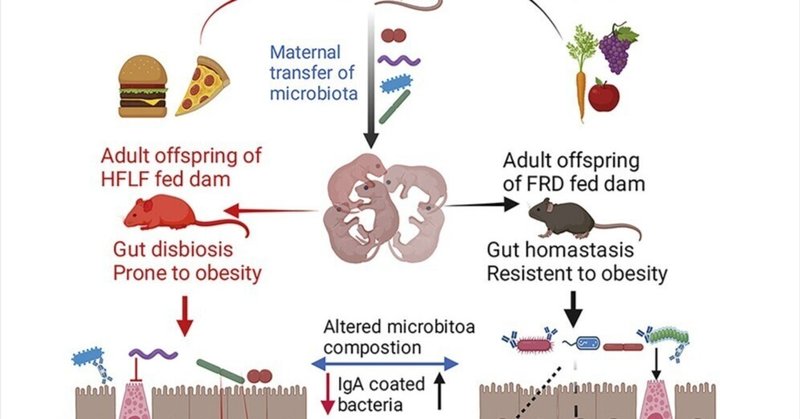
母親の食物繊維の欠乏が子孫の微生物叢を変化させ、低悪性度炎症と肥満の素因をもたらす
母親の食物繊維の欠乏が子孫の微生物叢を変化させ、低悪性度炎症と肥満の素因をもたらす
著者リンク オーバーレイパネルを開くJunZou1Andrew T.Gewirtz12
https://doi.org/10.1016/j.chom.2022.10.014
権利と内容を取得する


ハイライト
母親の食物繊維不足は、子供のマイクロバイオームに持続的かつ有害な影響を及ぼす
母親の食物繊維の欠乏は、子孫に低グレードの腸内炎症を引き起こした
食物繊維を奪われたマウスの子孫は非常に肥満になりやすかった
母親の食物繊維を強化することで、子孫のマイクロバイオームが回復し、肥満が予防された
まとめ
食事、特に食物繊維の含有量は、腸と代謝の健康を促進する健康な腸内細菌叢を維持する上で重要な役割を果たす。微生物叢の組成を決定するもう一つの大きな要因は、生後早期に、特に母親から獲得される特定の微生物である。そこで、授乳期における母親の食事内容の変化が、子孫の微生物叢組成と健康状態に持続的な影響を与える可能性があると仮定した。その結果、授乳期には食物繊維が豊富な食事を摂取していたにもかかわらず、低繊維食を与えた子孫は、分類学的多様性の減少やプロテオバクテリア種の増加など、マイクロバイオータ形成異常が持続することが観察された。このようなマイクロバイオータ異常は、内粘液層への細菌の侵入の増加、低悪性度腸炎、肥満誘発性食事に暴露した後のマイクロバイオータ依存的な脂肪率の劇的な上昇と関連していた。したがって、母親の食事は、子孫の微生物叢組成の長期にわたる重要な決定因子であり、腸の健康状態、肥満およびそれに関連する疾患への罹患率に影響を及ぼす。
図解要旨
ダウンロード 高解像度画像のダウンロード (207KB)ダウンロード: フルサイズ画像のダウンロード
キーワード
母親の食事 イヌリノベーシ ョン 子 どもの肥満 腸内細菌叢
はじめに
人類は、肥満の蔓延とそれに関連する代謝異常、特に2型糖尿病にますます悩まされている。1,2 肥満の蔓延は、一般に脂肪と単純炭水化物が多く、繊維質が少ない高度に加工された食事が増加したことと関連している。しかし、このような食事にアクセスできる人がどの程度肥満になるかは非常に多様であり5、さらに、このような食事が何十年も前から広く普及している地域でも増加し続けていることから、さらなる要因が肥満の流行に関与していることが示唆されます。6 疫学的研究により、肥満傾向には遺伝性があることが示されていますが、この表現型との特定の遺伝的関連性を明らかにしようとする努力は限られた成功にとどまっており、食事習慣や腸内細菌叢組成といった他の遺伝しうる特性(いずれも代謝の表現型に影響を与える可能性があります)の役割が示唆されています7,8。これらの要因は、食事がその人の腸内細菌叢を調節し、その結果、子孫に垂直に伝達されるマイクロバイオームを調節するという点で相互に関連している。10 したがって、食事はそれを消費する個人の代謝に影響を与えるだけでなく、むしろその子孫の代謝表現型に対してマイクロバイオータ依存性の影響を及ぼす可能性もある。このような影響を調査するアプローチを検討する中で、我々は、母親の食事が子孫のマイクロバイオームに及ぼす影響は、授乳期がマイクロバイオータの獲得と形成が行われる時期であるため、特に強くなるのではないかと推論した。さらに、授乳期のダムが低繊維組成で定められた食事を摂取した場合に、特に強い影響が生じるかもしれないと考え、我々は、その結果、マイクロバイオータのリモデリングを著しく速めることが確認されていることを明らかにした14,15。そこで我々は、授乳中のダムに高脂肪または低脂肪の低繊維食を与えることが、微生物叢、腸の健康状態、および生物医学研究でマウスの飼育に通常用いられる繊維が豊富なグレインベースチャウ(GBC)食で離乳した子供の代謝状態にどのように影響するかを検討した。また、母親の食事が、肥満誘発性の食事に暴露された後の子どもにどのような影響を与えるかも調べた。その結果、母親の食事が子孫のマイクロバイオームに影響を及ぼし、低グレードの炎症と軽度の基礎代謝表現型に関連するものの、食事誘発性肥満の傾向が劇的に上昇することが確認された。
研究結果
授乳中のダムに低繊維食を与えると、子孫のマイクロバイオーム、腸、および代謝に影響を及ぼす
生物医学研究に用いられるマウスは、従来、穀物ベースのげっ歯類飼料(GBC)で飼育されてきた。GBCは比較的未精製の原材料で構成されているため、バッチ間のばらつきが大きく、食餌ベースの研究を妨げるため、組成が明確に定義され、比較的不変の成分で構成されている「オープンソース」飼料を使用するようになりました16,17。一方、オープンソースのコントロール食は、通常5%しか食物繊維を含んでおらず、低繊維食とみなされている18。その結果、このような低繊維食は健康な腸内細菌叢を維持できず、上皮の停滞、低悪性度腸炎、および肥満の促進をもたらし、特にこのような低繊維食が飽和脂肪にも富んでいる場合14。食事による腸内細菌叢の変化は回復可能だが19、我々は授乳中に起こる食事誘発性の微生物叢異常が、その子孫に宿主-微生物叢関係を持続的に有害に刷り込むのではないかと仮定していた。図1Aに示すように、我々はこの仮説を検証するために、授乳中のダムの食事をGBCから低繊維低脂肪食(LF-LFD)または低繊維高脂肪食(LF-HFD)に切り替え、子犬を出産後すぐに実施した。LF-HFDはカロリーの60%を脂肪から摂取するもので、「ファーストフード」食をモデルとしている。一方、LF-LFDの使用は高脂肪食と低繊維食の相対的役割を明らかにすることを目的としている。授乳食は、仔マウスが3週齢で離乳するまで維持され、その時点で、ダムと仔マウスの糞便マイクロバイオームと代謝表現型が調査された。
ダウンロード 高解像度画像のダウンロード (925KB)Download : フルサイズ画像のダウンロード
図1. 授乳期における低繊維食の摂取は、子牛の微生物叢および代謝的健康に影響を与える。
(A) スキーム;泌乳期間中、ダムに穀物ベースの餌(GBC)、低繊維低脂肪食(LF-LFD)、または低繊維高脂肪食(LF-HFD)を摂取させた。泌乳期終了後、雌の仔ダムを安楽死させた。
(B-D) 16S rRNA遺伝子配列解析による糞便微生物相組成(各群のダムについてn = 4、各群の仔についてn = 8-9)、非加重UniFrac PCoA解析(B)、GBC群とLF-LFD/LF-HFD群の微生物相間のUniFrac距離(C)、観察-有機物豊かさの希薄曲線(D)で表した。
(EおよびF)Pielouの均等性(E)およびFaithの系統的多様性(F)によって測定された腸内細菌叢のα多様性(E)。
(G-I) 細菌門レベルでの相対的存在量の分類学的解析(G)、ファーミキューテスとバクテロイデットの比率(H)。Proteobacteriaの割合(I)。
(J-N)体重(J)、卵巣周囲脂肪パッド重量(K)、脂肪パッド/体重比(L)、腹腔内グルコース負荷試験(GTT)(M)、泌乳終了時のGTTの曲線下面積算出(N)などのダム(各群n=6-8)の代謝データ。
(O〜R)体重(O)、卵巣周囲脂肪絶対量(P)、卵巣周囲脂肪率(Q)、離乳時の非空腹時グルコース測定値(R)などの子犬の代謝データ(各群n=9〜10)。
一元配置分散分析(One-way ANOVA)。∗一元配置分散分析:*p<0.05、*p<0.01、**p<0.001、**p<0.0001;#p<0.05、#p<0.01、###p<0.0001. D)および(M)において、*はmLF-LFD VS mGBCを、#はmLF-HFD VS mGBCを示した。
また、図S1参照。
非授乳期マウスにおける我々の研究発表14と同様に、16S rRNA遺伝子配列決定とUni-Frac/主座標解析(PCoA)による糞便マイクロバイオームの解析により、GBCを与えたダムといずれかの低繊維食を与えたダムの間で食事ベースのマイクロバイオームクラスター化が顕著に見られた(図1B)。さらに、すべてのグループの仔のマイクロバイオームはそれぞれのダムと類似しており、予測されたように、食事が誘発する腸内細菌叢への影響が実際に子孫に伝達されたことが示された。UniFrac距離の測定により、これらの差は統計的に有意であることが確認された(図1C)。さらに、低繊維食を与えた非授乳期マウスで以前に観察された腸内細菌叢の異常の主な特徴は、繊維質を奪われた授乳期ダムとその仔にも観察された。具体的には、食物繊維を欠乏させたダムとその仔は、観察された分類群の数(図1D)および均等性の尺度(図1E)に基づくα-多様性の減少を呈した。フェイスの系統的多様性が減少する傾向も同時に観察されたが、これは食物繊維欠乏食を摂取したダムでは統計的有意差に達しなかった(図1F)。さらに、食物繊維の欠乏は、ダムおよびその離乳子において、より低い程度ではあるが、Proteobacteriaの存在量の増加を含む、門レベルでの腸内細菌叢組成を変化させた(図1G〜1I)。また、小腸のマイクロバイオームでも同様の異常が観察された(図S1A-S1E)。このように、マイクロバイオームが垂直的に伝播するという概念と一致して、離乳したばかりのマウスの仔は、授乳期に母親が食事の変更によって獲得したマイクロバイオータ・ディスバイオージスを示していた。
授乳期のダムは低繊維食を摂取することで、これまで非授乳期マウスで観察されていた代謝表現型を彷彿とさせる結果を得た。具体的には、LF-HFDを3週間摂取した場合、体重は有意に増加しなかったが、両低繊維食はGBCを摂取したダムと比較して脂肪率が増加し耐糖能が低下した(図1J〜1N)。低繊維食はまた、結腸の重量および長さの減少をもたらし、以前に記述した腸の表現型が授乳期マウスにも現れていることを示した(図S1FおよびS1G)。同様の代謝表現型は、離乳したばかりの子マウスでも明らかであった。具体的には、母親がGBCを摂取した仔マウスと比較して、LF-LFDおよびより大きくLF-HFDを母親が摂取した3週齢の仔マウスは、体重/脂肪率の増加および非絶食グルコース値の上昇を示した(図1O〜1R)。これらの代謝表現型は、これらの飼料を直接摂取したダムで観察された仔魚の腸の形態における明白な変化(図S1HおよびS1I)を伴わなかったが、フローサイトメトリーによる腸の自然免疫細胞のプロファイリングにより、仔魚には小腸および結腸におけるM1/M2マクロファージの比率の増加および好中球と単球のレベルの上昇など低レベルの腸の炎症が適度に見られたことが判明した。これらの変化は、CD4およびCD8 T細胞の緩やかな変化と関連しており、B細胞頻度の減少は、おそらく炎症性細胞の増加を反映していた(図S1J-S1Q)。
母親の食物繊維欠乏が子孫のマイクロバイオームに与える影響は長期にわたる
次に、離乳したばかりの子孫で観察された母親の授乳食がマイクロバイオームと表現型に与える影響が、そのようなマウスを食物繊維が豊富な食事、すなわちGBCで維持すると、どの程度持続するかを検討した(図2A)。12週齢の子孫(すなわち、GBC摂取9週間後)の糞便マイクロバイオームの解析により、母親の食物繊維剥奪に起因する分類学的α多様性の減少は、GBC摂取によって改善されないことが分かった(図2B〜2D)。特に、PCoA解析により、授乳期に母親がGBCを摂取したマウスと低繊維食を摂取したマウスの間で、微生物叢組成に著しい差があることが明らかになった(図2Eおよび図2F)。この差は、LF-LFDおよびLF-HFDを与えたダムの子孫においてProteobacteriaの存在量が有意に高く、門レベル(図2G)でも依然として明らかであった(図2H)。発酵性繊維含有量に比例して急速に変化する糞便1mgあたりの細菌総量14は子孫で差がなく、細菌密度が母親の食事によって刷り込まれないことが示された(図S1R)。
ダウンロード 高解像度画像のダウンロード (833KB)Download : フルサイズ画像のダウンロード
図2. 母親の食物繊維不足は子孫の微生物叢に持続的な影響を与え、子孫の食事誘発性肥満を悪化させる。
(A)スキーム;授乳中のダムは、出産時に表示された飼料を与えられた。雄の子マウスは3週齢で離乳させ、12週齢までGBCを投与し、その時点で糞を採取して16S rRNA遺伝子配列を決定し、その後LF-HFDを4週間投与した(各群n = 5-9)。
(B-D)12週齢の子孫の腸内細菌叢のα多様性、Faithの系統的多様性(B)、Pielouの均等性(C)、観察-OTU豊かさのRarefaction曲線(D)を測定した。
(E and F) 12週齢の子供における腸内細菌叢のβ多様性は、PCoAによる重み付けなしのUniFrac (E) とUniFrac距離のプロット (F) によって測定された。
(G and H) 分類学的解析(相対的な門の存在比(G)およびProteobacteriaの割合(H)を含む)。
(I-L) MRIによる体重測定(I)、全身脂肪(J)、除脂肪(K)、実験終了時に測定した副睾丸、腸間膜脂肪、褐色脂肪組織(BAT)重量(L)など、子孫の代謝に関するデータ。
(M-Q)血中コレステロール(M)、空腹時血糖(N)測定、ブドウ糖腹腔内投与による糖負荷試験(GTT)(O、P)、GTTのAUC算出(Q)。
(R-T)インスリン負荷試験中の血糖値を絶対濃度(R)または初期値との相対変化(S)で示した。SからAUCを算出した(T)。
一元配置分散分析(One-way ANOVA)。∗p<0.05,**p<0.01,**p<0.001,**p<0.0001;#p<0.05,#p<0.01,###p<0.0001 ns,not significant. I)、(P)、(R)、(S)について、*はmLF-LFD vs mGBC、#はmLF-HFD vs mGBCを示した。
また、図S1参照。
母親の食物繊維欠乏は、食事誘発性肥満に対する子孫の傾向を劇的に高めた
次に、母体の繊維質剥奪が子孫の代謝表現型に及ぼす影響を、マウスをGBCで維持したまま、食事誘発性肥満(DIO)モデルとして古くから広く用いられているLF-HFDに応答して調べた(図2A)。我々は、LF-LFDおよびLF-HFDダムの両方の子孫が離乳時に体重の上昇を示し、これらのマウスがGBC上で維持されるその後の数週間にわたって徐々に消失することを見出した(図2IおよびS1S)。それにもかかわらず、GBCで維持されたマウスでは、12週齢および16週齢において、脂肪率にわずかではあるが統計的に有意な差が残った(図2J、S1V、およびS1W)。しかし、より顕著だったのは、母親の食事がDIOの発症に与える影響である。具体的には、低繊維食のいずれかを母体に与えると、LF-HFDに4週間暴露した後(すなわち、16週齢のマウス)、体重の急激な増加、脂肪量の増加、MRIによる除脂肪量の減少、および主要脂肪層の量の増加が示すように、重度のDIO表現型が得られた(図2I〜2L)。このような重度のDIOは、メタボリックシンドロームの他の指標、すなわち高コレステロール血症、糖質異常、およびインスリン抵抗性と並行していた(図2M〜2T)。したがって、母親の食物繊維の剥奪の持続的な代謝の影響は控えめであり、一方、子孫は食物繊維が豊富な食事で維持されるが、DIOとその結果への高い傾向が付与された。
母親の食物繊維欠乏は、微生物叢への影響を介してDIOを促進する
肥満もまた炎症性疾患とみなすことができるため、低繊維食の高度に洗練された性質により、ダムはより多くのカロリーを摂取し、それが授乳中に子孫に伝達され、それによってDIOの発症を促したと推測される。しかし、産仔を淘汰しても12週齢のマウスのDIO発症率は変わらなかった(図S2A)。この考え方は否定的である。そこで我々は、繊維素欠乏ダムの子マウスにおけるDIOの悪化は、繊維素欠乏ダムの微生物叢の異常が持続していることが原因であると仮定した。この仮説を検証するために、GBCを与えたダムと食物繊維を失ったダムの子について、8週齢から広域抗生物質によるマイクロバイオータアブレーションを行い、DIOチャレンジの間、その状態を維持した場合としなかった場合で比較を行った(図3A)。この抗生物質レジメンは、それ自体ではGBCを与えたダムの子におけるDIOを改善しなかったが、繊維を奪われたダムの子で示されたDIOの悪化をほぼ排除した(図3B〜3E)。また、先行研究21と同様に、抗生物質はDIOによる血糖値上昇を抑制した(図3F-3H)。さらに、すべてのマウスが抗生物質による微生物叢の切除を受けた条件下で、母親の食物繊維の剥奪は血糖異常を悪化させなかった(図3F-3H)。また、4週間のLF-HFD曝露の直前に抗生物質の使用を中止するという、若干変更した抗生物質レジメンは、母体の繊維質剥奪がDIOに及ぼす影響を消失させた(図S2B〜S2D)。この結果は、食物繊維を欠乏させた母親から生まれた子供のDIOへのなりやすさは、肥満誘発性食への曝露時に存在する微生物叢によって決定されるというより、むしろ重度のDIOがDIO中に存在する微生物叢を必要とすることを反映していることを示唆するものであった。また、母親の食物繊維不足によるDIOの悪化における微生物叢の役割についても、同居させることで検討した。具体的には、GBCまたはLF-LFDを与えたダムの子マウスを離乳時に1つのケージに入れ、腸内細菌叢の自然交換を可能にした(図3I)。その結果、同居マウスは、非加重UniFrac距離および相対プロテオブacteria存在量に反映するように同様のマイクロバイオームを有した(図3Jおよび図3K)。このようなマイクロバイオームの正常化は、類似した免疫細胞プロファイル(図S2E〜S2K)、さらに、類似したDIOへの傾向(図3L〜3O)と関連しており、したがって、マイクロバイオータ組成に対する母親の繊維剥奪の影響がDIOの悪化を仲介するという考え方をさらに裏付けるものである。さらに、同居マウスにおけるDIOの程度が、GBCを与えたダムの非同居子孫のそれと同様であったことから、そのようなダムが子孫に伝える微生物が保護的な役割を果たすことが示唆された。
ダウンロード 高解像度画像のダウンロード(893KB)Download : フルサイズ画像のダウンロード
図3. 母体の繊維不足によるDIOの悪化は、抗生物質や同室飼育によって解消された
(A) スキーム、表示哺乳類用飼料を与えたダムの雄子(n = 3-5/群)に、8週齢から広域抗生物質を含む飲料水を投与して微生物叢を破壊し、LF-HFD曝露期間中も維持した。
(B と C) 抗生物質を投与していない(B)と投与した(C)の子供の体重を記録した。
(D と E) 安楽死時の精巣上体脂肪量 (D) およびその体重に対する割合 (E).
(F-H) マウスを5時間絶食させ、基礎グルコース値を測定した後(F)、腹腔内グルコース負荷試験を実施した(G)。GのAUCを算出した(H)。
(I)スキーム。3週齢の仔マウス(各群n = 5-8)を、表示飼料を与えたダムから離乳させ、12週齢までGBCを投与しながら表示通りに同居させ、その後、LF-HFDを与えた。
(JおよびK)同飼料および同飼料マウスの微生物叢を16S rRNA遺伝子配列解析し、非加重UniFrac解析によるPCoAで表されるグローバル組成(J)およびプロテオバクテリアの割合(K)を算出した。
(LおよびM)同腹仔マウスおよび同腹仔マウスについて測定した腹腔内ブドウ糖負荷試験(GTT)(L)およびGTTのAUC(M)。
(N および O) 精巣上体脂肪および腸間膜脂肪の絶対値 (N) および体重との関係 (O) を含む質量を測定した。
一元配置分散分析(B、C、D、E、F、G、およびH)またはスチューデントのt検定(K、L、M、N、およびO)。∗p < 0.05, **p < 0.01, **p < 0.001, **p < 0.0001; #p < 0.05, ##p < 0.01, #### p < 0.0001, ns, 無意図. B)、(C)、(G)において、*はmLF-LFD vs mGBC、#はmLF-HFD vs mGBCを示す。L)において、*は同飼育マウスにおけるmLF-LFD vs mGBCを示した。
また、図S2参照。
母体の繊維質剥奪に起因するマイクロバイオームの変化が、DIOを悪化させるのに十分である可能性の程度を、糞便微生物叢移植を介して調べた。まず、授乳期にGBC、LF-LFD、またはLF-HFDを摂取したダムの12週齢のGBC食の子孫の糞便を8週齢の無菌マウスに懸濁液として投与した。4週間後、そのようなマウスをLF-HFDに4週間暴露した(図4A)。ダムを繊維質剥奪したマウスの糞のレシピエントでは、適度に大きな脂肪率および糖質異常が観察され、マイクロバイオータ組成が母親の繊維質剥奪DIO表現型に寄与するという考えを支持した(図4B〜4F)。次に、低繊維食を与えたダムの子孫で濃縮されているProteobacteriaで微生物叢を濃縮することが、DIOにどの程度影響を与えるかを調べた。マウスは、微生物叢を一掃した後、プロテオバクテリア強化コンソーシアム(PEC)を添加したGBC糞便を投与されたが、その16S rRNA遺伝子配列決定から、98%がプロテオバクテリアで構成されており、主にAggregatibacter属とSutterella属であったことがわかった(図4G)。このようなマウスをGBCで4週間維持した後、4週間のLF-HFD投与に供した(図4H)。糞便移植にPECを加えても体重に有意な変化はなかったが、それでも耐糖能異常が中程度に増加し、体重に対する副睾丸脂肪量の比率が変化した(図4I〜4L)。同様のDIO増強パターン(図4Mおよび4N)は、糞便懸濁液に単一のProteobacteria単離株、すなわち、以前に我々のビバリアでディスバイオティクスマウスから分離されたAggregatibacter株のみを補充することによって得られた22。このDIO増強には、FMT後4週目の大腸M1/M2比の上昇および軽度の好中球流入が関連していた(図S2LおよびS2M)。これらの結果は、腸内細菌叢の変化、特にプロテオバクテリアレベルの上昇をもたらす変化が、母親の食物繊維欠乏に起因する肥満への傾向に寄与するという仮説をさらに支持するものである。
ダウンロード 高解像度画像のダウンロード(857KB)Download : フルサイズ画像のダウンロード
図4. 食物繊維不足のダムを持つ子孫の微生物叢を移植すると、レシートマウスの食事誘発性肥満が悪化する。
(A)スキーム。ジャームフリーマウス(各群n = 5)に、GBC、LF-LFD、またはLF-HFDを与えたダムの12週齢の子孫からの糞便微生物叢移植(FMT)を投与した。FMT後4週間、マウスにLF-LFD給餌を4週間実施し、安楽死させた。
(BおよびC)レシピエントマウスの精巣上体脂肪組織(B)および体重に対するパーセンテージで算出(C)。
(D-F)LF-HFD投与28日後、マウスを一晩絶食させ、基礎グルコース(D)、腹腔内グルコース耐性(E)をアッセイした。E)のAUCを算出(F)。
(G)(H)〜(L)で利用した糞便プロテオバクテリア濃縮コンソーシアム(PEC)の組成の属レベル。
(H)(I)〜(L)、(M)、(N)の実験スキーム。3週齢の従来型マウス(CV)を「腸内洗浄」(PEG経由)し、GBC飼育マウス糞便懸濁液+/-PEC(I〜L)またはアグリガティバクター分離株(MおよびN)を投与した。マウス(各群n=5)をGBCで維持し、4週間(I-L)または2週間(MおよびN)のLF-HFD給餌のコースを経た。
(IおよびJ)耐糖能(I)およびその結果としてのAUC(J)。
(K-N) 脂肪率。一元配置分散分析(B、C、D、E、およびF)またはスチューデントのt検定(I、J、K、L、M、およびN)。∗p<0.05, p<0.01, p<0.001, p<0.0001; #p<0.05, p<0.0001. E)において、*はGF:mLF-LFD対GF:mGBCを、#はGF:mLF-HFD対GF:mGBCを示した。
また、図S2参照。
母体の繊維不足は、微生物叢の侵食と低悪性度炎症をもたらす
次に、母親の食物繊維の欠如が、12週齢の子孫の粘膜にどのような影響を与えるかを調べようとした。この時点では、9週間GBCを摂取していたので、脂肪率はわずかであったが、DIOに非常にかかりやすい状態であった。ムコイド構造を保持することが知られている非脱水組織固定法を用いた共焦点顕微鏡による微生物叢の局在の評価23では、結腸の内側粘液への細菌の侵入がより一般的に頻繁に見られた(図5A)。複数の視野と標本で上皮に最も近い細菌の距離を測定したところ、実際、母親の食物繊維欠乏は12週齢のGBC給餌子においてかなりの程度微生物叢の侵入をもたらすことが示された(図5B)。この表現型は、IgAでコーティングされた糞便細菌の割合の減少に関連していた(図5Cおよび図5D)。これらの子孫マウスでは、低繊維食を直接摂取したマウスで減少したタイトジャンクションタンパク質claudin-1の発現や粘液厚の変化は観察されなかった(図S3AおよびS3B)18,24。母体の繊維不足による微生物叢の侵食は、抗菌タンパク質/炎症マーカーであるリポカリン-2の糞便レベルの上昇(図S3C)および血清抗フラジェリン抗体および抗LPS抗体の高レベルと関連していたが、血清総濃度のIgG1およびIgG2Cには変化がなかった(図S3D-S3G)。回腸と結腸の両方で、母体の繊維不足は、好中球、単球、M1マクロファージ、およびM1/M2マクロファージ比の上昇をもたらし、小腸の回腸DC、特にCD11b- CD103+が上昇する傾向が見られた(図5E〜5I、S3H〜S3K)。リンパ球の分析では、特に小腸でB-およびT細胞の頻度と数の減少が見られた(図5Jと5K、S3L、S3M)。T細胞サブセットの分析では、繊維を奪われたダムの子孫の腸において、CD8細胞の緩やかな増加とCD4細胞の減少が見られた(図5L、5M、S3N-S3O)。同様のパターンが脾臓および脂肪組織でも観察され、好中球、単球、およびM1/M2比の増加が見られた(図5E-5G、S3P-S3S)。また、BおよびTリンパ球の頻度も適度に減少していることが観察された。この差の一部は、これらの細胞型の絶対数の減少に関連するが、例えば、脾臓のB細胞の絶対数が有意に変化しなかったことから、脾臓細胞の総増加を反映していると考えられる(図5J〜5MおよびS3T〜S3W)。さらにCD4 T細胞分析により、母体繊維の剥奪は制御性T細胞の適度な減少をもたらし、IL-17+およびIFNγ+細胞の適度な増加をもたらした(図5N-5QおよびS3X-S3Z)。これらの知見を総合すると、繊維質剥奪ダムの子孫には低悪性度の炎症が持続するという考え方が支持されます。
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図5. 母親の食事は、子孫における微生物叢の局在と炎症誘発の可能性に影響を及ぼす
(A and B) 12週齢の子孫の大腸における微生物叢-粘液-上皮の局在をFISHにより解析した(各群n = 7-9)。代表的な共焦点画像(A)およびHPFあたりの平均細菌-上皮距離(B)。
(C と D) 細菌の IgA コーティング、各グループあたり n = 4-6. Rag-/-の糞便を陰性対照として、(C)のゲーティングスキームを用いて、IgAで被覆された糞便細菌の割合を判別した(D)。
(E-M)図S1でゲートした12週齢の子孫(各群n=5)の免疫細胞のフローサイトメトリー解析、好中球(Neu)、単球、M1/M2マクロファージ、樹状細胞(DC)、BおよびTリンパ球を定量化した。
(N-Q)機能的T細胞サブセット解析、各群n=3-5。小腸リンパ球および脾臓細胞をex vivoでPMAで刺激し、(N)でFACSゲーティングにより解析した。制御性T細胞(O)、IFN-γ+(P)、IL-17+ T細胞(Q)の割合を算出した。一元配置分散分析(One-way ANOVA)。∗一元配置分散分析:*p < 0.05, **p < 0.01, **p < 0.001, **p<0.0001。
図S3、S4参照。
母親の食物繊維不足は、子孫のエネルギー摂取量増加と関連する
低グレードの炎症および微生物叢の恒常性の乱れは、上皮の増殖の増加に関連する可能性がある25。したがって、母親の繊維質剥奪は、Ki67染色の増加および投与したBrDuの移動増加をもたらし、それぞれ上皮の増殖および移動の増加を示した(図S4A-S4D)。このような変化は長い絨毛と関連しており(図S4E)、LF-HFD食に豊富に含まれる脂質の取り込みを促進するかもしれないと我々は仮定している。この考えと一致するように、我々は脂質投与チャレンジ後に血清TGの上昇を観察した(図S4F)。増殖・移動の増加のもう一つの可能性として、GLP-1を含む代謝調節因子を産生するL細胞など、より分化した腸管細胞の集団が減少している可能性があると想定された。したがって、食物繊維を奪われたダムの子では、GLP-1+ L細胞の減少とGLP1 mRNAレベルの減少が観察された(図S4G-S4I)。GLP-1の広範な影響には満腹感の促進が含まれるため、母親の食物繊維欠乏が12週齢の子供におけるGBC消費量の15%増加につながった理由を説明できる可能性がある(図S4J)。LF-HFDは砕けやすいため、その消費量を測定することは技術的に困難である。そこで、LF-HFDを自由摂取またはペアフィーディングで投与して、DIOの悪化における食欲増進の役割を検討することにした。具体的には、GBC、LF-LFD、またはLF-HFDを与えたダムの子マウスに、年齢を合わせた対照マウスが自由摂取で食べた量の約90%に相当する量のLF-HFDを毎日正確に投与した。このような食物制限は、完全ではないものの、脂肪率および血糖値をほぼ正常化した(図S4K〜S4N)。これは、過食が、母親の繊維欠乏から生じる悪化したDIOに大きな役割を果たすが、完全に説明できない可能性があることを示すものである。より一般的には、これらの結果は、食物繊維を欠乏させたダムの子孫は、特にエネルギーが豊富な食餌を与えられたときに、高いエネルギー摂取と貯蔵を行うようになることを示す。
イヌリンを含む母親の食事は、母親の食物繊維不足によって誘発されるディスバイオシスとそれに関連する結果を改善する。
低繊維食が非授乳期マウスの腸および代謝表現型に及ぼす有害な影響の多くは、発酵性繊維であるイヌリンで低繊維食を強化することで防ぐことができる。14,26 そこで我々は、ダムをイヌリンで強化し、その子を重度のDIOから保護できるかを調査した。我々は、GBC、LF-LFD、またはイヌリン強化低脂肪食(IE-LFD)の授乳期食を投与したダムの子孫を比較した(図6A)。まず、微生物叢組成への影響を検討したところ、非泌乳期マウスでは、イヌリンによって微生物叢が変化するが、GBC投与マウスの微生物叢に回復するような方法では変化しなかった14。具体的には、9週間GBCを摂取した12週齢の子孫は、糞便マイクロバイオームがダム食に基づいてクラスタ化したが、Uni-Frac距離の測定では、母親のGBC対IE-LFDの差はGB対LF-LFDの差よりわずかに小さいことが示された(図6Bおよび図6C)。それにもかかわらず、IE-LFDを与えたマウスの子孫は、dysbiosisの主要な特徴であるProteobacteriaの拡大を欠いていた(図6Dおよび図6E)。この菌群をファミリーレベルで解析したところ、原腸菌の減少は、重度のDIOと関連するデスルホビブリオを含む複数のファミリーにわたって見られた(図6F)27。イヌリン摂取の既知および推定有益な影響として、GBC給餌マウスで観察されるレベルをはるかに超えるビフィズス菌の著しい増加がある28。このようなビフィズス菌の増加は、IE-LFDを摂取したダムの子ではLF-LFDを摂取したダムと比較して明らかになった(図6G)。一方、in vitro試験では、ビフィズス菌がプロテオバクテリア分離株、すなわちアグレガティバクター株の増殖を阻害する能力があることが分かった(図S5A)。母体LF-LFDをイヌリンで強化することで、異常な微生物叢の局在も緩和された。具体的には、共焦点顕微鏡による微生物叢局在化のアッセイにより、GBCまたはIE-LFDではなくLF-LFDを与えられたマウスの子孫が、上皮のごく近くまたは上皮を超えたところに細菌を示したことが見出された(図6H)。複数のフィールドにわたる微生物相-上皮距離の測定により、そのような微生物相侵食が、LF-LFDを与えたダムの子孫に存在し、IE-LFDを与えたマウスには存在しないことが確認され(図6I)、一方qPCRは、LF-LFDを与えたダムの子孫において回腸上皮に付着した細菌のレベルがより高いことを示唆した(図6J)。子孫における微生物叢の侵入の防止はまた、糞便中のIgA被覆細菌の増加とも関連した(図6K)。母体のLF-LFDをイヌリンで強化することで、子孫の腸粘膜に対する上記の影響も修正された。特に、LF-LFDの母体給餌はIE-LFDではなく、免疫細胞の腸内レベル(図S5B〜S5F)および結腸のGLP-1陽性細胞(図S5G〜S5I)を変化させることが確認された。
ダウンロード 高解像度画像のダウンロード(842KB)Download : フルサイズ画像のダウンロード
図6. イヌリンを用いた母体食の強化は、母体の食物繊維不足によって誘発される子孫のディスバイオーシスを改善する
(A)スキーム。授乳期に表示飼料を与えたダムの雄子マウスを3週齢でGBCに離乳させ、12週齢で糞便を採取した。
(BおよびC)16S rRNA遺伝子配列決定による糞便微生物相組成(各群n = 8)を、非加重UniFrac PCoAプロット(B)およびUniFrac距離(C)により表現した。
(D-G) プロテオバクテリア門 (E), プロテオバクテリア (F), ビフィズス菌属 (G) を含む相対的な門の存在量 (D).
(H-J) FISHによる12週齢児の結腸における微生物叢-粘液-上皮の局在、各群n = 4-6。代表的な共焦点画像(H)、HPFあたりの平均細菌-上皮間距離(I)。(J) 小腸の上皮細胞に付着した細菌をqPCRで測定した。
(K) 細菌のIgAコーティング、各群n = 7。一元配置分散分析。∗一元配置分散分析:*p<0.05、*p<0.01、**p<0.001、***p<0.0001。
図S5参照。
また、母体のLF-LFDをイヌリンで富化することで、その子孫が高い確率で肥満の発症を防ぐことができた(図7)。具体的には、雄の子孫において、基礎体重および脂肪率の緩やかな基礎増加およびDIOの顕著な程度の両方は、低繊維母体食をイヌリンで富化することによって正常化した(図7A〜7H)。肝臓および脂肪組織の分析は、イヌリンの濃縮が食餌誘導性肥満の他の発現から保護することを示す平行した結果を得た(図7I〜7L)。さらに、非常に類似した結果のパターンが、GBC、LF-LFD、およびIE-LFDを与えたダムの雌の子孫において、特にLF-HFDに反応して観察された(図S6A〜S6E)。母体食のイヌリン強化によるDIO悪化のこのような軽減は、肝臓、脂肪組織、および腸における炎症性サイトカイン、好中球、およびM1/M2マクロファージ比のレベルによって反映される炎症の指標の低減と関連していた(図S6F〜S6O)。これらの結果を総合すると、授乳中の母親による発酵性食物繊維の摂取は、その子孫の宿主-微生物叢関係、ひいては代謝表現型に持続的な影響を及ぼす可能性があることが示された。
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図7. 発酵性食物繊維イヌリンを母動物に摂取させると、子孫のDIOが減少した。
(A)スキーム。表示泌乳食を与えたダムからの子犬(1群あたりn = 9-10)を12週齢までGBC食で離乳させ、その後LF-HFDを与えた。
(B-D)体重(B)、MRIによる全身脂肪量(C)および除脂肪量(D)。
(E) 安楽死時に測定した副睾丸、腸間膜、褐色脂肪組織(BAT)の重量。
(F-H)空腹時血糖値(F)、耐糖能(G)、およびその結果としてのAUC(H)。
(I)肝臓および脂肪脂肪のHおよびE染色(代表画像)。
(J-L)肝臓重量(J)、肝臓の脂肪蓄積の相対的レベル(K)、および平均脂肪細胞面積(L)、n = 5/グループ。一元配置分散分析(One-way ANOVA)。∗p<0.05, ∗p<0.01, ∗p<0.001, ∗p∗p<0.0001, ##p<0.01, ###p<0.001, #### p<0.0001.
図S6参照。
B)および(G)において、*はmLF-LFD対mGBCを示し、#はmLF-LFD対mIE-LFDを示した。
図S6参照。
考察
肥満の流行には広範な環境(すなわち、非遺伝的)要因が寄与していると考えられるが、食事の変化、特にエネルギーに富む食品がすぐに利用できるようになったことが中心的な役割を果たしたと考えられる。しかし、欧米型食生活のエネルギー密度は、肥満の原因となる唯一の特徴ではない。少なくともマウスでは、腸内細菌叢が変化して低レベルの炎症を引き起こし、こうした食事が代謝に及ぼす有害な影響の多くを促進させるのである14。この意味で、本研究で用いた低繊維食は、標準的なマウス飼料(GBC)の総繊維量の25%であり、一般的に先進国に住む多くの人々の繊維消費量を彷彿とさせるもので、1日当たり15gの繊維しか消費していない。我々は、授乳期における母親の食物繊維の欠乏が、食物繊維の豊富な食事を摂取しているにもかかわらず、ダム、さらにはその成体の子孫において、腸内細菌叢の異常、低悪性度炎症、脂肪率の上昇をもたらしたことをここに報告する。さらに、このような微生物相の異常により、食物繊維を欠乏させたダムの子どもはDIOに極めてかかりやすくなっていた。これらの結果は、腸内細菌叢組成の社会的な世代間変化が肥満の蔓延に寄与しているという考え方の妥当性を支持するものである。より具体的には、母親の食物繊維摂取が、健康な子孫の育成と肥満傾向の改善に重要であることが明らかになった。
腸内細菌叢による食物繊維発酵の利点には、発酵産物、すなわち短鎖脂肪酸(SCFA)によってもたらされるものがあり、これは腸上皮細胞にエネルギーを提供し、さらに血糖コントロールの改善や免疫反応の抑制を含む一連の全身的利点があります30。さらに、おそらくより重要なこととして、発酵性食物繊維による微生物叢の栄養補給は、高密度の多様な微生物叢を促進し、その結果、コロニー形成抵抗性や、強い腸細胞の増殖と粘液および抗菌ペプチドの分泌によって特徴づけられる粘膜ダイナミズムの促進などのSCFAとは無関係な一連の利益をホストに提供します14,31。発酵性食物繊維のこうした利点は、プロテオバクテ リアに多い病原菌のレベルが低く、粘液層の内 部に細菌がいないことを特徴とする健全な微生物-宿主 関係につながります。逆に、食物繊維がないと微生物叢の密度が低下し、残った細菌が粘液層に侵入して消化し、宿主を侵食することになります。このような低レベルの炎症は、一般的な代謝機能障害、特にインスリン抵抗性を促進し、DIOの重症化を助長する可能性がある。
私たちの以前の研究、特に低繊維食をイヌリンで強化すると、微生物叢密度、粘膜ダイナミズム、代謝的健康が回復するが、微生物叢組成は回復しないことから、総腸内細菌量が重要なパラメータである一方、種組成の高いばらつきは十分許容される可能性があると主張しました14。この考えと一致するように、我々は、授乳期に食物繊維を奪われたダムを持つが、食物繊維が豊富な食餌を摂取するマウスは、正常な細菌密度と総体的に正常な腸の形態、すなわち、低繊維食を与えたマウスに見られるセカール/コロンの質量とクリプト深さの著しい減少がないことを確認した。しかし、母親の食物繊維の欠乏によって生じた微生物叢組成の変化は、微生物叢の侵食を引き起こし、低悪性度の炎症を引き起こし、DIOの発症を引き起こすことになった。ダムLF-LFDをイヌリンで強化すると、子孫のこれらの結果を防ぐことができたが、やはり微生物叢組成そのものを回復させることはできなかった。これらの結果は、微生物叢の密度が腸の健康状態を決定するという一般的な概念と一致するが、健康な腸粘膜を維持するための微生物叢の組成の役割も強調するものであった。特に、プロテオバクテリアに富む微生物叢の「遺伝」が、マウスの肥満や、おそらく低悪性度炎症が引き起こす他の疾患を引き起こす素因の一つである可能性が示唆された32。フラジェリンや特にLPSなどのプロテオバクテリアの成分は、炎症シグナルを活性化する強力な因子である。したがって、プロテオバクテリアの増加やその侵入は、TLR4などの自然免疫受容体を介したシグナル伝達を増加させるのではないかと推測される。実際、我々は、この製品への曝露の増加を示唆する抗LPS抗体の増加を観察し、皮下ミニポンプによるLPSへの長期曝露が肥満とその結果を直接促進することに留意している33。
食物繊維を奪われたダムの離乳したばかりの子供が、そのダムよりも程度は低いものの、それを連想させるProteobacteriaの上昇を示したことは驚くべきことではありませんでした。しかし、我々は食物繊維の豊富な食餌を数週間摂取すれば、遺伝性のディスバイオシスが緩和されると予想していたが、実際には、GBCを9週間摂取した後にProteobacteriaの上昇がより大きくなった。食物繊維を欠乏させたダムの子供とGBCを与えたダムの子供を同居させると、Proteobacteriaのレベルが部分的に正常化し、重度のDIOが予防されたという我々の観察結果と合わせて考えると、母親の食物繊維欠乏によって生じたディスバイオシスは、部分的には、食物繊維によって適切に栄養を与えられると病原体を抑制することができる有益な微生物の継承がないことを反映している可能性があることが示唆される。したがって、我々の発見は、Blaserが提唱した「欠落した微生物」仮説の一例とみなすことができ34、低繊維食を摂取する数世代にわたって微生物相の多様性が徐々に減少するというSonnenburgらの知見を想起させるものでもある35。我々の実験手法は、病原菌の抑制に役立つ特定の細菌を特定するために設計されたものではないが、それでも我々は、母親の食事をイヌリンで濃縮した結果、子孫はビフィズス菌の存在量が増加し、in vitroでProteobacteriaの増殖を抑制したことに注目した(図S5A)。一方、母親の食事にイヌリンを添加すると、in vivoで子孫のプロテオバクテリアが減少し、DIOの発症が改善された。これは、栄養が十分であれば、何らかの細菌が協調して働き、病原体を抑制することができることを示唆している。このような有益な微生物群集が生着し共生する時期は、免疫系の発達期に最適であり、将来の肥満を防ぐための治療的介入はこの時期に最も効果的であろうと推測される。
DIOの悪化は、カロリー摂取量の増加と関連していた。しかし、食物摂取量の増加は、彼らの代謝表現型の一側面に過ぎなかった。むしろ、これらのマウスは、腸の明らかな形態学的変化、すなわち長い絨毛など、最大限のエネルギー摂取に適した腸の生理機能を示しており、ボーラス投与時に脂質を採取する能力がより高くなることがわかった。このような表現型は、腸のL細胞の欠如と、それに伴うL細胞の産物であるGLP-1の減少に関連している。GLP-1の減少が過食とインスリン反応性の低下に寄与し、この代謝表現型は生後早期に刷り込まれ、その後、微生物叢の変化により維持されると推測している。マウスでの研究がヒトに適用できる範囲は、さまざまな要因によって制限されている。例えば、若いヒトは幅広い種類の微生物に曝露される可能性があるが、我々の研究でマウスが微生物を獲得できたのは、母親、兄弟、あるいは我々が意図的に同居させたケージメイトからだけであった。このことは、食物繊維の豊富な食事を摂る母親から伝えられるかもしれない有益な微生物が、実は他のソースからも容易に獲得できる可能性を示している。また、母親の食物繊維不足が肥満傾向を促進するメカニズムとして、子孫の微生物叢の変化が数あるうちの1つに過ぎない可能性があることも認識しておく必要があります。実際、母親の食物繊維欠乏を受けたマウスの糞便を無菌マウスに移植しても、母親の食物繊維欠乏の表現型は部分的にしか再現されなかった。我々は、食事が乳汁組成に与える影響など、その他の要因も関与しているのではないかと推測している。さらに一般的には、マウスとヒトでは栄養要求量が異なるため、マウスの食事に関する研究をヒトに適用することは本質的に困難である。このような注意点はあるものの、我々の結果は、微生物叢の獲得を含む、あまり理解されていない幼少期の出来事が、代謝の表現型を刷り込み、肥満のなりやすさに影響することを示唆するものであると考える。
STAR★メソッド
主要リソース一覧
試薬またはリソースのソース IDENTIFIER
抗体
抗BrdU抗体 Abcam Cat# ab74545;
RID: AB_1523224
Ki67 に対するウサギのポリクローナル Abcam Cat# Ab15580;
RID: AB_443209
抗ムチン2 サンタクルーズバイオテクノロジー Cat# H-300
Anti-GLP1 Abcam Cat# Ab22625;
RID: AB_447206
Alexa Fluor 488 Goat Anti-Rabbit IgG Invitrogen Cat# A11008;
RID: AB_143165
Alexa Fluor 555 Goat Anti-Rabbit IgG Abcam Cat# Ab150078;
RID: AB_2722519
抗マウス CD16/CD32 BioXCel Cat# BE0307
抗 CD45 Biolegend Cat# 103155;
RID: AB_2650656
抗CD11b BD Biosciences Cat# 557657;
RID: AB_396772
抗Ly6G BD Biosciences Cat# 561236;
RID: AB_10611860
Anti-Ly6C Thermo fisher Cat# 45-5932;
RID: AB_2723342
抗CD11c BD Biosciences Cat# 563786;
RID: AB_2732919
抗MHCII BD Biosciences Cat# 563415;
RID: AB_2738192
抗CD64 Biolegend Cat# 139309;
RID: AB_2562694
抗CD19 Biolegend Cat# 152404;
RID:AB_2629813
抗IFN-γ バイオレジェンド Cat# 505838;
RID: AB_2629667
抗マウスIgA eBioscience Cat# 12-4204-82
抗 CD8α Biolegend Cat# 100725;
RID: AB_493425
抗 CD45 Biolegend Cat# 103155;
RID: AB_2650656
Anti-CD4 Thermo fisher Cat# 47-0042-82;
RID: AB_1272183
抗IL17A BD Biosciences Cat# 559502;
RID: AB_397256
抗FoxP3 Biolegend Cat# 320014;
RID: AB_439750
抗TCRβバイオレジェンド Cat# 109212;
RID: AB_313435
抗CD4 バイオレジェンド Cat# 100434;
RID: AB_893324
抗マウスIgG抗体 Sigma-Aldrich Cat# M2650-1ML;
RID: AB_260486
抗マウスIgG1抗体 SouthernBiotech Cat# 1070-08;
AB_2794413
抗マウス IgG2C SouthernBiotech Cat# 1079-08;
AB_2794467
Normal Rat Serum Thermo Scientific Cat# 10710C;
RID:AB_2532985
細菌・ウイルス株
Bifidobacterium longum subsp.longum Reuter ATCC Cat# 15707
化学物質、ペプチド、リコンビナントタンパク質
D- (+)-GLUCOSE Sigma-Aldrich Cat# G8270-1KG
インスリン Sigma-Aldrich Cat# 12643-25MG
アンピシリン Sigma-Aldrich Cat# A9518-100G
ネオマイシン Sigma-Aldrich Cat# N1876-100G
PEG 3350 Sigma-Aldrich Cat# P4338
Tyloxapol MedChemExpress Cat # HY-B1068
SytoBC Invitrogen Cat# S34855
リポポリサッカライド Sigma-Aldrich Cat# l2887-10MG
ファロイジン Tetramethyl rhodamine B isothiocyanate Sigma-Aldrich Cat# P1951-.1MG
DAPI Fluoromount-G® マウンティングメディウム SouthernBiotech Cat# 0100-20
刺激カクテル サーモサイエンティフィック社 Cat# 00-4975-93
脳心筋梗塞(BHI)培地 Sigma-Aldrich Cat# 237500
パラホルムアルデヒド Thermo Scientific Cat# J19943-K2
IV 型コラゲナーゼ Sigma-Aldrich Cat# C5138-5G
DNase I Sigma-Aldrich Cat# 10104159001
重要な市販アッセイ
トリグリセリド試薬 Thermo Scientific Cat# TR22421
コレステロール試薬 Thermo Scientific Cat# TR13421
One-Step RT-PCR Kit with SYBR Green Bio-Rad Cat# 172-5151
QIAamp DNA Stool Mini Kit Qiagen Cat # 51504
QuantiFast SYBR Green PCR キット Bio-Rad Cat# 204054
リポカリン-2/NGAL ELISA R&Dシステムズ社 Cat# DY1857
FoxP3 染色バッファー Thermo Scientific Cat# 00-5523-00
寄託データ
16S rRNA配列 NCBI Sequence Read Archive PRJNA873095
実験モデル 生物/系統
マウス: C57BL/6 The Jackson Laboratory Cat # 000664
オリゴヌクレオチド
EUB338プローブ。5′-GCTGCCTCCCGTAGGAGT-3′、Alexa 647を用いた5′標識付き Invitrogen N/A
16S rRNA:5′-AGAGTTTGATCCTGGCTCAG-3′Invitrogen社製 N/A
16S rRNA: 5′CTGCTGCCTCCCGTAGGAGT-3′インビトロジェンN/A
V4の16S rRNA配列プライマー:515FB 5′TCGTCGGCAGCGTCAGATGTGTATAAG
AGACAGGTGYCAGCMGCCGCGTAA-3′ Invitrogen N/A
V4の16S rRNA配列プライマー:806RB 5′GTCTCGTGGCTCGGAGATGTGTATA
AGAGACAGGGACTACNVGG Invitrogen N/A
V3-V4の16S rRNA配列プライマー:5′TCGTCGGCAGCGTCAGATGTGTATAA
GAGACAGCCTACGGGNGGCWGCAG-3′;Invitrogen N/A
V3-V4の16S rRNA配列プライマー:5′GTCTCGTGGCTCGGAGATGTGTATAA
GAGACAGGACTACHVGGTATCTAATCC-3′。 インビトロジェン社製 N/A
18S rRNA:5′GTAACCCGTTGAACCCCATT3′インビトロジェンN/A
18S rRNA: 5′CCATCCAATCGGTAGTAGCG3′ Invitrogen N/A
IL-6:5′GTGGCTAAGGACCAAGACCA3′インビトロジェン(Invitrogen)N/A
IL-6:5′GGTTTGCCGAGTAGACCTCA3′インビトロジェン(Invitrogen)N/A
TNF-α。5′CGAGTGACAAGCCTGTAGCC3′インビトロジェンN/A
TNF-α。5′CATGCCGTTGGCCAGGA3′インビトロジェン(Invitrogen)N/A
MCP-1:5′GCTGGAGCATCCACGTGTT3′Invitrogen社製 N/A
MCP-1: 5′TGGGATCATCTTGCTGGTGAA3′ Invitrogen N/A
クラウディン-1:5′TCCTTGCTGAATCTGAACA3′Invitrogen N/A
クラウディン-1:5′AGCCATCCACATCTTCTG3′Invitrogen N/A
36B4:5′TCCAGGCTTTGGCATCA3′インビトロジェン(Invitrogen)N/A
36B4:5′CTTTATTCAGCTGCACATCACTCAGA3′ Invitrogen N/A
ソフトウェアとアルゴリズム
グラフパッドプリズム グラフパッドソフトウェア N/A
イメージ J NIH N/A
リソースの有無
リード連絡先
リソースや試薬に関する詳細な情報およびリクエストは、リードコンタクトのAndrew Gewirtz (agewirtz@gsu.edu)に直接お送りください。
材料の利用可能性
この研究では、新たな試薬は生成されなかった。
実験モデルおよび被験者の詳細
食餌性マウスモデル
C57BL/6 マウスは Jackson Labs (Bar Harbor, ME) から購入し、Georgia State University で承認された動物プロトコル (IACUC # A20043) に基づいて飼育された。ケージあたり2Fおよび1Mの8週齢のマウスの交配ケージに、穀物ベースのブリーダー食(LabDiet)を投与した。出生後、雄マウスを取り出し、1ケージあたり15〜16リットルを看護する2匹のダムに、穀物ベースの餌(表S1、LabDiet)、または組成を規定した餌、すなわち低繊維低脂肪食(LF-LFD)、イヌリン強化低脂肪食(IE-LFD)、低繊維高脂肪食(LF-HFD)(表S1、 Research Diets, Inc.)を摂取させた。3週齢になった仔魚はダムから離し(離乳)、新しいケージに入れ、12週齢になるまでGBCを与え、その後にLF-HFDを4週間投与することにより、12週齢になった仔魚を離乳させることができた。雄および雌の両方の子マウスを、示されたように研究に使用した。マウスは、指示されたように、仔犬離乳時、12週齢または16週齢で安楽死させられた。血清、糞、および小腸、大腸、肝臓、脂肪組織などの各種臓器を採取し、後の解析のために測定または保存した。
菌種および培養条件
Bifidobacterium longum subsp.longum ReuterはAmerican Type Culture Collection (ATCC, 15707)から入手した。アグリガティバクターは、当社の動物実験施設において免疫不全マウスから分離した。
方法詳細
抗生物質処理
8週齢の子マウスに、アンピシリン(1 g/L)およびネオマイシン(0.5 g/L)を含む飲料水を介して抗生物質を投与した(指示された場合)。これらのマウスは12週齢までGBCで維持され、その後16週齢までLF-HFDで飼育された。抗生物質処置は、LF-HFD曝露の間中維持されるか、または示されるように4週間のLF-HFD曝露の直前に中止された。
共同飼育実験
共同飼育のために、授乳期中にGBC(Pup-GBC)またはLF-LFD(Pup-LF-LFD)を摂取したダムからの雄仔を3週齢で離乳させ、Pup-GBCおよびPup-LF-LFDを単一ケージで、非共同飼育兄弟を対照とする共同飼育をした。これらの同居および非同居の兄弟姉妹には、12週齢までGBCを与え、その後LF-HFDを4週間投与した。12週齢で糞を採取し、微生物叢の解析を行った。LF-HFD投与後16週齢でマウスを安楽死させ、脂肪組織を重量測定し、大腸および脂肪組織中の免疫細胞をFACSで解析した。
糞便微生物叢/細菌移植
食物繊維欠乏マウスの子孫から糞便を移植するため、12週齢の子孫マウスから糞便を採取し、PBSに100mg/mlとして懸濁した。無菌の8週齢のC57BL/6雄マウスをTaconic Incから購入し、上記糞便懸濁液200μlを経口投与した。レシピエントマウスは、他の細菌への曝露を防ぐため、アイソケージで維持した。また、操作されていないマウスの糞便懸濁液+/-プロテオバクテリア強化コンソーシアム(PEC)またはアグリガティバクター単離株を用いて移植を実施した。アンピシリン(1g/リットル)、バンコマイシン(250mg/リットル)、ネオマイシン(1g/リットル)およびメトロニダゾール(1g/リットル)を含む抗生物質カクテルの投与停止1日後にマウスから採取した糞便からPECを生成し、100mg/mlとしてPBSに再懸濁させたことは既に述べたとおりである。PECと分離したアグリガティバクター、は糞便懸濁液に加え、既述37と同様に移植した:3週齢のC57BL/6雄マウスに、腸管洗浄としてポリエチレングリコール溶液(PEG 3350 (77.5 g/L) 、塩化ナトリウム (1.9 g/L) 、硫酸ナトリウム (7. 4g/L)、塩化カリウム(0.98g/L)、炭酸水素ナトリウム(2.2g/L)を添加した後、コントロールGBC飼育マウスの糞便100μlにプロテオバクテリア強化糞便、または105CFUのアグリガティバクター懸濁液を3日間連続経口摂取させた。移植後、これらのマウスにオートクレーブしたGBCを4週間与えた後、LF-HFDをさらに4週間投与した。ただし、従来のマウスには2週間だけLF-HFDを投与した。
体脂肪率および除脂肪率の測定
GBC、LF-LFD、LF-HFDまたはIE-LFDを摂取したダムからの子孫マウスを、12、14または16週齢で、Minispec NMR体組成分析器(Bruker Biospin Corporation; Billeria, MA)を用いて体組成分析に付した。データは、脂肪率または除脂肪率として表した。
グルコース測定
マウスは、指示通りに清潔なケージ内で5時間または16時間、餌を与えずに水を供給された。空腹時血糖値は、Nova Max Plus Glucose Meterを用いて測定し、mg/dLで表した。ブドウ糖負荷試験は以下のように行った:5時間または16時間絶食後、ベースライン血糖値をNova Max plus Glucose meterを用いて測定し、その後体重1gあたり2mgのブドウ糖を腹腔内に注入した。インスリン耐性試験は、5時間絶食させたマウスに0.75Uインスリン/kg体重を腹腔内投与した。ブドウ糖またはインスリンを投与後、30分、60分、90分後の血糖値を測定した。
摂餌量の測定
GBC、LF-LFD、LF-HFDを含む母体飼料を与えたダムからの子マウスに、12週齢までGBCを与えた後、清潔なケージに既知の量のGBC餌を置いた。24時間後、残餌を測定し、1日当たりの餌消費量を算出した。
摂食制限実験
マウスを個々に清潔ケージに入れ、10日間毎日2.8gのLF-HFDを供給した。これは、GBCを与えたマウスの年齢適合子孫が、LF-HFDをアドリビテーション投与した場合に食べる量の80〜90%と推定される量であった。
脂質吸収測定
マウスを16時間絶食させ、tyloxapol i.p注射(250μg/g体重)後30分してから、オリーブオイル(10μl/g体重)を経口摂取させた。投与後0,2,4,6時間目に尾部または眼窩内出血で採血した。血清は遠心分離後に採取し、Infinity triglyceride Reagent (Thermo Scientific, TR22421) を用いて、製造者の指示に従ってトリグリセリド濃度を測定した。
トリグリセリドとコレステロールの測定
Infinity Triglyceride (Thermo Scientific, TR22421) および Cholesterol Reagent (Thermo Scientific, TR13421) を用いて、メーカーの指示に従い血清中のトリグリセリドとコレステロールの濃度を測定しました。96ウェルプレートに2μlの血清と200μlのTriglycerideまたはCholesterol Reagentを順次加え、37℃で5分間インキュベート後、96ウェルプレートリーダーを用いて波長550 nmで測定した。
免疫蛍光染色
空腸、回腸、大腸などの腸管を採取し、OCTで包埋後、4μm厚で切片化した。組織切片を4%パラホルムアルデヒドで室温(RT)30分間固定し、PBSで洗浄した後、冷メタノールで5分間透過処理を行った。腸管切片を5%FBSでブロッキングした後、抗GLP1抗体(Abcam、Ab22625)または抗Ki67抗体(Abcam、Ab15580)と共に4℃で一晩インキュベートした。PBSで3回洗浄後、切片をAlexa Fluor 488 Goat Anti-Rabbit IgGまたはAlexa Fluor 555 Goat Anti-Rabbit IgGで染色した。DAPIを含むマウンティングメディウム(SouthernBiotech、0100-20)で対比染色した後、蛍光顕微鏡でイメージングした。GLP1陽性L細胞の密度およびKi67の蛍光強度は、image Jソフトウェアを用いて測定した。
Brdu染色
12 週齢の子孫マウスに 5-bromo-2-deoxyuridine (BrdU) をマウス体重 1 mg あたり 50 μg 注射し、注入後 24 時間で安楽死させた。空腸1cmを採取してOCTに包埋し,4%パラホルムアルデヒドで30分間RT固定する前に4μmの厚さで切片化した.PBSで洗浄後、切片をあらかじめ温めた1.5N HClで37℃、30分間インキュベートして変性させ、PBSで3回洗浄した。切片を5% FBSで1時間ブロッキングし、Alexa Fluor® 488 Anti-BrdU 抗体 (Abcam, ab74545) で2時間染色し、DAPIを含むマウント液でカウンターステインした。BrdU標識細胞は蛍光顕微鏡で可視化し、移動量はImage Jソフトウェアで測定した。
ヘマトキシリン・エオジン染色
安楽死後、肝臓と副睾丸脂肪を10%リン酸緩衝フォルマリンで少なくとも1週間固定し、70%エタノールに移した。組織はパラフィンに包埋し、標準プロトコールに従ってヘマトキシリン・エオジン(H&E)染色前に 4 μm の厚さで切開した39 。脂肪細胞の大きさは、image J ソフトウェアを使用して測定した。
フローサイトメトリー解析
マウスの脾臓細胞、脂肪中の免疫細胞、および腸管固有層細胞は、既報の方法で調製した40。簡単に言えば、プランジャーの平らな端を用いて脾臓をミンチにして脾臓細胞を放出し、70μmのセルストレーナーを通した。この細胞懸濁液を1,600 rpmで5分間遠心分離した。細胞ペレットを3mLの赤血球溶解バッファーに再懸濁し、PBSで洗浄した。副睾丸脂肪中の免疫細胞を単離するため、脂肪は、先に述べたように、5%FBS入りHBSS中の1 mg/mL のIV型コラゲナーゼ10 mL中で37℃、20分間消化した21。消化後、EDTAを最終濃度10 mmol/Lまで加え、さらに37℃、10分間インキュベーションをした。懸濁液を100 μmと40 μmのストレーナーに順次通し、1600 rpmで4℃、10分間遠心分離した。ペレットを3mLの赤血球溶解バッファーに再懸濁した後、PBSで洗浄した。結腸および小腸の層状固有細胞を分離するために、腸を1cmの長さに切断し、5%牛胎児血清(FBS)および2mmol/L EDTAを含む20mLのHBSSに入れ、37℃で20分間振盪しながら2回インキュベートし、5%FBS、1mg/mLタイプIVコラゲナーゼ(Sigma, C5138-5G) および0. 1 mg/mL DNase I (Sigma, 10104159001)を37℃で10分間振盪しながらインキュベートした。最後に、細胞を40μmセルストレーナーに通し、遠心分離した。分離後、すべての細胞を200 ulの冷たいリン酸緩衝生理食塩水(PBS)で2回洗浄し、Fc-ブロッキング用の抗マウスCD16/CD32(BioXCel)と共にインキュベートした。次に、細胞を蛍光活性化セルソーティング(FACs)バッファー(0.5%ウシ血清アルブミン入りリン酸緩衝生理食塩水)で2回洗浄した。Biolegend, BD Biosciences, eBioscience, Thermofisherから購入した蛍光標識抗体で、主要リソース表に記載したFACSバッファー中で細胞を染色した。染色カクテルには、Anti-CD45 BV605 (1:800), anti-Ly6G AF700 (1:200), anti-Ly6C PerCp-Cy5. 5(1:200)、抗CD11b APC-Cy7(1:200)、抗CD11c BV785(1:100)、抗IA/IE BV650(1:1000)、抗CD64 BV421(1:400)、抗F4/80(1:100)、抗CD103 PE(1:200)、抗CD301 APC(1:200)または抗TCRβ APC(1:200)、抗CD4 PerCP-Cy5.0 を含む混合抗体から構成される。 5(1:200)、抗CD8αパシフィックブルー(1:100)および抗CD19 FITC(1:200)を含む混合抗体を細胞内に添加し、氷上、暗所で30分間インキュベートした。T細胞の機能解析のため、子孫マウスの腸管前膜細胞および脾臓から分離した脾臓細胞に、タンパク質輸送阻害剤(Thermo Scientific、00-4975-93)を含む刺激カクテルを3時間、in vitroで投与した。細胞を抗CD4 APC-AF780 (1:200)で染色した後、Fix/Permバッファーを用いて固定・透過させ、FoxP3染色バッファー(Thermo Scientific, 00-5523-00)中で抗FoxP3 APC (1:100), 抗IFN-γ BV785 (1:100) および抗IL-17 PE (1:100)などで細胞内染色をした。細胞をFACsバッファーで3回洗浄し、200 ulのFACsバッファーに再懸濁した。CytoFlex (Beckman Coulter)でマルチパラメーター分析を行い、FlowJoソフトウェア(Tree Star)を用いて異なる免疫細胞集団のパーセンテージを分析した。単球の測定には、CD11b+&Ly6C+集団から好中球を差し引いた。
IgA被覆細菌の解析
12週齢の子孫マウスまたはRag1 koマウス(陰性対照)から糞便ペレットを採取し、100mg/mlとしてPBSに懸濁した後、100μmおよび40μmのナイロンメッシュで濾過した。200μlのパススルーは、10,000rpmで1分間の遠心分離によってペレット化された。得られた細菌ペレットをPBSで2回洗浄した後、20%正常ラット血清でブロッキングし、氷上で20分間インキュベートした。ブロッキング後、細菌を染色バッファ(PBS中1%BSA)中1:50の希釈でPE標識抗マウスIgA(eBioscience、12-4204-82)で30分間氷上で染色した。染色バッファで3回洗浄した後、細菌ペレットをSytoBC(Invitrogen、S34855)の1:5000希釈液を含む染色バッファで再懸濁した。サンプルは染色バッファーで2回洗浄した後、CytoFlex (Beckman Coulter)で分析した。
試験管内での微生物共培養
Bifidobacterium longum subspeciesとAggregatibacterをBHI培地で37℃、嫌気状態で一晩前培養し、連続希釈とコロニーカウントにより菌数を測定した。アグリガティバクターは単独またはビフィドバクテリウムと1:1の割合(6×105cfu/ml VS 6×105cfu/ml)でBHI培地で嫌気状態で30時間共培養し、培養後にサンプルを採取してアグリガティバクターの相対量をqPCRにより分析した。簡単に説明すると、0.5mlの菌培養液を遠心分離し、その後ペレットを0.5mlのPBSに再懸濁し、10分間煮沸してから12000rpmで10分間遠心分離して上清を採取した。上清の1μlをqPCRのためのDNAテンプレートとして使用し、Pasteurellaceae特異的プライマー: 5'-CATAAGATGAGCCCAAG-3; 5'-GTCAGTACATTCCCAAGG-3 をQuantiFast SYBR Green PCR kit (Bio-Rad, Hercules, CA) を用いて使用した。結果は、非共培養と共培養の間の2-CTの比率として表される。
ELISA法
12週齢の子マウスから糞便を採取し、100mg/mlのPBSでホモジナイズした後、12000rpmで10分間遠心分離し、上清を-80℃にて保存した。DuoSet Mouse Lipocalin-2/NGAL ELISA (R&D Systems, DY1857) キットを用い、その付属の説明書に従って糞便の上清中のLipocalin-2の濃度を測定した。血清中のフラジェリンおよびLPS特異的抗体は、既報の方法に従って測定した43。96ウェルEIA/RIAコーニングプレートに精製LPS(2mg/ウェル)またはフラジェリン(100ng/ウェル)をコートし、1:500希釈の血清をコートプレートに塗布した。3回洗浄後、ウェルを抗マウスIgG-HRP(1:1000)とインキュベートし、標準的なELISA分析を行った。血清中の総 IgG1 および IgG2C を測定するために、96 ウェル EIA/RIA コーニングプレートに抗マウス IgG 抗体 (Sigma, M2650-1M) を RT で一晩コートした。プレートを洗浄バッファ(PBS中0.05% Tween 20)で洗浄し、PBS中1%ミルクで1時間RTでブロッキングした。血清はPBS中の0.5%正常ヤギ血清で1:500に希釈し、プレート中に添加した。1時間インキュベート後、プレートを洗浄し、ストレプトアビジン-HRPでインキュベートする前に、PBS中の1%ミルクで1:500に希釈したビオチン標識抗マウスIgG1(Southern Biotech、1070-08)またはIgG2C(Southern Biotech、1079-08)を100 ul/ウェルで加え、RTで1時間反応させました。3回洗浄した後、TMB溶液を加えて発色させた。
qRT-PCR
安楽死後、結腸、肝臓、精巣上体脂肪を採取した。TRIzol(Invitrogen, Carlsbad, CA)を用いて、付属の説明書に従って結腸、肝臓および副睾丸脂肪からtotal RNAを単離し、RNeasy mini kit RNA cleanup procedure(Qiagen, Valenica, CA)を用いて肝臓および脂肪のmRNAをさらに精製した。肝と脂肪のIL-6、TNF-α、MCP-1、結腸のclaudin-1の発現レベルは、Biorad iScript™ One-Step RT-PCR Kitに従い、CFX96装置(Bio-Rad、Hercules、CA)で、主要リソース表に記載のプライマーで定量RT-PCR(qRT-PCR)を使用して分析した。転写レベルの差は、各アンプリコンをハウスキーピング遺伝子36B4に正規化することで定量化した。
糞便および回腸組織における細菌の定量化
糞便中の総細菌量を測定するために、QIAamp DNA Stool Mini Kit (Qiagen, 51504) を用いて錘付き糞便から総DNAを単離した。次に、このDNAを、ユニバーサル16S rRNAプライマー8F:5′-AGTTTGATCCTGGCTCAG-3′および338R:5′-CTGCTGCCTCCCGTAGAGT-3′を用いて、 QuantiFast SYBR Green PCR kit (Biorad, 204054) による定量PCRに付して、全菌数の計測を行なった。結果は、標準曲線を用いて、便1mgあたりの細菌数で表した。回腸組織に付着している細菌を測定するために、回腸遠位部を2cm切断し、内容物を流し、回腸組織をPBSで3回洗浄した後、QIAamp DNA Stool Mini Kitを用いてDNA抽出を行った。抽出したDNAを鋳型として、ユニバーサル16S rRNAプライマー8Fおよび338R、18S rRNAプライマー(5′-GTAACCCGTTGAACCCCATT-3′, 5′-CCATCCAATCGTAGTAGCG-3′ )をそれぞれ用いて細菌および宿主細胞の測定に使用した。回腸組織における細菌の相対量の差は、各アンプリコンを宿主細胞のハウスキーピング遺伝子18S rRNAで正規化することにより定量化した。
FISH染色による菌の局在化
回腸と結腸をメタノール-カルノー固定液(60%メタノール、30%クロロホルム、10%氷酢酸)中に室温で3時間以上静置した。回腸と結腸の細菌の局在は、以前に記述したように、16s rRNA FISHを用いて染色した14。簡単に言えば、組織をメタノール2x 30分、エタノール2x 20分、キシレン2x 20分で順次洗浄し、パラフィンに包埋して切片化した。組織切片は、60℃で10分間予熱した後、キシレン60℃で10分間、キシレン10分間、99.5%エタノール10分間で脱脂した。脱パラフィンした切片を、ハイブリダイゼーションバッファー(20 mM Tris-HCl, pH 7.4, 0.9 M NaCl, 0.1% SDS, 20% formamide)で10 μg/mLに希釈したEUB338プローブ(5'-GCTGCCTCCCGTAGAGT-3'、アレクサ647で5 'を標識)とともに50℃で一夜インキュベートした。洗浄バッファー(20 mM Tris-HCl, pH 7.4, 0.9 M NaCl)で10分間インキュベートし、PBSで3回洗浄後、乾燥させ、スライドをブロッキングし抗ムチン2抗体(サンタクルーズバイオテクノロジー、H-300)で染色してから抗ラビットAlexa 488二次抗体とファロイジンTetramethyl rhodamine B isothiocyanate (Sigma, P1951-.1MG) でインキュベートしてからDAPI含有マウント媒質でマウントした。抗ムチン-2抗体で染色したムチンの厚みと、細菌の上皮細胞までの距離をimage Jソフトを用いて測定した。
16S rRNA遺伝子配列解析による腸内細菌叢の解析
糞便DNA抽出、16S rRNA遺伝子増幅、シークエンス解析は、記載の方法で実施した44。簡単に説明すると、DNeasy 96 PowerSoil Pro QIAcube HT Kitを用いて糞便DNAを抽出し、抽出したDNAを用いて、Georgia Institute of Technology Molecular Evolution Core (Atlanta GA)にて以下のフォワードおよびリバースプライマーを用いて16S rRNA遺伝子のV4領域を増幅させた。515fb 5′TCCGTGCAGCTCAGATGTGTAAGACAGGTGYCAGcmGCCGG TAA-3′;806RB 5′GTCTCGTGCTCAGATGTGTAAGAGAGAGCTACNVGAG
GTWTCTAAT-3′; または我々の研究室で次のプライマーを用いて領域V3-V4を増幅する: 5′TCGTCGCAGCGTCAGATGTGTATAAGACAGCCTACGGGNGGCWGCAG-3′; 5′GTCTCGTGGCTCGAGATGTGTATAAGACAGGACTACHVGGGTATCTAATCC-3′. Ampure XP磁気精製ビーズを使用して各サンプルのPCR産物を精製し、バイオアナライザー高感度チップを使用するかDNAゲル上で実行してアンプリコンの大きさを確認した。Nextera XT Index Kitを使用して、デュアルインデックスとイルミナシーケンスアダプターを取り付けるために2回目のPCRが行われた。その後、生成物を定量してから、等モル比で精製した生成物からDNAプールを生成した。希釈したライブラリーに10% PhiXコントロールをスパイクし、当ラボのiSeq™ 100シーケンスシステム(ペアエンドリード、2×150塩基対)、またはジョージア工科大学Molecular Evolution Core (Atlanta GA) のIllumina MiSeqシーケンサー(ペアエンドリード、2×250塩基対)でシーケンシングを実施した。シーケンシャルをデマルチプレックスした後、Qiime2のDADA2プラグインを使用して、品質フィルタリング、ノイズ除去、キメラの除去を行いました。Qiime2パイプラインのEmperorを用いて、unweighted UniFrac tableに基づくPCoA (Principal Coordinate Analysis) プロットを可視化した。分類はGreengenes 16S rRNA遺伝子データベースに基づいて行いました。
定量化・統計解析
データは、特に断りのない限り、平均値 +/- SEM で表した。結果の統計的有意性は、図凡例に示すように、対応のない学生t検定または一元配置分散分析(ANOVA)を用いて分析した。実験群間の差は、*P<0.05、*P<0.01、**P<0.001で有意であるとみなした。∗∗P < 0.0001; #p<0.05, ##p < 0.01, ###p < 0.001, ####p < 0.0001, ns, not significant.で有意とした。解析はGraphPad Prism 9を用いて行った。
謝辞
この研究は、National Institute of Diabetes and Digestive and Kidney Diseasesの助成金DK099071 (A.T.G.) および DK083890 (A.T.G.) によって支援されている。J.Z.はAmerican Diabetes Association (#1-19-JDF-077)の助成を受けた。
著者による貢献
J.Z.とA.T.G.はプロジェクトの構想および実験の設計を行った。J.Z.とA.T.G.は、他のすべての著者の意見を取り入れながら原稿を作成した。J.Z.、V.L.N.、Yanling.W.、Yadong.W.は実験とデータ解析を行った。
利害関係の宣言
著者らは、競合する利害関係を宣言していない。
補足情報
すべての補足ファイルをダウンロードするヘルプ
ダウンロード Acrobat PDFファイルのダウンロード(3MB)
資料S1. 図S1〜S6、表S1.
ダウンロード ダウンロード:Acrobat PDFファイル(8MB)
資料S2. 論文と補足情報。
データおよびコードの入手方法
生シークエンスデータはGenBankに寄託されている。また、本研究で使用した他の全てのデータは、リード・コンタクトからの合理的な要求に応じて共有される。
本論文では、オリジナルのコードは報告していません。
この論文で報告されたデータを再解析するために必要な追加情報は、要求に応じて主管者から入手可能です。
参考文献
1
M.G. Saklayen
メタボリックシンドロームの世界的蔓延
Curr. Hypertens. Rep., 20 (2018), p.12, 10.1007/s11906-018-0812-z
Google Scholar
2
E.R.プルガロン、A.M.デラマター
小児における肥満と2型糖尿病:疫学と治療
Curr. Diab. Rep., 14 (2014), p.508, 10.1007/s11892-014-0508-y
ScopusGoogle Scholarで記録を見る
3
Y. 武田 浩二、藤原 謙一、根立 亮、池田 勇、森川 聡一、八田 昌彦、堀川 千尋、加藤 正樹、横山 裕、栗原 浩一
2型糖尿病患者における食事エネルギー密度およびエネルギー摂取量、大栄養素と肥満の関連性の比較 (JDDM 63)
ニュートリエンツ, 13 (2021), p.3167, 10.3390/nu13093167
ScopusGoogle Scholarで記録を見る
4
J.A. Mendoza、A. Drewnowski、D.A. Christakis
食事エネルギー密度は、米国成人の肥満およびメタボリックシンドロームと関連している
Diabetes Care, 30 (2007), pp.974-979, 10.2337/dc06-2188
ScopusGoogle Scholarで記録を見る
5
A. Lee, M. Cardel, W.T. Donahoo
肥満に影響を及ぼす社会的・環境的要因
K.R. Endotext, B. Feingold, A.B. Anawalt, G. Chrousos, W.W. de Herder, K. Dhatariya, K. Dungan, J.M. Hershman, J. Hofland, S. Kalra, et al. (Eds.) (2000)
Google Scholar
6
I. ロミュー、L. ドスース、S. バルケラ、H.M. ブロッティエール、P.W. フランクス、M. グンター、N. フワラ、S.D. ハースティング、M. ライツマン、B. マーゲット、西田千晶
エネルギーバランスと肥満:主なドライバーは何ですか?
Cancer Causes Control, 28 (2017), pp.247-258, 10.1007/s10552-017-0869-z
ScopusGoogle Scholarで記録を見る
7
T.A. Breuninger、N. Wawro、J. Breuninger、S. Reitmeier、T. Clavel、J. Six-Mercer、G. Pestoni、S. Rohrmann、W. Rathmann、A. Peters、H. Grallert
潜在的ディリクレ配分法を用いた習慣的食事、代謝性疾患、腸内細菌叢の関連性
マイクロバイオーム, 9 (2021), p.61, 10.1186/s40168-020-00969-9
ScopusGoogle Scholarで記録を見る
8
M.T.ベラスケス
腸内細菌叢の変化。食事とメタボリックシンドロームの関連性
Metab. Syndr. Relat. Disord., 16 (2018), pp.321-328, 10.1089/met.2017.0163
ScopusGoogle Scholarで記録を見る
9
S. 栃谷
腸内細菌叢の垂直伝播:脳の発達に影響を及ぼす環境因子の作用点
Neurosci. Res., 168 (2021), pp.83-94, 10.1016/j.neures.2020.11.006
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
10
F. アスニカー、S. マナーラ、M. ゾルフォ、D.T. トゥルーン、M. ショルツ、F. アルマニーニ、P. フェレッティ、V. ゴルファー、A. ペドロッティ、A. テット、N. セガタ
ストレインレベルのメタゲノムプロファイリングによる母親から乳児への垂直的なマイクロバイオーム伝達の研究
mSystems, 2 (2017), 10.1128/mSystems.00164-16
e00164
Google Scholar
11
K. Fehr, S. Moossavi, H. Sbihi, R.C.T. Boutin, L. Bode, B. Robertson, C. Yonemitsu, C.J. Field, A.B.Becker, P.J. Mandhane, et al.
母乳育児の実践は母乳と乳児の腸内細菌の共在と関連している:CHILDコホート研究
Cell Host Microbe, 28 (2020), pp.285-297.e4, 10.1016/j.chom.2020.06.009
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
12
C.L.グランジャー、N.D.エンブルトン、J.M.パーマー、C.A.ラム、J.E.ベリントン、C.J.スチュワート
母乳、乳児の腸内細菌叢と早産児の健康への影響
Acta Paediatr., 110 (2021), pp.450-457, 10.1111/apa.15534
ScopusGoogle Scholarで記録を見る
13
L.M. Cox, S. Yamanishi, J. Sohn, A.V. Alekseyenko, J.M. Leung, I. Cho, S.G. Kim, H. Li, Z. Gao, D. Mahana, et al.
重要な発達の窓の間に腸内細菌叢を変更すると、持続的な代謝的影響がある
Cell, 158 (2014), pp.705-721, 10.1016/j.cell.2014.05.052
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
14
J. ゾウ、B.シャサイング、V.シン、M.ペリゾン、M.リッチ、M.D.ファイス、M.V.クマル、A.T.ゲヴィルツ
食物繊維を介した腸内細菌叢の滋養は、IL-22を介した大腸の健康状態を回復させることにより、食事誘発性肥満から保護する
Cell Host Microbe, 23 (2018), pp.41-53.e4, 10.1016/j.chom.2017.11.003
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
15
J. Zou, L. Reddivari, Z. Shi, S. Li, Y. Wang, A. Bretin, V.L. Ngo, M. Flythe, M. Pellizzon, B. Chassaing, A.T. Gewirtz
イヌリン発酵繊維はIL22と短鎖脂肪酸を介して実験モデルでI型糖尿病を改善させる
Cell. Mol. Gastroenterol. Hepatol., 12 (2021), pp.983-1000, 10.1016/j.jcmgh.2021.04.014
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
16
M. Pellizzon
実験動物の飼料選択は腸の健康状態に影響する
ラボ・アニマル. (NY), 45 (2016), pp.238-239, 10.1038/laban.1014
ScopusGoogle Scholarで記録を見る
17
C.J. Tuck, G. De Palma, K. Takami, B. Brant, A. Caminero, D.E. Reed, J.G. Muir, P.R. Gibson, A. Winterborn, E.F. Verdu, et al.
ネズミの飼料の栄養プロファイルがマイクロバイオーム前臨床研究の実験的再現性に影響を与える
Sci. Rep., 10 (2020), p.17784, 10.1038/s41598-020-74460-8
ScopusGoogle Scholarで記録を見る
18
M.S. Desai, A.M. Seekatz, N.M. Koropatkin, N. Kamada, C.A. Hickey, M. Wolter, N.A. Pudlo, S. Kitamoto, N. Terrapon, A. Muller, et al.
食物繊維を欠く腸内細菌叢は大腸粘液バリアーを分解し、病原体感受性を亢進させる
Cell, 167 (2016), pp.1339-1353.e21, 10.1016/j.cell.2016.10.043
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
19
P.J.ターンボー、F.ベッケド、L.フルトン、J.I.ゴードン
食事誘発性肥満は、マウス遠位腸内細菌群の顕著な、しかし可逆的な変化と関連している
Cell Host Microbe, 3 (2008), pp.213-223, 10.1016/j.chom.2008.02.015
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
20
Z. アル・ナバニ、S・デュロワ、E・レキュイエ、B・ポロマック、P・カンパーニュ、M・ベラルド、G・エベール
生後早期のカロリー過剰摂取は成人期の大腸炎への感受性を高める
Nat. Metab., 1 (2019), pp.1101-1109, 10.1038/s42255-019-0129-5
ScopusGoogle Scholarで記録を見る
21
H.Q. Tran、A. Bretin、A. Adeshirlarijaney、B.S. Yeoh、M. Vijay-Kumar、J. Zou、T.L. Denning、B. Chassaing、A.T. Gewirtz
「西洋式ダイエット」によって誘発される脂肪の炎症には、複雑な腸内細菌叢が必要である
Cell. Mol. Gastroenterol. Hepatol., 9 (2020), pp.313-333, 10.1016/j.jcmgh.2019.09.009
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
22
J. Zou, X. Zhao, Z. Shi, Z. Zhang, M. Vijay-Kumar, B. Chassaing, A.T. Gewirtz
適応免疫の非存在下におけるフラジェリンに対する自然免疫の重要な役割
J. Infect. Dis., 223 (2021), pp.1478-1487, 10.1093/infdis/jiaa521
ScopusGoogle Scholarで記録を見る
23
M.E. Johansson, M. Phillipson, J. Petersson, A. Velcich, L. Holm, G.C. Hansson
結腸の2つのMuc2ムチン依存性粘液層の内側には細菌が存在しない
Proc. Natl. Acad. Sci. USA, 105 (2008), pp.15064-15069, 10.1073/pnas.0803124105
ScopusGoogle Scholarで記録を見る
24
B. 劉 浩、聶 慈、張 啟、安 偉、李 鍾昊
Lycium ruthenicum Anthocyanins は腸内細菌叢を調節することにより高脂肪食誘発性大腸バリア機能障害および炎症を抑制する。
Mol. Nutr. Food Res., 65 (2021), p. e2000745, 10.1002/mnfr.202000745
Google Scholar
25
R. クルチアレッロ、K.E.キャンツィアーニ、G.H.ドセナ、C.I.ムグリア
腸管炎症の活性化および調節における非免疫細胞の寄与
Front. Immunol., 10 (2019), p.647, 10.3389/fimmu.2019.00647
ScopusGoogle Scholarで記録を見る
26
N.D.ゲス、A.ドーンホースト、N.オリバー、J.D.ベル、E.L.トーマス、G.S.フロスト
無作為化比較試験:糖尿病予備軍被験者の体重管理および異所性脂肪に対するイヌリンの効果
Nutr. Metab. (Lond.), 12 (2015), p.36, 10.1186/s12986-015-0033-2
ScopusGoogle Scholarで記録を見る
27
C. Petersen, R. Bell, K.A. Klag, S.H. Lee, R. Soto, A. Ghazaryan, K. Buhrke, H.A. Ekiz, K.S. Ost, S. Boudina, et al.
T細胞を介した微生物叢の制御が肥満を防ぐ
サイエンス, 365 (2019), p. eaat9351, 10.1126/science.aat9351
ScopusGoogle Scholarで記録を見る
28
D. Vandeputte、G. Falony、S. Vieira-Silva、J. Wang、M. Sailer、S. Theis、K. Verbeke、J. Raes
プレバイオティクスであるイヌリン型フルクタンは、ヒトの腸内細菌叢に特異的な変化を誘発する
Gut, 66 (2017), pp.1968-1974, 10.1136/gutjnl-2016-313271
ScopusGoogle Scholarで記録を見る
29
S.J. O'Keefe(オキーフ
食物繊維の不足と高所得者の生活習慣関連疾患との関連性。バーキット仮説の再検討
Lancet Gastroenterol. Hepatol., 4 (2019), pp.984-996, 10.1016/S2468-1253(19)30257-2
記事ダウンロードPDF表示ScopusGoogle Scholarで記録を見る
30
A. コー、F.デヴァダー、P.コヴァチェヴァ-ダッチャリー、F.ベッケド
食物繊維から宿主生理学へ。細菌の主要代謝産物としての短鎖脂肪酸
Cell, 165 (2016), pp.1332-1345, 10.1016/j.cell.2016.05.041
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
31
B. シャサイング、O・コレン、J・K・グッドリッチ、A・C・プール、S・スリニバサン、R・E・レイ、A・T・ゲヴィルツ
正誤表:食事性乳化剤はマウスの腸内細菌叢に影響を与え、大腸炎とメタボリックシンドロームを促進する
ネイチャー, 536 (2016), p.238, 10.1038/nature18000
Google Scholar
32
F.A. Carvalho, O. Koren, J.K. Goodrich, M.E. Johansson, I. Nalbantoglu, J.D. Aitken, Y. Su, B. Chassaing, W.A. Walters, A. González, et al.
プロテオバクテリアの一過性の管理不能が、TLR5欠損マウスにおける慢性腸炎を促進する
Cell Host Microbe, 12 (2012), pp.139-152, 10.1016/j.chom.2012.07.004
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
33
P.D. Cani, J. Amar, M.A. Iglesias, M. Poggi, C. Knauf, D. Bastelica, A.M. Neyrinck, F. Fava, K.M. Tuohy, C. Chabo, et al.
代謝性エンドトキシン血症は、肥満とインスリン抵抗性を開始する
Diabetes, 56 (2007), pp.1761-1772, 10.2337/db06-1491
ScopusGoogle Scholarで記録を見る
34
M.J.ブレイザー
私たちの行方不明の微生物:短期間の抗生物質投与は長期的な結果をもたらす
Cleve. クリンです。J. Med., 85 (2018), pp.928-930, 10.3949/ccjm.85gr.18005
ScopusGoogle Scholarで記録を見る
35
E.D. Sonnenburg、S.A. Smits、M. Tikhonov、S.K. Higginbottom、N.S. Wingreen、J.L. Sonnenburg
ダイエットが誘発する腸内細菌叢の絶滅は、世代を超えて複合する
ネイチャー, 529 (2016), pp.212-215, 10.1038/nature16504
ScopusGoogle Scholarで記録を見る
36
Y. Zhang, Z. Ran, M. Tian, Y. Zhou, J. Yang, J. Yin, D. Lu, R. Li, J. Zhong(チャン、ラン、ティエン、周、李、鍾
百日咳菌感染に対する宿主体液性免疫に影響を及ぼすコンセンサルティング微生物の存在
Infect. Immun., 87 (2019), 10.1128/IAI.00421-19
e00421-19
グーグル スカラー
37
T. ルロワ、J.デベダ、F.マルケ、C.ダクーニャ、F.イシュ、M.ゲレミロ、N.カペル、J.アロン-ウィズネフスキー、K.クレマン
マウスモデルにおける糞便微生物移植後の微生物生着の比較評価:年齢、動態および微生物の状態に関する事項
Front. Microbiol., 9 (2018), p.3289, 10.3389/fmicb.2018.03289
ScopusGoogle Scholarで記録を見る
38
Z. Zhang、J. Zou、Z. Shi、B. Zhang、L. Etienne-Mesmin、Y. Wang、X. Shi、F. Shao、B. Chassaing、A.T. Gewirtz
IL-22による細胞外遊出とIL-18による細胞死がロタウイルス感染を予防・治癒させる
サイエンス・イミュノール, 5 (2020), 10.1126/sciimmunol.abd2876
eabd2876
Google Scholar
39
J. Zou, N. Shankar
表面タンパク質Espは腸球菌感染時にNF-κBの活性化を介して炎症性サイトカインの発現を促進する
イネイト・イミュン, 22 (2016), pp.31-39, 10.1177/1753425915611237
ScopusGoogle Scholarで記録を見る
40
B. Zhang, D. Oyewole-Said, J. Zou, I.R. Willliams, A.T. Gewirtz
マウス骨髄におけるTLR5シグナルは造血前駆細胞の増殖を誘導し、放射線からの生存を補助する
ブラッドアド, 1 (2017), pp.1796-1806, 10.1182/bloodadvances.2017006981
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
41
N.W. Palm, M.R. de Zoete, T.W. Cullen, N.A. Barry, J. Stefanowski, L. Hao, P.H. Degnan, J. Hu, I. Peter, W. Zhang, et al.
免疫グロブリンAコーティングは、炎症性腸疾患におけるコリトジェニック細菌を特定する
Cell, 158 (2014), pp.1000-1010, 10.1016/j.cell.2014.08.006
記事ダウンロードPDF表示ScopusGoogle Scholarでの記録
42
A.L. Kau, J.D. Planer, J. Liu, S. Rao, T. Yatsunenko, I. Trehan, M.J. Manary, T.C. Liu, T.S. Stappenbeck, K.M. Maleta, et al.
栄養不良のマラウイ人小児の食事依存性腸症を引き起こすIgA標的細菌分類の機能的特徴
Sci. Transl. Med., 7 (2015), p.276ra24, 10.1126/scitranslmed.aaa4877
Google Scholar
43
T. Hagan, M. Cortese, N. Rouphael, C. Boudreau, C. Linde, M.S. Maddur, J. Das, H. Wang, J. Guthmiller, N.Y. Zheng, et al.
抗生物質による腸内細菌叢の擾乱は、ヒトのワクチンに対する免疫力を変化させる
Cell, 178 (2019), pp.1313-1328.e13, 10.1016/j.cell.2019.08.010
記事ダウンロードPDFView Record in ScopusGoogle Scholar
44
J. An, X. Zhao, Y. Wang, J. Noriega, A.T. Gewirtz, J. Zou
-を用いた食事はCitrobacter rodentiumのコロニー形成とクリアランスを阻害する。
PLoS Pathog., 17 (2021), 10.1371/journal.ppat.1009497
e1009497
Google Scholar
この記事が気に入ったらサポートをしてみませんか?
