肥満は雌雄マウスにおいてインフルエンザウイルスによる重症化を増幅する
メインコンテンツへスキップ
MUCIMM
ソクムシム
ログイン
検索...
論文|プレスリリース
肥満は雌雄マウスにおいてインフルエンザウイルスによる重症化を増幅する
https://www.mucosalimmunology.org/article/S1933-0219(23)00070-3/fulltext?utm_medium=SORG&utm_source=TW&dgcid=STMJ_1700575936_TOPA_TOPOTR
パブロ・C・アラルコン
ミシェル・S・M・A・デーメン
キャシディ・J・ウラノヴィッチ
サラ・サボ
ウィリアム・J・ザカリアス
セナド・ディヴァノヴィッチ
すべての著者を表示
オープンアクセス掲載:2023年10月13日DOI:https://doi.org/10.1016/j.mucimm.2023.09.004
PlumXメトリクス
インフルエンザウイルスによる呼吸器肺炎は、依然として公衆衛生上の大きな関心事である。肥満、代謝性疾患、および女性の性別は、インフルエンザウイルスによる肺疾患の重症度を悪化させる独立した危険因子と考えられている。しかし、雌性マウスにおける重度の肥満の実験モデルがないため、発見に基づく研究は限られている。本研究では、30℃の恒温恒湿環境と高脂肪食(HFD)の給与により、雌性C57BL/6マウスに重度の肥満と代謝性疾患を誘導し、インフルエンザウイルス感染時の反応を重度の肥満の雄性C57BL/6マウスと比較した。その結果、痩せ型の雄マウスと雌マウスは、インフルエンザウイルス感染時の肺水腫、炎症、免疫細胞浸潤が同程度であることが示された。標準的な飼育条件では、HFD飼育の雄マウス(雌マウスは飼育していない)は、重度の肥満、代謝性疾患、インフルエンザ罹患率の悪化を示した。しかし、メスマウスに恒温恒湿飼育とHFD給餌を組み合わせると、重度の肥満と代謝性疾患が誘発され、インフルエンザウイルスによる疾患の重症度を重度の肥満のオスマウスに匹敵するレベルまで増幅させるのに十分であった。最後に、感染時の雌雄マウスの総体重の増加は、インフルエンザウイルスに起因する疾患の重症度指標の悪化と相関していた。以上の結果から、肥満および代謝性疾患がインフルエンザ重症化の重要な危険因子であることが確認され、インフルエンザウイルスによる重症化における性別、肥満および代謝性疾患形質のメカニズム解明に適した新しいマウス実験モデルが示された。
背景
インフルエンザウイルス感染は、依然として公衆衛生上の大きな脅威である。社会教育やワクチン接種キャンペーンにもかかわらず、インフルエンザウイルスによる呼吸器肺炎の負担は依然として大きく、世界全体で年間3,200万人の患者と570万人の入院が推定されている1。従来から、年齢、慢性肺疾患、妊娠、免疫不全状態、女性の性別は、インフルエンザ疾患の重症度を悪化させるリスクが高い重要な因子と考えられている2。さらに、2009年のH1N1インフルエンザA型パンデミックでは、肥満がインフルエンザ疾患の重症度と死亡率の独立した危険因子であることが証明された3。
肥満は衰えることのない大流行であり、世界中で5億人以上の人々に影響を及ぼしている4。肥満は、2型糖尿病、非アルコール性脂肪性肝疾患(NAFLD)、心血管疾患などの代謝性疾患と密接な関係がある5。これらの肥満に関連した後遺症を持つ人は、インフルエンザ感染時に重症肺炎に移行するリスクが高い6, 7。また、肥満に伴う免疫系の変調は、インフルエンザ感染時の病原性インフルエンザ株の出現促進8、ウイルス排出の長期化9、インフルエンザ感染後の適応反応の障害10とも関連している。しかし、肥満に関連したインフルエンザウイルスによる疾患の重症化の根本的な免疫学的原因は、まだ明らかにされていない11。
性別もまた、インフルエンザウイルス感染時の転帰悪化に関連する危険因子である。特に、思春期以降の女性は、季節性およびパンデミックに関連したインフルエンザ株に対して、年齢をマッチさせた男性よりも高い罹患率および死亡率を示す12, 13。特に、2009年のH1N1パンデミックの際には、女性の入院率および死亡率が男性よりも高かった14。さらに、インフルエンザウイルスのチャレンジ研究のメタアナリシスから、女性は男性と比較して、同じウイルス量からより多くの症状を発症する可能性が高いことが明らかになった15。しかし、このような女性におけるインフルエンザ疾患の重症化しやすい体質の根底にある機序は、まだ明らかにされていない。過小評価されている要因のひとつは肥満かもしれない。重要なことに、世界的な重度の肥満の割合は、男性に比べて女性の方が高い16, 17。したがって、女性における高度肥満の有病率の増加は、インフルエンザウイルスに起因する重症度の増加と関連している可能性がある。しかし、臨床的意義があるにもかかわらず、これまでに実施された疫学研究では、インフルエンザ疾患の発症における高度肥満、代謝性疾患、性別の交差点には焦点が当てられていない。
肥満におけるインフルエンザウイルスによる重症化に焦点を当てた実験的研究は、ほとんど高脂肪食(HFD)を与えた肥満の雄マウスのみを用いている。実際、これらの重度の肥満雄マウスは、痩せた雄マウスと比較して、死亡率、肺水腫、肺免疫細胞浸潤、気管支肺胞洗浄液(BALF)中の炎症性サイトカインレベルが高いことが報告されている18。しかし、野生型(WT)C57BL/6雌マウスは、重度の食事誘発性肥満(DIO)や代謝性疾患から保護されている19。C57BL/6雌マウスの肥満誘導が不十分である一因として、代謝恒常性に大きな役割を果たす飼育環境温度が考えられる。動物飼育施設は、そのような環境で働く人間が快適に過ごせるように、主に「室温」(19℃~22℃)に保たれている。しかし、マウスのサーモニュートラル(TN)ゾーンは30 °C~32 °Cであり、この温度以下で飼育すると、マウスは慢性的なサーモストレス(TS)状態にさらされ、ストレスホルモンの分泌(コルチコステロンとカテコールアミン)、細胞のエネルギー消費、免疫反応が悪化する20。
30℃のTN飼育は、体温維持のための代謝エネルギー消費を最小限に抑え21、TS飼育の影響を緩和し、マウスが代謝恒常性を達成できるようにする。特に、TN飼育とHFD給餌の組み合わせは、様々なモデルマウスで肝炎を増加させ、メスマウスにNAFLD22を発症させるだけでなく、アテローム性動脈硬化症23、グルコース代謝異常、内臓脂肪増加19の発症を促進する。したがって、TN飼育がメスマウスの重篤なDIOおよび代謝性疾患を促進する能力は、肥満メスおよびオスマウスの両方におけるインフルエンザウイルス感染を研究するための新規かつ効果的なモデルとなった。
本研究では、インフルエンザウイルスによる重症化に対する肥満と性別の寄与を明らかにするために、食餌(チャウ食[CD]vs.HFD)、飼育温度(TS vs.TN)、マウスの性別(雄vs.雌)のバリエーションを用いた。感染が成功したことを確認するために、感染細胞の細胞膜内に存在するウイルスマトリックスタンパク質であるインフルエンザM1タンパク質の総体重減少および肺RNA発現を用いた。インフルエンザ疾患の重症度を解析するために、肺水腫を推定するために、また、インフルエンザウイルス感染後の肺組織の病理組織学的変化を半定量的に調べるために、水洗していない左肺の重量を用いた。さらに、BALF中の炎症性サイトカインレベルと肺免疫細胞(マクロファージと好中球を含む総CD45+細胞)浸潤を用いて、インフルエンザウイルスによる肺の炎症と疾患の重症度を判定した。その結果、痩せ型の雄マウスと雌マウスでは、インフルエンザ感染時の肺水腫、炎症、免疫細胞浸潤が同程度であることがわかった。雄マウスのTS条件下でのHFD給餌は、肥満、代謝性疾患(内臓脂肪、グルコース代謝異常、肝細胞障害など)、およびインフルエンザウイルス駆動性疾患重症度の悪化を誘導するのに十分であるが、雌マウスのTS条件下でのHFD給餌のみでは、重度の肥満を誘導するにも、インフルエンザウイルス駆動性疾患重症度を増幅させるにも不十分である。しかし、TN飼育とHFD給餌を組み合わせた我々の新しいモデルを用いることで、メスマウスに重度の肥満と代謝性疾患を誘導することが可能となり、重度の肥満に関連するインフルエンザウイルス駆動性疾患の重症度と関連する表現型を完全に明らかにすることができた。最後に、体重の増加がインフルエンザウイルス駆動性疾患の悪化と正の有意な相関を示すことを、オスとメスの重度の肥満マウスの両方で示した。これらの知見を総合すると、インフルエンザウイルス駆動性疾患の重症度に代謝性疾患が寄与していることが雌雄ともに証明され、肥満、代謝性疾患、およびインフルエンザ疾患発症における性差の根底にある重要な細胞および分子メカニズムをさらに解明するために、今後DIOの強固な実験モデルを使用する必要性が浮き彫りになった。
結果
痩せた雌雄マウスはインフルエンザウイルスによる重症度は同等である
インフルエンザウイルスによる疾患の重症度における性別の寄与を検討するために、年齢をマッチさせた痩せた雌雄マウスを、生理食塩水でモック感染させるか、インフルエンザウイルス(H1N1 PR8; 30HA Units/5.7 log10 50% Tissue Culture Infectious Dose [TCID50])で経鼻感染させた(図1A24, 25)。インフルエンザウイルス感染により、雌雄マウスともに模擬感染マウスと比較して有意な体重減少が認められたが、痩せた雌マウスは痩せた雄マウスと比較して体重減少が少なかった(図1B24, 25)。さらに、インフルエンザウイルスに感染した痩せた雌雄マウスは、肺におけるウイルスMタンパク質の転写産物の発現(図1C24, 25)および肺水腫(非流血左肺の重量)(図1D24, 25)が同程度であった。
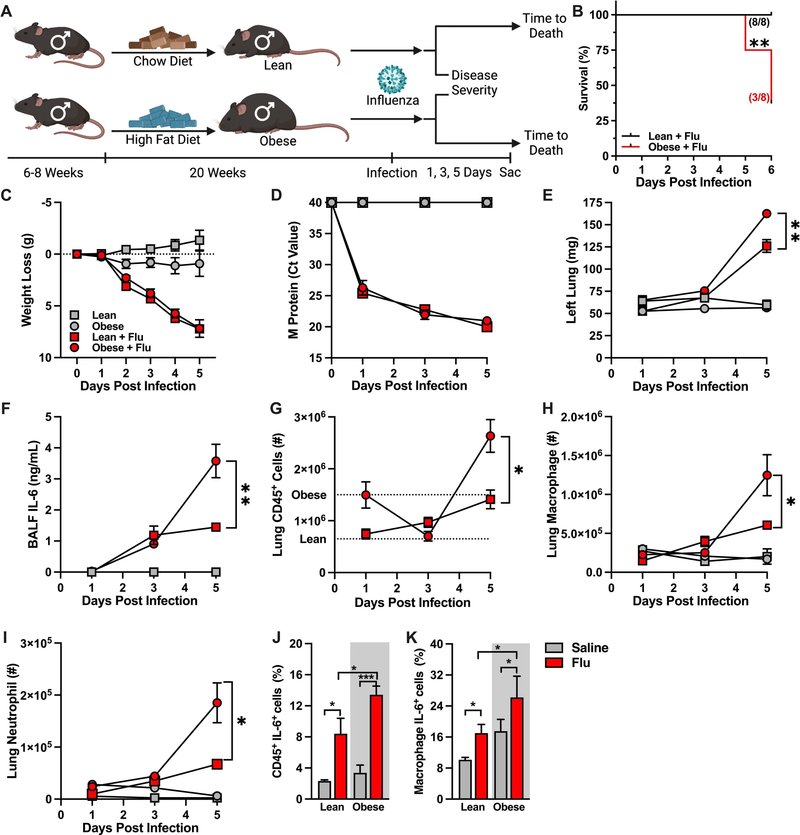
図のサムネイルgr1
図1Lean雌性マウスと雄性マウスのインフルエンザ重症度はほぼ同じである。(A)実験デザインの概略図。12週齢のWT C57/BL6雌雄(n = 6-13/群;3つの独立した実験の組み合わせ)を、生理食塩水で経鼻的に模擬感染させるか、インフルエンザウイルス(Charles River Influenza A/PR/8/34 (H1N1), Batch: 4XP160913、投与量は30ヘマグルチニン(HA)単位)。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)感染5日後の左肺重量。(E)サイトカインELISAで定量した気管支肺胞洗浄液(BALF)インターロイキン-6(IL-6)レベル。(F)ベースライン免疫細胞集団の肺CD45+細胞総数に対する割合。(G)肺CD45+細胞全体に占める感染免疫細胞集団の割合。(I) 肺マクロファージ絶対数(CD11bhiF4/80hi)。(J)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。スチューデントのt検定または一元配置分散分析; *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。ELISA = enzyme-linked immunosorbent assay; qPCR = quantitative polymerase chain reaction; SEM = standard error of the mean.
大きな画像を見るダウンロード 高解像度画像
炎症および免疫細胞組織の獲得と機能は、インフルエンザウイルス感染症の発症において中心的な役割を果たしている。肺で産生されるインターロイキン-6(IL-6)は、インフルエンザウイルスによる重症化の臨床的バイオマーカーとなりうる26。インフルエンザウイルス感染でも同様に、痩せた雄マウスと雌マウスのBALF中のIL-6レベルが上昇した(図1E24, 25)。肺免疫細胞集団の集団百分率分析では、模擬感染マウス(生理食塩水)とインフルエンザウイルス感染マウス(痩せ型、雌雄)の間で違いが見られた(図1F24, 25)。特に、インフルエンザウイルス感染マウスでは、マクロファージと好中球の頻度が増加し、その他の免疫細胞集団は男女ともに減少した。さらに、インフルエンザウイルスに感染した痩せ型マウスの肺は、模擬感染した痩せ型対照マウスと比較して、CD45+細胞の数が全体的に増加しており、これは雌雄間で同等であった(図1H24, 25)。最後に、インフルエンザに感染した雄マウスと雌マウスの間で、マクロファージと好中球の定量数には同様の増加がみられた(図1Iと1J24, 25)。これらのデータを総合すると、我々の研究で利用したインフルエンザ感染は、年齢をマッチさせた痩せ型の雌雄マウスにおいて、疾患発症を強固に推進し、肺の炎症の性質と勢いを同等に促進することが実証された。
高脂血症飼育は雄マウスにおいてインフルエンザウイルスによる疾患の重症化を悪化させる
肥満は、インフルエンザウイルスに起因する疾患転帰を悪化させる独立した危険因子である6, 7。肥満と代謝性疾患がインフルエンザウイルス駆動性疾患の重症度をどのように形成するかを調べるために、雄マウスにCDまたはHFDを与え、その後インフルエンザウイルスを経鼻的に模擬感染(生理食塩水)または感染させた(図2A)。肥満の雄マウスは、感染後6日(DPI)以内に死亡するまでの時間が、痩せた対照マウスに比べて有意に短縮した(図2B)。1、3、5DPIにおけるインフルエンザウイルスに起因する疾患の重症度の時間的解析から、インフルエンザウイルスに感染した痩せ型マウスと肥満マウスの両方が、模擬感染した対照マウスと比較して、同程度の振幅で有意な体重減少を示した(図2C)。さらに、感染した痩せ型マウスと肥満マウスの肺におけるウイルスMタンパク質の発現は、感染経過を通じて同様であった(図2D)。しかし、このような類似性にもかかわらず、インフルエンザウイルスに感染した肥満の雄マウスでは、5DPIの時点で、痩せたインフルエンザウイルス感染対照マウスと比較して、肺水腫が有意に悪化した(図2E)。
図サムネイルgr2
図2肥満の雄マウスは、痩せた雄マウスと比較して、インフルエンザ感染に対する肺の炎症が亢進している。(A)実験デザイン概略図。6~8週齢のWT C57/BL6雄(3つの独立した実験を行った:2つは死亡までの時間、2つは動態解析のため)をチャウ食(CD、脂肪10%、炭水化物70%、タンパク質20%;研究食#D12450J)または高脂肪食(HFD、脂肪60%、炭水化物20%、タンパク質20%;研究食#D12492)に20週間飼育し、その後生理食塩水またはインフルエンザウイルスで経鼻チャレンジした。(B)感染した痩せ雄および肥満雄マウスの死亡時間曲線(n = 8/群、独立した2回の実験結果)。(C)感染後の体重減少(n = 4-10/群、2回の独立した実験の結果)。(D)qPCRで定量した肺ウイルスMタンパク質発現。(E)左肺重量。(F)サイトカインELISAにより定量したBALF IL-6レベル。(G)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。生理食塩水で処理した対照の平均値を破線で示す。(H)肺マクロファージ絶対数(CD11bhiF4/80hi)。(I)肺好中球絶対数(CD11bhiGR1hi)。(J-K) ex vivo PMA-イオノマイシンおよびブレフェルジン刺激による免疫細胞炎症能。炎症性サイトカイン産生は、フローサイトメトリーによる細胞内抗体獲得により定量した。(J) ex vivo刺激後の全肺CD45+細胞IL-6産生。(K) ex vivo刺激後の肺マクロファージIL-6産生。平均値±SEM。スチューデントのt検定または一元配置分散分析;*p < 0.05、**p < 0.01。ELISA = enzyme-linked immunosorbent assay; PMA = phorbol 12-myristate 13-acetate; SEM = standard error of the mean; WT = wild-type.
大きな画像を見るダウンロード 高解像度画像
肥満は組織の炎症性免疫応答を歪める。そこで次に、肺の免疫細胞の性質と炎症の勢いを調べた。インフルエンザウイルス感染により、痩せ型および肥満型の雄マウスでは3DPIでBALF IL-6レベルが同程度に上昇したが、5DPIでは痩せ型雄マウスに比べて肥満型雄マウスでIL-6レベルが有意に高かった(図2F)。肥満の雄マウスは、痩せた雄の対照マウスと比較して、ベースライン時の肺CD45+免疫細胞の総増殖量も増加していた(図2G、破線)。インフルエンザウイルス感染後、肥満肺免疫細胞浸潤が減少したため、3DPIでは肺免疫細胞総増殖は同程度であったが、5DPIでは肥満マウスで有意に増幅した(図2G)。注目すべきことに、5DPIでは、インフルエンザウイルスに感染した肥満の雄マウスの肺で、マクロファージと好中球の数が圧倒的に増加した(図2Hと2I)。さらに、5DPIにおいて、肺CD45+細胞によるIL-6産生は、インフルエンザウイルスに感染した肥満雄マウスにおいて、感染した除脂肪雄コントロールと比較して有意に増加し(図2J)、肺マクロファージ集団によるIL-6産生においても同様の傾向が観察された(図2K)。
次に、肥満がインフルエンザウイルス感染による組織病態をどのように変化させるかを調べた。具体的には、肥満および痩せの雄のインフルエンザウイルス感染マウスおよび模擬感染マウスの左肺を組織学的に調べた(図3A、異なる倍率の代表切片)。肺のすべての組織学的区画を評価し、炎症病態を半定量的にスコア化し、これらのパラメータ(詳細は材料と方法を参照)を、異なる実験条件における気管支肺炎の重症度の合計スコアとして表した。その結果、インフルエンザウイルスに感染した痩せ型および肥満型の雄マウスは、模擬感染した対照マウスと比較して、肺の病理組織学的重症度スコアの合計が大きかった。しかし、気管支肺炎の重症度の振幅は、インフルエンザウイルスに感染した痩せ型および肥満型の雄マウスの間で同様であった(図3B)。特に、気管支中心の病理組織学的パターンと病理学的変化の程度は、感染した痩せ型と肥満型の雄マウスの間で同様であった(図3C)。注目すべきは、インフルエンザウイルスに感染した肥満の雄マウスは、除脂肪体重の感染対照マウスと比較して、実質の炎症の重症度スコアが上昇する傾向があったことである(末梢に拡大し、より重症化)(図3D)。これらの炎症所見と組織学的所見を総合すると、雄マウスのHFD誘導性肥満が肺におけるインフルエンザウイルス駆動性の炎症反応を増幅させることが証明され、我々の実験モデルの妥当性が証明された。
図サムネイルgr3
図3肥満雄性感染マウスは、痩せ雄性感染マウスよりも肺実質の炎症が悪化している。(A)除脂肪体重および肥満体重のコントロール/塩水処理マウスとインフルエンザ感染マウスの左肺の代表的な画像(4列に表示)、膨張なし、対物レンズ1倍、5倍、20倍に相当する異なる倍率で撮影(行;スケールバーはマイクロメートル;H&E染色)。低倍率の画像は各実験群の概観を示し、中倍率の画像は主要な伝導性気道(気管支中心性病理のため)および肺胞末梢から胸膜までを拡大した。コントロール(模擬感染時に生理食塩水を注入したが、水洗や炎症は起こしていない)の肺の代表的な画像は、十分に通気性のある気腔と、調達に関連した軽度の新鮮出血のある領域の両方を示している。対照の痩せ型および肥満型マウスでは、気道は無傷で、気管支中心の病理学的過程もなく(管腔、上皮、経気管支、気管支周囲の炎症性浸潤や損傷もない)、病理組織学的スコアに反映されているように、末梢肺実質への進展もない。インフルエンザに感染した肺では、低倍率(1倍および5倍相当)において、細胞密度増加の気管支中心性分布が、通気性の末梢実質とは対照的に明らかである。中間の倍率では、気管支中心性の病態("20倍"、3段目)は、気管支内への化膿性(壊死性)炎症性浸潤、炎症を起こした気管支上皮内層の減弱、気管支周囲腔への進展(細胞数の増加を伴う)によって証明される。末梢実質への進展("20X "4段目)は、肺胞隔膜に沿った消散性の小病巣でみられ、時折の被験者では胸膜下浮腫を含む(肥満感染マウス肺を参照)。(B) 肺全体の病理組織学的スコア。 (C) 気管支中心性肺炎の病理組織学的スコア("20X"、3段目、低倍率の画像で例示)。(D)実質への炎症性進展の病理組織学的スコア("20X"、4列目、低倍率で例示)。H&E = hematoxylin & eosin。
大きな画像を見るダウンロード 高解像度画像
HFD給餌のみではメスマウスのインフルエンザウイルスによる重症化は悪化しない
次に、HFD給餌が、重度の肥満とは無関係に、メスマウスにおいてインフルエンザウイルス駆動性疾患の重症度を同様に悪化させるのに十分であるかどうかを調べた。雌雄マウスにCDまたはHFDを与え、その後インフルエンザウイルスを感染させた(図4A)。注目すべきは、HFDを与えた雌マウスは、雄マウスと同じ期間「肥満促進食」を与えているにもかかわらず、「肥満」とみなされるほど頑健に体重が増加せず、「過体重」とみなされることである。CD感染群とHFD感染群では、雌雄で同程度の体重減少がみられたが、雌マウスは雄マウスに比べて、食餌にかかわらず絶対体重減少があまり顕著ではなかった(図4B)。しかし、感染した雌雄マウスの肺におけるインフルエンザウイルスMタンパク質の発現は、すべての条件下で同等であった(図4C)。さらに、HFD飼育のインフルエンザウイルス感染雄性マウスおよび雌性マウスでは、CD飼育のマウスと比較して肺水腫が同様に増加した(図4D)。しかし、HFD飼育、インフルエンザウイルス感染、雌マウスは、CD飼育、インフルエンザウイルス感染、雌マウスと比較して、BALF IL-6レベルがわずかに高い傾向があったが(p = 0.07)、このような増加は、HFD飼育、インフルエンザウイルス感染、雄マウスと比較して有意に低かった(図4E)。最後に、HFD食、インフルエンザウイルス感染、雌マウスは、CD食、インフルエンザウイルス感染、雌マウスと比較して、肺CD45+細胞、マクロファージ、好中球の数は同程度であったが、HFD食、雄マウスと比較して有意に減少した(図4F-H)。しかし、興味深いことに、肺免疫細胞集団の割合分析では、CD飼料を与えたインフルエンザウイルス感染雌雄マウス(図4I)と比較した場合、HFD飼料を与えたインフルエンザウイルス感染雌雄マウス(図4J)の間で同様の変化が見られた。これらのデータを総合すると、HFD給餌だけでは雌性マウスのインフルエンザウイルス感染に対する炎症反応を悪化させるのに十分ではないことが示唆される。これは、標準飼育(TS)条件下でHFDを与えたWT雌マウスでは肥満の誘発が限定的である(そして重度の肥満と代謝性疾患がない)ためと考えられる。さらに、これらのデータは、インフルエンザウイルス感染に対する免疫応答の制御における重度の肥満と代謝性疾患の重要な役割を潜在的に示唆している。
図サムネイルgr4
Fig.4高脂肪食(HFD)摂取は雌性マウスにおけるインフルエンザ罹患率を強固に増幅するには不十分である。(A)実験計画の概略図。6-8週齢のWT C57/BL6雌雄(n = 8-14/群;3つの独立した実験の結果)をCDまたはHFDで20週間飼育し、その後インフルエンザウイルス(30 HAユニット)で経鼻チャレンジした。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)左肺重量。(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。(I)CDを投与した雌雄の全肺CD45+細胞に占める感染免疫細胞集団の割合。(J)HFD飼育雌雄における肺CD45+細胞総数に占める感染免疫細胞集団の割合。スチューデントのt検定または一元配置分散分析;*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。CD = 飼料食; ELISA = 酵素結合免疫吸着測定法; SEM = 平均値の標準誤差; WT = 野生型.
大きな画像を見るダウンロード 高解像度画像
肥満に関連したインフルエンザウイルスによる疾患の重症化は、恒温恒湿飼育の雄マウスで維持される。
マウスをTNゾーンに収容することは、ヒトの疾病をより正確にモデル化する方法として浮上してきた。TN飼育が免疫系29や感染に対する炎症反応30,31に影響を与える可能性があることから、我々は次にTN飼育がインフルエンザウイルス駆動性疾患の重症度に与える影響を調べた。リーンの雄マウスをTS(22℃)またはTN(30℃)で4週間飼育して馴化させ、その後インフルエンザウイルスを感染させた(補足図1A)。インフルエンザウイルス感染により、体重減少、肺におけるウイルス性Mタンパク質の発現、肺水腫、およびBALF IL-6レベルが、生理食塩水対照と比較して悪化したが、インフルエンザウイルス感染、TS飼育、およびTN飼育の痩せ型雄マウス間で同程度であった(補足図1B-E)。さらに、全肺免疫細胞浸潤は、インフルエンザウイルスに感染した痩せ型雄性マウスで、模擬感染した対照マウスよりも増加したが、この増加は、TS飼育とTN飼育の痩せ型雄性マウスの間で同程度であった(補足図1F)。この傾向は、肺マクロファージおよび好中球集団でも見られた(補足図1Gおよび1H)。これらのデータを総合すると、TN飼育のみでは痩せ型雄マウスにおけるインフルエンザ疾患の重症度は変化しないことが示唆される。
TN飼育は肥満に関連した代謝疾患も形成する。そこで次に、TN飼育が雄マウスの代謝疾患の重症度を変化させるかどうかを調べた。年齢をマッチさせた雄マウスをTSまたはTNハウジングに入れ、CDまたはHFDを与えた(補足図2A)。TN飼育ではHFDを与えた雄マウスの体重増加がTS飼育のHFDを与えた雄マウスに比べて促進された(補足図2B)。しかし、TN飼育はHFD誘発グルコース代謝異常(補足図2C)や精巣上体白色脂肪組織拡大(補足図2D)をさらに悪化させることはなかった。興味深いことに、TN飼育の肥満男性では、TS飼育の肥満男性と比較して、腎周囲白色脂肪組織(補足図2E)および鼠径部白色脂肪組織(補足図2F)の蓄積が増加した。HFDで飼育した雄の肝臓重量と肝細胞障害(血清アラニントランスアミナーゼ[ALT]値で測定)もTN飼育によってさらに増加した(補足図2Gと2H)。これらのデータを総合すると、TN飼育は肥満雄マウスの特定の代謝疾患パラメーターの重症度を悪化させることが示唆される。
次に、TN飼育による代謝疾患パラメータの増幅が、肥満雄性マウスにおけるインフルエンザウイルス駆動性疾患の重症度にどのように寄与するかを調べた。HFDで飼育した肥満雄性マウスをTSまたはTN条件下で飼育し、インフルエンザウイルスを経鼻的に模擬感染または感染させた(図5A)。HFD飼育、TN飼育、モック感染雄性マウスは、チャレンジ後に体重減少を示したが、HFD飼育、インフルエンザウイルス感染雄性マウスは、TSおよびTN条件の両方で体重減少の振幅が大きかった(図5B)。同様に、肺ウイルスMタンパク質発現、左肺重量、およびBALF IL-6レベルは、模擬感染コントロールよりも有意に上昇したが、TSおよびTNに収容した肥満インフルエンザウイルス感染雄マウスの間では同等であった(図5C-E)。さらに、インフルエンザウイルスに感染した肥満雄性マウスの肺では、CD45+細胞、マクロファージ、好中球の数が模擬感染対照と比較して増加していたが、このような増加はTS飼育マウスとTN飼育マウスで同程度であった(図5F-H)。最後に、肺免疫細胞集団の解析から、TS飼育マウスとTN飼育マウスでは、模擬感染マウスの肺集団の割合が高度に類似していることが明らかになった(図5I)。しかし、インフルエンザウイルス感染時には、TN飼育マウスはTS飼育マウスに比べて肺マクロファージ浸潤率がわずかに増加した(図5J)。これらのデータを総合すると、TN飼育下でのHFD給餌は、痩せ型および肥満型雄マウスのいずれにおいても、インフルエンザウイルスによる疾患の重症度を強固に変化させないことが示唆される。
図サムネイルgr5
Fig.5肥満が関連するインフルエンザ疾患の重症度は、サーモニュートラル(TN)飼育の雄マウスで維持される。(A)実験デザインの概略図。6-8週齢のWT C57/BL6雄(n = 5-6/群;2つの独立した実験の結果)を恒温(TS、22℃)またはTN(30℃)のどちらかのハウジングに入れ、20週間HFDを与え、その後インフルエンザウイルス(30HAユニット)を経鼻投与した。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)左肺重量。(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。(I)HFD飼育、TS飼育またはTN飼育の雄の肺CD45+細胞総数に占めるベースライン免疫細胞集団の割合。(J)HFD-fed、TS-またはTN-houseed雄における肺CD45+細胞総数に占める感染免疫細胞集団の割合。Studentのt検定または一元配置分散分析;**p < 0.01, ***p < 0.001, ****p < 0.0001。BALF = 気管支肺胞洗浄液; CD = チャウ食; HFD = 高脂肪食; IL-6 = インターロイキン-6; qPCR = 定量ポリメラーゼ連鎖反応; SEM = 平均値の標準誤差; WT = 野生型.
大きな画像を見るダウンロード 高解像度画像
TN飼育により、メスマウスのDIO関連インフルエンザウイルスによる重症化が確立される
TN飼育とHFD給餌の組み合わせは、雄マウスにおける代謝性疾患の結果を増幅する可能性がある。年齢をマッチさせた雌性マウスをTSまたはTN条件下で飼育し、CDまたはHFDを与えた(補足図3A)。HFDを与えたTN飼育の雌性マウスは、HFDを与えたTS飼育の雌性マウス、あるいはCDを与えたTS飼育またはTN飼育の対照マウスと比較して、有意に体重が増加した(補足図3B)。さらに、このような肥満の増加は、TS飼育HFD飼育雌およびTN飼育CD飼育対照と比較した場合、生殖腺白色脂肪組織(補足図3C)、腎周囲白色脂肪組織(補足図3D)および鼠径部白色脂肪組織(補足図3E)の蓄積の増加と正の相関があった。注目すべきは、TN飼育HFD飼育雌マウスだけがグルコース代謝異常を発症し(補足図3F)、肝臓重量および血清ALT値が増加したことである(補足図3Gおよび3H)。これらのデータを総合すると、TN飼育はWT雌マウスにおいてもHFD誘発性肥満および代謝疾患の発症を可能にすることが確認された。
次に、TN飼育が痩せた雌マウスのインフルエンザウイルス誘発性疾患の重症度に影響するかどうかを調べた。雌性マウスにCDを与え、TSまたはTN条件下で4週間飼育し、インフルエンザウイルス感染前に馴化させた(補足図4A)。飼育条件はインフルエンザウイルス感染による体重減少に影響を与えなかった(補足図4B)。しかし、TN飼育の痩せた雌では肺水腫が増加した(補足図4D)。肺ウイルスMタンパク質の転写産物発現(補足図4C)およびBALF IL-6レベル(補足図4E)は、模擬感染対照より上昇したが、インフルエンザウイルス感染、TS-およびTN-飼育の雌間で同等であった。最後に、総肺免疫細胞浸潤(補足図4F)、肺マクロファージおよび好中球数(補足図4Gおよび4H)は、インフルエンザウイルスに感染したTN飼育雌マウスとTS飼育雌マウスの間で同程度であった。これらのデータを総合すると、痩せた雌マウスにおいて、TN飼育はインフルエンザウイルスによる疾患の重症度にほとんど影響しないことが示唆される。
重度の肥満および代謝性疾患がインフルエンザウイルスに起因する雌マウスの重症度に及ぼす影響を調べるため、インフルエンザウイルス感染前にTSまたはTN条件下でマウスを飼育し、HFDを摂取させた(補足図5A)。TN飼育のインフルエンザウイルス感染雌性マウスは、TS飼育の対照マウスと比較して、総体重減少が増加した(補足図5B)。肺ウイルスMタンパク質の転写産物発現、肺浮腫、およびBALF IL-6レベルは、インフルエンザウイルス感染、TSおよびTN、HFD飼育、マウスにおいて同様に上昇した(補足図5C-E)。しかし、インフルエンザウイルス感染により、TN飼育の肥満雌性マウスでは、TS飼育のHFD飼育の雌性対照マウスと比較して、肺CD45+細胞、マクロファージ、好中球の数が増加した(補足図5F-H)。これらのデータを総合すると、HFD飼育とTN飼育の組み合わせが、雌性マウスにおいて肥満関連インフルエンザ疾患の頑健な重症化を確立することが示唆される。
代謝性疾患を有する肥満雌雄マウスは、インフルエンザウイルスによる重症度は同等である。
肥満による代謝性疾患と雌性という独立した危険因子が、インフルエンザウイルスによる感染症の悪化に相乗的な影響を及ぼすかどうかはまだ不明である。このような可能性を検討するために、TN飼育の雌雄マウスをCDまたはHFDに置き、インフルエンザウイルスに感染させた(図6A)。性別や食餌に関係なく、すべての感染マウスは同程度の総体重減少(図6B)と肺ウイルスMタンパク質発現(図6C)を示した。肥満のインフルエンザウイルス感染雌性マウスは、痩せた雌性対照マウスと比較して、肺水腫が有意に悪化し、BALF IL-6レベルが上昇した。これは、肥満のインフルエンザウイルス感染雄性マウスと同程度に悪化した(図6Dおよび6E)。さらに、肥満の雌雄マウスは、痩せた雌マウスと比較して、肺の免疫細胞総増殖が顕著に増加した(図6F)。さらに、肺マクロファージおよび好中球の集団も、痩せ型マウスと比較して、肥満の雄および雌マウスで増加した(図6Gおよび6H)。これらの傾向は、痩せ型のインフルエンザウイルス感染雌雄マウス(図6I)を肥満型のインフルエンザウイルス感染雌雄マウス(図6J)と比較したときの母集団百分率解析でも認められた。病理組織像の半定量的解析(図6K)により、気管支中心および実質の病理学的パターンは、性別や食餌にかかわらず、すべての感染条件において同等であることが明らかになった(図6Lおよび6M)。注目すべきは、体重と疾患の重症度指標との間に変動相関分析が行われたことである。これらの試験では、TN飼育の雌雄マウスにおいて、感染前の体重増加と5DPI時の肺水腫(図7A)、BALF IL-6レベル(図7B)、および総免疫細胞増加(図7C)との間に有意な正の相関が認められた。
図のサムネイルgr6
図6肥満の雌雄マウスは、肥満に伴うインフルエンザ疾患の重症度が比較的に悪化した。(A)C57BL/6雌雄マウス(n=6-15/群;4つの独立した実験の結果を合わせた)をTN飼育にし、CDまたはHFDを20週間与えてからインフルエンザウイルス(30HAユニット)を経鼻チャレンジした。(B)感染後の体重減少。(C)qPCRで定量した肺Mタンパク質発現。(D)感染5日後の左肺重量(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺の全CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。(I)TN飼育CD飼育雌雄の肺CD45+細胞総数に占める感染免疫細胞集団の割合。(J)TN飼育HFD飼育雌雄における全肺CD45+細胞に占める感染免疫細胞集団の割合。(K)気管支中心性肺炎の病理組織学的スコア(L)実質への炎症進展の病理組織学的スコア。(M)洗浄していない左肺の代表的なH&E染色(光学顕微鏡、10倍)。平均値±SEM。Studentのt検定または一元配置分散分析;**p < 0.01、***p < 0.001、*p < 0.0001。BALF = 気管支肺胞洗浄液; CD = チャウ食; ELISA = 酵素結合免疫吸着測定法; H&E = ヘマトキシリン・エオジン; HFD = 高脂肪食; IL-6 = インターロイキン-6; SEM = 平均値の標準誤差; TN = サーモニュートラル。
大きな画像を見るダウンロード 高解像度画像
図サムネイルgr7
図7総体重の増加はインフルエンザ関連疾患の重症度転帰の悪化と相関する。TN飼育の痩せ型および肥満型雌雄における感染前の総体重は、様々なインフルエンザ重症度評価指標と相関していた。(A)感染前の総体重と5DPI時の左肺重量。(B). 感染前総体重と5DPI時の気管支肺胞洗浄液インターロイキン-6レベルとの比較。(C)感染前総体重対5DPI時の肺CD45+免疫細胞浸潤。ノンパラメトリックSpearman Rank相関検定およびPearson相関検定は、Prism(GraphPad software)を用いて、それぞれ男性および女性について行った。R値およびp値は直接報告した。DPI = 感染後日数; TN = サーモニュートラル。
大きな画像を見るダウンロード 高解像度画像
最後に、病気の重症度(体重減少、左肺重量、肺ウイルスMタンパク質転写産物発現、BALF IL-6レベル、肺免疫細胞浸潤)について、CD-対HFD飼育マウス、オス対メスマウスについて、TS条件下では表1に、TN条件下では表2にまとめた。これらのデータを総合すると、TN飼育はメスマウスの重度の肥満を誘導する新規かつ実行可能な方法であり、メスマウスはインフルエンザウイルスに感染すると、重度の肥満であるオスマウスと同程度に、肥満に関連したインフルエンザの重症化を発症することが示唆された。
表1恒温動物飼育下におけるインフルエンザ感染マウスの重症度評価指標。
恒温動物飼育
飼料 CD HFD
性別 オス メス オス メス
体重減少(g) 6.983 ± 0.35 4.741 ± 0.26 6.750 ± 0.38 4.920 ± 0.34
左肺重量(mg) 106.1 ± 8.55 95.93 ± 4.01 149.9 ± 5.85 147.9 ± 8.62† Mタンパク質(Ct値)
M蛋白(Ct値) 20.00 ± 0.50 22.35 ± 1.01 21.74 ± 0.51 20.00 ± 0.36
BALF IL-6 (ng/mL) 1.450 ± 0.08 1.410 ± 0.21 5.231 ± 0.53† 2.627 ± 0.25
肺CD45+細胞(#×106) 1.876 ± 0.481 1.410 ± 0.126 2.924 ± 0.174‡ 1.225 ± 0.0874
肺マクロファージ(#×105) 6.063 ± 0.451 4.822 ± 0.514 15.74 ± 1.61† 6.764 ± 0.535
肺好中球 (# × 104) 6.713 ± 0.787 8.664 ± 1.71 25.12 ± 3.21 7.304 ± 0.925
すべての条件は平均値±平均値の標準誤差(SEM)で報告。普通一元配置分散分析、統計解析はHFDマウスとそれぞれのCD性対照(HFD雄対CD雄、HFD雌対CD雌)を比較。
数;BALF=気管支肺胞洗浄液;CD=チャウ食;HFD=高脂肪食;IL-6=インターロイキン-6。
‡ p < 0.01.
† p < 0.0001.
p < 0.001.
新しいタブで表を開く
表2サーモニュートラル飼育下におけるインフルエンザ感染マウスの重症度評価指標。
ハウジング サーモニュートラル
飼料 CD HFD
性別 オス メス オス メス
体重減少(g) 6.956 ± 0.12 5.949 ± 0.42 7.050 ± 0.18 6.328 ± 0.28
左肺重量(mg) 118.9 ± 6.34 114.3 ± 3.92 150.3 ± 9.40* 136.3 ± 6.08* 136.3 ± 6.08* 136.3 ± 6.08
M蛋白(Ct値) 23.36 ± 0.50 20.92 ± 0.54 23.03 ± 0.49 21.44 ± 0.54
BALF IL-6 (ng/mL) 1.526 ± 0.24 1.632 ± 0.20 4.905 ± 1.07† 3.556 ± 0.61* 肺CD45+細胞(#1)
肺CD45+細胞(# × 106) 0.9057 ± 0.118 1.412 ± 0.123 2.177 ± 0.373† 2.469 ± 0.270† 肺マクロファージ(# × 106
肺マクロファージ(#×105) 5.087 ± 0.916 7.520 ± 0.680 13.18 ± 2.63† 14.15 ± 1.69† 肺好中球(#×106) 0.9057 ± 0.118 1.412 ± 0.123 2.177 ± 0.373† 2.469 ± 0.270
肺好中球 (# × 104) 9.250 ± 1.49 7.266 ± 0.890 19.93 ± 3.95* 16.30 ± 2.41†.
すべての条件は平均値±平均値の標準誤差(SEM)で報告。普通一元配置分散分析、統計解析はHFDマウスとそれぞれのCD性対照(HFD雄対CD雄、HFD雌対CD雌)を比較。
数;BALF=気管支肺胞洗浄液;CD=チャウ食;HFD=高脂肪食;IL-6=インターロイキン-6。
p < 0.05.
† p < 0.01.
新しいタブで表を開く
考察
本研究では、肥満および肥満に関連する代謝性疾患がインフルエンザ疾患の重症化に重要な危険因子として影響することを検証し、肥満におけるインフルエンザウイルス駆動性疾患の重症化形成における性および代謝性疾患の役割に関する今後のメカニズム解明に利用できる、メスマウスの新規重症肥満モデルマウスを確立することを目的とした。われわれは、雄マウスにおいて、HFD誘発性肥満がインフルエンザウイルス感染による死亡までの時間を早めることを見出した。しかし、従来型(TS)条件下で飼育したメスマウスでは、HFD給餌だけでは肥満に関連したインフルエンザウイルスによる重症化を誘導するのに十分ではなかった。重要なことは、HFD給餌とTN飼育を組み合わせることで、メスマウスの重度の肥満と代謝性疾患が促進され、この環境におけるインフルエンザウイルス駆動性疾患の重症度の初期評価が可能になることであった。これらの結果から、TN飼育の重度肥満雌雄マウスは、高用量インフルエンザウイルスチャレンジに対する炎症反応が同様に悪化し、感染前のマウスの体重がインフルエンザ重症度の結果と強く相関していることが明らかになった。
以前の報告32とは異なり、我々の最初の知見では、痩せ型の雄マウスと雌マウスはインフルエンザウイルスに起因する重症度が同程度であることが示唆された。このような乖離が生じた理由としては、インフルエンザウイルスの投与量の違いが考えられる。いくつかのインフルエンザ感染モデルでは、痩せたメスマウスは体格、体温、生存率がより低下し、ウイルス量が同程度であるにもかかわらず、BALFの炎症性サイトカイン(IL-6、腫瘍壊死因子、インターフェロン[IFN]-γなど)レベルが上昇することが示唆されているが33、他の研究では、これらの反応は用量依存的であり、より高用量のウイルスを用いた重症インフルエンザ感染モデルでは見られないことが示唆されている32。したがって、われわれの研究で用いられた高用量のインフルエンザウイルスは、これまで低用量で報告されていた性差を覆い隠すような、重症のインフルエンザウイルスによる疾患である可能性がある。したがって、肥満が関連したインフルエンザウイルス駆動性疾患発症の性特異的表現型を完全に明らかにするためには、今後、ウイルス力価の勾配(例えば、低、中、高)を利用した研究と我々の新規モデルを併用する必要があるかもしれない。
歴史的に、WT C57/BL6雌マウスはDIOおよび肥満に関連した代謝性疾患から保護されている34。我々の知見から、従来のTS飼育でメスマウスにHFDを与えると、TS飼育でHFDを与えた重度の肥満のオスマウスと比較して、インフルエンザ感染時の体重増加(過体重)と炎症の悪化が最小限に抑えられることが示唆された。雌マウスの肥満の代替モデルとして、レプチンホルモンの遺伝子操作を利用して肥満マウス(ob/obマウス)を作製する方法がある35。代謝性疾患を持つ雌マウスの作製には成功したが、この重要な内分泌ホルモンを除去することは、インフルエンザウイルス感染という状況において、交絡変数をもたらす可能性がある。具体的には、レプチンはインフルエンザウイルス感染に対する適切な反応に必要な細胞(マクロファージ、好中球、ナチュラルキラー細胞など)36に作用するなど、免疫系において炎症性の役割を担っている。さらに、レプチンは肺の発達とホメオスタシスにおいて重要な役割を果たすことが認められている37, 38。従って、肺向性感染症の文脈におけるレプチン欠損マウスの適用性には疑問がある。
伝統的な飼育環境の温度(22℃)は、動物施設内で人間が快適に過ごせるように選ばれている。従って、伝統的な飼育環境で飼育されたマウスは慢性的な寒冷ストレスを経験し、代謝の健康に影響を及ぼす。この温度では、WT雄マウスはDIOを発症するが、WT雌マウスは重度の肥満に抵抗性であるため、実施できる研究の範囲が制限される。実際、マウスをTNゾーン(30℃~32℃)に収容すると、代謝のホメオスタシスが達成される。TN飼育は、マウスの心拍数を毎分200回以上減少させ、平均動脈血圧を30%低下させ、エネルギー消費量を50~60%減少させることが示されている29, 39。さらに、TN飼育は、脂肪組織の炎症を悪化させ23、動脈硬化斑の発生を可能にし40、NAFLD発症モデルを改善することによって、雄マウスのDIOマウスモデルを改善する22。さらに、われわれが以前に得た知見によると、TN飼育を利用すると、WT雌マウスもDIOと代謝性疾患を発症することが示唆されている19。したがって、これらのデータは、重度の肥満が雌マウスにおけるインフルエンザウイルス駆動性疾患の重症度を形成するかどうかを調べるための新しい方法論を確立し始めるための基盤となった。
TN飼育がインフルエンザウイルス感染に対する免疫応答を独立に変化させるかどうかは、十分に定義されていない。既存の文献では、飼育温度が炎症性免疫反応に重要な役割を果たすことが示唆されている。例えば、TN飼育は全身性炎症を増加させ、炎症性サイトカインの循環レベルを上昇させ40、LPSチャレンジに対する発熱反応を促進することが報告されている30。このような炎症表現型の亢進は感染症においても認められ、ライノウイルス41や大腸菌42に対する免疫応答がより強固になる。しかし、感染症では逆の結果も報告されている。具体的には、TNハウスはチフス43や狂犬病44に対する死亡率を低下させることが示されている。呼吸器疾患関連病態との関連では、TNハウスはマウス喘息モデルにおいてTreg細胞の肺浸潤を増加させ45、感染後72時間の肺におけるインフルエンザウイルス感染に対する炎症性サイトカイン応答を減少させることが示されている46。したがって、これらの知見から、TS飼育における確立された表現型がすでに存在する雄マウスにおいて、TN飼育が肥満に関連したインフルエンザウイルスによる重症化に影響を与えるかどうかを調べることが不可欠であった。注目すべきことに、我々のデータは、肥満関連インフルエンザウイルス駆動性疾患の重症度は、TN飼育とTS飼育の痩せ型マウスで同程度であり、TN飼育とTS飼育の肥満雄マウスでは同程度に誘導されることを示している。
我々の研究では、TN飼育の模擬感染した肥満雄マウスは、模擬感染したTS飼育の肥満対照マウスと比較して、顕著な体重減少が観察された。この効果の説明として、本研究の設定に関連した可能性が考えられる。具体的には、雄マウスがTN飼育でもTS飼育でも肥満になった後、すべてのマウスを感染症研究に特化した動物施設に移し、研究終了までTS飼育条件に維持する。そのため、周囲温度の変化により、TN飼育マウスが経験する体重減少は増大する可能性がある。しかし、模擬感染したTN飼育の肥満雄マウスの総体重減少は、TN飼育のインフルエンザウイルス感染マウスで観察されたほど広範囲ではなかった。重要なことは、インフルエンザウイルスに起因する疾患の重症度を示す指標は、インフルエンザウイルスに感染したTS飼育の雄マウスとTN飼育の高度肥満雄マウスの間で同等であったことである。これらのデータから、TN飼育の肥満雄マウスにおける体重減少の潜在的な差は、インフルエンザウイルス感染後の肺の炎症状態の悪化の原因とは考えにくいことが示唆された。
生殖年齢にある雌は、インフルエンザウイルス感染によって病勢が悪化するリスクが高いことが研究で示されているが14, 15、これまでの疫学研究では、この素因が雌の肥満率が世界的に高いことに起因するかどうかは検討されていない17。妊娠はインフルエンザウイルスによる重症化の独立した危険因子であるが47, 48、発表された報告では、妊娠だけではインフルエンザの重症化に対する女性の素因の増加を完全には説明できないことが示唆されている13, 49。したがって、世界的な女性の肥満率の増加が、インフルエンザウイルス感染に関して女性の罹患率および死亡率の偏りの一因となっている可能性がある。したがって、インフルエンザウイルスによる疾患の重症化に対する肥満と性別の個人的および複合的な寄与を完全に解明するためには、さらなる疫学的研究が必要である。
厳密に実施されたとはいえ、本研究にはいくつかの限界がある。重要な限界のひとつは、致死量のウイルスを用いたことである。ほとんどのインフルエンザ感染生存研究は2週間を超えるが、我々の研究は感染後5日目までであり、肥満マウスは6日目からかなりの死亡率を示した(図2B)。さらに、痩せたマウスは、飼育環境や性別に関係なく、5DPIで動物飼育基準で許容される最大体重減少率を示した(データは示さず)。これらの限界を考慮すると、今後の重要な方向性としては、様々なウイルス投与量(例えば、低、中、高)での追加研究、および肥満状態における疾患の重症度表現型の経時的解析が挙げられる。もう1つの限界は、肥満に関連したインフルエンザウイルスによる重症度増悪の根底にあるメカニズムの解明が不足していることである。本研究では、肥満における疾患の重症度上昇の根底にあるメカニズムには言及していないが、重要なことは、TN飼育とHFD給餌を組み合わせた新しく確立されたモデルを提示したことであり、このような将来的なメカニズム研究を実施するための強固なプラットフォームを提供するものである。特に、体重増加とインフルエンザの重症度との間に正の有意な相関があることから(図6)、この表現型の原因となる分子的・細胞的原因を探るさらなる研究の必要性が明らかになった。我々の研究では、高用量のインフルエンザウイルスを感染させた肥満の雄マウスと雌マウスの間で、免疫細胞の獲得や炎症能力に大きな違いは見られなかったが、これは肥満時の免疫系の状態や、使用したインフルエンザウイルスの用量によるのかもしれない。肥満は慢性的な炎症状態である50。したがって、このような偏りは、肥満の雄と雌の炎症反応を悪化させるか、あるいは寛容化させ、両者が平衡化する程度まで悪化させ、その結果、インフルエンザウイルスに起因する疾患の重症度が同程度になる可能性がある。
TNハウスは、肥満による代謝の変化が主要な免疫メディエーターをどのように変化させるかをメカニズム的に調べるための重要なツールである。炎症性サイトカイン、アディポカイン、ホルモンなど、様々なメカニズムが関与している可能性が高い。例えば、免疫応答の重要な調節因子であるI型IFNは、インフルエンザウイルス感染において重要な役割を果たしている。I型IFN応答は、男性よりも女性でより強固であることが報告されており51、また、I型IFNレベルは肥満状態でも上昇する52。したがって、I型IFN軸の調節が、肥満と性差において、インフルエンザウイルスによる重症化をどのように形成するかは、今後の研究の有力な候補である。もう一つの可能性のあるメカニズムは、レプチンシグナル伝達経路である。レプチンレベルは肥満で上昇し53、男女で異なる54。さらに、レプチンの免疫細胞に対する炎症促進作用36を考慮すると、肥満と性差におけるインフルエンザウイルスによる重症化における肥満に関連した炎症反応に対するレプチンのメカニズム的役割の今後の検討は必須であろう。性特異的ホルモンの役割についても調べる必要がある。注目すべきは、エストロゲンが免疫細胞に対して抗炎症作用を持つことである55。したがって、肥満と性差における、インフルエンザウイルスが引き起こす疾患の重症度におけるエストロゲンの役割について、今後解析する必要がある。
このモデルの他の応用例としては、今後、非致死量を用いて、肥満の雄マウスと雌マウスの肺組織修復の基礎となる過程を調べる研究がある。肥満の雄マウスでは肺の修復が障害されていることから57、このような研究は非常に有益であろう。さらに、肥満雄性マウスは、インフルエンザウイルス感染に対する適応免疫応答が低下している10。このモデルは、肥満宿主を用いた再感染チャレンジ実験によって、インフルエンザウイルスに対する適応免疫応答に性差が存在する可能性を明らかにするためにも利用できる。最後に、結核59や重症急性呼吸器症候群-コロナウイルス260、61を含む複数の感染症58において、性差による違いが報告されている。従って、我々の新しいモデルは、様々な感染症の発症における性と代謝疾患の役割を検討するための理想的なプラットフォームである。このように、HFD飼育とTN飼育を組み合わせたモデルを利用することで、肥満雌雄マウスにおける多くの感染症における炎症性免疫応答の分子的・細胞的修飾因子を厳密に比較検討することができる。これらのプラットフォームの有用性を通して、新規のメカニズム的洞察を発見することで、感染症と闘うための、より的を絞った肥満集団における治療法の開発が可能になるかもしれない。
材料と方法
すべての動物飼育は、Guide for the Care and Use of Laboratory Animalsに従って行われた。すべての研究はCincinnati Children's Hospital Medical Center(CCHMC)のInstitutional Animal Care and Use Committeeの承認を得た。
肥満モデルマウス
WTマウスの繁殖ペアはJackson Laboratories(米国ミシガン州バーハーバー)から購入したもので、C57BL/6Jバックグラウンド、TS(22℃)条件下で飼育し、オートクレーブ滅菌した餌と水を自由に摂取できるようにし、オートクレーブ滅菌したCD餌(LAB Diet #5010 ;カロリーは炭水化物[58%]、脂肪[13%]、タンパク質[29%]で供給)と水を自由に摂取できるようにした。6~8週齢のWT雄および雌マウスを試験に用いた。すべての試験において、餌と水は毎週交換した。肥満モデルの研究では、年齢をマッチさせたマウスにCDまたは放射線照射したHFDを与えた(Research Diets #D12492i ; 60% of calories from fat)。体重は毎週記録した。すべてのマウスの飼育にはコーンコブ敷料を使用した。
TN試験では、6~8週齢のマウスをTSまたはTN(30℃、湿度30%)条件下で2週間飼育し、食餌負荷開始前に馴化させた。TN飼育はCaron chamber(Caron Products & Services, Inc, Marietta, OH, USA)を用いて行った。年齢をマッチさせたマウスにCDまたはHFDを与え、餌と水は毎週交換した。体重は毎週記録した。
グルコース負荷試験は、絶食マウスにグルコースを投与し(マウスは体重1gあたり10%ブドウ糖溶液100μLを注射)、グルコースはメーカーの指示に従い、当研究室が以前に行ったように、Accu-Chekグルコメーターを使って速度論的にモニターした19, 22。肝細胞障害の評価には、ALT試薬とCatatrol IおよびII(Catachem, Oxford, CT, USA)を用いて血清ALT値を定量した。
TCID50
ウイルス投与量を決定するために、単層のMadin-Darby Canine Kidney細胞を用いたTCID50アッセイを、以前に記載されたように実施した62。簡単に述べると、96ウェル組織培養プレート中のMadin-Darby Canine Kidney単層を、連続希釈(10倍)したウイルスストック(30 HA Unitsから開始)で感染させた。プレートを37℃で7日間インキュベートした後、1-3時間固定し(4%パラホルムアルデヒド)、その後一晩染色した(Naphthol Blue-Black色素)。その後プレートを洗浄し、光学顕微鏡で細胞病理効果を調べた。陽性シグナルは、細胞が50%以上の細胞障害効果を示したと解釈した。TCID50はReed-Muench法を用いて算出した。
In vivoインフルエンザ感染
マウスをTSまたはTNのハウジングからCCHMC動物施設の専用感染室(感染室は標準温度22℃に保たれている)に移動させた。マウスをイソフルラン吸入で鎮静させ(2.5%イソフルラン;Akorn社、NDC 59399-106-01)、生理食塩水(50μL、動物用グレード;Hospira社、NDC 0409-4888-02)またはH1N1 PR8インフルエンザ(50μL動物用グレード生理食塩水中30 HAユニット/7.16 log10EID/5.7log10TCID50;Charles River社)で経鼻処理した: Influenza A/PR/8/34、Batch: 4XP160913; Dr William Zachariasより提供)。その後、1、3、5DPI時の組織採取前にマウスをモニターした(体重を毎日測定)。
定量的リアルタイム逆転写酵素ポリメラーゼ連鎖反応
肺組織サンプルをTRIzol(Invitrogen, Waltham, MA, USA)でホモジナイズし、続いてメッセンジャーRNAを抽出し、cDNAに逆転写した(Verso cDNA Synthesis Kit; Thermo Scientific, Waltham, MA, USA)。定量的ポリメラーゼ連鎖反応は、QuantStudio 7 Real-Time polymerase chain reaction System(Applied Biosystems、米国マサチューセッツ州ウォルサム)を用いて、製造業者の指示に従って行った。インフルエンザM1タンパク質遺伝子に用いたプライマー配列は以下の通りである:
インフルエンザM1タンパク質センス:5ʹ-AAG ACC AAT CCT GTC ACC TCT GA-3ʹ
インフルエンザM1タンパク質アンチセンス:5ʹ-CAA AGC GTC TAC GCT GCA GTC C-3ʹ
BALFサイトカイン定量
マウスを失血死させた後、BALFを得た。露出した気管の断面を切開した。その後、カニューレを挿入し、肺を1mLのHanks' Balanced Salt Solution(Gibco, Billings, MT, USA)で3~4回洗浄した。回収した液体を1.5mLのエッペンドルフチューブに入れた。続いてBALFを300gで6分間、次いで5000gで30秒間遠心分離した。液体はペレット化した肺細胞から分離された。BALFのIL-6は、酵素結合免疫吸着測定法(BD Biosciences, Franklin, Lakes, NJ.)により、製造者の指示に従って定量した。
肺免疫細胞の分離とフローサイトメトリー解析
免疫細胞集団を決定するために、肺を消化した(消化バッファー: 7 mL/サンプル Dulbecco's modified Eagle's medium + 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid, 2% bovine serum albumin, 0.03 mg/mL Liberase Blendzyme 3 Collagenase Cocktail, 50 U/mL DNAse)、免疫細胞を単離した。細胞はフォルボール12-ミリスチン酸13-アセテート(50ng/mL;Sigma-Aldrich)、イオノマイシン(1μg/mL;Calbiochem)、ブレフェルジンAで4時間刺激され、その後モノクローナル抗体で標識された。具体的には、Live/dead (Zombie UV Dye; BioLegend, San Diego, CA, USA)、B220 - BV605 (clone RA3-6B2, BioLegend)、CD45 - PEDazzle (clone 104, BioLegend)、CD11b - eFluor450 (clone M1/70, eBioscience, San Diego, CA, USA)、CD11c - BV711 (clone N418, BioLegend)、NK1. 1-FITC(クローンPK136、BioLegend)、F4/80-AF700(クローンBM8、eBioscience)、Gr1-APC(クローンRB6-8C5、eBioscience)、CD8-BV510(クローン53-6.7、BioLegend)、IL6-PE(クローンMP5-20F3、eBioscience)。データはLRS Fortessaフローサイトメーター(BD Biosciences)を用いて収集し、FlowJo Xソフトウェア(vX10, Tree Star, Ashland, OR, USA)で解析した。
病理組織学的解析
全マウスについて、左肺をBALF分離時にヘモスタットでクランプしてから胸腔から取り出した(輸液、洗浄、膨張は行わなかった)。組織学的には、左肺組織を10%緩衝化ホルマリンで固定し、ヘマトキシリン・エオジンで染色した。評価は、経験豊富な認定病理医が行い、採点中は実験パラメータを盲検化した。半定量的評価により以下のことが決定された: (1)気管支肺炎の炎症の重症度/悪性度(なし、軽度、中等度、重度)、(2)炎症の活性と組成(好中球優位の化膿性壊死性から、組織球と形質細胞を伴うリンパ球核優位のものまで); (3)「気管支炎」→「細気管支炎」→「肺炎」と、近位細気管支レベルから(細気管支、終末細気管支、呼吸細気管支を経て)肺胞管、嚢、肺胞に至る、伝導性気道から気腔の主要な組織学的ランドマークで分類する; および(4)肺胞の浸潤と障害(ここでは「実質炎症」と呼ぶ)は、(a)伝導性気道/気管支樹に沿って肺末梢の気腔/肺胞まで炎症が進展すること、および(b)中心部では、(内腔から壁を通して)顕著な化膿性気管支炎が気管支周囲に直接進展することの両方に続発する。パラメータは、インフルエンザ疾患の重症度を半定量的に比較する目的で、合計スコアで定量化された。主に気管支内気道疾患(気管支中心性)か、肺胞実質(実質性)への追加的な重大な浸潤(肺胞中心性)もスコアリングに考慮された。
統計解析
統計解析には、Prism 5aソフトウェア(GraphPad Software Inc, San Diego, CA, USA)を用いて、必要に応じて正規性検定、対数正規性検定、パラメトリック検定を行った。すべての正規分布データセットについて、2群間比較の場合は、対応のない両側Studentのt検定を用い、3群以上の場合は、特定の群間の差を評価するためにTukeyのpost hoc検定を用いた一元配置分散分析を用いた。変数の相関分析については、検出力の小さいデータセットではノンパラメトリックのスピアマン順位相関検定を、nの大きいデータセットではピアソン相関検定を行った。すべての値は平均値±平均値の標準誤差で表した。p値<0.05を有意とした。サンプルサイズの決定は、体重減少、肺免疫細胞浸潤、肺ウイルスM蛋白発現を含むインフルエンザ感染に関する予備データに基づいて行った。分析から除外された動物はいなかった。
著者貢献
P.C.A.、M.S.M.A.D.、S.D.は、プロジェクトの構想および試験デザインに参加した。W.Z.およびA.T.はウイルスを提供し、試験実施に協力した。P.C.A.、M.S.M.A.D.、C.J.U.、K.S.、J.R.O.、J.L.W.、H.C.、T.E.S.、M.M.F.はデータの作成と解釈に参加した。S.S.は組織学的スコアリングの専門知識を提供し、解析を行った。P.C.A.とS.D.が原稿を執筆した。著者全員が本研究に貢献し、最終原稿を読み承認した。
利益相反宣言
著者らは、申告すべき競合利益はない。
データの利用可能性
本研究で作成および解析したデータセットは、合理的な要求があれば、対応する著者から入手可能である。
謝辞
本原稿は、米国国立衛生研究所R01DK099222(S.D.へ)、CCHMC Research Innovation and Pilot funding(S.D.へ)、米国国立衛生研究所1F31AI169757-01(P.C.A.へ)より一部支援を受けた。変数相関分析はTodd Jenkins博士によって検証された。図の画像はBioRender.comで作成。
付録A. 補足データ
以下は本論文の補足データである:
ダウンロード.pdf (1.9 MB)
pdfファイルのヘルプ
補足データ1
参考文献
上木 T.M.
ホイ D.S.
ザンボン M.
ウェントワース D.E.
モント A.S.
インフルエンザ。
Lancet. 2022; 400: 693-706
論文で見る
スコープス (66)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Van Kerkhove M.D.
他
2009年インフルエンザA(H1N1)感染後の重篤な転帰のリスク因子:グローバルプール解析。
PLoS Med. 2011; 8e1001053
論文で見る
スコープス (533)
PubMed
クロス
グーグル奨学生
パンデミック(H1N1)2009インフルエンザの臨床的側面に関するWHOコンサルテーション執筆委員会
他
パンデミック2009インフルエンザA(H1N1)ウイルス感染の臨床的側面。
N. Engl. J. Med. 2010; 362: 1708-1719
論文で見る
日本経済新聞
PubMed
クロス
グーグル奨学生
フィヌケーン M.M.
他
1980年以降の体格指数の全国的、地域的、世界的傾向:960カ国年、900-100万人の参加者による健康診断調査と疫学研究の系統的分析。
Lancet. 2011; 377: 557-567
論文で見る
スコープス (3245)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
コラボレーションP.S.
他。
900,000人の成人における体格指数と原因別死亡率:57の前向き研究の共同解析。
Lancet. 2009; 373: 1083-1096
論文で見る
スコープス (3409)
PubMed
要旨
全文
全文PDF
グーグル奨学生
アラールR.
ルクレール P.
トレンブレー C.
タネンバウムT.N.
糖尿病とパンデミックインフルエンザA(H1N1)感染の重症度。
糖尿病ケア。2010; 33: 1491-1493
論文で見る
スコープス (234)
PubMed
クロス
グーグル奨学生
パピック N.
et al.
インフルエンザ感染時の肝機能障害:2009年のパンデミックから考える。
インフルエンザその他の呼吸器。Viruses. 2012; 6: e2-e5
論文で見る
スコパス (56)
PubMed
クロス
グーグル奨学生
Honce R.
et al.
肥満に関連した微小環境は、病原性インフルエンザウイルス株の出現を促進する。
mBio. 2020; 11: e03341-e3419
論文で見る
スコープス (78)
PubMed
クロス
グーグル奨学生
Maier H.E.
他
肥満は成人におけるA型インフルエンザウイルスの排出期間を延長させる。
J. Infect. Dis. 2018; 218: 1378-1382
論文で見る
スコープス (157)
PubMed
クロス
グーグル奨学生
カールソンE.A.
シェリダンP.A.
ベック M.A.
食事誘発性肥満はインフルエンザウイルス感染に対するT細胞記憶応答を障害する。
J. Immunol. 2010; 184: 3127-3133
論文で見る
スコパス(186)
PubMed
クロス
グーグル奨学生
アラルコン P.C.
他
脂肪細胞の炎症とウイルス性肺炎の病態:見過ごされている寄与。
Mucosal Immunol. 2021; 14: 1224-1234
論文で見る
スコープス (14)
PubMed
要旨
全文
全文PDF
グーグル奨学生
クライン S.L.
フラナガン K.L.
免疫反応における性差
Nat. Rev. Immunol. 2016; 16: 626-638
論文で見る
スコープス (2860)
PubMed
クロス
グーグル奨学生
キャンベル A.
他。
パンデミック(H1N1)インフルエンザで入院した患者における重篤な転帰のリスク。
CMAJ. 2010; 182: 349-355
論文で見る
スコープス (148)
PubMed
クロス
グーグル奨学生
クライン S.L.
パッサレッティC.
アンカーM.
オルコヤP.
ペコシュA.
性、性別、妊娠が2009年新型インフルエンザに及ぼす影響。
Biol. Sex Differ. 2010; 1: 5
記事で見る
スコープス (77)
PubMed
クロス
グーグル奨学生
Giurgea L.T.
他
インフルエンザにおける性差:チャレンジ試験の経験。
J. Infect. Dis. 2022; 225: 715-722
論文で見る
スコープス (14)
クロス
グーグル奨学生
ヤコブセン H.
クライン S.L.
ウイルス感染に対する免疫の性差。
Front. Immunol. 2021; 12720952
論文で見る
スコープス (82)
クロスリファレンス
グーグル奨学生
ブータリ C.
マンゾロスC.S.
肥満の疫学と行動への呼びかけに関する2022アップデート:その双子のCOVID-19パンデミックが後退しているように見えるように、肥満と代謝異常のパンデミックは上で猛威を振るい続けている。
メタボリズム。2022; 133155217
記事で見る
スコープス(136)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ホンスR.
シュルツ-チェリーS.
肥満がA型インフルエンザウイルスの病原性、免疫応答、進化に及ぼす影響。
Front. Immunol. 2019; 10: 1071
論文で見る
スコープス (281)
PubMed
クロス
グーグル奨学生
ジャイルズD.A.
他
熱中性飼育はマウスの非アルコール性脂肪性肝疾患を悪化させ、性別に依存しない疾患モデル化を可能にする。
Nat. Med. 2017; 23: 829-838
論文で見る
スコープス (155)
PubMed
クロス
グーグル奨学生
バワーズ S.L.
ビルボS.D.
ダバーF.S.
ネルソン R.J.
マウスのコルチコステロンと免疫反応におけるストレス特異的変化。
Brain Behav. Immun. 2008; 22: 105-113
論文で見る
スコパス(175)
PubMed
クロス
グーグル奨学生
カープ C.L.
寒冷ストレスがマウスのモデリングをいかに蝕むか。
J. Exp. Med. 2012; 209: 1069-1074
論文で見る
スコープス (135)
PubMed
クロス
グーグル奨学生
オーツJ.R.
ら
非アルコール性脂肪性肝疾患モデルマウスにおける肝炎と肝障害を形成するサーモニュートラルハウジング。
Front. Immunol. 2023; 141095132
論文で見る
スコープ(2)
クロス
グーグル奨学生
Tian X.Y.
et al.
サーモニュートラル・ハウジングは代謝性炎症を促進し、動脈硬化を促進するが、インスリン抵抗性は促進しない。
Cell Metab. 2016; 23: 165-178
論文で見る
スコープス (105)
PubMed
要旨
全文
全文PDF
グーグル奨学生
モレノ-フェルナンデスM.E.
他
肝Th17細胞のPKM2依存的代謝スキューイングは、非アルコール性脂肪性肝疾患の病態を制御する。
Cell Metab. 2021; 33: 1187-1204.e9
論文で見る
スコパス (51)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Chan C.C.
ら
I型インターフェロンセンシングが脂肪細胞の炎症潜在能力を解き放つ。
Nat. Commun. 2020; 11: 2745
論文で見る
スコープス (33)
パブコメ
クロス
グーグル奨学生
パケット S.G.
他
インターロイキン-6はパンデミックH1N1インフルエンザA型重症感染のバイオマーカーとなりうる。
PLoS One. 2012; 7: e38214
論文で見る
スコープス(107)
PubMed
クロス
グーグル奨学生
ホーヴ M.A.
ナッシュ A.A.
ジャクソンD.
ランドール R.E.
ドランスフィールドI.
ヒト単球およびマクロファージ亜集団のインフルエンザウイルスA感染により、細胞の分化に関連した感受性の増加が明らかになった。
PLoS One. 2012; 7: e29443
論文で見る
スコープス(65)
PubMed
クロス
グーグル奨学生
ムーシーA.N.
タン K.B.
Wang S.
Narasaraju T.
チャウ V.T.
BALB/cマウスにおけるインフルエンザ肺炎時の肺好中球細胞外トラップ形成に対する高脂肪食の影響。
Front. Immunol. 2016; 7: 289
論文で見る
スコープス (38)
PubMed
クロス
グーグル奨学生
Stemmer K.
et al.
C57BL/6ヌードマウスの免疫機能と食事誘発性肥満には熱中性飼育が重要な因子である。
Int. J. Obes. (Lond)。2015; 39: 791-797
論文で見る
スコープス (54)
PubMed
クロス
グーグル奨学生
ルダヤ A.Y.
スタイナーA.A.
ロビンスJ.R.
ドラギッチ A.S.
ロマノフスキーA.A.
マウスにおけるリポ多糖に対する体温調節反応:投与量と周囲温度への依存性。
Am. J. Physiol. Regul. 統合。Comp. Physiol: R1244-R1252
論文で見る
スコープス (184)
PubMed
クロス
グーグル奨学生
ライス P.
et al.
発熱域の高体温は好中球の蓄積を増大させ、実験的グラム陰性細菌性肺炎における肺傷害を増強する。
J. Immunol. 2005; 174: 3676-3685
論文で見る
スコープス (88)
PubMed
クロス
グーグル奨学生
ロレンゾ M.E.
他
C57BL/6マウスにおける致死性A型インフルエンザウイルスに対する抗体応答と交差防御は雌雄間で異なる。
Vaccine. 2011; 29: 9246-9255
論文で見る
スコープス (80)
PubMed
クロス
グーグル奨学生
ラルコムA.N.
他
急性A型インフルエンザ感染に対する肺機能反応における性的二型性。
Influenza Other Respir. Viruses. 2011; 5: 334-342
論文で見る
スコパス (58)
PubMed
クロス
グーグル奨学生
ペッターソンU.S.
ワルデン T.B.
カールソンP.O.
ヤンソン L.
フィリップソン M.
雌性マウスは高脂肪食によるメタボリックシンドロームから保護され、脂肪組織における制御性T細胞集団を増加させる。
PLoS One. 2012; 7: e46057
論文で見る
スコープス (329)
PubMed
クロス
グーグル奨学生
ワン・ビー
チャンドラセケラ P.C.
ピピンJ.J.
レプチンおよびレプチン受容体欠損げっ歯類モデル:ヒト2型糖尿病との関連性。
Curr. Diabetes Rev. 2014; 10: 131-145
論文で見る
スコープス (345)
PubMed
クロス
グーグル奨学生
フランシスコ V.
et al.
肥満、脂肪量と免疫系:レプチンの役割。
Front. 生理学 2018; 9: 640
論文で見る
スコープス (261)
PubMed
クロス
グーグル奨学生
Huang K.
et al.
マウスの出生後の肺の発達に対するレプチン欠乏の影響。
J. 応用生理学 2008; 1985: 249-259
論文で見る
スコープス (46)
クロス
グーグル奨学生
ジュタント E.M.
トゥーL.
ハンバート M.
ギニャベール C.
Huertas A.
肺におけるレプチンの千の顔。
Chest. 2021; 159: 239-248
論文で見る
スコープス(14)
PubMed
要旨
全文
全文PDF
グーグル奨学生
マロニー S.K.
フラーA.
ミッチェル D.
ゴードン C.
オーバートン・J.M.
動物モデル研究の実用化:げっ歯類が寒いのは問題か?
生理学(ベセスダ)。2014; 29: 413-420
論文で見る
スコープス (126)
PubMed
クロス
グーグル奨学生
ジャイルズD.A.
他
周囲温度の調節は野生型C57BL/6マウスにおいて炎症を促進し、アテローム性動脈硬化症を発症させる。
Mol. Metab. 2016; 5: 1121-1130
論文で見る
スコープス (55)
PubMed
クロス
グーグル奨学生
フォックスマン E.F.
他
感冒ウイルスに対する温度依存性自然防御は、マウスの気道細胞における温暖な温度でのウイルス複製を制限する。
Proc. Natl Acad. Sci. U. S. A. 2015; 112: 827-832
論文で見る
スコープス (152)
PubMed
Crossref
グーグル奨学生
Liu E.
et al.
リポ多糖および大腸菌誘発全身性炎症の重症型では、発熱よりも自然低体温の方が有利である。
Am. J. Physiol. Regul. Integr. Regul. Physiol: R1372-R1383
論文で見る
スコープス (74)
PubMed
クロス
グーグル奨学生
モラゲスV.
Pinkerton H.
環境温度の変化に伴うマウスチフス感染の罹患率および死亡率の変化。
J. Exp. Med. 1944; 79: 41-43
論文で見る
スコープス (11)
PubMed
クロス
グーグル奨学生
ベル J.F.
ムーアG.J.
マウスにおける狂犬病ウイルス感染の様々な段階に対する高い周囲温度の影響。
Infect. Immun. 1974; 10: 510-515
論文で見る
PubMed
クロス
グーグル奨学生
Liao W.
et al.
熱中性住宅温度はT調節細胞機能を制御し、マウスにおけるオバブミン誘発喘息発症を抑制する。
Sci. Rep. 2017; 7: 7123
論文で見る
スコープス (18)
クロスリファレンス
グーグル奨学生
ジャヴェリ K.A.
トラメルR.A.
Toth L.A.
環境温度がC57BL/6Jマウスの睡眠、運動活性、中核体温および免疫応答に及ぼす影響。
Brain Behav. Immun. 2007; 21: 975-987
論文で見る
スコパス(52)
PubMed
クロス
グーグル奨学生
ジェイミーソン D.J.
et al.
米国における妊娠中のH1N1 2009インフルエンザウイルス感染。
Lancet. 2009; 374: 451-458
論文で見る
スコープス (1171)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ルイJ.K.
アコスタ M.
ジェイミソン D.J.
ホネインM.A.
カリフォルニア州パンデミック(H1N1)ワーキンググループ。カリフォルニア州における妊娠中および出産後の女性における重症2009 H1N1インフルエンザ。
N. Engl. J. Med. 2010; 362: 27-35
記事で見る
スコープス (567)
PubMed
クロス
グーグル奨学生
Kumar A.
et al.
カナダにおける2009年インフルエンザA(H1N1)感染重症患者。
JAMA. 2009; 302: 1872-1879
論文で見る
スコープス (1158)
PubMed
クロス
グーグル奨学生
ダーメンM.S.M.A.
アラルコンP.C.
シャー A.S.
Divanovic S.
糖尿病におけるウイルス性肺炎の炎症性病態に油を差す。
Obes. Rev. 2022; 23: e13415
論文で見る
スコープス(3)
クロスリファレンス
グーグル奨学生
プジャンテルM.
アルトフェルドM.
抗ウイルス免疫の制御におけるI型IFN応答の性差の結果。
Front. Immunol. 2022; 13986840
論文で見る
スコパス (9)
PubMed
クロス
グーグル奨学生
ホアン L.Y.
チウ C.J.
Hsing C.H.
Hsu Y.H.
肥満とインスリン感受性におけるインターフェロンファミリーサイトカイン。
細胞。2022; 11: 4041
論文で見る
スコープス (5)
クロスリファレンス
グーグル奨学生
ファーO.M.
ガブリエリA.
マンゾロス C.S.
2015年のレプチン応用:レプチンと肥満について我々は何を学んだか?
Curr. Opin. 内分泌。Diabetes Obes. 2015; 22: 353-359
論文で見る
スコープス (149)
PubMed
クロス
グーグル奨学生
ヘルストレムL.
Wahrenberg H.
Hruska K.
レイニスドッティル S.
アーナーP。
循環レプチン濃度の性差の背後にあるメカニズム。
J. インターン。Med. 2000; 247: 457-462
論文で見る
スコープス (142)
PubMed
クロス
グーグル奨学生
ギリバーS.C.
炎症制御因子としての性ステロイド。
J. Steroid Biochem. Mol. 生物学 2010; 120: 105-115
論文で見る
スコープス (133)
PubMed
クロス
グーグル奨学生
メア K.M.
ゴウ R.
マクリーンMR。
肥満、エストロゲン、脂肪組織機能不全 - 肺動脈性肺高血圧症の意味。
Pulm. 2020; 102045894020952019
論文で見る
スコープス(30)
クロス
グーグル奨学生
オブライエン K.B.
et al.
創傷治癒の障害により、肥満マウスは重症インフルエンザウイルス感染症に罹患しやすい。
J. Infect. Dis. 2012; 205: 252-261
論文で見る
スコープス (84)
PubMed
クロス
グーグル奨学生
ゲイ L.
et al.
感染症における性的二型性と性別。
Front. Immunol. 2021; 12698121
論文で見る
スコパス (51)
クロスリファレンス
グーグル奨学生
Min J.
et al.
性差が結核の部位と重症度に及ぼす影響。
Sci. Rep. 2023; 13: 6023
論文で見る
スコパス (3)
クロスリファレンス
グーグル奨学生
Singh R.
他。
肥満とCOVID-19重症度および死亡率との関連:最新の系統的レビュー、メタ解析、メタ回帰。
Front. Endocrinol. (ローザンヌ)。2022; 13780872
論文で見る
スコープス (41)
クロス
グーグル奨学生
高橋忠彦.
et al.
COVID-19の疾病転帰の根底にある免疫応答の性差。
Nature. 2020; 588: 315-320
論文で見る
スコープス (800)
PubMed
クロス
グーグル奨学生
シュレッターK.J.
バリッシュA.L.
カッツJ.M.
インフルエンザ:伝播、定量化、保存。
Curr. Protoc. Microbiol. 2006; (第15章、ユニット15G.1.1-15G.1.22)
論文で見る
PubMed
クロスレフ
グーグル
論文情報
出版履歴
オンライン公開 2023年10月13日
受理済み 受理:2023年9月13日
改訂版受理 2023年8月18日
受理:2023年8月18日 受理日:2023年5月11日
出版段階
インプレス校正
識別
DOI: https://doi.org/10.1016/j.mucimm.2023.09.004
著作権
© 2023 The Authors. Society for Mucosal Immunologyに代わってElsevier Inc.が発行。
ライセンス
クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止 (CC BY-NC-ND 4.0) | 情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルgr1
図1Lean雌性マウスと雄性マウスのインフルエンザ罹患率は同程度である。(A)実験計画の概略図。12週齢のWT C57/BL6雌雄(n = 6-13/群;3回の独立した実験の結果)を生理食塩水で経鼻的に模擬感染させるか、インフルエンザウイルス(Charles River Influenza A/PR/8/34 (H1N1), Batch: 4XP160913、投与量は30ヘマグルチニン(HA)単位)。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)感染5日後の左肺重量。(E)サイトカインELISAで定量した気管支肺胞洗浄液(BALF)インターロイキン-6(IL-6)レベル。(F)ベースライン免疫細胞集団の肺CD45+細胞総数に対する割合。(G)肺CD45+細胞全体に占める感染免疫細胞集団の割合。(I) 肺マクロファージ絶対数(CD11bhiF4/80hi)。(J)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。スチューデントのt検定または一元配置分散分析; *p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。ELISA = enzyme-linked immunosorbent assay; qPCR = quantitative polymerase chain reaction; SEM = standard error of the mean.
図サムネイルgr2
図2肥満雄性マウスは、痩せ雄性マウスと比較して、インフルエンザ感染に対する肺の炎症が亢進している。(A)実験デザインの概略図。6~8週齢のWT C57/BL6雄(3つの独立した実験を行った:2つは死亡までの時間、2つは動態解析のため)をChow Diet(CD、脂肪10%、炭水化物70%、タンパク質20%;Research Diet #D12450J )またはHigh-Fat Diet(HFD、脂肪60%、炭水化物20%、タンパク質20%;Research Diet #D12492 )に20週間飼育し、その後生理食塩水またはインフルエンザウイルスを経鼻投与した。(B)感染した痩せ雄および肥満雄マウスの死亡時間曲線(n = 8/群、独立した2回の実験結果)。(C)感染後の体重減少(n = 4-10/群、2回の独立した実験の結果)。(D)qPCRで定量した肺ウイルスMタンパク質発現。(E)左肺重量。(F)サイトカインELISAにより定量したBALF IL-6レベル。(G)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。生理食塩水で処理した対照の平均値を破線で示す。(H)肺マクロファージ絶対数(CD11bhiF4/80hi)。(I)肺好中球絶対数(CD11bhiGR1hi)。(J-K) ex vivo PMA-イオノマイシンおよびブレフェルジン刺激による免疫細胞炎症能。炎症性サイトカイン産生は、フローサイトメトリーによる細胞内抗体獲得により定量した。(J) ex vivo刺激後の全肺CD45+細胞IL-6産生。(K) ex vivo刺激後の肺マクロファージIL-6産生。平均値±SEM。スチューデントのt検定または一元配置分散分析;*p < 0.05、**p < 0.01。ELISA = enzyme-linked immunosorbent assay; PMA = phorbol 12-myristate 13-acetate; SEM = standard error of the mean; WT = wild-type.
図のサムネイルgr3
図3感染した肥満雄マウスは、感染した痩せ雄マウスよりも肺実質の炎症が悪化している。(A)除脂肪体重および肥満体重のコントロール/塩水処理マウスとインフルエンザ感染マウス(4列に表示)の左肺の代表的な画像(膨張なし)で、1倍、5倍、20倍の対物レンズで撮影した。低倍率の画像は各実験群の概観を示し、中倍率の画像は主要な伝導性気道(気管支中心性病理のため)および肺胞末梢から胸膜までを拡大した。コントロール(模擬感染時に生理食塩水を注入したが、水洗や炎症は起こしていない)の肺の代表的な画像は、十分に通気性のある気腔と、調達に関連した軽度の新鮮出血のある領域の両方を示している。対照の痩せ型および肥満型マウスでは、気道は無傷で、気管支中心の病理学的過程もなく(管腔、上皮、経気管支、気管支周囲の炎症性浸潤や損傷もない)、病理組織学的スコアに反映されているように、末梢肺実質への進展もない。インフルエンザに感染した肺では、低倍率(1倍および5倍相当)において、細胞密度増加の気管支中心性分布が、通気性の末梢実質とは対照的に明らかである。中間の倍率では、気管支中心性の病態("20倍"、3段目)は、気管支内への化膿性(壊死性)炎症性浸潤、炎症を起こした気管支上皮内層の減弱、気管支周囲腔への進展(細胞数の増加を伴う)によって証明される。末梢実質への進展("20X "4段目)は、肺胞隔膜に沿った消散性の小病巣でみられ、時折の被験者では胸膜下浮腫を含む(肥満感染マウス肺を参照)。(B) 肺全体の病理組織学的スコア。 (C) 気管支中心性肺炎の病理組織学的スコア("20X"、3段目、低倍率の画像で例示)。(D)実質への炎症性進展の病理組織学的スコア("20X"、4列目、低倍率で例示)。H&E = hematoxylin & eosin。
図サムネイルgr4
図4雌マウスにおいて高脂肪食(HFD)摂取はインフルエンザ罹患率を強固に増幅させるのに十分ではない。(A)実験計画の概略図。6-8週齢のWT C57/BL6雌雄(n = 8-14/群;3つの独立した実験の結果)をCDまたはHFDで20週間飼育し、その後インフルエンザウイルス(30 HAユニット)で経鼻チャレンジした。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)左肺重量。(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。(I)CDを投与した雌雄の全肺CD45+細胞に占める感染免疫細胞集団の割合。(J)HFD飼育雌雄における肺CD45+細胞総数に占める感染免疫細胞集団の割合。スチューデントのt検定または一元配置分散分析;*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001。CD = chow diet; ELISA = enzyme-linked immunosorbent assay; SEM = standard error of the mean; WT = wild-type.
図のサムネイル gr5
図5熱中性(TN)飼育の雄マウスでは、肥満関連インフルエンザ疾患の重症度が維持される。(A)実験デザインの概略図。6-8週齢のWT C57/BL6雄(n = 5-6/群;2つの独立した実験の結果)を恒温(TS、22℃)またはTN(30℃)のどちらかのハウジングに入れ、20週間HFDを与え、その後インフルエンザウイルス(30 HAユニット)を経鼻投与した。(B)感染後の体重減少。(C)qPCRで定量した肺ウイルスMタンパク質発現。(D)左肺重量。(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。平均値±SEM。(I)HFD飼育、TS飼育またはTN飼育の雄の肺CD45+細胞総数に占めるベースライン免疫細胞集団の割合。(J)HFD-fed、TS-またはTN-houseed雄における肺CD45+細胞総数に占める感染免疫細胞集団の割合。Studentのt検定または一元配置分散分析;**p < 0.01, ***p < 0.001, ****p < 0.0001。BALF = 気管支肺胞洗浄液; CD = チャウ食; HFD = 高脂肪食; IL-6 = インターロイキン-6; qPCR = 定量ポリメラーゼ連鎖反応; SEM = 平均値の標準誤差; WT = 野生型.
図サムネイルgr6
図6肥満の雌雄マウスは、肥満に伴うインフルエンザ疾患の重症度が比較的に悪化した。(A)C57BL/6雌雄マウス(n = 6-15/群;4つの独立した実験の結果を合わせた)をTN飼育に入れ、CDまたはHFDを20週間与えた後、インフルエンザウイルス(30HAユニット)を鼻腔内チャレンジした。(B)感染後の体重減少。(C)qPCRで定量した肺Mタンパク質発現。(D)感染5日後の左肺重量(E)サイトカインELISAで定量したBALF IL-6レベル。(F)フローサイトメトリーで測定した肺の全CD45+免疫細胞浸潤。(G)肺マクロファージ絶対数(CD11bhiF4/80hi)。(H)肺好中球絶対数(CD11bhiGR1hi)。(I)TN飼育CD飼育雌雄の肺CD45+細胞総数に占める感染免疫細胞集団の割合。(J)TN飼育HFD飼育雌雄における全肺CD45+細胞に占める感染免疫細胞集団の割合。(K)気管支中心性肺炎の病理組織学的スコア(L)実質への炎症進展の病理組織学的スコア。(M)洗浄していない左肺の代表的なH&E染色(光学顕微鏡、10倍)。平均値±SEM。Studentのt検定または一元配置分散分析;**p < 0.01、***p < 0.001、***p < 0.0001。BALF = 気管支肺胞洗浄液; CD = チャウ食; ELISA = 酵素結合免疫吸着測定法; H&E = ヘマトキシリン・エオジン; HFD = 高脂肪食; IL-6 = インターロイキン-6; SEM = 平均値の標準誤差; TN = サーモニュートラル。
図サムネイルgr7
図7総体重の増加はインフルエンザ関連疾患の重症度転帰の悪化と相関する。TN飼育の痩せ型および肥満型雌雄における感染前の総体重は、様々なインフルエンザ重症度評価指標と相関していた。(A)感染前の総体重と5DPI時の左肺重量。(B). 感染前総体重と5DPI時の気管支肺胞洗浄液インターロイキン-6レベルとの比較。(C)感染前総体重対5DPI時の肺CD45+免疫細胞浸潤。ノンパラメトリックSpearman Rank相関検定およびPearson相関検定は、Prism(GraphPad software)を用いて、それぞれ男性および女性について行った。R値およびp値は直接報告した。DPI = 感染後日数、TN = サーモニュートラル。
表
表1恒温飼育下におけるインフルエンザ感染マウスの重症度評価指標。
表2サーモニュートラル飼育におけるインフルエンザ感染マウスの重症度評価指標。
関連記事
ホーム
発展途上国へのアクセス
論文・号外
プレスリリース
最新号
号外リスト
著者へ
執筆許可
研究者アカデミー
原稿を投稿する
ジャーナル情報
ジャーナルについて
アブストラクト/索引付け
採用情報
連絡先
編集委員会
広告主情報
リプリント
新着情報
社会
SMI
その他の定期刊行物
定期刊行物の検索
製品カタログへ
このサイトのコンテンツは医療従事者向けです。
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&コンタクト
RELX
この記事が気に入ったらサポートをしてみませんか?
