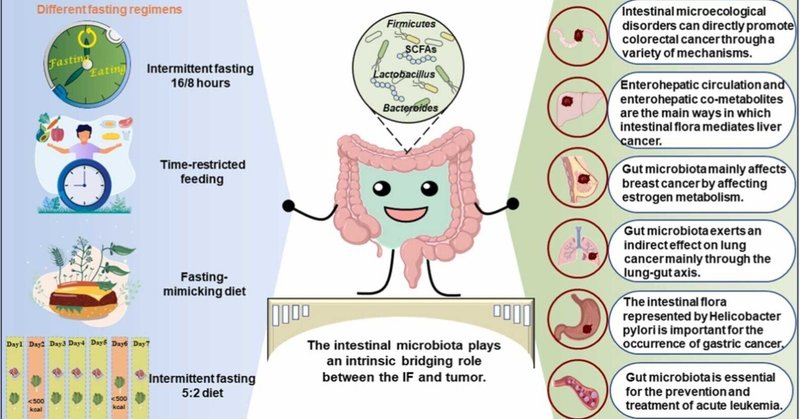
腸内細菌叢: 断続的絶食と腫瘍の架け橋
本文へスキップ記事へスキップ
エルゼビアロゴ
生物医学・薬物療法
第167巻 2023年11月, 115484
総説
腸内細菌叢: 断続的絶食と腫瘍の架け橋
https://www.sciencedirect.com/science/article/pii/S0753332223012829#bib153






著者リンク オーバーレイパネルを開くJing Liu a b, Nan Shao a b, Hui Qiu a b, Juanjuan Zhao a b, Chao Chen a b, Jiajia Wan a b, Zhixu He a c, Xu Zhao a d, Lin Xu a b
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.biopha.2023.115484
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
腸内細菌叢は腫瘍の発生・進展に重要な役割を果たしている。
代表的な食事介入法として、IFは腫瘍治療の有望なアプローチである。
IFは、腸内細菌叢に影響を与えることにより、腫瘍の発生および発症を抑制する可能性がある。
要旨
腸内細菌叢とその代謝産物は、腸の健康を維持し、炎症反応を制御し、身体の免疫機能を高めるために不可欠である。腸内細菌叢が腫瘍形成や介入効果と密接に結びついていることを示す研究が増えている。間欠的絶食(IF)は、エネルギー代謝を改善し、寿命を延ばし、腫瘍を含む様々な疾患の進行を抑えることができる、周期的な食事制限の方法である。IFは腫瘍細胞のエネルギー代謝に影響を与え、腫瘍細胞の増殖を抑制し、免疫細胞の機能を改善し、抗腫瘍免疫反応を促進することができる。興味深いことに、最近の研究により、腸内細菌叢がIFによって、特に微生物組成と代謝の変化によって影響を受けることがさらに明らかになった。これらの知見は、有望な腫瘍介入戦略としてのIFの複雑性を示唆しており、腫瘍介入戦略の理解を深め、臨床的な腫瘍介入戦略の開発を促進するために、さらなる研究が必要である。本総説では、さまざまな腫瘍における腸内細菌叢の特徴とそのメカニズムについて概説することを目的とした。特に、腸内細菌叢に対するIFの影響について要約し、腫瘍抑制効果との関連の可能性について論じた。最後に、取り組むべきいくつかの重要な科学的課題を提案し、関連する研究の展望を構想した。これらの研究は、理論的根拠を提供し、将来、臨床介入の新たな戦略としてIFと腸内細菌叢を応用するのに役立つかもしれない。
図解抄録
GA1
ダウンロード 高解像度画像ダウンロード(265KB)
ダウンロード フルサイズ画像のダウンロード
腸内細菌叢は間欠的絶食と腫瘍の関係において本質的な橋渡し的役割を果たしている。
前の記事次の記事
略語
IFintermittent fastingSCFAsshort-chain fatty acids短鎖脂肪酸GM腸内マイクロバイオームBAbile acidLPSlipopolysaccharidesSBAsecondary bile acidTMAOtrimethylamine N-oxideHDAChistone deacetylaseTLR-4toll-like receptor 4TNF- αtumor necrosis factor-αIL-6interleukin-6DACdeoxycholic acidLCAlithocholic acidUDCAursodesoxycholic acidPRRpattern recognition receptorTMPtape measure protein3-IAAindole-3-acetic acidCRCcolorectal cancerF. nucleatumFusobacterium nucleatumCTSKカテプシンKMSI-High microsatellite instabilityHATヒストンアセチルトランスフェラーゼJNKc-Jun N-末端キナーゼ肺がんSCLC小細胞肺がんNSCLC非小細胞肺がんNSCLC 小細胞肺がん樹状細胞ナチュラルキラー細胞GLA腸-肺軸PAMP病原体関連分子パターンB乳がんJAK2ヤヌスキナーゼ2STAT3シグナルトランスデューサーおよび転写活性化因子3MET間葉-上皮移行HCC 間葉系-上皮移行HCC肝細胞がんMAMP微生物関連分子パターンMDSC骨髄由来抑制細胞LTAリポテイコ酸SASP老化関連分泌表現型COX2シクロオキシゲナーゼ-2PGE2プロスタグランジンE2FXRファルネソイドX受容体NKTナチュラルキラーT細胞APAF1アポトーシスプロテアーゼ活性化因子-1PLC原発性肝がんGC胃がんH. pyloriHelicobacter pyloriCagAcytotoxin-associated gene AVacAvacuolating cytotoxin Acag PAIcag pathogenicity islandT4SSType IV secretion systemGSK3βglycogen synthase kinase 3βHDM2human double minute 2ΔΨ mmitochondrial transmembrane potentialCyt Ccytochrome cROSoxygen speciesNOCN- ニトロソ化合物EMT上皮間葉転換A急性白血病AML急性骨髄性白血病ALLリンパ芽球性白血病APB-ALL前駆体B 細胞性急性リンパ芽球性白血病MLL混合型白血病CTLA-4細胞傷害性Tリンパ球関連タンパク質4STINGインターフェロン遺伝子刺激因子UroAurolithin A5FU5 フルオロウラシルFMTfecal microbiota transplantationICAM1intercellular adhesion molecule 1CRcalorie restrictionTRFtime-restricted feedingFMDfasting-mimicking dietCLPcommon lymphoid progenitor cellsTILstumor-infiltrating lymphocytesEODFevery-other-day fastingHFDhigh fat dietA. muciniphilaAkermansia muciniphilaIFN-Itype I interferonICBimmune checkpoint blockade
キーワード
腸内細菌叢代謝産物絶食腫瘍免疫力
はじめに
最新の世界がん統計によると、2020年には世界20地域で約1,930万人の新規腫瘍患者と990万人の腫瘍関連死亡者が発生するとされている[1]。そのため、腫瘍学における臨床的介入のための新たな戦略を開発し、関連するメカニズムを探求することは、依然として急務である。腫瘍の発生は、遺伝的要因と環境的要因が組み合わさった結果であり、その中でも腸内細菌叢は、腫瘍の発生・進展における重要な環境因子として新たに認識され、また、短鎖脂肪酸(SCFA)に代表される代謝産物など、抗がんメカニズムにも密接に関係している、 に代表される代謝物は、Gタンパク質共役受容体に作用したり、ヒストンアセチル化をアップレギュレートしたりすることから、腫瘍細胞周期の停止、腫瘍細胞の転移・浸潤の抑制、腫瘍細胞のアポトーシスの誘導などにつながり[2]、腫瘍の予防や治療において腸内細菌叢を調節することの潜在的価値が示唆されている。これまでの研究から、腸内細菌叢は宿主の遺伝子型、年齢、食事パターン [3], [4] によって左右され、中でも食事パターンは腸内微生物群集構造の主な制御因子であるだけでなく、バランスのとれた腸内細菌叢は腸の健康維持、炎症反応の制御、免疫機能の増強に有益であることが示されている。したがって、腸内細菌叢は、宿主の代謝、免疫系の機能、および他のいくつかの生理学的・病理学的プロセスに影響を与える食事パターンにおいて、顕著な橋渡し的役割を果たす可能性がある。
現在、間欠的絶食(IF)は、最も広く研究され、適用されている食事制限治療戦略の一つであり、寿命を延ばし、老化関連疾患のリスクを低減する [5], [6] 。IFは、一定期間にわたって絶食と自由摂取を交互に繰り返す周期的な食事介入を指し、これには次のものが含まれる:交互日絶食(「絶食日」ごとに0~500kcal、「食事日」には自由摂取)、5:2食(週に2日絶食、5日通常食)、時間制限食(毎日指定された時間帯にのみ食事) [7] 。IFは、腫瘍細胞のエネルギー代謝に影響を与え、腫瘍細胞の増殖を抑制するだけでなく、免疫細胞の発達と機能を改善し、身体の抗腫瘍免疫反応を促進することが実証されている [8] 。特に、新たな一連の研究から、IFは腸内細菌叢に影響を与えることで、いくつかの慢性疾患(肥満、心血管疾患、糖尿病など)の成長を緩和できることが示されている[9]、[10]、[11]。これらの知見は、腸内細菌叢のリモデリングが、腫瘍に対するIF介入の効果において重要な役割を果たしている可能性を示唆した。そこで、本総説では、IFと腫瘍との関連を探ることにより、橋渡し役としての腸内細菌叢の役割を強調し、腫瘍治療の標的としてのIFと腸内細菌叢に基づく新たな臨床介入戦略の参考となることを目的として、腫瘍治療の文脈における現在のIFと腸内細菌叢の研究が直面している展望と課題について議論する。
腸内細菌叢
ヒトの体内には何兆もの微生物が生息しており、その代謝活性と協調機能は生命と健康に不可欠である。さらに、これらの微生物は腸管コンパートメント内で最高密度に達し、約3.8×1013個と、宿主細胞自体の数を10倍もはるかに上回り [12], [13] 、一緒になって腸内マイクロバイオーム(GM)と呼ばれる大規模な微生物群集を形成している [14] 。腸内細菌叢は、細菌、真菌、古細菌、ウイルスを含む、複雑で、動的で、空間的に不均一な生態系であり、互いに、またヒトの宿主と、共生的なものから寄生的なものまで、複雑な栄養関係を築いている [15]。さらに重要なことに、GMは、炭水化物発酵、有害微生物の抑制(競合阻害)、ビタミン合成、免疫系活性、薬物代謝など、様々な重要な生物学的機能に関与している [16], [17]。GMにおける非細菌成分の存在量が少なく、その標的化技術が困難であるため、これらの微生物の中では細菌が広く研究されている [18] 。
腸内細菌叢は主に6つの門で構成されている: すなわち、ファーミキューテス、バクテロイデス、アクチノバクテリア、プロテオバクテリア、ベルコミクレビア、フソバクテリアである。その中でも、ファーミキューテス類とバクテロイデス類が主要な菌叢であり、これら2つの菌叢の割合は、異なる生理的・病理的条件下で変化する可能性がある。したがって、ファーミキューテスとバクテロイデスの比率は、しばしば健康状態や疾病状態を評価するための予測マーカーと考えられている[19]。同時に、腸の解剖学的部位ごとの微生物叢の分布にも有意な差がみられた。例えば、腸内細菌科などのプロテオバクテリアは主に小腸に存在するが、大腸にはほとんど存在しない。一方、バクテロイデス科、プレボテラ科、リケネラ科は主に大腸に存在し、この分布の違いは主に小腸と大腸の微小環境の違いによるものである。小腸では胆汁酸(BA)濃度が高く、通過時間が短いのに対し、大腸ではBAが通常よりゆっくりと流れ、pHも穏やかであるため、より大規模な微生物群集が大腸、特に嫌気性微生物にコロニー形成することが多い[20]。さらに、正常な生物の腸内細菌叢の組成は一定ではなく、その組成は環境、年齢、ホルモンレベル、抗生物質などの薬物療法、食習慣などの様々な要因によって変化する [21], [22] 。
腸内細菌叢は、SCFA、リポ多糖類(LPS)、二次胆汁酸(SBA)、インドールおよびその誘導体、トリメチルアミンN-オキシド(TMAO)など、宿主の代謝のいくつかの側面において主要な調節的役割を果たすために、その代謝産物に依存している(図1)[23]。例えば、SCFA(酢酸塩、プロピオン酸塩、酪酸塩を含む)は、腸内細菌によって発酵された炭水化物やタンパク質の主な産物であり、主にヒストン脱アセチル化酵素(HDAC)の阻害やGタンパク質共役型受容体(GPR41、GPR43、GPR109aを含む)の活性化を通じて、身体の代謝や機能を調節し[24]、腸管バリアの完全性の向上、免疫系の強化、体重やインスリン抵抗性の減少などの活性を有する[25]。一方、LPSは腸内グラム陰性菌の細胞壁の構成成分であり、細胞表面のToll様受容体4(TLR-4)に結合することにより、マクロファージや単球を活性化し、腫瘍壊死因子α(TNF-α)、インターロイキン-6(IL-6)、IL-23などの炎症性サイトカインの産生を誘導することで、自然炎症反応を引き起こすことができる[26]。さらに、SBA(デオキシコール酸(DCA)、リトコール酸(LCA)、ウルソデスオキシコール酸(UDCA)を含む)は、肝臓で合成された一次BAから胆管や消化管に産生され、腸内細菌によって二次代謝産物(脱アミノ酸残基を含む、 脱水酸化、酸化、イソプロピル化など)に修飾され、T細胞の分化やマクロファージの分極を制御することで、腸の恒常性維持に寄与すると考えられている [23], [27] 。さらに、腸内細菌叢が産生する代謝産物であるインドールやTMAOもまた、腸上皮細胞のタイトジャンクション、タンパク質の構造的安定性や機能的完全性など、腸のホメオスタシスに有益である [28], [29], [30], [31]。結論として、腸内細菌叢とその代謝産物は、体内の正常な生理機能を維持するために不可欠であり、腸内細菌叢と健康との関係の複雑さを理解することは、疾患に対する新たな治療法を開発するための基盤作りに貢献する。
図1
ダウンロード 高解像度画像ダウンロード(131KB)
ダウンロード フルサイズ画像のダウンロード
図1. 腸内細菌叢が産生する主な代謝産物。(注 PAMPsは病原体関連分子パターン、LPSはリポ多糖類、SCFAは短鎖脂肪酸。)
腸内細菌叢と腫瘍
近年、腸内細菌叢は腫瘍において重要な役割を果たすことが注目されており、免疫応答、炎症、代謝、遺伝毒性および毒性作用の調節、細胞周期停止の誘導など、様々な経路を通じて腫瘍の発生に影響を及ぼす可能性がある [32] 。そのメカニズムには主に、パターン認識受容体(PRR)の活性化、抗原特異的活性化、代謝産物制御などがある [33] 。一例として、LPSはTLR-4およびNF-κB依存的にウロキナーゼ・フィブリノーゲン活性化系を活性化することにより、腫瘍細胞外マトリックスの接着と浸潤を促進する。動物モデルでは、テープメジャータンパク質(TMP)を含有する腸球菌の投与は、抗腫瘍T細胞活性と免疫遮断療法の全体的な有効性を高める可能性がある [35] ;さらに最新の研究では、インドール-3-酢酸(3-IAA)やTMAOを含む他の代謝産物も、化学療法や免疫チェックポイント遮断反応に対する癌の感受性を増幅させる可能性があることが示されている [36], [37] 。いくつかのがんにおける腸内細菌叢の変化とその影響の可能性を表1に示す。
表1. がんにおける腸内細菌叢の変化とその潜在的機序。
がん 対象 変化した微生物 考えられる影響 参考文献
大腸がん ヒト アップレギュレート: フソバクテリア属、プロテオバクテリア属、腸内細菌科
ダウンレギュレート ファーミキューテス属、クロストリジウム属、クロストリジウム属、 ラクノスピラ科、ルミノコッカス科 不明。 [38]
大腸がん C2016BL/0002 マウス Upregulate: バクテロイデス科, クロストリジウム科, うどんこ病菌科
低下させる: ムリバク科、S24-7_group_unidentified は CRC の進行を促進する。 [39]
肝臓がん ヒト アップレギュレート: アップレギュレート:プロテオバクテリア属、腸内細菌科、Bacteroides xylanisolvens、Ruminococcus gnavus、Clostridium bolteae
低下させる: バクテロイデス属とルミノコッカス属は、いくつかの全身性炎症・免疫マーカーと関連している。 [40]
肝臓がん Mdr2-/-マウス アップレギュレート: 腸内細菌、放線菌、パラバクテロイデス属、クロストリジウム属、バクテロイデーテス属
発現低下: Parabacteroidesの濃縮は炎症遺伝子Ifnb1と負の相関がある。 [41]
乳がんヒト アップレギュレート: アップレギュレート:大腸菌、クレブシエラ、プレボテラ・アムニー
ダウンレギュレート: ポルフィロモナス・ウエノニス(Porphyromonas uenonis)、ユーバクテリウム・エリゲンス(Eubacterium eligens)、ラクトバチルス・ヴァギナリス(Lactobacillus vaginalis) 不明 [42] 。
肺がん ヒト アップレギュレート: ハラネロビアオタ、放線菌、ベヨネラ、メガファエラ、腸球菌、クロストリジオイデス
ダウンレギュレート: クロストリジウムは肺がん患者のグリセロリン脂質代謝と正の相関がある。 [43]
膵がんヒトはアップレギュレートする: フソバクテリウム、カプノサイトファーガ、プレボテラ、セレノモナス
低下させる: 乳酸菌 不明 [44] 。
甲状腺がん ヒト アップレギュレート: プロテオバクテリア、バクテロイデス、ラクノクロストリジウム
低下させる: プロテオバクテリアの増加は微生物生態学的ディスバイオシスの症状であり、プレボテラは動物由来食品の摂取と甲状腺がんとの関係の可能性を示唆している。 [45]
神経膠腫 ヒト アップレギュレート: フソバクテリウム、アッケマンシア、エシェリヒア/シゲラ
ダウンレギュレート: ラクノスピラ、アガトバクター、ビフィドバクテリウム フソバクテリウムはDNAメチル化酵素を仲介する。アッカーマンシアは腸粘膜層を分解することにより炎症反応を誘導する。 [46]
食道がんヒトはアップレギュレートする: アップレギュレート:ファーミキューテス属、アクチノバクテリア属、ストレプトコッカス属、ビフィドバクテリウム属、サブドリグランリウム属、ブラウチア属、ロンブウチア属
低下させる: Lachnospira、Bacteroides、Agathobacterium、Lachnoclostridium、Parabacteroides、Paraprevotella、Butyricicoccus Firmicutes/Bacteroidesの割合が増加すると、炎症が抑制され、短鎖脂肪酸産生菌が減少する可能性がある。 [47]
前立腺がん NOD-SCIDマウス アップレギュレート: Verrucomicrobia、Wolbachia、Akkermansiaceae、Enterococcaceae、Bifidobacteriaceae、Muribaculaceae Akkermansiaceaeの存在量のダイナミックな変化は、前立腺がんのコロニー形成過程に関連している可能性がある。 [48]
3.1. 大腸がん
大腸がん(CRC)は、世界で3番目に頻度の高いがんであり、がんに関連する死亡原因の第2位である。大腸内視鏡検診の成功にもかかわらず、検診が日常的に行われていない一部の国では CRC の発生率が増加している。ヒトの大腸上皮は、外部環境と接触する最も広範な粘膜表面積を有しており、したがって最も多くの、そして多様な微生物叢を含んでいる [49] 。CRCの進行段階は、CRC組織や隣接粘膜の微生物の著しい環境破壊と関連していることが多く、隣接粘膜の微生物叢αの多様性が変化するとCRCの再発につながる可能性があることが研究で示されている [50] 。さらに、CRC患者の微生物叢は、日和見病原体や代謝障害に関連する微生物(フソバクテリウム・ヌクレアタム(F. nucleatum)、ビフィドバクテリウム・フラジリス(Bifidobacterium fragilis)、大腸菌が関与)に富んでいることが多く [51] 、腸の恒常性を維持する酪酸産生菌(ロゼブリア(Roseburia)、クロストリジウム(Clostridium)、フェーカリバクテリウム(Faecalibacterium)、ビフィドバクテリウム(Bifidobacterium)が関与する)は通常減少している [52] 。
腸内細菌叢は、炎症を誘発したり免疫抑制作用を発揮したりすることにより、間接的に発がん作用を及ぼす可能性がある [53] 。Kostic ADらは、腸腫瘍のApc(Min/+)マウスモデルにおいて、F. nucleatumが骨髄由来免疫細胞を動員して腫瘍増殖に好都合な炎症性微小環境を生成することにより、腫瘍の増殖を有意に増加させることを見出した [54] 。一方、別の研究では、F. nucleatumはCRC転移の高リスク因子であり、F. nucleatumから同定された病原因子であるFadAは、E-カドヘリンに結合し、β-カテニンシグナル伝達を活性化して炎症と発がんを誘導することが明らかになった(図2A)[55]。ヒト腫瘍モデル研究において、研究者らはヌクレアタムのFap2タンパク質がヒト抑制性受容体TIGITと結合して、身体の抗腫瘍免疫機能を抑制することを発見した [56]。さらに、一連の研究により、血漿中のLPS濃度が有意に上昇し、CRC検体ではLPS関連経路が濃縮されていることが証明されている。機序の面では LPSはケモカイン依存的に単核マクロファージの集積を制御し、LPSの放出はCRC細胞におけるカテプシンK(CTSK)の発現に寄与すると考えられる。CTSKの過剰発現は、マクロファージ膜上のTLR-4/mTOR経路と相互作用し、腫瘍形成を促進するM2型偏極およびサイトカイン(例えば、IL-4、IL-10)産生を誘導することにより、CRC細胞の攻撃的表現型および患者の予後不良と関連している [57], [58] 。さらに、LPSはTLR4/MD2複合体を刺激することでPI3K/ACTシグナルを活性化し、下流のβ1インテグリン機能を促進し、CRC細胞の接着と転移をさらに促進する [59] 。これらの研究は、腸内細菌叢の一部がCRCの発症にある程度寄与することを示唆している。
図2
ダウンロード 高解像度画像のダウンロード(640KB)
ダウンロード フルサイズ画像のダウンロード
図2. 大腸がん、乳がん、肝細胞がんの発症に関与する微生物関連機序。A) 腸内細菌叢は、代謝産物や遺伝毒素などの微生物由来因子を含む様々な機序を介して大腸発癌に影響を及ぼす可能性がある。宿主と微生物の相互作用は、最終的に大腸癌の進行につながる発癌シグナル伝達経路の活性化に寄与する。さらに、微生物叢や代謝産物の中には、免疫細胞やマイクロRNAのレベルに影響を与えることでCRCの発症に関与するものもある。B) LCAは乳癌細胞においてTGR5発現を誘導し、プロアポトーシスp53タンパク質発現の増加と抗アポトーシスBcl-2タンパク質発現の減少をもたらした。さらに、LCAはAktリン酸化を低下させた。微生物代謝産物TMAOは、PERK-ER-ストレス-GSDME軸を誘導して腫瘍細胞のパイロプトーシスを促進し、その結果、細胞傷害性CD8+ T細胞の浸潤を増加させた。最後に、抱合エストロゲンは、β-グルクロニダーゼ活性を持つ腸内細菌種(「エストロボローム」の構成成分)によって脱共役され、その後、エストロゲンは循環中に再吸収され、細胞の成長と増殖を刺激する。C) 腸内細菌叢の代謝産物および腸内細菌叢によって刺激された腸上皮細胞によって産生された因子は、主に門脈を通って肝臓に循環する。肝臓では、これらの代謝産物が免疫細胞、シグナル伝達経路、タンパク質発現レベルに影響を与えることにより、肝細胞がんの発生と進展に関与する。(注 FadA、Fusobacterium adhesin A、MD-2、Myeloid differentiation 2 protein、LPS、lipopolysaccharide、GPCR、G Protein-Coupled Receptor、TLR4、Toll-like receptor 4、TIGIT、T cell immunoreceptor with Ig and ITIM domain、CTSK、Cathepsin K、MyD88、Myeloid differentiation factor88、AC、adenylyl cyclase、ATP、adenosine triphosphate; cAMP、環状アデノシン一リン酸;CREB、cAMP応答エレメント結合タンパク質;ERα、エストロゲン受容体α;Gαs、Gタンパク質;PKA、プロテインキナーゼA;LCA、リトコール酸;PUMAおよびNOVA、BH3のみのBcl-2ファミリーメンバー;pCREBおよびpAkt、リン酸化CREBおよびAkt;TGR5、Gタンパク質共役胆汁酸受容体)。
CRCの病態は複雑な過程であり、ほとんどの症例は結腸や直腸の内壁のポリープの増殖から始まり、異形成腺腫、そして最終的には腫瘍へと進展する。腫瘍形成と進行において、DNAメチル化、ヒストン修飾、ノンコーディングRNAなどのエピジェネティック修飾は、細胞のシグナル伝達経路を変化させることにより、正常粘膜の発癌を促進する [60] 。例えば、CRC組織におけるF. nucleatumの高い負荷は、高いマイクロサテライト不安定性(MSI-H)およびCpG島メチル化の表現型と関連している[61]。同時に、ヘリコバクター・ピロリ(H. pylori)感染は、消化管発癌の発症における様々な遺伝子の過剰メチル化に関与することが示されている [62] 。ヒストンリジンのアセチル化は、転写、翻訳、DNA修復に関与しており、HDACとヒストンアセチルトランスフェラーゼ(HAT)によって制御されている[63]。SCFAはHDAC阻害剤として作用し、間接的にヒストン修飾に影響を与えることができるため、腫瘍や免疫学的恒常性の重要な制御因子である可能性が示されている [64]。さらに、ノンコーディングRNAはエピジェネティックな状態を制御する重要な因子であり、CRC遺伝子の発現を制御する上で重要な意味を持つ。研究により、腸内細菌叢がCRC関連miRNAの発現を変化させることが示されている。例えば、F. nucleatumはTLR4とMyD88自然免疫シグナルを標的とし、miR-18a*とmiR-4802の発現を選択的に消失させてオートファジー経路を活性化し、CRC患者の薬剤耐性を変化させる [65] 。まとめると、腸内細菌叢とその代謝産物は、エピジェネティックな修飾を制御することによってCRCの発症に影響を及ぼしており、このことは、CRCを治療するために腸内細菌叢を調節することは、ある程度明るい見通しがあることを示唆している。一方、有益な細菌とその代謝産物は、複数のメカニズムを通じてCRCの発症を予防する可能性もある。例えば、ラクトバチルス・カゼイ(ATCC 334株)が産生する鉄色素は、c-Jun N-末端キナーゼ(JNK)を介したアポトーシスによってCRCの進行を抑制することができる [66] 。さらに、酪酸はがん原遺伝子c-Mycを制御することにより、がん原性miR-92aの転写を阻害し、CRC細胞の増殖を抑え、そのアポトーシスを刺激することができる [67] 。したがって、腸内微生物とCRCの発生および進行との関係を深く理解することは、微生物叢に基づく抗CRC療法の開発に重要な助けとなる可能性がある。
3.2. 肺がん
Global Cancer Statistics 2020 [1]によると、肺がん(LC)は世界のがん死亡原因の第1位である。肺癌には小細胞肺癌(SCLC)と非小細胞肺癌(NSCLC)がある。中でもNSCLCはLCの約80~85%を占める [68] 。長い間、健康なヒトの肺は無菌であると考えられてきたが、最近の研究では、健康な肺組織には、プロテオバクテリア(Proteobacteria)、ファーミキューテス(Firmicutes)、フソバクテリア(Fusobacteria)、バクテロイデーテス(Bacteroidetes)を主要門として、シュードモナス(Pseudomonas)、ストレプトコッカス(Streptococcus)、プレボテラ(Prevotella)、ベイロネラ(Veillonella)、ヘモフィルス(Haemophilus)、ナイセリア(Neisseria)などが関与する微生物コロニーが存在することが明らかになっている [69] 。LCの場合、呼吸器腸内細菌叢の組成と多様性が変化し、LCの発症と密接に関連している [70] 。さらに重要なことに、LC患者では腸内細菌叢の組成構造も有意に変化することが一連の研究で提唱されている。例えば、健常対照群と比較すると、全てのLC群では、細菌の多様性とプロバイオティック細菌の相対的な減少が見られる一方、嫌気性細菌の相対的な増加が見られ、低酸素性の腫瘍促進微小環境をさらに悪化させている [71], [72] 。さらに、NSCLC患者の便では、リケネラ科、プレボテラ科、連鎖球菌科、乳酸桿菌科、バクテロイデス・プレベウス科、オシロスピラ科、腸内細菌科の相対量が増加しており [73] 、腸内細菌叢の構造的変化とLCの発症との密接な関連が示唆されている。従って、LCにおける腸内細菌叢の潜在的な機序を探求するための研究が増えつつある。
肺腫瘍微小環境内の主な浸潤免疫細胞はT細胞とB細胞(約3分の2)であるが、TAM、樹状細胞(DC)、ナチュラルキラー細胞(NK)も少数(約3分の1)存在し、これらの浸潤免疫細胞は抗腫瘍免疫プロセスにおいて重要な役割を果たしている [74], [75] 。最近の一連の研究から、腸内細菌叢が「腸-肺軸(GLA)」を通して肺の自然免疫反応と適応免疫反応を制御し、LC細胞の増殖と免疫逃避に間接的に影響を与えることが示されている(図3)。一例として、腸内の微生物の病原体関連分子パターン(PAMP)は、腸上皮細胞膜上のTLRによって認識され、TLR免疫を活性化し、T細胞(Treg細胞やTh17細胞を含む)、B細胞、マクロファージやDC細胞の分化と活性化を引き起こし、これらの細胞は血行性経路やリンパ経路を介して肺に浸潤し、肺免疫応答を活性化する [76], [77], [78], [79] 。注目すべきは、LCの発症は、局所の微生物叢と局所の免疫系との直接的な相互作用だけでなく、全身の免疫応答の制御を通じて、遠位の腸内細菌叢からも間接的に影響を受ける可能性があり、この影響はほとんどGLAを通じて実行されることを考慮する価値がある。GLAは、複雑な双方向リンパ系と血液系を介して確立された呼吸器と消化管の間のリンクである。そしてこのつながりの確立は、呼吸器管と消化管はともに内胚葉に由来し、ある種の類似性を保持しているという事実と関係している [80] 。ひとつは、腸内細菌叢の直接的な影響であり、例えばペプチドグリカンやLPSの存在は、宿主の肺免疫反応を高める可能性がある。例えば、未代謝のSCFAは末梢循環系や骨髄に入り、免疫細胞の発達に影響を与える。さらに、腸管免疫細胞は腸から血液循環を介して肺に移動し、肺免疫応答に影響を与えることもある。遠位腸内細菌叢と局所細菌叢が協力して、腫瘍免疫の促進と抗腫瘍免疫のバランスを調節する正確なメカニズムはまだ不明であるが、LCの過程におけるGLAの重要な役割は無視できず、LCの治療に新たな知見を提供するために、さらに研究が進められるであろう。
図3
ダウンロード 高解像度画像ダウンロード(174KB)
ダウンロード フルサイズ画像のダウンロード
図3. 腸-肺軸内の主なクロストーク。1) 未代謝のSCFAは末梢循環と骨髄に入り、免疫細胞の発達に影響を与える。2) 骨髄由来の細胞が肺の免疫反応を形成する。3) LPSは宿主の免疫反応を増強する。4) Th17、IC2、ILC3などの腸管免疫細胞は、血液循環を通じて腸から肺に移動し、呼吸器免疫に影響を与える可能性がある。
3.3. 乳がん
現在の研究では、腸内生態系の調節異常が乳がん(BC)の発生と進行に重要な役割を果たしていることが示されている[82]。例えば、BC患者ではフェカリス菌量が減少しており、IL-6の分泌やヤヌスキナーゼ2(JAK2)/転写シグナル伝達・活性化因子3(STAT3)のリン酸化を阻害することにより、BCの増殖、浸潤を抑制し、アポトーシスを促進することができる [83] 。さらに、エストロゲンの変化はBCの発生と密接な関係がある [84] 。エストロゲンは、その特異的な核内受容体αに結合し、直接的および/または間接的な作用によって成長因子の産生を増加させ、その結果、乳腺細胞の増殖を刺激してBCを引き起こすことが指摘されている [85] 。興味深いことに、胆汁に結合したエストロゲンは、β-グルクロニダーゼ活性を持つ腸内細菌叢によって脱共役され、乳房などの標的臓器への宿主の血中濃度を上昇させ、それによってその細胞の成長と増殖を刺激し [86]、BCの形成につながる可能性がある(図2B)。さらに、腸内細菌叢は、酸化還元反応によって発がん性を有する可能性のあるいくつかのエストロゲン様代謝産物を合成することができる。そのため、PlottelとBlaserらは、腸内細菌遺伝子の集合体を機能的エストロボロームと呼んでいる[87]。以上のことから、腸内微生物は全身のエストロゲン濃度を調節することにより、BCの発症に関与している可能性がある。
さらに、腸内微生物はBCの発生に影響を与える代謝産物も産生する。例えば、LCAは腫瘍細胞の増殖、浸潤、転移、上皮成長因子の産生を抑制し、間葉-上皮移行(MET)を誘導することにより、抗腫瘍免疫応答、酸化的リン酸化、TCAサイクリングを増加させる [88]。また、LCAで処理した乳がん細胞は、プロアポトーシス蛋白質p53の発現を増加させる一方、抗アポトーシス蛋白質Bcl-2の発現を減少させることが示された[89]。一方、Wang Hらは、TMAOが小胞体ストレスキナーゼPERKを活性化し、腫瘍のパイロプトーシスを誘導することで、トリプルネガティブ乳がんにおけるCD8+T細胞を介した抗腫瘍免疫を増強することを発見した[90]。さらに、酪酸塩はHDAC阻害剤として作用し、サイクリン依存性キナーゼ阻害剤p21の生成を刺激してBC細胞株の増殖を阻害する [91] 。以上の知見から、腸内細菌叢はその代謝産物を通じてBCの発症に間接的に関与している可能性があり、将来的にはBCのアジュバント治療に何らかの役立つことが期待される。
3.4. 肝細胞癌
肝細胞がん(HCC)は、世界の腫瘍関連死の第3位であり、代償性肝硬変患者の主な死因である [92], [93] 。近年、肝細胞癌における腸内細菌叢に関する研究が広く注目されており、研究者らは、肝細胞癌の発症に伴って腸内細菌叢の組成的および機能的に有意な変化が生じることを発見している。研究では、腸内細菌叢の生態学的ディスバイオーシスが腸上皮クラスター細胞の増殖とIL-25の産生を誘導し、それが門脈を通じて肝臓に入ることが明らかにされている(図2C)。腸に由来するIL-25は、ケモカインCXCL10を介したマクロファージの代替活性化、肝細胞癌の細胞新生と遊走を促進する [94] 。同時に、肝硬変を伴うHCC患者では、バクテロイデーテス属、ルミノコッカス属、エンテロバクテリウム属、ストレプトコッカス属が相対的に増加し、ビフィドバクテリウム属が減少している [95] 。さらに、腸内細菌叢の調節異常は、慢性肝疾患や肝細胞癌における疾患プロセスのいくつかの段階でリーキーガットを引き起こし、その結果、循環中のLPSレベルが上昇する [53] 。肝臓は血液供給の2/3を門脈から受けているため、PRRに結合して肝細胞や非実質細胞でNF-κBの活性化を誘発する大量のPAMPや微生物関連分子パターン(MAMP)による主要な侵襲部位となることに留意すべきである。その結果、炎症性ケモカインや細胞表面接着分子が産生され、骨髄由来抑制細胞(MDSC)の肝臓への遊走が促進され、腫瘍免疫逃避の機会が生じ、肝炎の微小環境が形成され、肝細胞癌の発症が促進される [96], [97], [98] 。例えば、MAMPメンバーの一人であるリポテイコ酸(LTA)は、TLR-2を介して老化関連分泌表現型(SASP)とシクロオキシゲナーゼ-2(COX2)をアップレギュレートする。興味深いことに、COX2が介在するプロスタグランジンE2(PGE2)は、PTGER4受容体を介して抗腫瘍免疫を抑制し、それによってHCCの進行を促進する [99] 。それとは別に、肝硬変や非アルコール性脂肪性肝炎を伴うHCCは、通常、持続的なLPS/LTA-TLR-4シグナルの活性化と関連している[100]。
さらに、肝細胞癌の発生と発症は、肝臓と腸内細菌叢によって合成される共代謝産物によって大きく媒介される。例えば、BAは肝臓で産生され、腸内細菌叢で代謝、合成される内因性のシグナル伝達分子である。BAシグナル伝達の主要な核内受容体はファルネソイドX受容体(FXR)である。炎症時にはFXRシグナル伝達が阻害され、肝臓内のBA濃度が上昇し、細胞膜を破壊してPKCの活性化を引き起こし、その結果p38-MAPK/NF- κB経路が活性化され、細胞のアポトーシスと炎症の持続的なサイクルが誘導され、これらすべてが最終的に肝細胞がんの形成につながる [101] 。興味深いことに、最近の研究では、BAにも抗腫瘍作用があることが証明されている。BAが肝類洞細胞やCXCL16依存性ナチュラルキラーT細胞(NKT)の動員を制御し、動員されたNKT細胞が活性化表現型を持ち、HCC細胞の増殖を抑制するという事実に反映されている[102]。さらに、Liu Hらは、UDCAがアポトーシス関連タンパク質Bax、アポトーシスプロテアーゼ活性化因子-1(APAF1)、切断システイン-9、切断システイン-3の発現をアップレギュレートする一方で、抗アポトーシスタンパク質Bcl-2の発現をダウンレギュレートしてアポトーシスを誘導することにより、in vivoでHCC細胞の増殖を抑制できることを発見した[103]。TMAOは、腸内細菌叢によって産生されるコリントリメチルアミンリアーゼによって食事性コリンからトリメチルアミンに変換され、門脈循環を介して肝臓でフラビン含有モノオキシゲナーゼによって触媒される[104]。最近の研究では、血清中のTMAO濃度が高いことが原発性肝がん(PLC)の発症と強く関連していることがわかった[105]。注目すべきは、ヒトにおける血清TMAOとPLCリスクとの関連を報告した最初の研究であり、今後大規模な前向き研究によってさらに確認される必要がある。さらに、TMAOはPOSTN遺伝子をアップレギュレートし、ILK/AKT/mTOR経路を活性化し、HCC細胞の増殖と遊走を誘導する [106] 。要するに、腸内細菌叢は肝細胞癌の疾患プロセスにおいてますます重要な役割を果たしており、腸内細菌叢の調節が肝細胞癌の治療に及ぼす影響については、今後さらなる研究と探求が必要である。
3.5. 胃がん
胃がん(GC)は世界的に5番目に多いがんであり、がんに関連した死因の第5位である。胃癌の発生は、宿主の遺伝、環境因子(喫煙、飲酒、高塩分食、野菜・果物摂取量の低下など)、および無視できない微生物因子と密接に関連している。中でもピロリ菌感染は、GCの最も強い危険因子である [107] 。ピロリ菌はグラム陰性細菌で、胃上皮に選択的に定着する。一旦ピロリ菌が胃環境に定着すると、宿主の生涯を通じて持続する可能性がある [108] 。ピロリ菌のコロニー形成は通常、ほとんどの人に症状を引き起こさないが、長期間の保菌は慢性胃炎を誘発し、腸管形質転換、異形成、そして最終的にはGCへと進行する可能性がある [109] 。
ピロリ菌感染は様々な機序でGCの発症を促進するが、その主な原因は、胃上皮細胞において小胞体ストレス、オートファジー、および酸化ストレスを誘導する、ピロリ菌が放出する病原性因子である。特に、2つの重要な病原因子である細胞毒素関連遺伝子A(CagA)と液胞化細胞毒素A(VacA)は、GCの発症に重要な役割を果たしている[110]。ピロリ菌cag病原性アイランド(cag PAI)にコードされるCagAタンパク質は、IV型分泌系(T4SS)を介して宿主細胞に直接侵入し、E-カドヘリン、グリコーゲン合成酵素キナーゼ3β(GSK3β)、チロシンキナーゼc-met受容体など、いくつかの宿主タンパク質と相互作用する。CagAは、Wnt/β-カテニン経路、PI3K/Akt経路、ERK/MAPK経路、JAK/STAT3経路などの複数の癌関連シグナル伝達経路を活性化し続ける [111], [112], [113]。さらに、CagAは腫瘍抑制経路の不活性化においても重要な役割を果たしている。胃上皮細胞におけるCagAの異所性発現が、癌抑制因子p53のヒトダブルミニッツ2(HDM2)のリン酸化、ユビキチン化、プロテアソーム分解を引き起こすことが研究で示されている[114]。VacAは、ヘリコバクター・ピロリに関連するもう一つの重要な病原性因子であり、ピロリ菌によってV型自己輸送体分泌系を通じて分泌される。一方、宿主細胞に結合し、内在化と細胞空胞化の誘導に寄与する[115]。その上、VacAはミトコンドリアを標的とし、ミトコンドリア膜貫通電位(ΔΨ m)の消失、シトクロムc(Cyt C)の放出、プロアポトーシス因子-Baxの活性化をもたらし、究極のVacA依存性細胞死を引き起こす(図4)[116]。さらに、VacAはG1/S細胞周期停止を介してT細胞の増殖を阻害することにより、強力な免疫抑制効果を示す[117]。
図4
ダウンロード 高解像度画像のダウンロード(215KB)
ダウンロード フルサイズ画像のダウンロード
図4. 胃癌におけるヘリコバクター・ピロリに関連するメカニズム。CagAは様々な発癌シグナル伝達経路を活性化し、癌抑制経路の不活化を誘導する。VacAは細胞表面に結合して細胞内に取り込まれ、細胞空胞化を誘導する。VacAはミトコンドリアも標的とし、ミトコンドリア膜貫通電位(ΔΨ m)の消失、シトクロムcの放出、アポトーシスを引き起こす。(注 CagA:細胞毒素関連遺伝子A;VacA:空胞化細胞毒素A;HDM2:ヒトダブルミニッツ2;ΔΨ m:ミトコンドリア膜貫通電位;Cyt C:シトクロムc)。
さらに、ピロリ菌とは別に、他の胃腸内細菌叢や代謝産物も発癌に寄与していることを示す証拠が増えてきている。乳酸菌(ストレプトコッカス属、ラクトバチルス属、ビフィドバクテリウム属、ラクトコッカス属など)のGCに対する抑制作用は多くの研究で証明されているが、癌の進行中に乳酸菌の存在量が増加することは、逆の役割を果たすことを示しているのかもしれない。すなわち、外因性乳酸、活性酸素種(ROS)、N-ニトロソ化合物(NOC)の産生亢進、上皮間葉転換(EMT)の促進、免疫寛容の確立、他の発がん性病原体によるコロニー形成の促進など、様々な機序によってGCのリスクを上昇させる可能性がある [118] 。さらに、Veillonella、Clostridium、Haemophilus、Staphylococcus、NeisseriaおよびNitrospiraeは、NOC産生を刺激することによってGCの発生を促進する可能性がある [119] 。真菌群集の不均衡もまた、GCの発生に重要な役割を果たしていることは、言及に値する。最近の研究により、カンジダ・アルビカンスは、胃内の真菌の多様性および存在量を減少させることにより、GCの発症を媒介する可能性があることが明らかにされている[120]。
要約すると、前述の研究は、ピロリ菌に代表される消化管細菌叢がGCの発症に重要な役割を果たしていることを示しており、腸内細菌叢を標的としたモジュレーションは、この疾患の新規治療戦略として大きな可能性を秘めている。
3.6. 急性白血病
急性白血病(AL)は、主に急性骨髄性白血病(AML)と急性リンパ芽球性白血病(ALL)を含む極めて不均一な血液悪性腫瘍であり、小児によくみられる [121] 。ALの病因は不明であるが、ほとんどの小児白血病は、前駆B細胞急性リンパ芽球性白血病(pB-ALL)における出生前の遺伝的感受性と出生後の感染の組み合わせによって引き起こされる[122]。ALL患者は、治療前に腸内細菌叢の構造的不均衡を経験していることが研究により証明されている。一例を挙げると、ALL患者の腸内にはバクテロイデス・クララス(Bacteroides clarus)が著しく濃縮されている [123] 。別の研究では、異種移植ALLマウスモデルの細菌組成が健常対照のそれとは著しく異なっており、食餌性フラボノイド形質転換細菌の割合が増加していることが示されている。この細菌はトポイソメラーゼIIを標的として混合スペクトル白血病(MLL)遺伝子の切断を誘導し、AL発症につながる可能性がある。これらの研究は、腸内細菌叢がALの病因および疾患過程に密接に関係している可能性を示唆している。
腸内細菌叢がALの予防と治療にも重要な役割を果たしていることは注目に値する(図5)。電離放射線が白血病の原因の一つであることはよく知られている。研究では、高線量放射線中で生存するマウスはユニークな腸内細菌叢を持ち、中でもLachnospiraceaeとEnterococcaceaeが最も豊富な細菌であること、そしてこれら2つのグループの存在量の増加が、放射線療法後の造血回復と消化管修復に関連することが示されている。同様に、放射線治療を受けた白血病患者においても、これらの細菌の濃縮が認められ、消化管機能障害の軽減が伴っている。さらに、メタボロミクス解析の結果、生存マウスの糞便中では、腸内微生物の誘導体であるプロピオン酸とトリプトファンの代謝物濃度が上昇していることが明らかになった。プロピオン酸は、造血、消化管組織のDNA損傷、活性酸素種の放出を抑制することで、マウスを放射線に抵抗性にする可能性がある。さらに、トリプトファン代謝産物は炎症性サイトカイン応答を抑制し、放射線誘発損傷を軽減する可能性があり、放射線防護剤の理想的な候補である[125]。これらの知見は、微生物叢-代謝産物軸が放射線防護に重要であり、放射線の副作用を治療し、AL発生を予防するための潜在的標的であることを示している。
図5
ダウンロード 高解像度画像ダウンロード(280KB)
ダウンロード フルサイズ画像のダウンロード
図5. 腸内細菌叢と急性白血病の予防、診断、治療。
さらに、腸内細菌叢が、多様性の減少、転座、免疫調節、代謝などのいくつかの重要な機序を通じて、化学療法剤に対する宿主の反応を調節し、主に薬効の促進、抗がん効果の拮抗および相乗、毒性作用の媒介として現れるという証拠が増えつつある [126], [127] 。例えば、化学療法によって引き起こされる主な合併症には、臓器毒性、好中球減少、感染、消化管機能障害などがある。なかでも、化学療法によって誘発される腸の微小生態学的障害による感染症は、血液悪性腫瘍患者の罹病率および死亡率の主な原因であり、その結果、損傷した腸粘膜に日和見病原性細菌が転移して、その後に菌血症が発症することが最近の研究で示されている [128] 。その上、関連する臨床研究では、腸内細菌叢が腫瘍の早期診断や予後の潜在的な指標として使用できることが示されており、プロテオバクテリア(Proteobacteria)、腸球菌科(Enterococcaceae)、連鎖球菌科(Streptococcaceae)などがその例である [129] 。より広い意味では、ALは腸内細菌叢の不均衡を引き起こすが、細菌叢の変化もまたALの疾患経過に影響を及ぼす。したがって、AL の進行における腸内細菌叢の機序をさらに探求することは、臨床治療をより良く行うために特に必要である。
腸内細菌叢と腫瘍治療、転移
腸内細菌叢は、新規の抗腫瘍療法として有望な応用の可能性を秘めている。最近の数多くの研究から、腸内細菌叢は抗腫瘍免疫を制御するだけでなく、がん免疫療法の有効性にも影響を与えることが示されている。例えば、バクテロイデス(B. fragilisおよび/またはB. thetaiotaomicron)は、細胞傷害性Tリンパ球関連蛋白質4(CTLA-4)遮断薬による抗腫瘍効果の増強において極めて重要な役割を果たしている。なぜなら、バクテロイデスはIL-12依存性のTh1免疫応答の調節を通じてCTLA-4遮断効果を促進する可能性があるからである [130] 。研究により、ビフィズス菌はin vivo抗腫瘍免疫のポジティブレギュレーターとして作用し、腫瘍にコロニー形成し、インターフェロン遺伝子(STING)およびインターフェロン依存性経路を刺激することにより、CD47遮断に反応しない宿主の抗腫瘍反応を効果的に回復させることができることも明らかにされている。その結果、腫瘍特異的CD47遮断を介した免疫療法を促進することができる [131]。さらに、ビフィズス菌はDC細胞の活性化を制御し、サイトカイン産生を刺激することで、腫瘍内での抗原特異的CD8+T細胞の蓄積を増加させ、そのエフェクター機能を高め、結果として抗PD-L1治療の有効性を促進することができる[132]。
腫瘍免疫療法の有効性に影響を及ぼすことに加えて、腸内微生物は抗腫瘍薬に対する腫瘍細胞の抵抗性も調節することができる。研究によると、抗生物質によって腸内細菌叢のバランスが崩れると、前立腺がんでは腸管透過性の亢進とともにプロテオバクテリアが増加し、腫瘍内LPSが著しく上昇し、NF-κB-IL6-STAT3シグナル伝達経路が活性化されるため、前立腺がんの第一選択薬であるドセタキセルに対する増殖と薬剤耐性が促進されることが示されている[133]。さらに、Jiang Sらは、免疫療法が奏効しなかったCRC患者では、糞便中のF.nucleatumの存在量と血清中のコハク酸濃度が有意に増加していることを発見した。メカニズム的には、F.nucleatumはコハク酸代謝産物を分泌することでcGAS-INF-β経路を阻害し、Th1ケモカインであるCCL5とCXCL10の分泌を減少させるとともに、CD8+T細胞の走化性と活性機能を制限し、最終的に免疫療法に対するCRC抵抗性を誘導している可能性がある[134]。それとは反対に、腸内微生物の代謝産物であるウロリチンA(UroA)とその構造類似体(UAS03)は、5-フルオロウラシル(5FU)抵抗性の結腸がんにおいてFOXO3-FOXM1軸を制御し、薬物トランスポーターの発現をダウンレギュレートする能力を持つ。その結果、5FUに対する大腸がん細胞の感受性が有意に増強される [135]。抗PD-1療法と組み合わせた糞便微生物叢移植(FMT)が、腸内細菌叢を変化させ、腫瘍微小環境を再プログラムすることで、PD-1療法に対するメラノーマ患者の抵抗性を克服できることは注目に値する[136]。
腫瘍転移は複雑な多段階プロセスであり、がん患者の死亡率の主な原因の一つでもあることに留意すべきである [137] 。研究により、腸内細菌叢もがん転移の制御に重要な役割を果たしていることが明らかになっている。例えば、抗生物質によって誘発される腸内細菌叢の調節異常は、circRNA/miRNAネットワークの調節機能に影響を及ぼすことにより、肺転移に寄与する可能性がある。さらに、F. nucleatumは、ALPK1と呼ばれる新規PRRを活性化することによってNF-κB経路をトリガーし、その結果、細胞間接着分子1(ICAM1)をアップレギュレートし、CRC細胞の内皮細胞への接着および転移を促進する可能性がある[138]。幸いなことに、SPFマウスからのFMTまたはプロバイオティック・ビフィズス菌を無菌マウスに投与すると、肺転移を有意に緩和することができる[139]。特に、プロバイオティクスのクロストリジウム・ブチリカムは、ユビキチンを介したMYCタンパク質の分解を促進し、その安定性を破壊することによって、がん細胞の転移を阻害することができる [140]。まとめると、腸内細菌叢は腫瘍転移に影響を及ぼす上で重要な役割を果たしており、腸内細菌叢と腫瘍転移の根底にある分子メカニズムのさらなる解明は、がんに対する臨床的介入戦略に新たな知見をもたらす可能性がある。
結論として、これらの研究は、腸内細菌叢が抗腫瘍療法の補助に応用できる可能性を示唆している。現在、腸内細菌叢を利用した精密医療(FMT、プレバイオティクス、プロバイオティクス、人工マイクロバイオームなど)は、がんにおける理想的な微生物治療アプローチとして提唱されている。
間欠的絶食(IF)、腫瘍および腸内細菌叢
5.1. IFと腫瘍
カロリー制限(CR)は、健康を改善し寿命を延ばすための最も効果的な食事介入戦略の一つであることが知られており、その主な特徴は、体重の安定を達成するために十分な栄養供給を維持しながら、介入前に必要とされたエネルギー摂取量の減少を持続させることである。例えば、タンパク質摂取量を減らさずにカロリー摂取量を減らせば、ラットの寿命を延ばすことができる [141] 。動物モデルではCRが達成可能であるにもかかわらず、そのコンプライアンスが低いため、ヒトでの長期的な実施は困難である。間歇的絶食(IF)は、CRに代わるより穏やかな形態であり、絶食に関連する分子経路を調節することによって有益な効果をもたらすように設計されており、ヒトにおいてプラスの効果をもたらす可能性が高いと広く考えられている [142] 。以前の研究では、IFが多くの臓器や組織に影響を与えることで、健康を改善する可能性があることが言及されている。例えば、IFは、膵島のオートファジー流束を回復させ、耐糖能を改善するために、インスリン分泌を増加させることにより、高血糖、インスリン抵抗性を予防することができる[143]、 パイエル板におけるリンパ球数を減少させることにより粘膜免疫応答を増強し [144]、酸化ストレスを軽減することによりミトコンドリア機能を高め、抗炎症応答、神経新生を促進し、シナプス可塑性を回復させることにより脳の老化と神経変性を改善する [145]。
さらに興味深いことに、最近の進歩により、IFは、ある種のがんにおいて、腫瘍形成を抑制し、腫瘍の進行を抑制するのに有効であることが実証されている。その主な利点は、腫瘍代謝の抑制、宿主免疫の強化、化学療法に対するがん細胞の感受性増強に反映されている。例えば、時間制限摂食(TRF)は、インスリン感受性を高め、概日リズムを回復させることによって、マウスにおける肥満誘発性乳がんの肺転移を減少させた [146]。さらに、化学療法と絶食模倣食(FMD)の併用は、骨髄共通リンパ前駆細胞(CLP)と細胞傷害性CD8+腫瘍浸潤リンパ球(TIL)のレベルを増加させ、乳癌と黒色腫の進行を大幅に遅らせることにつながる [147] 。さらに、トリプルネガティブ乳がんの場合、FMDはがん細胞の飢餓脱出経路を活性化し、がん幹細胞の表面マーカーを減少させるため、薬物療法に対するがん細胞の感受性が強化される [148]。さらに重要なことに、新たな一連の研究により、腸内細菌叢がIFを介した宿主のエネルギー代謝と密接に関連していることが判明しており、これはおそらく、宿主の食事構造に非常に敏感な微生物群集の構成に起因している。これらの知見に基づき、IFの抗腫瘍効果における腸内細菌叢の潜在的役割とその臨床応用の重要性が強調されるようになってきた。異なるIFレジメンが腸内細菌叢に及ぼす影響を表2に示した。
表2. 間欠的絶食は腸内細菌叢を変化させる。
被験者 介入方法 微生物叢への影響 参考文献
C57BL/6マウス EODF/30日 アップレギュレート: Firmicutes, Lactobacillus, Butyricicoccus, Blautia Downregulate: バクテロイデーテス属、放線菌属、腸内細菌属、ルミノコッカス属 [149]
C57BL/6マウス FMD/2サイクル アップレギュレート: ビフィズス菌科、乳酸桿菌科、うどんこ病菌科 ダウンレギュレート: S24-7ファミリー [150]
C57BL/6マウス IF/15サイクル アップレギュレート: Firmicutes, Ruminococcus, Lactobacillus, Akkermansia Downregulate: バクテロイデーテス属、ヘリコバクター属、プレボテラ属、パラシュッテレラ属 [151]
C57BL/6マウス IF16:8/30日 アップレギュレート: Verrucomicrobia, Clostridia, Akkermansiaceae Downregulate: Rikenellaceae,Ruminococcaceae,Alistipes[152]属
db/dbマウス ADF/7ヵ月間 アップレギュレート: アップレギュレート: Firmicutes, Verrucomicrobia, Lactobacillus, Oscillospira ダウンレギュレート: Akkermansia, Ruminococcaceae, Alistipes: アッカーマンシア、バクテロイデス、ビフィドバクテリウム [153]
C57BL/6 マウス ADF/4週 上昇: バクテロイデス科、乳酸桿菌科、プレボテラ科 [154]
db/dbマウス ADF/28日 アップレギュレート: ラクトバチルス、オドリバクター ダウンレギュレート: 腸球菌、連鎖球菌、未知の腸球菌科 [155]
C57BL/6マウス TRF/36日 アップレギュレート: アップレギュレート:乳酸桿菌、クリステンセネラ属、コプロコッカス属、ルミノコッカス属 ダウンレギュレート:Escherichia_coli、オドリバクター属 Escherichia_coli、赤痢菌[156]。
ヒト IF17:7/29日 アップレギュレート: 酪酸菌、バクテロイデス属、フェカリバクテリウム属、ロゼブリア属、アロバクラム属、ユーバクテリウム属、ダイアリスター属、エリシペロトリチ属 [157]
ヒト ラマダン関連IF/30日 アップレギュレート: ファーミキューテス属、ラクノスピラ科、ルミノコッカス科、 クロストリジウム属 ダウンレギュレート: 低下: バクテロイデーテス目、プレボテラ科 [158]
5.2. IFと腸内細菌叢
初期の研究では、IFが腸内細菌叢を形成して白色脂肪の褐変を促進することにより、肥満の発生率を低下させることが実証されている。C57BL/6マウスに隔日絶食(EODF)レジメンを採用することにより、EODFがC57BL/6マウスの腸内細菌叢の相対的存在量を有意に変化させ、門レベルでファーミキューテス門が濃縮され、バクテロイデス門、アクチノバクテリア門、テネリキューテス門の存在量が有意に低下することが証明された[149]。同様に、Beliらは、db/dbマウスの腸内細菌叢に対する長期IF(7ヶ月まで)の影響を評価し、相関分析により、IF群では、ファーミキューテス門のレベルが増加し、バクテロイデーテス門とVerrucomicrobiaのレベルが減少した。しかし、宿主を毎日絶食させると、Verrucomicrobiaは有意に濃縮された [153]。バーゲンでは、中枢神経系の自己免疫から保護するためのIFを介した腸内細菌叢の研究において、IFは腸内細菌叢を変化させ、乳酸桿菌科、バクテロイデス科、およびPrevotellaceae科における細菌存在量とその濃縮レベルの増加をもたらした[154]。
興味深いことに、一連の研究では、食事が腸内細菌叢を変化させることにより、がんの発生や発症に影響を及ぼすことが報告されている。例えば、高脂肪食(HFD)は、病原性細菌であるAlistipessp.Marseille-P5997とAlistipessp.5CPEGH6を増加させ、プロバイオティクスであるParabacteroides distasonisを減少させ、大腸腫瘍形成を促進する可能性がある [159]。さらに、HFDは腸内のF. nucleatumの存在量を増加させ、腸間膜静脈ドレナージを通じて腸から膵臓に移行し、膵臓がんの発生を促進する可能性がある [160]。さらに、フラボノイドは植物に含まれるポリフェノール化合物の一種で、主に果物、野菜、ナッツ類、豆類などに由来し、腸内細菌叢を再構築してがんに影響を及ぼす可能性がある。その説明として、フラボノイドの一つであるアントシアニジンは、腸内毒素原性B. fragilisまたは発癌物質が誘発する第I/II相酵素発現のシフトを緩和し、結腸腫瘍の増殖を抑制することができる(B. fragilisは、結腸組織における第I相酵素と第II相酵素のバランスの機能不全を引き起こす) [161] 。これらの研究は、IFを含む食事介入戦略が、微生物組成や多様性を含む腸内細菌叢の再形成を通じて、疾患プロセスに影響を及ぼす可能性を示唆している。
げっ歯類の腸内細菌叢の相対的存在量におけるIF誘発性の変化の傾向として、乳酸桿菌種の相対的存在量が増加し続けていることは注目に値する。乳酸桿菌は、抗増殖性、親アポトーシス性、抗酸化性を有する最も一般的な善玉菌の1つであり、複数のメカニズムを通じて腫瘍の発生と進行を防ぐことができることが知られている [162]。例えば、ラクトバチルス・アシドフィルスを経口投与すると、担癌マウスのサイトカイン産生をTh1防御モードへとシフトさせ、抗腫瘍免疫を促進することができる [163]。さらに、ナイシンはCEA、CEAM6、MMP2F、MMP9F遺伝子をダウンレギュレートすることによりCRCを抑制し、CRCの転移を抑制することができる [164]。さらに、大腸がんの動物モデルにおいて、ラクトバチルス・ラムノサスGGまたは/およびラクトバチルス・アシドフィルスとセレコキシブ(非ステロイド性抗炎症薬)を併用した予防的治療は、プロアポトーシスBaxをアップレギュレートし、抗アポトーシスBcl-2タンパク質をダウンレギュレートすることにより、腫瘍負担を軽減することができた[165]。
一方、複数の研究が、IFがAkkermansia muciniphila(A.ムチニフィラ)の存在量を増加させることを示している。A.muciniphilaはグラム陰性の嫌気性細菌で、消化管内の恒常性とバリアー性の維持に役立っている [166]。A.ムチニフィラが腫瘍の発生を制御する上で有益な役割を果たす可能性があることは特筆に値する。例えば、高繊維食がA.ムチニフィラを増加させ、A.ムチニフィラ由来のSTINGアゴニズが腫瘍内単球によるI型インターフェロン(IFN-I)産生を誘導し、マクロファージの分極化とNK-DCクロストークを制御することで、免疫チェックポイント阻害(ICB)の有効性が向上することが、ある研究で示されている[167]。A.muciniphilaは、CD8+T細胞の抗腫瘍能力を制御することにより、炎症を減衰させ、炎症が誘発する結腸の腫瘍形成を鈍らせる可能性がある [168]。さらに、A. muciniphilaは、TLR2/NF-κB/NLRP3経路を通じてM1様マクロファージを誘導し、CRCの進行を抑制することができる[169]。以上の研究から、IFは腸内細菌叢に影響を与え、有益な細菌の相対的な存在量を増加させる可能性があり、その結果、腫瘍の予防と治療に間接的な役割を果たすことが示唆された。したがって、IFがヒトの腸内細菌叢の構成にどのような影響を与えるかについての研究を強化することが急務であり、これは将来、腫瘍介入のための革新的な治療戦略としてのIFの開発に役立つであろう。
5.3. IFと腸内細菌叢の代謝産物
腸内細菌叢の代謝産物量は、環境や食事などの因子に大きく影響される [23]。絶食とヒトのメタボリックシンドロームに関するGuoらの研究では、8週間の5;2 IF(週2日は非連続的な75%エネルギー制限、残りの5日間は自由食)が実施され、SCFAの産生増加に反映されるように、IFが腸内微生物群集に有意な変化を誘導することが観察された[170]。さらに、Washburn RLらは、IFによってヒト血漿中のTMAO濃度が有意に低下することを見出した[171]。さらに、腸内細菌叢を介したIFによる糖尿病誘発性認知障害の緩和に関する研究では、3ヶ月齢のdb/dbマウスにおいて、28日間交互に絶食させた対照群と比較して、血漿中のIPAおよびBA濃度が増加し、LPS濃度が低下し、腸管バリア保全性が改善したことが観察された[155]。さらに、IFによる血漿中BA濃度の増強は、他の研究でも証明されている [172]。関連する研究では、IFが坐骨神経圧迫後の軸索再生を促進し、神経損傷モデルマウスにおいてIPA濃度を上昇させることで温熱感覚反応を改善することが示されている[173]。上記の研究は、IFが腸内微生物の代謝物を変化させることを示唆 している。
重要なことは、先に述べたように、IFによって変化しうる腸内微生物の代謝産物が、腫瘍の発生に関与していることを明らかにする研究結果が増えつつあることである。例えば、Wang R.らは、原発性AML患者において腸管バリアが損傷すると、血液循環中へのLPS放出レベルが上昇し、AML細胞の増殖と進行が促進されることを発見した。逆に、SCFAの一つである酪酸は、AMLマウスにおいて腸管バリアの損傷を修復し、LPSの吸収を抑制することができ、腸内細菌叢を標的とすることがAMLの新たな治療選択肢となる可能性を示唆している [174]。最も興味深いことに、これらの微生物代謝産物は、腫瘍によって異なる作用を示す可能性がある。例えば、BAは、骨髄性造血細胞の分化に関与するセリンプロテアーゼ骨髄タンパク質遺伝子の発現をダウンレギュレートすることができる [175]。DCAは、胃がん細胞の増殖、浸潤、転移を有意に抑制することができる [176]。一方、IPAは乳がんにおいて細胞賦活作用と抗悪性腫瘍作用を有し、上皮間葉転換を阻害し、酸化的ストレスとニトロソ化ストレスを誘導し、抗腫瘍免疫応答を高めることによって、がん幹細胞の割合を減らし、がん細胞の増殖、移動、転移形成を抑制することができる [177]。これらの研究から、腸内微生物の代謝産物もまた、腫瘍に対するIFの効果に重要な役割を果たしている可能性が示唆された。従って、腸内微生物の代謝産物に対するIFの影響についてさらに解析を進めることは、腫瘍治療におけるIFの基本的なメカニズムを解明する上で、非常に有益であろう。
まとめと展望
これまでの研究により、IFは抗腫瘍効果を有し、腫瘍に対する臨床的介入のための有望な新しい戦略として徐々に発展していることが示された。しかし、その特異的な抗腫瘍機序はまだ解明されておらず、IFに代表される食事療法を臨床治療に応用するためには有力な情報である。腸内細菌叢は、腫瘍形成と臨床治療において重要な役割を担っている。最近の一連の研究により、IFが腸内細菌叢の組成や代謝産物に大きな影響を与えることが明らかになり、腸内細菌叢の変化がIFの抗腫瘍効果に密接に関係している可能性が示唆された。これらの知見に基づき、腸内細菌叢の観点からIFの抗腫瘍効果を探索することは、IFの効果メカニズムを系統的に解析するのに役立つだけでなく、最終的にIFの介入を臨床応用するための実質的な助けとなるであろう。とはいえ、IFの腸内細菌叢への作用と腸内細菌叢の腫瘍への作用は複雑であるため、さらに取り組むべき多くの本質的な科学的課題が残っている:
(1)
腸内細菌叢に対するIFの正確な影響。IFが腸内細菌叢に及ぼす影響は、環境因子、食構造や嗜好性、宿主の遺伝などを含めて複雑である。特に、異なるIFレジメンが腸内細菌叢に及ぼす影響の違いという点では。研究により、IFは、乳酸桿菌、ファーミキューテス、バクテロイデーテスなどの腸内の有益な細菌の相対的な存在量の増加を誘導できることが実証されている。特に乳酸桿菌は、宿主の免疫反応を調節し、アポトーシスを促進し、化学療法の毒性を軽減することによって、腫瘍の発生と進行を防ぐことができる [160] 。ファーミキューテス類とバクテロイデーテス類は、哺乳類の腸内細菌の大部分を占め、腸内細菌叢の多様性を支配している [178]。それにもかかわらず、IFがこれらの異なる微生物叢の存在量に影響を及ぼす正確なメカニズムは、まだほとんど発見されておらず、メタゲノミクス、メタボロミクス、マイクロバイオームなどの理論や新たな技術を応用して、より体系的かつ深く探求する必要がある。
(2)
さまざまな腸内細菌叢間の相互関係もまだ解明されていない。特に、腸内細菌叢は複雑であるため、IFの食事療法が異なれば腸内細菌叢も異なり、腫瘍の個体差による腸内細菌叢の変化もかなり異なる(表1)。したがって、腸内細菌叢の関連は、IFの効果的なメカニズムを解明する上で重要である。説明として、腸内細菌叢の代謝産物には抗腫瘍作用があり、SCFA、SBA、LPS、TMAO、インドールおよびその誘導体が関与していることが研究で示されている。いずれにせよ、抗腫瘍効果を発揮する上で、さまざまな微生物叢が互いに、またその代謝産物とどのように協調しているのだろうか?特に最近の研究では、SCFAのような腸内細菌叢の代謝産物が、腫瘍細胞のアポトーシスを直接誘導するだけでなく、様々な免疫細胞の活性化や分化に影響を与え、身体の免疫反応を刺激することが証明されている[179]。したがって、これらの腸内細菌叢や代謝産物の抗腫瘍効果を、空間トランスクリプトームやシングルセルシーケンスなどの最先端技術と組み合わせて系統的に研究することが急務であり、IFの抗腫瘍効果を解明するための新たな手がかりとなることは間違いない。
(3)
応用面について。現在、IFは臨床腫瘍介入の革新的戦略として高い注目を集めている。しかし、IFの臨床応用のための標準化された戦略はまだ確立される必要があり、他の臨床介入と組み合わせた応用のためのプロトコールはまだ改善される必要がある。最近のある研究では、CRは雌マウスの腸内細菌叢に依存してMC38の皮下腫瘍形成を阻止するが、IFは阻止しないことが示されている[180]。従って、腸内細菌叢の多様性に及ぼす異なるIFレジメンのプロトコルの違いについて、十分に調査する必要がある。特に、臨床においては、腫瘍の病期の違いや薬物治療の違いなど、様々な要因が腸内微生物のバランスに影響を与えるため、状況はより複雑になり、その結果、腸内微生物の観点から、IFの抗腫瘍臨床応用をどのように推進するか、体系的に深く検討される必要がある。特に、IFに関する現在のヒト臨床試験のほとんどは、過体重や肥満の被験者の体重減少や代謝機能の回復に焦点を当てている。その結果、IFの抗腫瘍における腸内細菌叢の役割をより明確にし、IFと微生物叢の関係を分析し、IFの臨床的抗腫瘍戦略を促進するために、大規模な臨床多施設共同研究が緊急に必要とされている。
結論として、腸内細菌叢は腫瘍の発生・進展に重要な役割を果たすだけでなく、IFと腫瘍の間に本質的な架け橋を築いている可能性がある。ハイスループットシークエンシング技術、空間トランスクリプトミクス、アンターゲットメタボロミクス、その他の技術の急速な発展により、IF、腸内細菌叢、腫瘍の間の複雑な関係がさらに解明され、最終的には、将来の臨床腫瘍予防のための新規戦略としてのIFと腸内細菌叢の進歩を促進し、臨床腫瘍患者への介入効果を向上させると信じている。
資金提供
本研究は、中国国家自然科学基金(助成金番号:32160178、82272812)、貴州省科学技術局プロジェクト(助成金番号:QKHZC-2020-4Y156)、中国教育部共同イノベーションセンター(2020-39)、遵義科学技術局と遵義医科大学科学技術共同基金プロジェクト(ZSKH-RPT-2020-6、ZSKH-HZ-2021-193)の支援を受けた。
倫理承認および参加同意
該当なし。
CRediT著者貢献声明
Jing Liu、Nan Shao、Hui Qiu、Juanjuan Zhao:情報収集と原稿作成。Jing Liu, Chao Chen, Jiajia Wan: 参考文献の収集と図表の作成。Zhixu He:原稿を修正した。Xu Zhao, Lin Xu:原稿を修正し、原著論文を推敲した。すべての著者が本原稿を読み、同意した。
利益相反宣言
著者らは、金銭的または非金銭的な利害関係はない。
謝辞
Sidong Xiong教授(Soochow University)の貴重な示唆に心から感謝する。
データの入手
本論文に記載された研究に使用されたデータはない。
参考文献
[1]
H. Sung、J. Ferlay、R.L. Siegel、M. Laversanne、I. Soerjomataram、A. Jemal、F. Bray
世界のがん統計2020: GLOBOCANによる185ヵ国36癌の世界罹患率および死亡率の推定値
CA Cancer J. Clin., 71 (3) (2021), pp.209-249, 10.3322/caac.21660.
(PMID: 33538338)
Google Scholar
[2]
R. Mirzaei, A. Afaghi, S. Babakhani, M.R. Sohrabi, S.R. Hosseinii-Fard, K. Babolhavaeji, S. Khani Ali Akbari, R. Yousefimashouf, S. Karampoor
癌の発生と予防における微生物叢由来の短鎖脂肪酸の役割
Biomed. Pharmacother., 139 (2021), Article 111619, 10.1016/j.biopha.2021.111619.
(Epub 2021 Apr 24.)
PDFを見る記事を見るScopusで見るGoogle Scholar
[3]
M. ファサレラ、E.E.ブレイク、J.ペンダース、A.ナウタ、H.スミット、E.G.ゾーテンダール
腸内細菌叢の安定性と回復力:腸の健康を調節するための摂動に対する応答の解明
Gut, 70 (3) (2021), 595-605頁, 10.1136/gutjnl-2020-321747
Mar, Epub 2020 Oct 13. PMID: 33051190
スコープで見るGoogle Scholar
[4]
E.N.デジョン、M.G.スレット、D.M.E.ボウディッシュ
腸内細菌叢と不健康な老化: 原因と結果の切り分け
Cell Host Microbe, 28 (2) (2020), pp.180-189, 10.1016/j.chom.2020.07.013
8月12日、PMID: 32791111
PDFで記事を見るScopusで記事を見るGoogle Scholar
[5]
R.M.アンソン、Z.グオ、R.デ・カボ、T.イユン、M.リオス、A.ハゲパノス、D.K.イングラム、M.A.レーン、M.P.マトソン
間欠的絶食は、グルコース代謝および神経細胞の傷害抵抗性に対する食事制限の有益な効果を、カロリー摂取から解離させる。
Proc. Natl. Acad. Sci. USA, 100 (10) (2003), 6216-6220, 10.1073/pnas.1035720100.
(PMID: 12724520; PMCID: PMC156352)
Google Scholar
[6]
S. 本庶、山本高史、宇野昌宏、西田英俊
RHEB-1を介したシグナル伝達が線虫の間欠的絶食による長寿を媒介する
Nature, 457 (7230) (2009), 726-730頁, 10.1038/nature07583
(PMID: 19079239)
スコープで見るGoogle Scholar
[7]
K.A.ヴァラディ、S.シエンフエゴス、M.エスペレタ、K.ガベル
減量のための間欠的絶食の臨床応用:進歩と今後の方向性
Nat. Rev. Endocrinol., 18 (5) (2022), 309-321頁, 10.1038/s41574-022-00638-x
(Epub 2022 Feb 22. PMID: 35194176)
スコープで見るGoogle Scholar
[8]
X. X.ザオ、J.ヤン、R.黄、M.グオ、Y.周、L.徐
腫瘍における間欠的絶食の役割とそのメカニズム:敵か味方か?
Cancer Biol. Med., 18 (1) (2021), pp.63-73, 10.20892/j.issn.2095-3941.2020.0250
(PMID: 33628585; PMCID: PMC7877171)
スコープで見るGoogle Scholar
[9]
J. パク、ソ Y.G.、ペク Y.J.、ソン H.J.、パク K.H.、ノ H.M.
肥満と心代謝リスクに対する交互日ファスティングの効果:系統的レビューとメタ分析
Metabolism, 111 (2020), Article 154336, 10.1016/j.metabol.2020.154336
(Epub 2020 Aug 7. PMID: 32777443)
PDFを見る記事を見るScopusで見るGoogle Scholar
[10]
A. ミシュラ、H.ミルザエイ、N.グイディ、M.ヴィンチグエラ、A.ムートン、M.リナルディッチ、F.ラッパ、R.バローネ、G.ナバレテ、M.ウェイ、S.ブランドホルスト、S.ディ・ビアゼ、T.E.モーガン、S.ラム・クマール、P.S.コンティ、M.ペッレグリーニ、M.ベルニエ、R.デ・カボ、V.D.ロンゴ
高脂肪食が心代謝リスクと寿命に及ぼす影響を断食模倣食が防ぐ
Nat. Metab., 3 (10) (2021), pp.1342-1356, 10.1038/s42255-021-00469-6
(Epub 2021 Oct 14. PMID: 34650272)
スコープで見るGoogle Scholar
[11]
A. Obermayer, N.J. Tripolt, P.N. Pferschy, H. Kojzar, F. Aziz, A. Müller, M. Schauer, A. Oulhaj, F. Aberer, C. Sourij, H. Habisch, T. Madl, T. Pieber, B. Obermayer-Pietsch, V. Stadlbauer, H. Sourij
インスリン治療を受けている2型糖尿病患者における間欠的絶食の有効性と安全性(INTERFAST-2)-無作為化比較試験
糖尿病ケア, 46 (2) (2023), 463-468頁, 10.2337/dc22-1622
(PMID: 36508320; PMCID: PMC9887629)
スコープで見るGoogle Scholar
[12]
R. センダー、S.フックス、R.ミロ
ヒトとバクテリアの体内細胞数の改訂推定値
PLoS Biol., 14 (8) (2016), Article e1002533, 10.1371/journal.pbio.1002533
(pmid: 27541692; pmcid: pmc4991899)
スコープで見るGoogle Scholar
[13]
J. シュー、J.I.ゴードン
共生生物に敬意を払え
Proc. Natl. Acad. Sci. USA, 100 (18) (2003), pp.10452-10459, 10.1073/pnas.1734063100
(PMID: 12923294; PMCID: PMC193582)
スコープで見るGoogle Scholar
[14]
C.A.ロズポーン、J.I.ストンボー、J.I.ゴードン、J.K.ヤンソン、R.ナイト
ヒト腸内細菌叢の多様性、安定性、回復力
Nature, 489 (7415) (2012), 220-230頁, 10.1038/nature11550
(PMID: 22972295; PMCID: PMC3577372)
スコープで見るGoogle Scholar
[15]
M. ヴェンチュラ、S.オフラハティ、M.J.クレッソン、F.トゥローニ、T.R.クレンハマー、D.ファン・シンデレン、P.W.オトゥール
健康を促進する細菌のゲノムスケール解析:プロバイオゲノミクス
Nat. 微生物学, 7 (1) (2009), 61-71頁, 10.1038/nrmicro2047
(Epub 2008 Nov 24. PMID: 19029955)
スコープで見るGoogle Scholar
[16]
S.M. Jandhyala、R. Talukdar、C. Subramanyam、H. Vuyyuru、M. Sasikala、D. Nageshwar Reddy
正常な腸内細菌叢の役割
World J. Gastroenterol., 21 (29) (2015), pp.8787-8803, 10.3748/wjg.v21.i29.8787
(PMID: 26269668; PMCID: PMC4528021)
Google Scholar
[17]
C. パネビアンコ、A. アンドリウリ、V. パツィエンツァ
ファーマコマイクロバイオミクス:抗がん剤治療における薬剤と微生物叢の相互作用の利用
Microbiome, 6 (1) (2018), Article 92, 10.1186/s40168-018-0483-7
(PMID: 29789015; PMCID: PMC5964925)
スコープで見るGoogle Scholar
[18]
W. Gao, Y. Zhu, Je, H. Chu
アルコール関連肝疾患に寄与する腸内非細菌性微生物叢
Gut Microbes, 13 (1) (2021), Article 1984122, 10.1080/19490976.2021.1984122
2021 Jan-Dec, PMID: 34711112; PMCID: PMC8565833
スコープで見るGoogle Scholar
[19]
D. Mariat, O. Firmesse, F. Levenez, V. Guimarăes, H. Sokol, J. Doré, G. Corthier, J.P. Furet
ヒト微生物叢のファーミキューテス/バクテロイデーテス比は年齢とともに変化する
BMC Microbiol., 9 (9) (2009), p. 123, 10.1186/1471-2180-9-123
(PMID: 19508720; PMCID: PMC2702274)
スコープで見るGoogle Scholar
[20]
K. Hou, Z.X. Wu, X.Y. Chen, J.Q. Wang, D. Zhang, C. Xiao, D. Zhu, J.B. Koya, L. Wei, J. Li, Z.S. Chen
健康と疾患における微生物叢
シグナル Transduct. Target Ther., 7 (1) (2022), Article 135, 10.1038/s41392-022-00974-4
(PMID: 35461318; PMCID: PMC9034083)
スコープで見るGoogle Scholar
[21]
R.F.シュワーベ、C.ジョバン
マイクロバイオームとがん
Nat. Rev. Cancer, 13 (11) (2013), pp.
(PMID: 24132111; PMCID: PMC3986062)
スコープで見るGoogle Scholar
[22]
G.A.ワイス、T.ヘネット
腸内細菌異常症のメカニズムとその結果
Cell. Mol. Life Sci., 74 (16) (2017), pp.2959-2977, 10.1007/s00018-017-2509-x
(Epub 2017 Mar 28. PMID: 28352996)
スコープで見るGoogle Scholar
[23]
W.M.デ・ヴォス、H.ティルグ、M.ヴァン・フル、P.D.カニ
腸内マイクロバイオームと健康:メカニズム的洞察
Gut, 71 (5) (2022), 1020-1032頁, 10.1136/gutjnl-2021-326789
(PMID: 35105664; PMCID: PMC8995832)
Google Scholar
[24]
J. タン、C. マッケンジー、M. ポタミティス、A.N. ソーバーン、C.R. マッケイ、L. マキア
健康と病気における短鎖脂肪酸の役割
Adv. Immunol., 121 (2014), 91-119頁, 10.1016/B978-0-12-800100-4.00003-9
(pmid: 24388214)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[25]
E.E.カンフォラ、J.W.ヨッケン、E.E.ブレイク
体重とインスリン感受性の制御における短鎖脂肪酸
Nat. Rev. Endocrinol., 11 (10) (2015), pp. 577-591, 10.1038/nrendo.2015.128.
(Epub 2015 Aug 11. PMID: 26260141)
ScopusGoogle Scholarで見る
[26]
M. カン、P.エドマンドソン、F.アラウージョ-ペレス、A.N.マッコイ、J.ガランコ、T.O.ケクー
血漿中エンドトキシン、炎症性サイトカインと大腸腺腫リスクとの関連性
BMC Cancer, 13 (2013), Article 91, 10.1186/1471-2407-13-91
(PMID: 23442743; PMCID: PMC3599094)
スコープで見るGoogle Scholar
[27]
J. Cai, L. Sun, F.J. Gonzalez
腸管免疫、炎症、腫瘍形成における腸内細菌叢由来の胆汁酸
Cell Host Microbe, 30 (3) (2022), pp.289-300, 10.1016/j.chom.2022.02.004
(PMID: 35271802; PMCID: PMC8923532)
PDFを見る記事を見るScopusで見るGoogle Scholar
[28]
T. バンサル、R.C.アラニズ、T.K.ウッド、A.ジャヤラマン
細菌のシグナルであるインドールは、上皮細胞のタイトジャンクション抵抗性を高め、炎症の指標を減弱させる。
Proc. Natl. Acad. Sci. USA, 107 (1) (2010), pp.228-233, 10.1073/pnas.0906112107.
(PMID: 19966295; PMCID: PMC2806735)
スコープで見るGoogle Scholar
[29]
A. Agus、J. Planchais、H. Sokol
健康および疾患におけるトリプトファン代謝の腸内細菌叢制御
Cell Host Microbe, 23 (6) (2018), pp.716-724, 10.1016/j.chom.2018.05.003
(pmid: 29902437)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[30]
V. ロスハマー、F.J.キンタナ
アリール炭化水素受容体:健康と病気における免疫応答を統合する環境センサー
Nat. Rev. Immunol., 19 (3) (2019), pp.184-197, 10.1038/s41577-019-0125-8
(pmid: 30718831)
スコープで見るGoogle Scholar
[31]
J. マー、I.M.パゾス、F.ガイ
トリメチルアミンN-オキシド(TMAO)のタンパク質安定化効果に関する微視的洞察
Proc. Natl. Acad. Sci. USA, 111 (23) (2014), pp.8476-8481, 10.1073/pnas.1403224111.
(Epub 2014 May 27. PMID: 24912147; PMCID: PMC4060645)
スコープで見るGoogle Scholar
[32]
Q. マオ、ジャン、イン、ワン、シャ、ドン、マー、ヤン、シュー、フー
肺マイクロバイオームと肺癌の相互作用
Cancer Lett.、415(2018)、40-48頁、10.1016/j.canlet.2017.11.036
(Epub 2017 Dec 2. PMID: 29197615)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[33]
E.N.バルク、J.ワン、J.A.ウォーゴ
腸内細菌叢と抗腫瘍免疫:臨床効果の潜在的メカニズム
Cancer Immunol. Res., 9 (4) (2021), 365-370頁, 10.1158/2326-6066.CIR-20-0877
(pmid: 34003768)
スコープで見るGoogle Scholar
[34]
S.D.キリーン、J.H.ワン、E.J.アンドリュース、H.P.レドモンド
細菌性エンドトキシンは、TLR-4およびNF-κB依存性のウロキナーゼプラスミノーゲン活性化系の活性化を通じて、大腸がん細胞の接着と浸潤を促進する。
Br. J. Cancer, 100 (10) (2009), pp.1589-1602, 10.1038/sj.bjc.6604942
(pmid: 19436306; pmcid: pmc2696751)
スコープで見るGoogle Scholar
[35]
A. Fluckiger、R. Daillère、M. Sassi、B.S. Sixt、P. Liu、F. Loos、C. Richard、C. Rabu、M.T. Alou、A.G. Goubet、F. Lemaitre、G. Ferrere、L. Derosa、C.P.M. Duong、M. Messaoudene、A.Gagné、P.Joubert、L.De Sordi、L.Debarbieux、S.Simon、C.M.Scarlata、M.Ayoub、B.Palermo、F.Facciolo、R.Boidot、R.Wheeler、I.G.Boneca、Z. Sztupinszki、K. Papp、I. Csabai、E. Pasolli、N. Segata、C. Lopez-Otin、Z. Szallasi、F. Andre、V. Iebba、V. Quiniou、D. Klatzmann、J. Boukhalil、S. Khelaifia、D. Raoult, L. Albiges, B. Escudier, A. Eggermont, F. Mami-Chouaib, P. Nistico, F. Ghiringhelli, B. Routy, N. Labarrière, V. Cattoir, G. Kroemer, L. Zitvogel
腫瘍MHCクラスI制限抗原と腸球菌バクテリオファージとの交差反応性
Science, 369 (6506) (2020), pp.936-942, 10.1126/science.aax0701
(pmid: 32820119)
スコープで見るGoogle Scholar
[36]
J. Tintelnot、Y. Xu、T.R. Lesker、M. Schönlein、L. Konczalla、A.D. Giannou、P. Pelczar、D. Kylies、V.G. Puelles、A.A. Bielecka、M. Peschka、F. Cortesi、K. Riecken、M. Jung、L. Amend、T.S. Bröring、M. Trajkovic-Arsic, J.T. Siveke, T. Renné, D. Zhang, S. Boeck, T. Strowig, F.G. Uzunoglu, C. Güngör, A. Stein, J.R. Izbicki, C. Bokemeyer, M. Sinn, A.C. Kimmelman, S. Huber, N. Gagliani
微生物叢由来の3-IAAが膵臓癌の化学療法効果に影響を及ぼす
Nature, 615 (7950) (2023), 168-174頁, 10.1038/s41586-023-05728-y
(PMID: 36813961; PMCID: PMC9977685)
スコープで見るGoogle Scholar
[37]
G. Mirji、A. Worth、S.A. Bhat、M. El Sayed、T. Kannan、A.R. Goldman、H.Y. Tang、Q. Liu、N. Auslander、C.V. Dang、M. Abdel-Mohsen、A. Kossenkov、B.Z. Stanger、R.S. Shinde
微生物由来の代謝産物TMAOが免疫活性化を促進し、膵臓癌における免疫チェックポイント阻害に対する反応を高める。
Sci.Immunol.、7(75)(2022)、記事eabn0704、10.1126/sciimmunol.abn0704
(PMID: 36083892; PMCID: PMC9925043)
スコープで見るGoogle Scholar
[38]
Y. Yang、B.B. Misra、L. Liang、D. Bi、W. Weng、W. Wu、S. Cai、H. Qin、A. Goel、X. Li、Y. Ma
マイクロバイオームとメタボロームの統合解析により、大腸がんにおける常在細菌と代謝産物の新たな相互作用が明らかになった
Theranostics, 9 (14) (2019), pp.4101-4114, 10.7150/thno.35186
(PMID: 31281534; PMCID: PMC6592169)
スコープで見るGoogle Scholar
[39]
J. 劉、董、趙、呉、夏、謝、宋、X.
腸内細菌叢プロファイリングはマウスの大腸がん発生過程で変化する
BMC Genom., 23 (Suppl. 4) (2022), Article 848, 10.1186/s12864-022-09008-3
(pmid: 36550412; pmcid: pmc9773433)
Google Scholar
[40]
J. Behary、N. Amorim、X.T. Jiang、A. Raposo、L. Gong、E. McGovern、R. Ibrahim、F. Chu、C. Stephens、H. Jebeili、V. Fragomeli、Y.C. Koay、M. Jackson、J. O'Sullivan、M. Weltman、G. McCaughan、E. El-Omar、A. Zekry
非アルコール性脂肪性肝疾患関連肝細胞癌における末梢免疫反応への腸内細菌叢の影響
Nat. Commun., 12 (1) (2021), Article 187, 10.1038/s41467-020-20422-7
(PMID: 33420074; PMCID: PMC7794332)
スコープで見るGoogle Scholar
[41]
J. Behary、A.E. Raposo、N.M.L. Amorim、H. Zheng、L. Gong、E. McGovern、J. Chen、K. Liu、J. Beretov、C. Theocharous、M.T. Jackson、J. Seet-Lee、G.W. McCaughan、E.M. El-Omar、A. Zekry
Mdr2-/-マウスモデルにおける肝細胞癌に至る腸内細菌異常症と炎症反応の時間的進展の解明
BMC Microbiol., 21 (1) (2021), Article 113, 10.1186/s12866-021-02171-9
(PMID: 33858327; PMCID: PMC8048083)
スコープで見るGoogle Scholar
[42]
J. Zhu、M. Liao、Z. Yao、W. Liang、Q. Li、J. Liu、H. Yang、Y. Ji、W. Wei、A. Tan、S. Liang、Y. Chen、H. Lin、X. Zhu、S. Huang、J. Tian、R. Tang、Q. Wang、Z. Mo。
閉経後女性の乳癌は腸内メタゲノムの変化と関連している
マイクロバイオーム, 6 (1) (2018), p. 136, 10.1186/s40168-018-0515-3
8月6日、PMID: 30081953; PMCID: PMC6080540
ScopusGoogle Scholarで見る
[43]
F. Zhao、R. An、L. Wang、J. Shan、X. Wang
肺がん患者における特異的腸内細菌叢と血清メタボロームの変化
Front. Cell. Infect. Microbiol., 11 (2021), Article 725284, 10.3389/fcimb.2021.725284
(PMID: 34527604; PMCID: PMC8435782)
スコープで見るGoogle Scholar
[44]
E. デル・カスティーヨ、R.マイヤー、M.チョン、D.C.ケストラー、T.チェン、B.J.パスター、K.P.シャルペンティエ、K.T.ケルシー、J.イザード、D.S.ミショー
膵臓組織と十二指腸組織のマイクロバイオームは重複し、対象者特異性が高いが、膵臓がんと非がんでは異なる
Cancer Epidemiol. Biomark. Prev., 28 (2) (2019), 370-383頁, 10.1158/1055-9965.EPI-18-0542
(Epub 2018 Oct 29. PMID: 30373903; PMCID: PMC6363867)
スコープで見るGoogle Scholar
[45]
X. Yu、W. Jiang、R.O. Kosik、Y. Song、Q. Luo、T. Qiao、J. Tong、S. Liu、C. Deng、S. Qin、Z. Lv、D. Li
腸内細菌叢の変化と甲状腺癌との関係の可能性
J. Adv. Res., 35 (2021), 61-70頁, 10.1016/j.jare.2021.04.001
(PMID: 35003794; PMCID: PMC8721249)
スコープで見るGoogle Scholar
[46]
H. 姜、W. Zeng、X. Zhang、Y. Pei、H. Zhang、Y. Li
良性および悪性脳腫瘍患者における腸内細菌叢の役割:パイロット研究
Bioengineered, 13 (3) (2022), pp.7847-7859, 10.1080/21655979.2022.2049959
(PMID: 35291914; PMCID: PMC9208447)
スコープで見るGoogle Scholar
[47]
Y. Deng、D. Tang、P. Hou、W. Shen、H. Li、T. Wang、R. Liu
食道がん患者における腸内細菌叢のディスバイオシス
Microb. Pathog., 150 (2021), Article 104709, 10.1016/j.micpath.2020.104709.
(Epub 2020 Dec 27.)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[48]
P.Y. Huang、Y.C. Yang、C.I. Wang、P.W. Hsiao、H.I. Chiang、T.W. Chen
前立腺がんマウスの腸内細菌叢におけるアッケシソウ科細菌の増加
Int. J. Mol. Sci., 22 (17) (2021), p. 9626, 10.3390/ijms22179626
(PMID: 34502535; PMCID: PMC8431795)
スコープで見るGoogle Scholar
[49]
E.T.ヒルマン、H.ルー、T.ヤオ、C.H.中津
消化管に沿った微生物生態学
Microbes Environ., 32 (4) (2017), pp.300-313, 10.1264/jsme2.ME17017
(Epub 2017 Nov 10. PMID: 29129876; PMCID: PMC5745014)
ScopusGoogle Scholarで見る
[50]
R.X.フオ、Y.J.ワン、S.B.ホウ、W.ワン、C.Z.チャン、X.H.ワン
大腸癌の再発と関連する腸粘膜微生物叢プロファイル
World J. Gastroenterol., 28 (18) (2022), pp.1946-1964, 10.3748/wjg.v28.i18.1946
(PMID: 35664963; PMCID: PMC9150055)
スコープで見るGoogle Scholar
[51]
N. Avuthu, C. Guda
変化した腸内細菌叢のメタアナリシスにより、大腸がんの微生物および代謝バイオマーカーが明らかになった。
Microbiol. Spectr., 10 (4) (2022), Article e0001322, 10.1128/spectrum.00013-22.
(PMID: 35766483; PMCID: PMC9431300)
スコープで見るGoogle Scholar
[52]
E. サウス、S.イラオラ-グスマン、J.R.ウィリス、A.ブルネ-ベガ、T.ガバルドン
マイクロバイオームと大腸がん:発がんにおける役割と臨床的可能性
Mol. Asp. Med., 69 (2019), 93-106頁, 10.1016/j.mam.2019.05.001.
(Epub 2019 May 24. PMID: 31082399; PMCID: PMC6856719)
PDFを見る記事を見るScopusで見るGoogle Scholar
[53]
L.X.ユー、R.F.シュワーベ
腸内マイクロバイオームと肝臓がん:そのメカニズムと臨床への応用
Nat. Rev. Gastroenterol. Hepatol., 14 (9) (2017), pp.527-539, 10.1038/nrgastro.2017.72
(Epub 2017 Jul 5. PMID: 28676707; PMCID: PMC6467288)
スコープで見るGoogle Scholar
[54]
A.D. Kostic、E. Chun、L. Robertson、J.N. Glickman、C.A. Gallini、M. Michaud、T.E. Clancy、D.C. Chung、P. Lochhead、G.L. Hold、E.M. El-Omar、D. Brenner、C.S. Fuchs、M. Meyerson、W.S. Garrett
フソバクテリウム・ヌクレアタムは腸の腫瘍形成を促進し、腫瘍免疫微小環境を調節する。
Cell Host Microbe, 14 (2) (2013), pp.207-215, 10.1016/j.chom.2013.07.007
(PMID: 23954159; PMCID: PMC3772512)
PDFを見る記事を見るScopusで見るGoogle Scholar
[55]
M.R. Rubinstein、X. Wang、W. Liu、Y. Hao、G. Cai、Y.W. Han
Fusobacterium nucleatumはFadAアドヘシンを介してE-カドヘリン/β-カテニンシグナル伝達を調節することにより大腸発がんを促進する。
細胞宿主微生物, 14 (2) (2013), pp.195-206, 10.1016/j.chom.2013.07.012
(pmid: 23954158; pmcid: pmc3770529)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[56]
C. Gur、Y. Ibrahim、B. Isaacson、R. Yamin、J. Abed、M. Gamliel、J. Enk、Y. Bar-On、N. Stanietsky-Kaynan、S. Coppenhagen-Glazer、N. Shussman、G. Almogy、A. Cuapio, E. Hofer, D. Mevorach, A. Tabib, R. Ortenberg, G. Markel, K. Miklić, S. Jonjic, C.A. Brennan, W.S. Garrett, G. Bachrach, O. Mandelboim
Fusobacterium nucleatumのFap2タンパク質とヒト抑制性受容体TIGITとの結合は、免疫細胞の攻撃から腫瘍を保護する。
Immunity, 42 (2) (2015), 344-355頁, 10.1016/j.immuni.2015.01.010.
(Epub 2015 Feb 10. PMID: 25680274; PMCID: PMC4361732)
PDFを見る記事を見るScopusで見るGoogle Scholar
[57]
Y. Yang、Li、C. Xu、Y. Wang、Z. Wang、M. Chen、Z. Jiang、J. Pan、C. Yang、X. Li、K. Song、J. Yan、W. Xie、X. Wu、Z. Chen、Y. Yuan、S. Zheng、J. Yan、J. Huang、F. Qiu
腸内細菌叢と単球様マクロファージとの間のクロストークは、大腸炎関連腫瘍の発生を促進する炎症反応を媒介する。
Gut, 70 (8) (2020), 1495-1506頁, 10.1136/gutjnl-2020-320777
(PMID: 33122176; PMCID: PMC8292576)
スコープで見るGoogle Scholar
[58]
R. Li、R. Zhou、H. Wang、W. Li、M. Pan、X. Yao、W. Zhan、S. Yang、L. Xu、Y. Ding、L. Zhao
腸内細菌に刺激されたカテプシンKの分泌は、TLR4依存的なM2マクロファージの分極化を媒介し、大腸癌の腫瘍転移を促進する。
Cell Death Differ., 26 (11) (2019), pp.2447-2463, 10.1038/s41418-019-0312-y
(Epub 2019 Mar 8. PMID: 30850734; PMCID: PMC6889446)
スコープで見るGoogle Scholar
[59]
R.Y.シュー、C.H.チャン、J.D.スパイサー、M.C.ルソー、B.ジャンニアス、S.ルソー、L.E.フェリ
ヒト大腸癌細胞におけるLPS誘導TLR4シグナルは、β1インテグリンによる細胞接着と肝転移を増加させる
Cancer Res., 71 (5) (2011), 1989-1998頁, 10.1158/0008-5472.CAN-10-2833
(pmid: 21363926)
スコープで見るGoogle Scholar
[60]
Y. Zhao、C. Wang、A. Goel
大腸がんのエピジェネティック制御における腸内細菌叢の役割
Biochim. Biophys. Acta Rev. Cancer, 1875 (1) (2021), Article 188490, 10.1016/j.bbcan.2020.188490.
(Epub 2020 Dec 13. PMID: 33321173; PMCID: PMC7856101)
PDFを見る記事を見るScopusで見るGoogle Scholar
[61]
M. 鯉、沖田祐介、J.M.ケアザース
大腸がんにおけるFusobacterium nucleatum感染:炎症、DNAミスマッチ修復、遺伝的およびエピジェネティックな変化の関連性
J. Anus Rectum Colon, 2 (2) (2018), 37-46頁, 10.23922/jarc.2017-055
(Epub 2018 Apr 25. PMID: 30116794; PMCID: PMC6090547)
Google Scholar
[62]
M. 川中正彦、渡利淳一、神谷直人、山崎貴之、近藤忠彦、豊島文彦、池原秀樹、富田哲也、大島俊夫、福井裕之、大門毅、K.M.Das、三輪秀樹
内視鏡的治療後のメタクロナス胃癌発生に対するヘリコバクター・ピロリ除菌の効果:ランダム化比較試験による分子変化の解析
Br. J. Cancer, 114 (1) (2016), pp.21-29, 10.1038/bjc.2015.418
(Epub 2015 Dec 15. PMID: 26671747; PMCID: PMC4716539)
スコープで見るGoogle Scholar
[63]
G. レグベ、D. トルーシュ
ヒストンアセチルトランスフェラーゼと脱アセチラーゼの制御
EMBO Rep., 4 (10) (2003), pp.944-947, 10.1038/sj.embor.embor941
(PMID: 14528264; PMCID: PMC1326399)
スコープで見るGoogle Scholar
[64]
A. コー、F.デ・ヴァダー、P.コヴァチェヴァ=ダッチャリー、F.ベッケド
食物繊維から宿主生理へ:細菌の主要代謝産物としての短鎖脂肪酸
Cell, 165 (6) (2016), pp.1332-1345, 10.1016/j.cell.2016.05.041
(pmid: 27259147)
PDFを見る記事を見るScopusで見るGoogle Scholar
[65]
T. ユー, グオ, ユー, サン, マー, ハン, チアン, クリチェク, サン, ナガシェス, チェン, チェン, ホン, ズー, ファン, J.Y.
フソバクテリウム・ヌクレアタムはオートファジーを調節することで大腸がんの化学療法抵抗性を促進する
Cell, 170 (3) (2017), pp.548-563, 10.1016/j.cell.2017.07.008
(.e16. PMID: 28753429; PMCID: PMC5767127)
Google Scholar
[66]
H. 小西秀樹, 藤谷睦美, 田中秀樹, 上野直之, 森市和彦, 笹島淳, 生田和彦, 阿久津秀樹, 田辺秀樹, 興梠康也
プロバイオティクス由来のフェリクロムはJNKを介したアポトーシスを介して結腸癌の進行を抑制する
Nat. Commun., 7 (2016), Article 12365, 10.1038/ncomms12365
(pmid: 27507542; pmcid: pmc4987524)
スコープで見るGoogle Scholar
[67]
S. Hu, L. Liu, E.B. Chang, J.Y. Wang, J.P. Raufman
酪酸は、ヒト結腸がん細胞においてc-Myc誘導miR-17-92aクラスター転写を減少させることにより、増殖促進miR-92aを阻害する。
Mol. Cancer, 14 (2015), Article 180, 10.1186/s12943-015-0450-x
(PMID: 26463716; PMCID: PMC4604099)
PDFを見る記事を見るGoogle Scholar
[68]
V. レッリ、M.トレロトラ、E.ゲッラ、S.アルベルティ
非小細胞肺癌の概念を捨てる
Trends Mol. Med., 25 (7) (2019), pp.585-594, 10.1016/j.molmed.2019.04.012.
(Epub 2019 May 30. PMID: 31155338)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[69]
D. Wang、J. Cheng、J. Zhang、F. Zhou、X. He、Y. Shi、Y. Tao
肺がんにおける呼吸微生物叢の役割
Int. J. Biol. Sci., 17 (13) (2021), pp.3646-3658, 10.7150/ijbs.51376
(pmid: 34512172; pmcid: pmc8416743)
スコープで見るGoogle Scholar
[70]
M. フイン、M.J.クレーン、A.M.ジェイミソン
肺、ニッチ、微生物:がんと免疫における肺マイクロバイオームの探索
Front. Immunol., 13 (2023), Article 1094110, 10.3389/fimmu.2022.1094110
(PMID: 36733391; PMCID: PMC9888758)
スコープで見るGoogle Scholar
[71]
F. リウ、リー、グアン、ルー、チェン、シュー、デン、チェン、ニー、ザオ、リー、サン、カイ、X.
腸内細菌叢のディスバイオーシスは肺癌の腫瘍バイオマーカーと関連する
Int. J. Biol. Sci., 15 (11) (2019), pp.2381-2392, 10.7150/ijbs.35980
(PMID: 31595156; PMCID: PMC677532)
スコープで見るGoogle Scholar
[72]
L.A. Mur、S.A. Huws、S.J. Cameron、P.D. Lewis、K.E. Lewis
肺がん:マイクロバイオーム研究と臨床応用の新たなフロンティア
Ecancermedicalscience, 12 (2018), p. 866, 10.3332/ecancer.2018.866
(pmid: 30263057; pmcid: pmc6145518)
スコープで見るGoogle Scholar
[73]
P. ヴェルノッキ、T.ギリ、F.コンテ、F.デル・キエリコ、G.コンタ、A.ミッケリ、A.ボッティチェッリ、P.パチ、G.カルダレッリ、M.ヌティ、P.マルケッティ、L.プティニャーニ
腸内細菌叢とメタボロームのネットワーク解析による非小細胞肺癌患者における微生物叢関連バイオマーカーの発見
Int. J. Mol. Sci., 21 (22) (2020), p. 8730, 10.3390/ijms21228730
(pmid: 33227982; pmcid: pmc7699235)
Google Scholar
[74]
S.S. Wang, W. Liu, D. Ly, H. Xu, L. Qu, L. Zhang
腫瘍浸潤B細胞:肺がんの抗腫瘍免疫におけるその役割と応用
Cell. Mol. Immunol., 16 (1) (2019), 6-18頁, 10.1038/s41423-018-0027-x
(Epub 2018 Apr 8. PMID: 29628498; PMCID: PMC6318290)
スコープで見るGoogle Scholar
[75]
X. リュー、Y. チェン、S. チャン、L. ドン
腫瘍における腸内細菌叢を介した免疫調節
J. Exp. Clin. Cancer Res., 40 (1) (2021), Article 221, 10.1186/s13046-021-01983-x
(PMID: 34217349; PMCID: PMC8254267)
PDFを見る記事を見るGoogle Scholar
[76]
C. カルボーン、G.ピロ、V.ディ・ノイア、E.ダルジェント、E.ヴィータ、M.G.フェラーラ、S.ピロット、M.ミレッラ、G.カンマロータ、A.ガスバリーニ、G.トルトラ、E.ブリア
肺癌における免疫療法効果の隠れたドライバーとなりうる肺および腸内細菌叢
Mediat. Inflamm., 2019 (2019), Article 7652014, 10.1155/2019/7652014
(pmid: 31827379; pmcid: pmc6885300)
スコープで見るGoogle Scholar
[77]
W. Li、Y. Deng、Q. Chu、P. Zhang
腸内マイクロバイオームとがん免疫療法
Cancer Lett.、447(2019)、41-47頁、10.1016/j.canlet.2019.01.015
(Epub 2019 Jan 23. PMID: 30684593)
PDFを見る記事を見るGoogle Scholar
[78]
Y. サラザール、X.鄭、D.ブルン、H.ライファー、F.ピカール、Y.チャン、H.ウィンター、S.グエンター、A.ヴァイガート、B.ヴァイグマン、L.デュムティエ、J.C.ルナール、A.ワイスマン、A.シュモール、A.タフマン、L.フィンク、B.ブリュネ、T.ボップ、F.グリムミンガー、W.ゼーガー、S.S.プラムセッティ、M.フーバー、R.サヴァイ
微小環境Th9リンパ球とTh17リンパ球が肺癌の転移拡大を誘導する
J. Clin. Invest., 130 (7) (2020), 3560-3575頁, 10.1172/JCI124037
(PMID: 32229721; PMCID: PMC7324180)
スコープで見るGoogle Scholar
[79]
N. Martin-Orozco, P. Muranski, Y. Chung, X.O. Yang, T. Yamazaki, S. Lu, P. Hwu, N.P. Restifo, W.W. Overwijk, C. Dong
腫瘍免疫において細胞傷害性T細胞の活性化を促進するTヘルパー17細胞
Immunity, 31 (5) (2009), pp.787-798, 10.1016/j.immuni.2009.09.014
(PMID: 19879162; PMCID: PMC2787786)
PDFを見る記事を見るScopusで見るGoogle Scholar
[80]
K.F.ブッデン、S.L.ゲラトリー、D.L.ウッド、M.A.クーパー、M.モリソン、P.ヒューゲンホルツ、P.M.ハンスブロ
微生物叢と腸-肺軸の間に見られる新たな病原性の関連性
Nat. Rev. Microbiol., 15 (1) (2017), pp.55-63, 10.1038/nrmicro.2016.142.
(Epub 2016 Oct 3. PMID: 27694885)
スコープで見るGoogle Scholar
[81]
P.J.マー、M.M.ワン、Y.ワン
腸内細菌叢:肺疾患に対する新たな知見
Biomed. Pharmacother., 155 (2022), Article 113810, 10.1016/j.biopha.2022.113810.
(PMID: 36271581)
PDFを見る記事を見るScopusで見るGoogle Scholar
[82]
C. ブクタ・ロザン、R.R.ボスティック、J.C.M.フェレイ、T.Y.フェン、F.N.アザール、K.S.トン、M.G.ドズモロフ、E.スミルノワ、P.D.ボス、M.R.ルトコウスキー
ホルモン受容体陽性乳癌において、既存の常在菌ディスバイオーシスは組織炎症と腫瘍細胞播種の宿主内在性制御因子である。
Cancer Res., 79 (14) (2019), 3662-3675頁, 10.1158/0008-5472.CAN-18-3464
(Epub 2019 May 7. PMID: 31064848; PMCID: PMC6983951)
グーグル スカラー
[83]
J. 馬、L. 孫、Y. 劉、H. 任、Y. 沈、F. Bi、T. 張、X. 王
乳がんにおける腸内細菌と血中代謝産物の変化とFaecalibacterium prausnitziiの抗腫瘍効果
BMC Microbiol., 20 (1) (2020), Article 82, 10.1186/s12866-020-01739-1
(PMID: 32272885; PMCID: PMC7144064)
スコープで見るGoogle Scholar
[84]
J.N. Sampson、R.T. Falk、C. Schairer、S.C. Moore、B.J. Fuhrman、C.M. Dallal、D.C. Bauer、J.F. Dorgan、X.O. Shu、W. Zheng、L.A. Brinton、M.H. Gail、R.G. Ziegler、X. Xu、R.N. Hoover、G.L. Gierach
閉経後女性の異なるコホートにおけるエストロゲン代謝と乳癌リスクとの関連性
Cancer Res.、77(4)(2017)、918-925頁、10.1158/0008-5472.CAN-16-1717
(Epub 2016 Dec 23. PMID: 28011624; PMCID: PMC5313342)
スコープで見るGoogle Scholar
[85]
J. ルッソ、I.H.ルッソ
乳がんの発生におけるエストロゲンの役割
J. Steroid Biochem. Mol. Biol., 102 (1-5) (2006), 89-96頁, 10.1016/j.jsbmb.2006.09.004
(pmid: 17113977; pmcid: pmc1832080)
PDFを見る記事を見るScopusで見るGoogle Scholar
[86]
M. クワ、C.S.プロッテル、M.J.ブレーザー、S.アダムス
腸内マイクロバイオームとエストロゲン受容体陽性女性乳がん
J. Natl. Cancer Inst., 108 (8) (2016), Article djw029, 10.1093/jnci/djw029
(PMID: 27107051; PMCID: PMC5017946)
スコープで見るGoogle Scholar
[87]
C.S.プロッテル、M.J.ブレーザー
マイクロバイオームと悪性腫瘍
Cell Host Microbe, 10 (4) (2011), pp.324-335, 10.1016/j.chom.2011.10.003
(PMID: 22018233; PMCID: PMC3264051)
PDFを見る記事を見るScopusで見るGoogle Scholar
[88]
E. Mikó、A. Vida、T. Kovács、G. Ujlaki、G. Trencsényi、J. Márton、Z. Sári、P. Kovács、A. Boratkó、Z. Hujber、T. Csonka、P. Antal-Szalmás. Antal-Szalmás, M. Watanabe, I. Gombos, B. Csoka, B. Kiss, L. Vígh, J. Szabó, G. Méhes, A. Sebestyén, J.J. Goedert, P. Bai
細菌の代謝産物であるリトコール酸は乳がん細胞の増殖と攻撃性を低下させる
Biochim. Biophys. Acta, 1859 (9) (2018), 958-974頁, 10.1016/j.bbabio.2018.04.002
(Epub 2018 Apr 13. PMID: 29655782)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[89]
T.H. Luu、J.M. Bard、D. Carbonnelle、C. Chaillou、J.M. Huvelin、C. Bobin-Dubigeon、H. Nazih
リトコール胆汁酸は乳癌細胞の脂肪生成を阻害し、アポトーシスを誘導する。
Cell Oncol., 41 (1) (2018), 13-24頁, 10.1007/s13402-017-0353-5
(Epub 2017 Oct 9. PMID: 28993998)
スコープで見るGoogle Scholar
[90]
H. Wang、X. Rong、G. Zhao、Y. Zhou、Y. Xiao、D. Ma、X. Jin、Y. Wu、Y. Yan、H. Yang、Y. Zhou、M. Qian、C. Niu、X. Hu、D.Q. Li、Q. Liu、Y. Wen、Y.Z. Jiang、C. Zhao、Z.M. Shao
微生物代謝産物トリメチルアミンN-オキシドはトリプルネガティブ乳癌の抗腫瘍免疫を促進する
Cell Metab., 34 (4) (2022), pp.581-594, 10.1016/j.cmet.2022.02.010
(Epub 2022 Mar 11. PMID: 35278352)
Google Scholar
[91]
V. ショパン、R.A.トワヨン、N.ジュイ、X.ル・ブリス
P21(WAF1/CIP1)は、MCF-7乳がん細胞のG1停止には必須ではないが、酪酸ナトリウムによるアポトーシス誘導には必須である。
Oncogene, 23 (1) (2004), 21-29頁, 10.1038/sj.onc.1207020
(pmid: 14712207)
スコープで見るGoogle Scholar
[92]
A. Forner, M. Reig, J. Bruix
肝細胞がん
Lancet, 391 (10127) (2018), pp.1301-1314, 10.1016/S0140-6736(18)30010-2
(Epub 2018 Jan 5. PMID: 29307467)
PDFを見る記事を見るScopusで見るGoogle Scholar
[93]
T. ルーデ、N. カプロウィッツ、R.F. シュワーベ
肝疾患における細胞死と細胞死応答:そのメカニズムと臨床的関連性
Gastroenterology, 147 (4) (2014), pp.765-783, 10.1053/j.gastro.2014.07.018
(.e4. Epub 2014 Jul 18. PMID: 25046161; PMCID: PMC4531834)
スコープで見るGoogle Scholar
[94]
Q. Li、L. Ma、S. Shen、Y. Guo、Q. Cao、X. Cai、J. Feng、Y. Yan、T. Hu、S. Luo、L. Zhou、B. Peng、Z. Yang、Y. Hua
腸内細菌異常症が誘発するIL-25は、腫瘍微小環境におけるマクロファージの代替的活性化を介して肝細胞癌の発症を促進する。
J. Exp. Clin. Cancer Res., 38 (1) (2019), Article 303, 10.1186/s13046-019-1271-3
(PMID: 31296243; PMCID: PMC6625119)
スコープで見るGoogle Scholar
[95]
F.R. Ponziani, S. Bhoori, C. Castelli, L. Putignani, L. Rivoltini, F. Del Chierico, M. Sanguinetti, D. Morelli, F. Paroni Sterbini, V. Petito, S. Reddel, R. Calvani, C. Camisaschi, A. Picca, A. Tuccitto, A. Gasbarrini, M. Pompili, V. Mazzaferro
肝細胞癌は、非アルコール性脂肪性肝疾患における腸内細菌叢プロフィールおよび炎症と関連している。
Hepatology, 69 (1) (2019), 107-120頁, 10.1002/hep.30036
(Epub 2018 Jul 10. PMID: 29665135)
スコープで見るGoogle Scholar
[96]
A.J.マクファーソン、M.ハイケンワルダー、S.C.ガナル=ヴォナルバーグ
宿主と微生物の相互作用の結節点における肝臓
Cell Host Microbe, 20 (5) (2016), pp.561-571, 10.1016/j.chom.2016.10.016
(pmid: 27832587)
PDFを見る記事を見るScopusで見るGoogle Scholar
[97]
L.X. Yu, H.X. Yan, Q. Liu, W. Yang, H.P. Wu, W. Dong, L. Tang, Y. Lin, Y.Q. He, S.S. Zou, C. Wang, H.L. Zhang, G.W. Cao, M.C. Wu, H.Y. Wang
エンドトキシンの蓄積はげっ歯類における発癌物質誘発アポトーシスを阻止し、肝腫瘍化を促進する。
肝臓学, 52 (4) (2010), 1322-1333頁
CrossRefView in ScopusGoogle Scholar
[98]
D.H. Dapito, A. Mencin, G.Y. Gwak, J.P. Pradere, M.K. Jang, I. Mederacke, J.M. Caviglia, H. Khiabanian, A. Adeyemi, R. Bataller, J.H. Lefkowitch, M. Bower, R. Friedman, R.B. Sartor, R. Rabadan, R.F. Schwabe
腸内細菌叢とTLR4による肝細胞癌の促進
がん細胞, 21 (4) (2012), 504-516頁, 10.1016/j.ccr.2012.02.007
(PMID: 22516259; PMCID: PMC3332000)
PDFを見る記事を見るScopusで見るGoogle Scholar
[99]
T.M.Loo、鎌池史朗、渡辺義明、吉本茂、神田裕之、新井康晴、中島由紀夫、岩間昭夫、古賀亨、杉本祐樹、T. Ozawa、中村雅人、T. 小澤、中村雅人、熊谷正実、渡部和彦、武藤正明、青木孝夫、成宮慎一郎、大島正明、有田正人、原英史、大谷直樹
腸内細菌叢はPGE2を介した抗腫瘍免疫の抑制を介して肥満関連肝がんを促進する
Cancer Discov.,7(5)(2017),522-538頁,10.1158/2159-8290.CD-16-0932
(Epub 2017 Feb 15. PMID: 28202625)
スコープで見るGoogle Scholar
[100]
W. 賈(ジャ)、C.ラジャニ、徐(シュー)、X.鄭(チェン
腸内細菌叢の変化は原発性大腸がんと肝細胞がんで異なる
Protein Cell, 12 (5) (2021), 374-393頁, 10.1007/s13238-020-00748-0
(PMID: 32797354; PMCID: PMC8106555)
スコープで見るGoogle Scholar
[101]
W. 賈 賈、謝 賈、賈 賈
消化管の炎症と発がんにおける胆汁酸と微生物叢のクロストーク
Nat. Rev. Gastroenterol. Hepatol., 15 (2) (2018), 111-128頁, 10.1038/nrgastro.2017.119
(Epub 2017 Oct 11. PMID: 29018272; PMCID: PMC5899973)
スコープで見るGoogle Scholar
[102]
C. Ma、M. Han、B. Heinrich、Q. Fu、Q. Zhang、M. Sandhu、D. Agdashian、M. Terabe、J.A. Berzofsky、V. Fako、T. Ritz、T. Longerich、C.M. Theriot, J.A. McCulloch, S. Roy, W. Yuan, V. Thovarai, S.K. Sen, M. Ruchirawat, F. Korangy, X.W. Wang, G. Trinchieri, T.F. Greten
腸内細菌が介在する胆汁酸代謝はNKT細胞を介して肝臓がんを制御する
Science, 360 (6391) (2018), Article eaan5931, 10.1126/science.aan5931
(PMID: 29798856; PMCID: PMC6407885)
スコープで見るGoogle Scholar
[103]
H. リュー、シュー、チャン、ホアン、ハン、T.J.リャン、L.L.ウェイ、C.Y.チン、C.K.チン
ウルソデオキシコール酸はマウス肝細胞癌異種移植片にアポトーシスを誘導する
World J. Gastroenterol., 21 (2015), pp.10367-10374, 10.3748/wjg.v21.i36.10367
スコープで見るGoogle Scholar
[104]
Z. Wang, Y. Zhao
心血管系の健康と疾患における腸内細菌叢由来の代謝産物
Protein Cell., 9 (5) (2018), 416-431頁, 10.1007/s13238-018-0549-0
Epub 2018年5月3日。PMID: 29725935; PMCID: PMC5960473
スコープで見るGoogle Scholar
[105]
Z.Y. Liu, X.Y. Tan, Q.J. Li, G.C. Liao, A.P. Fang, D.M. Zhang, P.Y. Chen, X.Y. Wang, Y. Luo, J.A. Long, R.H. Zhong, H.L. Zhu
コリンの腸内細菌叢依存性代謝産物であるトリメチルアミンN-オキシドは、原発性肝癌のリスクと正の相関がある:症例対照研究
Nutr. Metab., 15 (2018), Article 81, 10.1186/s12986-018-0319-2
(PMID: 30479648; PMCID: PMC6245753)
PDFを見る記事を見るGoogle Scholar
[106]
Y. Wu、X. Rong、M. Pan、T. Wang、H. Yang、X. Chen、Z. Xiao、C. Zhao
統合解析により、腸内微生物の代謝産物TMAOがPOSTNをアップレギュレートすることで炎症性肝細胞がんを促進することが明らかになった。
Front. Cell Dev. Biol., 10 (2022), Article 840171, 10.3389/fcell.2022.840171
(PMID: 35676936; PMCID: PMC9167932)
スコープで見るGoogle Scholar
[107]
E.C.スマイス、M.ニルソン、H.I.グラブシュ、N.C.ファン・グリーケン、F.ローディック
胃がん
Lancet, 396 (10251) (2020), pp.635-648, 10.1016/S0140-6736(20)31288-5
(pmid: 32861308)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[108]
B.E.ダン、H.コーエン、M.J.ブレイザー
ヘリコバクター・ピロリ
Clin. Microbiol. Rev., 10 (4) (1997), pp.720-741, 10.1128/CMR.10.4.720
(pmid: 9336670; pmcid: pmc172942)
スコープで見るGoogle Scholar
[109]
P.B.エルンスト、B.D.ゴールド
ヘリコバクター・ピロリの疾患スペクトラム:胃十二指腸潰瘍および胃がんの免疫病態学的研究
Annu. Rev. Microbiol., 54 (2000), pp. 615-640, 10.1146/annurev.micro.54.1.615
(pmid: 11018139)
スコープで見るGoogle Scholar
[110]
V. マトソン、C.S.チャーヴィン、T.F.ガジェフスキー
がんとマイクロバイオーム-がん、免疫応答、免疫療法における常在細菌叢の影響
Gastroenterology, 160 (2) (2021), pp.600-613, 10.1053/j.gastro.2020.11.041
(PMID: 33253684; PMCID: PMC8409239)
PDFを見る記事を見るScopusで見るGoogle Scholar
[111]
F. Wang、W. Meng、B. Wang、L. Qiao
ヘリコバクター・ピロリによる胃の炎症と胃がん
Cancer Lett., 345 (2) (2014), pp.196-202, 10.1016/j.canlet.2013.08.016
(Epub 2013 Aug 24. PMID: 23981572)
PDFを見る記事を見るScopusで見るGoogle Scholar
[112]
X. ヨン、タン、リー、シエ、フー、ルオ、チン、ドン、ヤン、S.M.
ヘリコバクター・ピロリの病原因子CagAは、複数のシグナル伝達経路を介して胃癌の腫瘍化を促進する
Cell Commun. Signal., 13 (2015), Article 30, 10.1186/s12964-015-0111-0
(PMID: 26160167; PMCID: PMC4702319)
スコープで見るGoogle Scholar
[113]
M. 畠山
ヘリコバクター・ピロリ菌CagAと胃がん:ヒット・アンド・ラン発がんのパラダイム
細胞宿主微生物, 15 (3) (2014), 306-316頁, 10.1016/j.chom.2014.02.008
(pmid: 24629337)
PDFを見る記事を見るScopusで見るGoogle Scholar
[114]
J. Wei、T.A. Nagy、A. Vilgelm、E. Zaika、S.R. Ogden、J. Romero-Gallo、M.B. Piazuelo、P. Correa、M.K. Washington、W. El-Rifai、R.M. Peek、A. Zaika
胃上皮細胞におけるヘリコバクター・ピロリによるp53癌抑制因子の制御
胃腸病学, 139 (4) (2010), pp.1333-1343, 10.1053/j.gastro.2010.06.018
(PMID: 20547161; PMCID: PMC2949494)
スコープで見るGoogle Scholar
[115]
T.L.カバー、S.R.ブランケ
ヘリコバクター・ピロリのVacA、毒素多機能性のパラダイム
Nat. 微生物学, 3 (4) (2005), pp.320-332, 10.1038/nrmicro1095
(pmid: 15759043)
スコープで見るGoogle Scholar
[116]
A. ガルミッシュ、J. ラッソー
ヘリコバクター・ピロリ菌VacAのミトコンドリアへの標的化
Gut Microbes, 1 (6) (2010), pp.392-395, 10.4161/gmic.1.6.13894
(pmid: 21468222; pmcid: pmc3056105)
Google Scholar
[117]
B. ゲベール、W. フィッシャー、E. ワイス、R. ホフマン、R. ハース
ヘリコバクター・ピロリ空胞化細胞毒素はTリンパ球の活性化を阻害する。
Science, 301 (5636) (2003), 1099-1102頁, 10.1126/science.1086871
(pmid: 12934009)
スコープで見るGoogle Scholar
[118]
K. Vinasco, H.M. Mitchell, N.O. Kaakoush, N. Castaño-Rodríguez
微生物発がん:胃がんにおける乳酸菌
Biochim. Biophys. Acta Rev. Cancer, 1872 (2) (2019), Article 188309, 10.1016/j.bbcan.2019.07.004.
(Epub 2019 Aug 5. PMID: 31394110)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[119]
A. ナバビ=ラド、A.サデギ、H.アサザデ・アグダイ、A.ヤデガー、S.M.スミス、M.R.ザリ
ヘリコバクター・ピロリ管理における腸内細菌叢構造に対するプロバイオティクス補給の諸刃の剣
Gut Microbes, 14 (1) (2022), Article 2108655, 10.1080/19490976.2022.2108655
(PMID: 35951774; PMCID: PMC9373750)
スコープで見るGoogle Scholar
[120]
M. Zhong、Y. Xiong、J. Zhao、Z. Gao、J. Ma、Z. Wu、Y. Song、X. Hong
カンジダ・アルビカンスの障害は胃がん発生と関連する
Theranostics, 11 (10) (2021), pp.4945-4956, 10.7150/thno.55209
(PMID: 33754037; PMCID: PMC7978306)
スコープで見るGoogle Scholar
[121]
E. Steliarova-Foucher, M. Colombet, L.A.G. Ries, F. Moreno, A. Dolya, F. Bray, P. Hesseling, H.Y. Shin, C.A. Stiller
IICC-3の貢献者 小児がんの国際罹患率、2001-10年:人口ベースの登録研究
Lancet Oncol., 18 (6) (2017), 719-731頁, 10.1016/S1470-2045(17)30186-9
(Epub 2017 Apr 11. Erratum in: Lancet Oncol. 2017 Jun;18(6):e301. PMID: 28410997; PMCID: PMC5461370)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[122]
M. グリーブス
小児急性リンパ芽球性白血病の原因メカニズム
Nat. Rev. Cancer, 18 (8) (2018), 471-484頁, 10.1038/s41568-018-0015-6
(正誤表:Nat Rev Cancer. 2018 May 30;: PMID: 29784935; PMCID: PMC6986894)
ScopusGoogle Scholarで見る
[123]
X. 劉、Y. Zou、M. Ruan、L. Chang、X. Chen、S. Wang、W. Yang、L. Zhang、Y. Guo、Y. Chen、Y. Zhang、H. He、Y. Gan、K. Wang、X. Zhu
小児急性リンパ芽球性白血病患者は腸内細菌叢に特徴的な変化を示す
Front. Cell. Infect. Microbiol., 10 (2020), Article 558799, 10.3389/fcimb.2020.558799
(PMID: 33178621; PMCID: PMC7596659)
スコープで見るGoogle Scholar
[124]
R. ストリック、P.L.ストリッセル、S.ボルジャーズ、S.L.スミス、J.D.ローリー
食餌性バイオフラボノイドはMLL遺伝子の切断を誘導し、乳児白血病に寄与する可能性がある。
Proc. Natl. Acad. Sci. USA, 97 (9) (2000), pp.4790-4795, 10.1073/pnas.070061297
(pmid: 10758153; pmcid: pmc18311)
スコープで見るGoogle Scholar
[125]
H. Guo、W.C. Chou、Y. Lai、K. Liang、J.W. Tam、W.J. Brickey、L. Chen、N.D. Montgomery、X. Li、L.M. Bohannon、A.D. Sung、N.J. Chao、J. U. Peled、A.L.C. Gomes、M.R.M. van den Brink、M.J. French、A.N. Macintyre、G.D. Sempowski、X. Tan、R.B. Sartor、K. Lu、J.P.Y. Ting
放射線被曝者のマルチオミクス解析から放射線防護微生物と代謝産物が同定される
Science, 370 (6516) (2020), Article eaay9097, 10.1126/science.aay9097
(PMID: 33122357; PMCID: PMC7898465)
Google Scholar
[126]
J.L.アレクサンダー、I.D.ウィルソン、J.ティア、J.R.マルケージ、J.K.ニコルソン、J.M.キンロス
腸内細菌叢による化学療法の有効性と毒性の調節
Nat. Rev. Gastroenterol. Hepatol., 14 (6) (2017), 356-365頁, 10.1038/nrgastro.2017.20
(Epub 2017 Mar 8. PMID: 28270698)
スコープで見るGoogle Scholar
[127]
S. Viaud、F. Saccheri、G. Mignot、T. Yamazaki、R. Daillère、D. Hannani、D.P. Enot、C. Pfirschke、C. Engblom、M.J. Pittet、A. Schlitzer、F. Ginhoux、L. Apetoh、E. Chachaty、P.L. Woerther、G. Eberl、M. Bérard、C. Ecobichon、D. Clermont、C. Bizet、V. Gaboriau-Routhiau、N. Cerf-Bensussan、P. Opolon、N. Yessaad、E. Vivier、B. Ryffel、C.O. Elson、J. Doré、G. Kroemer、P. Lepage、I.G. Boneca、F. Ghiringhelli、L. Zitvogel
腸内細菌叢はシクロホスファミドの抗癌免疫効果を調節する
Science, 342 (6161) (2013), pp.971-976, 10.1126/science.1240537
(pmid: 24264990; pmcid: pmc4048947)
スコープで見るGoogle Scholar
[128]
J.R. Galloway-Peña、Y. Shi、C.B. Peterson、P. Sahasrabhojane、V. Gopalakrishnan、C.E. Brumlow、N.G. Daver、M. Alfayez、P.C. Boddu、M.A.W. Khan、J.A. Wargo、K.A. Do、R.R. Jenq、D.P. Kontoyiannis、S.A. Shelburne
腸内細菌叢シグネチャーは急性骨髄性白血病の導入療法後の感染リスクを予測する
Clin. Infect. Dis., 71 (1) (2020), 63-71頁, 10.1093/cid/ciz777
(pmid: 31436833; pmcid: pmc7312220)
スコープで見るGoogle Scholar
[129]
H. Hakim、R. Dallas、J. Wolf、L. Tang、S. Schultz-Cherry、V. Darling、C. Johnson、E.A. Karlsson、T.C. Chang、S. Jeha、C.H. Pui、Y. Sun、S. Pounds、R.T. Hayden、E. Tuomanen、J.W. Rosch
小児急性リンパ芽球性白血病患者における化学療法中の感染リスクを予測する腸内細菌叢の組成
Clin. Infect. Dis., 67 (4) (2018), 541-548頁, 10.1093/cid/ciy153
(PMID: 29518185; PMCID: PMC6070042)
スコープで見るGoogle Scholar
[130]
M. Vétizou、J.M. Pitt、R. Daillère、P. Lepage、N. Waldschmitt、C. Flament、S. Rusakiewicz、B. Routy、M.P. Roberti、C.P. Duong、V. Poirier-Colame、A. Roux、S. Becharef、S. Formenti、E. Golden、S. Cording、G. Eberl、A. Schlitzer、F. Ginhoux、S. Mani. Ginhoux、S. Mani、T. Yamazaki、N. Jacquelot、D.P. Enot、M. Bérard、J. Nigou、P. Opolon、A. Eggermont、P.L. Woerther、E. Chachaty、N. Chaput、C. Robert、C. Mateus、G. Kroemer、D. Raoult、I.G. Boneca、F. Carbonnel、M. Chamaillard、L. Zitvogel
CTLA-4遮断による抗癌免疫療法は腸内細菌叢に依存する
Science, 350 (6264) (2015), pp.1079-1084, 10.1126/science.aad1329
(Epub 2015 Nov 5. PMID: 26541610; PMCID: PMC4721659)
ScopusGoogle Scholarで見る
[131]
Y. Shi、W. Zheng、K. Yang、K.G. Harris、K. Ni、L. Xue、W. Lin、E.B. Chang、R.R. Weichselbaum、Y.X. Fu
腸内細菌叢の腫瘍内蓄積は、STINGシグナルを介してCD47に基づく免疫療法を促進する。
J. Exp. Med., 217 (5) (2020), Article e20192282, 10.1084/jem.20192282
(pmid: 32142585; pmcid: pmc7201921)
スコープで見るGoogle Scholar
[132]
A. シヴァン、L.コラレス、N.ヒューバート、J.B.ウィリアムズ、K.アキノ-ミカエル、Z.M.アーリー、F.W.ベニヤミン、Y.M.レイ、B.ジャブリ、M.L.アレグレ、E.B.チャン、T.F.ガジェフスキー
常在性ビフィズス菌は抗腫瘍免疫を促進し、抗PD-L1効果を促進する
Science, 350 (6264) (2015), pp.1084-1089, 10.1126/science.aac4255
(Epub 2015 Nov 5. PMID: 26541606; PMCID: PMC4873287)
ScopusGoogle Scholarで見る
[133]
W. Zhong、K. Wu、Z. Long、X. Zhou、C. Zhong、S. Wang、H. Lai、Y. Guo、D. Lv、J. Lu、X. Mao
腸内細菌異常症はNF-κB-IL6-STAT3軸の活性化を介して前立腺癌の進行とドセタキセル耐性を促進する
Microbiome, 10 (1) (2022), Article 94, 10.1186/s40168-022-01289-w
(pmid: 35710492; pmcid: pmc9202177)
スコープで見るGoogle Scholar
[134]
姜聡, 謝耀瑩, 肖暁, 姜瑞, 林玲, 張玲, 李慈洙, 倩淇, 徐鵬, 凌旭, 王玲, 王玲旺, 杜玲旺, 忠晶, 趙暁, 陳瑞, 王瑞, 劉喬, 洪晶, 陳赫瑩, 陳耀瑩, 方嘉祥
Fusobacterium nucleatum由来のコハク酸は大腸癌の免疫療法に対する腫瘍抵抗性を誘導する。
Cell Host Microbe, 31 (5) (2023), pp.781-797, 10.1016/j.chom.2023.04.010
(Epub 2023年5月1日 PMID: 37130518)
スコープで見るGoogle Scholar
[135]
S. Ghosh, R. Singh, Z.M. Vanwinkle, H. Guo, P.K. Vemula, A. Goel, B. Haribabu, V.R. Jala
微生物代謝物は、FOXO3-FOXM1軸の制御を介して薬物トランスポーターを感作することにより、5-フルオロウラシル耐性大腸腫瘍の進行を抑制する。
Theranostics, 12 (12) (2022), pp.5574-5595, 10.7150/thno.70754
(PMID: 35910798; PMCID: PMC9330515)
スコープで見るGoogle Scholar
[136]
D. Davar、A.K. Dzutsev、J.A. McCulloch、R.R. Rodrigues、J.M. Chauvin、R.M. Morrison、R.N. Deblasio、C. Menna、Q. Ding、O. Pagliano、B. Zidi、S. Zhang、J.H. Badger、M. Vetizou、A.M. Cole、M.R. Fernandes、S. Prescott、R.G. Prescott、R.G.F.Costa、A.K.Balaji、A.Morgun、I.Vujkovic-Cvijin、H.Wang、A.A.Borhani、M.B.Schwartz、H.M.Dubner、S.J.Ernst、A.Rose、Y.G.Najjar、Y.Belkaid、J.M.Kirkwood、G.Trinchieri、H.M.Zarour
糞便微生物叢移植がメラノーマ患者における抗PD-1療法への抵抗性を克服する
Science, 371 (6529) (2021), pp.595-602, 10.1126/science.abf3363
(PMID: 33542131; PMCID: PMC8097968)
スコープで見るGoogle Scholar
[137]
Y. Lin, J. Xu, H. Lan
腫瘍転移における腫瘍関連マクロファージ:生物学的役割と臨床治療への応用
J Hematol Oncol., 12 (1) (2019), p. 76, 10.1186/s13045-019-0760-3
7月12日、PMID: 31300030; PMCID: PMC6626377
PDFを見る記事を見るGoogle Scholar
[138]
Y. 張、張玲、鄭世纪、李正鎬、徐慈、賈大智、斉毓婷、侯婷、王玲、王薇、李艾玲、陳錫、斯贺、趙沃婷
Fusobacterium nucleatumは、ALPK1/NF-κB/ICAM1軸を誘導することにより、大腸がん細胞の内皮細胞への接着を促進し、血管外遊出と転移を促進する。
Gut Microbes, 14 (1) (2022), Article 2038852, 10.1080/19490976.2022.2038852
(PMID: 35220887; PMCID: PMC8890384)
スコープで見るGoogle Scholar
[139]
Z. Zhu、J. Huang、X. Li、J. Xing、Q. Chen、R. Liu、F. Hua、Z. Qiu、Y. Song、C. Bai、Y.Y. Mo、Z. Zhang
腸内細菌叢はcircRNA/miRNAネットワークを介して腫瘍転移を制御する
Gut Microbes, 12 (1) (2020), Article 1788891, 10.1080/19490976.2020.1788891
(Epub 2020 Jul 18. PMID: 32686598; PMCID: PMC7524358)
Google Scholar
[140]
H. Xu、H. Luo、J. Zhang、K. Li、M.H. Lee
大腸がんにおけるクロストリジウム・ブチリカムの抗がん作用の治療可能性
Gut Microbes, 15 (1) (2023), Article 2186114, 10.1080/19490976.2023.2186114
(PMID: 36941257; PMCID: PMC10038047)
スコープで見るGoogle Scholar
[141]
E.J.Masoro、K.Iwasaki、C.A.Gleiser、C.A.McMahan、E.J.Seo、B.P.Yu
加齢ラットにおける腎症進行の食事調節:タンパク質の重要性の評価
Am. J. Clin. Nutr., 49 (6) (1989), pp.1217-1227, 10.1093/ajcn/49.6.1217
(pmid: 2729159)
PDFを見る記事を見るScopusで見るGoogle Scholar
[142]
D.S.ファンボ、H.Y.リー、L.S.アボザイド、K.J.ミン
モデル生物におけるカロリー制限と断続的絶食による寿命調節のメカニズム
Nutrients, 12 (4) (2020), p. 1194, 10.3390/nu12041194
(pmid: 32344591; pmcid: pmc7230387)
スコープで見るGoogle Scholar
[143]
H. リュー、ジャヴァヘリ、R.J.ゴダー、J.マーフィー、X.マー、N.ロハトギ、J.マハデヴァン、K.ハイック、P.サフティグ、C.マーシャル、M.L.マクダニエル、M.S.レメディ、B.ラザニ、F.ウラノ、A.ディワン
間欠的絶食はオートファジー-リソソーム経路を介して肥満誘発糖尿病におけるβ細胞量を維持する
オートファジー, 13 (11) (2017), pp.1952-1968, 10.1080/15548627.2017.1368596
(Epub 2017 Nov 25. PMID: 28853981; PMCID: PMC5788488)
ScopusGoogle Scholarで見る
[144]
M. 永井, 野口亮介, 高橋大輔, 森川卓也, 越田紘一, 小宮山真也, 石原直樹, 山田哲也, 川村陽一, 室井健一, 服部和彦, N. 小林、藤村恭子、廣田昌宏、松本梨香、青木理恵、田村・中野、杉山正樹、片貝孝典、佐藤聡、田久保和也、土肥孝明、長谷和彦
絶食は免疫細胞の動態と粘膜免疫応答に影響を与える
Cell, 178 (5) (2019), pp.1072-1087, 10.1016/j.cell.2019.07.047
(.e14. PMID: 31442401)
ScopusGoogle Scholarで見る
[145]
Y. Zhao、M. Jia、W. Chen、Z. Liu
ミトコンドリア機能の調節を介した脳の老化および神経変性疾患に対する間欠的絶食の神経保護効果
Free Radic. Biol. Med., 182 (2022), pp.206-218, 10.1016/j.freeradbiomed.2022.02.021.
(Epub 2022 Feb 24.)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[146]
M. ダス、L.G.エリーズ、D.クマール、C.サウセダ、A.オバーグ、E.グロス、T.マント、I.G.ニュートン、M.カー、D.D.シアーズ、N.J.G.ウェブスター
時間制限摂食は高インスリン血症を正常化し、肥満閉経後モデルマウスにおける乳癌を抑制する。
Nat. Commun., 12 (1) (2021), Article 565, 10.1038/s41467-020-20743-7
(PMID: 33495474; PMCID: PMC7835248)
スコープで見るGoogle Scholar
[147]
S. ディ・ビアゼ、C.リー、S.ブランドホースト、B.マネス、R.ブオノ、C.W.チェン、M.カチョットロ、A.マーティン-モンタルボ、R.デ・カボ、M.ウェイ、T.E.モーガン、V.D.ロンゴ
絶食模倣食はHO-1を減少させ、T細胞を介する腫瘍細胞傷害性を促進する。
がん細胞, 30 (1) (2016), pp.136-146, 10.1016/j.ccell.2016.06.005
(PMID: 27411588; PMCID: PMC5388544)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[148]
G. Salvadori, F. Zanardi, F. Iannelli, R. Lobefaro, C. Vernieri, V.D. Longo
断食模倣食はトリプルネガティブ乳癌と癌幹細胞の脱出を阻止する
細胞代謝、33(11)(2021)、2247-2259頁、10.1016/j.cmet.2021.10.008
(PMID: 34731655; PMCID: PMC8769166)
スコープで見るGoogle Scholar
[149]
G. Li、C. Xie、S. Lu、R.G. Nichols、Y. Tian、L. Li、D. Patel、Y. Ma、C.N. Brocker、T. Yan、K.W. Krausz、R. Xiang、O. Gavrilova、A.D. Patterson、F.J. Gonzalez
間欠的絶食は腸内細菌叢を形成することによって白色脂肪の褐色化を促進し、肥満を減少させる
Cell Metab., 26 (4) (2017), 672-685頁, 10.1016/j.cmet.2017.08.019
(.e4. Epub 2017 Sep 14. Erratum in: Cell Metab. 2017 Nov 7;26(5):801. PMID: 28918936; PMCID: PMC5668683)
Google Scholar
[150]
P. Rangan, I. Choi, M. Wei, G. Navarrete, E. Guen, S. Brandhorst, N. Enyati, G. Pasia, D. Maesincee, V. Ocon, M. Abdulridha, V.D. Longo
断食を模倣した食事は微生物叢を調節し、腸の再生を促進して炎症性腸疾患の病態を軽減する。
セル・レップ, 26 (10) (2019), pp.2704-2719, 10.1016/j.celrep.2019.02.019
(.e6. PMID: 30840892; PMCID: PMC6528490)
ScopusGoogle Scholarで見る
[151]
J. リウ、Y.ジョン、X.M.ルオ、Y.マー、J.リウ、H.ワン
間欠的ファスティングは腸内細菌叢とメタボロームを再構築し、マウスにおいてメラトニンよりも効果的に体重増加を抑制する。
Front. Nutr., 8 (2021), Article 784681, 10.3389/fnut.2021.784681
(pmid: 34901130; pmcid: pmc8652062)
スコープで見るGoogle Scholar
[152]
L. Li、Y. Su、F. Li、Y. Wang、Z. Ma、Z. Li、J. Su
毎日の絶食時間がマウスの腸内細菌叢の形成に及ぼす影響
BMC Microbiol., 20 (1) (2020), Article 65, 10.1186/s12866-020-01754-2
(pmid: 32209070; pmcid: pmc7092480)
Google Scholar
[153]
E. Beli、Y. Yan、L. Moldovan、C.P. Vieira、R. Gao、Y. Duan、R. Prasad、A. Bhatwadekar、F.A. White、S.D. Townsend、L. Chan、C.N. Ryan、D. Morton、E.G. Moldovan、F. I. Chu、G.Y. Oudit、H. Derendorf、L. Adorini、X.X. Wang、C. Evans-Molina、R.G. Mirmira、M.E. Boulton、M.C. Yoder、Q. Li、M. Levi、J.V. Busik、M.B. Grant
間欠的絶食による腸内細菌叢の再構築は、db/dbマウスの網膜症を予防し、生存期間を延長させる
Diabetes, 67 (9) (2018), pp.1867-1879, 10.2337/db18-0158
(Epub 2018 Apr 30. PMID: 29712667; PMCID: PMC6110320)
スコープで見るGoogle Scholar
[154]
F. Cignarella、C. Cantoni、L. Ghezzi、A. Salter、Y. Dorsett、L. Chen、D. Phillips、G.M. Weinstock、L. Fontana、A.H. Cross、Y. Zhou、L. Piccio
間欠的絶食は、腸内細菌叢を変化させることによって中枢神経系自己免疫の保護をもたらす。
Cell Metab., 27 (6) (2018), 1222-1235頁, 10.1016/j.cmet.2018.05.006
(.e6. PMID: 29874567; PMCID: PMC6460288)
ScopusGoogle Scholarで見る
[155]
Z. リュー、X. ダイ、H. チャン、R. シー、Y. ホイ、X. ジン、W. チャン、L. ワン、Q. ワン、D. ワン、J. ワン、X. タン、B. レン、X. リュー、T. ザオ、J. ワン、J. パン、T. ユアン、C. チュー、L. ラン、F. イン、E. カデナス、L. シー、S. ザオ、X. リュー
腸内細菌叢は間欠的絶食による糖尿病誘発認知機能障害の軽減を媒介する
Nat. Commun., 11 (1) (2020), Article 855, 10.1038/s41467-020-14676-4
(pmid: 32071312; pmcid: pmc7029019)
Google Scholar
[156]
X. Zhang、Q. Zou、B. Zhao、J. Zhang、W. Zhao、Y. Li、R. Liu、X. Liu、Z. Liu
大腸炎および行動障害に対するDSSによる交互日絶食、時間制限絶食および間欠的エネルギー制限の効果
レドックスバイオロジー, 32 (2020), Article 101535, 10.1016/j.redox.2020.101535
(Epub 2020 Apr 10. Erratum in: Redox Biol. pmid: 32305005; pmcid: pmc7162980)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[157]
C. オズクル、M. ヤリネイ、T. カラカン
ラマダン断食後の腸内細菌叢の構造変化:パイロット研究
有益。Microbes, 11 (3) (2020), pp.227-233, 10.3920/BM2019.0039
(Epub 2020 Feb 19. PMID: 32073296)
スコープで見るGoogle Scholar
[158]
J. Su、Y. Wang、X. Zhang、M. Ma、Z. Xie、Q. Pan、Z. Ma、M.P. Peppelenbosch
ラマダンに伴う断続的絶食における腸内細菌叢のリモデリング
Am. J. Clin. Nutr., 113 (5) (2021), pp.1332-1342, 10.1093/ajcn/nqaa388
(PMID: 33842951; PMCID: PMC8106760)
PDFで記事を見るScopusで記事を見るGoogle Scholar
[159]
J. 楊、魏浩、周怡、C.H. Szeto、李慈、林怡、O.O. Coker、H.C.H. Lau、A.W.H. Chan、J.J.Y. Sung、J. Yu
高脂肪食は腸内細菌叢と代謝産物の調節を介して大腸腫瘍形成を促進する。
Gastroenterology, 162 (1) (2022), pp.135-149, 10.1053/j.gastro.2021.08.041
(Epub 2021 Aug 27. PMID: 34461052)
Google Scholar
[160]
Y. Tong、H. Gao、Q. Qi、X. Liu、J. Li、J. Gao、P. Li、Y. Wang、L. Du、C. Wang
高脂肪食、腸内細菌叢と消化管がん
Theranostics, 11 (12) (2021), pp.5889-5910, 10.7150/thno.56157
(PMID: 33897888; PMCID: PMC8058730)
スコープで見るGoogle Scholar
[161]
M. 王, 兪史, 張毓兪, 張沃, 周茂樹
フラボノイドのがん予防と治療における効果とメカニズム:腸内細菌叢に着目して
Int. J. Biol. Sci., 18 (4) (2022), pp.1451-1475, 10.7150/ijbs.68170
(PMID: 35280689; PMCID: PMC8898378)
スコープで見るGoogle Scholar
[162]
A. バッジリー、H.アンワル、K.モディ、P.マーフィー、A.ラクシュミクッティャンマ
プロバイオティクスと腸内細菌叢が抗がん剤に及ぼす影響:メカニズムの展望
Biochim. Biophys. Acta Rev. Cancer, 1875 (1) (2021), Article 188494, 10.1016/j.bbcan.2020.188494.
(Epub 2020 Dec 17. PMID: 33346129)
PDFを見る記事を見るScopusで見るGoogle Scholar
[163]
H. マルーフ、Z.M.ハッサン、A.M.モバレズ、M.A.モハマダバディ
乳酸菌はマウスモデルにおいて乳がんに対する免疫応答を調節する可能性がある。
J. Clin. Immunol., 32 (6) (2012), pp.1353-1359, 10.1007/s10875-012-9708-x
(Epub 2012 Jun 19. PMID: 22711009)
スコープで見るGoogle Scholar
[164]
Z. ノロウジ、A. サリミ、R. ハラビアン、H. ファヒミ
強力なバクテリオシンおよび抗菌ペプチドであるナイシンは、大腸がん細胞株における転移遺伝子の発現を抑制する。
Microb. Pathog., 123 (2018), pp.183-189, 10.1016/j.micpath.2018.07.006
(Epub 2018 Jul 11. PMID: 30017942)
PDFを見る記事を見るScopusで見るGoogle Scholar
[165]
L.K.シャラフ、M.シャルマ、D.チャンデル、G.シュクラ
プロバイオティクス(L. acidophilus、L. rhamnosus GG)とセレコキシブの予防的介入は、1,2-ジメチルヒドラジン誘発実験的結腸発がんにおいてBaxを介したアポトーシスを調節する。
BMC Cancer, 18 (1) (2018), Article 1111, 10.1186/s12885-018-4999-9
(PMID: 30424722; PMCID: PMC6234654)
スコープで見るGoogle Scholar
[166]
T. Zhang, Q. Li, L. Cheng, H. Buch, F. Zhang
アッカーマンシア(Akkermansia muciniphila)は有望なプロバイオティクスである。
Microb. Biotechnol., 12 (6) (2019), pp.1109-1125, 10.1111/1751-7915.13410.
(Epub 2019 Apr 21. PMID: 31006995; PMCID: PMC6801136)
スコープで見るGoogle Scholar
[167]
K.C. Lam、R.E. Araya、A. Huang、Q. Chen、M. Di Modica、R.R. Rodrigues、A. Lopès、S.B. Johnson、B. Schwarz、E. Bohrnsen、A.P. Cogdill、C.M. Bosio、J.A. Wargo、M.P. Lee、R.S. Goldszmid
微生物叢はSTING-type I IFN依存的に腫瘍微小環境の単球リプログラミングを引き起こす
Cell, 184 (21) (2021), pp.5338-5356, 10.1016/j.cell.2021.09.019
(PMID: 34624222; PMCID: PMC8650838)
スコープで見るGoogle Scholar
[168]
L. Wang, L. Tang, Y. Feng, S. Zhao, M. Han, C. Zhang, G. Yuan, J. Zhu, S. Cao, Q. Wu, L. Li, Z. Zhang
アッカーマンシア(Akkermansia)ムチニフィラ(muciniphila)または低温殺菌菌の精製膜タンパク質は、マウスにおけるCD8+ T細胞の調節によって大腸炎関連腫瘍の発生を抑制する。
Gut, 69 (11) (2020), 1988-1997頁, 10.1136/gutjnl-2019-320105
(Epub 2020 Mar 13. PMID: 32169907; PMCID: PMC7569398)
スコープで見るGoogle Scholar
[169]
L. L.ファン、C.シュー、Q.葛、Y.リン、C.C.ウォン、Y.チー、B.イェ、Q.リアン、W.ズオ、J.シ、S.チェン、L.ワン
A. muciniphilaは、TLR2/NLRP3を介したM1様TAMを誘導することにより、大腸腫瘍の発生を抑制する。
Cancer Immunol. Res., 9 (10) (2021), 1111-1124頁, 10.1158/2326-6066.CIR-20-1019
4/30, (Epub 2021 Aug 13. PMID: 34389559)
スコープで見るGoogle Scholar
[170]
Y. グオ、ルオ、イェ、イン、ファン、シャ
断食はメタボリックシンドローム患者の心代謝リスク因子を改善し、腸内細菌叢を変化させる
J. Clin. Endocrinol. Metab., 106 (1) (2021), 64-79頁, 10.1210/clinem/dgaa644
(pmid: 33017844)
スコープで見るGoogle Scholar
[171]
R.L.ウォッシュバーン、J.E.コックス、J.B.ミューレステイン、H.T.メイ、J.F.カールクイスト、V.T.レ、J.L.アンダーソン、B.D.ホーン
FEELGOOD試験における24時間水のみ絶食時のメタボロームおよびトリメチルアミンN-オキシドの変化に対する新規間欠的絶食効果のパイロット試験
栄養素, 11 (2) (2019), p. 246, 10.3390/nu11020246
(pmid: 30678028; pmcid: pmc6412259)
スコープで見るGoogle Scholar
[172]
H. シー、チャン、アボ・ハムジー、J.W.ネルソン、C.S.R.アンバティ、J.F.ペトロシーノ、R.M.ブライアン・ジュニア、D.J.ダーガン
間欠的絶食による腸内細菌叢の再構築は血圧を低下させる
Circ Res., 128 (9) (2021), 1240-1254頁, 10.1161/CIRCRESAHA.120.318155
Epub 2021 Feb 18. Erratum in: Circ Res. 2022年3月4日;130(5):e18. PMID: 33596669; PMCID: PMC8085162
スコープで見るGoogle Scholar
[173]
E. Serger、L. Luengo-Gutierrez、J.S. Chadwick、G. Kong、L. Zhou、G. Crawford、M.C. Danzi、A. Myridakis、A. Brandis、A.T. Bello、F. Müller、A. Sanchez-Vassopoulos、F. De Virgiliis、P. Liddell、M.E. Dumas、J. Strid、S. Mani、D. Dodd、S. Di Giovanni
腸内代謝産物インドール-3プロピオン酸は神経の再生と修復を促進する
Nature, 607 (7919) (2022), 585-592頁, 10.1038/s41586-022-04884-x
(PMID: 35732737)
スコープで見るGoogle Scholar
[174]
R. Wang、X. Yang、J. Liu、F. Zhong、C. Zhang、Y. Chen、T. Sun、C. Ji、D. Ma
腸内細菌叢は、酪酸を介した腸管バリア機能の変化を介して急性骨髄性白血病を制御する。
Nat. Commun., 13 (1) (2022), Article 2522, 10.1038/s41467-022-30240-8
(PMID: 35534496; PMCID: PMC9085760)
スコープで見るGoogle Scholar
[175]
J.Y. Jang, E. Im, Y.H. Choi, N.D. Kim
胆汁酸によるプログラム細胞死のメカニズムとがんに対する創薬:総説
Int. J. Mol. Sci., 23 (13) (2022), p. 7184, 10.3390/ijms23137184
(PMID: 35806184; PMCID: PMC9266679)
スコープで見るGoogle Scholar
[176]
A. Zimber、A. Chedeville、J.P. Abita、V. Barbu、C. Gespach
HL60およびTHP-1ヒト白血病細胞における胆汁酸、オールトランス型レチノイン酸、および1,25-ジヒドロキシビタミンD3の単球分化およびミエロブラスチン遺伝子ダウンレギュレーションに対する機能的相互作用
Cancer Res., 60 (3) (2000), pp.
(pmid: 10676652)
スコープで見るGoogle Scholar
[177]
Z. Sári, E. Mikó, T. Kovács, L. Jankó, T. Csonka, G. Lente, É. Sebő、J. Tóth、D. Tóth、P. Árkosy、A. Boratkó、G. Ujlaki、M. Török、I. Kovács、J. Szabó、B. Kiss、G. Méhes、J.J. Goedert、P. Bai
マイクロバイオームの代謝産物であるインドールプロピオン酸は、AHRおよびPXR受容体を活性化し、酸化ストレスを誘導することで、乳がんにおいて細胞賦活作用を示す。
Cancers, 12 (9) (2020), p. 2411, 10.3390/cancers12092411
(pmid: 32854297; pmcid: pmc7565149)
Google Scholar
[178]
H.J.フリント、K.P.スコット、P.ルイス、S.H.ダンカン
栄養と健康における腸内細菌叢の役割
Nat. Rev. Gastroenterol. Hepatol., 9 (10) (2012), pp.577-589, 10.1038/nrgastro.2012.156
(pmid: 22945443)
スコープで見るGoogle Scholar
[179]
Y. Y. Yao, X. Cai, W. Fei, Y. Ye, M. Zhao, C. Zheng
免疫、炎症および代謝における短鎖脂肪酸の役割
Crit. Rev. Food Sci. Nutr., 62 (1) (2022), pp.
(エパブ2020年12月1日。PMID: 33261516)
Google Scholar
[180]
Y.Q. Mao、J.T. Huang、S.L. Zhang、C. Kong、Z.M. Li、H. Jing、H.L. Chen、C.Y. Kong、S.H. Huang、P.R. Cai、B. Han、L.S. Wang
カロリー制限の抗腫瘍効果は腸内細菌叢によって媒介される
Nat. Metab., 5 (1) (2023), 96-110頁, 10.1038/s42255-022-00716-4.
(Epub 2023 Jan 16. PMID: 36646754)
スコープで見るGoogle Scholar
引用元: (0)
© 2023 The Authors. Elsevier Masson SAS発行。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイト上のすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
