母体γδT細胞は、マイクロバイオータ依存的に子孫の肺2型免疫を形成する
論文|オンライン版, 112074
母体γδT細胞は、マイクロバイオータ依存的に子孫の肺2型免疫を形成する
ペドロ H. パポット
バティヤル・ユルマズ 6
Gonçalo Pimenta 6
Andrew J. Macpherson
ジュディス・E・アレン
ブルーノ・シルバ=サントス 7
すべての著者を表示する
脚注を表示するオープンアクセス公開日:2023年2月13日DOI:https://doi.org/10.1016/j.celrep.2023.112074
ハイライト
γδT細胞欠損ダムの子孫は、肺タイプ2免疫の亢進を示す。
TCRδ-/-ダムは、皮膚のAMPレベルと微生物叢の構成に違いが見られる
出産・育児中の微生物叢の移行が初呼吸反応を制御する
ペンタン酸およびヘキサン酸SCFAはILC2機能と肺炎を抑制する
まとめ
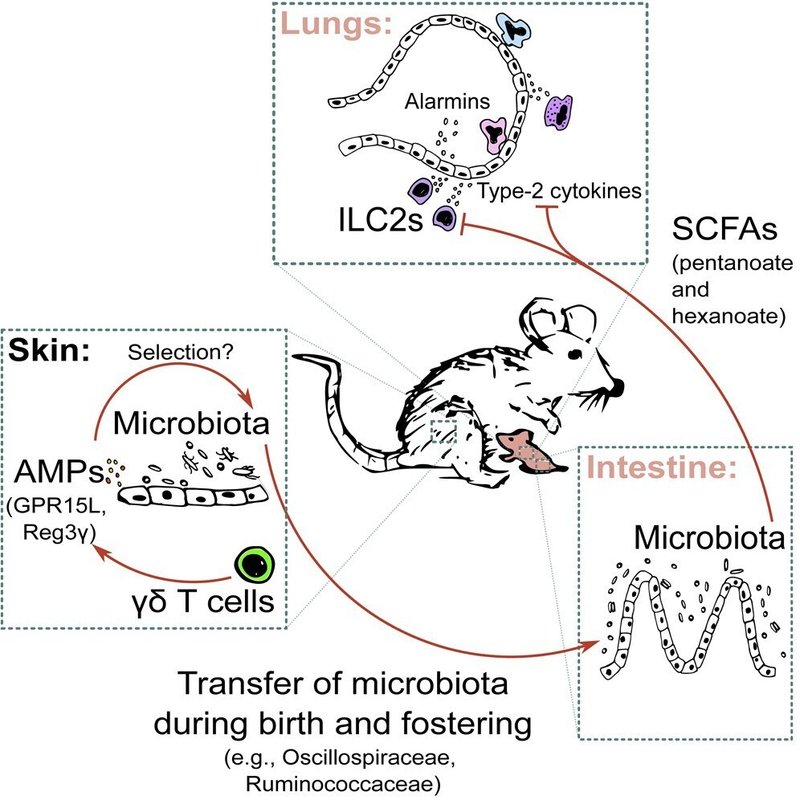
免疫の発達は、垂直的に伝達されるキューに大きく影響される。しかし、母親の自然免疫様リンパ球がどのように子孫の免疫を制御しているかについては、ほとんど知られていない。本研究では、γδT細胞欠損(TCRδ-/-)ダムから生まれたマウスは、γδT細胞欠損ダムの子孫と比較して、初呼吸による炎症が増加し、肺の環境は2型サイトカインと2型偏光免疫細胞に選択的に富んでいることを示す。蠕虫感染時、TCRδ-/-ダムから生まれたマウスは、2型炎症反応の増加を維持する。これは、仔マウスの遺伝子型とは無関係である。その代わりに、TCRδ-/-ダムの子孫は、出生時および養育期間中に獲得した独特の腸内細菌叢を有し、ペンタノエートやヘキサノエートのような腸内短鎖脂肪酸(SCFA)のレベルが低下している。重要なことは、外因性SCFA補給が2型自然リンパ球の機能を抑制し、初呼吸や感染症誘発性の炎症を抑制することである。これらの結果から、母体のγδT細胞-微生物叢-SCFAが新生児の肺免疫を制御していることが明らかとなった。
図解要約
図 サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
γδT細胞
短鎖脂肪酸
微生物叢
新生児
母体
2型免疫
腸-肺軸
蠕虫(ぜんちゅう)感染症
自然リンパ系細胞
研究テーマ
CP:免疫学
CP:微生物学
はじめに
1 妊娠中および離乳前の母体からの細菌種の移行は、子孫のマイクロバイオータプロファイルを決定し、それが後世の免疫応答に影響を及ぼす。例えば、妊娠中の抗体を介した細菌産物の垂直移行は、子孫の腸管免疫系の成熟を調節することが示されている5。さらに、妊娠中に母親が高繊維質の食事に暴露すると、食事代謝物の主要なクラスである短鎖脂肪酸(SCFAs)の移転を通じて、子孫の気道アレルギー疾患の重症度が低下することが分かっています7。興味深いことに、気道免疫疾患は幼少期の環境負荷と密接な関係があるようで、8 肺の発達の周産期を特徴づける2型免疫活性化と組織リモデリングに起因すると思われる9,10 この母性クロストークは、刺激的な生物学的影響とは別に、遺伝子改変マウスによる実験デザイン、すなわち正確かつ再現性の高いデータ作成のためのコントロール選択に深い影響を与えることになる。同腹子マウスがゴールドスタンダードと考えられているにもかかわらず11、同居や特に(市販業者から直接入手することの多いいわゆる「野生型」マウスとの)遺伝子背景の一致といった代替アプローチが、生物医学研究においていまだに広く用いられていることは明らかである。しかし、多くの外部からの手がかりが幼少期に垂直的に伝達され、長期にわたって影響を及ぼすことを考えると、5,6,7,12 リターメイトコントロールを使用せずに環境要因を制御することは、ほぼ不可能である。特に、子孫の免疫系に対する母親の影響が明らかであるにもかかわらず、母親の免疫系の個々の構成要素(抗体以外)が子孫の免疫状態を制御する役割については、ほとんど未解明である。
γδT細胞は、自然免疫系のリンパ球の一種で、女性の生殖管15,16,17、皮膚18,19、乳腺20など、母子間のインターフェースを構成する様々な組織に存在することが知られている。また、γδT細胞は、バリアー組織の微生物叢との複雑なクロストークに関与することが知られており23,24、特に、口腔内の微生物叢について最近報告されたように、細菌群に大きな選択圧を及ぼすことができる25,26。したがって、我々は、母親のγδT細胞が子孫の免疫系の発達に影響するか、どのように影響するかを明らかにする目的で、以下の研究を行った。本論文では、TCRδ-/-(TCRδ+/-と比較して)ダムから生まれた仔は、自身の遺伝子型に関係なく、定常状態と蠕虫感染時の両方で、2型免疫に強く偏った周産期の肺環境を呈することを示す。異種交配や帝王切開(C-Sec)出産実験、抗生物質治療やメタボロミクス的アプローチに基づき、このプロセスにおける微生物叢とその代謝副産物の重要な役割を提唱している。
研究成果
母親のγδT細胞の欠失は、周産期の肺2型免疫活性化を悪化させる
肺タイプ2免疫応答の確立における肺γδT細胞の重要性は、様々なグループによって強調されてきた27,28,29。このγδT細胞のクロストーク機構を理解するために、我々はTCRδ-/-×TCRδ-/-のコロニーから得たマウスが、年齢と性をマッチさせたC57BL6/Jマウスと比較して肺の2型自然リンパ球(ILC2)の頻度と数が減少することを観察した(図S1AおよびS1B参照)。しかし、興味深いことに、ヘテロ接合体交配(TCRδ+/-×TCRδ+/-)によるTCRδ+/-同腹子を比較すると、肺ILC2には差が観察されず、これは子孫の遺伝子型に依存しないことを示唆した(図S1CおよびS1D)。さらに、2型免疫に強く依存した肺の損傷/修復サイクルを誘導する寄生虫Nippostrongylus brasiliensisに感染すると、30 TCRδ-/-マウスはC57BL6/Jマウスと比較して肺損傷が増加した(図S1EおよびS1F)。しかし、TCRδ-/-とTCRδ+/-の同腹仔は感染時に同等の肺障害を示した(図S1GとS1H)。我々のTCRδ+/-交配はTCRδ-/-コロニーに由来し、両者は同じ環境因子を経験していることから、ダムにおけるγδT細胞の欠如が肺ILC2の変化に関与している可能性があると仮定した。この仮説を検証するために、TCRδ-/-雌とTCRδ+/-雄を交配し、逆にTCRδ-/-雌とTCRδ+/-雄を交配し、相互繁殖コロニーを作った。これらの繁殖戦略により、TCRδ-/-とTCRδ+/-両方の子孫が生まれ、子孫における遺伝子固有の影響を排除できる(図 1A)。肺免疫系の成熟につながる主要なイベントは、初呼吸による炎症反応の結果としてこの時期にピークを迎えるため、我々はγδ欠損および欠損のダムから生まれた仔の肺を生後15日目頃に解析することにした9, 10。我々の仮説に従い、TCRδ-/-ダムから生まれた仔は、TCRδ+/-ダムから生まれた仔と比べて肺ILC2が減少した(図S1Jおよび図S1K)。興味深いことに、TCRδ-/-ダムの子孫は、IL-5+ではなくインターロイキン-13(IL-13)+のILC2(図1B-1D)およびIL-5+肥満細胞(図S1N-S1P)の増加を含む周産期の肺タイプ2の活性化が増大したことを示した。したがって、TCRδ+/-ダムの子孫の肺では、そのTCRδ+/-から生まれた仔と比較して、2型誘導アラミンIL-33、および2型サイトカインIL-4とIL-5の組織レベルの増加も観察された(図1E)。さらに、2型喘息モデルにおける知見31と一致して、IL-12p70とIL-23ではなく、IL-12p40もTCRδ-/-ダムから生まれた子供の肺で増加した(図1EおよびS1S)。さらに、TCRδ-/-ダムの子孫の間質マクロファージは、Il13ra、I1rl1、Arg1などのタイプ2制御遺伝子の発現が、わずかではあるが有意に増加した(図1Fと1G)。決定的なことは、同じ仔を自身の遺伝子型に従って層別化すると、肺ILC2(図1H、1I、S1L、S1M)、肥満細胞(図S1Q、S1R)、肺サイトカインレベル(図1J)、間質マクロファージの遺伝子発現(図1K)に関するTCRδ-/-とTCRδ+/-仔との間に差異は見られなかったことである。したがって、TCRδ-/-ダムから生まれた仔において観察される初呼吸誘発性2型免疫応答の増加は、母体の遺伝子型にのみ依存することがわかる。
図サムネイルgr1
図1母体γδT細胞の欠如は、仔の初呼吸誘発性2型炎症を増悪させる
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
注目すべきは、肺の2型免疫で観察された違いにもかかわらず、TCRδ-/-とTCRδ+/-のダムから生まれた仔は、肺骨髄集団(図S2A)、TおよびBリンパ球(図S2B)、Treg細胞(図S2C)において同様の分布を示したことである。さらに、サーファクタントおよびムチンの産生およびバリア保全性を制御する上皮遺伝子の発現は、両方の繁殖戦略からの仔の間で類似していた(図S2D)。最後に、TCRδ-/-とTCRδ+/-のダムを持つ子孫の違いは肺に限られるようで、骨髄ではILC2前駆体や他のリンパ系・骨髄系前駆細胞の頻度が同程度であり(図S3A)、小腸の層状突起では自然リンパ系細胞の頻度が同程度であった(図S3B)。これらのデータは、母体のγδT細胞が、子供の初呼吸による肺反応を「垂直的」に(かつ選択的に)制御していることを示唆している。
幼少期の微生物叢の移行は、TCRδ+/-およびTCRδ-/-ダムからの子孫の肺免疫系の違いを媒介する
妊娠中の母体由来因子の移行は、腸管免疫系の発達を制御し5,6、子孫の気道炎症を抑制することが示されている7。驚くべきことに、TCRδ-/-ダムから生まれた仔をTCRδ+/-代理母に、またはその逆に交配すると(図2A)、それぞれの子孫間で認められた肺環境における差異が消失した(図2Bと図1Eを比較した)。このことは、子孫の肺免疫の垂直的条件付けが、妊娠中にのみ行われるわけではないことを示唆した。妊娠・出産時の母体移行因子の役割をさらに排除するために、TCRδ-/-またはTCRδ+/-のいずれかのダムからC-Secを介して生まれた仔を、同じまたは反対の遺伝子型の母親から自然に生まれた仔(NB)と共育した(図2Cおよび図2D)。TCRδ-/-ダムのNB仔はIL-33とIL-13産生肺ILC2の肺レベルの増加を保持していたのに対し、C-Sec投与は養母に関係なく、TCRδ-/-ダムの仔の肺における周産期2型活性化の増加を阻害した(図2D〜2I)。注目すべきは、TCRδ+/-ダムからC-Secを介して生まれた仔をそのTCRδ-/-の対応物に里子に出しても、肺の炎症の増加は引き起こされなかったことである(図2D)。
図のサムネイル gr2
図2分娩時および養育期間中に起こる、母体による初呼吸誘発性炎症の制御
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
母体抗体は、異常な2型免疫応答の制御を通じて子孫の喘息発症を予防することが示されており32 、γδT細胞は自然および適応的な抗体産生を制御できる。さらに、抗体欠損のJHT雌と抗体欠損の雄を交配し、相互繁殖コロニーを確立した(図3D)。予想通り、JHTダムとその野生型(WT)の子孫は、肺の2型サイトカインIL-33、IL-4、IL-5の組織レベルがほぼ同じで、IL-12p40がわずかに増加した(図3E)。
図のサムネイルgr3
図3初呼吸によって誘発される炎症の母性制御は、微生物叢に依存するが、抗体には依存しない。
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
微生物叢4やその産物の垂直的な移動5もまた、子孫の免疫の調節に関与していると考えられている。そこで我々は、相互繁殖戦略の親と子孫に、妊娠前から妊娠、養育に至るまで、広域抗生物質(ABX)カクテルを投与した(図3F)。対照区(図1E)とは対照的に、ABX処理したTCRδ-/-ダムとTCRδ+/-ダムから生まれた仔は、肺のサイトカインの組織レベルが同程度であった(図3G)。これは、TCRδ-/-ダムから生まれた仔で見られた2型肺反応の増強は、微生物叢または微生物由来の分子の垂直移動によることを示唆している。
TCRδ-/-ダムはTCRδ+/-オスと同居しているため、皮膚細菌群集に違いが見られる
共同飼育は、異なるマウスコロニー間の微生物相を高度に均一化することが知られている33。したがって、今回の飼育設定では、TCRδ-/-とTCRδ+/-のダムは、反対遺伝子型のオスと共同飼育しても微生物相に違いが見られないと予想された。実際、相互繁殖ペアを作る前、TCRδ-/-とTCRδ+/-のメスは糞便中の細菌多様性(図S4A)、細菌の豊富さと均一性(それぞれShannon指数とSimpson指数で評価)に有意差が見られた(図S4B)。予想通り、繁殖確立後、母体糞便微生物叢のβ多様性解析では、TCRδ-/-およびTCRδ+/-雌の細菌多様性に同居前後で有意な変化が見られた(図S4CおよびS4D);細菌富度の変化は見られなかった(図S4Eおよび図S4F)。その結果、繁殖ペアの確立後、TCRδ-/-とTCRδ+/-のダムは、糞便(図S5AおよびS5B)、膣(図S5CおよびS5D)および皮膚(図4Aおよび4B)の微生物叢において、同様の細菌多様性と濃度を示していた。しかし、特定の皮膚微生物群集の相対量を比較すると、TCRδ+/-ダムではBacteroidetes属とOscillospira属が有意に増加し(図4Cと4D)、TCRδ/-ダムではParvimonasとTannerella属がわずかに増加する(図4C)ことが示された。したがって、共同飼育によって微生物相がほぼ均一化されても、TCRδ+/-ダムとTCRδ-/-ダムの間では皮膚微生物相に分類学的な差異が保持されていることがわかる。γδT細胞はしばしばサイトカインの分泌を介して作用し、IL-17AとIL-22の主要産生者である34。これらはいずれも常在菌の制御に関与しているとされている35,36。驚くべきことに、そしてTCRδ-/-ダムの子孫で観察されたこととは明らかに対照的に(図1E)、Il17a-/-およびIl22-/-ダムの子孫は、コントロールダムの子孫と比較して、肺IL-33(図S6BおよびS6D)、IL-5(図S6B)およびIL-12p40(図S6D)のレベルの減少を呈示した。次に、別のメカニズムとして、TCRδ+/-とTCRδ-/-ダムの皮膚における複数の抗菌ペプチド(AMPs)35,37の発現を評価した。興味深いことに、S100タンパク質(S100a7、S100a8、S100a9)、ディフェンシン(Defb2、Defb4)、Reg1(Reg1)をコードする遺伝子の発現には差が見られなかったが、TCRδ-/-ダムはAMP Reg3-γとGPR-15LをそれぞれコードするReg3gとGpr15lの発現が著しく低いことが分かった(図4E)。注目すべきは、膣組織におけるAMP遺伝子の発現に差がないことである(図S7A)。したがって、Reg3-γやGPR-15Lなどの特定のAMPが皮膚で選択的に制御されることで、γδT細胞が地域の常在細菌群を形成する仕組みが説明できるかもしれない。
図 サムネイル gr4
図4TCRδ+/-とTCRδ-/-のダムは、同居しても皮膚微生物叢と抗菌ペプチドプロファイルが別個であることを示す
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
TCRδ+/-ダムの子孫は、SCFAs産生能力の高い腸内細菌叢を生後獲得している。
これらのデータを総合すると、TCRδ-/-ダムとTCRδ+/-ダムの子孫は、新生児期に異なる微生物コロニー形成を受けるという仮説が導き出された。TCRδ-/-およびTCRδ+/-ダムの子孫の肺微生物叢における細菌多様性および富栄養度に違いは見られなかったが(図S8AおよびS8B)、糞便内容物の微生物組成の分析により、TCRδ-/-ダムから生まれた仔の細菌多様性にわずかではあるが有意差が生じ(図5A)、細菌富栄養度が減少した(図5B)ことが明らかとなった。子孫の遺伝子型に基づく細菌の多様性や豊富さの差は認められなかった(図S8CおよびS8D)。TCRδ+/-ダムから生まれた仔は、Rikenellaceae RC9 gut group、Muribaculaceae、およびLachnospiraceae UCG-006属の相対存在量が有意に増加していた。ファミリーレベルでは、Rikenellaceae, Muribaculaceae, Oscillospiraceae, Ruminococcaceae, Erysipelatoclostridiaceaeの相対量がTCRδ+/-ダムの子供で有意に高かった(図5Cおよび図S9C)。一方、TCRδ-/-ダムから生まれた仔は、Lachnoclostridium属の増加を示した(図5C、S8E)。最も重要なことは、これらの分類学的変化の関連性を評価するために、Phylogenetic Investigation of Communities by Reconstruction of Unobserved States (PICRUSt) パイプラインを用いて、TCRδ-/-とTCRδ+/-ダムの子で見つかった糞便細菌群集の機能メタゲノム予測を行ったことである38。興味深いことに、最も有意に異なる20の代謝経路は、脂肪酸の生合成と分解およびSCFAへの発酵を含む経路に濃縮されていた(図5D)。TCRδ-/-およびTCRδ+/-ダムの子孫は、ペンタン酸およびヘキサン酸のレベルが増加し、統計的に有意ではなかったが、酢酸のレベルが増加する傾向が見られた(p = 0.0506)。 0506)。測定された他のSCFAには差が見られなかった(図5FおよびS9F)。これらの結果から、TCRδ-/-とTCRδ+/-のダムから生まれた仔の間で新生児腸内細菌のコロニー形成に差があると、微生物由来の代謝産物の利用可能性に変化が生じ、最終的に初呼吸誘発反応に影響を及ぼすことが示唆される。
図 サムネイル gr5
図5γδ充足型ダムの子は、γδ欠損型ダムから生まれた仔と比較して、SCFA産生量が増加した個別の腸内細菌叢を生後獲得する
キャプションを表示
大きな画像を見るダウンロード 高解像度画像
我々の仮説では、交配仔とC-Sec仔で肺の2型免疫に差がないことから、交配仔とC-Sec仔で新生児のコロニー形成を阻害すれば、細菌組成とその代謝能に差がなくなることが予想された。実際、交配仔の腸内細菌の豊富さには、細菌の多様性に有意差があるにもかかわらず(図S9A)、差がないことがわかった(図S9B)。C-Secを投与された仔魚については、より複雑な状況が観察された。Shannon指標を用いた場合、出生者や養母に関係なく、分析したC-Sec群間の細菌の豊富さに有意差は見られなかった(図S9C)。しかしSimpson指標では、養母の遺伝子型によって細菌の均一性に小さな差があることが示された(図S9C)。同様に、C-Secで出産した仔魚は、やはり里母の遺伝子型に依存して、細菌多様性に若干の有意差を保持していた(図S9D)。予想通り、交配によりTCRδ-/-とTCRδ+/-の子孫の間で最も豊富な上位30分類群はほぼ均質化した。一方、C-Sec投与はあまり一貫していなかったが、最も代表的な分類群のいくつかは出生後に垂直的に獲得され、里母の遺伝子型に大きく依存していることが示唆された(図S9E)。以上のことから、交配仔とC-Sec仔の微生物相の比較から、ほとんどの細菌群集は出生後に移行し、一部は出生前後に播種され、交配などの摂動後にも持続することが示唆された。したがって、TCRδ-/-とTCRδ+/-のダムを持つ子供の間で有意に異なることが判明した分類群に特化して解析したところ、交雑飼育によってこれらの差が完全に消失することが確認された(図5GおよびS10A)。C-Sec送達仔の微生物相を解析した結果、リケンテス科およびリケンテス属RC9腸群の細菌が、養育中に、TCRδ+/-ダムによってのみ移行することがわかった(図5H、S10B)。しかし、その他の有意に異なる細菌群集は、C-Secを介してTCRδ/-ダムから生まれ、TCRδ+/-母親によって養育された仔で有意に増加したムリバキュラ科およびムリバキュラ属の細菌を除き、群間でほぼ同様であることがわかった(図5HおよびS10B)。最後に、微生物の機能をインシリコで予測したところ、TCRδ-/-およびTCRδ+/-のダムから生まれた仔で観察された脂肪酸生合成・分解およびSCFA生成に関連する代謝経路の差異が交差飼育によって解消されることが確認された(図5Iおよび図S10C)。興味深いことに、C-Secを投与したTCRδ+/-ダムから育てた仔は、脂肪酸代謝を制御する経路のアップレギュレーションは維持されたが、SCFA産生に関連する経路の違いは失われた(図5JおよびS10D)。TCRδ+/-ダムの子孫ではOscillospiraceae, Ruminococcaceae, Erysipelatoclostridiaceaeの細菌とLachnospiraceae UCG-006属が著しく減少していたが、交差培養した仔とC-sec出産の仔では同様に分布したことから、これらの分類群は生後にTCRδ+/-ダムから仔に垂直移行し、新生児の肺タイプ2免疫に対して抑制作用を持つと考えることができた。さらに、我々のデータは、文献からの報告39,40とともに、これらの分類群がSCFA産生に関連しており、これらの微生物由来の代謝物が、提案されている腸-肺の制御軸を媒介する可能性があることを示唆している。
微生物由来のSCFAは、肺の初呼吸によるタイプ2炎症の悪化を防ぎ、蠕虫感染に対する離乳後の反応を制御する
外来性のSCFA補給が、γδT細胞欠損のダムから生まれた仔の肺で観察されるタイプ2の活性化の増加を抑制するのに十分かどうかを調べるために、TCRδ-/-ダムの子孫にSCFAカクテルを投与した(図6A)。我々の仮説を裏付けるように、TCRδ-/-ダムから生まれた仔にSCFAカクテルを投与すると、IL-33の組織レベルの違いが消失し、IL-4とIL-12p40の濃度が有意に減少した(図6B)。さらに、この処置は、IL-13+およびIL-5+細胞の同様の頻度によって証明されるように、TCRδ-/-ダムの子孫におけるILC2の活性化および機能もダウンレギュレートした(図6C〜図6E)。重要なことは、TCRδ-/-ダムに飲料水を介してSCFAカクテルを投与しても、その子孫におけるIL-13およびIL-5産生ILC2の頻度を、TCRδ+/-ダムのそれと比較して減少させるには十分ではなかった(図S11A〜S11D);IL-33の肺レベルも、TCRδ-/-ダムから生まれた子犬において依然として高かった(図S11E)。SCFAがどのように2型免疫を制御しているかについての機構的理解を深めるために、我々はin vitroシステムを採用し、SCFAカクテル、その個々の成分、またはILC2抑制の陽性対照としての酪酸存在下で精製ILC2をIL-33で再刺激した41。さらに、ペンタノエートのみの添加は、完全なカクテルの効果を再現するのに十分であった(図6F-6H);一方、ヘキサノエートは、IL-5産生を有意に減少させるが、IL-13は減少させない(図6F-6H)。注目すべきは、酢酸塩を添加しても、サイトカイン産生に違いは見られなかったことである(図6F-6H)。これらの結果から、微生物コンソーシアム解析から推定される細菌由来のSCFA、特にペンタン酸およびヘキサン酸が、ILC2サイトカイン産生を直接抑制することにより、第一呼吸反応を制御することが示唆された。
図 サムネイルgr6
図6子孫の微生物叢由来SCFAは肺の悪化した周産期2型炎症反応を抑制する
キャプションを表示
大きな画像を表示するダウンロード 高解像度画像
N. brasiliensis感染モデルを用いた最初の結果とあわせて、γδT細胞欠損ダムから生まれた仔マウスで初呼吸による2型炎症が増加したことから、TCRδ-/-ダムの仔マウスが2型炎症を促進するような刺激にどのように応答するかをさらに調査することになった。この疑問を解決するために、離乳後のマウスをN. brasiliensisに感染させた(図7A)。感染後2日目または6日目(p.i.)の肺の損傷、あるいは6日目p.i.の腸内寄生虫量には差が見られなかったが(図S12A-S12C)、TCRδ-/-ダムから生まれたマウスは、γδT細胞欠損ダムの子孫と比較して感染に対する炎症反応の増加を示し、肺への総白血球数の増加(図7B)、好酸球および好中球増加(図7Cおよび7D)が顕著であることがわかった。マクロファージや樹状細胞(DC)のプログラム細胞死リガンド2(PD-L2)の表面発現は、強いタイプ2条件下で起こることが報告されている42,43。したがって、TCRδ-/-ダムから生まれたマウスでは、コントロールと比較してPD-L2発現マクロファージ(図7Eおよび7F)とDC(図7Gおよび7H)数が増加することが確認された。これらの結果と同様に、我々はまた、TCRδ-/-ダムの子孫において、IL-13+およびIL-17A+(ただし、インターフェロンγ[IFN-γ]+ではない)CD4+T細胞(図7Iおよび7J)の増加を見いだした。マウスを自身の遺伝子型に従って分類すると、前述のパラメータのいずれにおいても、TCRδ-/-動物とTCRδ+/-動物の間に差は認められなかった(図S12D〜S12I)。以上のことから、TCRδ-/-ダムの子孫は、自身の遺伝子型に関係なく、定常状態と感染チャレンジ時の両方で、より強い2型免疫応答を示すことがわかった。
図7 サムネイル gr7
図7SCFAは、γδT細胞欠損ダムの子供におけるN. brasiliensis感染に対する反応の悪化を抑制する。
キャプションを表示
画像を拡大する 高解像度画像をダウンロードする
次に、離乳前のSCFA補給が、TCRδ-/-ダムの子孫で観察された蠕虫感染時の炎症反応の増加を抑制することができるかどうかを評価しようとした(図7A-7J)。そこで、TCRδ-/-ダムから生まれたN. brasiliensis SCFA投与マウスを、TCRδ+/-ダムから生まれたビヒクル投与マウスと一緒に感染させた(図7K)。SCFA投与により、TCRδ-/-ダムの子孫は、感染時に肺に浸潤する総白血球数(図7L)、好中球数(図7M)、好酸球数(図7N)にコントロールと比較して差がないことが確認された。さらに、感染によって誘導されたPD-L2発現マクロファージ(図7O)およびDC(図7P)の数は、TCRδ-/-およびTCRδ+/-のダムから生まれたマウス間で同様であることも見いだされた。最後に、SCFA補給後、TCRδ-/-ダムから生まれた子孫は、TCRδ+/-ダムから生まれたマウスと比較して、N. brasiliensis感染に応答して肺IL-13+、IL17+およびIFN-γ+CD4+ T細胞の同様の頻度を示した(図7.Q)。以上より、TCRδ-/-子孫で観察された表現型は、SCFA産生菌の母体移行が減少し、初呼吸による2型炎症が増加する以上に、離乳後の蠕虫感染に対する炎症反応を悪化させたことに起因すると考えられた。
考察
マウスでは、細胞性および体液性免疫応答における多くの変化がマイクロバイオータに依存することが実証されている。特に、γδT細胞と感染症の分野では、TCRδ-/-マウスの開発(1993年)以来、長年にわたって発表された研究のうち、同胞対照を用いた研究はわずか15%程度であり(図S13AおよびS13B)、一流雑誌からの除外も顕著である(図S13C)。これは、肺免疫におけるγδT細胞の役割に関して長年にわたって報告されてきた矛盾のいくつかの根拠であると思われる。
TCRδ-/-コロニーのマウスがTCRδ+/-コロニーのマウスと比較して非常に異なった糞便微生物叢を有していたことは、第一に、ヘテロ接合交配がTCRδ-/-コロニーの創設動物で確立されていたため、第二に、両方のマウス系統が同じ選択的環境圧力下で維持されていたため、驚くべきことであった。興味深いことに、Krishnanら25 は、TCRδ-/-マウスの口腔内細菌叢が、遺伝的背景を一致させたC57BL/6Jマウスと比較して有意に異なっていることを報告している。さらに、Wilharmらは、γδT細胞の急性枯渇モデルを用いて、γδT細胞を継続的に除去すると、対照(非除去)動物と比較して、口腔内細菌叢に大きな変化が生じることを見出した26。これらのデータは、バリアー組織に豊富に存在するγδT細胞が常在菌を選択することを示唆しており、TCRδ-/-ダムが同室飼育後も皮膚細菌群集に違いを維持しているという我々の知見を説明できる。TCRδ-/-ダムでは、AMPであるGpr15lとReg3gの発現が低下する一方で、皮膚細菌群集の差が持続していることから、γδT細胞はIL-17AやIL-22とは独立したプロセスでAMP制御により皮膚微生物相を形成していると考えられる。また、TCRδ-/-マウスの雌性生殖管では、微生物叢やAMPの発現に違いが見られなかったことから、我々の系では、これは組織特異的であるようである。重要なのは、GPR15Lが皮膚の主要なγδT細胞集団である樹状突起表皮T細胞(DETC;Lahlら、201449)の維持に重要であり、GPR15-/-マウスでこの軸が破壊されると皮膚のディスバイオシスになることが示されている50。
ヒトの母子ペアを対象とした以前の解析では、周産期に移行した母親の皮膚および膣株が早期にコロニー形成を開始し、次いで腸管由来の株が移行することが示されており、我々の結果を裏付けている51。我々の交配およびC-Sec実験から得られた結果は、TCRδ+/-ダムの子で増加が見られたほとんどの細菌群集が出生後に移行したことを示している。さらに、TCRδ-/-またはTCRδ+/-のダムからC-Secで産まれた仔の間で、いくつかの代謝経路は異なるままであったが、SCFAの生産に関連する経路は等しくなっていることが観察された。このように、今回の結果は、出産から数日間の期間が、微生物叢の組成だけでなく、その機能的能力も決定する上で重要であることを示していると思われる。また、TCRδ-/-ダムとTCRδ+/-ダムの皮膚は、新生児の腸管コロニー形成に影響を与え、最終的に初呼吸による肺反応を制御する可能性のある違いを示していることが示唆された。
ネズミの肺免疫系の発達は胎生期に始まるが52 、主な変化は生後2週間で起こる。我々の結果は、早期の腸内常在微生物およびその代謝物が、この肺の2型活性化を微調整できることを示しており、気道上皮細胞によるIL-33放出のプロセスは、物理的ストレス以上のものがあることを示しています10。文献によると、ペンタノエートは、CD4+ T 細胞における IL-17 産生を減少させることにより53 、あるいは CD8+ T 細胞における IFN-γ 産生を誘導することにより、リンパ球に対して抑制的および増強的な効果を示すことが報告されている54。しかし、本研究では、肺の免疫は離乳前に微生物叢由来のSCFAsの影響を受け、SCFAsの子宮内移行はTCRδ-/-ダムの子における肺タイプ2免疫の制御に関与しないことが示された。これらの知見は、異なる組織内に存在する免疫細胞の成熟時期が異なること、およびSCFAsの状況特異的な効果を強調するものである。
栄養、特に妊娠中と母乳育児中は、初期の微生物叢組成と子孫の生理学に大きな影響を与えるが、7,12,55 今回の研究は、周産期の段階で母親から乳児へ微生物叢を伝達することの重要性51を強調しており、このことが、幼少期に大きな免疫リモデリングを受ける肺という遠い臓器の生理学を条件付ける腸の微生物叢機能性確立に寄与している。
研究の限界
我々のデータは、母親のγδT細胞が出生後の微生物コロニー形成と子孫における微生物由来代謝物の利用可能性を制御し、最終的に肺免疫系の発達に影響を与えることを示唆している。TCRδ-/-とTCRδ+/-のダムを同居させると、皮膚に異なる細菌群が存在し、AMP遺伝子の発現に組織特異的な違いが見られるが、γδT細胞が微生物叢の構成を変化させるメカニズムを特定することはできなかった。さらに、今回のデータでは、先駆的な細菌群集がどの母体区画から来るのかを完全に特定することはできない。γδT細胞は女性の生殖管に比較的多く存在するので、TCRδ-/-とTCRδ+/-のダムの膣組織で微生物相にもAMPの発現にも違いが見られなかったのはやや意外であった。しかし、16S配列決定や遺伝子発現解析に用いた膣組織は、出産直前の妊娠女性から得られたものではないことに注意が必要である。母体の膣内細菌叢は妊娠中に大きく変化し、特に妊娠後期と出産時に劇的な変化が起こる56。したがって、γδT細胞の欠如が出産前の細菌叢の変化に異なる影響を与える可能性が出てきた。最後に、γδT細胞(および他の免疫細胞)が微生物叢を安定的に変化させるために必要な時間スケールについて、今後の研究により明らかにする必要がある。
STAR★メソッド
主要リソース表
試薬またはリソースのソース識別子
抗体
抗CD3 (145.2C11) BDバイオサイエンシズ AB_394591
抗CD3 (17A2) BioLegend AB_1595492
抗TCRδ(GL3) BioLegend AB_313832
抗CD90.2 (Thy1.2; 53-2.1) BioLegend AB_2650924
抗CD19(6D5) BioLegend AB_313645
抗CD23(B3B4) BioLegend AB_312833
抗CD45 (30F11) BioLegend AB_2563061
抗CD4(GK1.5) BioLegend AB_312693
抗NK1.1(PK136) BioLegend AB_313395
抗PD-L1 (10F.9G2) BioLegend AB_2563619
抗PD-L2 (TY25) BioLegend AB_2728123
抗 CD11b (M1/70) BioLegend AB_2562904
抗ST2 (IL-33R;DIH9)バイオレジェンド AB_2561917
抗 CD11c (N418) BioLegend AB_313777
抗Sca-1 (D7) BioLegend AB_493596
抗Gr-1(RB6-8C5) BioLegend AB_313373
抗Ly6G(1A8) BioLegend AB_1877261
抗Ly6C(HK1.4) BioLegend AB_1732076
抗IA/IE(MHC II; M5/114.15.2) BioLegend AB_2650896
抗CD24(M1/69) BioLegend AB_312839
抗シグレックF (E50-2440) BDバイオサイエンシズ AB_2687570
抗CD64 (X54-5/7.1) BioLegend AB_2629778
抗CD206 (CO68C2) BioLegend AB_2561992
抗IL-13 (eBio13A) イービオサイエンス AB_2573530
抗IL-9 (RM9A4) BioLegend AB_2562730
IL-5 (TRFK5) BioLegend AB_315330
化学物質、ペプチド、リコンビナントタンパク質
ヘキサン酸ナトリウム, 99-100% Sigma-Aldrich 10051-44-2
酢酸ナトリウム、無水、分子生物学用、≥99% Sigma-Aldrich 127-09-3
ペンタン酸ナトリウム Fluorochem 6106-41-8
酪酸ナトリウム Sigma-Aldrich 156-54-7
リコンビナントマウス IL-33 タンパク質 Biotechne Cat#3626-ML-010/CF
重要な市販アッセイ
LEGENDplex™ マウスサイトカインパネル 2 (13-plex) BioLegend Cat#740134
LEGENDplex™ Mouse Immunoglobulin Isotyping Panel (6-plex) with V-bottom Plate BioLegend Cat#740493
LEGENDplex™ MU Th1/Th2 パネル (8-plex) w/VbP V02 BioLegend Cat#741054
RNeasy Micro キット Qiagen Cat#74004
QIAamp Fast DNA Stool Mini キット Qiagen Cat#51604
寄託データ
Metagenomic Raw Sequencing Data 本紙 https://figshare.com/s/77865dbbf0daab588b8d
16S rRNA Amplicon Sequencing Data 本紙 https://figshare.com/s/77865dbbf0daab588b8d
実験モデル 生物種/株
マウス B6: C57BL/6J The Jackson Laboratory IMSR_JAX:000664
マウス TCRδ-/-: B6.129P2-Tcrdtm1Mom/J The Jackson Laboratory IMSR_JAX:002120
マウス JHT:B6.129P2-Igh-Jtm1Cgn/J Instituto Gulbenkian de Ciências IMSR_JAX:002438
マウス IL-17-/-: B6.IL-17-/- Instituto de Medicina Molecular MGI: 5695091
マウス マウス:IL-22-/-:B6.IL-22-/- The University of Manchester MGI:MGI:4453827
オリゴヌクレオチド
qPCR プライマー Sigma-Aldrich 表S1参照
ソフトウェアとアルゴリズム
Graphpad Prism v9.0a GraphPad Software, LLC www.graphpad.com
FlowJo v10.1 ツリースター https://www.flowjo.com
LEGENDplex™ データ解析ソフトウェアスイート Qognit https://legendplex.qognit.com/user/login
QIIME v1.9.1 Caporaso et al., 2010 http://qiime.org
R (v3.6.2) 解析部分用パッケージ: tidyverse, ape, vegan, nlme, stats, DEseq2, edgeR, ggtree https://www.r-project.org/
phyloseq Bolyen et al., 2019; McMurdie and Holmes, 2013 https://joey711.github.io/phyloseq/
PICRUSt2 Douglasら, 2020 https://github.com/picrust/picrust2/releases
MaAsLin2 モーガンら、2012年 https://huttenhower.sph.harvard.edu/maaslin/
新しいタブで表を開く
リソースの有無
リード連絡先
リソースや試薬に関する詳細な情報やリクエストは、リードコンタクトであるBruno Silva-Santos (bssantos@medicina.ulisboa.pt) までお願いします。
材料の利用可能性
この研究では、新たな試薬は生成されませんでした。
実験モデルおよび被験者の詳細
マウスと飼育環境
C57BL/6J (B6) マウスはCharles River Laboratoriesから、C57BL/6J.TCRδ-/- (TCRδ-/-, 以下同様) はThe Jackson Laboratoryから購入した。C57BL/6J.JHT(JHTと称する)マウスはInstituto Gulbenkian de Ciência (Oeiras, Portugal)から入手した。すべてのマウス系統は、分子医学研究所João Lobo Antunes(リスボン、ポルトガル)の特定の病原体を含まない動物施設で繁殖および維持された。ただし、IL-22-/-はJean-Cristophe Renauldから生成および取得し、マンチェスター大学で社内繁殖させたものである。性成熟後(約8週)、TCRδ-/-雌をTCRδ+/-雄(TCRδ-/-×B6交配から得られたTCRδヘテロ接合体)と交配し、またその逆も行った。上記の交配から得られた仔は離乳まで親と一緒に飼育し、後に性別に分けられた。特に断りのない限り、すべての仔魚はPN16±2で使用した。
研究の承認
リスボンで行われた動物を用いたすべての実験は、関連する法律および機関指針を遵守して行われ、地元およびヨーロッパの倫理委員会の承認を得た。マンチェスターで行われたすべての動物実験は、英国内務省から交付されたプロジェクトライセンス(70/8548)のもと、1986年の英国動物(科学的手続き)法に従い、マンチェスター大学動物福祉・倫理審査委員会により承認されたものである。安楽死は、濃度上昇中の二酸化炭素中での窒息によって行われた。
方法詳細
交差飼育とC-Sec手術
交配実験では、マウスを時間交配させた。簡単に説明すると、雌マウスを、雄動物が入ったケージの寝具を含むケージに48時間入れた。この期間の後、1匹または2匹の雌を単飼いの雄に導入した。翌日、膣栓の有無(E0.5とみなす)を記録し、雄を新しいケージに移した。場合によっては2日間同居させた。その後、TCRδ-/-ダムから生まれた仔を出産後1日目にTCRδ+/-ダムから生まれた仔と入れ替え(逆も同様)、仔のサイズ(最大3頭の差)を尊重した。
C-Sec実験では、TCRδ+/-とTCRδ-/-の雌を、1日の間隔をおいて2つのグループに分け、反対側の遺伝子型の雄と交配させた。そして、先に出産した雌のグループを代理母とした。18.5日目から19.5日目の間に、第2グループの雌はC-Sec手術を受けた。簡単に言うと、雌は安楽死させられ、子宮を摘出し、ヨウ素に浸される。仔魚は子宮から滅菌済み加熱プレートの上に取り出し、洗浄後、再活性化させる。規則的な呼吸運動を示す場合、仔魚はサロゲートダム(自分の母親と同じ遺伝子型のもの)およびその子孫と一緒にされる。
細胞調製、フローサイトメトリー、および解析
細胞表面染色のために、単細胞懸濁液を、抗CD16/CD32(eBioscience)の存在下で、上記のmAbの組み合わせの飽和濃度と共にインキュベートした。肺を解剖し、組織を断片に切断した後、コラゲナーゼD (0.66 mg/mL; Roche) とDNase I (0.10 mg/mL) (Sigma-Aldrich) で、5% Fetal Bovine Serum (FBS) 含むRPMI 1640中、37℃で30分間消化した。固有層細胞調製のため、小腸を解剖し、氷冷PBSで洗浄し、パイエル板を摘出した。その後、臓器を切り分け、EDTA 0.05Mとともに37℃で20分間インキュベートした。その後、細胞を洗浄し、100μmのセルストレーナーを通した後、肺と同様に消化した。組織を40μmのセルストレーナーに通し、70%/20% Percoll (Sigma-Aldrich) 勾配をかけ、2400rpmで30分間遠心分離することにより、単細胞を分離した。白血球は界面から回収して再懸濁し、さらなる分析に使用した。
細胞内サイトカイン染色のために、細胞を、ブレフェルジンA(10μg/mL)(すべてSigma製)の存在下、37℃で3時間〜4時間、PMA(ホルボール12-ミリスチン酸13-酢酸)(50ng/mL)およびイオノミシン(1μg/mL)により刺激した。細胞を、同定された上記細胞表面マーカーについて染色し、4℃で30分間固定し、抗CD16/CD32(eBioscience)の存在下でFoxp3/転写因子染色バッファセット(eBioscience)を用いて4℃で10分間透過させ、最後に透過化バッファ中の同定された上記サイトカイン特異的Absとともに室温で1時間インキュベーションされた。細胞はFACSFortessa (BD Biosciences) とFlowJoソフトウェア (Tree Star) を用いて解析された。
肺間質マクロファージ(IM)のセルソーティングのために、肺細胞懸濁液を調製し、上記のように免疫染色を行った。IMはCD45+CD64+CD24-CD11b+CD11c-生細胞として定義し、FACSAria(BD Biosciences)で200μLの溶解バッファ(Qiagen)を含む無菌RNaseフリーエッペンドルフに電子的にソーティングし、後mRNA分離のために使用した。ILC2s のセルソーティングのために、肺細胞懸濁液を調製し、上記のように免疫染色を行った。ILC2は、CD45+Lin-Thy1.2+CD127+ST2+生細胞として定義された。
In-vitro ILC2刺激
ソート精製のための細胞収量を最大化するために、マウスに0、2、4、6日目に1μgの組換えIL-33(BioTechne)を腹腔内注射した。マウスは7日目に淘汰され、肺はその後、細胞ソーティングのために前述のように処理され、染色された。
ソートしたILC2を、200uLのGlutaMAX培地(Gibco)(10%FBS、1%MEM Non-Essential Amino Acids Solution(100X)(Gibco)、1%Penicillin-Streptomycin(Sigma)、1%Sodium pyruvate solution 100mM(Sigma) およびβ-mercaptoethanol(Sigma)で補充)中で70,000細胞/ウェル(丸底プレート)密度でIL-7(25 ng/mL, Peprotech)と共にプレイティングした。細胞を、IL-33(20ng/mL、BioTechne)+個々のSCFAである酢酸塩(0.25mM)、ペンタン酸塩(0.25mM)、ヘキサン酸塩(0.25mM)、酪酸(0.25mM)、または最初の3つのSCFAを含むカクテル(酢酸、0.25mM;ペンタン酸、0.125mM;ヘキサン酸、0.125mM)により刺激した。細胞をCO2存在下、37℃で24時間インキュベートし、IL-13とIL-5の細胞内染色を行い、FACSFortessa (BD Biosciences) を用いて解析した。
肺組織サンプル中のサイトカインの免疫学的検出
肺組織は、PBSにプロテアーゼ阻害剤のカクテル(cOmplete ULTRA tablets, Mini; Roche)と直径1mmのジルコニア/シリカビーズ(BioSpec Products)を加えた2mL滅菌チューブ中で組織ホモジナイザーの助けを借りてホモジナイズした。ホモジネートは、細胞の残骸とビーズを取り除くために遠心分離し、使用するまで-80℃で保存した。サイトカイン濃度は、LEGENDplex Mouse Th1/Th2 および Mouse Cytokine Panel 2 キット(いずれもフローサイトメーター(Biolegend)を用いて可溶性分析物を定量するサンドイッチ ELISA の原理を用いたビーズベースアッセイ)を用いて、製造者の指示に従い評価した。サイトカイン濃度は、NanoDrop分光光度計(ThermoFisher)で測定した組織ホモジネート中の総タンパク質濃度を用いて正規化した。
血清サンプル中の抗体の免疫学的検出
血液は、成獣では頬袋から、仔獣では断頭から採取した。血清試料は、使用するまで-20℃で保存した。免疫グロブリンのアイソタイプの決定と血清濃度は、LEGENDplex Mouse Immunoglobulin Isotyping Panel (Biolegend) を用いて、製造者の指示に従い、評価された。
RNA単離、cDNA調製、リアルタイムPCR
mRNA は組織ホモジネートから RNeasy Mini Kit (Qiagen) を用いて調製した。逆転写は、Moloney murine leukemia virus reverse transcriptase (Promega) を用いて、ランダムオリゴヌクレオチド (Invitrogen) で42℃、1時間実施した。内因性参照Hprt、Actbまたはβ2ミクログロブリンに対する特定のcDNA種の相対定量は、ABI ViiA7サイクラー(Applied Biosystems)上でSYBRを用いて実施された。標的遺伝子のCTを内在性リファレンスの平均CTから差し引き、相対量を2-ΔCTとして算出した。
N. brasiliensisの感染
N. brasiliensisは、以前に記載したように、Sprague-Dawleyラットの連続継代によって維持した58。3齢幼虫(L3)を滅菌PBSで10回洗浄してから、マウスあたり300匹のL3を皮下感染させた。感染後 6 日目に肺を摘出し、実施する分析に応じた処理を行った。
組織学および病理組織学的解析
肺サンプルは10%中性緩衝ホルマリンで固定し、パラフィン包埋処理し、切片化し、ヘマトキシリン-エオシンで染色した。各スライドは、NanoZoomer-SQデジタルスライドスキャナーを用いてデジタル化した。肺気腫様損傷の定量化には、Linear Mean Intercepts(LMI)法を使用した。各肺のスライドをデジタル化した後、各肺の重ならない写真を10枚から20枚撮影した。画像はImageJソフトウェアで解析した。各写真に6本の水平線を引いた.LMIの計算には,線の長さに撮影枚数と1枚の写真中の線の数を掛け,線が肺胞を横切った回数の合計で割った.
抗生物質投与とSCFA補給
TCRδ-/-およびTCRδ+/-の雌雄成体マウスは、繁殖開始の少なくとも3週間前から飲料水に抗生物質の混合物(ストレプトマイシン5 mg/mL、アンピシリン1 mg/mL、コリスチン1 mg/mL、バンコマイシン 0.5 mg/mL; Sigma Aldrich)を加えて維持し、その後は既に述べたように交配させた。抗生物質の投与は、妊娠および育成の全期間にわたって継続された。
SCFAを直接補充するために、酢酸(2 mg/mL)、ペンタン酸(0.4 mg/mL)およびヘキサン酸(0.35 mg/mL)を含むカクテル50μLを、定常肺を分析する実験ではPN7から始まりPN13で終了し、N. brasiliensis感染に対する応答を分析する実験ではPN14から始まりPN20で終了して1週間ごとに i.p. 投与された。いずれの場合も、対照にはPBSを注射した。ダムに与える場合は、酢酸(50mM)、ペンタン酸(37.5mM)、ヘキサン酸(12.5mM)を含むSCFAカクテルを出産後2±1日目に飲料水に添加し、養育期間中保持させた。
16S rRNA遺伝子配列決定による微生物叢プロファイリング
サンプルはオートクレーブで滅菌したものを使用し、滅菌面にて採取した。糞便微生物叢は、1頭あたり2〜3個の糞便ペレットから評価した。皮膚マイクロバイオータは、1頭につき片耳を摘出した時点で評価した。膣内細菌叢は、30μLの滅菌PBSで膣内を洗浄したものから評価した。肺および盲腸粘膜関連細菌叢は、摘出した臓器全体から評価した。採取後すぐにサンプルを液体窒素でスナップ冷凍し、微生物のDNA抽出まで-80℃で保存した。抽出前に、直径1mmのオートクレーブしたジルコニア/シリカビーズ(BioSpec Products)を含む2mL滅菌チューブで、組織ホモジナイザーの助けを借りてサンプルをホモジナイズした。QIAamp Fast DNA Stool Mini kit (Qiagen)を用いて微生物ゲノムDNAを抽出した。16S rRNA V4アンプリコンとITS1-spanningアンプリコンは、いずれも以下のEarth Microbiome Project benchmarked protocolsを使用して生成した。アンプリコンは、Instituto Gulbenkian de Ciências (IGC) Genomics Unit (Oeiras, Portugal) の2×250bp PE mode Illumina MiSeqプラットフォームで配列決定された。
2つの独立したIllumina MiSeqランから得られた生配列は、最初にプールされ、ベルン大学のUBELIX Linuxクラスター(スイス、ベルン大学の高性能コンピューティング)で解析するためのカスタム解析スクリプトを用いてQIIME pipeline version 2で解析されました。アンプリコンシークエンスバリアントは、Greengenes (13_8) データベースを使用して、97%配列同一性閾値の特徴分類器classify-sklearn関数で割り当てられました59。QIIME2で生成されたタクソノミ、rep-seqs、rooted-treeファイルはRのphyloseq pipelineで呼び出され、α多様性(Simpson and Shannon index)、β多様性(NMDS plot上のBray-Curtis異質性)の計算とプロッティング、Adonis testによる統計解析はphyloseq pipelineを使用して行った60, 61,62,63...60 線形モデルによる多変量解析(MaAsLin2)を用いて、メタデータと微生物群集の存在量との関連を調べた(https://huttenhower.sph.harvard.edu/maaslin/)64。サンプルの30%以上に存在し、総存在量の0.001%超の分類群をさらなる解析のカットオフ値として設定した。Benjamini-Hochberg の偽発見率補正後、修正 p 値 (<0.05 または <0.2) を有意とみなした。
メタゲノム機能内容の予測は、16S配列データを用いてPICRUSt2(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)パイプラインで行った65 PICRUSt2予測はレベル1~3に分類し、さらにKyoto Encyclopedia of Genes and Genomesパスウェイに分類されるようにした。
SCFA測定
試料分析は、MS-Omics(www.msomics.com)により、以下のように行った。盲腸に超純水を加えて抽出したサンプル(30mg未満のサンプルには100μL、それ以上のサンプルには150μL)。濾過した盲腸水に重水素標識内部標準物質を加え、MTBEと混合してさらに抽出し、直接注入バイアルに注入した。すべてのサンプルはランダムな順序で分析された。分析は、四重極検出器 (5977B, Agilent) と組み合わせた GC (7890B, Agilent) に設置した高極性カラム (ZebronTM ZB-FFAP, GC Cap. Column 30 m × 0.25 mm × 0.25μm) で実施した。システムは ChemStation (Agilent)で制御しました。生データは、ChemStation (Agilent) を使用して netCDF 形式に変換してから、データをインポートして処理しました。GC-MS の生データは、MS-Omics と共同研究者によって開発されたソフトウェアで処理されました。このソフトウェアは強力なPARAFAC2モデルを使用しており、他の多くのGC-MSソフトウェアよりも多くの化合物ときれいなMSスペクトルを抽出することができます。
文献レビュー
2019年5月にPubMedデータベースで、「γδT細胞 AND 感染」「γδT細胞 AND 感染」のキーワードで検索を行った。その上で、TCRδ-/-マウスを用いた研究を、対照として同腹のマウスまたは遺伝的背景を合わせたマウスを用いたかどうかで分けた。ジャーナルは、文献検索時のインパクトファクターで分けた。
定量化・統計解析
統計解析
ほとんどの実験では、特に断りのない限り、3つの独立した産駒をプールした。母集団間の差の統計的有意性は、スチューデントのt検定または両側ノンパラメトリックのMann-Whitney U検定を用いて評価した(該当する場合)。グループ化された統計解析には、二元配置分散分析が採用された。p値<0.05は有意とみなし、図に示した。
データおよびコードの入手方法
16S rRNAアンプリコンシーケンスのデータセットと処理ファイル、使用したサンプルの全詳細は、以下のリンクからダウンロードできます: https://figshare.com/s/77865dbbf0daab588b8d (https://doi.org/10.6084/m9.figshare.15121245). 本論文で報告されたデータの再解析に必要な追加情報は、共著者のBahtiyar Yilmaz (bahtiyar.yilmaz@unibe.ch) からリクエストに応じて入手可能です。本論文では、オリジナルのコードは報告していません。
謝辞
iMMのげっ歯類研究施設、特にIolanda Moreira、Pedro Santos、Bruno Novais、フローサイトメトリーユニットのスタッフの貴重な技術的支援に感謝する。また、The University of ManchesterのBiological Services FacilityとFlow Cytometry Facilityのスタッフにも感謝したい。また、Instituto Gulbenkian de CiênciaとMS-OmicsのRodent FacilityとGenomics Unitのサービスにも感謝する。原稿を批判的に読んでくださったMarc Veldhoen氏、有益な議論と技術的助言をいただいたDebanjan Mukherjee、Helena Brigas、Julie C. Ribot、Karine Serre、Ana Pamplona、Julie Darrigues,57 Julie Chesné、Vânia Cardoso、Enrique Veiga-Fernandes (Champalimaud Center for the Unknown), James Parkinson (University of Manchester) およびZiad Al Nabhani (University of Bern) にも感謝いたします。この研究は、Fundação para a Ciência e a Tecnologia (PTDC/MED-ONC/6829/2020 to B.S.-S.);European Molecular Sciences (P.S.-S.) から資金提供を受けている。 S.); European Molecular Biology Organization (LTF 191-2019 to P.H.P. and ALTF 252-2017 to G.J.F.); European Commission Marie Sklodowska-Curie Individual Fellowship (refs. 101025781 to P.H.P. and 752932 to G.J.F.); a Swiss National Foundation (SNF) Ambizione Grant (PZ00P3_185880 to B. B.), Y. Y.); the Novartis Foundation for Medical-Biological Research (#19A013 to B.Y.); the Sir Henry Dale Fellowship jointly funded by the Wellcome Trust and the Royal Society (105644/Z/14/Z to M.R.H.); the BBSRC (BB/T014482/1 to M.R.H.); and the Wellcome Trust (106898/A/15/Z to J.E.A.)(WEBT は J. E. A.と共同).
著者の貢献
構想、P.H.P.およびB.S.-S.、方法論および調査、B.Y.、G.P.、S.M.、C.C、G.J.F、D.G.d.C、N.G.-S、B.H.K.C、B.B、R.G.D、T.C、M.R.H. 、A.J.M.., およびJ.E.A.;データ解析、P.H.P., B.Y., G.P.;リソース、B.H.K.C. およびJ.E.A.;執筆 - 原案、P.H.P. およびB.S.-S.;執筆 - レビューおよび編集、P.H.P., B.Y., J.E.A. および B.S.-S.
利害関係の宣言
著者らは、競合する利害関係を宣言しない。
補足情報
pdfをダウンロード (3.14 MB)
pdfファイルに関するヘルプ
ドキュメントS1. 図S1-S13、表S1
参考文献
Brodin P.
人生の早い段階で免疫-微生物相互作用:健康と病気の長期的な決定因子。
Science. 2022; 376: 945-950
https://doi.org/10.1126/science.abk2189
記事で見る
スコープス (7)
PubMed
クロスリファレンス
グーグル奨学生
田中幹夫
中山淳一
乳幼児期の腸内細菌叢の発達とその後の健康への影響。
Allergol. Int. 2017; 66: 515-522
https://doi.org/10.1016/j.alit.2017.07.010
記事で見る
スコープス(293)
パブコメ
アブストラクト
全文
全文PDF
Google Scholar
アル・ナバニ Z.
Dulauroy S.
マルケスR.
Cousu C.
アル・バウニー S.
デジャルダン F.
スパルワッサー T.
ベラール M.
セルフ・ベンサンN.
エベール G.
成体における免疫病理学的抵抗性には、微生物叢に対する離乳反応が必要である。
Immunity. 2019; 50: 1276-1288.e5
https://doi.org/10.1016/j.immuni.2019.02.014
記事で見る
スコープス(227)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
ヴァムパック L.
ハインツ-ブシャートA.
フリッツJ.V.
ラミロ-ガルシアJ.
ハビアー J.
ヘロルド M.
ナラヤナサミーS.
ケイセン A.
ホーガン A.H.
ビンドルL.
他
出生形態は、最も早い時期に株分けされた腸内細菌群の機能および免疫賦活能と関連している。
Nat. Commun. 2018; 9: 5091
https://doi.org/10.1038/s41467-018-07631-x
記事で見る
スコープス (135)
パブコメ
クロスレフ
グーグル奨学生
ゴメス・デ・アグエロM.
ガナル・ヴォナルブルグS.C.
フーラーT.
ルップ S.
内村 陽子
リー H.
シュタイナート A.
ハイケンワルダー M.
ハプフェルマイヤーS.
ザウアー U.
他
母体微生物叢は生後早期の自然免疫の発達を促進する。
サイエンス. 2016; 351: 1296-1302
https://doi.org/10.1126/science.aad2571
記事で見る
スコープス (666)
パブコメ
クロスリファレンス
グーグル奨学生
ラマナンD.
セフィクE.
ガルバン-ペーニャS.
Wu M.
ヤン L.
ヤン Z.
コスティッチ A.
ゴロフキナ T.V.
カスパー D.L.
マチスD.
ブノイスト C.
多世代伝達の免疫学的モードが支配するa.
Cell. 2020; 181: 1276-1290.e13
https://doi.org/10.1016/j.cell.2020.04.030
記事で見る
スコープス (60)
パブコメ
概要
全文
全文PDF
Google Scholar
ソーバーン A.N.
マッケンジーC.I.
シェン S.
スタンレーD.
マシア L.
メイソン L.J.
ロバーツ L.K.
ウォン・C.H.Y.
シム R.
ロバートR.
他。
喘息が母親の食事と細菌の代謝産物に影響される発達起源疾患であることを示す証拠。
Nat. Commun. 2015; 6: 7320
https://doi.org/10.1038/ncomms8320
記事で見る
スコープス (522)
PubMed
クロスリファレンス
グーグル奨学生
レンツ H.
Skevaki C.
幼少期の微生物曝露とアレルギーリスク:予防のための機会。
Nat. Rev. Immunol. 2021; 21: 177-191
https://doi.org/10.1038/s41577-020-00420-y
記事で見る
スコープス (70)
PubMed
クロスリファレンス
グーグル奨学生
デクレアI.M.
Kool M.
デ・ブルーインM.J.W.
ウィラート M.
ファン・モーレヘムJ.
シュイス M.J.
プランティンガ M.
ベヤート R.
ハムス E.
ファロンP.G.
他
インターロイキン-33経路の周産期の活性化は、発達中の肺における2型免疫を促進する。
Immunity. 2016; 45: 1285-1298
https://doi.org/10.1016/j.immuni.2016.10.031
記事で見る
スコープス (210)
パブコメ
アブストラクト
全文
全文PDF
Google Scholar
サルッツォ S.
ゴーリキー A.D.
ラナ B.M.J.
マルティンスR.
スカンロン S.
シュタルクルP.
ラコヴィッツ K.
フラディック A.
コロセック A.
シャリフO.
他。
初呼吸による2型経路は肺の免疫環境を形成する。
セル・レップ 2017; 18: 1893-1905
https://doi.org/10.1016/j.celrep.2017.01.071
記事で見る
スコープス (148)
PubMed
概要
全文
全文PDF
Google Scholar
スタッペンベック T.S.
ヴァージン H.W.
実験科学における宿主-微生物相互作用の会計処理。
ネイチャー. 2016; 534: 191-199
https://doi.org/10.1038/nature18285
記事で見る
スコープス (154)
PubMed
クロスリファレンス
グーグル奨学生
木村勇一
宮本淳一
大上・北野亮子
渡辺和男
山田哲也
大貫正夫
青木理恵子
磯部陽一
樫原大輔
井上大輔
他
妊娠中の母親の腸内細菌叢は、マウスの子孫の代謝表現型に影響を与える。
Science. 2020; 367eaaw8429
https://doi.org/10.1126/science.aaw8429
記事で見る
スコープス (145)
クロスリファレンス
Google Scholar
マクファーソン A.J.
デアグエロM.G.
Ganal-Vonarburg S.C.。
どのように栄養と母親の微生物叢は、新生児の免疫系を形成する。
Nat. Rev. Immunol. 2017; 17: 508-517
https://doi.org/10.1038/nri.2017.58
記事で見る
スコープス(201)
PubMed
クロスリファレンス
グーグル奨学生
ペレス M.F.
レナーB.
動物における世代間および世代を超えたエピジェネティックな遺伝。
Nat. Cell Biol. 2019; 21: 143-151
https://doi.org/10.1038/s41556-018-0242-9
記事で見る
スコープス(236)
PubMed
クロスレフ
グーグル奨学生
糸原重美
ファーA.G.
ラファイユJ.J.
ボンヌヴィル M.
高垣由美子
ハース W.
利根川 聡
均一なT細胞受容体を持つガンマ・デルタ胸腺細胞サブセットの粘膜上皮へのホーミング。
Nature. 1990; 343: 754-757
https://doi.org/10.1038/343754a0
記事で見る
スクープ (461)
パブコメ
クロスリファレンス
グーグル奨学生
ピンゲG.V.
コーパスT.M.
ストルプJ.
ルースバーグ E.L.
ディエナー K.R.
ロバートソンS.A.
スプリントJ.
ウェブスター K.E.
妊娠中の母体-胎児界面に存在するマウス・ガンマデルタT細胞の大半はIL-17を産生する。
Immunol. セルバイオル. 2016; 94: 623-630
https://doi.org/10.1038/icb.2016.48
記事で見る
スコープス(37)
PubMed
Crossref
グーグル奨学生
モナン L.
ウシャコフD.S.
アルネセンH.
バーN.
ジャンドケ A.
ムニョス-ルイーズ M.
カルヴァーリョ J.
ジョセフ S.
アルメイダB.C.
グリーンM.J.
他
ガンマデルタT細胞は、発生学的に制御された子宮内集団を構成し、膣カンジダ症から保護する。
Mucosal Immunol. 2020; 13: 969-981
https://doi.org/10.1038/s41385-020-0305-7
記事で見る
スコープス (21)
パブコメ
概要
全文
全文PDF
Google Scholar
コニング F.
スティングル G.
横山和正
山田 浩二
マロイ W.L.
ツァクラーE.
シェバッハE.M.
コリガン J.E.
Thy-1+樹状突起表皮細胞株におけるT3関連γδT細胞受容体の同定。
Science. 1987; 236: 834-837
https://doi.org/10.1126/science.2883729
記事で見る
スコープス (186)
PubMed
クロスリファレンス
グーグル奨学生
ニールセン M.M.
ウィザーデンD.A.
Havran W.L.
上皮バリア組織のホメオスタシスと宿主防御におけるガンマデルタT細胞
Nat. Rev. Immunol. 2017; 17: 733-745
https://doi.org/10.1038/nri.2017.101
記事で見る
スコープス (248)
PubMed
クロスリファレンス
グーグル奨学生
レアルドン C.
ルフランコアL.
ファーA.
久保 亮
オブライエンR.
Born W.
授乳期乳腺のリンパ球におけるガンマ/デルタT細胞レセプターの発現。
J. Exp. Med. 1990; 172: 1263-1266
https://doi.org/10.1084/jem.172.4.1263
記事で見る
スコープス (29)
クロスリファレンス
Google Scholar
藤橋和彦
マクギーJ.R.
Kweon M.N.
クーパー・M.D.
利根川 聡
高橋 勇
廣井 徹
メステッキーJ.
清野 肇
γ/δT細胞欠損マウスは粘膜免疫グロブリンA反応が損なわれている。
J. Exp. Med. 1996; 183: 1929-1935
https://doi.org/10.1084/jem.183.4.1929
記事で見る
スコープス (162)
PubMed
クロスリファレンス
グーグル奨学生
レゼンデR.M.
ランサーA.J.
ルビーノ S.
クーンC.
スキリン N.
モレイラ T.G.
リュー S.
ガブリエリ G.
デビッドB.A.
メネゼスG.B.
ワイナ- H.L.
T濾胞ヘルパー細胞の分化を誘導することにより体液性免疫応答を制御するガンマデルタT細胞。
Nat. Commun. 2018; 9: 3151
https://doi.org/10.1038/s41467-018-05487-9
記事で見る
スコープス(25)
クロスリファレンス
グーグルスカラー
カイラルラ C.
チュー T.H.
シェリダン B.S.
メモリーおよび組織内常在ガンマδT細胞の組織適応。
フロント。Immunol. 2018; 9: 2636
https://doi.org/10.3389/fimmu.2018.02636
記事で見る
スコープス (68)
PubMed
クロスレフ
グーグル奨学生
パポットP.H.
ユルマズB.
シルバ-サントスB.
ガンマデルタT細胞と微生物叢の間のクロストーク。
Nat. Microbiol. 2021; 6: 1110-1117
https://doi.org/10.1038/s41564-021-00948-2
記事で見る
スコープス (16)
PubMed
クロスリファレンス
グーグル奨学生
クリシュナン S.
プリセI.E.
ウェミスK.
シェンクL.P.
ブリッジマンH.M.
マクルア F.A.
ザンゲル・マーレー・T
オボイル C.
バーベラ T.A.
マフムードF.
他。
アンフィレグリン産生ガンマデルタT細胞は、口腔バリアの免疫恒常性を維持するために不可欠である。
Proc. Natl. Acad. Sci. USA. 2018; 115: 10738-10743
https://doi.org/10.1073/pnas.1802320115
記事で見る
スコープス (52)
パブコメ
クロスリファレンス
グーグル奨学生
ウィルハルムA.
タビブ・Y.
ナサールM.
ラインハルト A.
ミズラジ G.
サンドロックI.
ヘイマン O.
バロス=マルティンス J.
アイゼンブド Y.
Khalaileh A.
他
IL-17産生gammadeltaT細胞と微生物叢の相互作用が口腔粘膜のホメオスタシスを制御している。
Proc. Natl. Acad. Sci. USA. 2019; 116: 2652-2661
https://doi.org/10.1073/pnas.1818812116
記事で見る
スコープス (52)
PubMed
クロスリファレンス
グーグル奨学生
ヴァン・ダイケン S.J.
モハパトラA.
ヌスバウムJ.C.
モロフスキーA.B.
ソーントン E.E.
ジーグラーS.F.
マッケンジーA.N.J.
クルメルM.F.
リャン・H.E.
ロックスリー R.M.
キチンは、自然リンパ系2型細胞およびハマドエルタT細胞を介して、異なる炎症反応を誘導する並列免疫モジュールを活性化する。
Immunity. 2014; 40: 414-424
https://doi.org/10.1016/j.immuni.2014.02.003
記事で見る
スコープス (180)
パブコメ
概要
全文
全文PDF
Google Scholar
サザーランド T.E.
ローガンN.
リュッケルD.
ハンブルスA.A.
アラン S.M.
パパイヤノプロスV.
ストッキンガー B.
マイゼルスR.M.
アレン J.E.
キチナーゼ様タンパク質は、線虫の殺傷と宿主のダメージの間のトレードオフにおいて、IL-17を介した好中球増加を促進する。
Nat. Immunol. 2014; 15: 1116-1125
https://doi.org/10.1038/ni.3023
記事で見る
スコープス (140)
PubMed
クロスリファレンス
グーグル奨学生
アジェンドラJ.
チェネリーA.L.
パーキンソンJ.E.
チャン・B.H.K.
ピアソン S.
コロンボ S.A.P.
ブーン L.
グレンシスR.K.
サザーランドT.E.
アレン J.E.
IL-17AはIFNγの抑制を介して線虫感染に対する肺の2型免疫反応を開始し、また制限する。
Mucosal Immunol. 2020; 13: 958-968
https://doi.org/10.1038/s41385-020-0318-2
記事で見る
スコープス (24)
パブコメ
概要
全文
全文PDF
Google Scholar
陳 福。
Liu Z.
Wu W.
ロゾ C.
ボウドリッジ S.
ミルマンA.
ヴァン・ルイエン N.
アーバン・ジュニア・J.F.
ウィン・T.A.
Gause W.C.
実験的蠕虫感染時の急性組織損傷の抑制におけるTH2型応答の本質的役割。
Nat. Med. 2012; 18: 260-266
https://doi.org/10.1038/nm.2628
記事で見る
スコープス (322)
パブコメ
クロスリファレンス
グーグル奨学生
ウォルター M.J.
梶原直樹
カランジャP.
カストロ M.
ホルツマン M.J.
気道炎症時のバリア上皮細胞によるインターロイキン12 p40の産生。
J. Exp. Med. 2001; 193: 339-351
https://doi.org/10.1084/jem.193.3.339
記事で見る
スコープス (142)
パブコメ
クロスリファレンス
グーグル奨学生
大崎晃一
ヴェントゥレッリ N.
ブチグロッソT.M.
オスガニアン S.K.
リー J.
ブルムバーグ R.S.
大吉 美紀子
母体IgG免疫複合体は食物アレルゲン特異的耐性を子孫に誘導する。
J. Exp. Med. 2018; 215: 91-113
https://doi.org/10.1084/jem.20171163
記事で見る
スコープス (77)
パブコメ
クロスリファレンス
グーグル奨学生
カルーソ R.
小野真由美
バンカー M.E.
ヌニェスG.
猪原直樹
実験用マウスの同居後の微生物群集の動的かつ非対称的な変化。
セル・リップ(Cell Rep.) 2019; 27: 3401-3412.e3
https://doi.org/10.1016/j.celrep.2019.05.042
記事で見る
スコープス (41)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
パポット P.H.
リボットJ.C.
シルバ-サントスB.
炎症のキックスターターとしてのIL-17(+) ガンマデルタT細胞。
Nat. Immunol. 2017; 18: 604-611
https://doi.org/10.1038/ni.3726
記事で見る
スコープス (167)
PubMed
クロスリファレンス
グーグル奨学生
クマールP.
モナンL.
カスティーリョP.
エルゼゲイニィ・W.
ホーンW.
エデンス T.
ヴィクラムA.
グッド M.
シェーンボーンA.A.
ビビーK.
他。
腸管インターロイキン-17受容体シグナルは、腸内細菌叢と自己免疫炎症の相互制御を媒介する。
Immunity. 2016; 44: 659-671
https://doi.org/10.1016/j.immuni.2016.02.007
記事で見る
スコープス (192)
パブコメ
概要
全文
全文PDF
Google Scholar
ゼネヴィッツ L.A.
Yin X.
Wang G.
エリナヴ E.
Hao L.
Zhao L.
Flavell R.A.
IL-22欠損は大腸菌叢を変化させ、伝達性と結腸原性を有する。
J. Immunol. 2013; 190: 5306-5312
https://doi.org/10.4049/jimmunol.1300016
記事で見る
スコープス (181)
PubMed
クロスリファレンス
グーグル奨学生
アフジャ M.
シュワルツD.M.
タンドン M.
ソン A.
Zeng M.
スウェイム W.
エックハウス M.
ホフマン V.
Cui Y.
Xiao B.
他
Orai1を介した膵頭蓋からの抗菌剤分泌は、腸内細菌叢を形成し、腸の自然免疫を制御している。
Cell Metabol. 2017; 25: 635-646
https://doi.org/10.1016/j.cmet.2017.02.007
記事で見る
スコープス (84)
パブコメ
概要
全文
全文PDF
Google Scholar
ランギル M.G.I.
ザネベルト J.
カポラソJ.G.
マクドナルドD.
ナイツD.
レイエスJ.A.
クレメンテJ.C.
バークパイルD.E.
ベガ・サーバーR.L.
ナイトR.
他
16S rRNA マーカー遺伝子配列を用いた微生物群集の予測的機能プロファイリング。
Nat. Biotechnol. 2013; 31: 814-821
https://doi.org/10.1038/nbt.2676
記事で見る
スクープ (5744)
パブコメ
クロスリファレンス
グーグル奨学生
Zhang L.
Wu W.
リー Y.K.
Xie J.
Zhang H.
豚腸管における粘膜および管腔マイクロバイオームの空間的不均質性と共起性。
Front. Microbiol. 2018; 9: 48
https://doi.org/10.3389/fmicb.2018.00048
記事で見る
スコープス(101)
クロスリファレンス
グーグルスカラー
He Z.
Ma Y.
ヤン S.
Zhang S.
Liu S.
Xiao J.
Wang Y.
Wang W.
Yang H.
Li S.
Cao Z.
新生児乳牛の腸内細菌叢由来のウルソデオキシコール酸は、腸のホメオスタシスと大腸炎を改善し、拡張スペクトラムβラクタマーゼ産生性腸管凝集性大腸菌感染を減弱させる。
Microbiome. 2022; 10: 79
https://doi.org/10.1186/s40168-022-01269-0
記事で見る
スコープス (7)
クロスリファレンス
Google Scholar
チオ C.L.P.
チー・P.Y.
ライ・A.C.Y.
Chang Y.J.
酪酸による2型自然免疫系リンパ球依存性気道過敏症の制御。
J. Allergy Clin. Immunol. 2018; 142: 1867-1883.e12
https://doi.org/10.1016/j.jaci.2018.02.032
記事で見る
スコープス (90)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
セレンコ・ゲバウアー N.
Majdic O.
Szekeres A.
ヘフラーG.
グータン E.
コルトーア U.
ツラビンガーG.
シュタインベルガーP.
ピックル W.F.
シュトッキンガーH.
他
樹状細胞上のB7-H1(programmed death-1 ligand)は、T細胞アレルギーの誘導と維持に関与している。
J. Immunol. 2003; 170: 3637-3644
https://doi.org/10.4049/jimmunol.170.7.3637
記事で見る
スコープス (242)
パブコメ
クロスリファレンス
グーグル奨学生
ガンドラ U.M.
ギルギスN.M.
ラッカールD.
ジェンキンスS.
ウォードL.N.
カーツ Z.D.
ウィーンズ K.E.
タン・M.S.
バス-ロイU.
Mansukhani A.
他
単球および組織マクロファージ由来の交互活性化マクロファージは、表現型および機能的に異なる。
Blood. 2014; 123: e110-e122
https://doi.org/10.1182/blood-2013-08-520619
記事で見る
スコープス(233)
PubMed
クロスリファレンス
グーグル奨学生
ブロディーンP.
ヨジッチV.
Gao T.
バッタチャリヤ S.
エンジェル C.J.L.
ファーマン D.
シェンオール S.
デッカー C.L.
スワンG.E.
ビュート A.J.
他
ヒトの免疫系の変異は、遺伝的でない影響によって大きく左右される。
Cell. 2015; 160: 37-47
https://doi.org/10.1016/j.cell.2014.12.020
記事で見る
スコープス (616)
パブコメ
概要
全文
全文PDF
Google Scholar
オルツァーク T.
アンD.
ツァイッシグ S.
ヴェラ M.P.
リヒター J.
フランケ A.
グリックマンJ.N.
シーベルトR.
バロンR.M.
カスパーD.L.
Blumberg R.S.。
幼少期の微生物曝露は、ナチュラルキラーT細胞機能に持続的な影響を及ぼす。
サイエンス。2012; 336: 489-493
https://doi.org/10.1126/science.1219328
記事で見る
スコープス (1176)
パブコメ
クロスリファレンス
グーグル奨学生
ムーンC.
ボルドリッジM.T.
ウォレスM.A.
バーナムC.A.D.
スタッペンベック T.S.
ヴァージンH.W.
スタッペンベック T.S.(英名:Stappenbeck T.S.
糞便中IgA濃度の垂直伝播は染色体外の表現型変異を決定する。
Nature. 2015; 521: 90-93
https://doi.org/10.1038/nature14139
記事で見る
スコープス(165)
PubMed
クロスリファレンス
グーグル奨学生
ロバートソン S.J.
ルミールP.
モーンH.
ゲーテル A.
ターピン W.
ベドラーニL.
ガットマンD.S.
クロイツル K.
ジラルディンS.E.
フィルポット D.J.
マウスモデルにおける微生物叢の標準化のためのCo-housing法とlittermate法の比較。
セル・リップ(Cell Rep.) 2019; 27: 1910-1919.e2
https://doi.org/10.1016/j.celrep.2019.04.023
記事で見る
スコープス(88)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
オスタッフ M.J.
シュタンゲE.F.
ウェカンプ J.
抗菌ペプチドと腸内細菌叢のホメオスタシスおよび病理学的研究。
EMBO Mol. Med. 2013; 5: 1465-1483
https://doi.org/10.1002/emmm.201201773
記事で見る
スコープス (220)
PubMed
クロスリファレンス
グーグル奨学生
ラール K.
スウィーアJ.
パン J.
ブッチャー E.
Orphan chemoattractant receptor GPR15 mediates dendritic epidermal T-cell recruitment to the skin.(希少化学誘引物質受容体GPR15は樹状突起表皮T細胞の皮膚へのリクルートメントを媒介する).
Eur J Immunol. 2014; 44 (2577-2581)
https://doi.org/10.1002/eji.201444628
記事で見る
スコープス(34)
クロスリファレンス
グーグルスカラー
セジン T.
ジェゴジンスキーL.
メイネL.M.
グプタ Y.
ムサビ S.
ルドウィグ R.J.
ジリケンズ D.
サディック C.D.
Gタンパク質共役型受容体15(GPR15)は、樹状突起表皮T細胞の維持と皮膚マイクロバイオームの制御により皮膚免疫学を制御している。
Eur. J. Immunol. 2021; 51: 1390-1398
https://doi.org/10.1002/eji.202048887
記事で見る
スクープ (1)
クロスリファレンス
Google Scholar
フェレッティ P.
パゾッリE.
テット A.
アスニカーF.
ゴルファー V.
フェディ S.
アルマニーニF.
チュオンD.T.
マナラ S.
ゾルフォM.
他。
母親から乳児への異なる身体部位からの微生物伝播は、発達中の乳児の腸内細菌叢を形成する。
Cell Host Microbe. 2018; 24: 133-145.e5
https://doi.org/10.1016/j.chom.2018.06.005
記事で見る
スコープス (492)
PubMed
アブストラクト
全文
全文PDF
Google Scholar
マッカーシー K.M.
ゴン J.L.
テルフォードJ.R.
シュネーベルガー E.E.
ラット胎児および新生児肺におけるIa+アクセサリー細胞の個体発生。
Am. J. Respir. Cell Mol. 生物学 1992; 6: 349-356
https://doi.org/10.1165/ajrcmb/6.3.349
記事で見る
スコープス (32)
PubMed
クロスリファレンス
グーグル奨学生
ルウ M.
パウツ S.
コール V.
シンR.
ロメロR.
ルーカス S.
ホフマン J.
ライファー H.
ヴァーチャラジャニ N.
カラスコサL.C.
他
短鎖脂肪酸ペンタノエートは、リンパ球の代謝-エピジェネティッククロストークを調節することにより、自己免疫を抑制する。
Nat. Commun. 2019; 10: 760
https://doi.org/10.1038/s41467-019-08711-2
記事で見る
スコープス(177)
パブコメ
クロスリファレンス
グーグル奨学生
ルウ M.
リースターZ.
バルドリッチA.
ライカールト N.
ユイル S.
ブセッティA.
クライン M.
ウェンペ A.
ライスター H.
ライファーH.
他。
微生物性短鎖脂肪酸は、CD8(+)T細胞応答を調節し、癌の養子免疫療法を改善する。
Nat. Commun. 2021; 12: 4077
https://doi.org/10.1038/s41467-021-24331-1
記事で見る
スコープス (77)
PubMed
クロスリファレンス
グーグル奨学生
Bäckhed F.
ロスウォールJ.
Peng Y.
Feng Q.
Jia H.
Kovatcheva-Datchary P.
Li Y.
Xia Y.
Xie H.
Zhong H.
他。
生後1年間のヒト腸内細菌叢の動態と安定化。
Cell Host Microbe. 2015; 17: 852
https://doi.org/10.1016/j.chom.2015.05.012
記事で見る
スコープス (256)
PubMed
概要
全文
全文PDF
Google Scholar
ラスムッセン M.A.
ソルセン J.
ドミンゲス-ベロM.G.
ブレーザー M.J.
モルテンセン M.S.
ブリュンロッドA.D.
シャー・S.A.
ヒェルムソ・M.H.
レヒティマキ J.
Trivedi U.
他。
妊娠・出産時の膣内細菌叢における生態学的継承。
ISME J. 2020; 14: 2325-2335
https://doi.org/10.1038/s41396-020-0686-3
記事で見る
スコープス (27)
PubMed
クロスリファレンス
グーグル奨学生
ユルマズB.
ムーサーC.
ケラー I.
Li H.
Zimmermann J.
ボスハルトL.
フューラー T.
ゴメス・デ・アギュエロ M.
トリゴ N.F.
ツァンツ=リッシャーH.
他
マウスにおける微生物叢の長期的進化と短期的適応。
Cell Host Microbe. 2021; 29: 650-663.e9
https://doi.org/10.1016/j.chom.2021.02.001
記事で見る
スコープス(21)
パブコメ
概要
全文
全文PDF
Google Scholar
ローレンス R.A.
グレイC.A.
オズボーン J.
Maizels R.M.
Nippostrongylus brasiliensis:正常マウスおよびIL-4欠損マウスにおけるサイトカイン反応と線虫の排出。
Exp. Parasitol. 1996; 84: 65-73
https://doi.org/10.1006/expr.1996.0090
記事で見る
スコープス (83)
PubMed
クロスリファレンス
グーグル奨学生
マクドナルドD.
プライスM.N.
グッドリッチJ.
ナウロッキ E.P.
デサンティス T.Z.
プロブスト A.
アンデルセン G.L.
ナイト R.
Hugenholtz P.
バクテリアとアーキアの生態学的・進化学的解析のための、ランクを明示した改良型Greengenes分類法。
ISME J. 2012; 6: 610-618
https://doi.org/10.1038/ismej.2011.139
記事で見る
スコープス (3418)
PubMed
クロスリファレンス
グーグル奨学生
カポラソJ.G.
クチンスキーJ.
ストンボーJ.
ビッティンガーK.
ブッシュマンF.D.
コステロE.K.
フィエラー N.
ペーニャ A.G.
グッドリッチ・J.K.
ゴードン J.I.
他
QIIMEによりハイスループットなコミュニティシークエンスデータの解析が可能になった。
Nat. Methods. 2010; 7: 335-336
https://doi.org/10.1038/nmeth.f.303
記事で見る
スコープス (24506)
パブコメ
クロスリファレンス
グーグル奨学生
ボリエン E.
ライドアウトJ.R.
ディロンM.R.
ボクリッチN.A.
アブネット C.C.
アル・ガリスG.A.
アレクサンダーH.
アルム E.J.
アルムガムM.
アスニカーF.
他
QIIME 2を用いた再現性、対話性、拡張性のあるマイクロバイオームデータサイエンス。
Nat. Biotechnol. 2019; 37: 852-857
https://doi.org/10.1038/s41587-019-0209-9
記事で見る
スコープス (5787)
パブコメ
クロスレフ
グーグル奨学生
マクマーディP.J.
ホームズS.
phyloseq:マイクロバイオームセンサスデータの再現性の高いインタラクティブな解析とグラフィックスのためのRパッケージ。
PLoS One. 2013; 8e61217
https://doi.org/10.1371/journal.pone.0061217
記事で見る
日本経済新聞
パブコメ
クロスリファレンス
グーグル奨学生
Yilmaz B.
ジュエラットP.
オヨス O.
ラモン C.
ブラボー F.D.
フラン Y.
フルニエ N.
ミケッティP.
ミューラー C.
ゲーキング M.
他。
再発性難治性クローン病における微生物ネットワークの乱れ。
Nat. Med. 2019; 25: 323-336
https://doi.org/10.1038/s41591-018-0308-z
記事で見る
スコープス (178)
パブコメ
クロスレフ
グーグル奨学生
マリック H.
ラーナバードA.
マカイバーL.J.
マー S.
ザン Y.
グエン L.H.
ティックル T.L.
ウェインガート G.
レン B.
シュワガーE.H.
他。
集団規模のメタオミクス研究における多変量関連発見。
bioRxiv. 2021; (プレプリントアット)
https://doi.org/10.1101/2021.01.20.427420
記事で見る
スコープス (0)
クロスリファレンス
Google Scholar
ダグラス・G.M.
マッフェイ V.J.
ザネベルトJ.R.
ユルゲルS.N.
ブラウン J.R.
テイラーC.M.
ハッテンハワーC.
ランギル M.G.I.
PICRUSt2 によるメタゲノム機能予測。
Nat. Biotechnol. 2020; 38: 685-688
https://doi.org/10.1038/s41587-020-0548-6
記事で見る
スコープス (1218)
PubMed
クロスリファレンス
Google Scholar
記事情報
出版履歴
オンライン公開 2023年2月13日
受理されました。2023年1月23日
改訂版受理 2022年12月21日
受理:2021年8月5日 2021年8月5日
出版段階
インプレス、修正プルーフ
識別番号
DOI: https://doi.org/10.1016/j.celrep.2023.112074
著作権について
© 2023 The Author(s).
ユーザーライセンス
クリエイティブ・コモンズ 表示 (CC BY 4.0) | 情報アイコンを再利用する方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図のサムネイルfx1
図版の概要
図のサムネイル gr1
図1母体のγδT細胞の欠如は、子供の初呼吸による2型炎症を悪化させる。
図1母体のγδT細胞の欠如が子供の初呼吸による2型炎症を悪化させる
図2母体による初呼吸誘発性炎症の制御は分娩時および養育中に行われる
図3.gr3
図3母体による子供の初呼吸誘発炎症の制御は、マイクロバイオータに依存するが、抗体には依存しない
図3.gr4
図4TCRδ+/-とTCRδ-/-のダムは同居しても皮膚微生物叢と抗菌ペプチドプロファイルが別個であることがわかる
図3.gr5
図5γδ欠損ダムを産んだ仔は、γδ欠損ダムを産んだ仔と比較して、SCFA産生量が増加し、生後分離した腸内細菌叢を獲得する。
図1.図2.図3.図4.図5.図6
図6子実体の微生物叢由来のSCFAは、悪化した周産期の肺の2型炎症反応を抑制する
図1.gr7
図7 γδT細胞欠損ダムの子孫におけるN. brasiliensis感染に対する増悪した反応を制御するSCFAs
関連記事
広告掲載
研究雑誌
細胞
癌細胞
セルケミカルバイオロジー
細胞ゲノミクス
細胞宿主・微生物
細胞代謝
セルレポート
セルレポートメディスン
セルレポート メソッド
セルレポート物理科学
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
デバイス
ヘリオン
イミュニティ
アイサイエンス
ジュール
マター
メド
分子細胞
ニューロン
地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理学ジャーナル
生物物理学レポート
HGGアドヴァンス
分子植物
分子療法ファミリー
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレス・レビュー
セルプレスセレクション
コンソーティアハブ
Nucleus コレクション
スナップショット・アーカイブ
ジャーナルを越えて
Cellキャリアネットワーク
セルメンター
細胞シンポジューム
ラボリンク
ウェビナー
記事を進化させる
コミュニティレビュー
Figure360
スニークピーク
STARメソッド
社会の中の科学
セル画展
セルプレスポッドキャスト
セル・プレス・ビデオ
カラーリングとコミック
リサーチアーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版アラート
アクセス
購読する
今すぐ読む
図書館に薦める
INFORMATION
広告主の皆様へ
採用担当者様へ
図書館員の方へ
ご利用条件
個人情報保護方針
アクセシビリティ
当サイトでは、サービスの提供・向上およびコンテンツのカスタマイズのためにCookieを使用しています。Cookieの設定を変更するには、このサイトのCookieの設定にアクセスしてください。
Copyright © 2023 Elsevier Inc. 第三者から提供された一部のコンテンツを除き、著作権はElsevier Inc.に帰属します。本サイトのコンテンツは、医療従事者を対象としています。
RELX
この記事が気に入ったらサポートをしてみませんか?
