小児クローン病患者における経腸栄養剤投与後の自己糞便微生物叢移植は合理的かつ実行可能か?
小児クローン病患者における経腸栄養剤投与後の自己糞便微生物叢移植は合理的かつ実行可能か?



フィージビリティ・テストによるデータ
で
ハンネス・ホエルツ
1,
ジーニン・ヒートマイヤー
1,
アナスタシア・ツァクマクリス
2,
アンドレアス・ヒアゲイスト
3,
コルヤ・シーベルト
1,
フェデリカ・デ・ゼン
1,
デボラ・ヘッカー
4,
アミラ・メトワリー
4,
クラウス・ノイハウス(Klaus Neuhaus
5,
アンドレ・ゲスナー
3,
マリア・J・G・T・ヴェヘレスチャイルド
2,6,
ダーク・ハラー
4,5と
トビアス・シュエルド
1,*
1
ミュンヘン大学病院小児科、ドクター・フォン・ハウナー小児病院、80337ミュンヘン、ドイツ
2
ケルン大学病院内科I科 臨床マイクロバイオーム研究グループ(ドイツ・ケルン、50931番地
3
レーゲンスブルク大学病院微生物・衛生研究所、93053レーゲンスブルク、ドイツ
4
ミュンヘン工科大学栄養学・免疫学講座(ドイツ、85354フライジング・ヴァイエンシュテファン
5
ミュンヘン工科大学ZIEL-食品と健康研究所、85354フライジング-ヴァイエンシュテファン、ドイツ
6
フランクフルト大学病院内科II部感染症科、フランクフルト大学、60596フランクフルト・アム・マイン、ドイツ
*
通信の宛先となる著者
栄養素2023, 15(7), 1742; https://doi.org/10.3390/nu15071742
受理された: 2023年2月15日/改訂:2023年3月30日/受理された: 2023年3月31日発行/2023年4月2日発行
(この記事は、特集「経腸栄養の現状と実際」に属しています。)
ダウンロード
フィギュアを見る
バージョン情報
アブストラクト
背景 排他的経腸栄養法(EEN)は小児クローン病(CD)の寛解導入に非常に有効な治療法であるが、通常の食事に戻した後の再発率は高い。EENによる寛解導入時に採取した便を用いた自己糞便微生物叢移植(FMT)は、EENの効果を維持するための新しいアプローチとなる可能性がある。方法 小児CD患者は自宅で糞便を提供し、それを4℃でFMT研究所に輸送してFMTカプセルの作成と広範な病原体安全性スクリーニングを行った。出荷前とカプセル化後に採取したサンプルの微生物群集組成を、16S rRNAアンプリコンシークエンシングを用いて特徴付けた。結果 7人の小児科患者が、少なくとも3週間の栄養療法後に、9回のテスト実行のために糞便材料を提供した。FMTカプセルは6/8回の納品で正常に生成されたが、便の重量と一貫性は大きく変動した。糞便をFMTカプセルに輸送・加工しても微生物組成に根本的な変化はなかったが、微生物の豊富さは3/9サンプルで30属未満であった。便の安全性スクリーニングでは、8/9の試験で潜在的な病原体または薬剤耐性遺伝子が陽性であった。結論 小児CD患者の維持療法として,自己カプセル-FMTは,高い病原体負荷,多様性の低い微生物相,EEN調整糞便の実用的な欠点から,不適当なアプローチであると思われる.
キーワード
小児IBD、クローン病、糞便微生物叢移植、自家FMT、経腸栄養法
グラフィカルアブストラクト
はじめに
健康なドナーからの糞便微生物叢移植(FMT)は、再発性Clostridioides difficile感染症に対する治療法として確立されており、顕著な臨床効果とドナー株の耐久性のある生着が確認されています[1,2,3]。現在、FMTは炎症性腸疾患(IBD)をはじめとする腸内細菌異常症に関連する他の疾患に対する有望な治療法として研究されています。健康なドナーによるFMTは、潰瘍性大腸炎(UC)患者の臨床的寛解と粘膜治癒を効果的に誘導することが示されているが[4,5,6,7]、最近の研究では、クローン病(CD)患者においても同様に有益であることが示唆されている[8,9]。CDでは、ドナー株の生着率が高いことが寛解の維持期間の延長や臨床転帰の改善につながっている[10,11]。しかし、様々なドナーおよびレシピエントの特性がIBDにおけるFMTの有効性に影響を与えることが示されており、適切なドナーの選択が困難である[4,10,12,13,14]。これまでの研究やメタアナリシスでは、FMTの安全性プロファイルは良好であるが[1,15,16]、IBD患者には疾患再発の潜在的リスクがある[17]。病原体伝播のリスクは、厳格なドナースクリーニングと検疫によって最小化することはできるが、排除することはできない[18,19,20]。さらに、発がん促進特性や肥満などの代謝障害の素因となる疑いのあるドナーの微生物相を移植することなど、FMTの長期効果に関する懸念が表明されている[21,22,23,24]。
小児のような脆弱な患者群に特に関連する「同種」FMTのこれらの限界に対処するために、レシピエント自身の糞便材料を健康な状態で収集し、後にその維持または回復に使用する代替アプローチとして、自家FMTが提案されている[13,25]。原理を証明するものとして、肥満患者を対象とした自己FMTの最近のランダム化比較試験において、食事誘発性体重減少期に採取した便をカプセル化し、予想される体重回復期に投与したところ、体重減少の維持とインスリンリバウンドの抑制が認められたが、これは緑の地中海食グループの参加者に限られた。肉の消費を減らし、魚、緑茶、マンカイダケの摂取を増やしたこの食事は、微生物組成と代謝経路に大きな変化をもたらしました[26]。これまでの食事療法の研究結果 [27,28] と合わせると、これらの知見は、IBDと同様に、食事療法が、その後の自家FMTに「最適化」された状態に向けて微生物叢を効果的に形成できることを示唆しています。
CDでは、そのような食事介入の1つとして、6~8週間の間、高分子または元素の液体フォーミュラを独占的に投与する経腸栄養(EEN)が考えられる。EENは、高い臨床効果、良好な安全性プロファイル、および栄養状態や成長の改善を含むその他の利点に加えて、経口コルチコステロイドと比較して有意に高い粘膜治癒率を達成するため、小児CD患者の寛解導入のための第一選択療法として推奨されている [29,30,31,32,33,34]. EENの有益な効果は、腸内細菌叢とメタボローム組成の大幅な変化を伴うが、個人差が大きい [29,35,36,37,38,39] 。EENはその利点にもかかわらず、長期的な治療法ではなく、微生物の変化も臨床的な改善も通常の食事に戻しても維持されず、42-67%の患者がEEN中止後1年以内に再発した [33,40,41,42] 。EENによる微生物組成と機能の変化が治療効果に大きく寄与するという仮説に基づき、我々はEENで調整された微生物叢を自家カプセルFMTアプローチに用いることで、小児CD患者の寛解を維持できるのではないかと考えた。
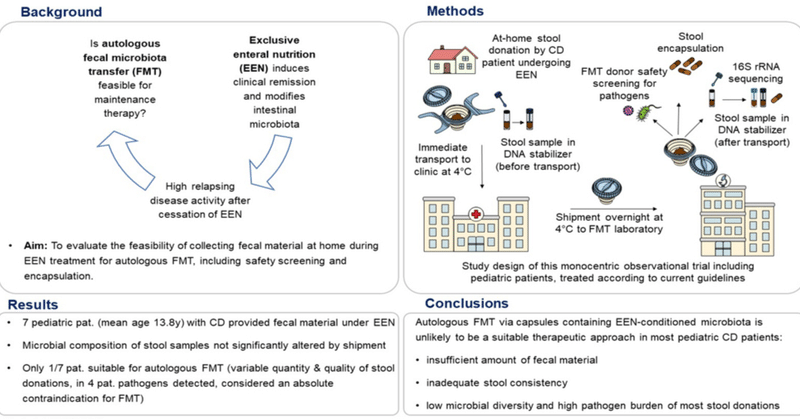
FMT製品が一貫して製造され、品質管理されることを保証するために、ドナーの糞便の収集とFMTの準備は標準的なプロトコルに従うべきである[43]。さらに、ヒトを対象としたFMTに関する現行の規制に従って、糞便材料は、Bristol Index 3-4、感染症スクリーニングと処理が可能な糞便量、病原体や抗生物質耐性遺伝子がないことなど、一定の品質基準を満たす必要がある。さらに、ドナー材料に高いレベルのα多様性があることが要求される(図S1)。同種FMTの場合、環境汚染を避け、微生物の安定性を確保するために、現場での便の提供が伝播するか、ドナーが排便後2時間以内に便を手渡す必要がある[43,44]。自家用FMTの場合、便の提供は、治療する病院とFMT研究所の位置によって、物流上の課題がある。そこで我々は、EENによる寛解期に自宅で便を採取し、さらに糞便をFMTカプセルに加工することの実現可能性を評価することを目的とし、便の提供の質と量の評価、微生物組成の分析、病原体に対する完全な安全スクリーニングを含む。材料と方法
2.1. 参加資格と採用
本研究は、地元のLMU倫理委員会の承認を受け(承認番号17-801、2018年3月18日承認)、ドイツ臨床試験登録(アクセッション番号DRKS00013306、2018年3月19日登録)に登録された。コンセンサスガイドラインに従ってEENによる導入療法を必要とする3~17歳の活動性CDの小児患者は、ミュンヘン小児IBDコホート研究[34]で募集しました。この単中心観察試験は、小児期発症のIBDにおける免疫制御と疾患進行に対する腸内微生物の組成と機能の機能的関連性を調査することを目的としています。すべての参加者について、親または保護者の書面によるインフォームド・コンセントを取得し、参加者自身がインフォームド・アセントを提供しました。参加者、保護者は金銭的な報酬や贈答品を受け取っていない。
2.2. 研究デザイン
EEN導入治療では、Frivoltら[40]に記載されているように、試験参加者はModulen® IBD(Nestlé Health Science, Frankfurt/Main, Germany)を6~8週間独占的に栄養源として使用しました。臨床的疾患活動性の評価については、加重小児クローン病活動性指数(wPCDAI)をベースライン時、EEN開始2~4週目に1回、EEN開始5~8週目に1回、EEN終了後1~2週目に1回測定した [45]. 可能であれば、wPCDAIと同様の時間間隔で便カルプロテクチン値を取得し、そうでない場合は、ベースライン時、EEN中、およびEEN後に1回ずつ測定された。試験参加者は、EEN中に自宅で便を提供するよう依頼され、提供されたFecotainer(DaklaPack® Europe, Lelystad, The Netherlands)を使用した。Fecotainerは4℃ですぐに病院に運ばれた後、梱包され、ケルンまたはレーゲンスブルクのGMP認定FMT研究所に4℃で一晩輸送されました。輸送中、温度の安定性が記録された。
FMTラボに到着後、臨床におけるFMTに関する欧州のコンセンサス会議および欧州消化器病学会(UEG)FMTワーキンググループのコンセンサスレポートに従って処理と品質管理が行われた(図S1、FMTカプセル製造プロセスのフローチャートを参照)。最初に、便提供者は、巨視的な不純物(すなわち、血液、粘液、尿がないこと)を検査し、便の質量(少なくとも65g)および便の粘性(Bristol stool scale 3-4)を分析しました(図S1参照)。病原体に関する包括的なFMTドナー安全性スクリーニングを実施し(表S1参照)、品質管理用のサンプルを採取した。カプセル化のために、便サンプルは生理食塩水(0.9%NaCl)でホモジナイズし、ろ過し、遠心分離して食品粒子などの大きな成分を除去した。上清を遠心分離し、ペレットを生理食塩水とグリセロールに再懸濁した後、便懸濁液をカプセルに分注し、-80℃で冷凍した。輸送前、輸送後、カプセル化後の微生物組成を比較するために、DNA安定剤(Invitek Molecular、ベルリン、ドイツ)を含むチューブに3つのサンプル(排便直後に自宅で採取した便サンプル、FMT研究所到着後にFecotainerから採取したサンプル、冷凍カプセル1個の内容物のサンプル)を移し、その後16S rRNAアンプリコン配列決定により分析しました。
高いアルファ多様性はFMT製品の重要な品質基準であるため、ケルンのFMT研究所では、シャノン指数>2および微生物の豊富さ>30属をFMTカプセル製造の前提条件として定義しています。これらの定義は、次のような考えに基づいています。アルファ多様性はさまざまな指標で表すことができ、それらはすべて、さまざまな側面を考慮した異なる計算式で算出されます。したがって、同じ数の分類群であっても、スコアが異なる場合がある。1つの分類群が支配的なマイクロバイオームは、構成が均等に分布しているマイクロバイオームよりも低いシャノン指数をもたらすでしょう。逆に、分類群の分布が最適(均等)であれば、分類群の数が少ないにもかかわらず、高いシャノン指数が得られるかもしれません。そのため、ケルンのFMT研究所では、多様性の二次指標として、リッチネス(サンプル内の分類群の数)も使用している。
2.3. 16S rRNAの塩基配列決定
サンプルは、Freising(Core Facility Microbiome; ZIEL-Institute for Food & Health)およびRegensburg(Institute for Clinical Microbiology and Hygiene, Core Facility Microbiome)の配列決定コア施設で配列決定のために準備された。微生物DNAは、各糞便サンプルの約150mgからビーズビート([46]参照)により分離し、その後、細胞成分を除去するためにグアニジニウムチオシアネートとN-ラウロイルサルコシン、フェノール類を除去するためにポリビニルピロリドンを用いた精製、さらにRNase AとNucleoSpin gDNA Clean-up Kit(Machery-Nagel, Dueren, Germany)でDNAを洗浄しました(フライジングコア施設)。レーゲンスブルクでは、TissueLyzer II装置(Qiagen, Hilden, Germany)でのビーズビートにより微生物DNAを分離し、その後MagNA Pure 96 system(Roche, Pernzberg, Germany)により便溶解物を精製した(レーゲンスブルクコアファシリティ)。マイクロバイオームシーケンスは、レーゲンスブルクでDIN EN ISO 15189認定のワークフローで実施されました。簡単に説明すると、ユニバーサルプライマーS-D-Bact-0008-c-S-20およびS-D-Bact-0517-a-18を用いて、各サンプルで16S rRNA遺伝子のV1-V3可変領域を増幅し、得られたアンプリコンをIon GeneStudio S5 Plus装置(ドイツ、Germering)でシーケンシングしました(サーモフィッシャーサイエンティフィック)。生シーケンスデータはTorrentSuite 5.18から取得し、さらにCutadapt 4.1によるアダプターおよびプライマーの除去、デマルチプレックス、Trimomatic 0.4によるスライドウィンドウベースの品質フィルタリング [47,48] を実施しました。細菌16S rRNAのコピー数は、前述したように16S qRT-PCRを使用して抽出したDNAから定量化した[49]。絶対的な細菌バイオマスは、最初の便の重量と処理中の希釈を考慮し、便1g中の細菌16S rRNAコピー数の量を用いて計算した。
2.4. 細菌組成の分析
VSEARCH 2.21.1ベースのパイプライン[50]を用いてシーケンスデータの前処理を行った。期待されるエラーレートが5を超えるリードは削除された。アルファ値2、最小サイズ5リードを適用し、品質フィルターされたリードからZero-Radius OTUs (zOTUs)が構築されました。キメラ配列はuchime3_denovoアルゴリズムで除去した。98%のペアワイズ同一性を持つフィルターされたリードは、usearch_globalアルゴリズムでキメラでないzOTUにマップバックされました。分類学は、DECIPHER 2.22のIDTAXAアルゴリズムとAll-Species Living Tree Projectデータベースバージョン01.2022 [51,52] を用いてRバージョン4.1.3で割り当てた。
2.5. 多様性インデックスの算出
多様性分析は、デフォルトのパラメータを使用してmiaで行った[53]。種の豊富さ(zOTUs)、シャノン指数、シャノン実効(種数)を算出し、α多様性を評価した。β多様性は、非加重および加重UniFrac距離によって評価された。重み付けされていないUniFrac行列と重み付けされたUniFrac行列に基づく主座標分析(PCoA)プロットは、研究参加者間の細菌群集の全体的な非類似性を示すために構築されました。zOTU カウントを中心対数変換および Z 変換した後、pheatmap 1.0.12 を使用して、最も豊富な 40 属のヒートマップを作成した。特徴量とサンプルは、完全連鎖法により階層的にクラスタリングした。
2.6. 統計解析
wPCDAIと糞便カルプロテクチン濃度の変化の統計的有意性は、Tukey´s多重比較検定付き一元配置分散分析で評価した。有効シャノン多様性のグループ間の差は、Wilcoxon signed-rank検定で有意性を検証した。PERMANOVA分析により、Bray-Curtis距離、非加重距離、加重距離、一般化UniFrac距離のグループ間の有意性を評価した。veganパッケージのadonis2コマンドを使用して、距離行列に線形モデルを当てはめた[54]。個人差をコントロールするために、患者を共変量としてモデルに含めた。結果は、p≦0.05で有意とみなした。一対比較の場合、p値はBenjamini-Hochberg手順を用いて偽発見率で調整された。
出荷前と出荷後、および出荷後とカプセル化後に有意に異なるzOTUを特定するために、TSS正規化、対数変換した線形モデルを使用した[55]。サンプリングの時点を固定効果として、個々の患者をランダム効果としてモデルに組み込んだ。多重検定の補正は、Benjamini-Hochberg FDR閾値0.25を使用して行った。各群の相対的な存在量をプロットするために、補正前のp値に対して0.05のカットオフ値が適用された。結果
3.1. 研究対象者
小児CD患者における自己FMTアプローチの一般的な実現可能性を評価するため、家庭での便の提供、認定FMTラボへの冷蔵輸送、および現地でのFMTカプセルへの加工を試験的に実施しました(図1a)。平均年齢13.8±2.1歳の小児CD患者7名が便を提供した(FMT-1からFMT-7とする)。
図1. 試験参加者の臨床経過と便提供の時点。(a) 研究デザイン。研究参加者は、EEN治療中に自宅で便を提供するよう求められた。4℃ですぐにクリニックに搬送した後、Fecotainerを梱包し、4℃で一晩かけてGMP認定のFMTラボに出荷した。その後、提供された便は、糞便量と便の硬さの分析、病原体に関する包括的なFMTドナー安全性スクリーニングが行われ、FMTカプセルの製造が行われました。(b)治療期間とFMTカプセル製造のための便提供の時点を示す図。緑色:EENによる導入療法。黄土色:IFXとMTXによる維持療法。赤い三角形:便を採取した時点。(c) 試験参加者のベースライン時、EEN2~4週目(EEN2~4週目)、EEN5~8週目(EEN5~8週目)、EEN終了後1~2週間(EEN後)の重み付けPCDAI(wPCDAI)スコア。(d) 試験参加者のベースライン時、EEN2~4週目(EEN2~4週目)、EEN5~8週目(EEN5~8週目)、EEN終了後1~2週間(EEN後)の便性カルプロテクチン(FCal)濃度について。有意性の検定は、Tukey´s多重比較検定付き一元配置分散分析を用いて行った(信頼水準95%、統計的有意性の定義:p<0.05)。Abb.: CD = クローン病、EEN = 経腸栄養剤、FCal = 便カルプロテクチン、FMT = 便微生物移植、IFX = インフリキシマブ、MTX = メトトレキサート、wk = 週、wPCDAI = 加重小児クローン病活動指数.
7名の患者(4/7女性)の人口統計学的特徴および臨床的特徴を表1に示す。7人中5人は新規に診断され、FMT-3とFMT-4はEENによる導入療法を必要とする疾患再発を経験した患者である。診断時の平均年齢は12.4±3.2歳であった。ほとんどの患者は回腸(3/7)または結腸(2/7)病であった。1名は末端回腸炎、もう1名は孤立性小腸疾患であった。また、全例で上部消化管への病変が認められた。病態の多くは非狭窄性、非貫通性であったが、MRIで小腸ループの広範な癒着を認めたFMT-5では腹腔内瘻孔を否定することはできなかった。この患者は括約筋間瘻と再発性の肛門周囲および直腸周囲膿瘍を併発した。肛門周囲疾患を有するもう一人の患者(FMT-3)では、軽度の肛門狭窄、複数の裂肛、小さな肛門周囲瘻孔が観察された。パリ分類による直線的な成長障害は、我々のコホートの3人の患者に認められた[56]。1人の患者は、BMI z-score<-2というWHOの定義に従った重度の栄養失調を呈した(表S2参照)。臨床的な疾患活動性は、軽度から重度の範囲であった(表1)。
表1. ベースライン時の研究対象者の人口統計学的および臨床的特徴。
診断ワークアップの後、全患者はEENを6~8週間投与された。予後不良の予測因子が存在するため[57]、抗薬物抗体の発現を防ぐために、7人の患者全員にEENと並行してメトトレキサート(MTX)を併用したインフリキシマブ(IFX)の投与を開始した。治療と自宅での便提供の時点を図1bと図S2に示す。2人の患者(FMT-2およびFMT-3)は、2回の試験実行のためにサンプルを提供した。以前、我々は、EENの2週間後に糞便細菌群集が有意に変化することを観察した[36]。すべての患者は、便提供時に少なくとも丸3週間のEENを完了しており、2人を除くほとんどのサンプルは、インフリキシマブとメトトレキサートによる維持療法を開始した後に採取されていた。
EENによる導入治療により、症状だけでなくwPCDAIスコアも急速かつ有意に低下し(EEN投与前とEEN投与2~4週目のp<0.001、EEN投与前とEEN投与5~8週目のp<0.001、図1c参照)、BMI zスコアの改善(p = 0.069, Table S2)も見られた。すべての試験参加者は、EEN終了時までに臨床的寛解を達成しました。また、治療により便中カルプロテクチン値の有意な低下が認められ(EEN前とEEN2-4週目のp = 0.026、EEN前とEEN5-8週目のp = 0.008 、図1d参照)、腸の炎症が改善したことを示しています。回腸炎を発症し、臨床的にも内視鏡的にも重度の活動性を示した1名の患者(FMT-3)を除き、EEN後、インフリキシマブとメトトレキサートによる維持療法を受けているすべての患者で、便中カルプロテクチン値は250mg/L以下に低下しました(図1d)。便提供時には、7人中6人が臨床的寛解状態にあったが、便中カルプロテクチンの低下とともに臨床的寛解が認められたのは、患者FMT-7のみであった(図S2参照)。
3.2. FMTカプセルの生産は、糞便の量的・質的不足によって制限される
自宅での便提供、FMTラボへの搬送、FMTカプセルへの加工を9回実施した結果を表2にまとめた。すべての患者は、便を提供するまでに少なくとも3週間のEENを終了していた。提供された便の重量は、輸送中にFecotainerから便が漏れた1例を除き、21~240gの間で変動した。FMTカプセルのフルバッチの製造に必要な最小重量65gは、9サンプル中5サンプルで超過していた(表2)。
表2. 自家用FMTカプセルの製造テストラン。
さらに、EENの下では、便の粘度に大きな違いがあることが確認されました。3人の患者は半~完全な液状便であったのに対し、2人の患者では固い塊が見られた。FMT-6とFMT-7の2つのサンプルだけが、製造基準に従ってFMTカプセルを製造するのに十分な硬さ(Bristol stool scale 3-4)であった。すべてのテスト実行において、FMTラボの通常の仕様とは無関係に、可能な限り最大数の便カプセルが製造された(図S1参照)。5人の患者に対して、30カプセルのフルバッチが製造されました(表2)。
さらに、16S rRNA遺伝子配列決定により便サンプルを分析し、微生物の構成と多様性を決定した(図2参照)。高レベルのα多様性は、UC研究において健康な微生物叢と同種FMTの成功と関連しています[14]。同種FMTの前提条件として、Shannon index >2および微生物リッチネス >30属が必要である(図S1参照)。EEN療法下での細菌の豊かさは患者間で大きく異なり、属レベルで15~49zOTUの間であった(表2)。4人の患者(5つのサンプル)においてのみ、糞便提供は高い微生物リッチネスを特徴とし、30以上の属が検出されました。1人の患者(FMT-6)では、細菌の豊かさは境界線上にあり、残りの2人の患者では特に低い属数が検出された(表2および図S3bを参照、2人の患者(FMT-3とFMT-4)では、20属未満が観察されたことを示す)。
図2. 16S rRNA配列決定による出荷前および出荷後、カプセル化後の糞便サンプルの微生物組成分析。(a)出荷前(■)、出荷後(▲)、便カプセル化後(●)の糞便サンプルについて、シャノンの有効種数をプロットした。有意性の検定はpaired t-test(信頼水準:95%、統計的有意性の定義:p<0.05)を用いて算出、n.s.=有意でない。(b)糞便サンプルの出荷前(■)、出荷後(▲)、カプセル化後(●)について、重み付けUniFrac非類似度と主座標分析(PCoA)により測定したベータ多様性のプロット。グループ間の有意性を評価するために、PERMANOVA分析を使用した。出荷前と出荷後の便(p = 0.41)、出荷前とカプセル化後の便(p = 0.07)を一対比較したところ、それぞれ統計的に有意な差は見られなかった。出荷後とカプセル化後の便の比較(p = 0.04)では、統計的に有意な差が見られた。(c) 出荷前(stool.bf.ship)、出荷後(stool.af.ship)、カプセル化後(caps.af.enc)の上位20菌属の相対存在量の棒グラフを重ねた図。(d) 16S rRNA配列決定による、研究参加者の便サンプルにおける上位40の細菌属の相対的存在量を示すヒートマップ(出荷前(stool.bf.ship、カーキグリーン)、出荷後(stool.af.ship、ライトブルー)、カプセル化後(caps.af.enc、ライトレッド))。階層的クラスタリングに基づく距離ツリーは、それぞれのサンプルと属の関係を示している。注:FMT-2およびFMT-3は、2回の試験(FMT-2a/bおよびFMT-3a/b)のために糞便を提供した患者である。患者FMT-5については、輸送後に採取した2つのサンプルを分析しましたが、輸送中にFecotainerから便が漏れたため、この患者から提供された糞便材料からカプセルを製造することは出来ませんでした。
3.3. FMTカプセルへの便提供の輸送と加工は、微生物組成のわずかな変化を誘発する。
家庭での採便、4℃での冷却輸送、カプセル化が微生物組成に影響を与えるかどうかを評価するため、排便時および実験室への輸送後に採取した便サンプルと、それぞれの患者の冷凍FMTカプセルの内容物を、16S rRNA遺伝子配列決定により分析した。安定したシャノン効果(便の出荷前と出荷後のp = 0.65)、および重み付けなしと重み付けのUniFracにおける1人の患者からの出荷前と出荷後のサンプルの密集によって証明されるように、αおよびβ多様性はどちらも冷却輸送によって大きく影響しなかった(図2a、b、図S3およびS4参照)。Bray-Curtisに基づく一対比較、重み付けなし、重み付けあり、および患者を共変量として補正したPERMANOVA分析を用いた一般化UniFracでは、便の出荷前と出荷後の有意差は認められなかった(表S3、便の出荷前と出荷後の一対比較のp値を示す: Bray-Curtis:p=0.10、非加重UniFrac:p=0.12、加重UniFrac:p=0.41、一般化UniFrac:p=0.09)。カプセル化した便を処理した場合、シャノン効果で表されるα多様性が安定した(出荷後の便とカプセル化した便の比較ではp = 0.53、出荷前の便の比較ではp = 0.98)。一方、β-多様性は、重み付けされていないUniFrac距離を除いて、出荷後の便とカプセル化された便の一対比較で有意に変化した(表S3参照、出荷後の便とカプセル化された便の一対比較の次の有意p値を示す): Bray-Curtis: p = 0.03; Weighted UniFrac: p = 0.04; Generalized UniFrac: p = 0.02).
属レベルでの相対存在量の分析では、2人の患者で最も顕著ないくつかのシフトを除いて、便サンプルの出荷の前後で相対的な微生物組成の全体的な安定性が明らかになった(図2c、dおよび図S5参照)。患者FMT-3(FMT-3a)の最初のサンプルでは、比較的大きな割合のEnterococcusが検出されましたが、出荷後のサンプルでは有意に減少し、Romboutsiaの相対量が強く増加しました。また、患者FMT-5の便サンプルでは、属レベルで微生物の変化が観察されました(図2c)。統計的に有意ではなかったものの、出荷後の便とカプセル化した便の間の微生物組成の違いは、主に、カプセル化後のDorea属の3つのzOTUとRuminococcus属の2つのzOTUの相対存在量の減少によって説明されました。一方、Anaerotruncus、Clostridium、および分類されていないEnterobacteriaceaeからの個々のzOTUの相対存在量における、便カプセル化後の統計的に有意でない濃縮が観察された(図S6参照、zOTUの差異存在量における統計的有意差なしを示す)。
qRT-PCR による 16S rDNA コピーの分析では、4 ℃での出荷後の 4 サンプルで、輸送前の細菌数と比較して絶対細菌数が増加した(FMT-2b、FMT-3b、FMT-4、および FMT-5)。便サンプルの処理およびカプセル化後、カプセル内の細菌含有量は、FMT-3を除くすべての患者において、元の便サンプルよりもはるかに低かった(図S7参照)。さらに、正規化後、すべてのzOTUについて、出荷前と出荷後の絶対量の有意な変化についてスクリーニングを行った。正規化されたzOTUレベルの違いが観察されたものの、これらの変化は有意ではないことが判明した(図S8参照)。
3.4. 安全性スクリーニングの結果、病原体のコロニー形成が多いことが判明
FMTカプセル製造の一環として、同種健常者FMTの要件に従った詳細な病原体スクリーニングを実施した(図3)。その結果、1検体(患者FMT-7)を除くすべての便検体から、Clostridioides difficile由来のToxin-Bを含む病原体および薬剤耐性株(またはその遺伝子)を検出した。患者FMT-2では、抗生物質耐性遺伝子Oxacillinase-48が検出されました。また、患者FMT-3の両検体からは、PCRによりTropheryma whippleiが検出された。健常者FMTでは許容されるAeromonas種が、2人の研究参加者から検出された。
図3. 感染症安全性スクリーニングの結果。7名の研究参加者の便サンプルに対して、綿密なFMTドナースクリーニングが行われた。赤枠はそれぞれの病原体の検出を示す。患者FMT-2およびFMT-3は、2回の試験実施(FMT2a/bおよびFMT-3a/b)のために糞便を提供した。
3.5. EEN下の小児CD患者からの便提供は、自己FMTカプセル製造に適さない
前述した実用性と安全性の観点に基づき、提供された便の自家FMTへの適合性を評価した(図4)。その結果、ほとんどの献便において、糞便の量が不十分であること、便の粘性が不十分であること(Bristol stool scale < 3 or > 4)、微生物の多様性が低いこと(3人からの4サンプルで30属未満が検出)等、量と質の両面で大きな欠点が確認された。4℃での輸送は微生物組成に大きな変化を与えませんでしたが、特に患者FMT-3とFMT-5の糞便材料では属レベルでいくつかの変化が観察され、細菌の絶対量は2つの便サンプルで顕著に増加しました(図S7参照)。4人の患者さんでは、FMTの絶対禁忌とされる病原体が検出されました。FMT-2では、便が固いことと、2回目の検体で抗生物質耐性遺伝子が検出されたことにより、自家用FMTへの適合性が制限された。FMT-5は、輸送中にFecotainerが破損し、FMTカプセルを製造できなかったため、十分な評価ができなかったが、便の半液状性は、いずれにしてもFMTカプセル製造の標準要件には該当しない。患者FMT-7においてのみ、便の提供は十分な量と質を持ち、病原体スクリーニングは陰性であったため、自己FMTの可能性に適していました。
図4. 小児CD患者からの便提供の自家FMTへの適否。1~7の数字は患者FMT-1~FMT-7を表す。便の質と量の説明(Fecotainer:緑:糞便バイオマス65g以上、Bristol stool scale 3-4、Shannon index >2および30属以上の豊富さで表される高いα多様性を含む、FMTカプセル製造に関するFMT研究所の標準要件を満たす、黄:糞便重量および/または一貫性および微生物の豊富さの逸脱、赤:糞便の重量や一貫性が不十分でFMTカプセルのフルバッチを製造できない)、輸送中の微生物組成の安定(Tube.緑:輸送前後の微生物組成および絶対量が同等、黄:輸送後の細菌の絶対量の増加および/または属レベルの相対的な微生物組成の著しい変化)、および9回のFMTカプセル製造試験におけるFMTドナーの病原体スクリーニング結果(細菌:緑:病原体検出なし、黄:許容できる病原体検出、赤:病原体検出)です。ディスカッション
今回のパイロット研究では、小児CD患者における自家FMTアプローチの一般的な実現可能性を評価することを目的として、EEN中に採取した自宅便のFMTカプセル製造への適合性を評価しました。その結果、16S rRNA遺伝子配列決定により評価された新鮮な便サンプルの微生物組成は、4℃での出荷やカプセル化によって有意な変化はなく、現場でのサンプリングに代わる自宅提供の可能性を支持し、冷凍FMTカプセルの高い生物学的品質を示すことがわかりました。しかし、これらの知見は7人の患者という非常に小さなコホートに基づくものであり、輸送や処理後の便サンプルにおける生菌の存在と保存を確認するためには、細菌生存率測定や培養などの追加検査が必要である。しかし、微生物組成とDNA含有量にはいくつかの変化が見られ、特に一部のサンプルでは輸送後の生物の絶対量が増加した。このような変化は、「制御されていない」細菌の増殖に起因する可能性があり、長期的な微生物組成や機能、ひいてはFMT製品の品質に与える影響は、依然として不明です。さらに、Fecotainerシステムでは嫌気性サンプリングができないため、Clostridiales目の細菌などの潜在的に有益な偏性嫌気性微生物が減少する可能性がある[58,59]。これらの制限は、出荷手順を最適化することで対処できるかもしれないが、特にEEN治療中の腸の習慣のばらつきを考えると、予定された当日の配送は実現不可能であると思われる。いずれにせよ、現在の規制では、FMTカプセルの製造工程における必須ステップとして、現場での便の提供を義務付けている。しかし、現地でのサンプリングを含む修正された研究デザインは、患者とその家族にとってロジスティクス上の難題となるであろう。
また、ほとんどの献便は、十分な量と十分な一貫性など、要求される品質基準を満たさないことが確認されました。EENは繊維質を含まないため、便の不規則性や下痢はEEN治療の一般的な副作用です[60]。さらに、一部の患者が嗜好性向上のために高濃度のModulen® IBD(ネスレヘルスサイエンス)フォーミュラを使用し、浸透圧の上昇により腸内の水分分泌/吸収に影響を与えた可能性も否定できません。また、FMTカプセルは、9回の試験のうち3回でフルバッチを製造することができず、1回ではFecotainerから便が漏れるなど、糞便原料に問題があった。これらの実用的な問題に加えて、大部分の便サンプルから病原体が検出されることが、自家用FMTアプローチの大きな制限となることが判明した。CD患者では、腸内細菌叢の組成と機能の両方において、生物多様性の減少、健康に関連する種の喪失、代謝プロファイルの変化など、さまざまな変化が報告されている [61,62,63,64] 。腸内細菌異常症と呼ばれるこの不均衡な状態は、粘膜免疫系の異常な活性化に寄与するだけでなく[65]、病原体のコロニー形成抵抗性の喪失につながり、それによって無症状のコロニー形成と潜在的病原体による有症状の感染の両方が多発する[66, 67, 68,69,70,71] 。これらの観察と同様に、我々は、自家FMTアプローチにそれぞれの糞便材料を使用した場合を除き、研究集団の半数以上で毒素を持つC. difficileまたは薬剤耐性細菌を検出した。
また、興味深いことに、1人の患者からTropheryma whippleiが検出されました。この菌は、一般的にWhipple病の原因菌として知られており、まれで致命的な多臓器疾患である[72]。無症候性慢性保菌の有病率は、集団によって異なることが研究により明らかになっている[73,74]。このようなコロニー形成は本患者のケースであると考えられるが、Tropheryma whippleiは幼児の急性胃腸炎にも関連している [75]。Tropheryma whipplei感染がCDを模倣することを示唆する症例報告は少ないが[76,77,78]、IBDとの一般的な関連やCD患者における保菌頻度の増加については報告されていない。
全体として、微生物学的に安全なFMTカプセルの製造が成功したのは1例のみであったことから、EEN調整糞便材料を用いた自家FMTは、相当数の小児CD患者にとって実行不可能である可能性があると判断した。CDの寛解維持のための同種FMTや、抗生物質耐性菌感染症の予防や移植片対宿主病の治療のための自家FMTを調査した他の研究では、直腸浣腸や内視鏡による糞便懸濁液の投与などの代替送達様式が用いられ、それによってFMTカプセルの製造という実用上の問題を回避している [10,79,80]. しかし、より侵襲的であるため小児科の研究集団には適していないことに加え、代替の送達経路を実施しても、我々のコホートで見られた高い病原体保有率の問題を解決することはできない。
我々の知る限り、本研究は、小児CD患者における自家FMTの実行可能性を検討した最初の研究である。参加者数が限られているにもかかわらず、本研究の対象者は年齢、性別、疾患分類の点で比較的異質であり、したがって小児CDをかなり代表するものであった。これは、以前に述べた自家FMTアプローチの限界は、特定の人口統計や疾患表現型に特有ではないことを示唆している。本研究の主な目的は、実用的かつ安全性に関する要件を含め、自家FMTの一般的な実現可能性を評価することであったが、FMTカプセルによる維持療法自体が実現可能であるかどうかは評価していない。便のカプセル化や病原体の排除に成功した場合でも、生物学的に有効な量の微生物群を移行させるためには、比較的多くのカプセルを摂取する必要があると考えられるが、カプセルの大きさや飲み込むことの難しさから、若い患者には困難であるかもしれない。さらに、EENによる寛解の期間は限られているため、十分な量のFMTカプセルの製造工程はさらに複雑となります。
これらの実現可能性の問題にかかわらず、小児CD患者におけるEEN後の自己FMTの根拠は、その後の安全性と有効性の試験に進む前に再考されるべきです。先に述べたように、EENによる粘膜治癒は、腸内細菌叢の変化を伴う[29,33]。これらの微生物シグネチャーが抗炎症、ひいては臨床反応を直接的に媒介すると仮定すると、我々はEENで調整した便を自家FMTアプローチで使用し、維持期間中の栄養療法の有益な効果を維持できると仮定した。しかし、CD患者の腸内細菌組成は、EEN中に逆説的に、細菌多様性のさらなる減少によって証明されるように、推定されるdysbiosisにさらにシフトすることが以前に発見されており[35,38,41]、これは治療成功と直接相関する[37,81,82]。すべての患者に共通する普遍的なEEN微生物叢の組成を観察する代わりに、我々の結果は、Shannon-indexと微生物の豊かさに大きなばらつきがある、EEN治療中の非常に個別的な微生物組成を示した。したがって、本研究コホートのほぼ半数の糞便サンプルにおいて、微生物の多様性と豊かさは特に乏しく、正常な同種FMTカプセルの製造に必要なFMT研究所の最小要件を下回っていました。IBDの同種FMTに関する研究では、ドナーの微生物多様性が高いことがFMT成功の最も重要な要因の1つであるとされているため[14,83,84]、多様性の低いコミュニティを持つこうした微生物叢をFMTに用いることは有望ではないと思われる。一方、胆汁酸代謝の改善や潜在的に有害な微生物の代謝物の減少など、EEN中に起こる代謝の変化は、腸内細菌叢の機能的正常化に対応するものである[35]。さらに、すべての患者がEEN中にインフリキシマブとメトトレキサートの投与を開始したため、ほとんどの便がEENと維持療法の両方で採取された。このような微生物叢の「ダブルコンディション」(例えば、EENとインフリキシマブおよびメトトレキサート)は、自家FMTの有益な効果を高めるかもしれないと仮定している。最近の研究では、抗TNF治療は、腸内細菌の多様性を高め、例えば、Faecalibacterium prausnitziiとEscherichia coliの比率を正常化することによって、以前の低多様性状態を改善することが判明した[85]。これらの知見は、抗TNF薬の治療効果が単なる抗炎症作用にとどまらないことを示唆しています。しかし、このような微生物の変化は、抗TNF治療開始から6ヶ月後に採取した便サンプルで観察されたものであり[85]、現在のところ、短期的効果について決定的な結論を出すことはできない。結論
EENを投与したCD患者の小規模なケースシリーズに基づくと、EENで調整した微生物叢を含むカプセルを用いた自家FMTは、小児CDの治療アプローチとして適切であるとは考えにくいと思われます。成人CDを対象とした最近の試験で、安心できる安全性データと有望な結果が得られたことから、同種FMTは小児患者においても説得力のある選択肢であると考えられ、さらなる研究で検討する必要がある[9,10,15,16]。微生物種の豊富さと多様性が治療の成功率向上につながることから、マルチドナーアプローチが望ましいかもしれない[14,83]。レシピエント側に関しては、移植された微生物叢に対する免疫的圧力を軽減するために、FMTの前に炎症コントロールを達成する必要があり、それによって移植が容易になり[10,11,12,13]、副作用の確率が減少する[17]。長期的には、ナイーブまたは人工の微生物コンソーシアムやプロバイオティクスなどの他の生きたバイオ治療製品は、ドナー選択の問題を解決し、個々の微生物の不均衡を選択的に修正するのに役立ち [66,86]、IBDの個別化医療への重要なステップとなるであろう。
補足資料
以下の補足情報は、https://www.mdpi.com/article/10.3390/nu15071742/s1、図S1:FMTカプセル製造工程のフローチャート、図S2:臨床コース、図S3: 試験参加者の便サンプルの出荷前、出荷後、カプセル化後のα多様性分析、図S4: 出荷前後およびカプセル化後の便サンプルのβ多様性;図S5:出荷前後およびカプセル化後の便サンプルにおける上位30種の細菌属の検出;図S6:出荷前後およびカプセル化後の便サンプルにおける上位30種の細菌属の検出: 出荷前とカプセル化後の主に変化したzOTUの相対的な細菌数;図S7: 図S7:出荷前およびカプセル化後の便サンプルの絶対量;図S8:出荷前および出荷後の主に変化したzOTUの絶対細菌数;表S1:便病原菌スクリーニング;表S2:EEN前および後の年齢に対する身長、年齢に対する体重およびBMIのZスコア;表S3.表S3:便処理のサンプリング時点間におけるβ多様性の有意差の検定。
著者による寄稿
概念化、T.S.、D.H.(ディルク・ハラー)、M.J.G.T.V.、A.G.、H.H、D.H(デボラ・ヘッカー)、A.M、K.N、A.G、D.H(ディルク・ハラー)およびM.J.G.T.V、ソフト、A.H.K.S.およびH.H.、検証、T.S.およびH.H.、形式分析、A.T.、A.H.、K.S、H.HおよびJ.H、調査、F.D.Z., H.H., T.S., A.H., K.N. およびA.T.、資源、F.D.Z., A.T., A.H., H.H および J.H.;data curation, A.T、 D.H. (Deborah Häcker), A.M., A.H., H.H., T.S., K.S. and J.H.; writing-original draft preparation, H.H. and J.H.; writing-review and editing, H.H., J.H., A.T., K.S., A.H., F.D.Z.,、 D.H.(デボラ・ハッカー)、A.M.、K.N.、A.G.、M.J.G.T.V.、D.H(ダーク・ハラー)、T.S.、可視化、J.H.、A.H.、K.S、H.H、T.S、監督、T.S、D.H(ダーク・ハラー)、M.J.G.T.V. および A.G.;Project Management: F.D.Z.、プロジェクト管理:T.S.、資金獲得:K.N.、T.S.、D.H. (Dirk Haller)。すべての著者は、出版された原稿を読み、同意している。
資金提供
本研究は、ドイツ連邦共和国(DFG)のDFG共同研究センター1371(プロジェクト番号395357507)およびLeona M. and Harry B. Helmsley Charitable Trust(助成番号2847)から資金提供を受けました。
インスティテューショナル・レビュー・ボード声明
本研究はヘルシンキ宣言に基づき実施され、LMU Munichの倫理委員会(郵便番号:80336、承認番号:17-801、2018年3月18日承認)の承認を受け、ドイツ臨床試験登録(アクセッション番号:DRKS00013306、2018年3月19日登録)に登録されました。
インフォームドコンセントに関する声明
本研究に参加したすべての被験者からインフォームドコンセントを得た。
データの利用可能性に関する声明
シーケンスデータはEuropean Nucleotide Archive (ENA)に提出され、プロジェクトアクセッションナンバーPRJEB55998で入手可能です。本論文の基礎となる更なるデータは、対応する著者への合理的な要求があれば共有される予定です。
謝辞
本研究に参加し、貢献してくれたすべての患者・家族に感謝する次第である。
利益相反について
T.S.はMSDとNutricia(Danone)から講演料を受け取った。K.N.はHipp社(Pfaffenhofen, Germany)と新規プロバイオティクス菌株について共同研究している。その他の著者は、潜在的な利益相反がないことを宣言しています。資金提供者は、本研究のデザイン、データの収集、分析、解釈、原稿の執筆、結果の公表の決定において、いかなる役割も担っていない。
参考文献
Kelly, C.R.; Yen, E.F.; Grinspan, A.M.; Kahn, S.A.; Atreja, A.; Lewis, J.D.; Moore, T.A.; Rubin, D.T.; Kim, A.M.; Serra, S.; et al. Fecal Microbiota Transplantation Is Highly Effective in Real-World Practice: FMT National Registryからの初期結果。Gastroenterology 2021, 160, 183-192.e3. [Google Scholar] [CrossRef]を参照してください。
Aggarwala、V; Mogno、I; Li、Z; Yang、C; Britton、G.J.; Chen-Liaw, A; Mitcham, J; Bongers, G; Gevers, D; Clemente, J.C.; et al. Fecal Microbiota Transplantation後の細菌株の精密定量化は長期的移植を規定し転機を説明する(Pecase of Bacterial Strains Delineates Long-term Engraftment and Explains Outcomes) 。Nat. Microbiol. 2021, 6, 1309-1318. [Google Scholar] [CrossRef]を参照してください。
Staley, C.; Kaiser, T.; Vaughn, B.P.; Graiziger, C.; Hamilton, M.J.; Kabage, A.J.; Khoruts, A.; Sadowsky, M.J. Durable Long-Term Bacterial Engraftment Following Encapsulated Fecal Microbiota Transplantation To Treat Clostridium Difficile Infection.mBio 2019, 10, e01586-19. [Google Scholar】【CrossRef】【PubMed】。
Moayyedi, P.; Surette, M.G.; Kim, P.T.; Libertucci, J.; Wolfe, M.; Onischi, C.; Armstrong, D.; Marshall, J.K.; Kassam, Z; Reinisch, W.; et al. Fecal Microbiota Transplantation Induces Remission in Patients With Active Ulcerative Colitis in a Randomized Controlled Trial. Gastroenterology 2015, 149, 102-109.e6. [Google Scholar] [CrossRef]を参照。
Paramsothy, S.; Kamm, M.A.; Kaakoush, N.O.; Walsh, A.J.; van den Bogaerde, J.; Samuel, D.; Leong, R.W.L.; Connor, S.; Ng, W.; Paramsothy, R.; et al. 活動性潰瘍性大腸炎に対するマルチドナー集中便微生物移植術: 無作為化プラセボ対照試験(A Randomised Placebo-Controlled Trial). Lancet 2017, 389, 1218-1228. [Google Scholar] [CrossRef] [PubMed].
Costello, S.P.; Hughes, P.A.; Waters, O.; Bryant, R.V.; Vincent, A.D.; Blatchford, P.; Katsikeros, R.; Makanyanga, J.; Campaniello, M.A.; Mavrangelos, C.; et al. 便微生物移植による8週目の寛解を潰瘍性大腸炎患者とした効果: 無作為化臨床試験。JAMA J. Am. Med. Assoc. 2019, 321, 156-164. [Google Scholar】【CrossRef】。
Haifer, C.; Paramsothy, S.; Kaakoush, N.O.; Saikal, A.; Ghaly, S.; Yang, T.; Luu, L.D.W.; Borody, T.J.; Leong, R.W. Lyophilised Oral Faecal Microbiota Transplantation for Ulcerative Colitis (LOTUS): 無作為化、二重盲検、プラセボ対照試験。Lancet Gastroenterol. Hepatol. 2022, 7, 141-151. [Google Scholar] [CrossRef] [PubMed].
Cheng、Y.-W.、Phelps、E、Ganapini、V、Khan、N、Ouyang、F、Xu、H、Khanna、S、Tariq、R、Friedman-Moraco、R.J、Woodworth、M.H、他 固形臓器移植患者における再発性および重症Clostridium Difficile感染治療に対する便微生物移植の検討:J.多施設での経験。Am. J. Transpl. 2019, 19, 501-511. [Google Scholar] [CrossRef]を参照してください。
Fehily, S.R.; Basnayake, C.; Wright, E.K.; Kamm, M.A. クローン病における糞便微生物移植療法: システマティックレビュー。J. Gastroenterol. Hepatol. 2021, 36, 2672-2686. [Google Scholar] [CrossRef]を参照。
Sokol, H.; Landman, C.; Seksik, P.; Berard, L.; Montil, M.; Nion-Larmurier, I.; Bourrier, A.; Le Gall, G.; Lalande, V.; De Rougemont, A.; et al. クローン病における寛解維持のための便微生物移植.パイロット無作為化対照試験。Microbiome 2020, 8, 12. [Google Scholar] [CrossRef]を参照。
Kong, L.; Lloyd-Price, J.; Vatanen, T.; Seksik, P.; Beaugerie, L.; Simon, T.; Vlamakis, H.; Sokol, H.; Xavier, R.J. 便微生物移植における菌株移植とクローン病における寛解維持の関連付け。Gastroenterology 2020, 159, 2193-2202.e5. [Google Scholar] [CrossRef]を参照してください。
Pigneur, B.; Sokol, H. 炎症性腸疾患における糞便微生物叢移植: 聖杯の探求。Mucosal. Immunol. 2016, 9, 1360-1365. [Google Scholar] [CrossRef]を参照してください。
Danne, C.; Rolhion, N.; Sokol, H. Faecal Microbiota Transplantationにおけるレシピエントファクター(Recipient Factor): 一つの便が全てに適合するわけではありません。Nat. Rev. Gastroenterol. Hepatol. 2021, 18, 503-513. [Google Scholar】【CrossRef】【PubMed】。
Vermeire, S.; Joossens, M.; Verbeke, K.; Wang, J.; Machiels, K.; Sabino, J.; Ferrante, M.; Van Assche, G.; Rutgeerts, P.; Raes, J. ドナー種の豊かさは炎症性腸疾患における糞便微生物移植成功の決め手となる. J. Crohns. Colitis. 2016, 10, 387-394. [Google Scholar】【CrossRef】【PubMed】。
Saha, S; Mara, K.; Pardi, D.S.; Khanna, S. Recurrent Clostridioides Difficile Infectionに対するFecal Microbiota Transplantationの長期的な安全性。Gastroenterology 2021, 160, 1961-1969.e3. [Google Scholar】【CrossRef】【PubMed】。
Marcella, C.; Cui, B.; Kelly, C.R.; Ianiro, G.; Cammarota, G.; Zhang, F. Systematic Review: 2000年から2020年までの糞便微生物移植関連有害事象の世界的発生率。Aliment. Pharm. 2021, 53, 33-42. [Google Scholar] [CrossRef]を参照してください。
Qazi, T.; Amaratunga, T.; Barnes, E.L.; Fischer, M.; Kassam, Z.; Allegretti, J.R. 便微生物移植後の炎症性腸疾患再燃のリスクについて: システマティックレビューとメタアナリシス(Systematic Review and Meta-Analysis). Gut Microbes. 2017, 8, 574-588. [Google Scholar] [CrossRef]を参照してください。
Kassam, Z.; Dubois, N.; Ramakrishna, B.; Ling, K.; Qazi, T.; Smith, M.; Kelly, C.R.; Fischer, M.; Allegretti, J.R.; Budree, S.; et al. 便微生物移植におけるドナーのスクリーニング(Fecal Microbiota Transplantation). N. Engl. J. Med. 2019, 381, 2070-2072. [Google Scholar] [CrossRef]を参照してください。
DeFilipp、Z、Bloom、P.P.、Torres Soto、M、Mansour、M.K、Sater、M.R.A、Huntley、M.H、Turbett、S、Chung、R.T、Chen、Y.-B、Hohmann、E.L。糞便微生物移植による薬剤耐性大腸菌血症伝播。N. Engl. J. Med. 2019, 381, 2043-2050. [Google Scholar] [CrossRef]を参照してください。
Zellmer, C; Sater, M.R.A.; Huntley, M.H.; Osman, M; Olesen, S.W.; Ramakrishna, B. Shiga Toxin-Producing Escherichia Coli Transmission via Fecal Microbiota Trplant. Clin. Infect. Dis. 2021, 72, e876-e880. [Google Scholar] [CrossRef]を参照してください。
Drewes, J.L.; Corona, A.; Sanchez, U.; Fan, Y.; Hourigan, S.K.; Weidner, M; Sidhu, S.D.; Simner, P.J.; Wang, H.; Timp, W.; et al. 再発クロストリジウム症に対する便性微生物移植時の潜在的発がん性細菌の伝播とクリアランス(原題:Fecal Microbiota Transplantation for Recurrent Clostridioides Difficile). JCI Insight 2019, 4, e130848. [Google Scholar] [CrossRef] [PubMed].
Nooij, S; Ducarmon, Q.R.; Laros, J.F.J.; Zwittink, R.D.; Norman, J.M.; Smits, W.K.; Verspaget, H.W.; Keller, J.J.; Terveer, E.M.; Kuijper, E.J.; et al. 便微生物移植の影響、レシピエントの再発クロストリジオイドディフィシル患者の発癌大腸菌の影響.Gastroenterology 2021, 161, 1218-1228.e5. [Google Scholar] [CrossRef] [PubMed].
Alang, N.; Kelly, C.R. Fecal Microbiota Transplantation後の体重増加。オープンフォーラム Infect. Dis. 2015, 2, ofv004. [Google Scholar】【CrossRef】【PubMed】。
Ridaura, V.K.; Faith, J.J.; Rey, F.E.; Cheng, J.; Duncan, A.E.; Kau, A.L.; Griffin, N.W.; Lombard, V.; Henrissat, B.; Bain, J.R.; et al. Gut Microbiota from Twins Discordant for Obesity Modulate Metabolism in Mice. Science 2013, 341, 1241214. [Google Scholar] [CrossRef]を参照してください。
Basson、A.R.、Zhou、Y.、Seo、B.、Rodriguez-Palacios、A.、Cominelli、F. 炎症性腸疾患の治療における自家糞便微生物叢移植の検討。Transl. Res. 2020, 226, 1-11. [Google Scholar】【CrossRef】【PubMed】。
Rinott, E.; Youngster, I.; Yaskolka Meir, A.; Tsaban, G.; Zelicha, H.; Kaplan, A.; Knights, D.; Tuohy, K.; Fava, F.; Scholz, M.U; et al. Diet-Modulated Autologous Fecal Microbiota Transplantation on Weight Regainのエフェクト。Gastroenterology 2021, 160, 158-173.e10. [Google Scholar] [CrossRef]を参照。
David, L.A.; Maurice, C.F.; Carmody, R.N.; Gootenberg, D.B.; Button, J.E.; Wolfe, B.E.; Ling, A.V.; Devlin, A.S.; Varma, Y.; Fischbach, M.A.; et al. Diet Rapidly and Reproducibly Alters the Human Gut Microbiome. Nature 2014, 505, 559-563. [Google Scholar] [CrossRef]を参照。
Lewis、J.D.、Chen、E.Z.、Baldassano、R.N.、Otley、A.R.、Griffiths、A.M、Lee、D、Bittinger、K、Bailey、A、Friedman、E.S、Hoffmann、C、他 小児クローン病における環境ストレスとしての炎症、抗菌、食事(Inflammation, Antibiotics, and Diet as environmental Stressors of Gut Microbiome in Pediatric Crohn's Disease, et al. 細胞宿主。Microbe. 2015, 18, 489-500. [Google Scholar] [CrossRef]を参照してください。
Pigneur, B.; Lepage, P.; Mondot, S.; Schmitz, J.; Goulet, O.; Doré, J.; Ruemmele, F.M. 粘膜治癒と細菌組成における経腸栄養とステロイドベースの導入療法への反応-クローン病児におけるランダム化前向き臨床試験。J. Crohns. Colitis. 2019, 13, 846-855. [Google Scholar] [CrossRef]を参照してください。
Dziechciarz, P.; Horvath, A.; Shamir, R.; Szajewska, H. Meta-Analysis: 小児の活動性クローン病における経腸栄養剤。Aliment. Pharm. 2007, 26, 795-806. [Google Scholar] [CrossRef]を参照してください。
Swaminath, A.; Feathers, A.; Ananthakrishnan, A.N.; Falzon, L.; Li Ferry, S. Systematic Review with Meta-Analysis: 小児クローン病における寛解導入のための経腸栄養療法。Aliment. Pharm. 2017, 46, 645-656. [Google Scholar] [CrossRef]を参照してください。
Borrelli、O; Cordischi、L; Cirulli、M; Paganelli、M; Labalestra、V; Uccini、S; Russo、P.M; Cucchiara、S. 活動性小児クローン病治療におけるポリマー食単独と皮質ステロイドの対比: ランダム化比較オープンラベル試験。Clin. Gastroenterol. Hepatol. 2006, 4, 744-753. [Google Scholar] [CrossRef]を参照してください。
Miele, E.; Shamir, R.; Aloi, M.; Assa, A.; Braegger, C.; Bronsky, J.; de Ridder, L.; Escher, J.C.; Hojsak, I.; Kolacek, S.; et al. 小児の炎症性腸疾患における栄養摂取: 欧州小児消化器・肝臓・栄養学会のポルト炎症性腸疾患グループを代表してのポジションペーパー。J. Pediatr. Gastroenterol. Nutr. 2018, 66, 687-708. [Google Scholar] [CrossRef]を参照してください。
van Rheenen, P.F.; Aloi, M.; Assa, A.; Bronsky, J.; Escher, J.C.; Fagerberg, U.L.; Gasparetto, M.; Gerasimidis, K.; Griffiths, A.; Henderson, P.; et al. The Medical Management of Paediatric Crohn's Disease: ECCO-ESPGHAN Guideline Update. J. Crohn. Colitis. 2020, 15, 171-194. [Google Scholar] [CrossRef]を参照してください。
Diederen, K.; Li, J.V.; Donachie, G.E.; de Meij, T.G.; de Waart, D.R.; Hakvoort, T.B.M.; Kindermann, A.; Wagner, J.; Auyeung, V.; te Velde, A.A.; et al. Exclusive Enteral Nutrition Mediates Gut Microbial and Metabolic Changes That Are Associated With Remission in Child with Crohn's Disease. Sci. Rep. 2020, 10, 18879. [Google Scholar] [CrossRef]を参照。
Schwerd, T.; Frivolt, K.; Clavel, T.; Lagkouvardos, I.; Katona, G.; Mayr, D.; Uhlig, H.H.; Haller, D.; Koletzko, S.; Bufler, P. 活動性小児クローン病における経口栄養の導入について: 腸内細菌叢と免疫制御への影響。J. Allergy Clin. Immunol. 2016, 138, 592-596. [Google Scholar] [CrossRef]を参照。
Kaakoush, N.O.; Day, A.S.; Leach, S.T.; Lemberg, D.A.; Nielsen, S.; Mitchell, H.M. Exclusive Enteral Nutrition on Microbiota of Children with Newly Diagnosed Crohn's Disease. Clin. Transl. Gastroenterol. 2015, 6, e71. [Google Scholar】【CrossRef】【PubMed】。
Quince, C.; Ijaz, U.Z.; Loman, N.; Eren, A.M.; Saulnier, D.; Russell, J.; Haig, S.J.; Calus, S.T.; Quick, J.; Barclay, A.; et al. 独占経腸栄養中のクローン病児における便メタゲノムに見られる幅広い変調. Am. J. Gastroenterol. 2015, 110, 1718-1729; quiz 1730. [Google Scholar】【CrossRef】【PubMed】。
Ghiboub, M.; Penny, S.; Verburgt, C.M.; Boneh, R.S.; Wine, E.; Cohen, A.; Dunn, K.A.; Pinto, D.M.; Benninga, M.A.; de Jonge, W.J.; et al. Metabolome Changes With Diet-Induced Remission in Pediatric Crohn's Disease. Gastroenterology 2022, 163, 922-936.e15. [Google Scholar] [CrossRef] [PubMed].
小児クローン病治療における反復排他的経腸栄養法: 有効性と転帰の予測因子。Aliment. Pharmacol. Ther. 2014, 39, 1398-1407. [Google Scholar] [CrossRef]を参照してください。
Gerasimidis, K.; Bertz, M.; Hanske, L.; Junick, J.; Biskou, O.; Aguilera, M.; Garrick, V.; Russell, R.K.; Blaut, M; McGrogan, P.; et al. Presumptively Protective Gut Bacterial Species and Metabolites Decline in Paradoxically Associated with Disease Improvement in Pediatric Crohn's Disease during Enteral Nutrition. Inflamm. Bowel Dis 2014, 20, 861-871. [Google Scholar] [CrossRef] [PubMed].
リーチ、S.T.、ミッチェル、H.M.、エン、W.R.、チャン、L.、デイ、A.S。クローン病の子供の治療に用いられる独占的経腸栄養による腸内細菌の持続的変調。Aliment. Pharm. 2008, 28, 724-733. [Google Scholar] [CrossRef].
Keller, J.J.; Ooijevaar, R.E.; Hvas, C.L.; Terveer, E.M.; Lieberknecht, S.C.; Högenauer, C.; Arkkila, P.; Sokol, H.; Gridnyev, O.; Mégraud, F.; et al. Faecal Microbiota Transplantation 用 Stool Banking 用 Standardised Model: A Consensus Report from a Multidisciplinary UEG Working Group. United Eur. Gastroenterol. J. 2021, 9, 229-247. [Google Scholar] [CrossRef]を参照してください。
Cammarota, G.; Ianiro, G.; Tilg, H.; Rajilic-Stojanovic, M.; Kump, P.; Satokari, R.; Sokol, H.; Arkkila, P.; Pintus, C.; Hart, A.; et al. 臨床における便性微生物移植に関する欧州合意会. Gut 2017, 66, 569-580. [Google Scholar] [CrossRef] [PubMed].
Turner、D; Levine、A; Walters、T.D; Focht、G; Otley、A; López、V.N; Koletzko、S; Baldassano、R; Mack, D; Hyams, J; et al. 小児クローン病における腸内炎症を最も反映したPCDAI版はどれか?J. Pediatr. Gastroenterol. Nutr. 2017, 64, 254-260. [Google Scholar] [CrossRef]を参照。
Reitmeier, S.; Kiessling, S.; Neuhaus, K.; Haller, D. ヒト腸内細菌叢における概日リズムの比較. STAR Protoc. 2020, 1, 100148. [Google Scholar] [CrossRef] [PubMed].
Martin、M. Cutadaptはハイスループットなシーケンスリードからアダプター配列を除去する。EMBnet. J. 2011, 17, 10-12. [Google Scholar] [CrossRef]を参照。
Bolger, A.M.; Lohse, M.; Usadel, B. Trimmomatic: イルミナシーケンスデータのための柔軟なトリマー。バイオインフォマティクス 2014, 30, 2114-2120. [Google Scholar] [CrossRef]を参照。
Bonk、F.; Popp、D.; Harms、H.; Centler、F. PCRに基づく微生物群集の分類群別存在量の定量化: 定量化とよくある落とし穴の回避。J. Microbiol. Methods 2018, 153, 139-147. [Google Scholar] [CrossRef]を参照してください。
Rognes, T.; Flouri, T.; Nichols, B.; Quince, C.; Mahé, F. VSEARCH: メタゲノミクスのための多用途オープンソースツール。PeerJ 2016, 4, e2584. [Google Scholar] [CrossRef] [PubMed].
Murali, A.; Bhargava, A.; Wright, E.S. IDTAXA: A Novel Approach for Accurate Taxonomic Classification of Microbiome Sequences. Microbiome 2018, 6, 140. [Google Scholar] [CrossRef] [PubMed].
Yarza, P.; Richter, M.; Peplies, J.; Euzeby, J.; Amann, R.; Schleifer, K.-H.; Ludwig, W.; Glöckner, F.O.; Rosselló-Móra, R. The All-Species Living Tree Project: 全配列型菌株の16S RRNAに基づく系統樹. Syst. Appl. Microbiol. 2008, 31, 241-250. [Google Scholar] [CrossRef] [PubMed].
Ernst, F.G.M.; Shetty, S.A.; Borman, T.; Lahti, L.; Cao, Y.; Olson, N.D.; Waldron, L.; Ramos, M.; Bravo, H.C.; Kancherla, J.; et al. Mia: Microbiome Analysis; Bioconductor version: リリース(3.16)。2023. Available online: https://github.com/microbiome/mia (accessed on 14 February 2023).
Dixon, P. VEGAN, a Package of R Functions for Community Ecology. J. Veg. Sci. 2003, 14, 927-930. [Google Scholar] [CrossRef]を参照。
Mallick、H; Rahnavard、A; McIver、L.J; Ma、S; Zhang、Y; Nguyen, L.H; Tickle, T.L; Weingart, G; Ren, B; Schwager, E.H; et al. Population-Scale Meta-Omics Studiesにおける多変量の関連発見. PLoS Comput. Biol. 2021, 17, e1009442. [Google Scholar] [CrossRef] [PubMed].
Levine、A; Griffiths、A; Markowitz、J; Wilson、D.C.; Turner、D; Russell、R.K; Fell、J; Ruemmele、F.M.; Walters、T; Sherlock、M; 他 炎症性腸疾患のモントリオール分類に対する小児修正版: パリ分類。Inflamm. Bowel Dis. 2011, 17, 1314-1321. [Google Scholar] [CrossRef]を参照。
Ricciuto、A.; Aardoom、M.; Orlanski-Meyer、E.; Navon、D.; Carman、N.; Aloi, M.; Bronsky, J.; Däbritz, J.; Dubinsky, M.; Hussey, S.; et al. 管理最適化のための小児クローン病の予後予測: 小児炎症性腸疾患先行プログラムからの系統的レビューとコンセンサスステートメント。胃腸病学 2021, 160, 403-436.e26. [Google Scholar] [CrossRef] [PubMed].
アタラシ、K; タノウエ、T; オオシマ、K; スダ、W; ナガノ、Y; ニシカワ、H; フクダ、S; サイトウ、T; ナルシマ、S; ハセ、K; et al. ヒト微生物叢のクロストリジア株の合理的に選ばれた混合によるT Reg誘導. Nature 2013, 500, 232-236. [Google Scholar] [CrossRef] [PubMed].
Sokol, H.; Pigneur, B.; Watterlot, L.; Lakhdari, O.; Bermúdez-Humarán, L.G.; Gratadoux, J.-J.; Blugeon, S.; Bridonneau, C.; Furet, J.-P.; Corthier, G.; et al. Faecalibacterium Prausnitzii Is an anti-Inflammatory Commensal Bacterium identified by gut microbiota analysis of Crohn Diseases Patients. Proc. Natl. Acad. Sci. USA 2008, 105, 16731-16736. [Google Scholar] [CrossRef] [PubMed].
Day, A.S.; Whitten, K.E.; Sidler, M.; Lemberg, D.A. Systematic Review: 小児クローン病における栄養療法(Systematic Review: Nutritional Therapy in Paediatric Crohn's Disease). Aliment. Pharm. 2008, 27, 293-307. [Google Scholar] [CrossRef]を参照してください。
Gevers、D; Kugathasan、S; Denson、L.A; Vázquez-Baeza、Y; Van Treuren、W; Ren、B; Schwager、E; Knights, D; Song, S.J; Yassour, M; et al. The Treatment-Naive Microbiome in New-Onset Crohn's Disease. Cell Host. Microbe. 2014, 15, 382-392. [Google Scholar] [CrossRef]を参照してください。
Pascal, V.; Pozuelo, M.; Borruel, N.; Casellas, F.; Campos, D.; Santiago, A.; Martinez, X.; Varela, E.; Sarrabayrouse, G.; Machiels, K.; et al. A Microbial Signature for Crohn's Disease. Gut 2017, 66, 813-822. [Google Scholar] [CrossRef] [PubMed].
Morgan, X.C.; Tickle, T.L.; Sokol, H.; Gevers, D.; Devaney, K.L.; Ward, D.V.; Reyes, J.A.; Shah, S.A.; LeLeiko, N; Snapper, S.B.; et al. Dysfunction of Intestinal Microbiome in Inflammatory Bowel Disease and Treatment. Genome. Biol. 2012, 13, R79. [Google Scholar] [CrossRef] [PubMed].
Franzosa, E.A.; Sirota-Madi, A.; Avila-Pacheco, J.; Fornelos, N.; Haiser, H.J.; Reinker, S.; Vatanen, T.; Hall, A.B.; Mallick, H.; McIver, L.J.; et al. Inflammatory Bowel DiseaseにおけるGut Microbiome Structure and Metabolic Activity. Nat. Microbiol. 2019, 4, 293-305. [Google Scholar】【CrossRef】【PubMed】。
炎症性腸疾患における免疫細胞回路とトラフィッキングを標的とする。Nat. Immunol. 2019, 20, 970-979. [Google Scholar] [CrossRef]を参照してください。
Sorbara, M.T.; Pamer, E.G. Microbiome-Based Therapeutics. Nat. Rev. Microbiol. 2022, 20, 365-380. [Google Scholar] [CrossRef]を参照してください。
Buffie, C.G.; Pamer, E.G. Microbiota-Mediated Colonization Resistance against Intestinal Pathogens. Nat. Rev. Immunol. 2013, 13, 790-801. [Google Scholar] [CrossRef]を参照してください。
Axelrad, J.E.; Olén, O.; Askling, J.; Lebwohl, B.; Khalili, H.; Sachs, M.C.; Ludvigsson, J.F. Gastrointestinal Infection Increases Odds of Inflammatory Bowel Disease in a Nationwide Case-Control Study. Clin. Gastroenterol. Hepatol. 2019, 17, 1311-1322.e7. [Google Scholar] [CrossRef]を参照してください。
Singh, H.; Nugent, Z.; Yu, B.N.; Lix, L.M.; Targownik, L.E.; Bernstein, C.N. Inflammatory Bowel Diseaseを有する個人のClostridium Difficile Infectionの高い発症率. Gastroenterology 2017, 153, 430-438.e2. [Google Scholar] [CrossRef]を参照してください。
プライマリケアにおける炎症性腸疾患患者における一般的な感染症のリスク.人口ベースのコホート研究。BMJ Open Gastroenterol. 2021, 8, e000573. [Google Scholar] [CrossRef]を参照してください。
Nguyen, G.C.; Leung, W.; Weizman, A.V. 米国における炎症性腸疾患で入院した患者におけるバンコマイシン耐性腸球菌(VRE)感染リスクの上昇。Inflamm. Bowel Dis. 2011, 17, 1338-1342. [Google Scholar] [CrossRef]を参照してください。
Boumaza、A; Ben Azzouz、E; Arrindell、J; Lepidi、H; Mezouar、S; Desnues、B. Whipple病とTropheryma Whipplei感染症について: ベンチからベッドサイドへ。Lancet Infect. Dis. 2022, 22, e280-e291. [Google Scholar] [CrossRef] [PubMed].
Tropheryma Whippleiは常在菌である。Future Microbiol. 2013, 8, 57-71. [Google Scholar] [CrossRef] [PubMed].
Fenollar, F.; Trani, M.; Davoust, B.; Salle, B.; Birg, M.-L.; Rolain, J.-M.; Raoult, D. ヒトおよび非ヒト霊長類におけるTropheryma Whipplei無症状保菌の有病率. J. Infect. Dis 2008, 197, 880-887. [Google Scholar] [CrossRef] [PubMed].
Raoult、D; Fenollar、F; Rolain、J.M.; Minodier、P; Bosdure、E; Li、W; Garnier、J.M.; Richet、H. Tropheryma Whipplei in Children with Gastroenteritis. Emergency. Infect. Dis. 2010, 16, 776-782. [Google Scholar] [CrossRef] [PubMed].
Bulut、K; Markova、A; Canbay、A.E.; Schmidt、W.E.; Kahraman、A. Whipple病-クローン病患者におけるまれで困難な合併症。Z Gastroenterol. 2022, 60, 598-601. [Google Scholar] [CrossRef] [PubMed].
ムーサ、O.Y.、ムーサ、Y.S.、ニムリ、S.M.小腸クローン病の肉芽腫はウィップル病を覆った。Am. J. Gastroenterol. 2017, 112, S1322. [Google Scholar] [CrossRef]を参照してください。
Klochan, C.; Anderson, T.A.; Rose, D.; Dimitrov, R.K.; Johnson, R.M. 抗TNF療法を誤って受けた患者におけるウィップル病のほぼ致命的な症例. ACG Case Rep. J 2013, 1, 25-28. [Google Scholar] [CrossRef]を参照。
Liu, C.K.; Seo, J.; Pravodelov, V.; Frazier, S.; Guy, M.; Concilio, K.; Lau-Ng, R.; Brandeis, G.; Watson, J.; van der Velde, J.; et al. 介護施設居住者に対する自己糞便微生物移植のパイロットスタディ: 実現可能性と安全性。Contemp. Clin. Trials Commun. 2022, 27, 100906. [Google Scholar] [CrossRef]を参照してください。
Taur, Y.; Coyte, K.; Schluter, J.; Robilotti, E.; Figueroa, C.; Gjonbalaj, M.; Littmann, E.R.; Ling, L.; Miller, L.; Gyaltshen, Y.; et al. Autologous Fecal Microbiota Transplant by Antibiotic-Treated Patients, Reconstitution of Gut Microbiota. Sci. Transl. Med. 2018, 10, eaap9489. [Google Scholar] [CrossRef]を参照してください。
Jones、C.M.A.、Connors、J.、Dunn、K.A.、Bielawski、J.P.、Comeau、A.M.、Langille、M.G.I、Van Limbergen、J。Bacterial TaxaとFunction are predictive of Sustained Remission Following Exclusive Enteral Nutrition in Pediatric Crohn's Disease. Inflamm. Bowel Dis. 2020, 26, 1026-1037. [Google Scholar] [CrossRef]を参照してください。
Dunn, K.A.; Moore-Connors, J.; MacIntyre, B.; Stadnyk, A.W.; Thomas, N.A.; Noble, A.; Mahdi, G.; Rashid, M.; Otley, A.R.; Bielawski, J.P.; et al. Microbial Community Structureにおける初期の変化は小児クローン病の栄養療法後の持続的寛解と関連する. Inflamm. Bowel Dis. 2016, 22, 2853-2862. [Google Scholar] [CrossRef] [PubMed].
Paramsothy, S.; Paramsothy, R.; Rubin, D.T.; Kamm, M.A.; Kaakoush, N.O.; Mitchell, H.M.; Castano-Rodriguez, N. 炎症性腸疾患に対する便性微生物移植術.システマティックレビューとメタアナリシス。J. Crohn. Colitis. 2017, 11, 1180-1199. [Google Scholar】【CrossRef】【PubMed】。
Kump, P.; Wurm, P.; Gröchenig, H.P.; Wenzl, H.; Petritsch, W.; Halwachs, B.; Wagner, M.; Stadlbauer, V.; Eherer, A.; Hoffmann, K.M.; et al. The Taxonomic Composition of Donor Intestinal Microbiota Is a Major Factor Influencing the Efficacy of Faecal Microbiota Transplantation in Therapy Refractory Ulcerative Colitis. Aliment. Pharm. 2018, 47, 67-77. [Google Scholar] [CrossRef] [PubMed].
Sanchis-Artero, L.; Martínez-Blanch, J.F.; Manresa-Vera, S.; Cortés-Castell, E.; Valls-Gandia, M.; Iborra, M.; Paredes-Arquiola, J.M.; Boscá-Watts, M.; Huguet, J.M.; Gil-Borrás, R.; et al. 抗TNFα治療後のクローン病患者の腸内微生物相における変化評価.Sci. Rep. 2021, 11, 10016. [Google Scholar] [CrossRef] [PubMed].
Charbonneau, M.R.; Isabella, V.M.; Li, N.; Kurtz, C.B. Developing a New Class of Engineered Live Bacterial Therapeutics to Treat Human Diseases. Nat. Commun. 2020, 11, 1738. [Google Scholar] [CrossRef]を参照。
免責事項/出版社からの注意事項:すべての出版物に含まれる声明、意見、データは、個々の著者および寄稿者のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示または製品に起因する人または財産の損害について責任を負わない。
© 2023 by the authors. ライセンシー MDPI, Basel, Switzerland. この記事は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件に基づいて配布されるオープンアクセス記事です。
共有と引用
MDPIおよびACSスタイル
Hoelz、H、Heetmeyer、J、Tsakmaklis、A、Hiergeist、A、Siebert、K、De Zen、F、Häcker、D、Metwaly、A、Neuhaus、K、Gessner、A、Vehreschild、M.J.G.T、Haler、D、Shwerd、T 小児クローン病患者で経口栄養補給後に自己便微生物群移行は合理性と実行性があるか?フィージビリティ・テストによるデータ。Nutrients 2023, 15, 1742. https://doi.org/10.3390/nu15071742.
AMAスタイル
Hoelz H, Heetmeyer J, Tsakmaklis A, Hiergeist A, Siebert K, De Zen F, Häcker D, Metwaly A, Neuhaus K, Gessner A, Vehreschild MJGT, Haller D, Schwerd T: Is Autologous Fecal Microbiota Transfer after Exclusive Enteral Nutrition in Pediatric Crohn's Disease Patients Rational and Feasible? Feasibility Testのデータ。Nutrients. 2023; 15(7):1742。https://doi.org/10.3390/nu15071742。
シカゴ/トゥラビアンスタイル
Hoelz, Hannes, Jeannine Heetmeyer, Anastasia Tsakmaklis, Andreas Hiergeist, Kolja Siebert, Federica De Zen, Deborah Häcker, Amira Metwaly, Klaus Neuhaus, André Gessner, Maria J. G. T. Vehreschild, Dirk Haller, and Tobias Schwerd. 2023. "Is Autologous Fecal Microbiota Transfer after Exclusive Enteral Nutrition in Pediatric Crohn's Disease Patients Rational and Feasible? Data from a Feasibility Test" Nutrients 15, no. 7: 1742. https://doi.org/10.3390/nu15071742.
他のスタイルを探す
なお、2016年創刊号より、本誌はページ番号ではなく記事番号を使用しています。詳しくはこちらでご確認ください。
記事メトリックス
引用文献
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
記事アクセス統計
記事アクセス統計記事閲覧数2. 4月3日 4月4日 4月0100200300400
ジャーナル統計の詳細については、こちらをご覧ください。
同一IPアドレスからの複数のリクエストは、1回の閲覧としてカウントされます。
Nutrients, EISSN 2072-6643, 発行:MDPI
RSSコンテンツアラート
その他の情報
論文処理料請求書の支払いオープンアクセスポリシーお問い合わせMDPIJobs at MDPI
ガイドライン
著者向け査読者向け編集者向けライブラリアン向け出版社向け学会向け会議主催者向け
MDPIの取り組み
SciforumMDPI BooksPreprints.orgScilitSciProfilesEncyclopediaJAMSProceedings Series
MDPIをフォローする
LinkedInFacebookTwitter
MDPIジャーナルからの発行通知やニュースレターを受信するために登録します。
音響学 アクチュエーター 行政科学 思春期 呼吸器医学の進歩 航空宇宙 農業工学 農薬 農学 AI 空気 アルゴリズム アレルギー 合金 アナリティクス アナトミア 動物 抗生物質 抗酸化物質 応用生命科学 応用力学 応用微生物学 応用ナノ 応用科学 応用システム革新 応用化学 応用数学 水産学 雑誌 建築 生物節 芸術 天文 大気 原子 オーディオロジー 研究 自動化 アクシオン バクテリア バッテリー 行動科学 飲料 ビッグデータ・認知コンピューティング バイオケム バイオエンジニアリング バイオロジクス 生物学・生命科学フォーラム バイオマス バイオメカニクス バイオメディシン バイオミメティクス バイオ分子 バイオフィジカ バイオセンサー バイオテック 鳥 ブロックチェーン 脳科学 建物 ビジネス C がん 心遺伝学 触媒 細胞 セラミックス 挑戦 化学工学 化学論文集 ケモセンサー 子どもたち チップス CivilEng クリーンテクノロジー 気候 臨床とトランスレーショナル神経科学 臨床と実践 時計と睡眠 コーティング コロイドと界面 色材 商品 複雑さ 化合物 計算 コンピュータ科学と数学 フォーラム コンピュータ 物性 保存 建設材料 腐食と材料劣化 化粧品 COVID 作物 暗号 結晶 分子生物学の最新の課題 現在の腫瘍学 乳製品のデータ 歯学 ジャーナル Dermato Dermatopathology Designs Diabetology Diagnostics Dietetics Digital Disabilities Diseases Diversity DNA Drones Drugs and Drug Candidates Dynamics Earth Ecologies Econometrics Economies Education Sciences Electricity Electrochem Electronic Materials Electronics Encyclopedia Endocrines Energies Eng Engineering Proceedings Entropy Environmental Sciences Proceedings Environ Epidemiologia Epigenomes European Burn Journal European Journal of Investigation in Health、 心理学と教育 発酵 繊維 FinTech 火 魚 流体 食品 予測 法医学 森林 基礎 フラクタルとフラクタル 燃料 未来 未来 インターネット 未来 薬学 未来 交通 銀河 ゲーム ガス 胃腸学 洞察 胃腸障害 美食 ゲル 系図 遺伝子 地理学 GeoHazards Geomatics Geosciences Geotechnics Geriatrics 痛風、ウラテ、 と結晶析出症 草 ハードウエア ヘルスケア ハート ヘマトロジー レポート ヘリテージ ヒストリー ホーティカルチュラエ ホスピタル 人文学 水素学 水素学 衛生学 免疫 感染症 レポート インフォマティクス 情報インフラ 無機物 昆虫 楽器 国際環境研究・公衆衛生ジャーナル 国際金融ジャーナル 国際分子科学ジャーナル 新生児スクリーニング 国際植物バイオロジー 国際翻訳医学ジャーナル 国際タービン機械ジャーナル、 推進力と動力 国際医学教育 発明 IoT ISPRS International Journal of Geo-Japan 情報誌 加齢・長寿ジャーナル 循環器発達・疾患ジャーナル 臨床・トランスレーショナル眼科ジャーナル 複合材料科学ジャーナル サイバーセキュリティ・プライバシージャーナル 発達生物学ジャーナル 実験・理論解析ジャーナル 機能性バイオマテリアル・ジャーナル of Functional Morphology and Kinesiology Journal of Fungi Journal of Imaging Journal of Intelligence Journal of Low Power Electronics and Applications Journal of Manufacturing and Materials Processing Journal of Marine Science and Engineering Journal of Molecular Pathology Journal of Nanotheranostics Journal of Nuclear Engineering Journal of Otorhinolaryngology Journal、 聴覚と平衡医学 Journal of Personalized Medicine Journal of Respiration Journal of Risk and Financial Management Journal of Sensor and Actuator Networks Journal of Theoretical and Applied Electronic Commerce Research Journal of Vascular Diseases Journal of Xenobiotics Journal of Zoological and Botanical Gardens Journalism and Media Kidney and Dialysis Kinases and Phosphatases Knowledge Land Language Laws Life Liquids Literature Livers Logics Lubricants Lymphatics 機械学習と知識抽出機 Macromol 磁性 磁性化学 海洋薬剤 材料 論文集 数理・計算応用 数学 医学 医学フォーラム メディシン メンブレン メリット メタボライト 金属 気象学 メタン 方法とプロトコル 計測学 マイクロ微生物学 研究 マイクロマシン 微生物 マイクロプラスチック 鉱物 鉱山 モデリング Molbank Molecules Multimodal Technologies and Interaction Muscles ナノエネルギーの進歩 ナノマテリアル NDT Network Neuroglia Neurology International NeuroSci Nitrogen Non-. コーディングRNA 看護レポート 栄養補助食品 栄養素 肥満症 大洋 オンコ オプティクス オーラル オーガニクス オステオロジー 酸素 パラシトロジア パーティクル 病原体 病態生理 小児レポート 医薬品 薬学 薬物療法 薬学哲学 フォトケム フォトニクス フィコロジー フィケム 物理科学フォーラム 物理学 Physiologia 植物 Plasma プラットフォーム 汚染物質 高分子 多糖類 家禽類 粉体 論文集 プロセス プロテオーム 精神医学 国際サイコアクティブ 出版物 量子ビーム科学 量子レポート 四元放射線反応 受容体 リサイクル 宗教 リモートセンシング レポート 生殖医療 資源 リウマチ リスク ロボット工学 反芻動物 安全 科学 サイエンティア 薬剤学 硬化症 種子 センサー 分離 性別 信号 副鼻腔炎 スマートシティ 社会科学 社会 ソフトウェア 土壌システム 太陽固体 分光学 雑誌 スポーツ 規格 統計 ストレス 表面 手術 手術技術 開発 持続可能性 持続可能化学 対称性 シンバイオ システム 目標 分類技術 通信 繊維製品 サラセミア レポート サーモトモグラフィー 観光とホスピタリティ 毒素 移植学 トラウマケア 高等教育の動向 熱帯医学と感染症 ユニバース 都市科学 ウロワクチン 乗り物 獣医学 振動 仮想世界 ウイルス 視覚 廃棄物 水 風 女性 世界 電気自動車 雑誌 若者 人獣共通感染症
オプションを選択
サブスクライブ
特に断りのない限り、© 1996-2023 MDPI (スイス・バーゼル)
免責事項 ご利用規約 プライバシーポリシー
この記事が気に入ったらサポートをしてみませんか?
