
7-1. 酸化と還元
こんにちは、おのれーです。少し日が開きましたが、また記事を書いていこうと思います。
今回からはついに化学基礎の最終章「酸化還元反応」です。実は私、高校の時、この単元が非常に苦手でした。でも、この酸化還元反応が分かると、専門の化学を学ぶときに非常に役立ちます。
では早速、中身を見ていきましょう。
■そもそも「酸化」って何?
「酸化」という言葉ですが、元々の由来は、「酸素と化合する」というところからきています。つまり、酸化とは、"酸素とくっつくこと"だと考えられます。
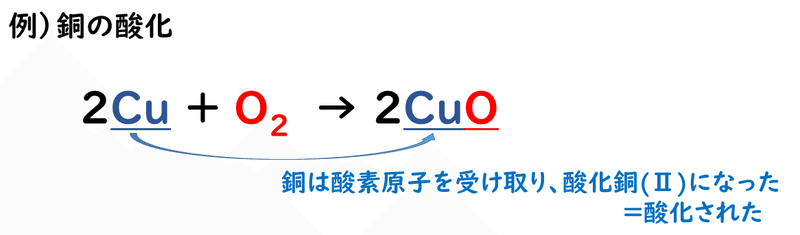
また、酸化してできた物質を酸化物といいます。金属のさびも、酸化鉄、酸化銅など、酸化の一種です。
一方で、酸化物から酸素がとり去られる化学変化のことを、還元といっています。還元という言葉は「還」も「元」も ”もとに戻る” という意味があります。酸素と結びついている状態から、もとの結びついていない状態に戻るから「還元」と思っていてください
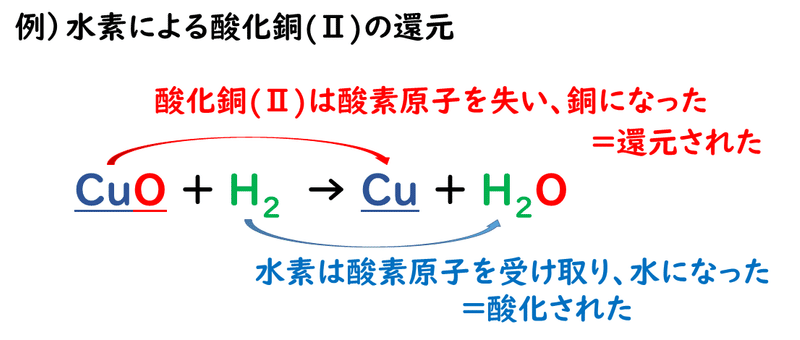
上の反応で、酸化銅(Ⅱ)CuOは酸素原子を失い、銅Cuになっているので還元されていますが、水素H2は酸素原子を受け取って水H2Oなっているので酸化されています。このように、酸化と還元は同時に起きる反応なので、合わせて酸化還元反応といいます。
ではここで、問題を解いてみましょう。

■酸素原子が無くても、酸化還元反応??
酸素原子のやり取りによって定義されている酸化還元反応ですが、酸素原子が反応に関係していなくても、「酸化還元反応」と呼ぶことがあります。
ここで、メタンCH4の燃焼反応について考えてみましょう。
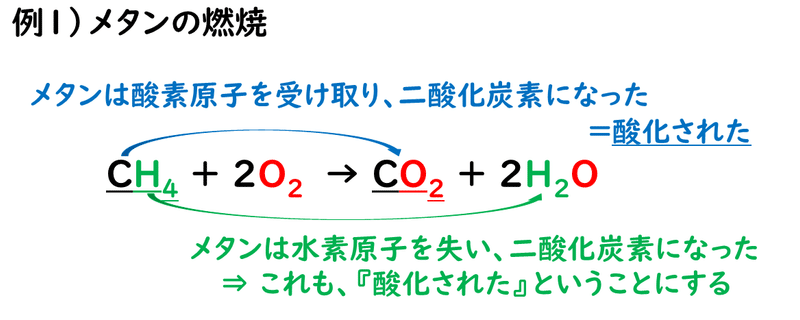
燃焼反応とは、物質が光と熱を出しながら、酸素と激しく結びつく反応のことです。なので、物を燃やすと、その物質は酸化されます。
この反応の場合、メタンCH4は燃焼して、二酸化炭素CO2と水H2Oに変化します。このとき、メタンは酸素原子を受け取り、二酸化炭素になったと考えられますので、「メタンは酸化された」といえます。一方で、メタンは酸素原子を得るために、もともと持っていた水素原子Hを失っています。要は、酸化するために、水素原子を失うこともあるわけです。
このように、物質が酸素と反応するときには、酸素と結びつく代わりに水素を失うことがあります。そこで、水素を失う反応も酸化といい、逆に水素と結びつく反応も還元と定義することもできます。
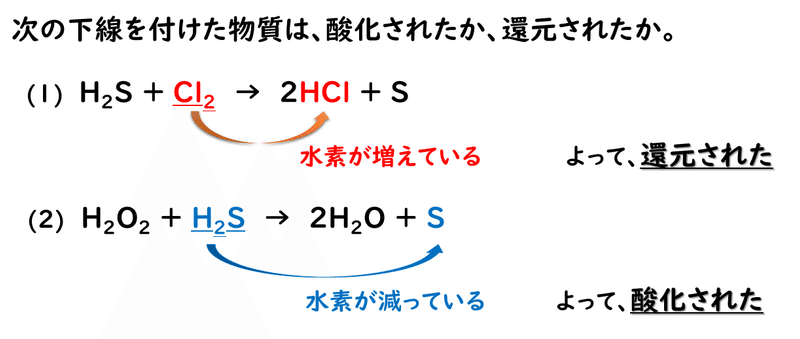
では、酸素原子が出てこない反応についても、この定義をあてはめて、酸化されているか、還元されているのかを考えてみましょう。
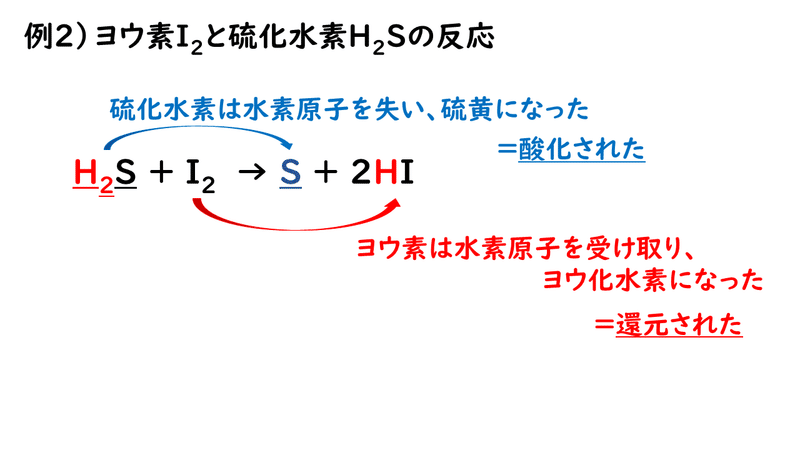
このように考えれば、酸素原子が関わらない反応でも、酸化されたり、還元されたりということがあるのだということが分かるかと思います。
ここでまた、問題を解いてみましょう。
■なぜ、酸素原子が関係しなくても酸化還元反応と言えるのか??
とはいえ、酸素原子が関係していないのに、酸化とか還元とかいうのは、何だか釈然としない、という方もいらっしゃるのではないのでしょうか。
なぜ、酸素原子が関係していないのに、酸化・還元という言葉を用いるかということを個々では考えてみたいと思います。
先ほど学習した「酸素や水素のやりとりによる酸化・還元の定義」は、古くから使われてきたものです。20世紀に入ると、金属が酸素と結びついて酸化物になるのと、硫黄や塩素と結びついて硫化物や塩化物になる反応には共通性があるということが分かってきました。そして、それらの反応に共通することは、「物質の間で電子のやりとりが行われている」ということだったのです。
そこで、酸素原子が関係していなくても、物質の間で電子のやり取りが行われている反応のことを、広い意味での酸化・還元というようになりました。
では具体的に、「銅の酸化反応」を例として、電子のやりとりがどうなっているか、イオン反応式を書いて考えてましょう。
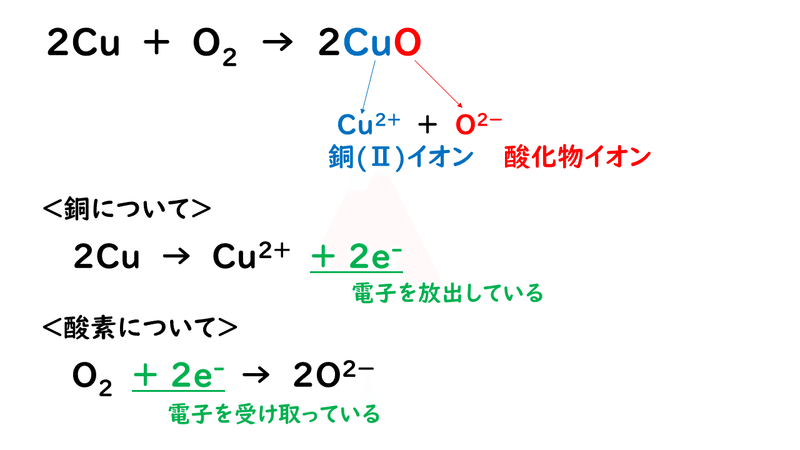
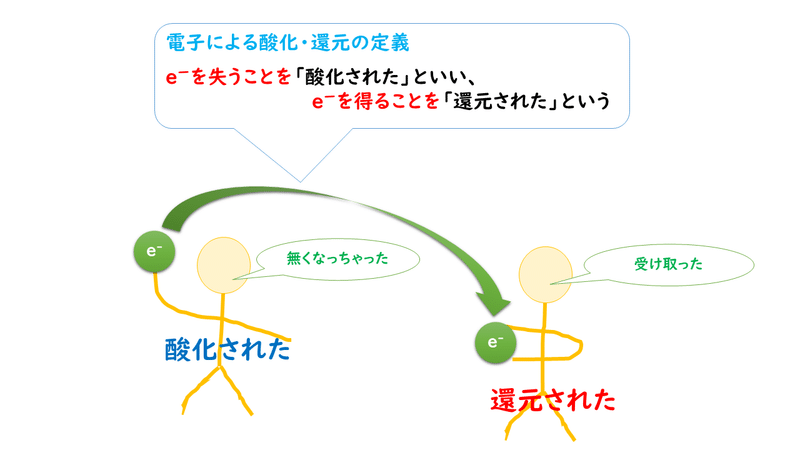
これを見てみると、銅Cuが酸化されて酸化銅CuOになるとき、電子e-を放出して、銅(Ⅱ)イオンCu2+に変化しています。したがって、物質が電子を放出するとき、その物質は酸化されたといいます。
また、酸化還元反応は同時に起こるはずなので、銅が酸化されるとき、相手の物質である酸素O2は還元されていると考えることができます。そして、酸素が還元されるとき、電子e-を受け取って、酸化物イオンO2-に変化していることから、物質が電子を受け取るとき、その物質は還元されたといいます。
電子を失う物質があれば、必ず電子を受け取る物質が存在するので、酸化と還元は同時に起こります。そこで、このような反応を酸化還元反応といいます。いわば、酸化還元反応とは、「電子のキャッチボール反応」であると考えることができます。
今まで学習してきた酸素や水素のやりとりによる定義は、酸素や水素が関係した反応において酸化・還元を判定する場合には、とてもわかりやすくて便利な定義です。しかし、酸素や水素が関係する反応にしか適用することができません。
一方、電子のやりとりによる定義は、電子のやりとりがありさえすれば、酸素や水素が関係しない反応にも適用することができます。
電子のやりとりによる定義は、OやHという原子のレベルではなく、化学結合に深く関係している電子のレベルで酸化・還元を定義しています。これにより、酸化・還元の考え方をいろいろな反応に適用できるようになったのです。したがって、これ以降では「酸化還元とは、電子のやりとり(=電子の移動)によって起こる反応のことで、物質がOやHと結びついたり、OやHを失ったりする反応は、酸化・還元の一種である」ととらえるようにしよう。
では最後に練習問題に取り組んでみましょう。
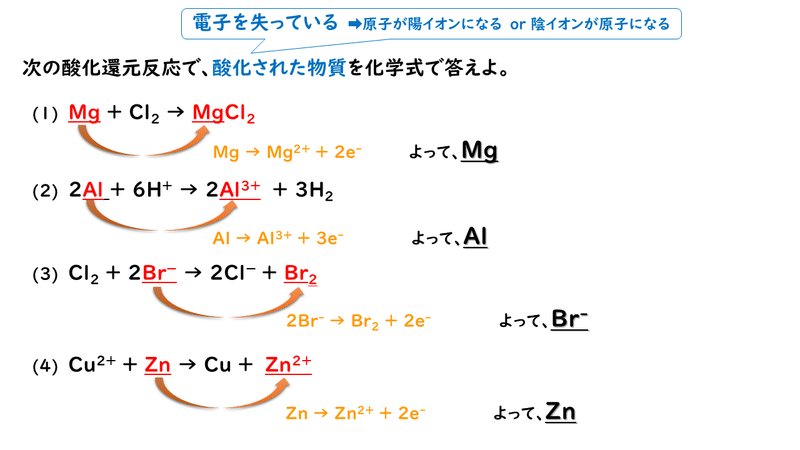
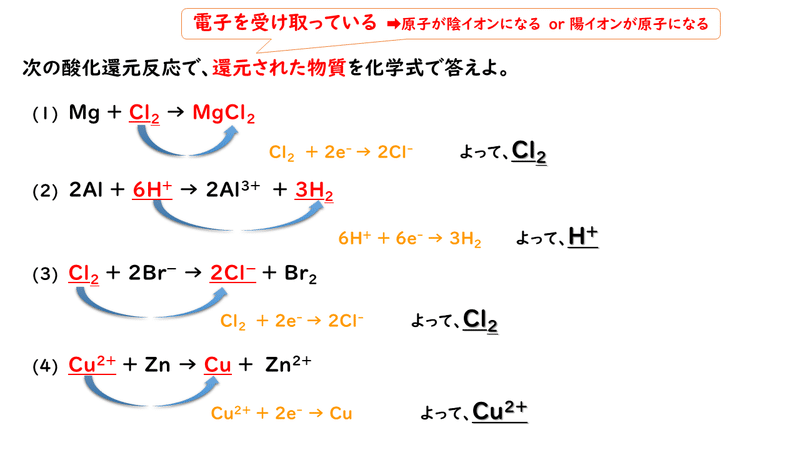
今回はここまでです。
次回は、かんたんに酸化・還元の定義を考える方法について見ていきたいと思います。お楽しみに!
この記事が気に入ったらサポートをしてみませんか?
