
ビールと水〜③水は変わり者(水の形と水素結合)
前回からの続き
前回は、水が「特異的な構造を持ち、特異的な性質を持つ物質」つまり変わり者であること、それが極性や水素結合に由来するという内容でした。極性と溶解力の話までしましたので、今回はその続きとして水素結合について書きます。
水分子の形
水素結合の説明に入る前に水分子の形について確認していきたいと思います。今更ではありますが水分子H2Oは酸素原子1つに水素原子が2つ結合(共有結合)した分子です。これらの原子同士は適当な角度で結合しているわけではなく、決まった角度で結合しています。
この角度の求め方について、確からしいとされている理論にVSEPR(原子価殻電子対反発則)というのがあります。ざっくりいうと電子対どうしが互いに反発することでできるだけ遠ざかろうとすると仮定し、その角度を予測するものです。例えば水分子H2Oやメタン分子CH4のように電子対が4つある分子だと、正四面体の真ん中に中心原子を置き、4つの電子対がそれそぞれの角(頂点)に伸びているモデルとして考えます。

正四面体の中心角は109.5度なのですが、水分子は共有電子対どうしが104.5度です。これは共有電子対と非共有電子対では反発力が異なり、共有電子対の方がより反発力が強いためです。一方、メタン分子はすべての電子対が共有電子対なので、それぞれの角度は正四面体の中心角と同じ109.5度になります。
※非共有電子対は「孤立電子対」とか「ローンペア」という名称のほうが一般的かもしれません。

水分子が実際どういう構造をしているか、モデルの表し方は実際にはいろいろです。模型で表すと球棒モデル(左)や空間充填モデル(右)がメジャーな気がします。真ん中のは球棒モデルで非共有電子対をバルーンで表したものです。
水素結合とは
さてさて、本題の水素結合について。水素結合は分子と分子の間に働く分子間相互作用(分子間力)の一種です。分子内の電子の偏りによって発生するクーロン力(電気的な力)によって水素と別の分子の非共有電子対が結合します。分子を作る結合である共有結合やイオン結合と違って、水素結合は分子同士が緩く結合するイメージです。
水の水素結合が有名ですが、水以外でも、タンパク質の高次構造、DNAの塩基の結合などもよく知られる水素結合の例です。また、エタノールなどヒドロキシ基(OH)を持つ分子も水素結合します。
電気陰性度と水素結合
電気陰性度についてもざっくり解説します。1932年にポーリングという人が表したものです。

電気陰性度が最大であるフッ素の値を4.0として、相対的に表された指数です(測定の精度が上がって今はフッ素の電気陰性度は3.98とされます)。フッ素(3.98)以外だと、酸素(3.44)、窒素(3.04)なども高く、これらと水素(2.20)の電気陰性度の差の大きさが水素結合の強さに関係します。ちなみになぜ水素結合に関与するのが水素かというと水素がとても小さく、相手の分子の非共有電子対との距離が近くなるからと言われています。なので酸素(3.44)と炭素(2.55)だと一見水素結合が成立しそうですが、両原子が大きいため距離が遠く、水素が関与した時ほどの強い結合力にならないということです。同様に塩素(3.16)と水素(2.20)も塩素が大きすぎて距離が離れてしまうため水素結合が成立しません。
ちなみに、マリケンという人が1934年、電気陰性度はイオン化エネルギーと電子親和力の和に比例するという説をとなえています。今はポーリングの定義が使われることが多いですが、電気陰性度がイオン化エネルギーと関係していることは押さえておきたいポイントです。
融点・沸点への影響
分子量が大きくなると分子間に働くファンデルワールス力が大きくなるので、分子量と融点・沸点は正の相関関係にあります。ところが水素結合を持つ水分子(H2O)は沸点が非常に高いです。これは熱エネルギーによって動き出して気体になろうとする水分子を水素結合が一定程度繋ぎ止めているからとされています。
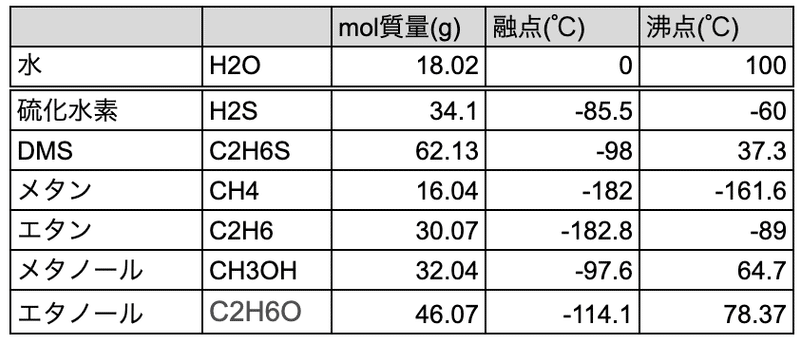
とくに水分子は一つの分子に対して周りに4つの水素結合ができます。これもあってメタノールやエタノールより水素結合性が強く、沸点も高くなっています。

水の沸点の高さのお陰でビールの仕込では十分な煮沸をすることで、DMSを飛ばすことができます。またお湯として使うことで、安全で効果が高い洗浄や殺菌ができるというわけです。
水素結合の強さ
「水素結合は弱い結合」と言われることが多いです。高校化学の学習サイトとかWikipediaには「水素結合は共有結合やイオン結合に比べるとだいぶ弱い」という趣旨のことがふわっと書かれています。下記のような不等号式を見かけることもあります。
共有結合>イオン結合>金属結合>>水素結合>ファンデルワールス力
前提として、分子間相互作用は分類上ひとまとめにして弱いとされることが多いようです。ところが、私の手元にある『カラー図解 アメリカ版 新・大学生物学の教科書 第1巻 細胞生物学』という書籍だと、以下のように記されています。

ん?水素結合はイオン結合と同程度の強さ??かなり食い違う情報ですが、どちらも根拠(実証方法とか)となるソースを辿れなかったので、真偽はよく分かりません。「生理的条件下」というのが鍵になるかな。とはいえ「水素結合は意外と強い」ということは言えると思います。そもそもDNAの塩基を結合したり、タンパク質の構造を支えている大事なところに使われる結合なので弱いということはないです。それがイオン結合と同じくらいの強さかどうかは要検証という感じでしょうか。
変わり者の原因
「意外と強いけど共有結合ほどは強くない」という水素結合の絶妙な強さは水の特異的な性質に影響を与えています。融点・沸点以外にも表面張力や比熱容量の強さ、気化熱なども水素結合で説明できます。また、VSEPR法で求めることができる水分子の形が水素結合で構造化されることで、固体の氷は液体の水より密度が低くなります。だから氷が水に浮くし、湖沼の水が底まで全部凍ることはめったにないです。ビールには直接関係しないことも多いのでこれ以上の説明は割愛しますが、前回と合わせたまとめとしては「水は変わり者であり、その原因は極性と水素結合」です。
次回へと続く
「水は変わり者」、どうだったでしょうか。水のことを説明するためには、極性や水素結合は避けて通れないと思い、少し長くなりましたが導入編として書いてみました。次回は「酸と塩基」です。これも避けて通れない基礎知識なのでまたまたお付き合いください。
お読みくださりありがとうございます。この記事を読んで面白かったと思った方、なんだか喉が乾いてビールが飲みたくなった方、よろしけばこちらへどうぞ。
新作情報。Off Trailの新ビールがなんと缶で登場です。Off Trailとしてははじめてバレルエイジングではないブレッドペールエールとして造っています。
https://faryeast.com/news/22526/

この記事が気に入ったらサポートをしてみませんか?
