
KRAS変異肺癌について学んでみた2022.8
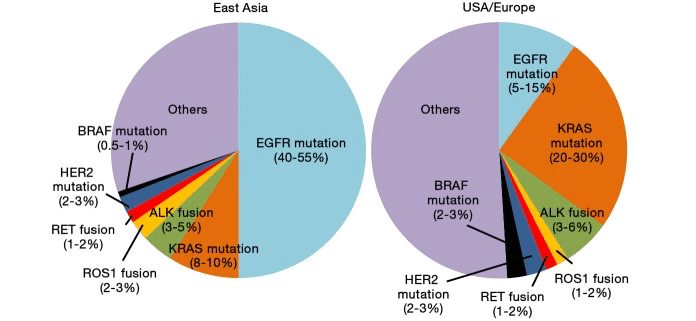
肺腺癌におけるKRAS変異の頻度
EGFR変異と逆で、アジアではKRAS変異は少ない
・肺腺癌において、欧米人では発現頻度高く、25%程度。
・対して、東アジアでは、KRAS変異は肺腺癌の8-10%程度と頻度は低い。
・日本におけるNon-Sq-NSCLCのうち、KRAS変異は15%で、変異サブタイプ別はKRAS G12Cが4.5%(KRAS変異の中では29%)と最多。
・KRAS、EGFR、ALKの遺伝子変異はは相互排他的
KRAS変異NSCLCは喫煙と高い関連
腺癌のうち、KRAS変異は喫煙者では34%、非喫煙者では6%に認められ、喫煙者に多い。
*また別の意味合いになるが、IMAはKRAS変異が69%に認められる。
日本におけるNon-Sq-NSCLCのうち、KRAS変異は15%で、変異サブタイプ別はKRAS G12Cが4.5%(KRAS変異の中では29%)と最多。[1]
*G12C=コドン12のGGTからTGTへの変異←タバコの影響が示唆
*大腸癌や膵癌で頻度の高いKRAS変異はG12D(コドン12のGGT→GAT変異)
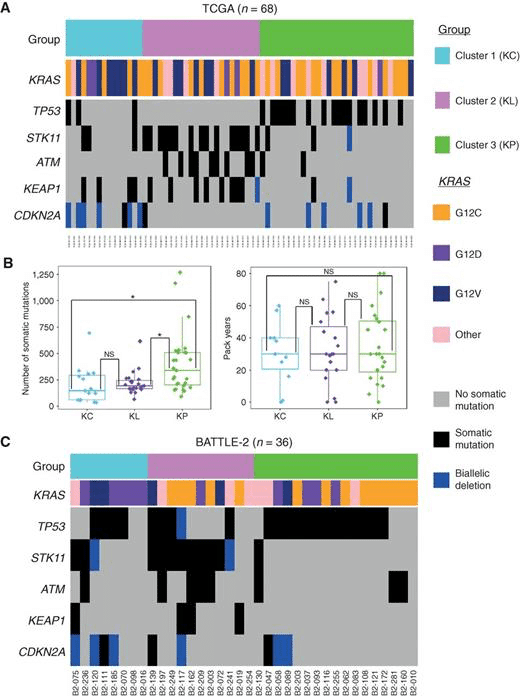
KRAS変異陽性肺癌には3つのサブグループがある
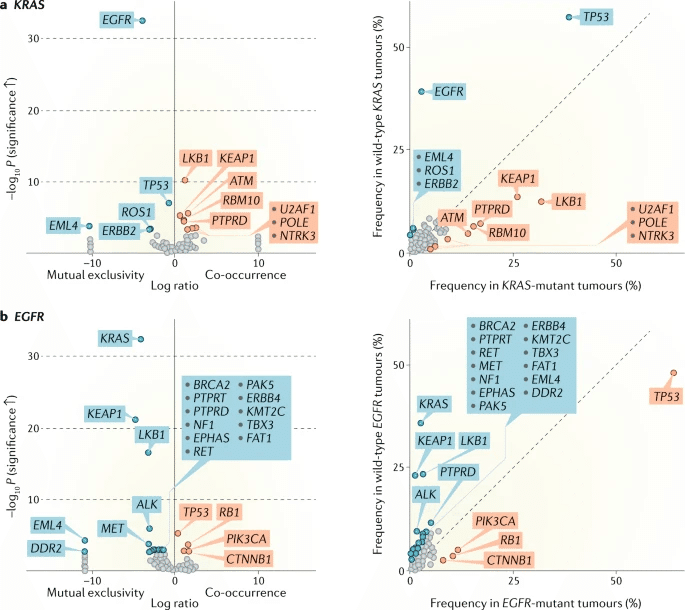
肺癌における共変異 Co-occurring genomic alterations
Driver mutaionの肺癌の治療などを考慮する上で、そのHeterogeneityには共変異の有無がサブグループ化の一つのキーワードであるとされる。
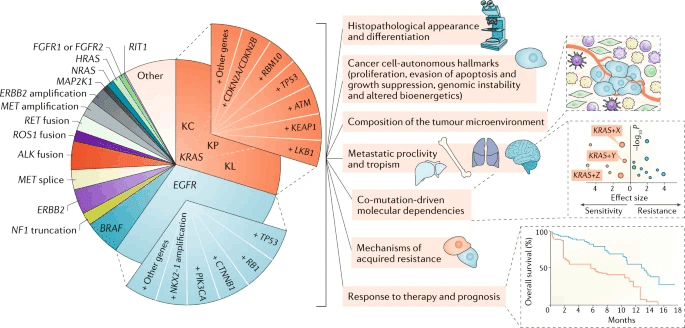
KRAS変異とその共変異による3つのサブグループ
KRAS変異陽性肺癌における、共変異の頻度はTP53> STK11>KEAPで30%〜10%程度。どの共変異をもつかで、特徴が変わる。
①STK11/LKB1(KL群):KEAP1変異の不活性化率が高く、PD-L1を含む免疫マーカーの発現が低い。
→Cold tumor:免疫チェックポイント分子の発現が乏しい腫瘍微小環境になる
②TP53(KP群):体細胞変異、炎症マーカー、TMB高、PD-L1高発現、無再発生存 RFSが一番良好で合った。
→Hot tumor:免疫チェックポイント分子が活性化されて高い免疫原性を示す
③CDKN2A/B不活性化&NKX2-1(TTF1)低発現(KC群):粘液性の組織構造を示し、mTORC1シグナルが抑制されていることが多い。
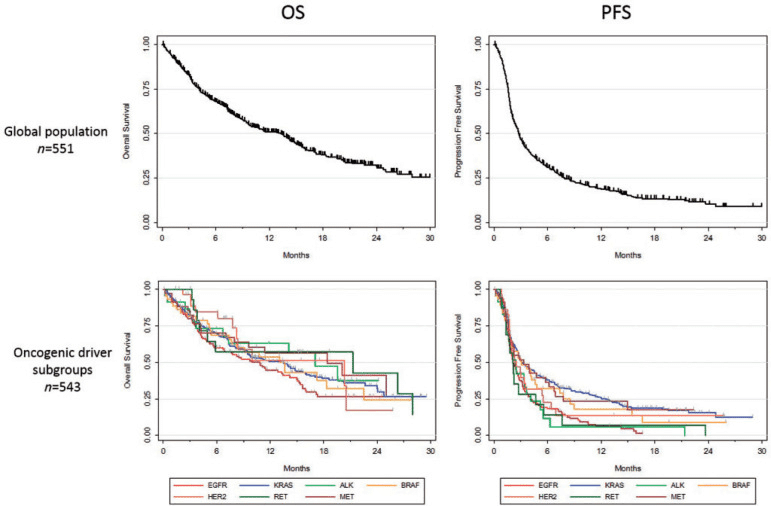
KRAS変異のあるNSCLCへのICIの有効性はKRAS変異無しと同様
2013年4月から2017年6月
ICIによる治療を受けた進行NSCLC患者282人
・KRAS変異あり162(57.4%)
・その他の変異あり27(9.6%)
・Wild-type 93(33%)
KRAS変異型NSCLCとその他のNSCLCの間で、客観的奏効率、無増悪生存期間、全生存期間について有意差は認めらなかった。
主要なKRAS変異サブタイプ(G12A、G12C、G12D、G12V、G13C)間でも、全生存期間や無増悪生存期間に有意差なし。
KRAS変異型NSCLC患者において、ICIの有効性は他のタイプのNSCLC患者と同様。
Jeanson A, Tomasini P, Souquet-Bressand M, et al. Efficacy of Immune Checkpoint Inhibitors in KRAS-Mutant Non-Small Cell Lung Cancer (NSCLC). J Thorac Oncol. 2019;14(6):1095-1101. doi:10.1016/j.jtho.2019.01.011
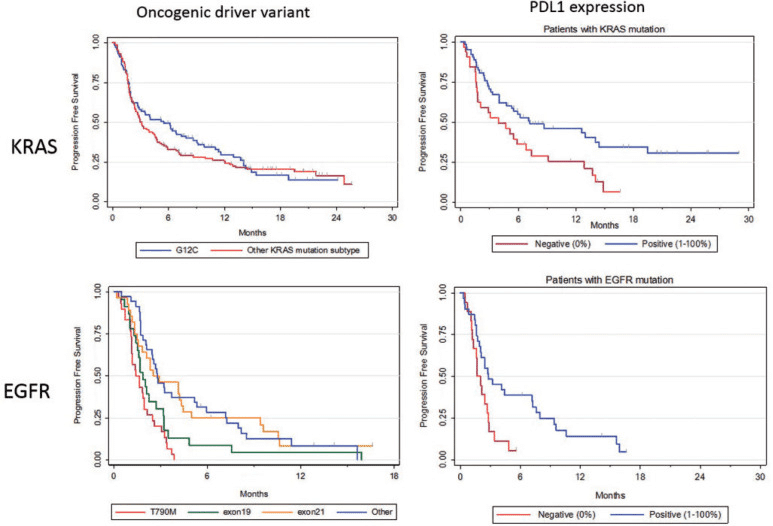
KRAS+患者では、PD-L1陽性患者でPFS延長
Mazieres J, Drilon A, Lusque A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019;30(8):1321-1328. doi:10.1093/annonc/mdz167
We conducted a retrospective study for patients receiving ICI monotherapy for advanced NSCLC with at least one oncogenic driver alteration.
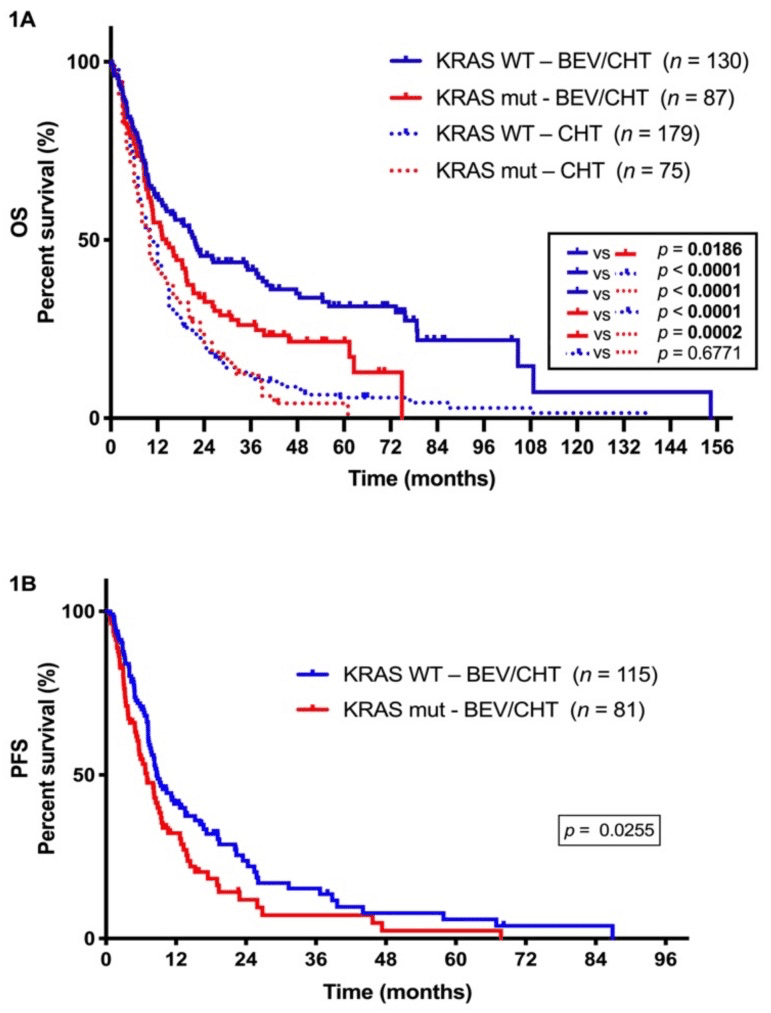
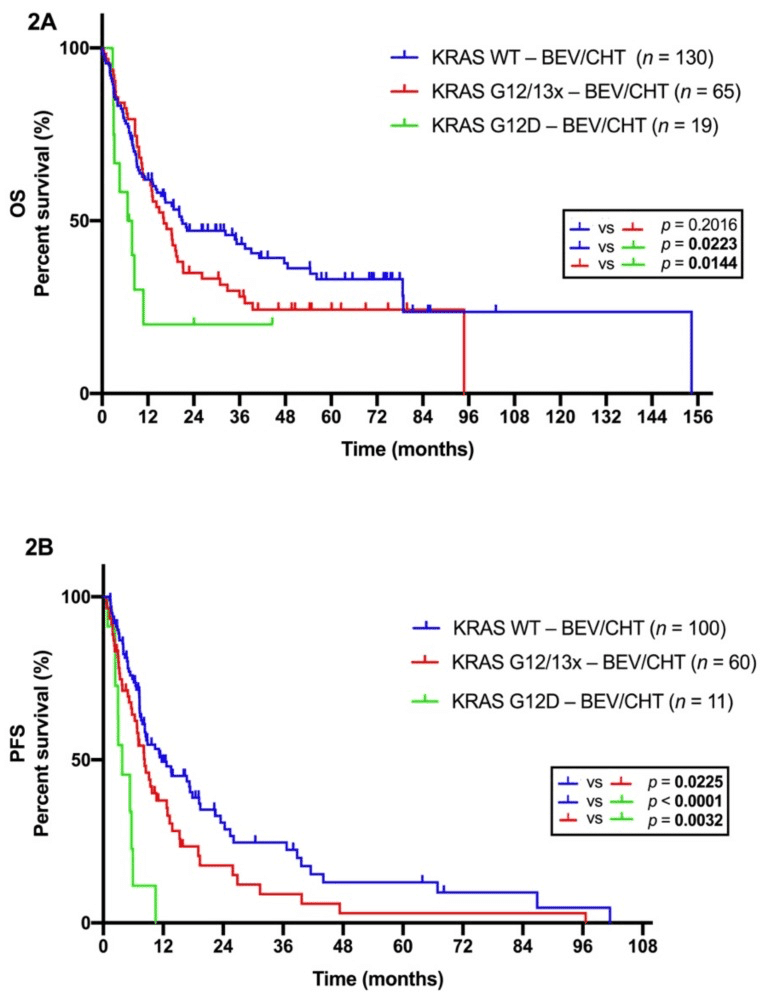
KRAS変異のある肺癌では、ChemoにBEVを追加する効果が減弱か。
BEVを併用または非併用Pt. Chemo(CHT)を1stで施行
ステージIIIB-IV LADC患者 501例
BEV/CHT 247例
CHT 254例
のうち、それぞれ
95例(38.5%)
75例(29.5%)
がKRASの変異を有していた。
CHT単独群では、KRAS変異型とKRAS野生型との間でOSに差は認められなかった(p=0.6771)
KRAS変異型腫瘍の患者において、BEV/CHT群はPFS(p=0.0255)およびOS(p=0.0186)が有意に短くなった。
KRAS変異は,BEV/CHT群におけるPFS(ハザード比,0.597,p=0.011)およびOS(ハザード比,0.645,p=0.012)短縮の独立予後不良因子。
G12D変異は、BEVに適さないKRAS変異型LADC患者のサブセットを定義している可能性がある。
Impower150試験のサブグループ解析 (ABCP併用療法)ではmKRAS肺癌に+Bevを加えることに意義があるかも?な結果
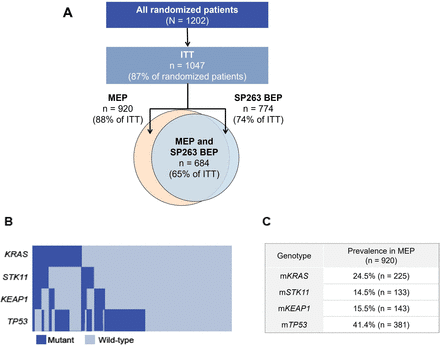
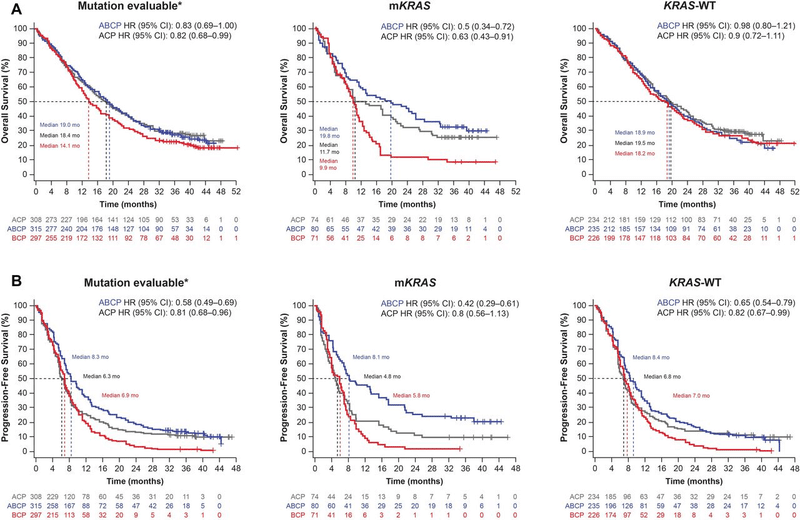
KRAS変異+(STK11、KEAP1、TP3共変異あり)のNSCLCにおいて
BCP(Bev+ carboplatin/paclitaxel)群と比較して、ABCP群(Bevあり)の方がACP群(Bevなし)よりも生存期間を延長(サブ解析のため解釈は慎重に)
ABCP OS:HR0.50(95%CI:0.34~0.72)19.8ヵ月 vs 9.9ヵ月
ACP OS:HR0.63(95%CI:0.43~0.91)
https://jitc.bmj.com/content/10/2/e003027
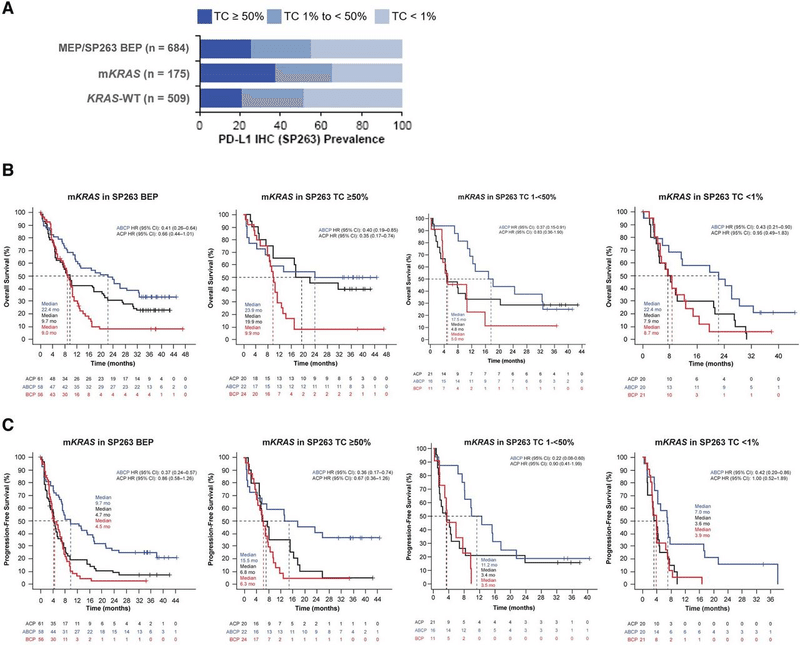
PD-L1 low, negativeでは有意差ないが、PD-L1 HighではABCPが良好(上記の研究と同様)
アテゾリズマブにベバシズマブを追加することが、KRAS+TP53+NSCLCに対する治療戦略であるかもしれない!?
Bev+AtezoがmKRAS肺癌のCold Tumor(STK11/LKB1(KL群))をHOT(免疫賦活状態)にしてくれるかも?という製薬会社のウリ。(謎)
https://jitc.bmj.com/content/10/2/e003027.long
KRAS G12Cを標的とした治療法
歴史的に、RASとGTPの結合阻害剤の創薬は困難を極めた。しかし、2013年にKRASG12C/GDP複合体に弱点となるポケットが発見され、その阻害剤(G12Ci)が開発された。
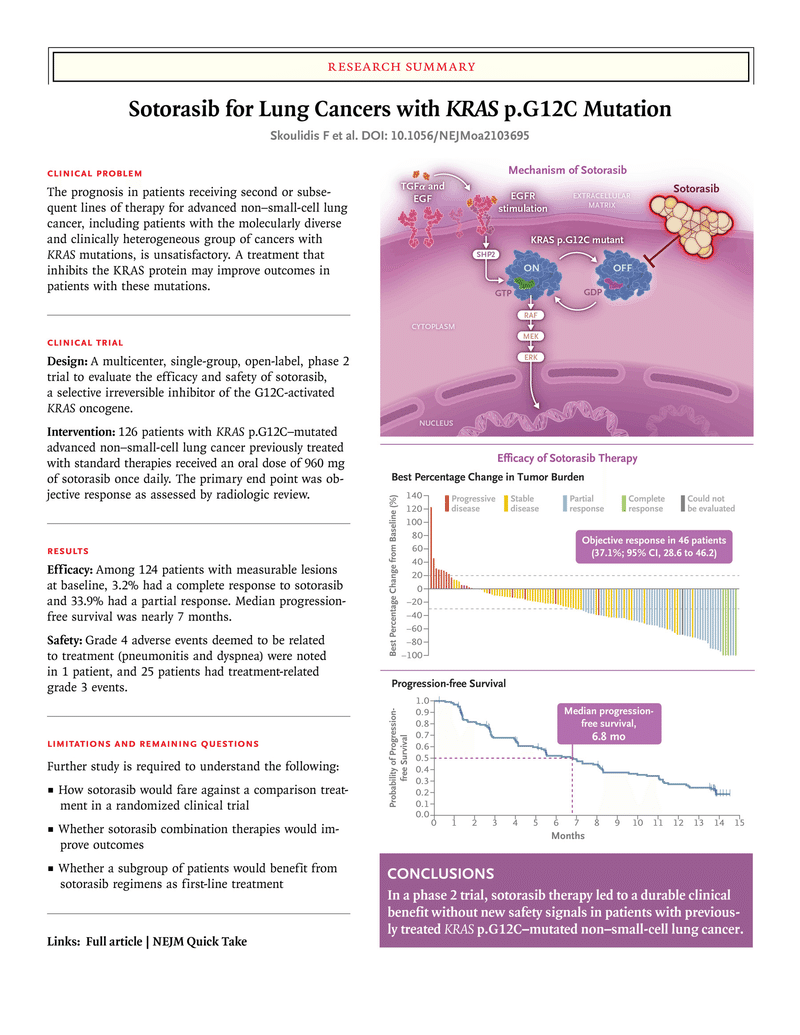
ソトラシブ (商品名 ルマケラス錠120mg)
適応:がん化学療法後に増悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺癌
用法用量:成人にはソトラシブとして、1日1回960mgを経口投与する。なお、患者の状態により適宜減量する。
承認されているKRAS遺伝子陽性検出のコンパニオン診断薬のtherascreen KRAS変異検出キットRGQ「キアゲン」、Guardant360CDxがん遺伝子パネルなどを用いて、本薬投与の該当患者を事前に確認すること
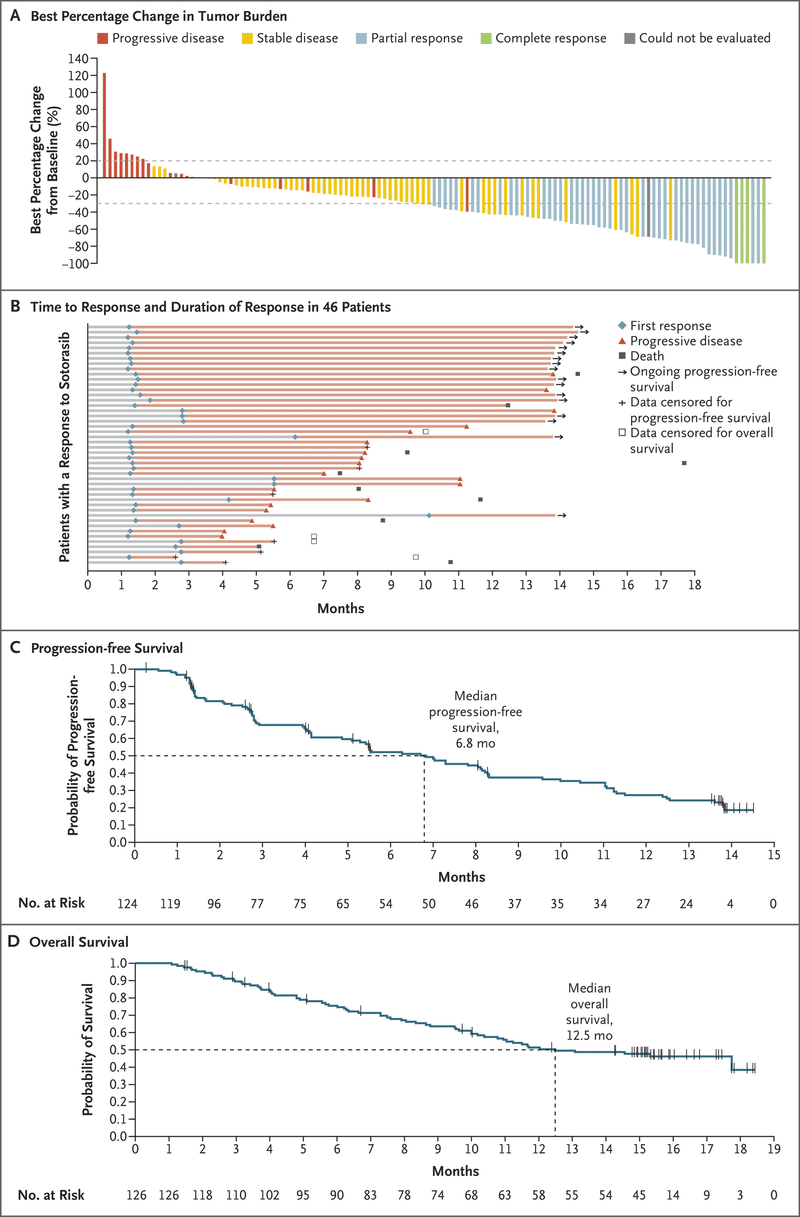
第Ⅱ相試験において、
奏効率 37.1%
奏効期間 中央値 11.1カ月
無増悪生存期間 中央値 6.8カ月
全生存期間中央値 12.5カ月(95%CI、10.0~評価不能)
治療関連の有害事象は126例中88例(69.8%)に発現し、そのうちグレード3の事象は25例(19.8%)、グレード4の事象は1例(0.8%)に発現。
アダグラシブ
116人のKRASG12C変異NSCLC患者
98.3%が化学療法と免疫療法の両方を受けたことがあった。
奏功率 42.9%
奏効期間中央値 8.5カ月
PFS中央値 6.5カ月
全生存期間中央値は12.6カ月(95%CI、9.2~19.2
治療関連の有害事象は97.4%の患者に発生し、グレード1または2が52.6%、グレード3以上が44.8%(グレード5の事象2件を含む)
https://www.nejm.org/doi/full/10.1056/NEJMoa2204619
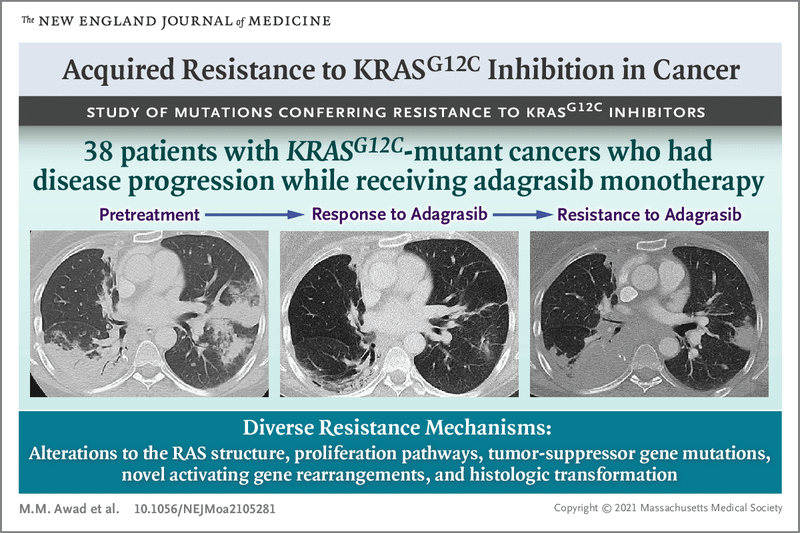
アダグラシブ治療を受けた38人の患者(肺がん27人、大腸がん10人)のうち、17人に耐性を引き起こす可能性のある分子病変が確認されており、耐性克服のための治療は開発中。
G12C以外の変異に対する阻害剤
G12Cのような弱点となるポケットがないため、阻害剤は開発段階。
新たなターゲットとして、KRAS上流のSOS1、SHP2と標的とした治療などが検討されている。[1]
Ref.
[1]https://www.jstage.jst.go.jp/article/haigan/62/3/62_188/_pdf/-char/ja
この記事が気に入ったらサポートをしてみませんか?
