
続・塩水が面白い:ナノテクの未来
小学小学校の時に、塩水の中に塩を入れ続けたら、そのうち塩が析出するという実験をやったことがある人は多いのではないでしょうか
入れたそばから塩が析出するので、新しく入れた分が析出するかのように見えますが、実際は溶けきれない塩の成分(Na+,Cl-)が結晶化して出てくるわけです。
理系の人間ならそんなこと当たり前だよと思われると思います。
しかし、そんな濃厚な塩水を対象にした研究で、ここ数年で不思議な物理現象が発見されています。
最先端かつマニアックすぎて、日本語の説明はどこにもない内容ですので、もし興味があれば、ご覧ください。
それでは本編を始めましょう
ようやく本編
ちょっと前置きが長くなってしまいましたが、いきなり本編に入るとちょっと重すぎるので助走をつけてみました。
今回は完全に私自身の備忘録となっていますが、塩水の物理の第3弾です。
現在の研究で分かっているのは、初回、第2回とそして今回のお話で全部だと思います。
当然、関連する続報は出ていますが、この3回分の内容が新しい現象の発見についての論文です。
前回までのおさらい
通常、砂粒のような小さな粒子は液中で電気的な反発力を持って安定にプカプカと浮いています。これが塩水にさらされると電気的なバリアが薄くなり、不安定化して凝集することが知られています。

しかしながら、自然界ではあまり見られないぐらい濃い塩水の状態になると、粒子などの表面にイオンの多重層が形成し、安定化するということが発見されました。
そのため、従来の希薄な溶液中で考えられてきた理論は適用されず、異常な反発力と安定性が実現したという話です。
しかしこの時、私は半分しか理解していませんでした。
今回は残りの半分のお話です。
2つの反発力
最新の研究では、濃厚な塩水の中では2つのタイプの反発力がはたらくといっています。
1つ目は前回の内容(イオン多重層形成)。そしてもう1つが今回の内容です。
それでは紐解いていきましょう。
一般に塩が溶けた水溶液では、溶液中のイオン同士やイオンと水の相互作用について考えなければなりません。相互作用というのはくっつきやすさや反発しやすさのことです。
これまで、この相互作用を考えるのは難しくて、無視されることが多かったのです。特に希薄な溶液では、無視しても問題なかったというのもあります。
しかし、今にも塩が析出しそうなぐらい濃い塩水を作るとこれまで考えられてきたモデルが成り立たなくなります。
薄い塩水ではイオンはふらふらと浮かんでいますが、濃くなってくるとイオンが近づきペアを作ると考えられています。そんなイオンペアが増えてくるとふらふら動けるアクティブなイオンが少なくなってしまいます。
単独でいる明るいイオン(+,ー)だけがアクティブだとすると、希薄溶液の方が、たくさん動けるイオンがいることになる。
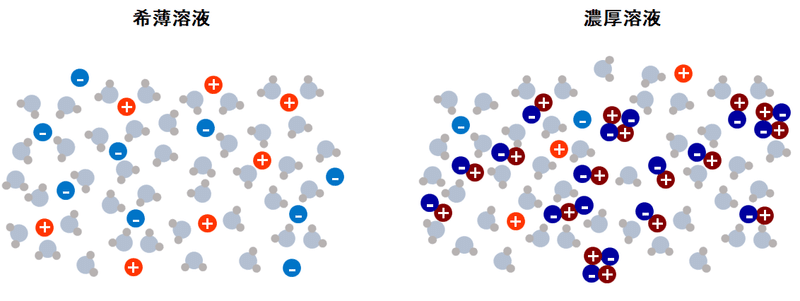
ちょっと遠回りしましたが、そろそろ本題に戻りましょう。
粒子の表面にある電気のバリア(電気二重層)を薄くするのはこのアクティブなイオン(明るい+,ー)だけです。
つまり、アクティブイオンが多くなっていくとイオンが電気的なバリアを薄くしていくんですが、濃すぎるとイオンがペアになってしまい、今度はアクティブなイオンが少なくなります。それにより、電気的なバリアが厚くなっていくという仕組みです。
と、これで終了と行きたいところですが、実はこのアクティブなイオンが少なくなる”希薄説”に異議を唱えるグループがあるんです。
ということで、次回ホントの最終回ということでまだ少し続きます。
最後に
超マニアックな内容でしたが、何かのきっかけで見てくれている方がいたらうれしいですね。
正直、この現象を理解/納得するのに数週間かかりました。それぐらい常識からかけ離れた怪しげな現象なのです。
そもそも前回紹介した電気多重層の形成と、イオンペアの形成が独立の現象なのか、どのように理解できるのかはまだ明らかになっていないのは事実です。
しかし簡単に調べただけで数十件の関連研究が出てきて、この手法を応用した研究も進んでいるので、新しい時代のものづくりとなると信じています。
この記事が気に入ったらサポートをしてみませんか?
