
115)ケトン食は寿命を延ばす
体がみるみる若返るミトコンドリア活性化術115
ミトコンドリアを活性化して体を若返らせる医薬品やサプリメントを解説しています。
【絶食すると体脂肪が燃焼する】
普通の体格の人では、絶食しても水だけ飲めれば1〜2ヶ月くらいは生きていけます。長期間の絶食(断食)で水だけの摂取ではビタミンやミネラルが不足して健康障害がでてきますが、ビタミンやミネラルをサプリメントなどで補充すれば、健康障害を起こすことなく1ヶ月以上は普通に暮らしていけます。
その理由は、体脂肪に1ヶ月分以上のエネルギーが蓄えられているからです。体重に占める体脂肪の比率は、平均的な体格の人で、男性は10〜20%程度、女性は20〜30%程度です。
体重60kgの人で体脂肪率が20%とすると、12kgの脂肪が貯蔵されています。1gの脂肪は約9キロカロリーのエネルギーを産生するので、12kgで約10万キロカロリーのエネルギーになります。普通に生活して消費するエネルギー量は2000キロカロリー程度なので、約50日分のエネルギー量に相当する計算です。
動物の場合、食事からの余ったカロリーはグリコーゲンと脂肪に合成されて貯蔵されます。
グリコーゲンはブドウ糖(グルコース)が多数結合したもので、主に肝臓や筋肉に貯蔵されています。平均的な成人のグリコーゲンの貯蔵量は、肝臓にせいぜい100g程度、筋肉には400g以下しかありません。
グリコーゲンはブドウ糖に分解されてエネルギー産生に使われますが、グリコーゲンもブドウ糖も1gのエネルギーは約4キロカロリーなので、グリコーゲン貯蔵量を最大に見積もって500gとしても2000キロカロリー程度、すなわち1日程度で枯渇してしまいます。通常のグリコーゲンの貯蔵量は200〜300g程度なので、数時間から半日程度で枯渇します。これが、半日くらい食べないと空腹になってエネルギーが出なくなる理由です。
一方、体脂肪は、前述のように1ヶ月から2ヶ月分のエネルギーを蓄えることができます。
グリコーゲンは、動物の体内でエネルギーを一時的に保存しておくための物質で、脂肪に比べると利用しやすいかわりに、すぐに枯渇する欠点を持っています。
一方、脂肪は体積当たりのエネルギー量が糖質より大きく、長期的なエネルギーの保存に適した物質と言えます。この体脂肪に蓄えたエネルギー源によって、人間は水だけで1ヶ月以上の生存と活動が可能になっています。

図:体重60kgの標準的な体格の人では、肝臓と筋肉に貯蔵されているグリコーゲンの量は500g以下で、2000キロカロリー(kCal)程度のエネルギー量に相当し、絶食すれば24時間以内に枯渇する。一方、体脂肪率が20%で10kg程度の脂肪が貯蔵されており、エネルギー量は10万キロカロリー(kCal)程度になり、これは1〜2ヶ月分のエネルギー量に相当する。
【グルコースが枯渇した状況で脂肪が燃焼するとケトン体が産生される】
細胞に必要なエネルギー(ATP)は、グルコース(ブドウ糖)が解糖系でピルビン酸に分解され、ピルビン酸がミトコンドリアでアセチルCoAを経てTCA回路(クエン酸回路)で代謝され、さらに酸化的リン酸化によって産生されます。
一方、脂肪酸からエネルギーを産生する場合は、脂肪酸が分解されてアセチルCoAになり、このアセチルCoAがミトコンドリアで代謝されてATPを作り出します。
脂肪酸の酸化で作られるアセチルCoAの多くはTCA回路(クエン酸回路)に入りますが、絶食時などグルコースの供給が少ない状況ではアセチルCoAをTCA回路で処理する時に必要なオキサロ酢酸が不足するためTCA回路が十分に回りません。そのためTCA回路で処理できなかった過剰のアセチルCoAは肝臓でケトン体の合成に回されます。
肝細胞では、脂肪酸が分解されてできたアセチルCoAはアセトアセチルCoAになり、3-ヒドロキシ-3-メチルグルタリル-CoA(HMG-CoA)を経てアセト酢酸が生成され、これは脱炭酸によってアセトンへ、還元されてβ-ヒドロキシ酪酸へと変換されます。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言います(下図)。

図:グルコース(ブドウ糖)の供給が少ない状況(飢餓時)では、肝臓では脂肪酸の燃焼(β酸化)で産生されたアセチルCoAからアセト酢酸の合成が亢進する。アセト酢酸は脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換される。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言う。アセトンは呼気に排出され、アセト酢酸とβ-ヒドロキシ酪酸は血液を介して他の組織や細胞に運ばれて、アセチルCoAに変換されてTCA回路でATP産生に使用される。
ケトン体は肝臓(ケトン体を利用する酵素が無い)と赤血球(ミトコンドリアが無い)以外の細胞でエネルギー源として利用されます。
脂肪酸と違ってケトン体は水溶性であるため、特別な運搬タンパク質の助けがなくても肝臓からその他の臓器(心臓や筋肉や腎臓や脳など)に効率よく運ばれ、細胞内でケトン体は再びアセチル-CoAに戻され、TCA回路で代謝されてエネルギー源となります。
この際、エネルギー産生に使われるのはアセト酢酸のみで、β-ヒドロキシ酪酸はアセト酢酸に変換されて初めてエネルギー代謝に使用され、アセトンはエネルギー源にはならず呼気から排出されます。
【食べ物が減ると老化を先延ばしにする】
断食やカロリー制限が老化速度を遅くし寿命を延ばすのは、食糧が少ない時期に生殖を先延ばしするというメカニズムが体内に存在するからです。
生物が生きる最大(唯一ともいえる)の目的は、種の維持と繁栄です。生殖活動を行うために、食物から栄養を摂取して成長・成熟し、生殖年齢が超えたあとは成長・成熟のメカニズムが老化を促進して、不要になった(生殖寿命が尽きた)個体を集団から排除するというのが、生物の宿命になっています。
冬になって食糧が乏しくなるように、自然環境においては食糧が手に入らない状況が突然訪れることがあります。このような状況では生殖活動するエネルギーもなく、子供を作っても育てられません。したがって、生物は食糧事情が悪くなると生殖活動を先延ばしし、食糧が豊富になったときに生殖活動を行うように、その期間を老化が進行しないようなメカニズムを進化の過程で獲得してきたということです。そして、そのメカニズムの基本は、酵母から哺乳動物まで共通しています。
種の繁栄に有利な性質が進化の過程で淘汰を生き残ることになります。食糧が乏しくなるとすぐ死ぬような生き物は進化の過程で簡単に淘汰されます。栄養やエネルギーの不足に対して抵抗性を持つようなメカニズムを獲得したものが生き残ります。実際、断食やカロリー制限食では酸化ストレスや栄養飢餓など様々なストレスに対する抵抗性が増すことが知られています。
食糧が乏しい時には、栄養飢餓に対する抵抗性を高め、代謝を抑制して寿命を延ばし、食糧が十分に入手できるようになったときに生殖活動が行えるように、食糧が乏しい条件(カロリー摂取が不足するとき)では寿命を延ばすメカニズムやストレスに対する抵抗性を高めるメカニズムが進化したと言えます。
飢餓時にストレスに対する抵抗性を高める複数のメカニズムが知られていますが、その一つが転写因子のFOXOの活性化です。
【転写因子FoxOはストレス耐性を高めて寿命を延長する】
寿命延長とストレス耐性が相互に密接に関連することは、1980年代にショウジョウバエの研究で初めて明らかになっています。
老化の遺伝学的研究の第一人者であるマイケル・R・ローズ博士(Michael R. Rose:現カリフォルニア大学アーヴァイン校/生態学・進化生物学部門教授)は、寿命を延ばしたショウジョウバエの集団を作成して、老化の遺伝的研究を行っていました。ローズ博士は長寿化したショウジョウバエ群を初めて作成した研究者ですが、研究の初期のころ(1982年)、実験助手がエサをやるのを忘れてハエを死なせてしまうという出来事がありました。そのとき、普通のハエはほとんど死んでいたのに、長寿のハエはほとんどが生き残っていました。
そこで、ローズ博士は、「長寿バエはストレスに対する抵抗力は高くなっている」、「ストレス耐性の向上は寿命延長と関連する」と考えました。 実際に、長寿バエは普通のハエに比べて、飢餓や乾燥や酸化ストレスに対する耐性が高いことがその後の実験で明らかになっています。
この偶然の発見から、ショウジョウバエを使った長寿の遺伝子の研究は進歩します。つまり、それまでは、ハエの寿命が延びたかどうかは、ハエが死ぬまで(3ヶ月程度)待たなければなりませんが、若いハエを使ってストレスに対する能力を測定するのは数日で調べられるので、実験のスピードは5~10倍にまで加速することになったということです。
最近の研究で、このようなストレス耐性を高めているのがFoxO(Forkhead Box O)という転写因子であることが明らかになっています。
転写因子FoxO(Forkhead Box O)はDNA結合ドメインFox(Forkhead box)を持つForkheadファミリーのサブグループ“O”に属する転写因子です。哺乳類では4種類(FoxO1, FoxO3a, FoxO4, FoxO6)ありショウジョウバエでは1種類(dFOXO)あります。
ハエと哺乳類において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系は保存されており、FoxO転写因子はこのシグナル伝達系の下流する位置しています。
FoxO1とFoxO3は約650個のアミノ酸からなるタンパク質で、遺伝子のプロモーター領域のTTGTTTACという配列に結合します。
転写因子というのは特定の遺伝子の発現(DNAの情報をタンパク質に変換すること)を調節しているタンパク質で、FoxOはストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などに関連する多くの遺伝子の発現を促します。
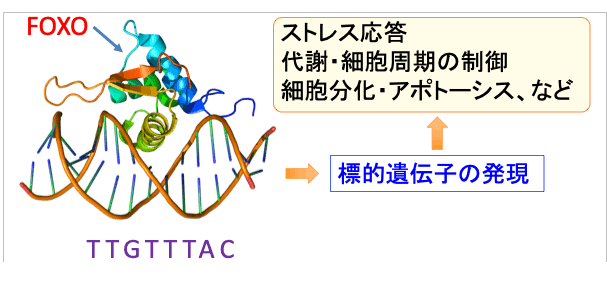
図:転写因子のFoxOは遺伝子のプロモーター領域のTTGTTTACという配列に結合し、標的遺伝子の発現を誘導し、ストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などの細胞機能を制御する。
FoxOは様々なストレスに対する抵抗力を高める作用を担っており、たとえば、カタラーゼやスーパーオキシドディスムターゼ(SOD)のような抗酸化酵素の発現を高めることによって酸化ストレスに対する抵抗力を高める作用があります。 がん抑制遺伝子としての性格も持っており、FoxOの活性化は抗がん作用を示します。
絶食すると脂肪が燃焼してケトン体が多く産生されます。ケトン体の一種のβヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害し、FoxO遺伝子のプロモーター領域におけるヒストンの高アセチル化を引き起こし、FoxO遺伝子発現を亢進することによって酸化ストレス耐性を高めることが報告されています。
すなわち、飢餓や絶食による寿命延長効果のメカニズムとして、βヒドロキシ酪酸によって転写因子FoxOが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強することが関与している可能性が示唆されています。これは、血中のβヒドロキシ酪酸が高濃度になるケトン食や絶食(断食)が、寿命延長やがん抑制に有効である可能性を示唆しています。
【インスリンやインスリン様成長因子-1(IGF-1)はFoxO活性を抑制して寿命を短縮する】
線虫とハエと哺乳類において、インスリン/インスリン様成長因子-1(IGF-1)シグナル伝達系は保存されており、FoxO転写因子はこのシグナル伝達系の下流する位置しています。
FoxOのリン酸化にはリン酸化されるセリンあるいはスレオニンの部位によって、核外に移行して転写活性が阻害される場合と、逆に核内に保持されて転写活性が亢進される場合の2種類があります。
インスリン/インスリン様成長因子-1(IGF-1)はPI3K/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxOをリン酸化します。この場合、リン酸化されたFoxOは核外(細胞質)へ移行して分解されるので、FoxOの転写活性は抑制されます。(下図)

図:インスリン/インスリン様成長因子-1(IGF-1)はPI3キナーゼ/Aktシグナル伝達系を亢進し、活性化されたAktは転写因子FoxOをリン酸化する。リン酸化されたFoxOは14-3-3というたんぱく質と結合し核外(細胞質)へ移行して分解されるので、FoxOの転写活性は抑制される。FoxOの標的遺伝子はストレス応答、代謝制御、細胞周期、アポトーシス、細胞分化、DNA修復、免疫機能、炎症などの細胞機能を制御する。インスリン/IGF-1シグナル伝達系の活性化はFoxOの核外への移行(不活性化)を促進して、ストレス抵抗性を低下させ、寿命を短縮する。
前述の様に、FoxOはインスリン-PI3K-AKTシグナルによって負に制御されています。つまり、PI3K-AKTシグナルが活性化されるとAKTによって直接的にリン酸化され、FoxOの核外移行を促進することでその転写活性は抑制されます。
一方、栄養飢餓状態ではPI3K-AKTの不活性化に伴いFoxOの活性化が誘導されることになります。つまり、飢餓や断食やカロリー制限などによる寿命延長や抗がん作用に関与する転写因子として重要な役割を担っています。
【断食するとストレスに対する抵抗力が高まる】
断食というのは、一定期間すべての食物または特定の食物の摂取を断つことです。その目的や方法は様々ですが、世界中の多くの宗教で断食が行われています。食を断つことによって人間の欲望を制御し、精神の集中を助け、高い宗教的境地に到達する目的で断食が行われています。
病気の治療目的でも古くから断食療法は行われています。古代ギリシャ時代の医師ヒポクラテスは、様々な病気の治療に断食が有効であることを記述しています。ヒポクラテスは「断食すると体の治癒力が高まり、病気が治りやすくなる」と言っています、ヒポクラテスは約2500年前の人で西洋医学の礎を作ったとされ「医聖」や「医学の父」と呼ばれています。
薬が効かない難治性てんかんの治療に絶食が有効であることが知られています。がんやその他の様々な難病の食事療法としても断食や絶食が試されています。
絶食すると体脂肪が燃焼してケトン体(アセト酢酸とβヒドロキシ酪酸)という物質ができます。このケトン体には抗炎症作用や細胞保護作用があります。
また、絶食すると細胞のオートファジー(自食作用)が亢進して、細胞内に蓄積した異常タンパク質を分解して除去してくれます。つまり、細胞を若返らせ、治癒力を高める効果があります。
断食はファスティング(fasting)と呼ばれて、病気の治療目的で研究され実践されています。病気の治療の目的で長期間(2~4週間程度)絶食する方法や、健康増進の目的で1週間に1~2日間程度絶食する方法や、1日ないし数日置きに1日間絶食する間歇的な断食など、様々な方法で行われています。
絶食というのは生物にとっては生きるか死ぬかの強いストレスになるので、体は最大の防衛モードに入ります。日頃細胞分裂を行っている細胞も一時的に増殖を止めるか分裂速度を低下させ、様々なストレスや毒物に対する抵抗性を高めるタンパク質の合成を促進させます。
すなわち、絶食を行うと、物質を合成する同化作用や細胞分裂させる作用をもったホルモンや増殖因子(インスリンやインスリン様成長因子など)は減少し、ストレスに対する抵抗力を高める遺伝子の発現は増加します。
酵母の実験では活性酸素や抗がん剤に対する抵抗性は栄養飢餓(絶食)によって10倍以上に高まることが報告されています。
絶食はインスリンやインスリン様成長因子-1(IGF-1)の発現を低下させます。マウスの実験で、72時間の絶食で血中のIGF-1濃度が70%低下し、IGF-1の活性を阻害するIGF結合タンパク質-1(IGFBP-1)の濃度は11倍に増加しました。IGF-1の血中濃度が70から80%減少したマウスでは、抗がん剤などによる細胞毒性に対して抵抗性を示しました。
寿命の研究では、成長ホルモン/IGF-1シグナル伝達系の阻害は、ストレス抵抗性を高め、寿命延長作用を示すことが多くの実験モデルで示されています。例えば、IGF-1シグナル伝達系が欠損している動物は寿命が長く、ストレスに対する抵抗性が高いことが報告されています。
つまり、絶食はインスリンやIGF-1シグナル伝達系の抑制によってストレス抵抗性が増し、寿命を延ばすメカニズムが作動すると考えられています。
【βヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する】
βヒドロキシ酪酸はケトン体の一種です。ケトン体は絶食などで糖質が枯渇した状態で脂肪酸の燃焼(β酸化)が亢進したときに肝臓で産生され、グルコース(ブドウ糖)が枯渇した時の代替エネルギーになります。絶食時などで日常的に産生されています。
ケトン体としてアセト酢酸、βヒドロキシ酪酸、アセトンの3種が作られますが、アセトンは呼気となって排泄され、アセト酢酸とβヒドロキシ酪酸はエネルギー源になります。
ケトン (ketone) は R−C(=O)−R'の構造式で表される有機化合物です。酸素と二重結合している炭素の両脇が炭素である化合物をケトンと言います。β-ヒドロキシ酪酸はケトン基を持っていない(ケトン基が還元されて水酸基になっている)ので、正確にはβ-ヒドロキシ酪酸はケトンとは言えませんが、ケトンのアセト酢酸に変換されて代謝されるので、ケトン体に含められています(図)。
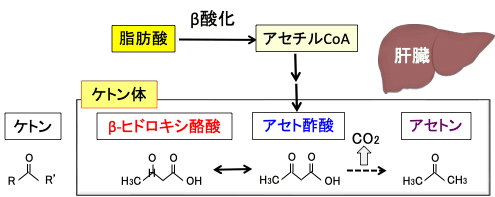
図:肝臓において、脂肪酸の燃焼(β酸化)で産生されたアセチルCoAからアセト酢酸が生成する。アセト酢酸は脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換される。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言う。β-ヒドロキシ酪酸はケトン基を持っていないので正確にはケトンとは言えないが、アセト酢酸と相互に変換されるのでケトン体に含まれている。
ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素を阻害することによってヒストンアセチル化を亢進することが明らかになっています。
飢餓や直接βヒドロキシ酪酸を投与する方法でマウスの血中のβヒドロキシ酪酸の濃度(0.6~1.5mM)を上昇させると、腎臓など複数の臓器においてヒストンのアセチル化が増えていることが確認されています。(Science 339(6116): 211-4, 2013年)
長期間の絶食では血中のケトン体のレベルが6~8mM程度まで上昇します。 中鎖脂肪酸を多く使ったケトン食ではβヒドロキシ酪酸を1~2mM程度に維持することは比較的簡単です。つまり、ケトン食で達成できるレベルのケトン体が内因性のヒストン脱アセチル化酵素阻害剤として作用することが証明されています。
ヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によるヒストンのアセチル化について簡単に説明しておきます。
【遺伝子発現を制御するヒストンのアセチル化】
細胞核内では、DNAはヒストンという球状のタンパク質複合体に巻き付くような状態で存在します。ヒストンはリジンやアルギニンといった塩基性(プラスの電荷をもつ)のアミノ酸が多く、酸性(マイナスの電荷をもつ)のDNAと強い親和性を持っています。ヒストンは、長いDNAをコンパクトに核内に収納するための役割と同時に、遺伝子発現の調節にも重要な役割を果たしています。
遺伝子が転写されるためには、転写因子やRNAポリメラーゼなどの他のタンパク質がDNAに結合する必要があり、ヒストンが結合していると転写に邪魔になります。したがって、転写の活発な遺伝子の部分ではヒストンとDNAの結合が緩くなっています。
DNAとヒストンの結合を緩くする機序として、「ヒストンのアセチル化」という現象があります。
アセチル化というのはアセチル(CH3CO)基が結合することです。ヒストンのN末端領域のリシン残基のアミノ基(-NH2)がアセチル化という修飾を受けると、リシン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出することになります。
一般的に、ヒストンが高度にアセチル化されている領域の遺伝子は転写が活発に行われていることを示しています。すなわち、ヒストンのアセチル化は遺伝子発現を促進し、反対にヒストンが脱アセチル化(低アセチル化)されることにより遺伝子発現は抑制されると考えられています。
ヒストンのアセチル化と脱アセチル化の反応はヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によってダイナミックに制御されており、遺伝子発現のON/OFFのメインスイッチになっていると考えられています(図)。

図: DNAはヒストンという球状のタンパク質複合体に巻き付くような状態で存在する。ヒストンのリジン残基のアミノ基(-NH2)がアセチル化という修飾を受けると、リジン残基の塩基性が低下して酸性のDNAとの親和性が無くなり、DNAからヒストンが離れ、DNAが露出する結果、遺伝子の転写が促進される。ヒストンのアセチル化と脱アセチル化の反応はヒストンアセチル基転移酵素とヒストン脱アセチル化酵素によって制御されている。
ケトン体のβ-ヒドロキシ酪酸にはヒストン脱アセチル化酵素阻害作用があります。(下図)

図:ヒストンアセチル基転移酵素(①)によってヒストンのアセチル化が亢進すると、クロマチンが緩み、遺伝子転写活性が亢進する(②)。ヒストン脱アセチル化酵素(③)によってヒストンのアセチル化が低下するとクロマチンが凝集して遺伝子転写活性は抑制される(④)。β-ヒドロキシ酪酸はヒストン脱アセチル化酵素を阻害する作用がある(⑤)。
ヒストン脱アセチル化酵素の阻害が、寿命の延長やがん細胞の分化誘導や増殖抑制に効果があることも多くの研究で明らかになっています。つまり、絶食やケトン食による健康作用や寿命延長作用や抗がん作用の一部は、βヒドロキシ酪酸によるヒストン脱アセチル化酵素の阻害作用が関与している可能性を示唆しています。(下図)

図:絶食や飢餓やケトン食によってβヒドロキシ酪酸の濃度が上昇すると、ヒストン脱アセチル化酵素が阻害される。これによって遺伝子プロモーター領域のヒストンが高アセチル化し、転写因子FOXOが活性化され、Mnスーパーオキシドジスムターゼ(Mn-SOD)やカタラーゼの発現を誘導し、酸化ストレスに対して耐性が増強する。ケトン食による寿命延長作用や抗がん作用のメカニズムの一つにヒストン脱アセチル化酵素の阻害作用が報告されている。
【ケトン体は飢餓を生き延びるために進化の過程で獲得した代謝系】
「ケトン体は私たちの体を動かす重要なエネルギー源である」ということは長い間見逃されてきました。その理由は多々ありますが、ケトン体の最初の発見が、糖尿病性ケトアシドーシスの患者の尿であったことが最も関与しているようです。
ケトン体は19世紀中頃に糖尿病性ケトアシドーシスの患者の尿に大量に含まれることから最初に見つかったので、「ケトン体は脂質の不完全な酸化によって生成される毒性のある不必要な代謝産物である」とこの時代の医師の多くが認識していました。
しかし、20世紀のはじめになると、「ケトン体は、飢餓時や食事からの糖質が不足したときに、肝臓で脂肪酸から産生される正常な代謝産物で、肝臓以外の組織で容易にエネルギー源として利用される」ことが明らかになりました。
さらに、1920年代にはケトン体の産生を増やす高ケトン食が、小児の薬剤抵抗性てんかんの治療に極めて有効であることが明らかになりました。
1967年には、長期間の絶食や飢餓時に脳のエネルギー源としてグルコースに代わってケトン体が使用されることが明らかになりました。それまでは、脳のエネルギー源はグルコースのみと考えられていたのです。
1990年代に入ると、食事によってケトン体の産生を高めるケトン食が、グルコースの利用障害のある神経疾患の治療に有効であることが明らかになります。パーキンソン病やアルツハイマー病などの脳では、ミトコンドリアの機能異常によって、エネルギー産生が低下していることが多くの研究で明らかになっています。
ケトン体はミトコンドリアでATP産生に効率よく利用され、さらに、神経細胞をフリーラジカルの害から守る作用があるので、ケトン食がパーキンソン病やアルツハイマー病やその他の神経変性疾患(筋萎縮性側索硬化症など)の治療に有効であることが報告されるようになりました。
近年では、ケトン体のβヒドロキシ酪酸がヒストン脱アセチル化酵素の阻害作用によって遺伝子発現に作用してストレス抵抗性の増強や抗老化や寿命延長の効果を発揮することや、炎症を引き起こすNLRP3インフラマソームの活性を阻害することによって抗炎症作用を示す作用、細胞膜の受容体を介して細胞機能に影響する作用などが明らかになっています。ケトン食が寿命を延ばす可能性も報告されています。
そして、サプリメントとしてケトン体を補充する治療法も検討されるようになってきました。
発見された当時は「代謝異常に伴う毒性物質」と思われていたケトン体が、実際は、極めて多彩で有用な働きを発揮する代謝産物であることが判明したのです。
最近ではβヒドロキシ酪酸は「an anti-aging ketone body(抗老化ケトン体)」と表現され、様々な老化性疾患を予防し、寿命を延ばす効果も指摘されるようになってきました。
この記事が気に入ったらサポートをしてみませんか?
