
nutritional care
●臓器解剖(口腔)
6歳で乳歯はすべて脱落する。
永久歯は28本 親知らずをいれると32本
●顎関節
最も使われる関節で関節腔内に関節円板がある。
蝶番運動と滑走運動をしている。
●唾液
唾液は、舌咽神経と顔面神経を介して分泌される。
1日に1~1.5L
【唾液腺】
①耳下腺(最大)
アミラーゼが多い。
②顎下腺(漿液と粘液が混ざった混合性唾液)
③舌下腺(漿液と粘液が混ざった混合性唾液)
●臓器解剖(胃)
成人の胃の容量 1400ml(ペットボトル3本くらい)
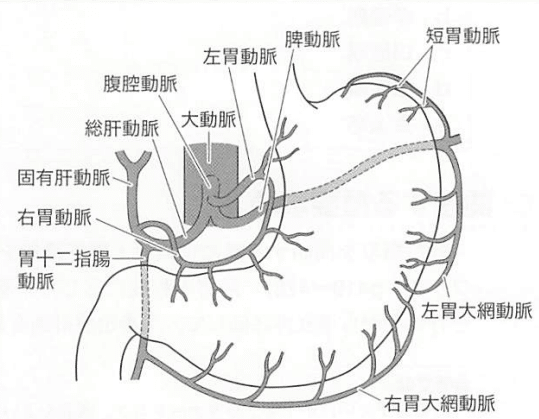
静脈:同名静脈(左胃静脈は冠静脈とも呼ばれる)からすべて門脈へ
噴門の一部は下横隔膜静脈や半奇静脈系を介して上大静脈と吻合があり、これらが門脈圧亢進時に食道静脈瘤や胃静脈瘤となる。
胃壁
内側から【粘膜】【粘膜下層】【筋層】【漿膜】
粘膜は、【単層円柱上皮】(細胞の丈が長いため吸収分泌しやすい)
粘膜下層は、【胃底腺】【幽門腺】【噴門腺】→胃液は1日1.5L~2L(2000)~2500ml(分泌される。
【胃底腺】:主細胞(ペプシノーゲン分泌)
ペプシノーゲンは、蛋白質を分解する。ペプシノーゲン→ペプシンになる。
脂質を分解するリパーゼも分泌される。
壁細胞(傍細胞:塩酸分泌→ph1程度)
(ビタミンB12の吸収に必要なIF因子 内因子)
→迷走神経刺激、ガストリン分泌、ヒスタミン分泌による
副細胞(粘液分泌)
【幽門腺】:ガストリンを出すG細胞がある。筋が発達して、輪状の幽門括約筋を形成する。
※胃体部から幽門腺の移行部は潰瘍の好発部位である。
胃に液体のみはいった場合は、胃は拡張せず、小弯側が管状を保ったまあで、短時間に十二指腸に流入する。(胃体管)
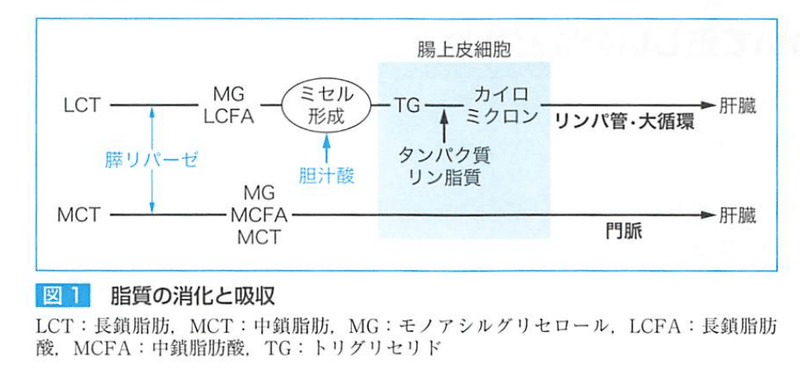
【中性脂肪の消化と吸収】
中性脂肪(トリグリセリド)腸管内でリパーゼによって脂肪酸が外れて、脂肪酸とグリセリドになる。
脂肪組織からの脂肪分解は重症病態で加速する。
脂肪酸の放出は生体のエネルギー要求量を超えることができ血中の脂肪酸濃度は上昇する。
脂肪酸は、肝臓で酸化されるだけでなく筋肉・心筋などの末梢組織でも酸化され、一部はトリグリセリドとして再度エステル化される。
成人で4~5mg/kgという生体内での代謝限度を超えた量のグルコースを投与した場合は、新規の脂肪合成が起こり、脂肪肝や筋肉への脂肪沈着をもたらす。(DM,敗血症、慢性炎症性疾患で容易に起こる)
また、肝臓で合成された脂質の運搬に重要な血清リポ蛋白は、エネルギー基質の輸送体のみではなく、エンドトキシン中和による直接歴な抗炎症やサイトカイン調節による免疫応答の調節因子である。
中性脂肪が、
①脂肪酸②ジグリセリド③モノグリセリド④グリセリン(グリセロール)となる。
脂肪の消化は不完全で、【トリグリセリド】のままでも吸収される。
しかし、中性脂肪の2/3はモノグリセリドまで
1/3はグリセリンと脂肪酸までに分解され、吸収される。
炭素数が12個以下(中鎖脂肪酸)は、小腸上皮で吸収され門脈へ
大半の脂肪酸は【再びトリグリセリドに合成】される。
これに、【アポ蛋白】【リン脂質】【コレステロール】などが結合し、【キロミクロン】となり、リンパ管へ
※アポ蛋白=脂質可溶化タンパク
コレステロールは、水塩基を有するが水には溶けず血中ではアポ蛋白によりエマルション化され、リポ蛋白として高濃度に存在する。
【胃液分泌の過程】
①脳相 ②胃相 ③腸相
脳相:見た目、味、においなど 大脳→迷走神経→アセチルコリン→酸促進
胃相:迷走神経→アセチルコリン→酸分泌
食物の進展刺激:ガストリン、ヒスタミン→酸促進
腸相:十二指腸までいくとセクレチンなどが分布され、胃粘膜のD細胞からソマトスタチン(酸分泌抑制)が分泌される。
筋肉:縦走筋 輪状筋 内層は斜走筋
神経:迷走神経→副交感神経 内臓神経→交感神経
迷走神経刺激(においや味)や食物に含まれる芳香族アミノ酸によるガストリン分泌、ガストリン分泌によるECL細胞からのヒスタミン分泌により、酸分泌が促進する。
機能:アルコール以外の吸収は行わない
ペプシノーゲンと塩酸とを混合し、蛋白質の消化の一部を担っている
●胆汁の生成と分泌
胆汁は、【胃酸中和】【コレステロールやビリルビンの排泄など】
主成分は、水
固形成分は、胆汁酸、ビリルビン、コレステロール、脂肪酸、レシチン、無機塩などを含んでいる。
※胆汁中には、【消化酵素はない】
①肝細胞は、1日600~800mlの胆汁を毛細胆管に分泌
②毛細胆管から肝内胆管へ移行した短銃は水や電解質の分泌・再吸収により流入が調節され、肝外胆管へ
③肝外胆管から胆嚢に蓄積され、水や電解質が再吸収され肝胆汁の5~10倍に濃縮される。
④脂肪がくると十二指腸粘膜上皮から【セクレチン】【コレシストキニン(CCK)】が分泌される
※セクレチン
胆管細胞のCFTRとアクアポリン(AQP)を介して重炭酸イオンと水を胆管内に移動させる。
※CCK
胆嚢を収縮 Oddi括約筋を弛緩させ、胆汁を十二指腸に放出する。
※ビリルビン(胆汁色素である)
腸内細菌の作用で【ウロビリノーゲン→ウロビリン(ステルコピリン)】
大部分は排便に排泄される。(一部は小腸で再吸収され、ビリルビンとして胆汁中へ)
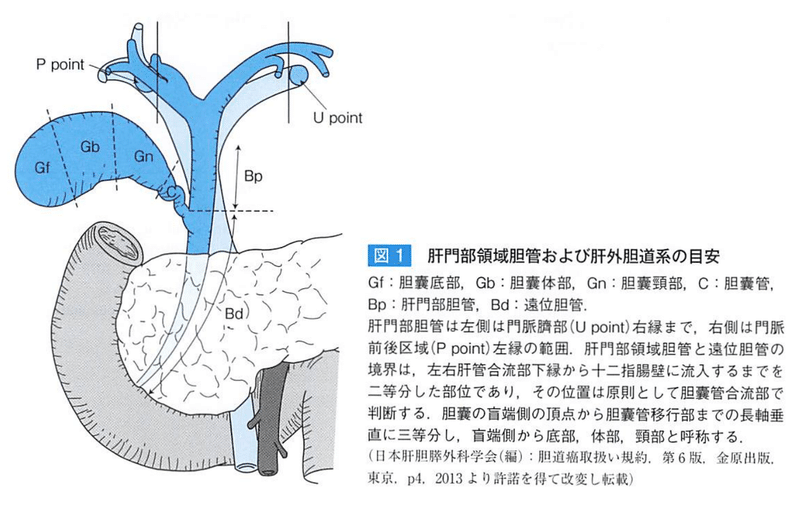
★胆道系
粘膜筋板の欠如することは、胆道がんが壁外へ伸展する原因である
★胆管の神経
交感神経、迷走神経、右横隔神経が神経支配を受ける。
胆道疾患の放散痛が右肩にみられるのは、知覚神経が右横隔神経にも伝達されるから。
★胆嚢の部位
底部、体部、頸部
★胆嚢の動静脈
総肝管、胆嚢管、肝下面で囲まれたcalot三角内で右肝動脈から分岐する。
【胆汁酸の腸肝循環】
肝細胞でコレステロールより合成された胆汁酸を一次胆汁酸(コール酸、ケノデオキシコール酸)
一次脂肪酸は、腸管内の脂質とともにミセルを形成し、リパーゼによる脂質分解と吸収に寄与する。
腸内細菌により二次胆汁酸(コール酸→デオキシコール、ケノデオキシコール酸→リトコール酸)に変換される。
胆汁酸は、【回腸末端】で再吸収される。
腸肝循環は、1日4~12回行われる。
●膵液
【外分泌腺】と【内分泌腺】にわかれる。
膵液は、外分泌腺 1日1500ml 強アルカリ性 ph8~8.3
蛋白質分解に関わるものなどは、活性を持たない前駆体(チモーゲン)として分泌される。
チモーゲンのうち、トリプシノーゲンは、十二指腸にいくとエンテロキナーゼの作用により、
トリプシノーゲン→トリプシンへと活性化される。
トリプシン→ほかのチモーゲンに作用し、膵酵素を活性化させる。
トリプシンは、蛋白質を分解する。
アミノ酸がジペプチド・トリペプチドまで分解される。
吸収上皮細胞の刷子縁膜上には多糖類のアミノポリペプチダーゼとジぺプチダーゼが存在しすべてのポリペプチドはトリペプチドからジペプチドへ、一部はアミノ酸まで分解される。
膵内のトリプシノーゲンの活性化は、内因性の抑制因子である膵分泌性トリプシンインヒビター(PSTI)によっても抑制される。
●大腸
腸内細菌が100兆個ある。
腸内細菌は、水溶性食物繊維を発行することで有機酸(短鎖脂肪酸)を生成する働きが重要である。
●短 中 長脂肪酸トリグリセリド
炭素数が6以下→短鎖脂肪酸(SCFA)(酪酸・プロピオン酸・酢酸)
※酪酸:ブドウ糖とともに大腸粘膜上皮細胞のエネルギー源である。
栄養素を吸収する腸管自体も栄養摂取が必要である。
経口摂取では、グルタミンやグルタミン酸をエネルギー源とし、絶食+静脈栄養時には腸絨毛の基底膜側のトランスポーターを介して、血管経由でグルタミンやケトン体を輸送して、エネルギー源とし、低栄養のダメージを最小限にしている。
大腸は短鎖脂肪酸が唯一のエネルギー源である。
グアーガムなどの水溶性食物繊維は直絶ビフィズス菌などによって短鎖脂肪酸を生成されることでBifidobacterium優位の腸内細菌叢が誘導される、(プレバイオティクス)
同時に、大腸内phを下げてクロストリジウムなどの腐敗菌の増殖を抑制し、発癌抑制効果が期待される。
炭素数が8・ 10・12個→中鎖脂肪酸(MCFA)
(長鎖脂肪酸よりもアセチルCoA産生量が少ない=エネルギー産生量も少なくなる。
14以上を長鎖脂肪酸(LCFA)
(1gで9kcalのエネルギーが産生される。中鎖脂肪酸は8.3kcal)である
↓
それぞれの脂肪酸3つがグリセロールと結合して構成されたトリグリセリドを
①短鎖脂肪(SCT)
②中鎖脂肪(MCT)
③長鎖脂肪(LCT):脂肪乳剤に入っている
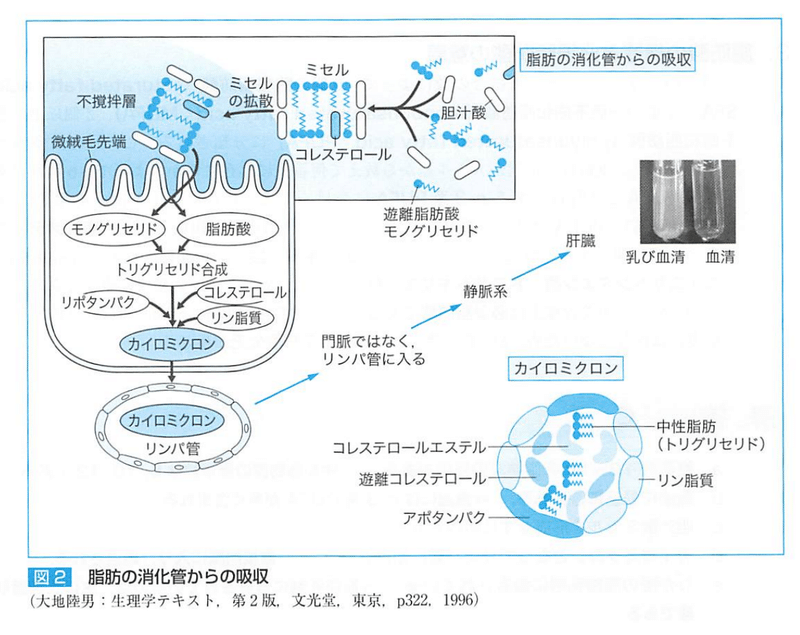
●中鎖脂肪酸の吸収と代謝 MCT
カプリル酸 ペラルゴン酸 カプリン酸 ラウリン酸など
中鎖脂肪酸で構成されたトリアシルグリセロールを中鎖脂肪(MCT)という。
MCTは、小腸内で膵臓リパーゼや胆汁酸塩に依存することなく、加水分解され、直接門脈を経て吸収される。
(MCTは、加水分解されやすいため、経口・経静脈投与いずれでも酸化的利用されやすい。
(ミトコンドリア内膜で輸送される際に、カルニチンに依存しないためである)
したがって、胆汁酸が欠乏する状態でも吸収可能でエネルギー源となる。
肝胆膵・腎疾患のエネルギー源にもなる。
LCTは、小腸内で加水分解されて遊離脂肪酸あるいはモノグリセリドになり、胆汁酸とミセルを形成して(胆汁酸ミセル)、腸粘膜上皮細胞内で再びトリグリセリドに合成される。
また、カイロミクロン(脂肪粒子)となる。
カイロミクロンは水に不溶で粒子径が大きいため、門脈ではなくリンパ管に入る。
静脈投与されると加水分解されやすく、長鎖脂肪酸とは異なり、カルニチンに依存することなくミトコンドリア内膜を通過する。
侵襲時にはカルニチンの減少をきたすことや加水分解されやすい特徴を持つために効率的に利用され、侵襲時に長鎖脂肪酸と中鎖脂肪酸の組み合わせで蛋白質の節約効果を改善できる。
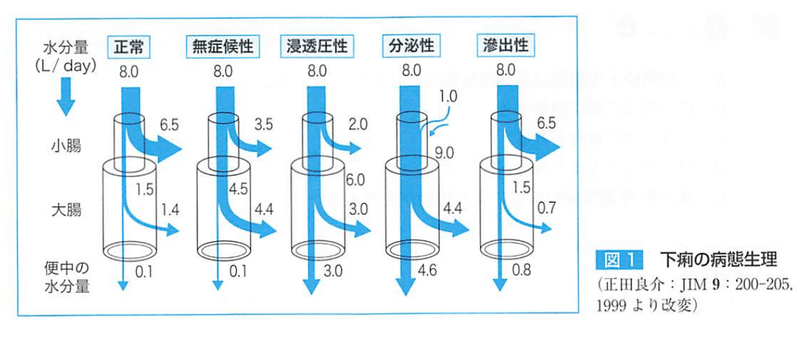
【水分電解質の吸収は通常、大腸よりも小腸で多い】
しかし、浸透圧下痢や分泌性下痢の場合は大腸で吸収される水分や電解質の量が増える。
★食物繊維の生理作用
水溶性と不溶性で異なる。

短鎖脂肪酸を生成するのは【水溶性食物繊維】である。
不溶性は、セルロースなどで便のかさをます作用(蠕動運動促進、bulk効果)
●
【ビタミンB12】
胃粘膜からのR結合蛋白と結合→膵酵素で分解→IF(内因子)と結合→回腸末端のIF受容体として吸収.
吸収されたビタミンB12-IF複合体は分解され、血中へ。
【十二指腸液のph】
膵液:アルカリ性 1日1500ml分泌される。 ph8
胃酸を中和する。
膵液と胆汁が十二指腸液の主成分であり、肝胆汁のphが7~8であるため、十二指腸液はアルカリ性である。
下部食道括約筋部(LES )
食道の生理的狭窄は3つ
→食道入り口部・左気管支の交差部・横隔膜食道裂孔部(ここがLES)
横隔膜の食道裂孔を形成する筋束や胃の斜走筋(willis胃斜走筋)
横隔膜食道靭帯とその周辺構造によりものであり、内容物の逆流を防いでいる。吸気時に腹腔側は陽圧、胸腔側は陰圧であり、この境界は呼吸変換点(LES)に一致する。
胃食道逆流症(GERD)
胃底部胃壁の伸展、脂肪を含む食事によるコレシストキニン(CCK 十二指腸粘膜から)分泌亢進し、嚥下以外にLESの弛緩が起こる。(一過性LES弛緩(TLESR)という。
そのため、軽症のGERDは、日中の食後に起こりやすい。
重症はLESの常時閉鎖ができずに夜間睡眠中に起こる。
●消化
★口腔
中のアミラーゼ→デンプン→デキストリン・マルトースになる
常在菌、10 10乗~11乗個 1g
アミラーゼで炭水化物を二糖類・三糖類・デキストリンに分解する。
★小腸
平滑筋が収縮していれば3m、伸ばせば6~7mになる。
微絨毛の中には、毛細血管やリンパ管が多くあり、糖質、アミノ酸、ミネラルなどの水溶性物質は、毛細血管→門脈→肝臓へ
※脂質は、小腸壁で再合成され、【リンパ管→乳び層→胸管→静脈角へ】
【糖質とペプチドの膜消化】
小腸の粘膜上皮の刷子縁には、
【二糖類分解酵素】【ジペプチド分解酵素】【アミノペプチダーゼ】などがある。→こいつらが膜消化を行う。
炭水化物→単糖類 ペプチド→アミノ酸まで分解→門脈
★大腸
盲腸、結腸、直腸で構成
機能は、【水分吸収】【腸内細菌による食物繊維の発酵】
【食物繊維】
多糖類からなり、大腸内の腸内細菌で嫌気的に発酵し、多く【プロピオン酸や酪酸】などの短鎖脂肪酸となる。
短鎖脂肪酸は、大腸粘膜組織から直接吸収され、上皮細胞の増殖や粘液の分泌、水やミネラル吸収のエネルギー源となる。
余った短鎖脂肪酸は、肝・筋・腎などの合成材料となる。
●体液評価
体液の6割は、内液が40%、外液が20%(細胞間液 15%、血漿5%)
細胞内液の主な陽イオンはカリウム、マグネシウム
陰イオンはリン酸イオン
●ガストリン
胃前庭部の幽門にあるG細胞から分泌される。
胃に食物が入り、進展することで迷走神経からガストリン放出ペプチドを遊離して、G細胞を刺激する。
また、胃内の蛋白分解産物(ペプチドなど)により化学的に刺激され、ガストリンが分泌される。
ガストリンは壁細胞に作用し、酸分泌を促し、胃内のph低下によりG細胞からのガストリン分泌を抑制する。
※ソマトスタチンはG細胞を抑制し壁細胞からの酸分泌を抑制する。
●ソマトスタチン
膵島や消化管粘膜内に存在するD細胞から分泌される。
D細胞は胃酸で刺激され、ソマトスタチンはG細胞を抑制する。
ソマトスタチンはほかに膵島ホルモンやセクレチンなどほとんどのホルモン分泌を抑制する。
●コレシストキニン(CCK) パンクレオチミン)
十二指腸から上部空腸に存在する I細胞が蛋白分解物(ペプチド・アミノ酸や迷走神経刺激などで刺激され、CCKの分泌が誘発される。
CCK分泌により膵酵素や胆汁分泌が促され、食物がペプチド・オリゴ糖などまで分解される。
●セクレチン
CCKと同様に十二指腸や上部空腸に存在するS細胞から放出され、膵臓あるいは胆管からの重炭酸分泌を促す。
セクレチン放出には十二指腸に食物と共に流入する胃酸が最も重要で十二指腸のphが4.5になると放出が止まる。
セクレチンは胃酸やガストリン分泌を抑止する(エンテロガストリン作用)
幽門を閉じる。
胃酸分泌促進:ガストリン、ヒスタミン
胃酸分泌抑制:ソマトスタチン、セクレチン
膵液分泌促進:セクレチン、コレシストキニン
膵液分泌抑制:ソマトスタチン
●胃酸分泌の相
頭相:視覚嗅覚味覚によって反射的に消化液分泌の増加と胃腸運動の促進が始める。
胃相:食物が胃に存在している段階。胃の進展刺激から迷走神経を介して酸を分泌し、ガストリン・ヒスタミンを介して酸を分泌する。
腸相:食物が十二指腸に移送された段階。十二指腸が胃酸で酸性化されるとセクレチンが促進され、胃粘膜のD細胞からのソマトスタチンを促進される。
●ミトコンドリアと細胞質
ミトコンドリアは、内膜と外膜の2種類の膜構造を持つエネルギー産生を担当する細胞内小器官である。
内膜に囲まれた空間をマトリックス、内膜が内側に陥入したひだ状の構造をクリステという。
好気的条件下では、マトリックス内でのTCA回路、内膜での電子伝達系によりATPが産生される。
細胞内の細胞小器官を取り巻く、液状部分を「細胞質ゾル」という。
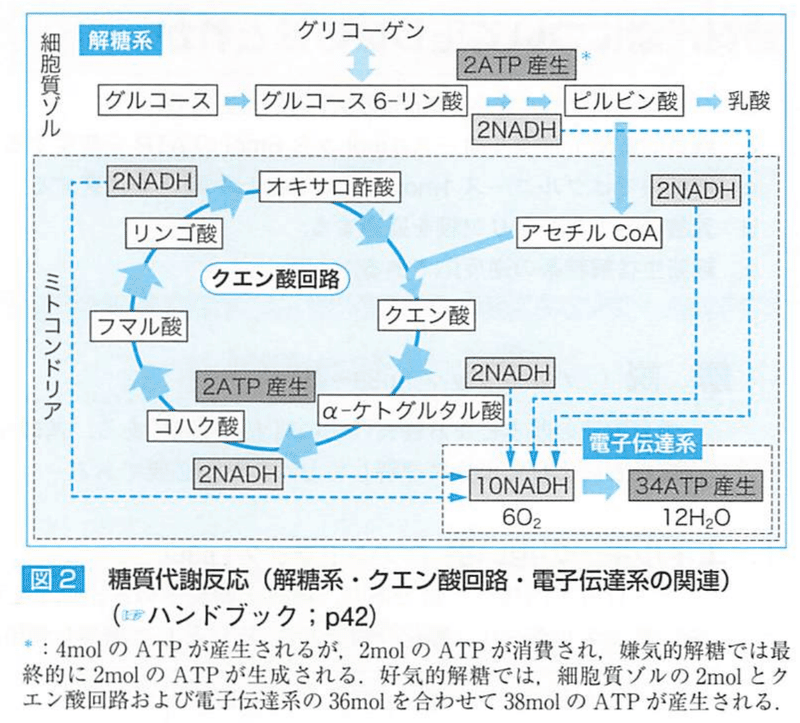
グルコース1mol当たり38molのATPが産生される。
グルコース1molあたり産生されるATPは解糖系で2mol、TCA回路で2mol、電子伝達系で34molである.
主なATP産生は電子伝達系である。
●糖新生
糖新生の代謝経路は、
①解糖系の可逆性反応系
②ホスホエノールピルビン酸の生成系
③クエン酸回路
①解糖系の可逆性反応系
グルコースからホスホエノールピルビン酸までは可逆的
この逆が糖新生の最終段階である。
脂肪分解でできるグリセロールは①の反応に入る
②ホスホエノールピルビン酸
ホスホエノールピルビン酸からピルビン酸への反応は不可逆的である。
この反応の初めは、クエン酸回路のリンゴ酸が、ミトコンドリアの外でオキサロ酢酸に変化する。
③クエン酸回路
乳酸、アラニンなどのアミノ酸は、ピルビン酸の原料になる。
乳酸は好気的条件で容易にピルビン酸に変換される。
アラニンは脱アミノ反応でピルビン酸になる。
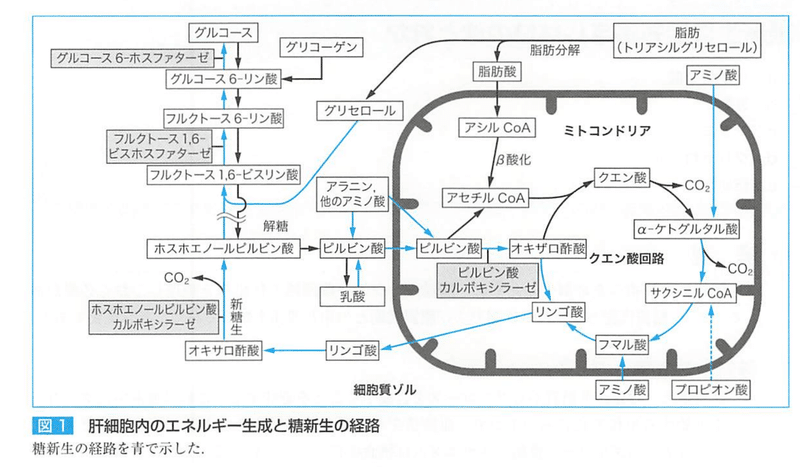
十分な糖質が供給されない状況では、
肝臓に貯蔵されているグリコーゲンは半日程度で枯渇する。
糖原性アミノ酸やグリセロールからのグルコース合成が必要になる。
糖新生は解糖系の逆反応ではない。
a.ピルビン酸からのホスホエノールピルビン酸の合成
ミトコンドリア内のピルビン酸はピルビン酸カルボキシラーゼの作用によりオキサロ酢酸を生成する。
オキサロ酢酸はミトコンドリア膜を通過できない ためリンゴ酸に変換リンゴ酸はミトコンドリア膜を通過し細胞質ゾルに移動する。
細胞質ゾルに移動したリンゴ酸はオキサロ酢酸となり、オキサロ酢酸はホスホエノールピルビン酸カルボキシラーゼの作用で脱炭酸し、ホスホエノールピルビン酸が生成される。
b.フルクトース1,6ビスリン酸からフルクトース6リン酸の生成
フルクトース1,6ビスホスフォターゼにより反応が触媒される。
c.グルコース6リン酸からグルコース生成
グルコース6ホスフォターゼにより触媒される。
●Cori サイクル
肝で乳酸から合成されたグルコースが赤血球などで嫌気的解糖を受け、再び乳酸になって肝に戻る経路をコリサイクルという。
肝でアラニンから合成されたグルコースが筋でピルビン酸となり、アミノ基転移によってふたたびアラニンとなって肝にもどる経路をグルコースアラニンサイクルという。
●脂肪酸の生合成
飢餓など摂取熱量不足になると脂肪酸は糖質やアミノ酸由来のアセチルCoAを前駆体として細胞質ゾルで合成される。
アセチルCoAはピルビン酸からミトコンドリア内で生じるが、ミトコンドリア膜を通過することできず、いったんクエン酸に変換されて細胞質ゾルに移動し、再びアセチルCoAに変換されて脂肪酸合成に利用される
※アセチルCoAは、そのままではミトコンドリアを通過できない。
●脂質
★脂質とは?
有機溶媒に溶けやすい。
身体の1/5を占める大部分は中性脂肪である。
★脂質の分類
①単純脂質
②複合脂質
③誘導脂質
①単純脂質
脂肪酸とアルコールなどがエステル結合したもの
ロウは、高級脂肪酸と高級アルコールのエステルである。
中性脂肪(トリアシルグリセロール、トリグリセリド)は、グリセロールに3つの脂肪酸がついている。
②複合脂質
リン酸や糖などを含み脂質で、リン脂質・糖脂質などがある
③誘導脂質
単純脂質と複合脂質の加水分解物でコレステロール、ステロイド、脂溶性ビタミン、ケトン体などがある。
★飽和脂肪酸(SFA) 一価不飽和脂肪酸(MUFA) 多価不飽和脂肪酸(PUFA)
★脂肪酸の分類
短鎖脂肪酸は、不飽和脂肪酸はない
中鎖脂肪酸は、不飽和脂肪酸はない
長鎖脂肪酸は一価にオレイン酸がある。
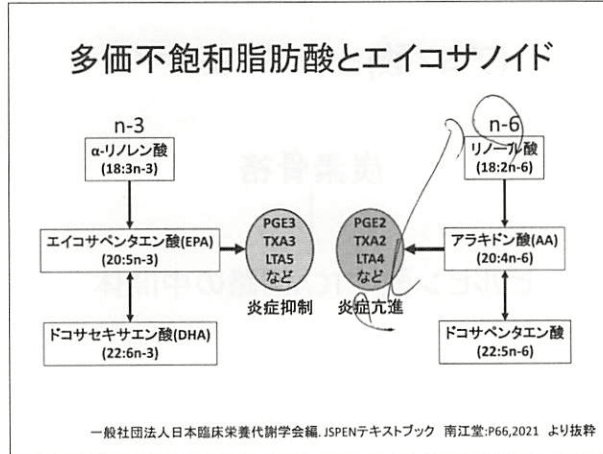
多価は、リノール酸(ω6系)・リノレン酸(ω3系)・EPA(エイコサペンタエン酸)・DHA(ドコサヘキサエン酸)がある。
多価不飽和脂肪酸は必須脂肪酸である。
不飽和脂肪酸は、不飽和結合がメチル基炭素から考えて何番目であるかでn-3系、n-6系に分類される。
脂肪酸は、二重結合(不飽和結合)の数が多い程融点が低く、炭素数が少ない程融点が低い、オリーブ油やごま油のような植物性脂肪は液体である。
PUFAは、リン脂質として細胞膜などの体構成膜の構成となり、脂質メディエーターの生成に関与する。
特にn-6系のアラキドン酸と魚油に含まれるn-3系のエイコサペンタエン酸とドコサヘキサエン酸は脂質メディエーターの生成に重要である。
必須脂肪酸であるPUFAの投与は基本である。
(MCTは細胞膜構成に関与しないため、MCTを投与しても必須脂肪酸欠乏が起こる)
●必須脂肪酸欠乏
脂肪含有量の少ない、成分栄養剤や消化態栄養剤のみを長期投与をしていると起こる。
対策:半消化態栄養剤への変更、脂肪乳剤の静脈投与
●脂質代謝
★中性脂肪
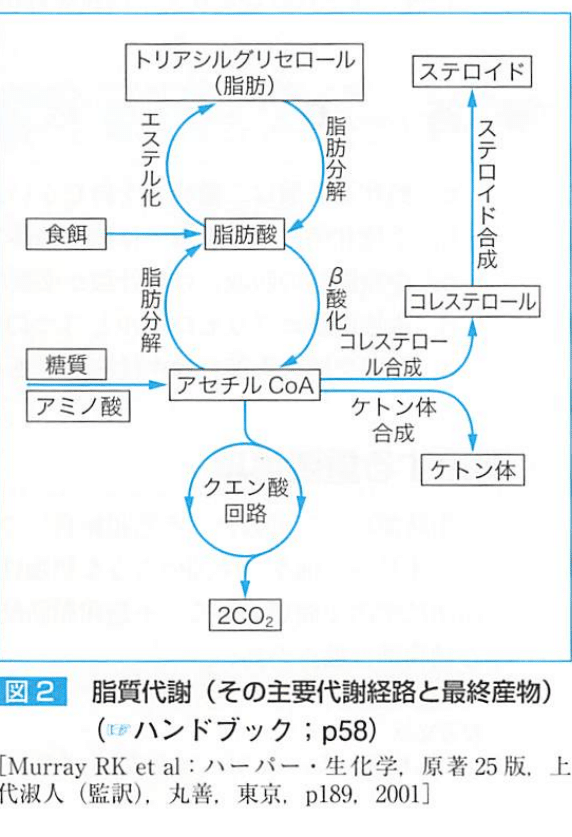
中性脂肪は、脂肪酸のグリセリンエステルの事である。
食物中の脂質の主要成分はトリグリセリドであり、消化されカイロミクロンとなる。
脂肪酸は糖質やアミノ酸由来のアセチルCoAから合成され、脂肪酸もβ酸化され、アセチルCoAになる。
ケトン体は、脂肪酸酸化が非常に速いときに肝ミトコンドリアで起こり、エネルギー源となる。
★MCT
トリグリセリドは、中鎖脂肪酸で構成され、MCTという。
MCTとは、
小腸内で膵臓リパーゼ、胆汁酸塩に依存することはなく、加水分解され、門脈から肝臓で吸収される。
静脈内にはいったMCTは加水分解されにくく、カルニチンに依存することなう、ミトコンドリアへ。
侵襲時にはカルニチン減少、加水分解されやすいため、長鎖脂肪酸と中鎖脂肪酸の組み合わせで蛋白質を補充する。
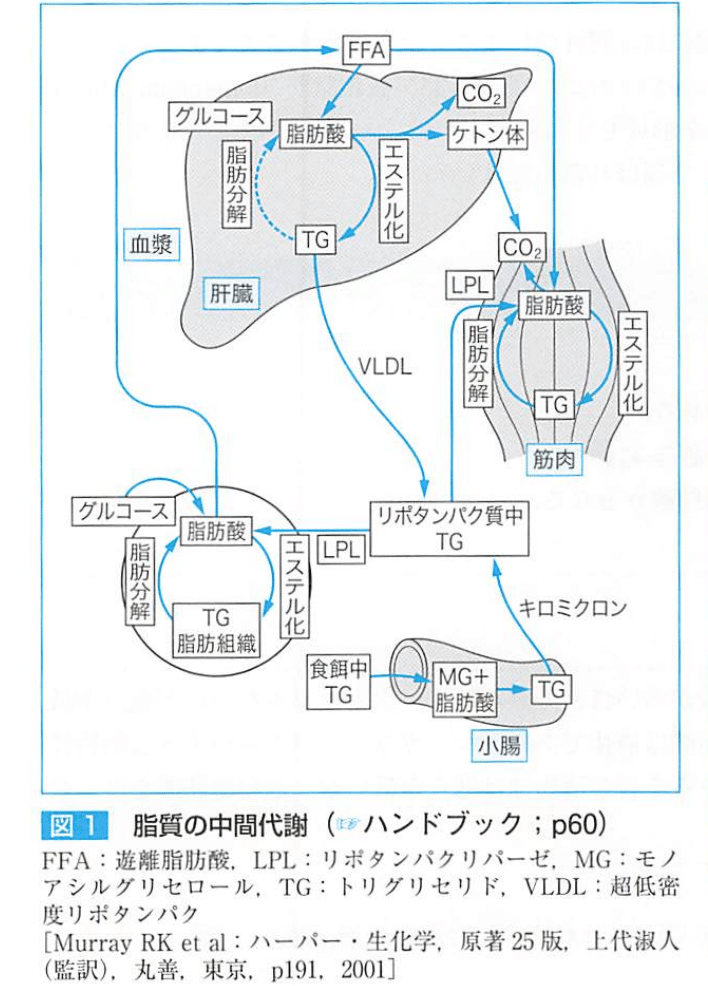
肝臓はすべての脂質代謝回路をもっている。
門脈からくる【中鎖脂肪酸】は肝細胞へいき、アシルCoAとなってカルニチン非依存性にミトコンドリア内へ移行。(中鎖脂肪酸はエネルギー源として効率が良い)

長鎖脂肪は、腸管内で脂肪酸とグリセロールに加水分解された後に吸収され、腸管上皮細胞内で脂肪に再合成、リン脂質で被われ、アポ蛋白を結合して原始カイロミクロンとしてリンパ管へ。
グルコースから脂肪を合成し、VLDLとして血中に放出する。
食事から4~5時間経過すると肝臓グリコーゲンから供給されるグルコースが減少し、代わって脂肪組織に蓄積されているトリグリセリドの加水分解が始まり、脂肪酸がエネルギーとなる。
脂肪酸の分解(β酸化)はミトコンドリアのマトリックスで起こる。
→細胞質内のミトコンドリアの内膜とが外膜を通過しなければいけない。
★ケトン体
ケトン体=アセト酢酸、3-ヒドロキシ酪酸、アセトンの総称
肝ミトコンドリアで産生される。
筋肉や脳などでアセチルCoAに変換され、クエン酸回路によって酸化されエネルギーを産生する。
飢餓時にはグルコース供給が低下し、脳のエネルギーとなる。
●尿素回路におけるアンモニア処理と産生
腸管内(腸内細菌、ウレアーゼ産生菌による)、筋肉・脳(BCAAの分解)、腎(排泄されたグルタミンに由来)、肝(不要な蛋白や過剰摂取蛋白質に由来するアミノ酸の異化)で産生される。
アンモニアは【そのままの形】【グルタミン】【アラニン】として肝臓へ
アミノ酸が酸化してできたアンモニアは、ミトコンドリア内で二酸化炭素と結合して、アンモニアはカルバモイルリン酸となる。
カルバモイルリン酸+オルニチン→シトルリン→細胞質に運ばれ→アスパラギン酸と結合。
アルギニノコハク酸はフマル酸・アルギニンになる。
(フマル酸はミトコンドリア内でリンゴ酸となり、TCA回路へ入り、オキサロ酢酸からアスパラギン酸に変換される、
アルギニンはアルギナーゼ(加水分解酵素)により尿素とオルニチンを生成する。
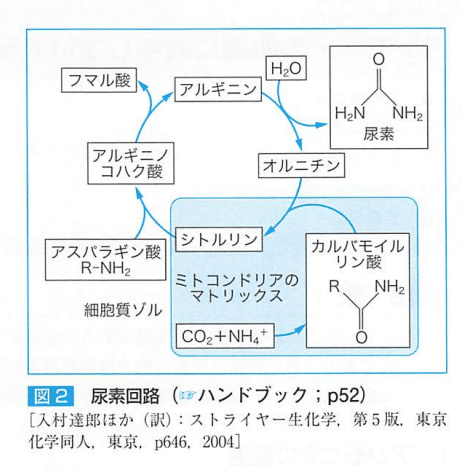
肝硬変などで尿素回路が障害され、アンモニアが蓄積すると、
酸化的脱アミノ反応の平衡がグルタミン酸産生へ移行してαケトグルタル酸が減少し、クエン酸回路や呼吸鎖反応も低下する。
腎臓もシトルリンを尿素に変換できるが完全な尿素回路ではない。
★アミノ酸のアミノ基転移とアンモニアの遊離
アミノ酸が代謝されるには、アミノ基を除去する。
アミノ基転移反応によって
ケト酸(αケトグルタル酸 ピルビン酸 オキサロ酢酸)となり、
αケトグルタル酸→グルタミン酸
ピルビン酸→アラニン
オキサロ酢酸→アスパラギン酸 になる。
※アミノ基転移を受けたアミノ酸は肝のミトコンドリア内ですべてグルタミン酸とアスパラギン酸に変換される。
(グルタミン酸は酸化的脱アミノ酸反応によりアンモニアを遊離する)
多くのBCAAは筋肉内で除去され、アラニンとグルタミンに収束し、
グルタミン→小腸で吸収
●エネルギー代謝
ATPは、解糖系・TCA回路・電子伝達系からつくられる。主な産生場所は電子伝達系である。
●解糖系
・糖の吸収と利用
多糖類は、唾液及び膵液中のαアミラーゼ、少量刷子縁でグルコースに分解される。肝臓へ
・糖質代謝
腸管→門脈→グルコースが肝細胞に取り込まれ、グリコーゲンとなる
グリコーゲンは、肝と筋に貯められ500~800gしかないため絶食・飢餓では2日以内に枯渇する。
肝は、筋で生じたアラニンからグルコースを合成して、筋に供給する(グルコースアラニン回路)
細胞内に運ばれたグルコースがピルビン酸にまで代謝される経路。
反応の場は細胞質ゾルである。
→好気ではグルコースがピルビン酸
細胞質ゾルからミトコンドリアのマトリックスに輸送され、ピルビン酸は酸化的脱炭酸され2アセチルCoAに変換され、オキサロ酢酸と結合してTCA回路へ。
NADHを産生し、電子伝達系でATP産生に利用される。
嫌気ではグルコースは乳酸になる。
グルコース1分子で4分子ATP(2分子が反応で消費)生成は2ATP
同時に2分子のNADHができる。(酸素の有無とは無関係に進行)
NADHは、NADに還元されるため、嫌気的解糖を続けることができる。
十分な酸素がない(嫌気的条件ではピルビン酸から乳酸が生成される。
乳酸は細胞外に移動し、肝臓へ流れ、糖新生回路によってグルコースに再生。Cori回路で再利用される。
※糖質代謝の嫌気的代謝では【水 二酸化炭素 ATP】がつくられる。
十分な酸素があればピルビン酸はアセチルCoAに変化する。
還元されずに細胞質に残ったNADHはリンゴ酸アスパラギン酸シャトルによってミトコンドリア内に入り、電子伝達系に電子を受けわたす。
このときに得られるエネルギーを利用してATPが産生される。
→嫌気的 1グルコースは【2ATP】と2乳酸
好気的 グルコース1molで38molのATPが産生される。
解糖系で2㏖,TCAで2mol,電子伝達系で34mol
→合計38molできる

嫌気的代謝とビタミンB1は関係している!
ビタミンB1は、ピルビン酸からアセチルCoAへの変換や好気的糖質代謝に必須な補酵素である。
ビタミンB1が不足→解糖系以降の好気的代謝が障害され、乳酸が増加する。
★キシリトールの代謝
グルコースと異なる代謝経路である。
Dキシルロースに変換され、キシルロース5リン酸となり、グリセルアルデヒド3リン酸から解糖系へ
代謝速度も吸収もグルコースより遅い。
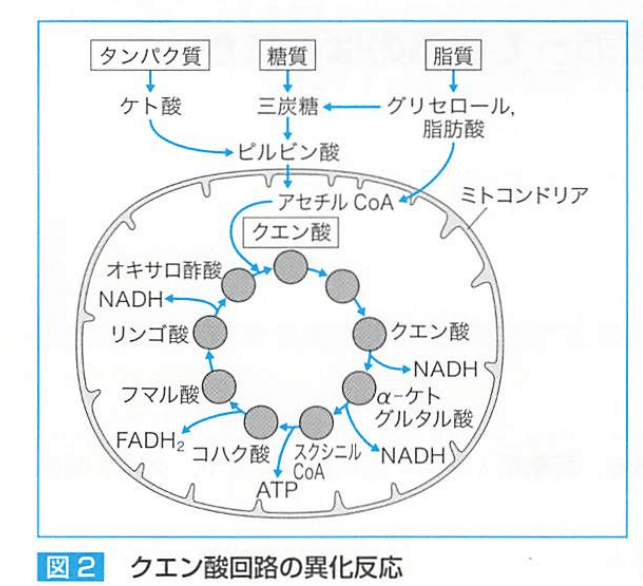
●クエン酸回路
ミトコンドリアの基質内で行われる代謝経路で【異化】【同化】を有する。
クエン酸回路=TCA回路=クレプス回路
【異化】
糖質、脂質、蛋白代謝からできるアセチルCoAがオキサロ酢酸と結合し、クエン酸となる。
2molのアセチルCoAから2molのATPが作られるだけでなく、2molの還元型フラビンアデニンジブクレオチド(FADH)₂と6molの還元型ニコチン酸アミドアデニンジヌクレオチド(NADH)が産生され、電子伝達系などのATP合成に利用される。
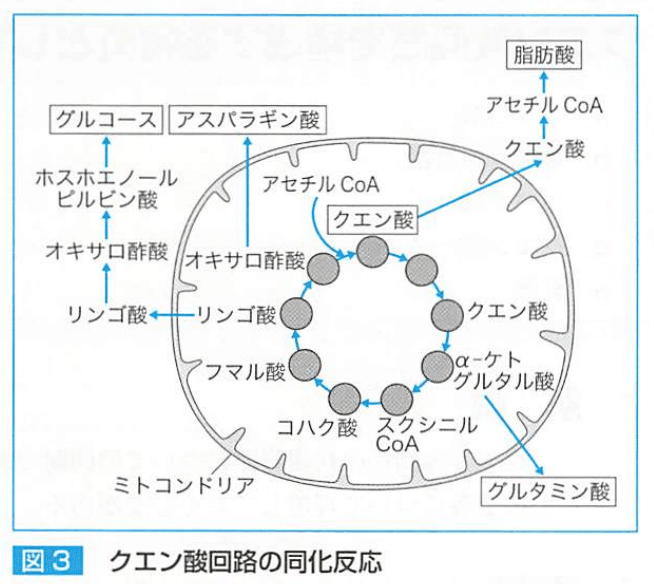
【同化】
クエン酸回路は、糖新生や脂肪酸合成に関与する。
リンゴ酸は細胞質に拡散し、ホスホエノールピルビン酸を経てグルコースへ。
オキサロ酢酸からがアスパラギン酸
αケトグルタル酸からグルタミン酸が合成される。
→クエン酸回路はアミノ酸合成にも関与する。
●糖新生
①食事
②グリコーゲン分解
③糖新生
ピルビン酸、乳酸、オキサロ酢酸からグルコースを生成する。
●糖の安全な投与限界は?
7g/kg/day(単位注意)=5mg/kg体重/min
糖質過剰投与は、糖尿病・侵襲・感染・脱水・ステロイド下ではDKAや高浸透圧性非ケトン性昏睡などを起こしうる。
脂肪肝や肝障害に注意する。
●蛋白代謝
【グロブリン以外】のほとんどの蛋白質を合成して供給する。
(グロブリンは腸管上皮細胞・リンパ球で合成される)
肝不全では【高アンモニア血症】から意識障害となる。
芳香族アミノ酸(AAA フェニルアラニン、トリプトファン)と分岐鎖アミノ酸(BCAA バリン ロイシン イソロイシン)の不均衡が起こる。
肝不全では、AAA 分解低下とBCAA合成低下によりFisher比低下し、脳細胞へAAAが流入し、肝性脳症を起こす。
BCAA投与が良い。
●アミノ酸の分類
蛋白質がアミノ酸からなる。アミノ酸は結合してペプチドとなる。
蛋白質は20種類の標準アミノ酸から構成され、α炭素原子にカルボキシル基とアミノ基がついている。
phにより、
①アミノ基とカルボキシル基を1つずつ→中性アミノ酸
②アミノ基を1つ、カルボキシル基2つ→酸性アミノ酸
③アミノ基 2つ、カルボキシル基1つ→塩基性アミノ酸
構造により、
脂肪族アミノ酸 芳香族アミノ酸 含硫アミノ酸
にわかれる。
★窒素代謝 概要
生体の蛋白量、アミノ酸必要量は、正常な生理機能を維持するための各臓器の代謝的窒素必要量(MD)と蛋白質、アミノ酸の摂取量及びその有効利用率によって規定される。
蛋白質は理論上分子構造から重量で平均
16%
の窒素を含む。
①血中に存在する遊離アミノ酸プール
②体構成蛋白質プール
との間で蛋白代謝回転を調節することにより、平衡を維持している。
食物中の蛋白質利用率は、最大でも
70%程度
1日の蛋白最低必要量は
約0.57~0.6g/kg体重/day
●RQ
RQ=CO₂産生量/O₂消費量
エネルギー基質を酸化したときに消費した酸素量に対する発生した二酸化炭素量の割合である。
生理学的には、0.67~1.3



★RQと代謝動態
健常者は、糖質優位
飢餓・肝硬変 糖尿病などで異化亢進すると脂肪有意となり、RQは減少した。
栄誉投与量不足は、飢餓により脂肪有意となりRQは減少する。
(RQのみで脂肪投与量は決めない)
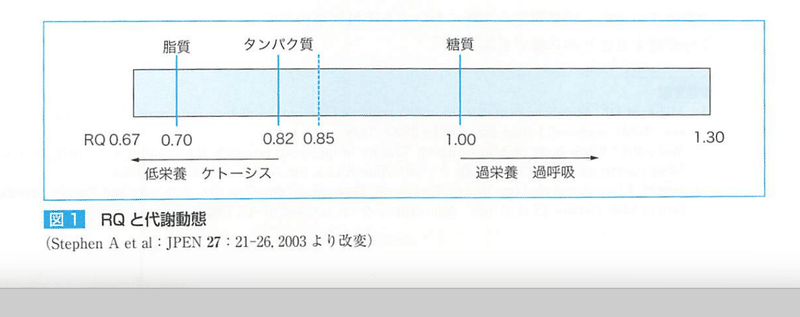
★RQに影響する因子

このような代謝でRQは変動する。
脂肪合成では、RQは上昇し、ケトーシスでは減少。
乳酸は1.0 グリコーゲン 1.0 βヒドロキシ酪酸 0.89 エチルアルコール0.67
酸塩基平衡により二酸化炭素の放出と貯留が制御されているのでアシドーシスでRQは上昇し、アルカローシスで減少する。
蛋白質の代謝産物の多くは尿中に排泄され、尿中の尿素窒素の測定することで蛋白質酸化による二酸化炭素産生量と酸素消費量が算出できる。
非タンパクRQ(nmRQ)からは糖質と脂質の燃焼割合が算出でき、RQが0.8前後であればRQとnmRQの差は小さいと推測される。
ビリルビン代謝
老化した赤血球が処理しヘモグロビンからビリルビンを合成して胆汁中に排泄する。
溶血が亢進すると溶血性の高ビリルビン血症が出現する。
●肝臓の外分泌機能
肝臓はコレステロールから胆汁酸を合成し、ビリルビンと共に胆汁として胆管へ排泄する。(一部は再吸収され、肝臓へ 腸肝循環)
胆汁酸は【脂肪を乳化し、膵液に含まれるリパーゼ】による加水分解を促進する。
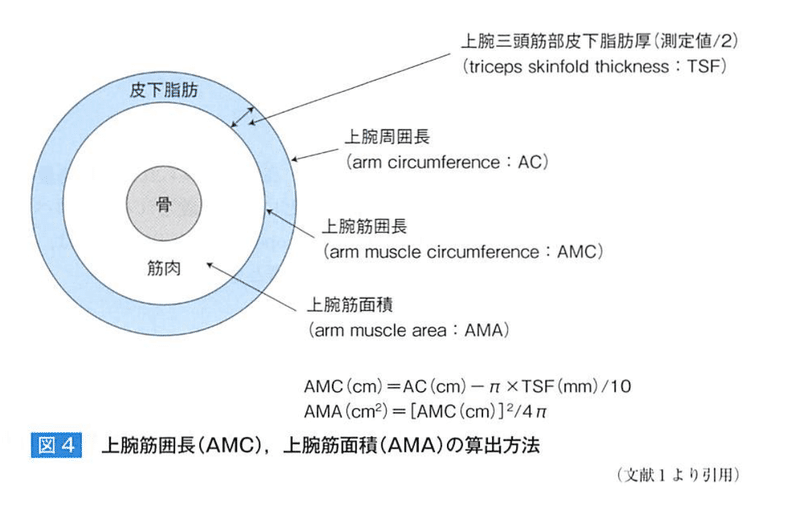
●AMAとAMC
は、筋蛋白量の指標 80~90で軽度、80~60で中等度、60以下で重度障害。
※AMCは、骨格筋量、内臓蛋白の指標でもある。
AC:立位か座位で利き腕とは反対側の腕を下垂させて、肩峰突起と肘頭の間の上腕三頭筋の中間部を測定する。全身体重の指標
●static index
TLV
●dynamic index(動的栄養指標)
大腿四頭筋筋力 呼吸筋力 握力 免疫能 神経機能 間接熱量測定 RTPなど
●脂溶性ビタミンはDAKE (ダケ)
過剰摂取は蓄積に過剰症がでる。
肝細胞内のコレステロール→胆汁酸→胆汁→十二指腸→回腸末端→肝臓へ(腸肝循環)※胆汁酸の役割は脂溶性ビタミンの吸収である
脂溶性ビタミンは、胆汁酸→ミセル化→カイロミクロンに結合→リンパ管へ
(胆汁が少ないと脂溶性ビタミンの吸収障害を起こす。長期化するとビタミンD吸収障害からカルシウム不足となり、骨軟化症を起こす)
(胆汁酸塩の欠乏は吸収不良を引き起こし、脂肪便及び脂溶性ビタミン欠乏を発症する。
ビタミンK欠乏はプロトロンビン値を減少させる。
胆汁うっ滞が長期化するとビタミンDとカルシウムの吸収不良を伴い、骨粗鬆症や骨軟化症を来す。
●ビタミンD
は、カルシウムの吸収に関係がある。
食物中のプロビタミンDは紫外線によりビタミンDに変換され、カルシウム及びリンの吸収代謝を調節する。
ビタミンDは、骨の石灰化に関与する。欠乏すると骨形成不全。(小児:くる病、成人:骨形成不全)
ビタミンD欠乏は、副甲状腺ホルモン(パラソルモン PTH)濃度上昇も起こし、骨を壊し、カルシウムを血中へ。尿路結石を起こす。
クル病 骨・歯育成不全
過剰では、、嘔吐 衰弱 異所性石灰化を起こす。
ビタミンDは、さらにマグネシウムとも関係がある。
●ビタミンA
成長 視覚 生殖 皮膚の正常保持など
欠乏:夜盲症 毛包性角化症など
過剰:脳圧亢進 食欲不振 脱毛 催奇形性など
●ビタミンE
膜脂質の過酸化帽子 プロスタグランジン代謝などに関与
欠乏:溶血性貧血 過酸化脂質産生
過剰:血小板減少
●ビタミンK
プロトロンビン合成に関与する。腸内細菌からも生成される。
【新生児ではビタミンK欠乏になりやすい】頭蓋内出血を起こしやすい。
成人での欠乏はまれで合成ビタミンK3(メナジオン)を過剰摂取すると溶血性貧血を起こす。
ビタミンKは、納豆・クロレラ・緑黄色野菜に多く含有されている。
日本人の食事摂取基準2010年では、
成人男性の1日目安亨は75μg 女性は65μg
ワーファリンの唯一禁忌薬は、骨粗鬆症治療薬であるビタミンK製剤のメナテトレノン
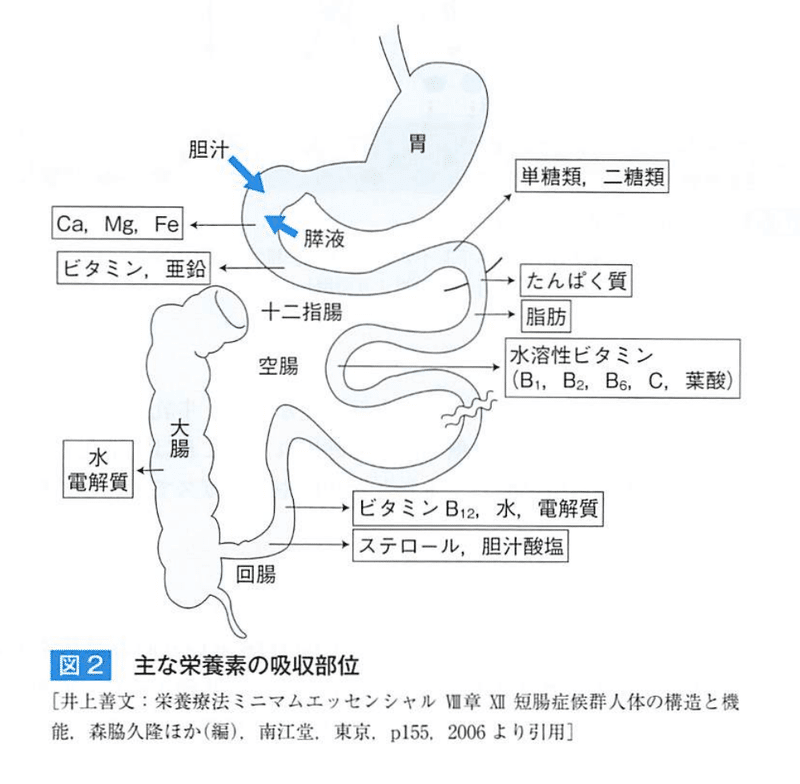
●栄養素の吸収部位
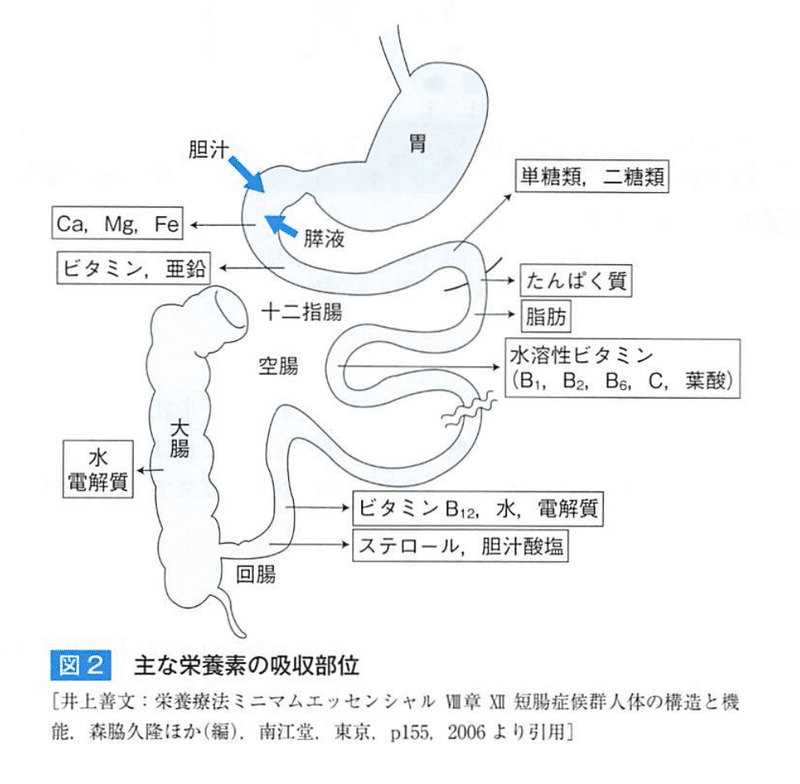
★直接的吸収障害
①鉄やカルシウム:十二指腸と上部空腸が切除されると吸収障害
②糖質:上部空腸は短時間で糖質を吸収するところ
③胆汁酸やビタミンB12:回腸末端切除
★間接的吸収障害
①ビタミンB12:胃の内因子と塩酸の存在下で結合し、回腸で吸収。
胃切除で吸収障害を起こす
②葉酸:上部空腸で吸収される際に胃酸による低phが必要であるため空腸切除や胃切除で胃酸分泌が低下すると吸収が低下する
③脂溶性ビタミン:膵臓切除後に吸収障害が起こると欠乏する
【相互作用】
①亜鉛と銅
亜鉛過剰摂取→腸管の銅吸収を阻害して銅欠乏を起こす
亜鉛を含む胃潰瘍治療薬を長期間内服すると血中濃度が低下する。
②尿路結石の発生
回腸末端が切除されると、胆汁酸吸収が低下し、胆汁酸プールが減少。
→二次的に胆汁酸と脂肪、脂肪酸の混合ミセル形成が不十分になり、空腸で脂肪の吸収が悪くなる。
吸収されない脂肪や脂肪酸がカルシウムと結合し、シュウ酸がシュウ酸カルシウムとして沈降できず、シュウ酸が大腸から吸収されて尿路結石となる。
③胆石の発生
コレシストキニン(CCK)やセクレチンが多く存在する十二指腸や空腸が切除・障害されると胆嚢の収縮が悪くなり、胆石形成の原因となる。
●BCAA
バリン ロイシン イソロイシン
BCAAは筋組織で代謝され、アラニン、グルタミンとして放出された後肝臓に運ばれ糖新生を行い、グルコースとして供給される。
侵襲下では、BCAAは骨格筋で利用され、損傷した組織蛋白合成の基質として利用される(muscle liver fuel system)
この時にフィッシャー比が低下するため、侵襲下でBCAAを投与すると蛋白「合成促進と筋蛋白崩壊を抑制する。
・肝疾患のBCAA補給にはリーバクト顆粒
エネルギー補給またはBCAA・エネルギー両者の補給には肝不全用TFにする(アミノレバン・へパン)
・AKIでは、蛋白異化亢進を起こすため腎不全用アミノ酸輸液を用いる。
●ビタミンの生理作用 欠乏過剰
★水溶性ビタミン
過剰なものは尿中に排泄されるので過剰症状はない。
①B1 (サイアミン)
酸化的脱炭酸反応の補酵素として働く 神経や筋肉の機能を正常に保つ
欠乏:乳酸アシドーシス ウェルニッケ脳症 脚気 など
【必ず投与】する。
②B2(リボフラビン)
電子伝達系酵素 欠乏はまれ(口内炎や皮膚炎を起こす)
③B6(ピリドキシン)
アミノ酸代謝の補酵素として赤血球機能改善に働く。
欠乏(貧血 末梢神経炎
④B12(コバラミン)
DNA合成 細胞への葉酸蓄積など
欠乏:悪性貧血(巨赤芽球出現、白血球及び血小板の形成障害)
末梢神経障害など
⑤ナイアシン
植物性食品では、ニコチン酸として存在
動物性食品では、ニコチンアミドとして存在
欠乏(ペラグラ)は稀。皮膚炎 下痢 認知症を呈する
⑥葉酸
ビタミンB12と共に造血や核酸合成に関与している。
欠乏:巨赤芽球性貧血、神経管欠損症 舌炎など
⑦ビオチン
脂肪酸合成 β酸化など
欠乏は稀 食欲不振、皮膚炎など
⑧C (アスコルビン酸)
酸化 還元反応に関与
欠乏:壊血病 骨発育不全など
⑨パントテン酸
ステロール ステロイド ポルフィリン合成に関与
欠乏は非常にまれ 抵抗力低下 肝障害 副腎肥大
●微量元素(9元素)
①体重1kg当たり1mg以下
②体内貯蔵量が鉄よりも少ない
③組織中濃度がppm(μg/g)オーダーより低もの
④1日必要摂取量が100mgより少ないもの
を微量元素としている。(定義)
鉄 ヨウ素 亜鉛 銅 マンガン コバルト クロム セレン モリブデン
●亜鉛
は微量元素の1つで他に、Sn,I、Cu、Mnなどがある。
(十二指腸~小腸で吸収される)
→胃全摘出(Roux-en-Y手術 ルーワイ)の場合は、微量元素不足が起こる。
亜鉛:骨 骨格筋 肝臓 皮膚を中心に存在する。
多いときは膵液により体外へ
体内の金属酵素の活性中心になっている。
蛋白質代謝、脂質代謝、糖質代謝、生殖、発達、味覚、遺伝子、損傷治癒などに関わる。
→皮疹、免疫能低下、消化器症状、味覚障害などが起こる。
(小児では、低身長、低身長など)
皮膚症状:口・会陰・爪周囲から起こり、増悪する
Znは、ALPと関連アリ。
●過剰摂取は、Cuと競合してしまい、吸収障害を起こす。
●Cu
:上部消化管・十二指腸→肝臓へ送られる。大部分は胆汁中として排便される。
食物繊維やカルシウムの吸収抑制を起こす。
欠乏:鉄欠乏貧血(早期に起こる)、好中球減少、骨代謝障害(病的骨折、骨粗鬆症)
皮膚:毛髪の色素欠乏、脱毛
※通常は過剰症を起こさない。(胆汁排泄障害の場合で長期TPN管理の場合は過剰症を起こす)
●Mn:マンガン
小腸上部で吸収→門脈→肝臓へ。過剰な場合は胆汁中へ
小腸での吸収はFeと競合するため、Feが多いとMnは吸収されにくい。
ミトコンドリア内に多く存在し、肝臓、腎臓、網膜、毛髪、皮膚色素沈着部など色素部に多く存在する。
過剰な場合は頭部MRIでの診断が多く、T1強調画像で大脳基底核に高信号。
初期は、易疲労感、食欲不振、頭痛、筋肉痛から高度になるとPD様、錐体外路症状が出現する。
●I(ヨウ素)
吸収:小腸から甲状腺組織(甲状腺ホルモンへ)
甲状腺ホルモンから遊離したヨウ素の9割は尿となり、体外へ。欠乏・過剰共に甲状腺腫や甲状腺機能低下症を起こす。
●Se(セレン)
ビタミンEと共に膜の安定化に関与する。
吸収:十二指腸から上部空腸。尿中・便中及び呼気中に排泄。
欠乏は、長期TPNで見られ。爪の白色化や変形、筋肉痛、筋力低下など
重篤になると不整脈・心筋症
●Fe
非ヘム鉄は、通常三価鉄の吸収されにくい形で存在するため、胃酸やビタミンCによって還元され二価鉄の形になり、トランスポーターDMT1より吸収される。DMT1が十二指腸に多く分布している。(胃からすぐ吸収したいので)
ヘム鉄は、タンパク質と同様の経路を使って吸収される。
●マグネシウム
TRPM6または7を通って吸収される。
胃酸を受けて吸収されやすい
●クロム
糖・コレステロール 蛋白代謝に関与している、耐糖因子
欠乏:耐糖能異常 体重減少 など
●モリブデン
尿酸・アミノ酸代謝などに関与している。
欠乏:頻脈 多呼吸 頭痛など
●脂溶性ビタミンKと肝疾患における血液凝固異常
胆汁性肝硬変や閉塞性黄疸では、出血に注意。特に閉塞性黄疸では脂溶性ビタミンの吸収が低下し、易出血となる。
胆道閉塞により3日以上の胆汁分泌障害で黄疸が顕性化してくる時期は出血に注意。
●体液量と分布
体液量は体重の6割を占める。
①細胞内液(40%)
②細胞外液(20%)→組織間液(15%)、血漿(5%)
年齢や脂肪量によって変動し、小児では多く、高齢者や肥満者、女性では一般に少ない。
細胞内液と細胞外液を隔てる
細胞膜
は、蛋白質などの高分子は通さず、電解質も特異的能動輸送によって通貨する。
組織間液と血漿間の
毛細血管内皮細胞
は高分子物質は通さないが電解質や低分子物資は自由に通過する。(両者の電解質濃度はほぼ等しい。)
●浸透圧
浸透により左右の液面の高さが異なるようになるが、この状態から元の液面の高さに戻すのに必要なある力を浸透圧という。
浸透圧は濃度に依存する。
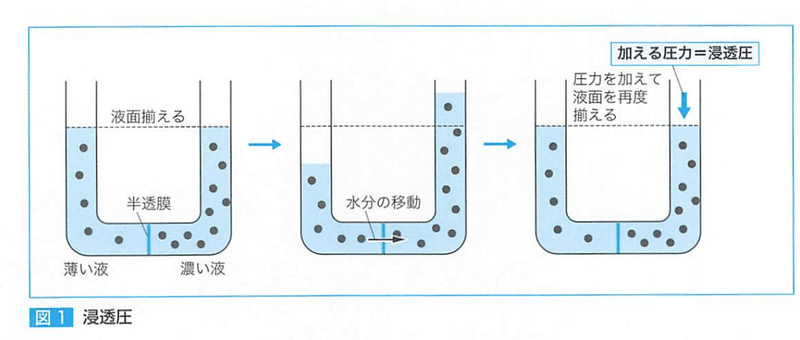
●浸透圧 単位
浸透圧は濃度に依存する。
g/L:溶液1L中に溶けている物質の重さ(グラム数)
%:溶液100ml中に溶けている物質のグラム数(5%ブドウ糖は100ml中に5%のブドウ糖が溶けているということ)
mol/L:溶液1L中に溶けている溶質のモル数
※モル数:溶質のグラム数をその物質の分子量でわったもの
mEq/L:溶液1L中に溶けている溶質の当量数である。
※当量数:モル数に電荷数をかけたもので、2価にイオンであれば当量数はモル数の2倍となる。 mOsm/L=mmol/L
●血漿浸透圧
285±5mOsm/Lに調節されている。
等張性:生理食塩液(0.9%食塩液) 5%ブドウ糖 乳酸リンゲル液 など
3%アミノ酸液と10%脂肪乳剤も等張性)
低張性:注射用蒸留水 水分は細胞内へ(細胞が膨化)
高張性:10%食塩液 20%ブドウ糖液 など (細胞は萎縮)
・注射用蒸留水
溶質がないため、浸透圧は0
・5%ブドウ糖液
溶液1L中にブドウ糖50gが溶けている溶液。ブドウ糖の分子量は180であるため、5%ブドウ糖=278mOsm/L(50/180=0.278) だから、等張性
・0.9%食塩液
1Lに食塩が9g溶けている。 食塩の分子量は58.5のため0.9%の場合は154mOsm/L(9/58.5=0.154)のため。
食塩は、NaとClに100%電離しているため154mOsm/L(Na)と154mOsm/L(Cl)となり、308mOsm/Lの溶液となる。→等張性
※末梢から投与可能な輸液の浸透圧比は3以下であり、血漿浸透圧は約300mOsm/Lであるため末梢から投与できるのは浸透圧900mOsm/L以下
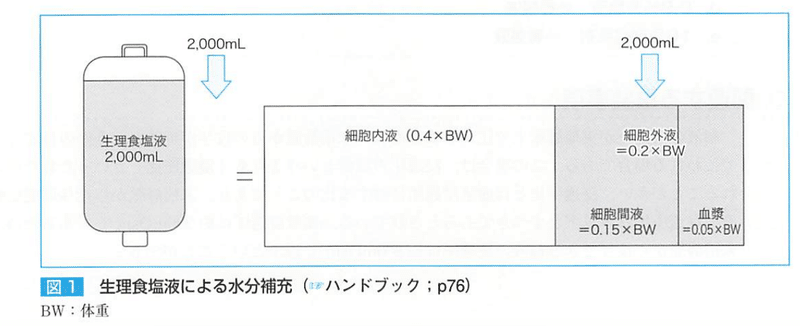
●リンゲル液
生理食塩液のナトリウム濃度が血中よりも高いため、ナトリウム過剰負荷になりやすいデメリットを改善するために開発され、酢酸リンゲル液は酢酸ナトリウムがアルカリ化剤として配合されている。
●1号液(開始液)
1/2生理食塩液であり、カリウムフリー。病態が把握できない脱水症に使用する。
●2号液(回復液)
カリウムを加えた1号液で下痢などカリウムを失う脱水に使用する
●3号(維持)
カリウム、マグネシウム、リンなどを含有した1/3~1/4生理食塩液であり、長時間の維持が可能。

●食物繊維
人の消化酵素では加水分解されにくく、大腸で一部または大部分が腸内細菌によって加水分解を受ける植物成分である。
水溶性と不溶性に分かれる。
不溶:便量を増加させ、蠕動運動を亢進させ、便秘を改善。
→セルロース、ヘミセルロース、リグニン、キチン、グルカンなど
水溶:腸粘膜表面の不攪拌の増大や糖質及びコレステロールを吸着することで吸収を抑制し、糖尿病や脂質異常症心血管の患者に応用される。
→ペクチン、グアーガム、グルコマンナン、ポリデキストロース、アルギン酸ナトリウム、ラクトロースなどのオリゴ糖は腸粘膜に対する栄養効果を発揮する。
※日本人の食事摂取基準2010年版では、食物繊維の1日の目標量は(18歳以降)は男性で19g以上、女性で17g以上。
※グアーガムやペクチン、ラクトスクロースなどのオリゴ糖(水溶性)
腸粘膜に対する栄養効果を発揮する。
「日本人の食事摂取基準2010 1日の目標量(18歳以降は男19g、女17g)
●アルブミン
血清蛋白は、
①アルブミン
②トランスサイレチン(プレアルブミン)
③レチノール結合蛋白
④トランスフェリン
→RTP(急性相蛋白)
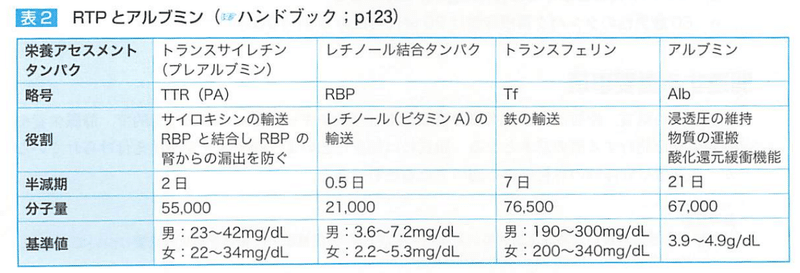
分子量 6700
血清蛋白の60%を占める
【機能】
①血漿の膠質浸透圧の保持
②金属イオン、ビリルビン、胆汁酸、脂肪酸などの輸送
③生体内におけるアミノ酸の供給源
④酸塩基平衡
生体内のアルブミンプールは3.5~5.3g/kgであるが、約1/3が血管内プール(血漿アルブミン)、それ以外は血管外プール(体組織、皮膚など)に存在する。
●脂肪乳剤の投与について
人工脂肪粒子は、加水分解された後、アポリポ蛋白CⅡとⅢがHDLに戻り、次々とはいってくる人工脂肪粒子に絶え間なく供給される。
脂肪粒子とHDLのバランスが大事でHDLの量を超えると血中に脂肪が停滞する。
速度は、0.1g/kg/体重/hr トリグリセリド 300mg/dl未満であることを確認する。
●短鎖脂肪酸
栄養素を吸収する腸管自体も栄養摂取が必要である。
経口摂取では、グルタミンやグルタミン酸をエネルギー源とし、絶食+静脈栄養時には腸絨毛の基底膜側のトランスポーターを介して、血管経由でグルタミンやケトン体を輸送して、エネルギー源とし、低栄養のダメージを最小限にしている。
大腸は短鎖脂肪酸が唯一のエネルギー源である。
グアーガムなどの水溶性食物繊維は直絶ビフィズス菌などによって短鎖脂肪酸を生成されることでBifidobacterium優位の腸内細菌叢が誘導される、(プレバイオティクス)
同時に、大腸内phを下げてクロストリジウムなどの腐敗菌の増殖を抑制し、発癌抑制効果が期待される。
●GFO
グルタミン、グアーガム酵素分解物、オリゴ糖を含む。
グルタミンは小腸のエネルギーとなる。(絶食時でも消化吸収を行う腸管自体にも栄養が必要であるため絶食時にも投与する)
グアーガム酵素分解物は、短鎖脂肪酸へと変化し、大腸へのエネルギー源である。
オリゴ糖は、ビフィズス菌であり、生体に有害な酵素活性を抑制する。
●エネルギー計算
★摂取エネルギー
20~69歳 平均エネルギー摂取量 男性2110~2180kcal
女性1610~1730kcal
★炭水化物の摂取量
男性:300g/day 女性:220~250g/day
炭水化物は4kcal/gであるので男性1200 女性1000
(
炭水化物の総エネルギーの55%
)
★脂質の摂取量
男子:55~65g/day 女性49~55g/day
コレステロール摂取量は平均すると1000mg/day以下であるので、コレステロールの割合は1%内外である。
★蛋白質の摂取量
男性 73~78g/day 女性58~67g/day
(1.2~1.3g/kg体重/dayの蛋白質を摂取している)
●安静時エネルギー消費量(REE)
酸素消費量と二酸化炭素産生量を測定し、Weirの式からREEを計算する。
(FIO₂0.4以上は、Elbynの式を用いる。

★間接熱量測定の留意点
①30分前から安静
②外来患者1晩絶食
③入院患者は測定2時間前から投与・食べさせない。
④静脈栄養や経静脈栄養者は中止せずに、投与速度を一定にする
⑤適応・静穏な環境で測定する(テレビ、読書などは禁止)
★そのほかの活動量・エネルギー消費量の測定法
①ヒューマンカロリーメトリ法
ベッドやトイレを備えた呼気ガス分析を行う。
マスクやマウスピースは着用しない。
長時間測定ができる。
②二重標識水法
酸素と水素の安定同位体を用いて測定する。
簡便で活動制限がない。測定には3日かかる
平均の総エネルギー量しか得られない。
③加速度計法
加速度の大きさがエネルギー消費量と相関することを利用し、エネルギー消費量を推計する。
★食事誘導性熱産生(DIT)
食物を消化吸収するときの熱産生で摂取エネルギーの6~10%が誘発される。
蛋白質を摂取したときに顕著で20~30%になる。
静脈栄養時でもDITは起こる。
DITはBEE(基礎エネルギー消費量)の10%程度である。

●術後 エネルギー消費量(EE)
★EE
TEE=BEE+DIT+AEE=REE+AEE
TEE(総エネルギー消費量)
BEE(基礎エネルギー消費量)=基礎代謝量(BMR)
DIT(食事誘導性熱産生)
AEE(活動時エネルギー消費量)
体動+運動時のEEである。
REE(安静時エネルギー消費量)
★基礎エネルギー消費量(BEE)
定義
「食後10時間以上経過、臥床、覚醒、正常体温及び環境温度、非ストレス下という条件下で個体が消費する熱量」
体表面積(身長・体重)にBEEは相関する。
身長と体重が同じ個体であれば加齢により減少する。
●体重
徐脂肪体重は加齢とともに減少し、51歳以上でエネルギー投与量から男性で300kcal、女性で600kcalを減らすことを推奨している。



●栄養評価
★一次スクリーニング(主観的包括的アセスメントSGA)である
①MNA
65歳以上の高齢者を対象したものである
②MUST
身長 体重 BMIで評価する 成人用 最近5日間の栄養摂取状況をみる
③NRS2002
a.BMI20.5以下
b.最近3か月で体重減少がある
c.最近一週間以内に食事摂取量の減少がある
d.重篤な疾患を有している
1つでも該当すればファイナルスクリーニングへ
入院患者全般に使用できる
④成長曲線
小児対して有用である

●ODA
静的指標と動的指標がある。
静的:
動的:大腿四頭筋筋力 呼吸筋力 握力 免疫能 神経機能検査
RTP
●侵襲時
★長期飢餓と侵襲の違い
飢餓→代謝率は低下 体タンパクは保存 脂肪酸からのケトン体産生が亢進
侵襲→蛋白異化亢進 ケトン体産生は軽度亢進

糖質代謝
→免疫細胞 線維芽細胞 脳でブドウ糖が利用される。
肝臓のグリコーゲンは12から24時間で枯渇するため乳酸とアミノ酸から糖新生が促進される。
内因性のブドウ糖産生は制御が障害されているため、外因性のブドウ糖やインスリン投与により抑制されない。
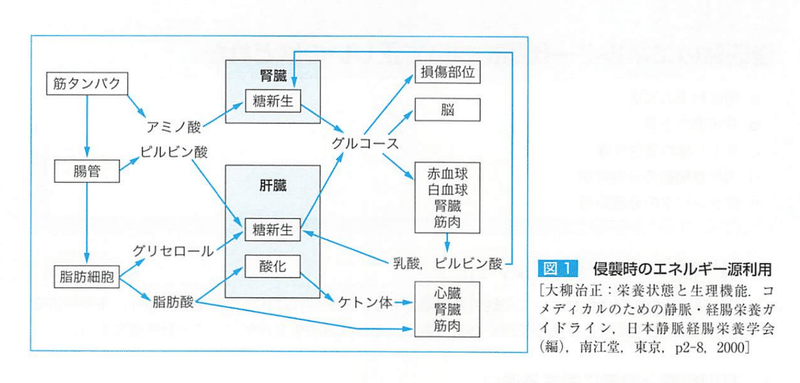
蛋白代謝
蛋白異化亢進すると 260g/day 1kg/dayの筋肉減少に相当する。
アミノ酸は筋組織から供給されるが結合組織や腸管からの喪失も著明である。
脂質代謝
カテコラミンにより組織リパーゼ活性が増加し、脂肪分解促進。
血中脂肪濃度は上昇する。
肝における糖新生に必要なエネルギーの9割は脂肪酸の酸化による。
呼吸商は、ブドウ糖で1.0 脂肪酸で0.7
侵襲時には脂肪酸の酸化が優位になり、呼吸商は減少する。
血中の脂肪酸は肝臓と筋で酸化されて、残りはエステル化されてトリグリセリドとなる。
4~5mg/kg体重/minを超えるグルコース投与を行うと脂肪肝と筋組織での脂肪蓄積を起こし、DM、肥満、敗血症では頻度が高い。
●ライン類の交換
輸液ライン:週1~2回定期交換
CV:定期的に交換する必要はない
末梢ライン:96時間以上留置しないほうが良い。 72時間以上留置しない方が良い。
・経鼻胃管:4重間程度の短期間の栄養管理で用いられるため、4週以内に交換する理由もない。
・胃管カテーテルの交換時期はバルーン型とバンパー型で異なる。
バルーン:交換容易 破損などにより胃婁カテーテルの脱落が生じやすい。
1~2か月で交換
バンパー:耐久性が良い 事故抜去も生じにくい、交換時に苦痛を伴いやすい。バンパー型は4~6か月を目安とする。
・CRBSI
①皮膚挿入部(一番多い) ②輸液の汚染 ③ほかの感染巣からの血行性転移

・CRBSIの予防
留置部位の選択:大腿静脈は皮膚常在菌が多く、排泄物もあるため発生率が高い。
鎖骨下静脈と内頚は発生率に差がない。
留置操作時の対策:消毒には高濃度のクロルヘキシジンアルコールか10%ポピヨンヨードを用いる。
高度バリアプレコーション(MBP)が有効である。
・CRBSIの起因菌は、真菌とブドウ球菌が多く、肺炎かん菌、大腸菌などの腸内細菌もみられる。
真菌の血流感染による真菌性眼内菌は視力低下・失明などを起こす可能性がある。
●TF後の腹部膨満、腹痛、悪心、嘔吐
対策:PPI,H₂ブロッカー、腸管蠕動運動促進薬、下痢による薬物療法や注入前の版行(PEGの場合)、栄養剤の投与速度を低速にする。
幽門後経路に変更する。半固形化にする。食物繊維を添加する。
下痢・便秘への対応は、水分・食物繊維不足、運動不足、蠕動運動低下など
他にも乳糖不耐症(ラクターゼ不足)、栄養剤の細菌汚染なども考える。
→血漿浸透圧は280mOsm/L、半消化態栄養剤は300~400前後で投与後は速やかに吸収・消化されるため緩徐投与されれば下痢が発生するリスクは少ない。
※栄養剤に関係のない下痢を発生することもある。
→抗菌薬(ペニシリン、セファロスポリン、クリンダマイシンなどによる腸内にクロストリジウムが異常増殖して起こる偽膜性腸炎、感染性腸炎、薬剤性下痢、過敏性腸症候群、放射線治療後、消化吸収障害性疾患など
●PEG
胃切除後症例や腹水貯留例だけではなく、高度肥満やChilaiditi症候群のように横隔膜下に結腸があり、送気で胃を膨満させても体表から穿刺できない場合はPEGは禁忌。
①プル法:ワイヤーで口から胃へ
②プッシュ法:ガイドワイヤーで口から胃へ
③イントロデューサー法:腹壁から胃へ
※セルシンガー法(ダイレクト法):イントロデューサ法の変法
●胃婁晩期の合併症
多くは胃婁チューブの瘻管圧迫による血流障害
(チューブ型(外にチューブがでている):外部バンパーの閉めすぎ、
ボタン型:短いチューブ長が原因)→常に1~2cmの遊びが必要である。
※チューブ型
飛び出ているので外観悪い。リハビリしにくい。事故抜去あり。
シャフト長は変更可能。接続チューブ不要。
※ボタン型
シャフト長は固定、接続チューブが必要。

●瘻孔からの漏れ
圧迫介助のために細いチューブへ交換。減圧のため開放する。
栄養剤は半固形化にする。長期の場合は抜去して、自然閉鎖or OPE。
●瘻孔の炎症
原因:機械的炎症 or 瘻管感染
対応:圧迫解除 洗浄による保清 感染兆候があればポピヨンヨード(イソジン)は刺激が強いため、クロルヘキシジン(ヒビテン)を使用する。
増悪すると蜂窩織炎になる。
●半固形化の適応
下痢、GER(胃食道逆流)、瘻孔からの漏れが適応である。
※食道裂孔ヘルニアは逆流による窒息リスクがある。
●胃婁チューブの交換
胃婁チューブ増設後2~3周でバンパー型は耐久性に優れるため長期留置が可能である。
バンパーは6か月以上、バルーン型は24時間以上留置が必要。
※バンパー型
抜去のリスク低い、耐久性が高い、4~6か月で交換、交換は技術を要する。抜去時痛い。
※バルーン型
抜けやすい、耐久性低い、1~2か月で交換、交換は容易で苦痛はない。
●空腸投与の問題
PEG-Jは、PEGなどで留置された胃婁チューブを通して幽門後チューブを留置する手技である。
幽門後チューブは逆流防止のため先端を空腸に置くが、十二指腸をバイパスするために長期管理では微量元素の欠乏が起きやすい。


●ワーファリンの作用機序
血中の遊離型ワーファリンが肝細胞中に取り込まれ、肝臓で産生されるビタミンK依存性凝固因子と総称されるⅡ(プロトロンビン)、Ⅶ、Ⅸ、Ⅹ因子の生成を阻害することにより発揮される。
※ビタミンK欠乏症
ビタミンK供給量不足も、ビタミンKサイクルが回転しないことの要因となる。
①抗生物質投与時の腸内細菌叢の抑制に伴う腸内細菌からの供給不足
②肝臓・胆道疾患に伴うγ-GCの活性化低下、胆汁分泌不全、VKOR活性低下など
●小児
新生児、低出生体重児は体脂肪の貯蔵量が少ない。代謝が高く、飢餓に対する耐用性が低い。代謝異常をきたしやすい。不感蒸泄も大きい。
総水分量が大きく、外液の量も多い。
体液:成人よりも水分量が大きい。水分不足や発熱、下痢に伴う脱水で循環不全を起こしやすい。
※小児の腎臓
生直後:濃縮能は成人の1/2、GFRは成人の1/5
(1~2歳で成人と同じになるが、それまでは高張性脱水を起こす)
38℃以上では、1℃上昇ごとに5ml/kg/体重/dayの不感蒸泄が増加する。
濃縮能:1歳半から2歳ごとになってほぼ成人と等しくなる。
希釈能:生後2週目には成人と等しくなる。
●小児の特殊性
・糖質の消化
新生児→乳幼児:膵臓の未熟性による膵臓アミラーゼ活性が低い(3か月まで)、多糖類は(デンプン、デキストリン)は分解困難。
乳糖分解酵素(ラクターゼ)は小腸刷子縁に存在し、最も活性が高い。糖質は乳糖が好ましい。(乳糖不耐症では消化できない)
母乳中の糖の95%は乳糖であり、小腸に豊富にある乳糖分解酵素(ラクターゼ)でガラクトースとグルコースに分解され、吸収される。
(成人ではほとんどが活性を失い、消化は困難)
・糖質の静脈投与時
成人に比し、小児は耐糖能が優れている。
低出生体重児:4~6mg/kg/minから開始、MAX 【8】
成熟時:6~8mg/kg/minから開始 MAX【10~14】
過剰投与により、非アルコール性脂肪性肝疾患(NAFLD)に注意!
(成人投与では、4mg/kg/minで5は超えないこと)
・蛋白質の消化
新生児は胃液の酸度が低い(胃ペプシン活性が低い)
※膵液は、トリプシン、キモトリプシンがある。
カゼイン量の多い牛乳蛋白は、胃内でハードカードを形成し、消化が悪く、食物アレルギーのリスクとなる。
母乳は、蛋白質が牛乳より少なく、カゼインも少ない、消化の良い乳糖(ホエイ)蛋白を多く含む。
・蛋白質の消化吸収
生後3か月までで胃酸・ペプシン活性が低い。
胃内での蛋白分解困難!トリプシンは、出生時年長児の10%前後。
1か月で摂取蛋白に見合う分泌、4か月で成人レベルに達する。
出生後数週間までは、
①小腸上皮細胞の細胞間マトリックスが未熟
②異種蛋白の吸収を妨げる免疫グロブリン(IgA)の産生が少ない。
→十分に加水分解されない蛋白質が抗原性を保持したまま吸収される。
※だから、うまれてすぐ離乳食などは始めない。

・脂肪の消化
膵リパーゼ活性が低く、胆汁酸プールが小さい。
約45%の脂肪を含有する母乳や人工乳は、舌リパーゼと母乳中の胆汁酸塩促進性リパーゼ消化吸収を行っている。
※舌リパーゼの分泌を促さないTF管理では、不消化便を認める場合は脂肪分解酵素を含む消化酵素薬の併用を検討する。
・静脈栄養における脂肪乳剤の投与の重要性と注意点
血管内皮細胞表面にあるリポ蛋白リパーゼ(LPL)の活性が低い。
長鎖脂肪酸の参加に必要なカルニチン合成が不十分であり、肝臓も未成熟であるため、脂質クリアランスが低下している。(脂肪蓄積量も少ないため脂肪投与を行わなければ容易に必須脂肪酸欠乏を起こす。
新生児、乳児:1日の脂肪投与量→0.5g/kg/体重/dayから開始。
0.5g/kg体重/dayずつ増量し、維持は2G/KG体重/DAYとする。(最大3まで)
低出生体重児:速度を遅く。高脂血症予防で0.1g/kg体重/hrを超えないようにする。
●小児の水分出納
エネルギー/水分量=1.2~1.7ml/kcal(成人は1ml/kcal~)
●小児のエネルギー蓄積量
小児は基礎代謝が高い、エネルギー蓄積量が必要。
(生直後の成人の3倍~4倍)
消費エネルギーが大きい!6か月齢前では
①グリコーゲンの蓄積量が少ない
②筋肉量が少なく糖新生が十分に行えない
→容易に低血糖(4時間以上持続すると後遺症が発症)、栄養不良に陥る。
→小児の脳のエネルギー消費量は?
成人:18% 約500kcal 新生児:50%(約150kcal)
→中枢神経系を含めた成長発達では、4~7日以内に経腸が困難な場合は速やかに経静脈栄養を開始すべき。
→2週間未満 PPN 2週間以上 TPN(PICCを入れる)
※シナプスは10歳前後まで増加する
●新生児、乳児期に特有の条件付き必須アミノ酸は?
ヒスチジン
フェニルアラニン、チロシンの分解酵素活性が低いため過剰症になりやすい。(中枢神経障害を惹起する)
メチオニンからシステインへの変換酵素活性が低いため、脳細胞の発達に不可欠なシステインやタウリンは条件付き必須アミノ酸と考えられている。
成長発育に必須のヒスチジンも生後6か月までは条件付き必須アミノ酸である。
栄養療法では、小児は非蛋白エネルギーを大きく設定することで窒素利用効率が高まり、腎臓への負担も軽減する。
NPC/N比を200~250とする。
低出生体重児、特に1500g未満の極低出生体重児は1000g未満では消化器系が未熟であるため、1日目からの静脈栄養が飢餓状態の予防、蛋白異化の抑制、高血糖、高Kを抑制する。
※アミノ酸投与量は 2.0g/kg体重/day
●経腸栄養剤の種類
成分栄養 消化態栄養剤 半消化態栄養剤
※クローン病への経腸栄養は?
活動期クローン病の寛解導入には、ペンタサ(経口メサラジン)やステロイド(中等度~重度)、免疫抑制薬、成分栄養(窒素源がアミノ酸であり、低脂肪である)、TPNなどを組み合わせる。
(ステロイドは骨粗鬆症、高血糖、高血圧、緑内障などを起こす)
※ステロイドを減量できない場合はイムラン(免疫調節薬)
脂肪は腸管への抗原刺激性があるため、低脂肪食とする。

消化管は、消化吸収、免疫反応の場でもある。
gut associated lymphoid tissureが備わっている(免疫臓器がある)
→クローン病では、粘膜免疫系が破綻し、マクロファージやT細胞が活性化し、炎症性サイトカインによる腸上皮細胞が障害される。
(原因は、西欧食事、腸内環境、食事抗原の過剰な免疫反応? 不明確である)
症状:全消化管に病変を起こす。 好発は、回盲部(8割)
腹痛、下痢、発熱、体重減少(クローン病の7割に起こる)小腸大腸型は80%で体重減少がみられる。
全層性に見られ、瘻孔や膿瘍形成、狭窄、穿孔が起こる。
潰瘍性大腸炎は、連続性病変であるが、クローン病は非連続性(skip lesion)`である。小腸型(脂質や微量元素の消化吸収障害を起こす)、小腸大腸型、大腸型に分類されるが上部消化管のみに出現する例もある。
びらんや潰瘍などにより蛋白漏出を起こし、低Alb、低コレステロール血症を起こす。
所見:縦走潰瘍、敷石像(cobble stone appearance)
吸収不良症候群は、単一の栄養素の消化吸収のみ(ラクターゼの活性低下による乳糖不耐症)の場合と複合的な消化吸収障害(短腸症候群により小腸における栄養素不足と膵酵素の分泌低下により消火機能低下した病態)を認める場合がある。
REE(安静時消費エネルギー量)が主要因で体重減少は起こらない。
クローン病では、吸収面積減少により、脂肪の消化吸収機能が最も障害されやすい。(糖質や蛋白質に比べて消化吸収過程が複雑であるため)
ブドウ糖の吸収障害は、著しい短腸症候群ではない限り、ほとんど認められない。
ビタミンは、脂溶性ビタミンの吸収障害を起こす。
【薬物療法】
インフリキシマブ(レミケード)、アダリムマブ(ヒュミラ)抗TNF-α抗体
→有用性が高い
抗薬物抗体があると二次無効を来す。(頻度は30~50%のため成分栄養剤(half ED)などを組み合わせる.
※他にウステキヌマブ(ステラーラ)→インターロイキン12/23をターゲットペドリズマブ(エンタイビオ)→α4/β7インテグリンをターゲットも使用可能。
●潰瘍性大腸炎
病態:クローン病と同様に粘膜免疫径が破綻し、炎症性サイトカインにより
腸上皮細胞に傷害を来す。(結腸にびらんや潰瘍を形成する)
原因:不明
特徴:直腸から口側に連続性を認める。
持続性または反復性の血便または粘血便
下痢・腹痛・発熱など
種類:
①直腸に限局(直腸炎型)
②直腸から脾湾曲部まで(左側大腸炎側)
③脾湾曲部(全大腸炎型)
食欲不振や貧血、体重減少などを認める。
腹痛や下痢・発熱など→食事摂取量減少→異化亢進
小腸粘膜が侵されていることはまれで消化吸収機能は保たれている。
潰瘍やびらんにより蛋白漏出を来す。
◆薬物療法
5-アミノサリチル酸製剤(5-ASA製剤)が基本。ダメならステロイド(長期使用で骨粗鬆症、高血圧DM,緑内障など)
他に、①アサコール ②ペンタサ ③サラゾピリン ④リアルダ
②:坐剤 注腸剤
③:坐剤
ステロイドで無効な場合は、イムラン・ロイケリンなど
タクロリムス(プログラフ)やシクロスポリン(サンディミュン、ネオーラル)など免疫抑制薬。
また、抗TNF-α抗体はレミケードやヒュミラ、シンボニーを使う。
JAK阻害薬:トファシチニブ(ゼルヤンツ)、抗α4β7インテグリン抗体でああるベドリズマブ(エイタイビオ)や抗IL-12/23抗体であるウステキヌマブ(ステラーラ)などを使用する。
◆栄養療法
頻回の下痢、粘血便の場合は、静脈栄養!
ブドウ糖の投与速度は、5mg/kg/分以下にする!
低アルブミンは、製剤投与で中毒性巨大結腸症を予防する。
アミノ酸投与量は、粘膜障害からの蛋白漏出を考慮して1.5~2.0g/kg/体重/dayとする。総エネルギーの12~15%をアミノ酸で投与する。
脂肪乳剤は総エネルギーの10~30%
※脂肪乳剤で潰瘍性大腸炎は悪化
活動期:エネルギー代謝亢進
中等度~重症:エネルギー必要量は 32~36kcal/kg/日(28~31kcal/IBW/日)
寛解導入後には戦時エネルギー消費量は低下し、エネルギー必要量は約30kcal/kg/日程度に低下する。
寛解すれば食事制限じゃない。静脈栄養から食事に移行する際は動物性脂肪や刺激物など、腸管に刺激性のある食品を控える。
プレバイオティクス、プロバイオティクスが有効。
水溶性食物繊維には抗炎症作用がある。
軽症~中等度:成分栄養剤では、下痢を助長する。(高浸透圧のため)
※経腸栄養そのものに寛解維持効果も認められないのは、クローン病との大きな相違点。(成分栄養剤を用いた経腸栄養は寛解導入されるものではない)
薬物療法が主体。特殊な栄養管理はない
●急性膵炎
では、急性であっても可能な限り経腸栄養(EN)が推奨)。
膵内での膵酵素活性化による膵臓の自己消化をしてしまう。
症状:急性 上腹部痛 圧痛から反跳痛など
原因:アルコール(男性)、胆石(女性に多い)
栄養管理:軽症であれば経口栄養(EN)が推奨
重症では、ENが推奨。
脂肪投与は、膵外分泌を刺激し、炎症を増悪させると器具されたが否定されている。


●非代償性慢性膵炎
膵臓の外・内分泌組織が荒廃しており、消化吸収障害や耐糖能異常を起こす。(徐脂肪量が減少)
積極的な栄養管理は、非代償期である。
評価は、身体計測と血中栄養指標である。
身体計測:体重測定 体脂肪量 徐脂肪量の測定
血中栄養:プレアルブミン・レチノール結合蛋白・脂溶性ビタミン・微量元素の測定が推奨。
膵外分泌機能不全の評価:便中脂肪量測定が望ましいが、BT-PABA試験が良い。
消化吸収障害により便中へのエネルギー喪失及び膵性糖尿病による尿中へのエネルギー喪失を防ぐ目的で消化酵素薬・胃酸分泌抑制薬を投与することが必要。
(脂肪便の場合は脂溶性パンクレアチン製剤:脂肪便減少、蛋白代謝改善、体重増加、腹痛軽減など)
重炭酸塩分泌が低下している状態では、十二指腸内phが低下するため消化酵素は容易に失活し、腸管内で十分な効果を発揮できない。胃酸分泌抑制薬を同時内服することで胃十二指腸内phを上昇させることで消化酵素薬の効果発言を高めることができる。
脂肪摂取量は、1日40~60g、全エネルギーの30~40%を摂取する。
脂溶性ビタミンの欠乏や微量元素、水溶性ビタミンの欠乏を起こす。
●非代償性肝硬変の栄養治療
肝障害→BCAA(分岐鎖アミノ酸)とAAA(芳香族アミノ酸)、メチオニンが変動する。(AAA増加、BCAA低下のためBCAAを投与する)
BCAA:ロイシン イソロイシン バリン
AAA:チロシン フェニルアラニン トリプトファン
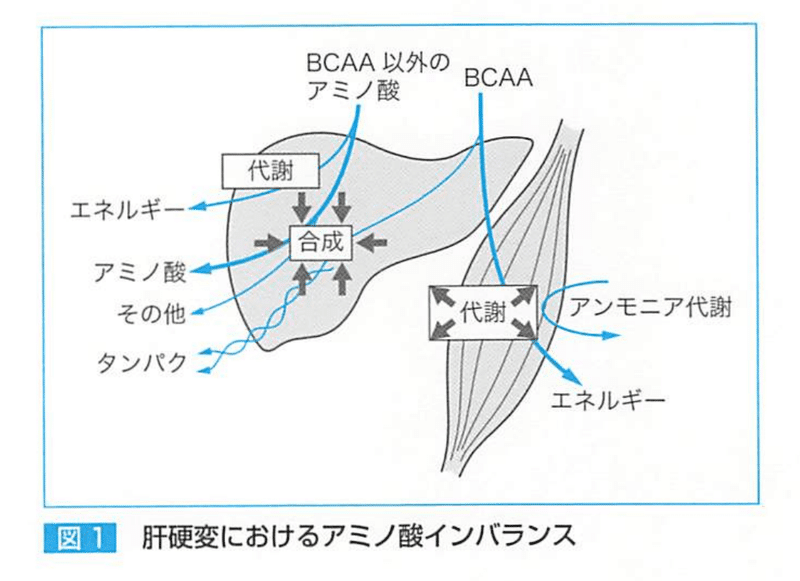
①肝硬変→高アンモニア→代償のためBCAAを使用する 説
②肝硬変→BCAAをエネルギー源とする 説 などある。
骨格筋が血中からBCAAを取り入れることになる。(アンモニア解毒のため)
アンモニアは、肝硬変になると骨格筋でグルタミン酸からグルタミン合成をする過程でアンモニアを取り込むことで処理されるため、グルタミン酸の供給が不可欠である。(その前段階でBCAAが必要である)
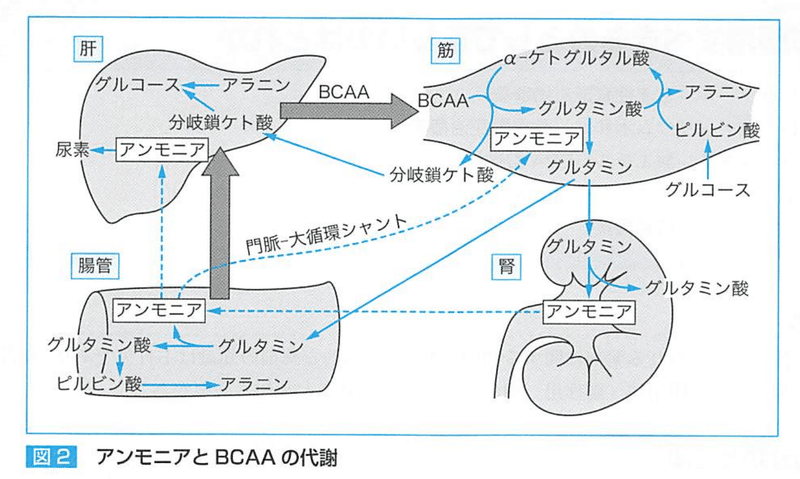
肝硬変では、よく使用される糖質が
①肝臓の萎縮によるグリコーゲン貯蔵減少
②末梢組織でのインスリン抵抗性増加のため利用効率が低下する。
肝硬変になるとBCAAは骨格筋に利用されるため投与しなければいけない。

●透析患者の代謝異常
【水分・電解質異常】
水分過剰 低Na 高K 低Ca 高P 高Mg 代謝性アシドーシス
※マグネシウム:腎臓で1/3排泄している
【蛋白代謝異常】
腎障害あるが、BCAAはエネルギー効率が良いため、欠乏と非必須アミノ酸の過剰状態が生じることも知られている。
【糖質代謝異常】
アシドーシスや尿毒素蓄積により細胞におけるインスリン感受性が低下し、糖の利用が障害される。(血中インスリン濃度がひくくなる)
さらに、腎機能低下によりインスリン分解が遅延し、血中のインスリン濃度が上昇する。
【脂質代謝異常】
VLDL((超やIDLが増加、HDL減少。
ビタミンAが増加 ビタミンDが減少
ビタミンA過剰:食欲不振 骨関節痛 高Ca血症
ZnとSeが欠乏 Cuとアルミニウム(AI)が過剰
亜鉛は吸収が低下し、味覚障害や貧血の原因となる。

●メタボリックシンドロームの診断基準
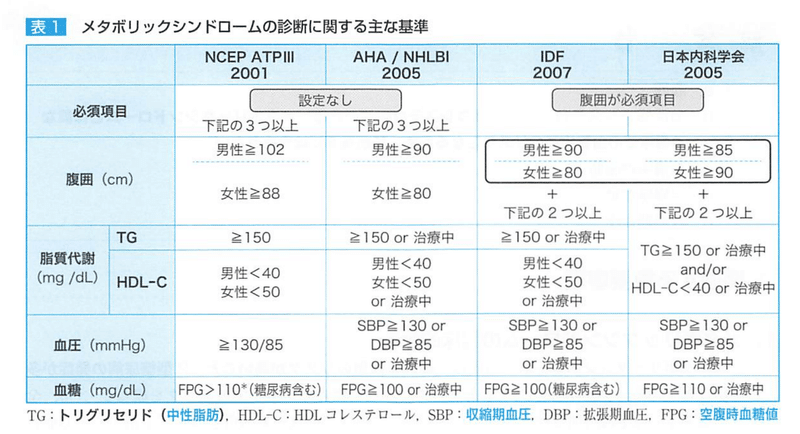
IDF、日本内科学会では、【内臓肥満】が必須。
腹囲基準と脂質異常、高血圧、空腹時血糖の高値で2項目以上でメタボ!
腹囲:立位 軽呼気時に臍レベル
(脂肪蓄積の場合は肋骨下縁とASISの中点の高さで測定
※糖負荷試験は必須ではない。
臍高部レベルCTスキャンによる腹腔内脂肪面積100cm²に相当する腹囲は、
男性で85cm、女性90cmである。
IDFでは2007年 男性90cm以上 女性80cm以上が腹囲基準
メタボがなぜ重要なのかと言われると、
心血管疾患のリスクが高い、Ⅱ型DMの発症が多い
脳卒中リスクが2~3倍
腹囲が増大すると心血管イベントがさらに増加する。
食事療法:摂取エネルギー25kcal/kg/標準体重を目安
まずは、現体重の5%減を3~6か月かけて行う。
●糖尿病
遺伝と環境要因で起こり、インスリン作用の不足に基づく慢性の高血糖状態
インスリン作用の異常は【高血糖】【脂肪】【蛋白質】などを起こす。
【糖尿病とメタボリック】
肥満とインスリン抵抗性を基盤として高血圧、脂質異常症、高血糖などの代謝異常をもたらす。
内臓脂肪が過剰に蓄積すると脂肪細胞が肥大化し、肥大化した脂肪細胞はインスリンの働きを悪化させる。
T NF-α(腫瘍壊死因子)、FFA(遊離脂肪酸)、レジスチンなどを分泌し、インスリン作用を促して動脈硬化を予防するアディポネクチンの分泌を低下させる。インスリン抵抗性が起こり、血糖値が上昇する。(サルコペニアと関係している)
内臓脂肪は皮下脂肪に比べ蓄積しやすいが、代謝されやすい。
減量によってインスリン抵抗性は改善し、アディポネクチンは増加する。
【糖尿病の栄養療法】
高脂肪、高エネルギーな食事、ファストフード、スナック菓子、清涼飲料水などによる単糖類の過剰な摂取と食物繊維の摂取減少、運動不足、夜間の過剰摂取などの生活習慣で起こる。
糖尿病治療は、
【血糖コントロールを維持】【合併症の発症及び進行を予防】【QOL維持】
【適正なエネルギー量】【バランスのよい食事】【規則的な食事】
食事では、余分なエネルギー摂取を避け、インスリン需要量を減らすことができる。
朝昼夕にすることで血糖値の変動を最小限に抑えることができ、著しい高血糖や低血糖を避けることができる。
【糖尿病とエネルギー量】
エネルギー摂取量=目標体重×エネルギー係数
※目標体重:身長(m)×身長(m)×22(65歳未満)
身長(m)×身長(m)×22~25(65歳以上)
※75歳以上では、フレイル、ADL低下、併存疾患、体組成などを含める
身体活動レベルと病態によるエネルギー係数
①軽労作(大部分が座位の活動) 25~30
②普通の労作(座位中心だが通勤・家事・軽い運動を含む 30~35
③重労作(力仕事 活発な運動習慣がある) 35~
50~60%は炭水化物、食物線維を豊富にとる。
蛋白質標準当たり 1.0~1.2g(1日50~80g)残りを脂質(25%以下)
糖質:脳 神経組織 赤血球 腎尿細管 精巣 酸素不足の骨格筋など 通常はブドウ糖しかエネルギー源として利用できない組織に送る。
高脂質/低炭水化物食は、低脂質/高炭水化物に比べて
短期的には、体重、血糖コントロールにおいて優れている。
LDL増加、食後遊離脂肪酸・食後トリグリセロール増加、蛋白質摂取が増加し、動脈硬化が進行する。
【糖尿病と小児】
小児の2型DMは摂取エネルギー量の制限を指導してはいけない。
【糖尿病と妊婦】
糖尿病妊婦:糖尿病である女性が妊娠した状態
妊娠糖尿病:妊娠後に発見されたDM
糖尿病妊婦における血糖コントロールの悪化は、母体の高血圧、腎症、眼症などのリスクを高める。胎児の先天奇形や流産、巨大児や新生児低血糖などをリスクを高める。
エネルギー摂取は、非妊娠時の標準体重×30kcal+付加量(妊娠前半:150kcal、妊娠後半350kcalとする。 1日6回の分食にする。
【糖尿病と慢性膵炎】
食事制限をすると膵外分泌低下による吸収障害を起こし、低栄養となる。
【糖尿病と脂質】
総エネルギーの25%にする。
n-3系多価不飽和脂肪酸(魚、青魚)の摂取し、トランス脂肪酸を控える。
※n-3系:血清TG低下 血圧低下 血小板凝集作用 内皮機能の改善など
多価不飽和脂肪酸+水素添加→ハードマーガリン ショートニングなどに含まれるトランス脂肪酸の過剰摂取はLDL上昇する。
飽和脂肪酸(摂取エネルギーの7%)と多価不飽和脂肪酸(10%)以内
一価不飽和脂肪酸の摂取にも留意する。
【糖尿病と蛋白質】
摂取エネルギーの20%以下
蛋白質過剰摂取により、耐糖能低下、心血管増加、癌発症率増加、骨量の減少など
動脈硬化予防のために動物性蛋白(40~50%)を控え、大豆製品などの植物性蛋白質を摂取することが進められている。
大豆にあるイソフラボン、蛋白質、、多価不飽和脂肪酸などにより軽度LDL低下、抗酸化作用、血圧低下などの摂取が良い。
【糖尿病と食物繊維とグリセミックインデックス(GI)】
食物繊維は、ヒトの消化酵素では加水分解を受けにくく、大腸では腸内細菌によって加水分解を受ける植物成分であるとされている。
排便量・回数増加、消化管通過時間の短縮の作用
野菜は1日350g以上が推奨されている。
食物繊維→水溶性と不溶性がある。
・水溶性(ペクチンなど)胃排泄の遅延と小腸からの吸収遅延効果
食後の糖吸収遅延による血糖コントロール改善と
コレステロール低下作用あり。
グリセミックインデックス(GI)
健常人においての同量の糖質を含む食品の食後の血糖上昇の程度を指標化したもの。
食物繊維を多く含むものはGIが低くなる。

食物に含まれる炭水化物量とグリセミック指数を掛け合わせたグリセミックロード(GL)が摂取炭水化物量の指標である。
【糖尿病とアルコール】
アルコールは、胃(30%)、空腸上部(70%)で吸収される。
肝グリコーゲンの蓄積が少ない状況でのアルコール摂取は糖新生を抑制し、低血糖予防となる。
飲んだ酒の量(mL) × 酒のアルコール濃度 × 0.8 エタノール換算
エタノール換算して45g以上の常習者はDMが悪化しやすい。
【糖尿病と低血糖】
対応:経口でブドウ糖5~10g 静注で10~20g
自律神経障害を合併している場合は低血糖の前兆がないまま意識障害を起こす(無自覚性低血糖)
【糖尿病とシックデイ】
糖尿病患者が風などの感染症、食欲不振、嘔吐、下痢などを生じた状態をシックデイという。
ストレスがかかるとインスリンに拮抗するホルモンが増え、血糖値が上昇。
高血糖となり、高血糖性脱水を起こす。
食欲不振では糖の摂取が下がり、低血糖を起こす。
インスリンに拮抗するホルモンが増え、インスリン欠乏が起こると脂肪分解され、ケトン体を増やす。
シックデイの時の対応
→安静、食事や水分、電解質をとること。
水分は1日1L、食べやすいもの、塩分やカリウムなどを電解質を含むもの
特に糖質と水の摂取を優先する。
【糖尿病と血糖コントロールの目標】
厳格な血糖コントロールが推奨さらない。
重症例:随時血糖が180mg/dL以下
インスリン併用で140~180
低血糖が回避できる場合は110~140とする。
【糖尿病へのTF】
①低炭水化物(低糖質)
②MUFA(一価不飽和脂肪酸)の強化
③食物繊維の添加
④難消化性の糖質に使用 など
【COPD】
気腫性病変が優位な気腫型COPD
末梢気道病変が優位な非気腫型COPD の2種類がある。
【COPDと低栄養】
軽症・中等症でもBMIが20未満が3割もいる。
体重減少は、閉塞性障害の重症度と関連し、1秒量が30%未満の最重症患者では60%とさらに体重減少が認められた。
安定期のCOPDでは、アルブミンの低下はないがRTP(プレアルブミン・レチノール結合蛋白)の低下がみられる。
BCAAは低下し、BCAA/AAA比が低下する。
気腫型COPD患者の億は、RTP低下とアミノ酸インバランスを伴うマラスムス型の蛋白エネルギー低栄養状態を呈する(呼吸器悪液質)
脂肪量(fat mass FM)の減少は軽度の体重減少(80%≦%IBW≦90%)から認められるが、徐脂肪体重(LBM)と骨塩量(BMC)の減少は中等度以上の体重減少(%IBW<80%)で明確となる。
MNA-SFでCOPDは半数が栄養学的リスクが認められている。
※LBMは、筋蛋白量の指標である。
閉塞性換気障害(FEV1)や肺過膨張(RV/TLC)などの呼吸機能指標や呼吸筋力を相関し、VO2MAX(最大酸素摂取量)や6MWTの規定因子となる。
【COPDの栄養障害の原因】
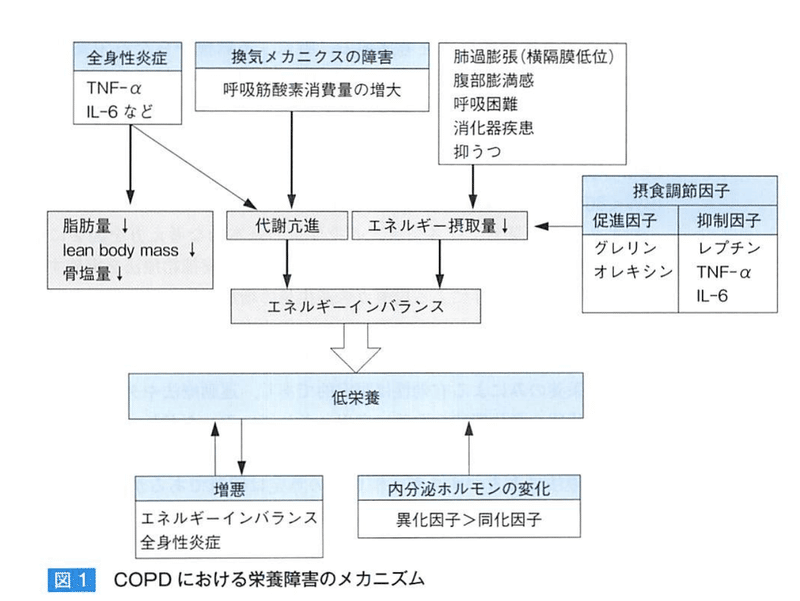
安定期でも代謝亢進状態のため、安静時エネルギー消費量(REE)は増大している。(閉塞性換気障害や肺科包丁、呼吸筋力の低下に基づく呼吸筋酸素消費量の増大が主因)
【COPDの増悪と低栄養の関連】
増悪時には、BMIやMNASFが増悪の予測因子となる。
また、炎症性マーカーとレプチンが押下する。
【COPDの栄養療法】
低体重患者(%IBW<90%あるいはBMI<20g/m²)で食事摂取量を増やすことが困難な場合は経腸栄養や経口栄養補給をする。
特にLBMが減少している患者や、LBMの減少が予測される中等度以上の体重減少(IBW<80%)では栄養補給療法が必須である。
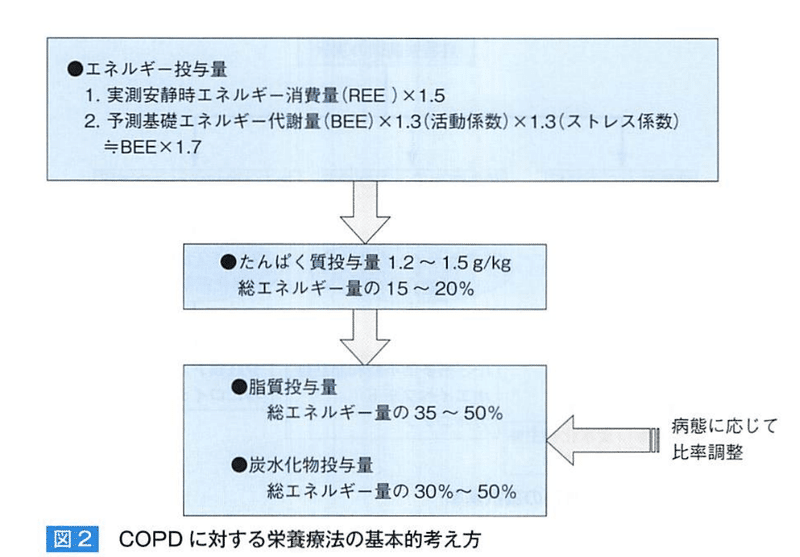
REE/BEEともに増大する。
BMI及びBODEindexはCOPDの予後因子として重要である。LBMは体重よりも有用な予後因子である。
【COPDと栄養指導】
食後に腹部膨満感や呼吸困難を訴えることが多いため、食事は4~6回の分食にする。
消化管でガスを発生しやすい食物や炭酸は避ける。
肺性心の合併により浮腫があれば塩分は7~8g/日以内にする。
COPDには、アミノ酸スコアの高い良質のタンパク質、BCAAの合併率が高い食品の摂取が進められる
カリウム、カルシウム、リン、マグネシウムなどの電解質や微量元素は呼吸筋や四肢運動の収縮力保持に重要である。
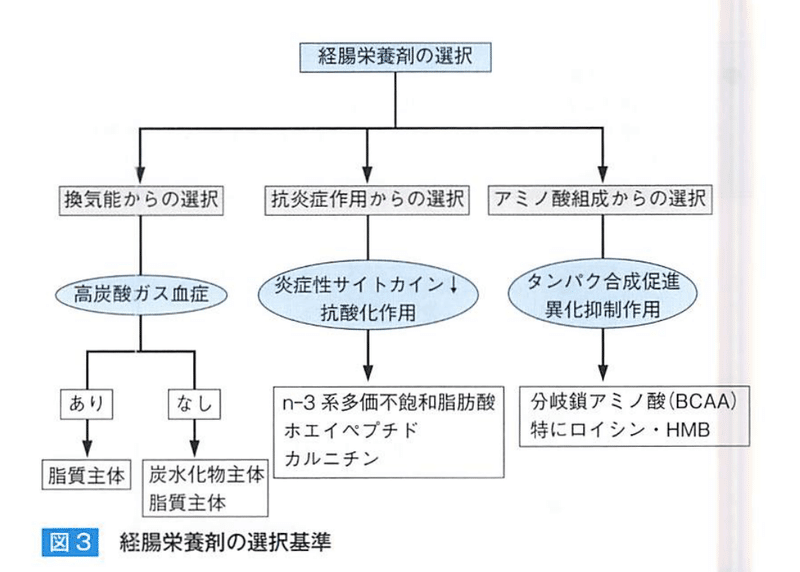
【COPDの経腸栄養の投与法】
体重減少+COPD→ONSを少なくとも3か月以上継続する。
【COPDの経腸栄養の選択】
・換気能力からの選択
高CO2 血漿があれば呼吸商の小さい脂質の栄養剤にする。
脂質は胃内での停留時間が長いため横隔膜運動を低下させる。
・抗炎症作用からみた選択
n-3系多価不飽和脂肪酸はNF-kBを制御して炎症性サイトカインを抑制する。
n-3/n-6比の高い経腸栄養剤の有効性やn-3系のサプリメント併用で運動耐容能改善がみられる。
ホエイペプチドは抗炎症・抗酸化
・アミノ酸組成からみた選択
BCAAには異化抑制・蛋白合成促進作用があり、BCAAは運動時に骨格筋での利用が高まるため運動時の投与が有用である。
ロイシンは筋蛋白合成促進効果が強く、ロイシンの中間代謝物である(HMB)はさらに強力な作用を有する。
【COPDと運動と炎症】
運動時には骨格筋からサイトカイン産生が誘導される(マイオカイン)
マイオカイン(IL-6)は、運動時に血中濃度が上昇する。
サルコペニアや身体活動性低下がみられる患者ではIL6が上昇する。
継続的なリハビリテーションでIL-6産生が抑制される。
COPDの血中IL-6やCRPの上昇が筋力低下や運動能の低下と関連する。
【COPDと運動と栄養の併用】
低強度運動と栄養補給療法により蛋白同化作用と全身炎症の抑制効果がある。
ホエイペプチドは消化吸収に優れ、BCAAの含有率が高く、抗炎症・抗酸化。
Lカルニチンは、長鎖脂肪酸のミトコンドリアへの輸送に必須の栄養素である。
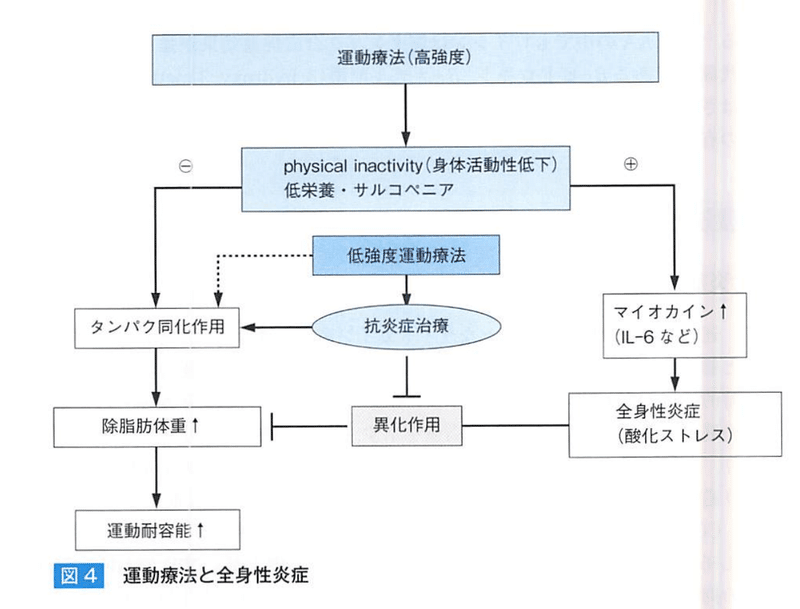
【COPDの予防的観点からみた栄養療法】
低BMIが喫煙とは独立したCOPDの発症因子であり、閉塞性換気障害悪化の促進因子であることが報告されている。
【COPDとQOL評価】
COPDに特異的な質問票:SGRQやCRQで評価した健康関連QOL(HRQOL)の低下は呼吸機能障害よりも体重やLBMの減少と強い関連を認める。
●酸塩基平衡
細胞の生命活動により、3大栄養素(糖質、脂質、蛋白質)が代謝され、代謝産物として多量の酸(二酸化炭素と水)が生成される。
代謝産物は有害で酸性でphの変化に対して、細胞外環境を保つために調節機構を働かせる。
腎は、余分な酸を出して、中和するために塩基を産生・再吸収することでphを調整している。
●アルカローシスを起こす病態
呼吸性→過呼吸
代謝性→H喪失(嘔吐)またはHCO₃-の過剰産生
重曹投与 大量輸血(HCO₃⁻の前駆物質であるクエン酸が含まれている)
●アシドーシスを起こす病態
代謝性アシドーシスの原因
①有機酸(不揮発性酸)が蓄積タイプ;AG増加 腎不全、ケトアシドーシス
②HCO₃⁻が喪失するタイプ:下痢
③H⁺が負荷されたタイプ:塩酸塩の投与
●バクテリアルトランスロケーション
腸粘膜のバリアが種々の要因で障害され、腸内細菌、エンドトキシン、真菌を含めたすべての微生物及びその菌体成分の腸管内腔から全身への移行。
腸粘膜上皮細胞のtoll likerecepterからの細胞内刺激伝達系を介したサイトカイン産生と腸粘膜免疫系の活性化からの病態としてSIRS、MOFとの関連が重要である。
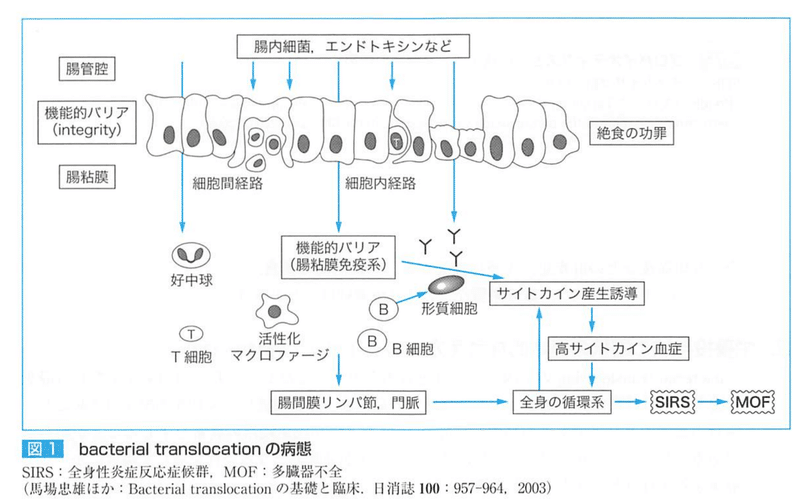

①外傷、熱傷、ショック、大侵襲手術などの救急あるいは外科領域
②BTを生じる代表的な消化管疾患である重症急性膵炎
③門脈圧亢進症や胆汁うっ滞を生じる慢性肝疾患、急性肝不全、肝切除後などの肝疾患
④炎症性腸疾患
⑤長期間の絶食、TPN、成分栄養
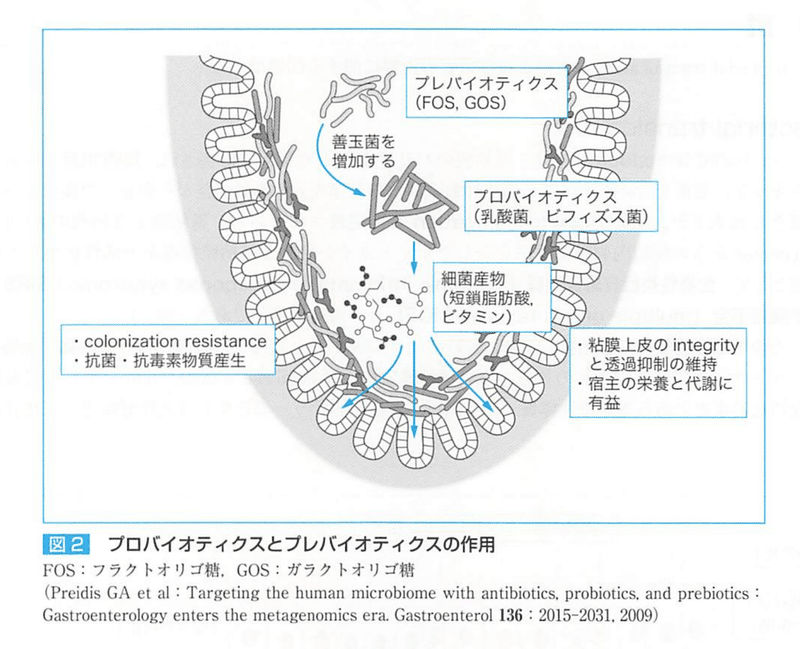
グルタミンは侵襲下において需要が増し、条件付き必須アミノ酸と呼ばれ、腸粘膜細胞及びリンパ球やマクロファージの重要なエネルギー源であり、蛋白合成、プリン・ピリミジン合成にも用いられる。
善玉菌を生菌として投与する:プロバイオティクス
プロバイオティクスによって利用される食物繊維などのプレバイオティクスを投与することが行われる。
両者の投与がシンバイオティクス
プロバイオティクスで細菌の産物である短鎖脂肪酸や各種ビタミンなど腸粘膜integrityと透過性抑制を維持すること、プロバイオティクスによるcolonization resistance、抗菌・抗毒素物質の産生が相まって、宿主の栄養と代謝に有益化効果をもたらす。
【免疫増強栄養】
・アルギニン
・グルタミン
・n-3系
・核酸 など これらを配合したものを免疫増強経腸栄養剤(IED)
※重症ICU患者、敗血症などではアルギニンを含むIEDは炎症を惹起するため慎重投与である。


この記事が気に入ったらサポートをしてみませんか?
