「見てみよう!本物のiPS細胞」訪問記:健康未来EXPO 2019から学んだこと 外伝 未来医XPO'15から学んだこと その01
詳細は「SS01.「見てみよう!本物のiPS細胞」訪問記.zip」を参照してください。その圧縮フォルダ内には、同名のPDFファイルと関連写真が含まれます。
2019年04月05日、私は一般客として健康未来EXPO 2019(以下EXPO 2019)に参加し、ブース「未来にふれる再生医療研究室」を見学した([1])。その後、記事「「未来にふれる再生医療研究室」レポート:健康未来EXPO 2019から学んだこと その01」を執筆・公開した([2])。
その前日譚として、「見てみよう!本物のiPS細胞」訪問記を紹介する。
2015年03月30日、私は第29回 日本医学会総会 2015 関西 一般公開展示「あなたの暮らしと医の博覧会~未来医XPO'15」(以下未来医XPO'15)([3])を訪れた。その展示の1つであるサイエンスアイランド内で、「見てみよう!本物のiPS細胞」で、人工多能性幹細胞(induced pluripotent stem cell:iPSC,図01)やiPSC由来各種細胞、ならびに、モデル研究室が展示された。

図01.人工多能性幹細胞(induced pluripotent stem cell:iPSC)。
向かって右下のバーの長さは、100 μmである。
山中伸弥(以下敬称略)は胚性幹細胞(embryonic stem cell:ESC)の遺伝子に関心を持ち、奈良先端科学技術大学院大学助教授(現在の准教授)だった2000年頃から、新規多能性幹細胞の作製方法の研究に取り組んでいた。 数多くの遺伝子の中から、ESCで特徴的に働いている4つの遺伝子(Oct3/4、Sox2、Klf4、c-Myc)を見出し、レトロウイルス・ベクターを使って、これらの遺伝子をマウスの皮膚細胞(線維芽細胞)に導入し、数週間培養した。 すると、送り込まれた4つの遺伝子の働きにより、リプログラミングが起き、ESCに似た、様々な組織や臓器の細胞に分化することができる多能性幹細胞ができた。これが2006年に世界で初めて報告されたマウスiPSCである。
その後、山中らは、工夫を重ねて、同様に上記の4遺伝子をヒト皮膚細胞に導入してヒトiPSCの作製に成功したと2007年11月に発表した。
世界中の大勢の研究者が様々なiPS細胞の作製方法を開発している。具体的には、ジェームズ・トムソンらはOct3/4、Sox2、Nanog、および、Lin28の4つの遺伝子を使って、ヒトiPSCを作製に成功した。
また、レトロウイルス・ベクターの代わりに、レンチウイルスやアデノウイルスをベクターとして用いてiPSCを作製した研究者ら、および、遺伝子を用いず、化合物を用いて、iPSCを作製したという研究者らもいる([4])。
京都大学 iPS細胞研究所(CiRA)では、その後様々な作製法の研究を進めた結果、当初の作製法からより安全性の高い方法を確立することに成功している。具体的には、がん化の危険性を高めると考えられたc-Myc遺伝子をL-Myc遺伝子に変更する、 また、細胞が持つ本来のゲノム情報を傷つけ、がん化を引き起こすとされたウイルス・ベクターを用いずに、エピソーマル・プラスミドを使ってヒトiPSCを作製することにも成功している(4)。
線維芽細胞の代わりに、細胞傷害性T細胞(キラーT細胞)からiPSCを作製する方法もある([5])。
「見てみよう!本物のiPS細胞」では、センダイウイルス・ベクターを使って、ヒト皮膚線維芽細胞からiPSCを作製する工程が紹介された(図02,[6])。
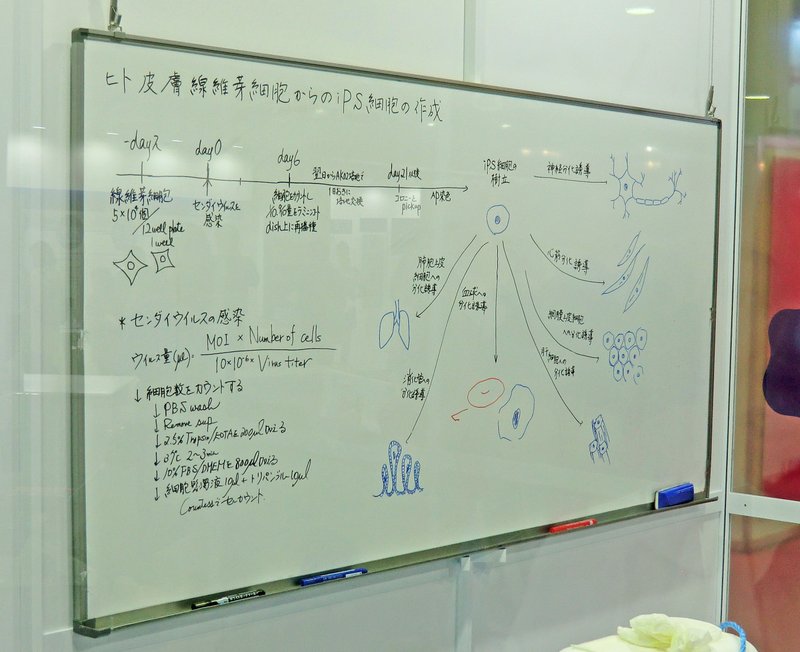
「作成」は誤字。
図02.ホワイトボード「ヒト線維芽細胞からのiPS細胞の作製」。
「作成」は誤字。
また、2010年、Cell Stem Cell誌で、RNAリプログラミング法で作製されたiPSCが報告された。RNAリプログラミングでは、導入因子をRNAとして細胞に導入し、細胞質に留まったRNAから各種の初期化因子が翻訳されて細胞が初期化される。さらに、RNAは細胞内で速やかに分解されるので、RNA-iPSCは導入因子の残存性を気にすることなく、染色体の安定性が高く、そして、クローン間差が小さい。RNA-iPSCは今後の再生医療利用および産業利用に最適なiPSCである。
RNAリプログラミング法は、2012年に発売を開始した第1世代の製品から、2015年には第2世代に、そして、2016年には第3世代の技術へと進歩してきている。
最新の第3世代RNAリプログラミング法では、RNAをドナー細胞に導入した際に引き起こされるインターフェロンの反応を抑えることで、iPSCの樹立効率を高めることに成功した。さらに、線維芽細胞や血液よりも格段に侵襲性が低い尿からの樹立プロトコールが確立された。尿からiPSCを樹立できるようになったことから、これまでは皮膚および血液の採取が難しかった患者や小児からiPSCを作製することが容易になった。
RNA-iPSCはテラトーマ形成およびin vitroでの分化誘導による三胚葉への分化能も確認できており、心筋細胞、肝細胞、および、神経細胞への分化実績も十分にある。特に、従来法で作成されたiPSCよりも網膜系の細胞への分化が良好であることが報告されている([7])。
iPSCは自己複製能と分化能を有することから、再生医療の手段として期待されている。日本では、眼疾患、パーキンソン病、脊髄損傷、糖尿病、血液疾患、心疾患などのiPSCを使用する再生医療の研究が進められている([8]のp.41-71)。
また、疾患の機序の解明や新薬に開発に、iPSCが期待されている。再生医療が有効とされる疾患は限られている。その一方、基礎研究や創薬分野では、これまで治療が困難とされたより多くの疾患で、iPSCの利用が可能とされている。日本では、筋萎縮性側索硬化症(Amyotrophic lateral sclerosis:ALS)、慢性乳児神経皮膚関節炎症候群(Chronic infantile neurological cutaneous and articular syndrome:CINCA症候群)、糖尿病、筋ジストロフィー、アルツハイマー病の疾患特異的iPSCが作製され、研究用に使用されている(8のp.85-106)。
再生医療は主に細胞を用いて行う移植治療技術である。
移植治療技術は自家移植と同種移植(他家移植)に分類される。
自家移植は自分の体の一部から取り出した細胞や組織を患部に移植することである。一方、同種移植(他家移植)は他人の体の一部から取り出した細胞や組織を患部に移植することである。
ヒトなどの動物の体に備わっている免疫機能は、自己(自分)と非自己(自分以外のもの)を区別することで、体外の様々な病原微生物などから体を守っている。
自家移植の場合、ある細胞が体内の他の部位に移植されても免疫機能は自己と判断し、拒絶反応はほとんど生じない。一方、同種移植(他家移植)の場合、免疫機能は移植される細胞を異物(非自己)と判断し、拒絶反応が生じる。
現在行われている臓器移植は通常同種移植で、血液型やヒト白血球抗原(Human Leucocyte Antigen: HLA)型などを合わせることで拒絶反応を生じにくくするようにしている。しかし、こうした臓器移植を受けた患者は生涯にわたって免疫抑制剤を服用することで、拒絶反応が生じないよう免疫機能を低下させる必要がある。
iPSCは患者自身の皮膚などの細胞から作成できるため、このiPSCから治療用細胞を作製できれば、自家移植による治療が可能である(当然拒絶反応はほとんど生じない)。
しかし、移植治療用iPSCを1株分作製するためには、多大な費用と時間を要する。患者由来iPSCを使用する自家移植は理論上実現可能だが、経済的観点を考慮すると、実際は多くの患者に適用可能な医療技術となるには困難が伴う。
一方、同種移植でもHLA型の一致度が高いと拒絶反応を抑制できる。そこで、HLAホモ接合体(稀に父母から受け継いだそれぞれのHLAの対立遺伝子が同じ型である事例)のiPSCを開発し、使用する細胞移植治療が考えられている。CiRAが発起し、京都大学iPS細胞財団が現在実施している再生医療用iPS細胞ストックプロジェクトは、再生医療に利用できるHLAホモ接合体のiPSC株を多数保有している(HLAホモドナー由来iPSCストック)。また、ゲノム編集技術を用いて拒絶反応のリスクを小さくしたiPSCも研究用として数株保有している(8のp.73-84,[9],[10],[11],[12])。
iPSC由来神経細胞(図03)とiPSCを用いた神経再生医療(図04)が展示された。

向かって右下のバーの長さは、200 μmである。
図03.iPSC由来神経細胞。
向かって右下のバーの長さは、200 μmである。

図04.iPS細胞を用いた神経再生医療。
iPSC技術を用いることで、細胞移植による神経再生と患者由来iPSCを用いた創薬において、医療の飛躍的発展が期待されている。そのためには、ヒトiPSCから効率よく神経細胞を誘導することが必要だが、現在では全ての細胞を神経系細胞に誘導可能である。
iPSCを用いた神経再生治療に関しては、パーキンソン病と脊髄損傷に対する神経再生治療を紹介する。
パーキンソン病に関しては、菊池隆幸医師(以下敬称略,京都大学医学部附属病院脳神経外科)らは「iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」における1人目の患者に対し、ヒト iPSC由来ドパミン神経前駆細胞を移植した。なお、この治験で使用されたiPSCは「再生医療用iPS細胞ストック」由来のものである([13])。
2020年には4人目の患者に対して、両側への細胞移植手術が実施された。結果として、合計4人の患者への細胞移植を完了したことになる。なお、この4人目から、CiRAで樹立したヒトiPSCを用いて大日本住友製薬株式会社で製造されたドパミン神経前駆細胞を移植している。また、細胞投与量を 3人目までの500万個から、1,000万個に増量している。現在のところ安全性に関する懸念は出ておらず、細胞移植後の経過を慎重に観察しながら進められている。
2021年中に3人の患者に対する手術を実施し、7人の患者への細胞移植が完了される予定である。
移植後、免疫抑制剤を1年間服薬してもらい、2年間の経過観察を行うことで、本細胞移植の安全性と有効性は評価される([14])。
脊髄損傷に関しては、岡野栄之教授(慶應義塾大学医学部生理学教室)らは、脊髄損傷マウスにヒトiPSC由来神経幹/前駆細胞を移植し、デザイナー・ドラッグによってのみ活性化されるデザイナー受容体(designer receptors exclusively activated by designer drugs:DREADDs)技術を用いて体外から移植した細胞を刺激して移植細胞の活動性を繰り返し亢進させることで、脊髄損傷マウスの運動機能を回復させることに成功した([15])。
神経疾患におけるiPSCを用いた創薬に関しては、筋萎縮性側索硬化症(Amyotrophic lateral sclerosis:ALS)とアルツハイマー病に対する創薬を紹介する。
ALSに関しては、2019年03月18日、井上治久教授(CiRA)らは「筋萎縮性側索硬化症(ALS)患者を対象としたボスチニブ第1相試験」を開始した([16])。
そして、井上、和泉唯信教授(徳島大学病院脳神経内科)、髙橋良輔教授(京都大学医学部附属病院脳神経内科)、永井真貴子診療准教授(北里大学病院脳神経内科)、および、渡辺保裕准教授(鳥取大学医学部附属病院脳神経内科)らの研究チームは、「筋萎縮性側索硬化症(ALS)患者さんを対象としたボスチニブ第1相試験」(iDReAM試験:iPSC-based Drug Repurposing for ALS Medicine study)を行い、ボスチニブにALS特有の有害事象は認めなかったこと、ボスチニブの投与期間に一部の患者でALSの進行の停止が見られたこと、そして、その目印となる可能性のある指標があったことを見出した([17])。
アルツハイマー病に関しては、2020年06月04日、井上(CiRA兼京都大学医学部附属病院流動プロジェクトプロジェクトリーダー)、冨本秀和教授(三重大学医学部附属病院)、および、坂野晴彦准教授(京都大学医学部附属病院)らは、「プレセニリン1遺伝子変異アルツハイマー病に対するTW-012R(ブロモクリプチン)の安全性と有効性を検討する二重盲検比較試験及び非盲検継続投与試験」開始を発表した。ブロモクリプチンはパーキンソン症候群などの治療薬として既に使用されているが、アルツハイマー病病因物質であるアミロイドベータを低減させる働きが、特にプレセニリン1遺伝子変異を有する家族性アルツハイマー病患者由来iPSCモデルで認められている([18])。
iPSC由来視細胞(図05)とiPSC由来視細胞による網膜色素変性症の再生治療(図06)が展示された。

図05.iPSC由来視細胞。
向かって右下のバーの長さは、100 μmである。

図06.iPS細胞由来の視細胞による網膜色素変性の再生治療。
網膜色素変性症は、様々な遺伝子変異が引き起こす視細胞の変性疾患である。その症状は徐々に進行する視野狭窄や夜盲で、進行すると著しい視力低下を引き起こす。ESC/iPSCから分化した視細胞を移植することで、暗い場所でも光が分かるようになる、失われた視野がある程度回復する、および/または、疾患の進行を抑えるなどの効果が目標とされている。また、より効果的な移植治療を目的とするより高度な、または、安定した分化培養技術の開発が目指されている。
実際、2021年03月11日、神戸市立神戸アイセンター病院は「網膜色素上皮(Retinal Pigment Epithelium:RPE)不全症に対する同種 iPSC由来 RPE 細胞懸濁液移植に関する臨床研究」における1例目の移植手術の実施を発表した([19])。
iPSC由来RPE細胞(図07)とiPSC由来RPE細胞移植による加齢黄斑変性症治療の開発(図08)が展示された。

図07.iPSC由来RPE細胞。
向かって右下のバーの長さは、50 μmである。

図08.iPS細胞由来網膜色素上皮細胞移植による加齢黄斑変性治療の開発。
加齢黄斑変性症などの網膜疾患は失明に至る疾患であるにもかかわらず、根治的な治療法が存在しない。
そこで、滲出型加齢黄斑変性症患者を対象に、患者本人由来iPSCから作製されたRPEシートを網膜の下に移植することで、視機能を維持・改善する新規治療法が開発された。
実際、髙橋政代(理化学研究所 多細胞システム形成研究センター 網膜再生医療研究開発プロジェクト)らは、先端医療財団先端医療センター病院、神戸市医療センター中央市民病院、京都大学CiRAらと共同で、2013年08月より自家iPSCを用いた加齢黄斑変性の臨床研究を開始し、2014年09月に1人目の患者への移植手術を実施した。具体的には、皮膚由来細胞からiPSCを樹立後、iPSCからRPE細胞を分化誘導する。そして、RPE細胞から作製されたRPEシート(1.3×3 mm)をその患者の網膜下腔(新生血管を抜去済)に移植した。
2017年03月17日時点、このシートは移植部位に留まっており、細胞の異常増殖や免疫拒絶といった有害事象は起こっていない([20])。
また、2017年3~9月にかけて、滲出型加齢黄斑変性に対する他家iPSC由来RPE細胞懸濁液移植の安全性を確認する臨床研究5例が実施され、移植後1年の経過観察が全て終了した。全例で、他家iPSC由来RPE細胞に対する免疫反応は、局所ステロイド投与のみで抑制可能であった。そして、HLA適合済他家iPSC由来RPE細胞の移植後1年での安全性が確認された([21])。
一方、2019年08月29日、西田幸二教授(大阪大学大学院医学系研究科,眼科学)らは、ヒトiPSCから作製された角膜上皮細胞シートを角膜上皮幹細胞疲弊症の患者1名に移植したことを発表した。なお、そのヒトiPSCは京都大学CiRAより提供されたもの(言い換えれば、ドナー由来の細胞)である([22])。
ヒトiPSCからの硝子軟骨の作製が展示された(図09)。

図09.ヒトiPS細胞から硝子軟骨の作製 ~関節軟骨損傷の再生治療法開発へ向けて~。
ヒトiPSCから軟骨細胞への新たな分化方法が確立され、その軟骨細胞から純粋な硝子軟骨が試験管内で生じることが明らかになった。また、腫瘍を形成せずに、関節軟骨の欠損の補充が成功した。これは、iPSCを用いた関節軟骨損傷の治療法開発へ向けた研究の重要な一歩である。
実際、宝田剛志教授(岡山大学学術研究院医歯薬学域(医学系))らは、ヒトiPSCから肢芽間葉系細胞を誘導・拡大培養する技術を開発し、肢芽間葉系細胞の軟骨細胞分化能を事前に評価するための表面抗原の同定に成功した。この開発した技術を利用することで、四肢骨格形成異常をきたす2型コラーゲン異常症患者由来 iPSCより肢芽間葉系細胞を誘導し、培養皿上で患者疾患病態を再現させ、疾患モデリング/創薬スクリーニング方法の開発にも成功した。
さらに、iPSC由来肢芽間葉系細胞と細胞自己凝集化誘導技術を組み合わせることで、均一な大きさを有する硝子軟骨組織塊の大量作製法を開発し、同組織塊が膝関節軟骨の再生能を有していることを示した。
以上の成果から、ヒトiPSC由来の肢芽間葉系細胞を用いることで、ヒト四肢の骨格形成メカニズムの解明や各種骨格系疾患の病態解明が進むだけでなく、軟骨再生医療や骨格系統疾患患者由来 iPSCを用いた創薬応用の進展が期待される([23])。
その一方で、軟骨無形成症およびタナトフォリック骨異形成症患者由来iPSC(疾患特異的iPSC)を樹立し、軟骨細胞に分化誘導したところ、細胞増殖が低下し、疾患の特徴を反映した異常な軟骨形成が認められた。
しかし、スタチンを投与することで、疾患特異的iPSCから分化誘導した軟骨細胞の細胞増殖と軟骨形成が回復した。また、スタチンは軟骨無形成症モデルマウスにおいて骨を伸長させた。その結果、疾患特異的iPSCモデルと疾患マウスモデルの結果を併せて、高コレステロール血症治療薬であるスタチンが本疾患に有効である可能性が示された([24])。
iPSC由来心筋細胞(図10)とiPSCからの心筋細胞の分化誘導と再生治療応用(図11)が展示された。
図10.iPSC由来心筋細胞。
向かって右下のバーの長さは不明瞭ゆえ、わからなかった。

図11.iPS細胞からの心筋細胞の分化誘導と再生治療応用。
心筋細胞は、心臓の筋肉の細胞である。心臓は手足の筋肉と異なり、意識して動かさなくても勝手に動いて血液を送っている。心筋細胞もこの勝手に動く性質(自動能)を有する。成人の心臓では心筋細胞は増殖する力がなくなっている。iPSCから作製された心筋細胞を使って、様々な心臓病で失われた心筋細胞を補うことで、これまでは不可能だった心臓再生治療が可能にできないかと期待されている。
澤芳樹教授(大阪大学大学院医学系研究科(心臓血管外科))らは、iPSCからヒトに移植可能な安全性の高い心筋細胞を大量に作製し、シート化することに成功した。そして、iPSCから作製した心筋細胞シートに関して、重症心筋症患者を対象としてヒトへの移植に関する安全性と有効性を検証する医師主導治験を実施し、第1例目の被験者に移植を完了した。心筋細胞シート移植治療は、深刻なドナー不足にある重症心不全に対する新たな治療法として期待されている([25])。
2021年06月21日18時(日本時間)に英国科学誌「Nature Communications」でオンライン公開された研究成果によると、三木健嗣(現ハーバード大学兼マサチューセッツ総合病院リサーチフェロー、元CiRA増殖分化機構研究部門特定助教兼T-CiRAプログラム研究員)らは、約9,000種類の化合物から、エストロゲン関連受容体(estrogen-related receptor:ERR)γ作動薬がヒトiPSC由来心筋細胞の成熟を促進することを発見し、ERRγ作動薬を用いると、T管構造を有する心筋細胞にまで成熟させることを見出した。
本研究成果は、成熟度の低さが課題であったヒトiPSC由来心筋細胞に短期間に、単一の化合物を添加することで、新生児心筋細胞に相当するレベルにまで成熟度が亢進したことを示すもので、今後、疾患の発症メカニズム解明や新規治療戦略の確立が加速することが期待できる([26])。
福田恵一教授(慶應義塾大学医学部内科学(循環器)教室)らが計画中の「難治性重症心不全患者を対象とした同種iPS細胞由来再生心筋球移植の安全性試験」の臨床研究に関して、同研究の内容を定めた第1種再生医療等提供計画が、慶應義塾特定認定再生医療等委員会により、再生医療等の安全性の確保等に関する法律(平成25年法律第85号)および同法施行規則(厚生労働省令第110号)の規定する再生医療等提供基準に適合している旨の判定を2020年02月05日付で受けた([27])。
「見てみよう!本物のiPS細胞」には紹介されていなかったが、iPSCを使用する他の研究には、直径6 mmのレンコン状構造のハイドロゲルにヒトiPSC由来膵島をカプセル化した移植片の糖尿病モデルマウスへの移植([28])、ヒトiPSC由来HLAホモ型血小板(MEG-002)治験計画([29])、iPSCにゲノム編集を施すことによる移植先の免疫細胞に攻撃されないT細胞の作製([30])、および、TMPRSS2(Ⅱ型膜貫通型セリンプロテアーゼの一種)阻害剤+カテプシンB阻害剤の組合せによる重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2、新型コロナウイルス)感染効率の低下([31])などがある。
私は「見てみよう!本物のiPS細胞」を訪れることで、iPSCに関する知識をさらに学ぶことができた。それは非常に有意義であった。
しかし、未来医XPO'15、特に、サイエンスアイランド内の「見てみよう!本物のiPS細胞」を訪れることができなかった人は多数存在する。これらの人にiPSCとは何かを知ってもらうために、私はこの訪問記を執筆した。
この訪問記から、iPSC、ならびに、それがもたらす再生医療と創薬に関心を持って下されば有難いと、私は強く望んでいる。
参考文献
[1] 日本コンベンションサービス(JCS)株式会社.“4年に一度開催される「健康未来EXPO 2019」は、大盛況の中でフィナーレを迎えました”.JCS トップページ.ニュース.イベント&講演.2019年05月16日.https://www.convention.co.jp/news/detail/contents_type=15&id=541,(参照2021年10月31日).
[2] たけっち.“「未来にふれる再生医療研究室」レポート:健康未来EXPO 2019から学んだこと その01”.たけっち ホームページ.健康未来EXPO 2019から学んだこと.2019年05月13日.https://note.com/take_judge/n/n31375af0074b?magazine_key=mc0ba625fcc29,(参照2021年10月31日).
[3] 国立大学法人 神戸大学.“未来医XPO'15(第29回日本医学会総会2015関西一般公開展示)”.神戸大学 ホームページ.お知らせ.イベント情報.過去のイベント情報[2014年度].2015年03月28日 - 04月05日.https://www.kobe-u.ac.jp/archive/event/2014/20150328_1.html,(参照2021年10月31日).
[4] 国立大学法人 京都大学 iPS細胞研究所(CiRA).“iPS細胞とは?”.京都大学 iPS細胞研究所 ホームページ.もっと知るiPS細胞.よくある質問.https://www.cira.kyoto-u.ac.jp/j/faq/faq_ips.html,(参照2021年10月12日).
[5] 国立研究開発法人 理化学研究所.“がん細胞を殺すT細胞をiPS細胞化し若く元気なT細胞に再生 -がんの免疫療法を革新する可能性-”.理化学研究所 ホームページ.研究成果(プレスリリース).研究成果(プレスリリース)2013.2013年01月04日.https://www.riken.jp/press/2013/20130104_1/,(参照2021年11月12日).
[6] ナカライテスク株式会社.“iPS細胞作製用センダイウイルスベクターキット CytoTuneEX™-iPS”.ナカライテスク トップページ.製品情報.再生医療・幹細胞研究.iPS 細胞作製キット CytoTuneEX™-iPS.https://www.nacalai.co.jp/products/entry/pdf/EX_v1.1_clean_PDF.pdf,(参照2021年11月21日).
[7] 株式会社 リプロセル.“iPS細胞樹立サービス”.リプロセル ホームページ.https://reprocell.co.jp/reprogramming-service,(参照2021年11月23日).
[8] 山中伸弥 監修,京都大学CiRA 編集.iPS細胞の世界:未来を拓く最先端生命科学.第1版第3刷,株式会社 日刊工業新聞社,2013年11月15日,208 p.(B&Tブックス).
[9] 国立大学法人 京都大学 CiRA.“再生医療用iPS細胞ストックプロジェクト”.京都大学 CiRA ホームページ.研究活動.https://www.cira.kyoto-u.ac.jp/j/research/stock.html,(参照2021年11月23日).
[10] 公益財団法人 京都大学iPS細胞研究財団.“iPS細胞ストックプロジェクト”.京都大学iPS細胞研究財団 ホームページ.研究者・企業の方.https://www.cira-foundation.or.jp/j/research-institution/ips-stock-project/,(参照2021年11月23日).
[11] 公益財団法人 京都大学iPS細胞研究財団.“iPS細胞ストックの細胞(HLAホモドナー)”.京都大学iPS細胞研究財団 ホームページ.研究者・企業の方.iPS細胞ストックプロジェクト.https://www.cira-foundation.or.jp/j/research-institution/ips-stock-project/homozygous.html,(参照2021年11月23日).
[12] 公益財団法人 京都大学iPS細胞研究財団.“iPS細胞ストックの細胞(ゲノム編集)”.京都大学iPS細胞研究財団 ホームページ.研究者・企業の方.iPS細胞ストックプロジェクト.https://www.cira-foundation.or.jp/j/research-institution/ips-stock-project/genome-edited.html,(参照2021年11月23日).
[13] 国立大学法人 京都大学 CiRA.“「iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」における第一症例目の移植実施について”.CiRA ホームページ.ニュース・イベント.ニュース.2018年.研究活動.2018年11月09日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/181109-120000.html,(参照2021年12月01日).
[14] 国立大学法人 京都大学大学院医学研究科 脳病態生理学講座 臨床神経学(脳神経内科).“「iPS 細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験」の進捗について(経過報告)”.京都大学大学院医学研究科 脳病態生理学講座 臨床神経学(脳神経内科) ホームページ.iPS細胞由来ドパミン神経前駆細胞を用いたパーキンソン病治療に関する医師主導治験について.2021年01月29日.https://neurology.kuhp.kyoto-u.ac.jp/ips-pd/ips_pd06_20210129.pdf,(参照2021年12月01日).
[15] 学校法人 慶應義塾.“移植したヒトiPS由来細胞を刺激することにより、脊髄損傷の治療効果改善に成功-人工受容体技術を活用した選択的な細胞刺激によるシナプス活動性亢進-”.慶應義塾 ホームページ.プレスリリース一覧.プレスリリース.2021年11月24日.https://www.keio.ac.jp/ja/press-releases/2021/11/24/28-88393/,(参照2021年12月01日).
[16] 国立大学法人 京都大学 CiRA.“筋萎縮性側索硬化症(ALS)患者を対象とした治験開始について”.CiRA ホームページ.ニュース・イベント.ニュース.2019年.研究活動.2019年03月26日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/190326-140000.html,(参照2021年12月01日).
[17] 国立大学法人 京都大学 CiRA.“筋萎縮性側索硬化症(ALS)患者さんを対象とした ボスチニブ第1相試験のご報告 ~ALS進行停止を目指すiDReAM Study~”.CiRA ホームページ.ニュース・イベント.ニュース.2021年.研究活動.2021年10月01日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/211001-000000.html,(参照2021年12月01日).
[18] 国立大学法人 京都大学 CiRA.“家族性アルツハイマー病を対象とした治験開始について”.CiRA ホームページ.ニュース・イベント.ニュース.2020年.研究活動.2020年06月04日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/200604-120000.html,(参照2021年12月01日).
[19] 地方独立行政法人 神戸市民病院機構 神戸市立神戸アイセンター病院.“「網膜色素上皮(RPE)不全症に対する同種 iPS 細胞由来 RPE 細胞懸濁液移植に関する臨床研究」の1例目の移植手術の実施について”.神戸市立神戸アイセンター病院 トップページ.お知らせ.患者さんへ.2021年03月11日.http://kobe.eye.center.kcho.jp/files/20210311/9e45f7049e8fede5b5da9b2966d206b69b1a85de.pdf,(参照2021年12月01日).
[20] 国立研究開発法人 理化学研究所 生命機能科学研究センター.“自家iPS細胞由来網膜細胞を用いた加齢黄斑変性の臨床研究”.理化学研究所 多細胞システム形成研究センター(理研CDB) ホームページ.ニュース一覧.2017.研究成果.2017年03月17日.http://www.cdb.riken.jp/news/2017/researches/0317_13027.html,(参照2021年12月01日).
[21] 国立研究開発法人 理化学研究所.“「滲出型加齢黄斑変性に対する他家iPS細胞由来網膜色素上皮細胞懸濁液移植に関する臨床研究」の移植後1年の経過観察終了の報告について”.理化学研究所 ホームページ.広報活動.トピックス2019.2019年04月18日.http://www.riken.jp/pr/topics/2019/20190418_1/,(参照2021年12月01日).
[22] 国立大学法人 大阪大学大学院医学系研究科・医学部.“世界初、iPS細胞から作製した角膜上皮細胞シートの第1例目の移植を実施”.大阪大学大学院医学系研究科・医学部 トップページ.NEWS & TOPICS.2019年08月29日.https://www.med.osaka-u.ac.jp/archives/19156,(参照2021年12月01日).
[23] 国立大学法人 岡山大学.“ヒト多能性幹細胞から手足の元である肢芽間葉系細胞の誘導・拡大培養に成功―軟骨再生医療やiPS細胞を用いた創薬研究への応用に期待―”.岡山大学 ホームページ.NEWS & RELEASE.プレスリリース.2021年08月10日.https://www.okayama-u.ac.jp/tp/release/release_id866.html,(参照2021年12月01日).
[24] 国立大学法人 京都大学 CiRA.“スタチンが軟骨無形成症の病態を回復 ~疾患特異的iPS細胞モデルによるドラッグ・リポジショニングの可能性~”.CiRA ホームページ.ニュース・イベント.ニュース.2014年.研究活動.2014年09月18日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/140918-084300.html,(参照2021年12月01日).
[25] 国立大学法人 大阪大学.“iPS細胞から作製した心筋細胞シートの医師主導治験の実施 重症心筋症の治療に向けて”.Research at Osaka University:ResOU ホームページ.生命科学・医学系.2020年01月27日.https://resou.osaka-u.ac.jp/ja/research/2020/20200127_1,(参照2021年12月01日).
[26] 国立大学法人 京都大学 CiRA.“ヒトのiPS細胞から新生児レベルまで成熟した心筋細胞を作製する”.CiRA ホームページ.ニュース・イベント.ニュース.2021年.研究活動.2021年06月21日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/210621-180000.html,(参照2021年12月01日).
[27] 学校法人 慶應義塾.“「難治性重症心不全患者を対象とした同種iPS細胞由来再生心筋球移植の安全性試験」の臨床研究について”.慶應義塾 ホームページ.プレスリリース一覧.プレスリリース.2020年02月06日.https://www.keio.ac.jp/ja/press-releases/2020/2/6/28-67426/,(参照2021年12月01日).
[28] 国立大学法人 東京大学 生産技術研究所.“【記者発表】レンコン構造が細胞治療の鍵!? ~ヒトiPS細胞由来膵島移植による糖尿病マウスの血糖値正常化と移植片の回収に成功~”.東京大学 生産技術研究所 ホームページ.ニュース.プレスリリース.2021年04月02日.https://www.iis.u-tokyo.ac.jp/ja/news/3520/,(参照2021年12月01日).
[29] 株式会社 メガカリオン.“ヒトiPS細胞由来HLAホモ型血小板(MEG-002)治験計画届30日調査終了のお知らせ”.メガカリオン ホームページ.Data Room.リリース.2021年04月26日.http://www.megakaryon.com/dataroom/pdf/mega_release_20210426_jp.pdf,(参照2021年12月01日).
[30] 国立大学法人 京都大学 CiRA.“iPS細胞×ゲノム編集 がん免疫療法のための"ステルスファイターT細胞"を作製する”.CiRA ホームページ.ニュース・イベント.ニュース.2021年.研究活動.2021年05月18日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/210518-000000.html,(参照2021年12月01日).
[31] 国立大学法人 京都大学 CiRA.“TMPRSS2とカテプシンBを標的とした新型コロナウイルスの感染阻害”.CiRA ホームページ.ニュース・イベント.ニュース.2021年.研究活動.2021年10月21日.https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/211021-000000.html,(参照2021年12月01日).
この記事が気に入ったらサポートをしてみませんか?
