やっぱり温度って不思議
なんか考え始めると、その思考の周辺で思いつく色々な事も気になって、いつのまにかフォーカスがシフトしてしまい、間にいろいろ違う話題がはさまりがちになっています。私の悪い癖ですね。
しかし、改めてアウトプットというのは、それだけで学びの切っ掛けになりますね。この note は、過去に私が得た気付きをまとめる為に始めたつもりなんですが、数年経ってまとめ直すと、今の視点で新たな気付きがまた出てくるんです。
●アウトプットを意識したインプットが大事
またまた余計な話ですが、最近、
知識のインプットばかりでなくアウトプットが大事
という話を聞いたりするんですが、まずはやはりインプットが無いと、そもそもアウトプットが出来ません。しかし、重要なのは、
インプットの仕方
なんです。さらに、質と量の問題もありますが、
量を「こなし」ながら質を高める
が正解です。ただ大量にインプットするのに、「こなす」も何もないと思うかも知れませんが、
アウトプットを意識しながらインプットする
という事をやっていると、インプットもかなり集中力が必要です。
そして、よく
「メモが大事」
という話も最近言われていますが、要するに、「メモを取る」という行為は、
インプットした知識の即席アウトプット
なんです。だから、メモの本質は
アウトプットを意識してインプットする事
であって、「殴り書き」でも「板書写し」でもないんですね。
逆に、頭の中でアウトプットのための整理が出来ていれば、「書く」という行為自体必須ではないんです。ただ、そんなことをできる人は、よほど頭の回転が速い人なのでしょうけど。
のっけからいきなり盛大に話が逸れてしまいましたが、「ジュールトムソン効果」の話の続きです。
「ジュールの実験(断熱自由膨張)」と「ジュール・トムソンの実験(断熱搾り膨張)」を紹介しました。そしてこの実験では、
気体の膨張に伴い、気体の仕事に関係なく温度が低下する場合がある
ということでした。そのメカニズムを、分子論から考察してみたいと思います。
●内部エネルギの中身
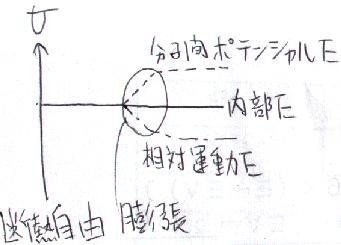
内部エネルギーの「中身」を分子論的に見ると、
(内部エネルギー)=(分子間の相対的な運動エネルギ)+(分子間距離によるポテンシャルエネルギ)
という事になります。「温度」に関係するのは、このうち「運動エネルギ」の方であると言う話がいわゆる「分子運動論」です。
一方、体積膨張に関しては、「ポテンシャルエネルギ」が関係してきます。
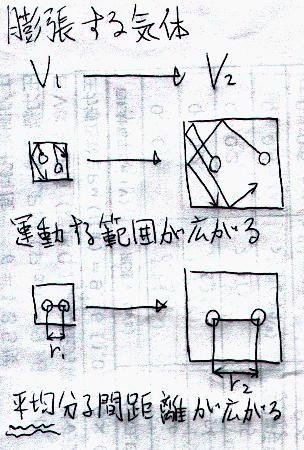
「膨張」と一口に言っても、「気体」は「固体」のように
ただ寸法が大きくなる
という感じではありません。気体では分子がもともと激しく運動をしているので、その
運動の範囲が広がる
つまり、
分子間の「平均距離」が広がる
と考えるということになります(下図)。
分子間距離が広がるということは、「分子間のポテンシャルエネルギ」が増加するということです。つまり、ジュールの「断熱自由膨張」の実験では、
外部に仕事をしていなくても「分子間引力」に対して仕事をして
いて、
その分「相対的運動エネルギ」が減少している
わけです(下図)。
よって、
分子間力の働く「実在気体」
では、
相対運動のエネルギが形として表れている温度が下がる
のです。この現象は、
分子間力の働かない「理想気体」
では説明が出来ません。
●ジュールトムソンの実験と温度の正体
また「ジュール・トムソンの実験」では、
(エンタルピの変化)-(分子間ポテンシャルの増加)<0
となるとき、温度が低下する
ということが言えます。
何故、温度が低いとこれが負になるのかというと、
温度が低い時は内部エネルギーが小さい
ので、分子間のポテンシャルエネルギが小さく、
膨張した時の「ポテンシャルエネルギの増加」が大きい
からです。
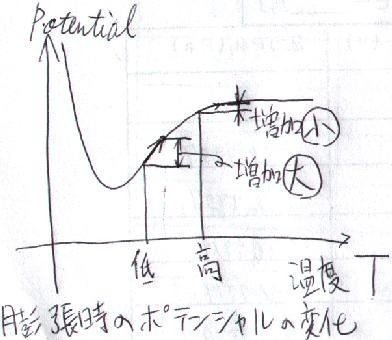
分子間力によるポテンシャルが、何故こういう曲線になるのかは、「分子間力」のイメージについてまた記事を書きたいと思います。
温度が「上がる」場合の話ですが、この実験を厳密に説明するには、「実在気体の状態方程式を理解する必要があります。「逆転温度」に対しては当然「逆転圧力」という見方も存在するわけで、「P-T曲線」上に現れる「逆転曲線」で表わされます。
ただ、完全にイメージだけで言うと、
気体の温度と圧力が高い
場合、
温度が高いのでもともと分子は激しく運動をしたい
のですが、高い圧力で一定の体積に圧縮されているため
広い範囲で運動できずに押し込められている
という事になります。そして、
体積が増えると、熱運動できる範囲が広がって、運動が激しくなる
という感じです。
ところで、気体分子運動論をかじっただけだと、
「圧力」も「温度」もどちらも「分子の運動」によるもの
という感じがするので、膨張して圧力が下がるのに、温度が上がるのは不思議な感じがするのですが、この
ジュール・トムソン膨張で温度が上がる
という現象は、
温度と圧力が本質的に異なるもの
という事を示していると言えます。
確かに温度というか、熱の伝わり方は「接触(熱伝導)」だけでなく、「電磁波(熱輻射)」もあります。
つまり、圧力は微視的には
分子の運動の力学的現象
であるのに対して、温度は
電子の運動も関係する電磁気学的現象
でもあるわけです。
改めて、温度というものは不思議なものだと感じます。
●ジュールの直観と先見性
ここで、分子間力の働かない理想気体について考えます。分子間力が働かなければ、当然
自由膨張しても温度が変化しない
ので、内部エネルギを
U = U(V, T)
と考えると、ジュール・トムソン過程は「断熱過程」であり、
U(V1, T) = U(V2, T)
であるので、
(∂U/∂V)t = 0
つまり、等温下での体積変化では、「内部エネルギー変化」は無い事が言えます。これを「理想気体のジュールの法則」と言ったりします。
十分「希薄」な気体は分子間力も弱く、理想気体とみなせる
ので、
希薄な気体でジュールの実験を行えば、温度変化は無い
わけです。またジュールの法則より、
理想気体の内部エネルギーは、「体積」には依存しない
ことが言えます。
ここで疑問なのは、
「断熱過程で仕事をしないなら、内部エネルギーの変化が"0"であることは直観的にもわかりそうなのに、ジュールの一連の実験では何を明らかにしようとしたのか?」
ということです。前にも書いた通り、
「熱の仕事当量の実験」でもジュールは、水の粒子間の摩擦を予想していたかのような実験を行いました。この頃はまだ、
「気体の分子論」は認められていなかった時代
であり、内部エネルギは、「温度変化」によってしかその表象を捕らえることが出来なかったわけです。
このジュールの実験も、まるで
ファン=デル=ワールスの唱えた「分子間力」を先駆けて予想していた
かのような実験に思えます。
ジュールは父親の造り酒屋を継ぎ、大学には所属せず、生涯、学者にはなりませんでした。しかし学者にはない鋭い洞察力で、熱学の理論を先駆ける素晴らしい実験を沢山行ったのです。
また、ジュールはとても好奇心旺盛で、新婚旅行の時に滝を見て、
「滝では水が落下するので、滝の上よりも下の滝壺のほうが温度は高くなるであろう。」
と考えて、なんと持っていた温度計で測定を始めたというエピソードが残っています。しかし、性格はとても控えめで、亡くなる前に、
「私はちょっとしたことを二つ三つやったけれど、どれも大したことではない。」
という言葉を残したそうです。
私も、ジュールのような学びの心を忘れない技術者でありたいと、改めて思わされました。
この記事が気に入ったらサポートをしてみませんか?
