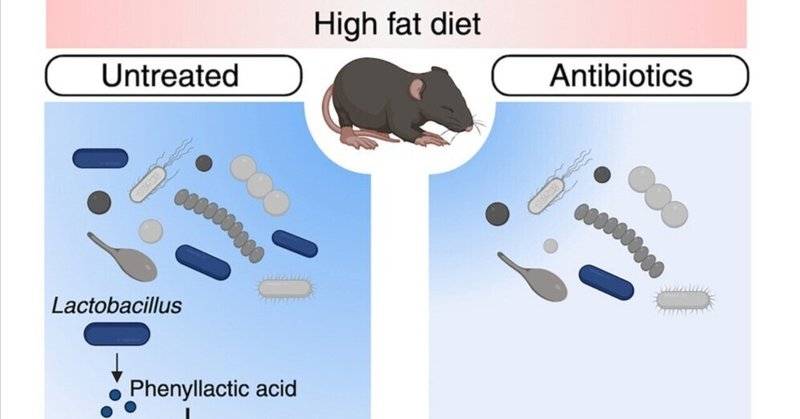
腸内脂質代謝を制御することで肥満を予防する初期微生物叢の代謝産物
細胞宿主と微生物
オンラインで入手可能 2023年10月3日
In Press, Corrected Proofこれは何ですか?
論文
腸内脂質代謝を制御することで肥満を予防する初期微生物叢の代謝産物
https://www.sciencedirect.com/science/article/pii/S1931312823003694

著者リンクはオーバーレイパネルを開くCatherine D. Shelton 1, Elizabeth Sing 1, Jessica Mo 1, Nicolas G. Shealy 1, Woongjae Yoo 1 2, Julia Thomas 1, Gillian N. Fitz 3, Pollyana R. Castro 1 4, Tara T. Hickman 5, Teresa P. Torres 1, Nora J. フォージング 1、ジェイコブ・K・ジーバ 1、M・ウェイド・カルカット 6、シモーナ・G・コドレアヌ 7、ステイシー・D・シェロッド 7、ジョン・A・マクリーン 7、スン・H・ペック 5 8 9 10、ファン・ヤン 3 11、ニコラス・O・マーカム 9 10 12 13、ミン・リウ 14...マリアナ・X・ビンドロス 1 13 15 16 17 18
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.chom.2023.09.002
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
幼少期の抗生物質と高脂血症食への曝露が肥満を悪化させる
小腸乳酸菌の喪失は脂肪率の増加をもたらす
抗生物質と高脂血症食は腸内PPAR-γの枯渇を介して脂肪率を悪化させる。
乳酸菌由来のフェニル乳酸は抗生物質誘発性肥満を予防する
まとめ
幼少期の微生物叢が小児肥満を促進する環境因子から保護する機序は、ほとんど解明されていない。我々は、幼若マウスを抗生物質と高脂肪(HF)食に同時に曝露するマウスモデルを用いて、小腸(SI)微生物叢の主要メンバーである乳酸桿菌種が、幼若期の食事誘発性肥満を抑制するために腸上皮細胞(IEC)を制御することを示した。乳酸菌由来の代謝産物であるフェニル乳酸(PLA)は、SI IECsにおけるペルオキシソーム増殖剤活性化受容体γ(PPAR-γ)の存在量を増加させることにより、抗生物質や高脂肪食に幼少期に暴露されることによる代謝機能障害から保護する。したがって、PLAは微生物叢由来の代謝産物であり、小腸上皮の保護経路を活性化し、腸の脂質代謝を調節し、抗生物質に関連した幼少期の肥満を予防する。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(164KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
脳線維芽細胞くも膜関門レプトメニングシングル細胞RNAシーケンシング三細胞接合部肥満微生物叢乳酸菌代謝腸管上皮抗生物質初期生活
はじめに
1,2成人の微生物叢とは対照的に、乳児の微生物叢は細菌の存在量と多様性が低いという特徴がある3,4,5。このような発達段階において、早期腸内細菌叢は、肥満の原因となる高脂肪(HF)食や抗生物質投与などの環境因子による擾乱に対して特異的に敏感である6,7。例えば、幼少期の抗生物質への曝露は、小児の体重増加および肥満度(BMI)の上昇と相関している8,9。マウスモデルを用いたこれまでの研究は、ヒトの研究を裏付けるものであり、幼少期の抗生物質曝露による腸内細菌叢組成の変化と脂肪率の上昇との間に因果関係があることを立証している10,11。しかし、小児肥満の状況において腸内細菌叢が保護作用を発揮するメカニズムはほとんど不明である。
幼少期の抗生物質使用と肥満リスクとの関連で、あまり認識されていない点は、食習慣が微生物叢に与える影響である。食事は微生物叢組成の重要な決定要因である。例えば、肥満の原因となる欧米式の高脂血症食は微生物叢を乱し、代謝性疾患のリスクを上昇させる12,13。米国では、小児は飽和脂肪酸14の摂取量が多く、治療用抗生物質の使用割合が高い15。従って、幼少期の抗生物質投与がどのように脂肪率を増加させるかを完全に理解するには、腸内細菌叢と宿主の代謝に対する食事と抗生物質の複合効果を調べる必要がある。
腸内細菌叢と食事はともに腸上皮の機能を調節している。具体的には、SI上皮は脂肪を代謝する能力を高め、宿主を代謝機能不全の特徴から守っている16,17,18。同時に、SI微生物叢は腸内脂質の吸収、代謝、分泌の重要な調節因子として機能するため、HF食に暴露されるとSIの微生物叢が変化し、SIの機能に影響を与える19,20,21。さらに、最近の研究では、SI微生物叢の特定のメンバーは、高脂血症食の摂取中に脂質の分泌を抑制し、それによって血清トリグリセリドを制限できることが明らかにされている22,23。したがって、早生期の抗生物質は、高脂血症食によって引き起こされる代謝機能障害から保護する微生物-上皮相互作用に障害を与えることによって肥満を促進する可能性がある。
本原稿では、幼若期の微生物叢の乱れがHF食誘発性肥満をどのように促進するかを調べた。我々は、幼若マウスを抗生物質と高脂血症食に同時に暴露し、抗生物質投与が高脂血症食摂取中の脂肪率と代謝機能障害をより大きくすることを明らかにした。抗生物質と高脂血症食への同時曝露により、SI微生物叢から乳酸桿菌種が枯渇し、コロニー形成したグノトビオティックでの実験により、乳酸桿菌種の喪失が本モデルにおける過剰脂肪蓄積の原動力であることが同定された。抗生物質と高脂血症食を与えたマウスの腸管上皮の性状を調べたところ、脂質代謝に関連する遺伝子の調節異常が明らかになり、SI上皮と血清中のトリグリセリドの増加につながった。我々は、腸内脂質代謝の破綻が、SI上皮における脂質代謝調節因子であるペルオキシソーム増殖因子活性化受容体γ(PPAR-γ)の枯渇を介して、脂肪率の上昇につながることを提唱する。標的を絞らないメタボロミクスにより、抗生物質と高脂血症食は、SI内腔における乳酸菌由来の代謝産物であるフェニル乳酸(PLA)の存在量を減少させることが明らかになった。我々は、PLAが腸内PPAR-γをアップレギュレートし、抗生物質と高脂血症食への早期の曝露によって引き起こされる代謝機能障害から保護することを示した。したがって、PLAは微生物叢由来の代謝産物であり、SI上皮における保護経路を活性化し、幼少期の肥満を予防する。
研究結果
幼少期における抗生物質と高脂血症食の同時暴露は、長期にわたる代謝機能障害を促進する。
幼少期に有害な環境因子(例:肥満の原因となるHF食と抗生物質)に同時に暴露されると、代謝機能障害が長期化するかどうかを検討する、 まず、3週齢の若齢マウスを、低用量ペニシリン(LDP)投与(6.67mg/L)または非投与で、低脂肪(LF)食(10%)または高脂肪(60%)食に曝露するモデルマウスを作製した(図1A)10。5週間後、HF食とLDPに曝露したマウスは、餌の消費量は同等であったにもかかわらず、HF食のみを与えたマウスよりも体重(図1B)と腹部脂肪(図1C)が有意に増加した(図S1A)。さらに、体重増加(図1B)および腹部脂肪(図1C)には、LF食を与えたマウスとLF食とLDPを与えたマウスとの間に差は観察されず、このことは、我々のモデルにおいて、抗生物質への曝露だけでは脂肪増加を促進するには不十分であることを示している。HF食とLDPを与えたマウスにおける体重増加の増加が、全体的な体組成の変化(除脂肪体重や骨密度など)によるものかどうかを評価するために、HF食またはHF食とLDPを与えた動物で二重エネルギーX線吸収測定(DEXA)スキャンを行った(図S1BおよびS1C)。DEXA分析の結果、除脂肪体重(図S1B)および骨密度(図S1C)は実験群間で差がなく、HF食とLDPは脂肪蓄積を特異的に増加させることが示唆された。LDPを投与し、HF食を与えたマウスは、HF食を与えたマウスと比較して、空腹時血糖値の上昇(図1D)および肝細胞における脂肪蓄積の増大(図1Eおよび1F)など、代謝機能不全のさらなる特徴も発現した。
ダウンロード 高解像度画像ダウンロード(993KB)
ダウンロード フルサイズ画像のダウンロード
図1. 低用量ペニシリン(LDP)と高脂肪(HF)食への早期の暴露は代謝機能障害を促進する。
(AおよびG)実験モデルと使用群の概略図。
(B-D)(B)5週間後の各群マウスの体重増加、(C)腹部脂肪(g)、(D)空腹時グルコース値。
(E)HF食およびHF食+LDP投与マウスの肝臓のオイルレッドO染色切片の代表的画像。スケールバーは100μmを表す。
(F)HF食またはHF食+LDPを与えたマウスの肝臓のオイルレッドスコアの組み合わせ。
(H)10週間の実験期間中の各群のマウスの体重増加。
(I)10週間の食餌および抗生物質投与後に測定した腹部脂肪(g)。
(J)空腹時グルコース値はHF食を8週間および10週間摂取した後に測定した。
(B-D、F、I、J)各点は1頭を表す。バーは幾何平均を表す。(H)ドットは平均値±平均値の標準誤差を表す。(BおよびC)n=12マウス/群。2つの独立したコホートを代表するデータ。(D、F、H-J)n=9マウス/群。独立した1つのコホートを代表するデータ。(B-D、I、J)*p<0.05;*p<0.01;*p<0.005。(F) Mann-Whitney検定による*p<0.05。(H) ∗p < 0.05; ∗∗p < 0.01:複数の対にならない両側スチューデントのt検定を用いて。
抗生物質投与終了後も代謝機能障害が持続するかどうかを調べるため、HF食とLDP、またはHF食のみに曝露したマウスに、さらに5週間HF食のみを与えた(図1G)。HF食とLDPに暴露されたマウスは、LDPを投与されなくなり、実験期間中同量の餌を摂取したにもかかわらず、10週間HF食のみを与えられたマウスよりも体重(図1H)と腹部脂肪(図1I)が増加した(図S2A)。LDPを投与しHF食を与えたマウスは、抗生物質を除去した3週間後も空腹時血糖値の上昇を持続した(図1J)。これらのデータは、HF食とLDPへの早期曝露が空腹時血糖値の上昇を引き起こし(図1D)、この実験群では抗生物質を除去した数週間後もグルコースレベルが上昇したままであることを示唆している(図1J)。LDPが持続的な脂肪増加を促進するためには、HF食の摂取が必要であった。HF食とLDPに5週間暴露した後、LF食に切り替えたマウスは、体重も脂肪も増加しなかったからである(図S2B-S2D)。さらに、LDPを投与してLF食を与えたマウスに、さらに5週間LF食を単独で与えても、体重増加や腹部脂肪に差は認められなかった(図S2E-S2G)。これらのデータを総合すると、抗生物質とHF食への早期の同時暴露は、未知のメカニズムを通して、HF依存性の肥満と代謝機能障害を早期に発症し、持続させることが明らかになった。
SI微生物叢からのリギラクトバチルス・ムリヌスの枯渇は脂肪蓄積を増加させる
抗生物質による早期の微生物叢の破壊が脂肪蓄積を促進することが以前に示されたことから11、我々は抗生物質とHF食への同時曝露が腸内細菌叢を変化させ、脂肪蓄積を促進するという仮説を立てた。抗生物質投与は、肥満誘発性の高脂血症食を与えた若いマウスにおいてのみ、5週間の投与後に代謝機能障害を増加させた(図1B-1H)。SIは食餌性脂質の吸収と代謝の主要な部位であることから19、我々は、HF食と抗生物質への早期の同時曝露によるSI微生物叢の変化を調べることにした。遠位SI微生物叢の16S rRNA解析から、4つの実験群間の組成変化の最も主要な要因は食餌であることが明らかになった(図S3A-S3C)。HF食のみの群と比較して、LDPに暴露すると、SI微生物叢で最も豊富な乳酸菌科に属する細菌が著しく減少した(図2A、2B、S3C、S3D)。興味深いことに、ラクトバチルス属のin vitro増殖は、ペニシリンと脂質の組み合わせ、あるいはペニシリンと胆汁酸塩の組み合わせ(HF食摂取中に腸内で上昇26)に対する感受性を示し(図S3FおよびS3G)、ペニシリンとHF食への暴露中にラクトバチルス属が枯渇したことの説明となった。HF食とLDPに曝露したマウスをHF食のみに切り替えると、乳酸菌レベルは回復したが、体重増加は依然として持続した(図1H、S3H、S3I)。これは、短期的な微生物叢の擾乱が持続的な代謝変化を促進するという仮説を支持するものである11。
ダウンロード 高解像度画像ダウンロード(745KB)
ダウンロード フルサイズ画像のダウンロード
図2. リギラクトバチルス・ムリヌスは幼少期のHF食摂取による脂肪増加を予防する。
(A)5週間投与後のマウス小腸内細菌叢における最も豊富な5ファミリーの存在量の差を示すヒートマップ。
(B)16S rRNA配列決定による小腸微生物叢中の乳酸桿菌属の相対的存在量。
(C)qPCRにより決定した小腸におけるL. murinusの存在量。
(DおよびE) (D)HF食とLDPのみを与えたマウス、またはL. murinusのペニシリン耐性株(L. murinus PenR)を経口投与したマウスの5週間後の体重増加と(E)腹部脂肪。
(F)gnotobiotic実験の概略図。
(G)HFを5週間投与した後の小腸(SI)における乳酸菌量(コロニー形成単位[CFU]/グラム)。点線は本実験における乳酸菌種の検出限界。
(HおよびI) (H)5週間後のマウスの体重増加および(I)腹部脂肪(g)。各点は1匹を表す。バーは幾何平均を表す。
(A) n = 5匹/群; (B) n = 9匹/群; (C) n = 7-8匹/群; (DおよびE) n = 12匹/群; (GおよびH) n = 8匹/群。2つの独立したコホートを代表するデータ。∗p<0.05;p<0.01;p<0.005;p<0.001。
次に、抗生物質と高脂血症食に暴露したマウスにおいて、乳酸菌の減少が代謝機能不全を促進するかどうかを調べた。定量的PCR(qPCR)により、無処置マウスのSIに存在する優勢な乳酸桿菌種はリギラクトバチルス・ムリヌス(L. murinus)であることが明らかになった(図S3E)。さらに、L. murinusは、LDPおよびHF食を与えたマウスのSI微生物叢から有意に減少していた(図2C)。そこで、L. murinusのペニシリン耐性株(L. murinus PenR)を作製し、この株を用いて、HF食とLDPを与えたマウスのサブセットにL. murinus PenRを再接種することにより、腸管内腔におけるL. murinusの存在を回復させた。L.ムリヌスPenRを投与したマウスは、HF食とLDPのみを投与したマウスに比べて、体重増加(図2D)と腹部脂肪増加(図2E)が少なかった。L. murinus PenRのコロニー形成が一過性であったため(データは示さず)、gnotobioticマウスを用いた定義された微生物叢戦略を用いた追加実験を行った。若齢(3週齢)の無菌(GF)マウスに、L. murinusを含むか、あるいはL. murinusを含まない定義された微生物叢をコロニー形成させ(図2F)、その後5週間HF食で維持した。L.murinusを含む微生物叢(図2G)をコロニー形成させたマウスは、L.murinusを含まない微生物叢を与えたマウスに比べて、体重増加(図2H)と腹部脂肪蓄積(図2I)が少なかった。これらのデータを総合すると、L. murinusはHF食摂取中の若いマウスを脂肪増加から保護することが示唆される。
しかし、小児は感染症の際に治療量の抗生物質を投与されることもあり、このような場合はLDPによる治療では再現できない。治療上必要な濃度の抗生物質とHF食との組み合わせが、LDPと同様の生理学的効果をもたらすかどうかを検討するため、幼若マウスを5週間にわたって3臨床用量のペニシリン(CDP、0.167g/L)(LFまたはHF食との組み合わせ)に曝露した(図3A)。LDPと同様に、HF食と臨床用量の抗生物質の同時投与は、HF食のみを与えたマウスと比較して、顕著な体重増加(図3B)、腹部脂肪の増加(図3C)、空腹時血糖値の上昇(図3D)を引き起こした。我々のLDPモデルで見られたように、CDPは若いマウスの微生物叢から乳酸菌を枯渇させた(図3Eおよび3F)。このことは、臨床的および不顕性抗生物質曝露とHF食が肥満を促進する相乗効果のドライバーとして、SI微生物叢からの乳酸菌枯渇の役割を裏付けている。L.murinusがどのようにして抗肥満効果を発揮するのかをさらに調べるために、HF食とLDPに同時に曝露したマウスでは、小腸内細菌叢から乳酸桿菌が持続的に減少していたことから、HF食とLDPモデルを利用することにした(図1I、1J、S3H)。
ダウンロード 高解像度画像ダウンロード(563KB)
ダウンロード フルサイズ画像のダウンロード
図3. 臨床用量のペニシリン(CDP)と高脂肪食の反復投与は脂肪率の増加を促進する。
(A)実験モデルと使用群の概略図。
(B-D)(B)5週間後のマウスの体重増加、(C)腹部脂肪率、(D)空腹時血糖値。
(E)5週間の実験期間中の処理マウスの糞便中の乳酸菌量(コロニー形成単位[CFU]/グラム)。
(F)5週間後に小腸内の乳酸菌量を測定した。
(A-DおよびF)各点は1匹の動物を表す。バーは幾何平均を示す。n = 12マウス/群。(E)ドットは6匹のマウスの量の幾何平均を示す。∗p<0.05;**p<0.01;***p<0.001。対にしない両側Studentのt検定による
幼若期の抗生物質がHF食摂取中の腸内脂質代謝を破壊する
腸内細菌叢の崩壊が代謝機能障害につながる機序として、腸上皮機能の障害によるものがある29,30。腸上皮は、脂質代謝、取り込み、分泌の調節や腸管ホルモン産生など、数多くの機序を通じて宿主の健康な代謝に寄与している31。したがって、抗生物質曝露とHF食による早期の腸内細菌叢の変化は、腸上皮細胞(IEC)の活性を障害することにより、小児肥満の一因となる可能性がある。HF食と抗生物質の組み合わせが腸上皮に影響を及ぼすかどうかを調べるため、LDPを併用したLF食またはHF食に5週間暴露した後、または併用せずに回腸の切片を調べた(図4A)。切片の病理組織学的解析から、LDPとHF食の両方に暴露されたマウスでは、LDP投与またはHF食のいずれかが腸上皮に与える影響が相乗的に大きくなることが明らかになった(図4B)。HF食とLDPへの曝露が腸上皮の機能をどのように変化させるかをより深く理解するために、次に、HF食またはHF食とLDPを与えたマウスの遠位SI IECのRNA配列決定を行った。その結果、肥満誘発性のHF食と抗生物質への同時曝露は、多様な経路に属する約200の遺伝子の発現を変化させた(HF食のみを与えたマウスと比較して)(図4Cと4D)。HF食とLDPを投与したマウスで変化した遺伝子経路を解析したところ、脂質と脂肪酸代謝に関連する転写産物の発現に異常が認められた(図4D)。 SI IECのqPCR解析では、RNAシークエンシングの結果が確認され、脂質の消化(Angptl4)と吸収(Cd36)、輸送(Fabp1とFabp2)、分泌(MttpとApoB)に関連する遺伝子の発現に有意差が認められた(図4E)。 32,33,34,35,36,37。Cd36の発現が増加しているにもかかわらず、HF食とLDPを与えたマウスは、HF食のみを与えたマウスと比較して、食餌からの脂肪吸収は増加しなかった(図4F)。しかし、絶食HF食およびLDP投与マウスのSI IECでは、有意に高いトリグリセリドが測定された(図4G)。また、HF食とLDPを与えたマウスは、HF食のみを与えたマウスに比べて、絶食時の血清中の脂質が有意に多かった(図4H)。従って、LDPによる初期投与が腸の脂質代謝を擾乱し、腸から循環への脂質輸送を増加させたと考えられた。この仮説を検討するため、HF食またはHF食とLDPを与えたマウスにリポ蛋白リパーゼ阻害剤タイロキサポールを注射し、その後オリーブ油をボーラス投与した。HF食とLDPを与えたマウスは、オリーブ油投与2時間後に血清トリグリセリドが有意に増加しており(図4I)、血清脂質の上昇(図4H)は、腸からの脂質分泌の増加に起因していることが示唆された。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図4. 初期抗生物質への暴露は高脂肪食に対する腸上皮の反応を変化させる。
(A)LFまたはHF±LDP食に5週間暴露したマウスの回腸のヘマトキシリン・エオジン染色切片。
(B)回腸切片の病理組織学的スコア。スケールバーは200μmを表す。
(CおよびD)HF食またはHF食+LDPに5週間暴露したマウスの回腸(IEC)から単離した上皮細胞のRNA配列決定解析。(C)HF食+LDPに暴露したマウスでは、HF食のみを与えたマウスと比較して、有意に(調整p値<0.05)発現が上昇した遺伝子(赤)と低下した遺伝子(青)のボルケーノプロット。(D) HF食+LDP投与マウスのIECにおける濃縮された遺伝子オントロジー(GO)カテゴリー。
(E)HF食またはHF食とLDPを与えたマウスのqPCRで測定した指示遺伝子の上皮転写産物。
(F)HF食またはHF食+LDPに5週間暴露した後の糞便脂肪吸収を測定した。
(G-I)HF食またはHF食とLDPを5週間与えたマウスを絶食させ、(G)IEC中のトリグリセリド量および(H)血清中の中性脂質を測定した。(I)HF食またはHF食とLDPを5週間与えたマウスで経口脂肪負荷試験を行った。血清トリグリセリド濃度はオリーブ油ボーラス投与2時間後に測定した。
(JとK) (J)HF食またはHF食とLDPを2週間与えたマウスの腹部脂肪(g)と(K)空腹時トリグリセリド。
(BおよびE)バーは平均±平均の標準誤差(SEM)を表す。 F-K)バーは幾何平均を表す。各点は1匹を表す。(B) n = 6マウス/群。データは1つの独立したコホートを代表する;(CおよびD)n=3マウス/群。(E) n = 14匹/群。2つの独立したコホートを代表するデータ。(F-H) n = 5-6マウス/群。1つの独立したコホートを代表するデータ。(I) n = 12 mice/群。独立した1つのコホートを代表するデータ。(JおよびK) n = 9 mice/群。独立した1つのコホートを代表するデータ。(B)片側Mann-Whitney検定による*p<0.05;*p<0.01。(E-K)*p<0.05;**p<0.01;**p<0.005;***p<0.001は、対にならない両側スチューデントのt検定によるもの。
HF食とLDPに暴露されたマウスにおける血清脂質の上昇が、脂肪率の上昇に先行するかどうかを調べるために、HF食とLDPを2週間摂取させた後の生理学的差異を調べた。SIの乳酸菌種が減少したにもかかわらず(図S4A)、HF食とLDPを与えたマウスは、わずか2週間の曝露で体重が増加したり(図S4B)、腹部脂肪が蓄積したり(図4J)しなかった。しかし、HF食とLDPを与えたマウスは、空腹時血清中のトリグリセリドが有意に増加した(図4K)。血清中のトリグリセリドの上昇が、HF食とLDPに2週間暴露した後の腸内脂質代謝の障害と一致しているかどうかを理解するために、HF食とLDPを与えたマウスで5週間後に変化したのと同じ遺伝子の発現を測定した(図4E)。興味深いことに、Angptl4の発現はHF食とLDPに2週間暴露した後に減少したが、他の脂質代謝遺伝子の発現には有意差は観察されなかった(図S4F)。我々のデータは、HF食とLDPへの暴露が腸の脂質代謝を調節不全にし、血清トリグリセリドの上昇を招き、過剰体重増加と脂肪増加を促進することを示唆している。
L.murinusによる腸内PPAR-γの活性化は、HF食摂取中の脂肪蓄積を防ぐ
次に、HF食とLDPが腸の脂質代謝をどのように阻害するかを調べた。特に、SI IECにおけるAngptl4の減少につながるメカニズムに注目した。重要なことに、大腸IECにおけるPPAR-γの存在量と活性は、抗生物質治療中に減少する38。そこで、我々は、HF食とLDPへの早期の曝露において、腸管PPAR-γが、微生物叢の擾乱と腸管脂質代謝異常とをつなぐメカニズムであるかどうかを調べた。LDP投与は、LF食を与えたマウスのSI IECにおけるPPAR-γの遺伝子発現およびタンパク質存在量に影響を与えなかった(図S5A-S5D)。しかしながら、SI IECにおけるPPAR-γの遺伝子発現およびタンパク質存在量は、HF食とLDPを与えたマウスでは(HF食のみを与えたマウスと比較して)有意に減少した(図5A-5D)。脂肪組織や肝臓では、Ppargや関連標的遺伝子の発現に変化は認められなかった(図S5EおよびS5F)。この結果は、HF食と抗生物質への曝露がSI IECsからPPAR-γを特異的に枯渇させることを示唆している。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図5. 腸管PPAR-γシグナル伝達の消失は、LDPおよびHF食への曝露による脂肪率の増加を促進する。
(A)HF食またはHF食+LDP投与マウスの回腸上皮におけるPpargの発現をqPCRで測定した。
(B)回腸上皮におけるPPAR-γの存在量は、回腸の染色切片をスコアリングすることによって定量した。
(CおよびD)(C)HF食負荷マウスおよび(D)HF食+LDP処理マウスにおけるPPAR-γ染色の代表的画像。スケールバーは200μmを表す。
(E)3週齢のPpargfl/flVillincre/-マウス(PpargΔIEC)および同腹のコントロールPpargfl/flVillin-/-マウス(Ppargfl/fl)にHF食を10週間与え、体重増加を毎週測定した。
(FおよびG)(F)腹部脂肪(総体重%)および(G)PpargΔIECおよびPpargfl/flの小腸(SI)における乳酸菌存在量(コロニー形成単位[CFU]/グラム)を、6週間の食餌および抗生物質操作後に測定した。
(H-L)腸上皮細胞にL. murinusを100のMOIで感染させた。(H)処理したCaco-2細胞から分泌されたBODIPY C12の量を、脂質ミセル添加4時間後に測定した。(I)不死化マウス小腸上皮(MSIE)細胞をモック処理、または大腸菌Mt1B1、S. xylosus 33-ERD13C、L. murinusで処理した後、qPCRを用いてPpargの発現を測定した。(J-L)MSIE細胞をL. murinusで処理し(L)、あるいは未処理のまま(K)、16時間インキュベートした。 (J)PPAR-γ核強度はImageJを用いて定量した。3つの独立した実験から得られた2つの画像から15個の細胞を選択した。
(M-O)無胚葉マウスに、L. murinusを含む、または含まない、定義された微生物叢をコロニー形成させ、5週間HF食を与えた。(M)回腸の染色切片をスコアリングすることにより、上皮中のPPAR-γ量を定量した。L.murinusをコロニー形成させたマウス(O)またはコロニー形成させないマウス(N)におけるPPAR-γ染色の代表的画像。スケールバーは200μm。
(A、F、G)各ドットは1匹を表す。n = 5-7匹/群。(BおよびM)各点は1匹を表す。バーは平均を表す。つの独立したコホートから得られた代表的なデータ。(E)ドットは平均±SEMを表す(N = 8-9/遺伝子型)。(HおよびI)各ドットは1つのテクニカルレプリケートを表す(データは3つの生物学的レプリケートから示される)。バーは幾何平均を表す。(J)PPAR-γ核強度分布を示すバイオリンプロット(n=90細胞)。(AおよびG-J)*p<0.05;**p<0.01;**p<0.001;***p<0.0001。(BとM)両側Mann-Whitney検定による*p<0.05。(E)Šídákの多重比較検定による二元配置分散分析を用いた*p<0.0332。(F) Šídákの多重比較検定を用いた一元配置分散分析により、*p < 0.05。
HF食およびLDP投与マウスで観察された腸管PPAR-γの減少をもとに、次に、IECに特異的なPPAR-γの遺伝子破壊が体重増加と代謝機能不全をもたらすかどうかを検討した。腸上皮特異的PPAR-γノックアウトマウス(PpargΔIEC)と同腹仔コントロールマウス(Ppargfl/fl)にLFまたはHF食を10週間与えた(図5EおよびS5G)。PpargΔIECは、HF食を与えた場合、同腹のコントロールマウスよりも体重および脂肪が増加した(図5EおよびS5H)。HF食とLDPの効果と一致して、PpargΔIECはLF食を与えても体重も脂肪も増加しなかった(図S5GとS5H)。PpargΔIECと野生型Ppargfl/flをHF食またはHF食とLDPに暴露した。野生型Ppargfl/flマウスをHF食とLDPに暴露すると、HF食のみを与えた場合と比較して、有意に腹部脂肪が増加した(図5F)。しかし、HF食とLDPを投与しても、PpargΔIECマウスが蓄積した脂肪量は増加しなかった(図5F)。これは、LDPが腸上皮におけるPPAR-γシグナル伝達を鈍らせることによって、HF食曝露中の脂肪蓄積を促進するという我々の仮説を支持するものである。脂肪率の差がLDP活性の変化に起因するものではないことを確認するため、PpargΔIECマウスおよびPpargfl/flマウスのSIにおける乳酸菌量を測定した。HF食を与えたPpargΔIECマウスとPpargfl/flマウスの間、あるいはHF食とLDPに曝露したPpargΔIECマウスとPpargfl/flマウスの間で、乳酸菌の存在量に差は観察されなかった(図5G)。
乳酸桿菌種は、PPARの活性化を通じてIECの脂質分泌を調節することができる22,23。HF食とLDPに曝露すると乳酸桿菌が減少することが観察されたので(図2A)、次に乳酸桿菌種がin vitroでPPAR-γを活性化できるかどうかを調べた。L.murinusがHF食誘発肥満から若いマウスを保護することが観察されたので(図2I)、この分離株を利用して乳酸桿菌とPPAR-γの関係を調べた。腸管上皮細胞(Caco-2)において、L. murinusがPPAR-γの転写活性を、既知のPPAR-γアゴニストである酪酸38と同程度まで上昇させることを明らかにした(図S6A)。さらに、L. murinusはPPAR-γの核局在を有意に増加させた(図S6B、S6C、S6E)。L.murinusがPPAR-γの存在量と活性の両方を制御していることから、L.murinusがPPAR-γ依存的に脂質分泌に影響を及ぼすかどうかを検討した。以前の知見23 と一致し、L. murinusはCaco-2細胞による蛍光脂肪酸(BODIPY C12)を含むミセルの分泌を減少させた(図5H)。しかし、PPAR-γ阻害剤であるGW9662を添加すると、L. murinusの脂質分泌抑制能は阻害された(図5H)。このことから、L. murinusはIECにおいてPPAR-γ活性を上昇させ、腸からの脂質分泌を抑制することが示唆された。
L.ムリヌスとPPAR-γの関係を引き続き調べるため、マウスモデルをより正確に再現するSI細胞株に移行した。L.murinusで処理したマウス小腸上皮(MSIE)細胞では、Pparg発現が増加した(図5I)。対照的に、大腸菌(E. coli)Mt1B1または黄色ブドウ球菌(Staphylococcus xylosus)による処理では、MSIE細胞におけるPpargの発現を増加させることができなかったことから、Pparg発現の増加はL. murinusに特有のものであり、細菌との共培養の結果ではないことが示唆された(図5I)。さらに、モック処理細胞と比較して、L. murinusはMSIE細胞において核内のPPAR-γの量を有意に増加させた(図5J-5L)(Caco-2細胞で得られた知見と一致;図S6)。L.ムリヌスと腸PPAR-γとの特異的相互作用のさらなる証拠は、L.ムリヌスを含む、または含まない規定された微生物叢でコロニー形成されたgnotobioticマウスで見られる(図2F)。我々のin vitroデータと一致して、L. murinusを含む微生物叢でコロニー形成されたマウスは、L. murinusを欠くマウスと比較して、腸内のPPAR-γ染色レベルが有意に高い(図5M-5O)。
PPAR-γは微生物叢由来の代謝産物によって制御されることが知られているため38,41、次にL. murinus培養の無細胞上清がPPAR-γの核局在を増加させるかどうかを調べた。実際、L. murinus培養上清は、大腸菌Mt1B1ではなく、PPAR-γの核内局在量を有意に増加させた(図S6B-S6I)。これらのin vitroデータを総合すると、乳酸菌由来の代謝産物はPPAR-γを活性化することが明らかになり、HF食と抗生物質への曝露によるPPAR-γ活性の低下は、乳酸菌由来の代謝産物の枯渇が原因であるとの仮説が導かれた。
PLAはSI内腔から枯渇し、腸管PPAR-γを制御する
腸内PPAR-γの活性化に関与する乳酸菌代謝産物を同定するために、HF食またはHF食とLDPを与えたマウスのSI内容物についてアンターゲットメタボロミクスを行った(図6A)。乳酸菌種によって産生されることが知られている複数の代謝物が、PLAを含むHF食とLDPを与えたマウスで有意に減少した(図6B)。以前の研究で、乳酸菌由来のPLAが脂肪細胞でPPARGをアップレギュレートすることが確認されていることから42、IECsでPPAR-γを制御する上清中のL. murinus由来代謝産物がPLAであるかどうかを調べた。まず、腸内PLA量が腸内細菌叢に依存していることを明らかにした。HF食を与えたGFマウスでは、従来型マウスに比べてSI中のPLA量が有意に少ないからである(図6C)。次に、GFマウスをコロニー形成させるために用いた規定微生物叢の培養上清でPLAを測定した(図2F)。PLAレベルは、L. murinusを含む規定された微生物叢の上清で有意に高かった(図6D)ことから、L. murinusが、規定されたSI微生物叢に存在する他の微生物と比較して、PLAの主要な産生者であることが示された。さらに、L. murinusは単独で、細胞培養実験においてPLAを産生した(図6E)。重要なことに、L. murinus PenR(図2Dおよび2E)、L. murinusの別の株(DSM 20452)、異なるラクトバチルス属、およびビフィドバクテリウム・アニマリスもすべてin vitroでPLAを産生し(図6E)、PLAを産生する能力は、腸内細菌叢に存在する複数の細菌種間で保存されていることが強調された。L.murinusによるPLA産生をin vivoで調べるため、L.murinus PenRを投与したマウスで、HF食とLDPに暴露した際の腸内PLAレベルを測定した(図2Dおよび2E)。HF食とLDPのみを投与したマウスと比較して、L. murinus PenRをコロニー形成させたマウスのSI含量中のPLAレベルは有意に高く(図6F)、この乳酸菌種が腸内PLA量に大きく寄与しているという我々の仮説を支持した。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. HF食とLDPに暴露すると、腸PPAR-γの活性化因子であるフェニル乳酸が小腸から枯渇する。
(AおよびB)HF食またはHF食+LDP(N = 5/表現型)を与えたマウスの回腸内容物について、非標的メタボロミクスを行った。(A)実験サンプル群と代謝物のヒートマップクラスタリング。サンプル(列)はグループごとにクラスタ化され、異なるグループ間の相対存在量(行)は低存在量(青)から高存在量(赤)の順に並んでいる。(B) HF食またはHF食+LDP投与マウスの小腸内容物中のフェニル乳酸(PLA)のアンターゲットメタボロミクスによる正規化相対存在量。
(C)5週間HF食を与えた無菌マウス(GF)および通常マウス(conventional)の小腸中のPLA濃度(pmol/mg腸内容物)。
(D)L.murinusを欠失または含有する定義された微生物叢培養の上清中のPLA濃度(μM)。
(E)細胞培養培地で増殖させた乳酸菌の上清中のPLA濃度(μM)。
(F)マウスの小腸におけるPLAの濃度(pmol/mg腸内容物)。点線は検出限界=0.025pmol/mgを示す。
(G)マウス腸管を10μMのロシグリタゾンまたは5mMのPLAで処理するか、未処理のままとした。
(HおよびI)不死化マウス小腸細胞を5mM PLAで処理(H)または未処理(I)。その後、細胞を抗PPAR-γおよびファロイジンで染色し、F-アクチンを同定した。
(J)PPAR-γ核強度はImageJを用いて定量した;3つの独立した実験から得られた2つの画像から15個の細胞を選択した。
(K)処理したCaco-2細胞から分泌されたBODIPY C12の量は、脂質ミセル添加の6時間後に測定した。
(BおよびC)各点は1匹を表す。線は幾何平均を表す。(F) 各ドットは1匹を表す。線は平均値を表す。(B、C、F)データは1つの独立したコホートを表す。(DおよびE)各ドットは生物学的複製を表す。線は幾何平均を示す。(G)各ドットは1つのテクニカルレプリケートを表す。3つの生物学的複製からのデータ。線は幾何平均を示す。(J)PPAR-γ核強度分布を示すバイオリンプロット(n=90細胞)。(K)各ドットは1テクニカルレプリケートを示す。3生物学的複製からのデータ。線は幾何平均を示す。∗p<0.05;p<0.01;p<0.001;p<0.0001。
PLAがIECにおいてPPAR-γを活性化するかどうかを調べるために、マウス腸管をPLAで処理したところ、マウス腸管におけるAngptl4の発現がPPAR-γアゴニストであるロシグリタゾンと同程度に増加することが観察された(図6G)。さらに、PLA処理は、モック処理細胞と比較して、IECの核におけるPPAR-γの蓄積を有意に増加させた(図6H-6J)。PLAはまた、Caco-2細胞による脂質ミセル分泌を減少させた(図6K)。このことは、この乳酸菌由来の代謝産物が、PPAR-γを介してIECにおける脂質代謝を調節することにより、HF食摂取中の代謝機能障害から宿主を保護する役割を果たしている可能性を示唆している。
PLAは若いマウスを高脂血症食誘発性代謝機能障害から保護する
我々のin vitroデータに基づいて、PLAを補充することによって、HF食とLDPに暴露されたマウスのSIにおけるPPAR-γの存在量が増加するかどうかを検討した。非標的メタボロミクスデータ(図6A)と一致するように、HF食とLDPに暴露されたマウスは、HF食のみを与えられたマウスと比較して、SIにおけるPLAが有意に少なかった。腸内PLAの上昇(図7A)は、HF食のみを与えたマウスと比較して、HF食とLDPを与えたマウスの腸管上皮におけるPPAR-γの存在量を有意に増加させた(図7Bおよび7C)。腸内PPAR-γの増加と一致して、PLAを投与したHF食およびLDP曝露マウスは、HF食および抗生物質を投与したマウスに比べて、脂肪率が低下し、体重増加が有意に抑制された(図7D、7E、およびS7A)。PLAの補充はまた、LDP誘発肝細胞における脂肪蓄積を有意に阻害し(図7Fおよび7G)、空腹時血糖を減少させた(HF食とLDPに曝露したマウスと比較して)(図S7B)。PLA補給による生理学的変化は、PLAを投与したマウスがより多くの食物を摂取し、SIにおける乳酸菌の存在量が同様に減少したにもかかわらず生じた(図S7CおよびS7D)。我々は、SIに常在する腸内細菌叢によって産生される代謝産物であるPLAが、IECにおけるPPAR-γの機能を制御することによって、HF食に暴露された際の早期の代謝機能不全から保護することを決定した。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図7. フェニル乳酸は腸内PPAR-γをアップレギュレートし、HF + LDP誘発代謝機能障害を抑制する。
(A)マウスの小腸におけるPLAの濃度(pmol/mg腸内容物)。点線は検出限界=0.025pmol/mgを示す。
(B)10mMのPLAを飲料水および/またはLDPに5週間投与したHF食マウスの回腸切片をPPAR-γについて染色した。スケールバーは200μmを示す。
(C)回腸の盲検切片をスコアリングすることにより、上皮中のPPAR-γ存在量を定量した。
(DおよびE)(D)HF食±PLA±LDPで5週間飼育したマウスの腹部脂肪(総体重%)および(E)体重増加を測定した。
(F)肝臓のオイルレッドO染色切片の代表画像。スケールバーは100μmを表す。
(G)5週間投与後のマウスの肝臓のオイルレッドスコアの組み合わせ。
(AおよびG) n = 6匹/群。(C-E)n=12匹/群。(A、C-E、G)各点は1匹を表す。線は幾何平均。データは2つの独立したコホートを代表する。(A、D、E)*p<0.05;*p<0.01;**p<0.001;**p<0.0001。(CおよびG)*p<0.05;**p<0.01(Mann-Whitney検定による)。
考察
小児肥満の世界的有病率は過去30年間で劇的に上昇した43。米国では、学齢期の小児の約20%が肥満とされ、公衆衛生上の重大な関心事となっている44。8,46重要なことは、これらの疫学調査では小児の食事が考慮されていないため、抗生物質と他の環境因子との相乗効果を見逃している可能性があるということである。特に、米国で最も一般的に処方されている抗生物質であるペニシリンの影響について検討した47。本論文では、幼少期のペニシリン曝露が、SI微生物叢とIECsの相互作用を阻害することにより、高脂血症食誘発性肥満の発症を促進することを明らかにした。我々はさらに、抗生物質と高脂血症食を与えたマウスのSIにおける乳酸桿菌種の枯渇が、過剰な脂肪を引き起こすことを証明した。特に、高脂血症食と抗生物質の投与により、乳酸桿菌由来の代謝産物であるPLAが減少した。PLAはIECsのPPAR-γを制御し、高脂血症食誘発性肥満を予防する。
我々は、抗生物質と高脂血症食への早期の同時曝露がIECの脂質代謝を擾乱することを明らかにし、SIが全身の脂質ホメオスタシスを制御する重要な役割を担っていることのさらなる証拠を提供した48。興味深いことに、肥満患者49のSIで増加したタンパク質(FABP1、FABP2、MTP)は、高脂血症食と抗生物質に曝露されたマウスのSIでアップレギュレートされた遺伝子と一致した。我々は、高脂血症食と抗生物質を投与したマウスは、IECと血清中に有意に多くのトリグリセリドを蓄積するが、食餌からの脂肪吸収は増加しないことを明らかにした。これらのデータを総合すると、高脂血症食と抗生物質への同時曝露が腸の脂質代謝を擾乱し、リポ蛋白分泌を増加させるという仮説が支持される。これまでの研究で、腸内細菌叢の破壊が腸内のPPAR-γ活性を低下させることが示されている38。脂質代謝におけるPPAR-γの役割は、細胞タイプに特異的である。例えば、脂肪組織では、PPAR-γは脂質の貯蔵と脂肪生成を促進する50。一方、マクロファージでは、PPAR-γは遊離脂肪酸とトリグリセリドの蓄積を減少させる51。腸では、PPAR-γの欠失は血清トリグリセリドの上昇をもたらし、40腸PPAR-γの欠失が絶食血清中のトリグリセリドを有意に増加させるという我々のモデルと一致する。したがって、腸管PPAR-γは、脂質代謝を調節し、高脂血症食曝露中の代謝機能障害を軽減する有望な標的である。実際、PPAR-γアゴニストであるロシグリタゾンの投与は、ハムスターモデルにおいて、腸管アポBの発現を抑制し、トリグリセリド分泌を減少させる52。これらの知見を総合すると、代謝機能障害からの保護における腸管脂質代謝、特にPPAR-γの役割が強調される。
高脂血症食と抗生物質に暴露されたマウスでは、SIから乳酸桿菌種が枯渇しているため、早期の微生物-宿主相互作用に重大な脅威を与えている。乳酸桿菌は腸の初期コロニー形成者の1つであり、乳幼児期の微生物叢の主要メンバーである4,53。子供が成熟するにつれて乳酸桿菌の相対的存在量が減少するにもかかわらず、4,54乳酸桿菌種は依然として腸内細菌叢の重要な構成要素である。したがって、乳酸桿菌の減少が宿主の健康と発育にどのような影響を及ぼすかを調べることは、依然として臨床的に重要である。これまでの研究で、特定の乳酸菌種であるL. paracasei F19およびL. reuteri ATCC 4659が、成体マウスにおける肥満誘発性HF食の影響を制限することが明らかにされている55,56が、これらの菌株がどのようなメカニズムで保護作用を発揮するのかは、比較的未知のままである。55,57。さらに、プロバイオティクス介入研究では、ラクトバチルス属の菌は小児の体組成をほとんど変化させないことが示されており58,59、ラクトバチルス属の菌がHF食誘発性肥満からどのように保護するのかを理解することが極めて重要であることが強調されている。我々の論文では、ヒト腸内の優勢な乳酸菌種であるL. murinusが54、腸内PPAR-γをアップレギュレートすることによってIECからの脂質分泌を抑制することを明らかにした。
この論文では、幼少期にHF食に暴露された際の宿主の脂肪率に対する他のSI微生物叢メンバーの影響については調べていない。しかし、HF食とLDPに曝露したマウスのSI微生物叢の16S rRNA配列決定において、我々はレンサ球菌科の相対的存在量が増加していることを明らかにした。ストレプトコッカス属はヒトのSI微生物叢では支配的なグループであるため60、我々のモデルにおけるこの増加はさらなる調査が必要である。ストレプトコッカス属は動脈硬化性プラークに非常に多く存在し、HDLコレステロール値と正の相関があることから61、HF食やLDPを投与したマウスではストレプトコッカス科の増加が代謝機能障害に拍車をかけている可能性が示唆される。興味深いことに、常在性連鎖球菌はPPAR-γ活性をダウンレギュレートすることが示されており62、これはHF食およびLDP投与マウスにおける腸管PPAR-γの抑制に寄与している可能性がある。従って、今後の研究では、複数のSI微生物叢メンバー間の相互作用が、腸管PPAR-γを介して宿主の代謝にどのような影響を及ぼすかを調べる予定である。
プロバイオティクスのコロニー形成は一過性であるため63、有益な乳酸菌由来の代謝産物を直接投与した方が、代謝機能障害の予防に成功する可能性がある。そこで我々は、腸内PPAR-γを活性化し、HF食と抗生物質への同時曝露による代謝機能障害から若齢マウスを保護する乳酸菌由来代謝産物PLAを同定した。興味深いことに、HF食を与えたマウスとHF食と抗生物質に曝露したマウスでは、ビフィズス菌科とペプトストレプトコッカス菌科の細菌が減少しており(図2A)、複数の細菌種が腸内でのPLA産生に寄与している可能性が示唆される。重要なことに、PLAは乳児の糞便中に存在し、ビフィズス菌の多さと相関している64。このことは、この代謝物がヒトの初期腸内メタボロームの構成要素であることを示している。以前の研究で、PLAがPPAR-γの脂肪組織特異的アイソフォームをアップレギュレートすることが明らかになった42。さらに我々は、PLAがIECにおける脂質分泌を抑制し、肥満誘発性HF食摂取中の若いマウスにおいて抗生物質誘発性過剰脂肪を予防することを示すことによって、これらの知見を拡張した。以上より、我々は、幼少期の微生物叢が腸管上皮と相互作用してHF誘発性肥満を減少させるという、これまで知られていなかったメカニズムを同定し、幼少期の抗生物質曝露と小児肥満を関連づける新たな証拠を提供した。
STAR★方法
主要リソース表
試薬またはリソースソース識別子
抗体
マウスモノクローナル抗PPAR-γ Santa Cruz Biotechnology Cat #: sc-7273, RRID:AB_628115
ヤギ抗マウス IgG Alexa Fluor 488 Thermo Fisher Scientific Cat #: A-11001, RRID:AB_2534069
細菌およびウイルス株
Ligilactobacillus murinus 本試験 CS010
ムリバクラム・インテスティナーレ DSMZ YL27
クロストリジウム・クロストリジオフォルメ DSMZ YL32
クロストリジウム・スポロゲネス DSMZ B-CC-163-3B
ストレプトコッカス・ダニエレ ERD01G DSMZ ERD01G
黄色ブドウ球菌 33-ERD13C DSMZ 33-ERD13C
大腸菌Mt1B1 DSMZ Mt1B1
リギラクトバチルス・ムリヌス PenR CS052
リギラクトバチルス・ムリヌス DSMZ M-6244-3B
乳酸アシドバシラス ラムノサス ATCC Cat #: 53103
ラクトバチルス アシドフィルス ATCC Scav; Cat #: 4356
ビフィドバクテリウム・ロンガム・サブスピー・アニマリス DSMZ YL2
化学物質、ペプチド、組換えタンパク質
Difco乳酸菌MRS寒天 Becton Dickinson Cat #: 288210
Difco Lactobacilli MRSブロス Becton Dickinson Cat #: 288130
ペニシリンVカリウム塩 Sigma Cat #: P1382
D-(+)-3-フェニル乳酸 Sigma Cat #: 376906
Difco LBブロス Becton Dickinson Cat #: 244620
Difco Brain Heart Infustion 寒天 Becton Dickinson Cat #: 241830
Bacto 酵母エキス Becton Dickinson Cat #: 212750
Bacto Tryptic soy broth ベクトン・ディッキンソン Cat #: 211825
リン酸水素二カリウム Fisher Chemicals Cat #: P288
ヘミン Sigma Cat #: 51280
D(+)-グルコース Acros Organics Cat #: 41095
炭酸ナトリウム Fisher Chemicals Cat #: 5263
(L) - システイン Sigma Cat #: 168149
メナジオン Sigma Cat #: 47775
熱不活性化ウシ胎児血清 Gibco Cat #: 16140-071
RPMI 1640 培地 Gibco Cat #: 11875093
組み換えマウス IFN-γタンパク質 R&D Systems Cat #: 485-MI-100
ペニシリン-ストレプトマイシン Gibco Cat #: 15140122
ITS液体培地サプリメント Sigma Cat #: I3146
最小必須培地 ギブコ Cat #: 11095-080
グルタマックス ギブコ Cat #: 35050-061
非必須アミノ酸 Gibco Cat #: 11140-050
ピルビン酸ナトリウム Gibco Cat #: 11360070
トリプシン-EDTA(0.05%) Gibco Cat #: 25300054
プリモシン InvivoGen Cat #: ant-pm-1
ジチオスレイトール Acros Organics Cat #: 16568
EDTA Sigma Cat #: E5134
EGTA Sigma の Cat #: E3889
マトリゲル膜マトリックス Corning Cat #: 354234
腸内オルガノイド増殖培地(マウス) STEMCELL Technologies Cat #: 06005
Y-27632 二塩酸塩 TOCRIS Cat #: 1254
ロシグリタゾン Sigma Cat #: R2408
O.C.T.コンパウンド Fisher Chemicals Cat #: 4585
iQ SYBR Green スーパーミックス BioRad Cat #: 1708880
胆汁酸塩 Sigma Cat #: B8756
脂質混合物 Sigma Cat #: L0288
TRIzol 試薬 Invitrogen Cat #: 15596026
QIAzol 溶解試薬 Qiagen Cat #: 79306
バイオラッド タンパク質試薬 BioRad Cat #: 5000006
タイロキサポール Sigma Cat #: 1704003
GW9662 シグマ社 Cat #: M6191
オレイン酸 Sigma Cat #: O1008
タウロコール酸ナトリウム Sigma Cat #: T4009
2-モノ-オレオイルグリセロール Sigma Cat #: M7765
コレステロール Sigma Cat #: C8667
L-a-リゾホスファチジルコリン Sigma Cat #: L4129
BODIPY 558/568 C12 Invitrogen Cat #: D3835
HEPES ギブコ Cat #: 15630-080
パラホルムアルデヒド Electron Microscopy Sciences Cat #: 15710-5
Triton X-100 Acros Organics の Cat #: 327372500
Alexa Fluor 647 Phalloidin Invitrogen 社の Cat #: A22287
ProLong Diamond Antifade Mountant with DAPI Invitrogen Cat #: P36971
酪酸、ナトリウム塩 Acros Organics Cat #: 263191000
DL-3-フェニル乳酸-d3 Toronto Research Chemicals Cat #: P335567
DL-3-フェニル乳酸 Toronto Research Chemicals 社の Cat #: H953713
重要な市販アッセイ
Total RNA 精製キット Norgen Biotek Corp. Cat #: 37500
オイルレッドO、プロピレングリコール染色キット Newcomer Supply Cat #: 12772
DNeasy PowerSoil キット Qiagen Cat #: 47014
PureLink Genomic DNA Mini Kit Invitrogen Cat #: K182001
iScript gDNA Clear cDNA 合成キット BioRad Cat #: 1725034
NEBNext® Ultra™ II Directional RNA Library Prep Kit for Illumina New England BioLabs Inc. Cat #: E7760
脂質定量キット Cell BioLabs, Inc. Cat #: STA-617
血清トリグリセリド定量キット Cell BioLabs, Inc. Cat #: STA-396
遊離脂肪酸定量キット Cell BioLabs, Inc. Cat #: STA-618
総コレステロール測定キット Cell BioLabs, Inc. Cat #: STA-384
ボンドリファインポリマー検出システム Leica Biosystems Cat #: DS9800
ルシフェラーゼアッセイシステム Promega Cat #: E1500
寄託データ
遠位小腸内容物の 16S rRNA シークエンシング European Nucleotide Archive ENA: PRJEB52997
遠位小腸上皮細胞のRNAシーケンス European Nucleotide Archive ENA: PRJEB53157
遠位小腸内容物の非標的メタボロミクス Metabolomics Workbench Metabolomics Workbench: ST002186
実験モデル 細胞株
マウス:H-2Kb-tsA58トランスジェニックマウスの小腸細胞 Whitehead et al.67 MSIE
ヒト Caco-2 細胞 ATCC HTB-37
実験モデル: 生物/株
マウス B6.Cg-Tg(Vil1-cre)997Gum/J The Jackson Laboratory JAX: 004586
マウス B6.129-Ppargtm2Rev/J The Jackson Laboratory JAX: 004584
マウス Ppargfl/flVillincre/- Byndloss et al.38 N/A
マウス C57BL/6NCrl Charles River Laboratory CRL: 027
マウス ジャームフリー C57Bl/6N 自社コロニー N/A
オリゴヌクレオチド
本研究で使用したオリゴヌクレオチドに関する情報を表S2に示す。
組換えDNA
PPRE x3-TK-Luc Addgene プラスミド番号: 1015
ソフトウェアとアルゴリズム
Excel Microsoft N/A
Prism 9(バージョン 9.2.0) Graphpad https://www.graphpad.com/features
QIIME2 (バージョン 2022.2) N/A https://qiime2.org/
STAR (v2.7.3a) Dobin et al.68 https://github.com/alexdobin/STAR
featureCounts (v2.0.0) Liao et al.69 https://subread.sourceforge.net/
DESeq2 (v.1.24.0) Love et al.70 http://bioconductor.org/packages/release/bioc/html/DESeq2.html
WebGestaltR (v0.4.4) N/A https://www.webgestalt.org/
Progensis QI v. 3.0 Non-linear Dynamics、ウォーターコーポレーション https://www.nonlinear.com/progenesis/qi/v3.0/download/
Metaboanalyst 5.0 N/A https://www.metaboanalyst.ca/MetaboAnalyst/home.xhtml
利用可能なリソース
連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、リードコンタクトであるMariana Byndloss (mariana.x.byndloss@vumc.org)までご連絡ください。
試薬の入手可能性
本研究で生成された全てのユニーク/安定試薬は、リードコンタクトから制限なく入手可能である。
実験モデルの詳細
動物実験
本研究におけるすべての実験は、VanderbbのInstitutional Animal Care and Use Committee(IACUC)により承認された。
(IACUC)の承認を得た。
さらに、食事誘発性肥満の影響は、メスに比べて若いオスマウスで有意に大きい72。本研究では、抗生物質と高脂肪(HF)食の相乗効果に焦点を当てたため、オスマウスを用いた。3週齢の雄C57BL/6Nマウス(#027)をCharles River Laboratoryから入手した。実験に先立ち、マウスから糞便サンプルを採取し、1mLの滅菌PBSで糞便をホモジナイズした後、サンプルを連続希釈し、De Man, Rogosa, and Sharpe(MRS)寒天培地(BD Difco #288210 )にプレーティングすることにより、初期乳酸菌レベルを測定した。嫌気条件下で一晩培養した後、コロニー形成単位(CFU)を算出し、乳酸菌のコロニー形成レベルを求めた。マウスの初期体重も測定した。その後、治療を開始する前に、群間で体重や乳酸菌量に有意差が生じないようにマウスを群に割り付けた。
雌雄C57BL/6J Ppargfl/flVillincre/-および同腹子Ppargfl/flVillincre/-(コントロール)マウスは、Ppargfl/flマウス(The Jackson Laboratory、#004584)とPpargfl/flVillincre/-マウスの交配によりVanderbilt University Medical Centerで作製した38。マウスは3週齢で離乳させ、以下に述べる治療群のいずれかに割り付けた。
60%脂肪食(HF)(Research Diets Inc.、#D12492)または10%脂肪対照食(LF)(Research Diets Inc.、#D12450J)のいずれかを5週間摂取させた。LFまたはHF食マウスの群には、実験期間中、飲水に低用量のペニシリン(Sigma Aldrich #P1382 )(LDP)(6.67mg/L10)を、または0~5日目、15~20日目、30~35日目に飲水に臨床用量のペニシリン(0.167g/L73)を投与した。長期実験では、マウスにLFまたはHF食、あるいはLFまたはHF食にLDPを加えたものを5週間与えた後、HFまたはLF単独食に切り替えてさらに5週間与えた。Ppargfl/flVillincre/-マウスと同腹のPpargfl/flVillin-/-マウスは、HF食を与えたC57BL/6Nマウスと同程度の体重になるまでさらに時間を要したため、HF食またはHF食とLDP処理で6週間維持した(データは示さず)。一部の実験では、飲料水に10 mM D-(+)-3-フェニル乳酸(Sigma-Aldrich #376906 )を5週間添加した。
C57Bl/6N無菌マウス(Taconic、B6NTac - GF)は社内で繁殖させ、3週齢で陽圧ケージシステムに移した。
実験期間中、マウスの体重を毎週測定した。マウス群の食物消費量を週2回測定し、群またはケージ重量で正規化した。さらに、実験に応じて毎週または隔週に糞便サンプルを採取し、MRS寒天培地にプレーティングして乳酸菌量を測定した。5、8、10週後、マウスを約6時間絶食させてから、グルコメーターで空腹時血糖を測定した。
実験終了時(食餌および抗生物質投与開始後5週または10週)、マウスはCO2投与により人道的に安楽死させた。その後、血清、回腸(遠位小腸)内容物、回腸組織(後述の上皮分離用)、および病理組織学、IHC、オイルレッド染色用のサンプルを採取した。肝臓と脂肪組織はRNA抽出のために急速冷凍した。さらに、マウスの精巣上体(腹部)脂肪を除去し、重量を測定した。
細菌培養条件
本研究で使用した菌株を表S1に示す。乳酸菌株は、MRSブロス(BD Difco # 288130)中、またはMRS寒天プレート上で、37℃で嫌気的に定常増殖させた。大腸菌Mt1B1はLBブロス(BD Difco #244620 )中、37℃で好気的に増殖させた。Clostridium clostridioformeおよびClostridium sporogenesは、5%(v/v)の脱脂ヒツジ血(Thermo Scientific #R54016 )を添加したBrain Heart Infusion (BHI) 寒天培地(BD Difco #211059 )上で37℃で嫌気的に増殖させ、単一コロニーをSupplemented Brain Heart Infusion (BHIS) 培地に接種した75。Streptococcus daniellae ERD01Gは、Tryptic Soy Broth (TSB) (BD Difco #211825 )中、37℃で嫌気的に培養した。Staphylococcus xylosus 33-ERD13Cは、LBブロス(BD Difco #244620 )中、37℃で好気的に培養した。
マウス小腸上皮細胞
MSIE細胞はFan Yang博士のご厚意により提供されたもので、IFN-γ誘導性H-2Kbプロモーターと温度感受性シミアンウイルス40(SV40)ラージT抗原の制御下で、熱可逆性変異(tsA58)を保有する6~8週齢のC57BL/6マウスの小腸から以前に作製された67。MSIE 細胞は、5% ウシ胎児血清(Gibco #16140071 )、5 U/ml のマウス IFN-γ(R&D Systems #485 -MI)を添加した RPMI 1640 培地(Gibco #11875093 )で定常的に培養した、 100U/mlのペニシリンとストレプトマイシン(Gibco #15140122 )、5μg/mlのインスリン、5μg/mlのトランスフェリン、5ng/mlのセレン酸(Sigma-Aldrich #I3146 )を添加し、5% CO2下、33℃(許容温度)で培養した。細胞は2~3日ごとに継代した。MSIE細胞を12ウェルプレート(1 x 105 cells/ウェル)または6ウェルプレート(6 x 105 cells/ウェル)に播種し、コンフルエントになるまで(通常2~3日)培養した後、処理した。
Caco-2細胞培養
Caco-2細胞(ATCC #HTB -37)をCaco-2細胞培養培地(Minimal Essential Media (MEM) (Gibco #11090081 )、10% Fetal Bovine Serum (Gibco #16140071 )、1% Glutamax (Gibco #35030061 )、1% MEM Nonessential Amino Acids (Corning #11140050 )、および1% Sodium Pyruvate (Gibco #11360070 ))中で37℃、5% CO2で培養した。細胞はATCCのプロトコールに従ってT75フラスコで3-4日ごとに継代した。脂質分泌アッセイでは、70-80%コンフルエントのT75フラスコを希釈し、コラーゲンでコートした0.4μm孔径のインサートを含む12ウェルトランスウェルプレート(Corning Costar #3493 )に約1×105個の細胞を播種した。細胞は、2日ごとに培地を交換しながら、トランスウェルプレート上で14日間分化させた。免疫蛍光実験では、70~80%コンフルエントのT75フラスコを希釈し、約6×105個の細胞を6ウェルプレートのガラスカバースリップに播種した。
マウス腸管
腸管は10-12週齢の雌性C57BL/6Jマウスから作製した。マウスを人道的に安楽死させ、回腸を摘出し、氷冷PBSで洗浄した後、開腹した。組織をPBS中の0.5%漂白剤で5分間インキュベートした後、PBS中の0.1mg/mL Primocin(InvivoGen #ant -pm-05)でリンスした(PBS/P)。その後、回腸をキレート緩衝液(PBS中1Mジチオスレイトールおよび20mM EDTA/EGTA)中で4℃、30分間穏やかに揺することにより、組織から陰窩を単離した。上清を捨て、さらにPBS/Pを加えてから組織を激しく振盪した。上清を70μmのフィルターで濾過し、500×gで5分間スピンした。細胞ペレットをPBS/Pとマトリゲル(Corning #356234 )に再懸濁した(マトリゲルの最終濃度は約80%)。30μLの混合液を6ウェル非組織培養処理プレート(6ドメス/ウェル)に分注し、37℃で固化するまでインキュベートした。その後、培地(Intesticult(Stemcell Technologies #06005 )、10μM Y-27632(bio-techne|TOCRIS#1254)、Primocin)を加え、腸溶菌を37℃、5%CO2で2日間培養した。Y-27632は2日後に除去した。培地は2-3日ごとに交換し、腸内細菌は7-10日ごとに継代した。腸オルガノイドは、マトリゲルからオルガノイドを解離し、TrypLE Express (Gibco #12604013 )を添加することにより継代した。
分化した腸管小体(継代後10~14日目)を10μMのロシグリタゾン(Sigma-Aldrich #R2408 )または5mMのPLAで処理し、24時間インキュベートした。培地は8時間ごとに補充した。その後、オルガノイドをマトリゲルから解離し、細胞ペレットからRNAを抽出した(Norgen BioTek Corp.#17200)。
方法の詳細
体組成
マウスを5週間、HF食またはHF食とLDPに曝露した。その後、麻酔をかけたマウスを犠牲にする前に、Faxitron UltraFocus(Hologic社製)を用いて二重エネルギーX線吸収測定(DEXA)を行った。装置は、オフセット画像、ダーク画像、フラットフィールド画像について、メーカーが提供する方法で測定前に較正した。
オイルレッドO染色
肝臓の一部を最適切断温度(O.C.T.)コンパウンド(Fisher Scientific #23730571 )で凍結し、厚さ5μmの切片を切り出し、スライドにマウントした。スライドは染色まで-80℃で保存した。脂質を染色するため、スライドを室温に戻し、10%中性緩衝ホルマリン溶液に10分間入れた。可視化にはNewcomer Supply Tech Oil Red O, Propylene Glycol staining kit(Newcomer Supply #12772B )を使用した。その後、スライドを水性マウントメディウムでカバースリップした。盲検化された組織切片の採点は、表S4に示す基準に基づいて獣医病理学者が行った。代表的な画像はLeica DM750顕微鏡とLeica ICC50Wカメラで撮影した。
16s rRNA配列決定およびデータ解析
5週間の実験終了時に遠位小腸の内容物を採取し、氷上で保存した。その後、DNeasy PowerSoil Kit(Qiagen #47016 )を用い、製造元の指示に従ってサンプルからDNAを抽出した。シークエンシングライブラリーは、Earth Microbiome Projectのウェブサイトで公開されているプロトコールとプライマーを用いてカリフォルニア大学サンディエゴ校(UCSD)Microbiome Coreで調製し、製造元の指示に従ってIllumina NovaSeq 6000でシークエンシングを行った。その他のサンプルはSeqmaticによりIllumina MiSeqでシーケンスした。シングルエンド配列はQIIME2(バージョン2022.2)にインポートした。リードは品質スコア25を下回る領域を除外するためにトリミングした。各データセットのフィーチャーテーブルを構築し、ノイズ除去後にマージした。データは最小リード量に基づいて希釈化された。その後、系統樹を構築し、Silva遺伝子分類器に基づいて分類を割り当てた。食事または低用量ペニシリン投与に基づく腸内細菌叢組成の変化を同定するために、シュードカウントを追加し、ANCOMを実行した。分類レベル5(属)、6(科)、2(門)についてフィーチャーテーブルを作成。折りたたんだ各特徴量表に擬似数を追加し、各実験変数について前回と同様にANCOMを実施。距離行列(jaccard、bray-curtis、weighted、unweighted)をQIIME2からエクスポートし、R-studioでさらに処理。アルファ多様性指標(Shannon、Faith_pd、Observed features)は、下流のアプリケーション用にQIIME2から抽出した。各距離行列に対してPERMANOVAを実施し、各距離行列に基づいて非計量的多次元尺度構成法(nmds)プロットを作成した。
L. murinus特異的qPCR
小腸におけるL. murinusの存在量を測定するため、Yildezら76 のプロトコルを参考にした。簡単に説明すると、L. murinus(3週齢の雄性C57BL/6Nマウス(#027)から採取した分離株、Genewizによるコロニーの16S rRNA配列決定により種を同定)を用いて、DNA(ng)とCFUの相関を作成した。L. murinusをMRSブロスで一晩嫌気培養した後、1mLの培養液を連続希釈し、MRS寒天培地にプレーティングしてCFUを測定した。L.murinusの培養液1mLを溶解し、PureLink Genomic DNA Mini Kit(Invitrogen #K1820 -01)を用いてゲノムDNAを抽出した。L.murinusのCFU/ngは、上記の結果を用いて3連で算出した。
DNeasy PowerSoil Kit を用いて、遠位小腸の内容物から DNA を抽出した。Lactobacillus species77またはL. murinusの16S rRNA遺伝子に特異的なプライマー(表S2)をiQ SYBR Green Supermix(Bio-Rad #1708882 )と組み合わせ、小腸内容物またはL. murinus gDNAの標準曲線から20 ngのDNAを得た。定量的 PCR(qPCR)は、以下の熱サイクリングプログラムを用いて実施した:95℃、5 分間の初期変性ステップ、95℃、30 秒間の変性、60℃、60 秒間のアニーリング/伸長を 40 サイクル。そして、上記のように算出した相関を用いて、CFU/ng の小腸内容物 DNA を算出した。
L.murinusのPenRによるHFおよびLDP処置マウスのコロニー形成
上記のマウス実験で用いた低用量のペニシリンに耐性を持つL. murinus株を作成するため、L. murinusの単一コロニーを、50μg/Lのペニシリン(Sigma Aldrich #P1382 )を含むMRSブロスに接種した。24時間後、培養物を100μg/Lのペニシリンを含むMRSブロスに1:100で希釈した。L.murinusが6.67mg/Lのペニシリンを含むMRSブロスで増殖するまで、培養液をペニシリンの濃度を増加させながら継代した。単一コロニーを分離するために、継代したL. murinusを6.67mg/Lのペニシリンを含むMRS寒天培地にプレーティングした。シングルコロニーを新鮮なMRSブロスに接種し、培養液をグリセロールストックとした。
マウスにL. murinus PenR(後述の菌株世代)をコロニー形成させるため、Charles River Laboratoryの3週齢の雄性C57BL/6Nマウス(#027)にL. murinus PenRを胃内接種した(0.1 mL MRSブロス中1 x 109 CFU)。コロニー形成後48時間で、マウスはHF食に切り替えられ、飲料水にLDPが与えられた。マウスにL. murinus PenRを胃内投与した(0.1 mL MRSブロス中1 x 109)。
胆汁酸塩とペニシリンによる細菌培養
ペニシリン、胆汁酸塩、脂質、またはその組み合わせに暴露したときの細菌の増殖を測定するために、細菌種を以下のように培養した: L.murinusをMRS寒天培地に播種し、単一コロニーをMRSブロスで培養を開始した。一晩培養したものを4,000 x gで5分間遠心分離して回収し、ペレットを1 mLの新しい培地に懸濁した。600 nmの光学密度(OD600)を測定し、OD600 = 0.1に調整した。その後、OD600 = 0.001まで再度希釈した。ペニシリン(Sigma Aldrich #P1382 )のストックをdH2O中250 mg/Lの濃度で調製し、アッセイで試験した濃度の10倍のバッチをMRSブロス(pH = 6.4)で作製した。胆汁酸塩(Sigma Aldrich #B8756 )は250 mMの濃度でdH2Oに溶解し、MRSブロス(pH = 6.4)で0.9375 mMの濃度に希釈した。脂質混合物(Sigma Aldrich #L0288 )をMRSブロスで12.5%(v/v)の濃度に希釈した。未処理菌種の増殖を測定するため、96ウェルプレート中の90μlの培地に10μlの調整済み細菌培養液を添加した。細菌増殖に対するペニシリンの影響を測定するために、10μlの10倍ペニシリンストックを、10μlの調整済み細菌培養物と80μlの培地を含むウェルに添加した。細菌増殖に対する胆汁酸塩の影響は、0.9375mMの胆汁酸塩を含む培地80μlを、調整した培養液10μlとプレーン培地10μlに添加して測定した。脂質が細菌の増殖に及ぼす影響は、12.5%の脂質を含む培地80μlを、調整した培養液10μlとプレーン培地10μlに添加して測定した。ペニシリンと胆汁酸塩、またはペニシリンと脂質の組み合わせが細菌増殖に及ぼす影響を測定するために、調整培養10μl、10xペニシリンストック10μl、および0.9375mMの胆汁酸塩、または12.5%の胆汁酸塩を含む培地80μlを合わせた。プレートを37℃で嫌気培養した。OD600は、Epoch 2プレートリーダー(BioTek)を用いて24時間、1時間ごとに測定した。In vitro増殖アッセイは、コロニーを変えて3連で行った。
無菌マウス実験
C57Bl/6N無菌マウス(自社コロニー)に、小腸の微生物叢を代表する定義された微生物叢を3週齢でコロニー形成させた。定義された微生物叢には、以下の細菌が1 x 109 CFU含まれていた: Muribaculum intestinale、Clostridium clostridioforme、Clostridium sporogenes、Streptococcus daniellae ERD01G。Ligilactobacillus murinus(単離および特性は後述)を、マウスのサブセットについて定義された微生物叢(1 x 1010 CFU)に添加した。無胚芽マウスに0.1mLの定義された微生物叢を胃内接種し、5日間チャウ食で維持した。その後、コロニー形成したマウスに大腸菌Mt1b1を1 x 108 CFU投与し、48時間後にHF食(Research Diets社、D12492i)に切り替えた。マウスはHF食で5週間維持された。L. murinusでコロニー形成されたマウス群には、引き続き1 x 1010 CFUの細菌を毎週経口投与し、L. murinusを飲料水にも供給した(1 x 108 CFU/mL)。
病理組織学的分析
遠位小腸の組織を10%中性緩衝ホルマリンで固定し、パラフィン包埋して厚さ5μmの切片を切り出し、スライドにマウントしてヘマトキシリン・エオジンで染色した。盲検化された組織切片の採点は、表S3に示す基準に基づいて獣医病理学者が行った。代表的な画像はLeica DM750顕微鏡とLeica ICC50Wカメラを使用して撮影した。
腸細胞の分離
マウスから回腸(遠位小腸)を取り出し、縦に開いてから冷リン酸緩衝生理食塩水(PBS)(Gibco #14190144 )に入れた。チューブを静かに4回転倒させた。次に組織を、解離試薬#1(30mM EDTA、1.5mM DTT、PBS中pH8)を含む15mL円錐遠心チューブに入れ、氷中に埋めて20分間インキュベートした。その後、組織をあらかじめ加温(37℃)した解離試薬#2(30mM EDTA、PBS中pH8)を入れた新しい15mL円錐遠心チューブに移し、サンプルを37℃で10分間インキュベートした。インキュベーション後、サンプルの入ったチューブを30秒間激しく振り、基底膜から上皮を遊離させた。細胞懸濁液を新しい15 mLコニカル遠心チューブに移し、残存組織を残し、800 x g、4℃で5分間遠心して細胞をペレット化した。上清を除去し、細胞ペレットを液体窒素で瞬間凍結し、その後のRNA抽出またはトリグリセリド測定に用いた。
RNA抽出と定量的リアルタイムPCR
肝組織および腸細胞ペレットをFastPrep-24を用いてホモジナイズし、製造業者のプロトコールに従ってTRIzol法(Invitrogen #15596018 )によりRNAを単離した。脂肪組織はFastprep-24を用いてホモジナイズし、RNAはQIAzol Lysis Reagent(Qiagen #79306 )を用いて製造業者のプロトコールに従って単離した。RNAはiScript gDNA Clear cDNA Synthesis Kit (Bio-Rad #1725035 )を用いて逆転写した。定量的リアルタイムPCRは、iQ SYBR Green Supermix(Bio-Rad #1708882 )と適切なプライマーセットを用いて行った(表S2)。相対的遺伝子発現は、ハウスキーピング遺伝子としてAct2bを用いて計算した。
RNA配列決定
RNAは上記のように腸細胞ペレットから抽出し、Vanderbilt Technologies for Advanced Genomics (VANTAGE)で塩基配列を決定した。VANTAGEはmRNA濃縮を行い、鎖状mRNA(polyA-selected)ライブラリー調製キット(New England BioLabs #E7760 )を用いてcDNAライブラリーを調製した。その後、Illumina NovaSeq 6000でペアエンド150bpでシーケンスし、サンプルあたり平均25Mリードをターゲットとした。結果は、Vanderbilt Technologies for Advanced Genomics Analysis and Research Design(VANGARD)で以下のように解析した。Cutadapt(v2.10)によりアダプターをトリミングした。トリミング後、リードはSTAR (v2.7.3a)68を用いてマウス参照ゲノムGRCm38.p6にマッピングし、featureCounts (v2.0.0)69を用いて定量した。WebGestaltR (v0.4.4)を用いて、Gene OntologyとKEGGに対する機能濃縮解析を行った。Gene Ontology解析は、オンラインツールDavid Bioinformatics Resources (https://david.ncifcrf.gov/)を用いて行った。
脂質測定
HF食またはHF食とLDPに5週間暴露した後、マウスを一晩絶食させ、CO2により人道的に安楽死させた。血漿を採取し、中性脂質(Cell Biolabs STA-617)、トリグリセリド(Cell Biolabs STA-396)、遊離脂肪酸(Cell Biolabs STA-618)、またはコレステロール(Cell Biolabs STA-390)を適切な測定キットを用いて測定した。絶食マウスから腸細胞を上記のように採取し、細胞溶解液中のトリグリセリドを測定した。トリグリセリドの濃度は、標準的なBradfordアッセイ(Bio-Rad #5000006 )によって決定された細胞溶解液中のタンパク質存在量に対して正規化された。
腸内脂肪吸収の非侵襲的測定
食餌性脂肪吸収の測定は、Jandacekら78 のプロトコールに基づいて行った。5週間の投与後、マウスを清潔なケージに入れ、ショ糖ポリベヘネートを含む飼料(Research Diets, Inc.) マウスは24時間後に再び清潔なケージに移され、ショ糖ポリベヘネートを含む飼料で維持された。ショ糖ポリベヘネートを与えて3日目に、動物を清潔なケージに入れる前に、マウスから糞便を採取した。給餌4日後、糞便を再度採取した。
糞便サンプルをメタノール性水酸化ナトリウムで鹸化して遊離脂肪酸を得、これを14% BF3メタノールでメチル化して脂肪酸メチルエステルを生成した。その後、ヘキサンを用いて脂肪酸メチルエステルを抽出した。脂肪酸はガスクロマトグラフィーを用いて検出し、標準物質および内部標準物質と比較した。脂肪吸収のパーセンテージは、食餌中および糞便中の総脂肪酸とベヘン酸の比率に基づいて決定された。
経口脂肪負荷試験
マウスにHF食またはHF食とLDPを5週間与えた後、6時間絶食させた。その後、マウスに0.5g/kgのチロキサポール(Sigma Aldrich #1704003 ;滅菌PBSに溶解)を腹腔内注射し、その30分前に胃内投与で200μlのオリーブ油を与えた。オリーブオイル投与2時間後に尾部から血液を採取した。その後、サンプルを4℃で20分間、1000 x gで回転させ、上清を回収し、-80℃で保存した。血清中のトリグリセリドは後述の方法で測定した。
PPAR-γ免疫染色
遠位小腸の一部を10%中性緩衝ホルマリンで固定し、パラフィン包埋して厚さ5μmの切片を切り出し、スライドにマウントした。スライドをLeica Bond-Rx IHC Stainerにセットした。脱水、クリアリング、カバースリップ以外のすべての工程をBond-Rx上で行った。スライドを脱パラフィンした。Bond Max 上で Epitope Retrieval 2 solution(Leica Biosystems #AR9640 )を用いて 20 分間、熱による抗原回収を行った。スライドをプロテインブロック(Agilent DAKO # x0909)に10分間置いた。その後、スライドをPowerVision Block(Leica Biosystems #PV6122 )に60分間置いた。切片を1:100に希釈した抗PPARγ(Santa Cruz Biotechnology #sc -7273)と30分間インキュベートした。Bond Refine Polymer detection system(Leica Biosystems #DS9800 )を用いて可視化した。スライドを脱水し、透明にしてカバースリップした。盲検化された組織切片の採点は、表S5に示す基準に基づいて獣医病理医が行った。代表的な画像はLeica DM750顕微鏡とLeica ICC50Wカメラで撮影した。
Caco-2細胞における脂質分泌アッセイ
分化Caco-2ウェルを、3μM GW9662(Sigma-Aldrich #M6191 )、生きたL. murinus(上記のように調製)、3μM GW9662(Sigma-Aldrich #M6191 )と生きたL. murinusの両方、または5mM D-(+)-3-フェニル乳酸(Sigma-Aldrich #376906 )のいずれかで16時間処理した。脂質ミセルは、無血清Caco-2細胞培養培地を用いて、既述のように調製した22,23,79。0.6mMのオレイン酸(Sigma-Aldrich #O1008 )、2mMのタウロコール酸ナトリウム(Sigma-Aldrich #86339 )、0.2mMの2-モノ-オレオイルグリセロール(Sigma-Aldrich #M7765 )、0. 05mMコレステロール(Sigma-Aldrich #C8667 )、0.2mM L-α-リゾホスファチジルコリン(Sigma-Aldrich #L4129 )、0.02mM BODIPY C12脂肪酸(Invitrogen #D3835 )を細胞の先端コンパートメントに加えた。10分間のインキュベーション後、脂質ミセルを含む培地を除去し、無血清Caco-2細胞培養培地と交換した。脂質ミセル添加の4時間後と6時間後に、基底コンパートメントから150μLを除去し、50μLを黒色96ウェルプレートのウェルに3回に分けて添加した。蛍光を測定した(励起は548 nm、発光は578 nm)(BioTek)。
PPAR-γ蛍光染色
MSIE細胞またはCaco-2細胞を上記のようにカバースリップに播種し、48時間インキュベートした。その後、細胞をモック処理するか、生きたL. murinus(上記のように調製)、L. murinusまたは大腸菌Mt1B1上清(上記のように調製)、または5 mM D-(+)-3-フェニル乳酸(Sigma-Aldrich #376906 )で16時間処理した。すべての条件は20mM HEPES(ギブコ#15630080)で緩衝化した。処理後、培地を除去し、細胞を4%パラホルムアルデヒド(Electron Microscopy Sciences #15710 -S)で37℃で15分間固定した。その後、細胞をPBS(Gibco #14190144 )で5分間3回洗浄した。その後、細胞を0.1% Triton X-100(Acros Organics #AC327371000 )で15分間処理し、PBS(Gibco #14190144 )で5分間3回洗浄した。細胞を5%BSA(Alfa Aesar #J64655 )で1時間ブロックした後、抗PPAR-γ(Santa Cruz Biotechnology #sc -7273)(1:50希釈)と室温で1時間インキュベートした。一次抗体とのインキュベーション後、細胞をPBS(Gibco #14190144 )で5分間3回洗浄し、ヤギ抗マウスIgG Alexa Fluor 488(Invitrogen #A -11001)(1:1000希釈)を加え、室温で1時間インキュベートした。カバースリップをPBS(Gibco #14190144 )で洗浄した後、Alexa Fluor 546-Phalloidin(Thermo Fisher #A22283 )またはAlexa Fluor 647-Phalloidin(Thermo Fisher #A22287 )を20分間添加した。その後、カバースリップをPBS(Gibco #14190144 )で洗浄し、ProLong Diamond Antifade Mountant with DAPI(Molecular Probes #P36962 )でスライドガラスにマウントした。Zeiss LSM880 Airyscan共焦点顕微鏡を用いてイメージングを行った。405, 488, 561, 645 nmのレーザーとPlan Fluor 40X/ 1.30 NA液浸対物レンズを装備したNikon A1顕微鏡を用いて、論文に示した代表的な画像を収集した。すべての顕微鏡モダリティにおいて、画像取得中の画像取得パラメータはサンプル間で一致させた。画像はFIJI/ImageJソフトウェア(NIH)を用いてコントラストを強調し、トリミングした。核内PPAR-γの存在量は、FIJI/ImageJ測定ツールとDAPI染色核の寸法を用いて算出した。
PPARレポーターアッセイ
80~90%コンフルエントのCaco-2細胞を96ウェルプレートに約1×104個/ウェルの濃度で播種した。播種から48時間後、Caco-2細胞を含むウェルに、Lipofectamine 3000(Thermo Fisher L3000008)を用いて、150 ngのPPRE x3-TK-Luc80を製造者の指示に従ってトランスフェクトした。一晩インキュベートした後、トランスフェクトした細胞をモック処理、または8mM酪酸ナトリウム(Acros Organics #263191000 )、または生きたL. murinusで5時間処理した。その後、培地を除去し、細胞を100μlのPBSで洗浄した。その後、細胞を溶解し、ルシフェラーゼアッセイ基質(Promega #E1500 )をメーカーの指示に従って添加した。その後、プレートリーダー(BioTek)を用いてルシフェラーゼを測定した。
細菌株と腸管上皮細胞の共培養
in vitro実験では、以下のように菌株を一晩培養した: L. murinusはMRSブロスで嫌気的に増殖させ、E. coli Mt1B1とS. xylosus 33-ERD13CはLBブロスで好気的に増殖させた。一晩培養したものを4000 x gで5分間静置し、菌体を回収した。その後、L. murinusをCaco-2細胞培養培地でOD = 1に、大腸菌Mt1B1をOD = 0.025に、S. xylosus 33-ERD13CをOD = 0.05に調整した。大腸菌およびS. xylosus 33-ERD13Cの細胞培養培地中での増殖能のため、菌株は異なる開始濃度に調整された。細菌株をCaco-2細胞またはMSIE細胞に添加して共培養実験を行った。16時間の共培養後、菌株間で同様の細菌量が観察された。乳酸菌および大腸菌Mt1B1上清を調製するために、Caco-2培地にL. murinusの単一コロニーを接種し、好気的(37℃、5%CO2)に24時間培養した。その後、4000×gで5分間培養し、上清をフィルター滅菌した(孔径0.2μm)。使用した上清の量は、2つの異なる菌株を使用した場合、細菌培養のODで正規化した。生菌培養液と上清の両方は、20 mM HEPESを用いて緩衝化した。MSIE細胞を生きた細菌培養物とともに16時間インキュベートし、その後、細胞からRNAを抽出するか(Norgen BioTek Corp.#17200)、細胞をPPAR-γについて染色した(プロトコールは後述)。Caco-2細胞を生きた細菌またはその上清と16時間インキュベートした後、細胞をPPAR-γで染色した(プロトコールは後述)。
非標的メタボロミクス
質量分析用の Optima グレードの LC-MS 溶媒は、米国 Thermo Fisher Scientific 社から購入した(Thermo Fisher Scientific, Waltham, MA)。個々の同位体標識標準物質は、Cambridge Isotope Laboratories (Tewksbury, MA) および CDN Isotopes (Pointe-Claire, Quebec, Canada) から購入した。
メタボロミクス試料の調製
500μlの氷冷溶解バッファー(1:1:1:2、v:v:v:v、アセトニトリル:メタノール:炭酸水素アンモニウム0.1M - pH 8.0)中で凍結マウス腸内容物サンプル(n=20、各サンプル群について5生物学的複製)を溶解し、プローブチップソニケーターを用いて50%出力で個別に超音波処理した(10パルス)。溶解バッファーには同位体標識標準物質(n=2)を含み、サンプルプロセスのばらつきを測定した(表S6参照)。ホモジナイズしたサンプルは、各サンプルが等量の組織を含むように、最小量の組織サンプルの重量で正規化した。800μLの氷冷メタノールを加え、-80℃で一晩インキュベートすることにより、個々のサンプルからタンパク質を沈殿させた。沈殿したタンパク質を遠心分離(15,000 rpm、15 分間)によりペレット化し、代謝物抽出物を減圧乾燥し、-80℃で保存した。個々のサンプルを 100 μL の逆相液体クロマトグラフィー再構成バッファー(0.1%ギ酸を含むアセトニトリル/水、3:97、v/v)に再構成し、同位体標識標準物質(n=2)を加えて装置のばらつきを評価した(表 S6 参照)。プールされた品質管理(QC)サンプルは、再構成後に各サンプルから等量(10 μL)をプールして調製した。
メタボロミクスに基づく逆相液体クロマトグラフィー高分解能タンデム質量分析
調製したサンプルは、Vanderbilt Center for Innovative Technology(CIT)において、逆相クロマトグラフィー負イオン化法の改良版を用いてRPLC-HRMS/MSで分析した81。代謝物は、Thermo Fisher Scientific(マサチューセッツ州ウォルサム)のHypersil Gold C18カラム(100 x 2.1 mm、粒子径1.9 μm)で、ギ酸(0.1%)を両移動相に添加した水/アセトニトリル勾配を用いて分離した。サンプルは、Xcalibur 4.4ソフトウェア(マサチューセッツ州ウォルサム)で制御されたThermo Fisher Scientific Vanquish UHPLCバイナリーシステムとオートサンプラーを装備した高分解能Thermo Fisher Scientific Q-Exactive HFハイブリッド四重極-オービトラップ質量分析計(ドイツ、ブレーメン)で分析した。液体クロマトグラフィーは、溶媒A(水中0.1%ギ酸)と溶媒B(80:20アセトニトリル:水中0.1%ギ酸)を用い、Popayらの既述のようにグラジエントの長さを30分とし、250μL min-1で行った81。溶媒とカラムは45℃に保持した。
質量分析(フルMS)分析(注入量5μL)は、最大分解能120,000のネガティブイオンモードで取得し、m/z 70からm/z 1050まで、スキャンレート3.5 Hz、自動ゲインコントロール(AGC)ターゲット1 x 106、最大イオン注入時間100 msでスキャンした。MS/MSスペクトルは、分解能15,000、AGCターゲット2 x 105イオン、最大イオン注入時間100 msで収集した。プールQCサンプルは、カラムコンディショニング(各サンプルの分析前に10倍のプールQCサンプルを、5サンプルごとに2倍のプールQCサンプルを注入)、リテンションタイムのアライメント、およびサンプルセット全体の質量分析装置の再現性(バッチ内)を評価するために使用しました。プールQCサンプルで分析プラットフォームを調整した後、合計20サンプル(ランダム注入1x)をRPLC-HRMS/MS分析で分析しました。分析法の性能を評価するために、品質保証(QA)を実施した。さらに、システム適合性サンプル(LCMS QC標準物質、Waters Corporation、マサチューセッツ州ミルフォード)を使用して、サンプルバッチ分析前後の保持時間、ピーク形状、面積の安定性を検証した。
メタボロミクスデータの処理と統計解析
Progensis QI v. 3.0 (Non-linear Dynamics, Waters Corporation, Milford, MA)を用いて、RPLC-HRMS/MSデータからスペクトルの特徴(リテンションタイム、m/zペア)を抽出した。簡単に言うと、各サンプルタイプから5つ(n=5)の生物学的複製からのデータがインポートされ、処理され、正規化(統合)され、レビューされた。すべてのMSおよびMS/MSサンプルランは、プールされたQCサンプルリファレンスランに対してアライメントされた。スペクトルの特徴(リテンションタイム、m/zペア)は、化合物または代謝物を生成するために、さらに脱アダクトおよび脱アイソトープされました。データは、QAを適用することでさらに精査されました。具体的には、プールされた QC サンプル中の変動係数 (CV) が 25% を超えるスペクトル特徴を持つ化合物または代謝物を除去しました (合計: 2270 代謝物)。データは Progenesis QI を使用してすべての化合物に正規化しました。
主成分分析(PCA)を使用して、データセット内の異常値を同定および除去した(図 S8A 参照)。Metaboanalyst 5.0 でヒートマップ解析を行い、データをパレートスケーリングし、ピアソン距離と平均クラスタリングを使用して対数変換し(図 S8B 参照)、実験グループ間の代謝物アバンダンスに基づく差異を図示した。サンプルプロセスおよび装置の変動性も評価し(表 S6 参照)、サンプルおよびバッチの受容性を決定した。簡単に説明すると、サンプルプロセスのばらつきと装置のばらつきの QA メトリクスは、それぞれ≤ 25% CV と ≤ 10% CV です。これらの研究では、外れ値として同定されたサンプルはなかった。統計解析は、一元配置分散分析(ANOVA)検定によってp値を計算するために、対数正規化によって達成された分散安定化測定値を使用してProgensis QIで実行されました。有意に変化した代謝物は、p値<0.05および|fold change|>2の基準で選択された。
暫定的アノテーション(レベル3、L3)および推定アノテーション(レベル2、L2)は、Progenesis QIソフトウェア内で、正確な質量測定(誤差5ppm未満)、同位体分布の類似性、保持時間のマッチング、およびHuman Metabolome Database(HMDB)82、METLIN83、National Institute of Standards and Technologydatabase84、および社内ライブラリに対するデータベース検索を使用したフラグメントスペクトルのマッチングを用いて決定した。アノテーション(レベル1~3)85 は、上記のライブラリまたはデータベースを検索して、有意な代謝物について決定した。有意差のある化合物の代謝物アノテーション(HF食とHF食+LDP処理マウスの一対比較)を表S7に示す。MSデータはmetabolomics Workbenchの公開リポジトリにあり、データセット識別子はST002186である。
定義された微生物叢上清の調製
定義された微生物叢の培養上清中のPLAを測定するために、大腸菌Mt1B1でコロニー形成する前に、上記の定義された微生物叢(L. murinusを含む、または含まない)でコロニー形成したgnotobioticマウスから糞便サンプルを採取した。糞便サンプルは1gの糞便を25mLのPBSに懸濁し、50%の滅菌グリセロールと1:1の割合で合わせた。1mLの糞便サンプル(L. murinusを含むか含まないか)を用いて、10mLの嫌気性アッカーマニサ培地に接種した。培養は48時間嫌気培養した。48時間後、4000 x gで10分間培養した。得られたペレットをMRSブロスに再懸濁し、Caco-2培地(48時間嫌気培養済み)の5mLアリコート3個に分けた。培養液を16時間培養した後、4000 x gで10分間破砕した。上清をフィルター滅菌し、以下に記載するようにPLAを測定した。
フェニル乳酸の測定
抽出と標準化
腸内容物を秤量し、250mMリン酸ナトリウムpH2.5で緩衝化した水/アセトニトリル(3:2)で最終濃度40mg/mLに希釈し、セラミックビーズ(直径2.8mm)とビーズミル4ホモジナイザー(Thermo Fisher; Waltham, MA)を用いてホモジナイズ/抽出した。不溶性の残渣は遠心分離(10,000 x g、30分、5℃)で除去した。上清は清潔なエッペンドルフチューブに移し、分析日まで-20℃で保存した。
LC-HRMS分析
3-フェニル乳酸(PLA)および重水素標識内部標準物質(PLA-d3)を、試薬ダンシルヒドラジンおよびカルボキシル活性化剤1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)で誘導体化し、対応するダンシルヒドラゾン誘導体とした。EDCの酸性条件下での安定性には限界があるため、EDCのストック溶液は水で新たに作り、すぐに使用した。簡単に説明すると、解凍した抽出物の25μLアリコートを2nmol PLA-d3でスパイクし、ホモジナイズバッファーで1:3に希釈し、ダンシルヒドラジン(25μL×50mg/mL)およびEDC(25μL×150mg/mL)で室温で誘導体化した。室温で1時間後、500mMのグルコースを含む25μLのメタノール/水(1:1)を加え、過剰の試薬をクエンチした。遠心分離(10,000 x g、30分、5℃)後、クエンチした反応混合物を、低容量ポリプロピレンインサートとテフロンライニングゴムセプタを備えた2mLオートサンプラーバイアルに移した。サンプル注入量は10μLであった。PLAキャリブレーションスタンダードは水で調製し、同様の方法で誘導体化した。LC-HRMS分析は、Vanquish Horizon HPLCシステム(Thermo Fisher)に接続したThermo Q Exactive HFハイブリッド四重極/オービトラップ高分解能質量分析計を用いて行った。質量分析計はポジティブイオンモードで動作させ、30,000の分離能、2.0 m/zの分離ウインドウで特定のプリカーサーイオンをターゲット選択イオンモニタリング(t-SIM)検出し、以下のHESIソースパラメータを設定した:スプレー電圧4 kV、キャピラリー温度300℃、HESI温度100℃、SレンズRFレベル50、N2シースガス40、N2補助ガス10、スイープガス2.0、インソースCIDオフ。PLAおよびPLA-d3について、以下の精密質量および±5ppmの質量公差で抽出イオンクロマトグラムを作成した: PLA: [M+H]+ 414.1482; PLA-d3: [M+H]+ 417.1670。データ取得と定量スペクトル解析は、それぞれThermo Xcalibur version 4.1.31.9とThermo LCQuan version 2.7を用いて行った。検量線は、0.010~1000μMの11種類の検量線標準物質について、分析物濃度に対するピーク面積をプロットして作成した。濃度範囲にわたる分散の均一性を維持するために、線形最小二乗回帰分析で1/C2の重み付け係数を適用した。すべてのクロマトグラフィー分離には、Acquity BEH C18逆相分析カラム(2.1 x 100 mm, 1.7 μm, Waters, Milford, MA)を使用した。移動相は、(A)水中および(B)CH3CN中の0.2 % HCOOHで構成された。グラジエント条件は以下の通り: 0-1.0分、B = 5 %; 1-6分、B = 5-95 %; 6-8分、B = 95 %; 8-8.5分、B = 95-5 %; 8.5-12分、B = 5 %。流速は300μL/minに維持され、クロマトグラフィーの総実行時間は12分であった。各クロマトサイクルの0~4.5分および6.5~12分のLC溶離液を廃液にするために、ソフトウェア制御のディバーターバルブを使用した。
定量と統計解析
比率(mRNA相対発現、PPRE活性、BODIPY C12分泌)の倍数変化、ならびに腹部脂肪率、空腹時グルコース、PLA濃度(相対濃度および絶対濃度)、および細菌量は、統計解析の前に対数変換した。PPAR-γ核強度の定量化のために、DAPI染色した核内のPPAR-γ蛍光シグナルの積分密度を測定した。その後、統計解析の前に積分密度を対数変換した。グループ間の差が統計的に有意(p < 0.05)であるかどうかを判定するために、変換後のデータに対して、対応のないスチューデントのt検定を用いた。3群以上の比較は、一元配置分散分析にTukeyの多重比較検定またはŠídákの多重比較検定を加えて行った。2つの独立変数を含む複数群間の比較が評価された場合、群間の統計的に有意な差は、二元配置分散分析(ANOVA)後にTukey'sまたはŠídák'sの多重比較検定によって決定された。病理組織学、PPAR-γ免疫組織化学、オイルレッドO染色における差の有意性は、両側ノンパラメトリック検定(Mann-Whitney)により決定した。
謝辞
NCI/NIHがんセンター支援助成金P30CA068485およびLeica Bond RXのShared Instrumentation助成金S10 OD023475-01A1の支援を受けたVanderbilt University Medical CenterのTranslational Pathology Shared Resourceに謝意を表したい。さらに、カリフォルニア大学サンディエゴ校(UCSD)Microbiome Coreに感謝したい。本書は、国立衛生研究所SIG助成金(S10 OD026929)から購入したIllumina NovaSeq 6000を使用し、UCサンディエゴ校IGM Genomics Centerで作成されたデータを含んでいる。この研究は、Vanderbilt大学のCenter for Innovative Technology(CIT)のリソースを一部利用した。著者らはまた、Vanderbilt Technologies for Advanced Genomics Analysis and Research Design(VANGARD)コア施設の専門的技術支援にも謝意を表したい。免疫蛍光画像は、Vanderbilt Cell Imaging Shared Resource(NIH助成金 CA68485, DK20593, DK58404, DK59637, EY08126)を用いて、Zeiss LSM 880 Airyscan共焦点顕微鏡(NIH助成金 1 S10 OD021630 1)を用いて収集した。C.D.S.は、NIH(T32AI112541および1F31AI161882-01A1)、2021-2022 Danone North America Gut Microbiome, Yogurt and Probiotics Fellowship、およびVICTR(VR55193およびVR54476)の支援を受けた。N.G.S.は、NIH T32研修助成金T32ES007028-46およびJames H. Gilliam Fellowships for Advanced Studyプログラムによるハワード・ヒューズ医学研究所のGT15104の支援を受けた。N.J.F.はNIH T32 training grant T32DK007673の支援を受けた。N.O.M.の研究室での研究は、退役軍人省(Department of Veterans Affairs)から資金提供を受けた(BX005699)。S.H.P.の研究室での研究は、退役軍人省(1IK2BX005401)およびヴァンダービルト大学メディカルセンター医学部からの資金提供を受けた。M.X.B.はHHMIフリーマン・フラボウスキー奨学生である。M.X.B.の研究室での研究は、The V Foundation for Cancer Research V Scholar grant(V2020-013)、NIH(R01DK131104-01および1R01AI168302-01A1)、The Pew Charitable Trusts(2022-A-19568)、およびVanderbilt Institute for Clinical and Translational Research(VICTR)(VR53102)から資金提供を受けた。本論文はHHMIのOpen Access to Publicationsポリシーに従う。HHMIの研究室長はこれまで、研究論文において、一般への非独占的CC BY 4.0ライセンスとHHMIへのサブライセンス可能なライセンスを付与してきた。これらのライセンスに従い、本論文の著者が受理した原稿は、出版後直ちにCC BY 4.0ライセンスで自由に利用できる。
著者の貢献
M.X.B.とC.D.S.が本研究を企画・立案した。C.D.S.、J.M.、N.G.S.、E.S.、J.T.がすべての実験を行った。W.Y.、G.N.F.、T.P.T.、N.J.F.、J.K.Z.は実験デザインとデータ収集を手伝った。M.W.C.はフェニル乳酸の測定を行った。S.G.C.、S.D.S.、J.A.M.はアンターゲットメタボロミクスのサンプル調製、データ取得、データ解析を実施した。T.T.H.とS.H.P.はDEXAスキャンを行った。F.Y.は、MSIE細胞を用いたすべての実験デザインおよびデータ収集に協力した。N.O.M.は、マウス腸管の培養に関する技術的専門知識と試薬を提供した。M.L.は腸内脂肪吸収の非侵襲的測定を行った。すべての著者がデータ解析と原稿作成に貢献した。原稿はC.D.S.とM.X.B.が執筆し、全著者が査読した。
利害関係
著者らは競合する利益はないと宣言している。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード: Acrobat PDFファイルのダウンロード (3MB)
ドキュメントS1。図S1-S8および表S1-S7。
ダウンロード アクロバットPDFファイルのダウンロード(7MB)
資料S2. 論文と補足情報。
データとコードの利用可能性
16S rRNAシーケンスデータは、European Nucleotide Archiveにアクセッション番号で寄託されている: ena:prjeb52997。RNAシーケンスデータはEuropean Nucleotide Archiveにアクセッション番号で寄託されている: ena:prjeb53157。質量分析データはMetabolomics Workbenchのパブリックリポジトリで利用可能で、データセット識別子はMetabolomics Workbenchである: ST002186。全てのデータセットが公開されている。本論文ではオリジナルコードは報告していない。本論文で報告されたデータの再解析に必要な追加情報は、要望があればリードコンタクトから入手可能である。
参考文献
1
T. ゲンソレン、S.S.アイヤー、D.L.カスパー、R.S.ブルンバーグ
幼少期の微生物叢によるコロニー形成が免疫系をどのように形成するか
Science, 352 (2016), pp.539-544, 10.1126/science.aad9378
ScopusGoogle Scholarで見る
2
C.L.メイナード、C.O.エルソン、R.D.ハットン、C.T.ウィーバー
腸内細菌叢と免疫系の相互作用
Nature, 489 (2012), 231-241頁, 10.1038/nature11551
スコープで見るGoogle Scholar
3
M. デリエン、A.S.アルバレス、W.M.デ・ヴォス
生後10年間の腸内細菌叢
Trends Microbiol., 27 (2019), pp.997-1010, 10.1016/j.tim.2019.08.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
4
J. Roswall, L.M. Olsson, P. Kovatcheva-Datchary, S. Nilsson, V. Tremaroli, M.C. Simon, P. Kiilerich, R. Akrami, M. Krämer, M. Uhlén, et al.
生後5年間の健康なヒト腸内細菌叢の発達軌跡
Cell Host Microbe, 29 (2021), pp.765-776.e3, 10.1016/j.chom.2021.02.021
e763
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
5
T. Yatsunenko, F.E. Rey, M.J. Manary, I. Trehan, M.G. Dominguez-Bello, M. Contreras, M. Magris, G. Hidalgo, R.N. Baldassano, A.P. Anokhin, et al.
ヒトの腸内細菌叢は年齢と地理に関係なく観察される
Nature, 486 (2012), 222-227頁, 10.1038/nature11053
Scopusで見るGoogle Scholar
6
N.A. Bokulich, J. Chung, T. Battaglia, N. Henderson, M. Jay, H. Li, A. D.L., F. Wu, G.I. Perez-Perez, Y. Chen, et al.
抗生物質、出生様式、および食事は、生後間もない時期におけるマイクロバイオームの成熟を形成する。
Sci. Transl. Med., 8 (2016), Article 343ra382, 10.1126/scitranslmed.aad7121
グーグル・スカラー
7
M.P.マクナマラ、J.M.シングルトン、M.D.キャドニー、P.M.ルーガー、J.ボーンマン、T.ガーランド
マウスの成体腸内細菌叢組成に及ぼす幼少期の欧米食と運動の影響
J. Exp. Biol., 224 (2021), Article jeb239699, 10.1242/jeb.239699
スコープで見るGoogle Scholar
8
C. チェリモ、C.A.カマルゴ・ジュニア、S.M.B.モートン、C.C.グラント
4歳までの繰り返し抗生物質曝露と4.5歳時の体格との関連性
JAMA Netw. Open, 3 (2020), Article e1917577, 10.1001/jamanetworkopen.2019.17577
Scopusで見るGoogle Scholar
9
K. コルペラ、A.サロネン、L.J.ヴィルタ、R.A.ケッコネン、K.フォルスルンド、P.ボーク、W.M.デ・ヴォス
フィンランドの就学前児童における生涯抗生物質使用と腸内細菌叢の関連性
Nat. Commun., 7 (2016), Article 10410, 10.1038/ncomms10410
スコープで見るGoogle Scholar
10
I. Cho, S. Yamanishi, L. Cox, B.A. Methé, J. Zavadil, K. Li, Z. Gao, D. Mahana, K. Raju, I. Teitler, et al.
幼少期の抗生物質がマウスの大腸マイクロバイオームと脂肪率を変化させる
Nature, 488 (2012), 621-626頁, 10.1038/nature11400
スコープで見るGoogle Scholar
11
L.M. Cox, S. Yamanishi, J. Sohn, A.V. Alekseyenko, J.M. Leung, I. Cho, S.G. Kim, H. Li, Z. Gao, D. Mahana, et al.
腸内細菌叢を発達の重要な時期に変化させると、代謝に持続的な影響を及ぼす
Cell, 158 (2014), 705-721頁, 10.1016/j.cell.2014.05.052
PDFで記事を見るScopusで記事を見るGoogle Scholar
12
W. Yoo, J.K. Zieba, N.J. Foegeding, T.P. Torres, C.D. Shelton, N.G. Shealy, A.J. Byndloss, S.A. Cevallos, E. Gertz, C.R. Tiffany, et al.
高脂肪食による結腸細胞の機能障害は、微生物由来のトリメチルアミンN-オキシドをエスカレートさせる。
サイエンス, 373 (2021), 813-818頁, 10.1126/science.aba3683
スコープで見るGoogle Scholar
13
P.J.ターンボー、F.ベッケド、L.フルトン、J.I.ゴードン
食事誘発性肥満は、マウス遠位腸内細菌叢の顕著だが可逆的な変化と関連している。
Cell Host Microbe, 3 (2008), 213-223頁, 10.1016/j.chom.2008.02.015
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
14
Y. Wang, D. Guglielmo, J.A. Welsh
米国の乳幼児期から就学前までの子どもにおける糖質、飽和脂肪、ナトリウムの摂取量、NHANES 2009-2014
Am. J. Clin. Nutr., 108 (2018), 868-877頁, 10.1093/ajcn/nqy168
PDFを見る記事を見るScopusGoogle Scholarで見る
15
R.M.ゼッツ、A.ストエズ、B.A.スミス、D.Y.ヒョン
外来での抗生物質の使用と抗生物質スチュワードシップの取り組み強化の必要性
Pediatrics, 141 (2018), Article e20174124, 10.1542/peds.2017-4124
スコープで見るGoogle Scholar
16
R. クララ、M.シューマッハー、D.ラマチャンドラン、S.フェデレ、J.P.クリーガー、W.ランガンス、A.マンスーリ
短期および中期の高脂肪食曝露に対する小腸の代謝適応
J. Cell. Physiol., 232 (2017), 167-175頁, 10.1002/jcp.25402
ScopusGoogle Scholarで見る
17
A.S.ゼンブロスキー、T.ダクイラ、K.K.ブーマン
食餌性脂肪に対する除脂肪および食餌誘導性肥満マウスの小腸の各部位における細胞質脂質滴の特性化
Am. J. Physiol. Gastrointest. Liver Physiol., 321 (2021), pp.G75-G86, 10.1152/ajpgi.00084.2021
スコープで見るGoogle Scholar
18
H. 近藤秀樹、峰岸祐介、小峰祐介、森貴志、松本郁夫、阿部和彦、時光勇夫、長谷知行、村瀬智也
肥満抵抗性A/Jマウスと肥満傾向C57BL/6Jマウスにおける腸内脂質代謝関連遺伝子の制御の違い
Am. J. Physiol. Metab., 291 (2006), pp. E1092-E1099, 10.1152/ajpendo.00583.2005
スコープで見るGoogle Scholar
19
K. Martinez-Guryn、N. Hubert、K. Frazier、S. Urlass、M.W. Musch、P. Ojeda、J.F. Pierre、J. Miyoshi、T.J. Sontag、C.M. Cham、他。
小腸内細菌叢は食事脂質に対する宿主の消化・吸収適応反応を制御する
Cell Host Microbe, 23 (2018), 458-469.e5頁, 10.1016/j.chom.2018.03.011
PDFで記事を見るScopusで記事を見るGoogle Scholar
20
I. セモワ、J.D.カルテン、J.ストンボー、L.C.マッキー、R.ナイト、S.A.ファーバー、J.F.ロールズ
ゼブラフィッシュにおける脂肪酸の腸管吸収と代謝を制御する微生物群
細胞宿主微生物, 12 (2012), pp.277-288, 10.1016/j.chom.2012.08.003
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
21
S. El Aidy, C.A. Merrifield, M. Derrien, P. van Baarlen, G. Hooiveld, F. Levenez, J. Doré, J. Dekker, E. Holmes, S.P. Claus, et al.
腸内細菌叢は、マウスの空腸粘膜において、慣行化に伴う代謝の大きな方向転換を引き起こす。
Gut, 62 (2013), 1306-1314頁, 10.1136/gutjnl-2011-301955
スコープで見るGoogle Scholar
22
A. タジ、J.R.アラウージョ、C.ミューレ、E.T.アレーナ、G.ニグロ、T.ペドロン、P.J.サンソネッティ
腸管細胞による脂質分泌の宿主-微生物叢制御の解明:腸内細菌ラクトバチルス・パラカゼイおよび大腸菌からの知見
mBio, 9 (2018), 10.1128/mBio.01493-18
e01493-e01418
グーグル スカラー
23
J.R.アラウージョ、A.タジ、O.バーレン=デフラヌー、S.ヴィシエ=ゲール、G.ニグロ、H.リカンドロ、S.デミニョ、P.J.サンソネッティ
常在細菌の発酵産物は腸細胞の脂質代謝を変化させる
Cell Host Microbe, 27 (2020), 358-375.e7頁, 10.1016/j.chom.2020.01.028
PDFで記事を見るScopusで記事を見るGoogle Scholar
24
C. Kappe, Q. Zhang, T. Nyström, A. Sjöholm
高脂肪食と抗糖尿病薬メトホルミンが循環GLP-1と腸管L細胞の相対数に及ぼす影響
Diabetol. Metab. Syndr., 6 (2014), Article 70, 10.1186/1758-5996-6-70
スコープで見るGoogle Scholar
25
E. Poteres, N. Hubert, S. Poludasu, G. Brigando, J. Moore, K. Keeler, A. Isabelli, I.C.V. Ibay, L. Alt, M. Pytynia, et al.
食事と抗生物質による腸内細菌叢の選択的地域変化
Front. Physiol., 11 (2020), Article 797, 10.3389/fphys.2020.00797
スコープで見るGoogle Scholar
26
Y. 村上洋一郎、田辺晋一郎、鈴木敏夫
高脂肪食による腸管透過性亢進はマウス大腸における胆汁酸の増加と関連している
J. Food Sci., 81 (2016), pp.H216-H222, 10.1111/1750-3841.13166
スコープで見るGoogle Scholar
27
D.I.アンダーソン、D.ヒューズ
亜致死レベルの抗生物質の微生物学的影響
Nat. Rev. Microbiol., 12 (2014), pp.465-478, 10.1038/nrmicro3270
スコープで見るGoogle Scholar
28
J. チェン、G.G.イン、W.J.デン
食品中の残留抗生物質:抽出、分析、およびヒトの健康への懸念
J. Agric. Food Chem., 67 (2019), pp.7569-7586, 10.1021/acs.jafc.9b01334
スコープで見るGoogle Scholar
29
A. Everard, L. Geurts, R. Caesar, M. Van Hul, S. Matamoros, T. Duparc, R.G. Denis, P. Cochez, F. Pierard, J. Castel, et al.
腸管上皮のMyD88は、栄養状態に応じて宿主の代謝を肥満へと切り替えるセンサーである
Nat. Commun., 5 (2014), Article 5648, 10.1038/ncomms6648
スコープで見るGoogle Scholar
30
Y. Wang, Z. Kuang, X. Yu, K.A. Ruhn, M. Kubo, L.V. Hooper
腸内細菌叢はNFIL3と概日時計を介して体組成を制御する
Science, 357 (2017), 912-916頁, 10.1126/science.aan0677
ScopusGoogle Scholarで見る
31
C.W. Ko、J. Qu、D.D. Black、P. Tso
腸内脂質代謝の制御:現在の概念と疾患との関連性
Nat. Rev. Gastroenterol. Hepatol., 17 (2020), 169-183頁, 10.1038/s41575-019-0250-7
スコープで見るGoogle Scholar
32
J.M. Ntambi、宮崎正弘、J.P. Stoehr、H. Lan、C.M. Kendziorski、B.S. Yandell、Y. Song、P. Cohen、J.M. Friedman、A.D. Attie
ステアロイル-CoAデサチュラーゼ-1の機能喪失はマウスの脂肪化を防ぐ
Proc. Natl. Acad. Sci. USA, 99 (2002), 11482-11486頁, 10.1073/pnas.132384699
スコープで見るGoogle Scholar
33
M.M. Hussain、R.K. Kancha、Z. Zhou、J. Luchoomun、H. Zu、A. Bakillah
カイロミクロンのアセンブリーと異化:アポリポタンパク質とレセプターの役割
Biochim. Biophys. Acta, 1300 (1996), pp.151-170, 10.1016/0005-2760(96)00041-0
スコープで見るGoogle Scholar
34
F. Mattijssen, S. Alex, H.J. Swarts, A.K. Groen, E.M. van Schothorst, S. Kersten
Angptl4は腸内脂質消化の内因性阻害因子として機能する
Mol. Metab., 3 (2014), 135-144頁, 10.1016/j.molmet.2013.11.004
PDFで記事を見るScopusで記事を見るGoogle Scholar
35
M. リネス、成澤慎一郎、J.L.ミラン、E.P.ウィドマイアー
マウス小腸におけるCD36とglobal intestinal alkaline phosphataseの相互作用と高脂肪食の影響
Am. J. Physiol. Regul. Integr. Regul. Physiol., 301 (2011), pp. R1738-R1747, 10.1152/ajpregu.00235.2011
Google Scholar
36
W.S. Lagakos、A.M. Gajda、L. Agellon、B. Binas、V. Choi、B. Mandap、T. Russnak、Y.X. Zhou、J. Storch
腸および全身のエネルギー恒常性維持における腸型および肝臓型脂肪酸結合タンパク質の異なる機能
Am. J. Physiol. Gastrointest. Liver Physiol., 300 (2011), pp.G803-G814, 10.1152/ajpgi.00229.2010
スコープで見るGoogle Scholar
37
H. Peng, T.Y. Chiu, Y.J. Liang, C.J. Lee, C.S. Liu, C.S. Suen, J.J. Yen, H.T. Chen, M.J. Hwang, M.M. Hussain, et al.
PRAP1は、MTTPを介した脂質輸送を促進することにより脂質吸収を促進する新規脂質結合タンパク質である
J. Biol. Chem., 296 (2021), Article 100052, 10.1074/jbc.RA120.015002
PDFで記事を見るScopusで記事を見るGoogle Scholar
38
M.X. Byndloss, E.E. Olsan, F. Rivera-Chávez, C.R. Tiffany, S.A. Cevallos, K.L. Lokken, T.P. Torres, A.J. Byndloss, F. Faber, Y. Gao, et al.
微生物叢が活性化したPPARγシグナルは、腸内細菌科細菌の異常増殖を抑制する
Science, 357 (2017), pp.570-575, 10.1126/science.aam9949
スコープで見るGoogle Scholar
39
S. Alex, K. Lange, T. Amolo, J.S. Grinstead, A.K. Haakonsson, E. Szalowska, A. Koppen, K. Mudde, D. Haenen, S. Al-Lahham, et al.
短鎖脂肪酸は、ペルオキシソーム増殖因子活性化受容体γを活性化することにより、ヒト結腸腺癌細胞におけるアンジオポエチン様4合成を刺激する。
Mol. Cell. Biol., 33 (2013), 1303-1316頁, 10.1128/MCB.00858-12
スコープで見るGoogle Scholar
40
K. Duszka, M. Oresic, C. Le May, J. König, W. Wahli
PPARγは腸上皮における長鎖脂肪酸プロセッシングを調節する
Int. J. Mol. Sci., 18 (2017), Article 2559, 10.3390/ijms18122559
スコープで見るGoogle Scholar
41
M. ネペルスカ、T.ド・ウータース、E.ジャクートン、F.ベゲ・クレスペル、N.ラパック、J.ドレ、V.アルランパラム、H.M.ブロティエール
常在腸内細菌は、ヒト腸管上皮細胞におけるリン酸化依存的PPARγ転写活性を調節する。
Sci. Rep., 7 (2017), Article 43199, 10.1038/srep43199
Scopusで見るGoogle Scholar
42
S. イラベニル、D.H.キム、M.ヴァラン・アラス、S.スリゴパラム、R.シヴァネサン、K.C.チョイ
乳酸菌由来フェニル乳酸はPPAR-γ2のアップレギュレーションを介して3T3-L1脂肪細胞の脂肪形成活性を促進する
Molecules, 20 (2015), 15359-15373頁, 10.3390/molecules200815359
スコープで見るGoogle Scholar
43
M. ディ・チェーザレ、M.ソリッチ、P.ボヴェ、J.J.ミランダ、Z.ブッタ、G.A.スティーブンス、A.ラクスマイア、A.P.ケングネ、J.ベンサム
小児期肥満の疫学的負担:緊急の対策が必要な世界的流行
BMC Med., 17 (2019), p. 212, 10.1186/s12916-019-1449-8
Scopusで見るGoogle Scholar
44
国民健康センター
国民健康・栄養調査2017-2020年3月プレパンデミックデータファイルの開発および特定健康アウトカムの有病率推定値
国民健康統計報告書
(2021), 10.15620/cdc:106273
Google Scholar
45
S. クマール、A.S.ケリー
小児肥満の総説:疫学、病因、合併症から臨床評価と治療まで
Mayo Clin. Proc., 92 (2017), 251-265頁, 10.1016/j.mayocp.2016.09.017
PDFを見る記事を見るGoogle Scholar
46
K.S.W.レオン、J.マクレイ、J.G.B.デレイク、S.ギブ、N.シャックルトン、R.W.テイラー、M.グローバー、R.オーダス、B.テイラー、B.J.ミルン、W.S.カットフィールド
出生前および小児期の抗生物質曝露と4歳時肥満との関連
JAMA Netw. Open, 3 (2020), Article e1919681, 10.1001/jamanetworkopen.2019.19681
Scopusで見るGoogle Scholar
47
疾病管理予防センター
外来抗生物質処方-米国
(2021)
https://www.cdc.gov/antibiotic-use/data/report-2021.html
グーグル・スカラー
48
F.A.デュカ、T.M.Z.ワイズ、W.T.ペプラー、T.K.T.ラム
小腸栄養センシングの代謝への影響
Nat. Commun., 12 (2021), p. 903, 10.1038/s41467-021-21235-y
スコープで見るGoogle Scholar
49
A. Veilleux, E. Grenier, P. Marceau, A.C. Carpentier, D. Richard, E. Levy
腸内脂質処理:ヒト肥満被験者におけるインスリンシグナル伝達異常の証拠とその意義
Arterioscler. Thromb. Vasc. Biol., 34 (2014), 644-653頁, 10.1161/ATVBAHA.113.302993
スコープで見るGoogle Scholar
50
W. 彼
脂肪組織特異的PPARγ遺伝子ターゲティング
Methods Mol. Biol., 952 (2013), 117-135頁, 10.1007/978-1-62703-155-4_8
スコープで見るGoogle Scholar
51
G.イェー、H.ガオ、Z.ワン、Y.リン、X.リャオ、H.チャン、Y.チー、H.チュウ、S.ドン
PPARαおよびPPARγの活性化は、Fatp1の発現抑制を介してマクロファージにおける総遊離脂肪酸およびトリグリセリドの蓄積を抑制する
Cell Death Dis., 10 (2019), p. 39, 10.1038/s41419-018-1135-3
スコープで見るGoogle Scholar
52
G.F.ルイス、K.ウッフェルマン、M.ナポリ、L.セト、M.ハイダリ、K.アデリ
インスリン抵抗性の構成要素として新たに認識された腸内リポ蛋白過剰産生は、インスリン感作薬ロシグリタゾンによって改善される:フルクトース給餌シリアンゴールデンハムスターを用いた研究
内分泌学, 146 (2005), 247-255頁, 10.1210/ja.2004-1143
スコープで見るGoogle Scholar
53
M.G.ドミンゲス-ベロ、E.K.コステロ、M.コントレラス、M.マグリス、G.イダルゴ、N.フィーラー、R.ナイト
分娩様式は、新生児における複数の体内生息環境にわたる初期微生物叢の獲得と構造を形成する
Proc. Natl. Acad. Sci. USA, 107 (2010), 11971-11975頁, 10.1073/pnas.1002601107
スコープで見るGoogle Scholar
54
M. ロッシ、D. マルティネス=マルティネス、A. アマレッティ、A. ウルリチ、S. ライモンディ、A. モヤ
メタゲノム全ゲノム配列の解析により、ヒト腸内細菌叢におけるラクトバチルス属の集団は優勢ではないが一定であることが明らかになった。
Environ. Microbiol. Rep., 8 (2016), 399-406頁, 10.1111/1758-2229.12405
スコープで見るGoogle Scholar
55
F. F. Fåk, F. Bäckhed
ラクトバチルス・ロイテリ菌は、Apoe-/-マウスにおいて、食事誘発性肥満を予防するが、動脈硬化は予防しない。
PLoS One, 7 (2012), Article e46837, 10.1371/journal.pone.0046837
スコープで見るGoogle Scholar
56
L. Aronsson, Y. Huang, P. Parini, M. Korach-André, J. Håkansson, J.Å. グスタフソン、S.ペッターソン、V.アルランパラム、J.ラフター
パラカゼイ乳酸菌による脂肪蓄積の減少は、アンジオポエチン様4タンパク質(ANGPTL4)レベルの増加と関連している。
PLoS One, 5 (2010), Article e13087, 10.1371/journal.pone.0013087
Google Scholar
57
W. Zhong、H. Wang、Y. Yang、Y. Zhang、H. Lai、Y. Cheng、H. Yu、N. Feng、R. Huang、S. Liu、et al.
高タンパク質食は、乳酸菌による脂質吸収促進を打ち消すことにより、ダイエット後の脂肪量増加を防ぐ。
Nat. Metab., 4 (2022), 1713-1731頁, 10.1038/s42255-022-00687-6
スコープで見るGoogle Scholar
58
F. カールソン・ヴィデフルト、I.オーランド、H.ステンルンド、O.ヘルネル、C.E.ウェスト
離乳期のプロバイオティクス:学齢期の体組成と代謝マーカーへの影響に関する追跡調査
Eur. J. Nutr., 54 (2015), 355-363頁, 10.1007/s00394-014-0715-y
スコープで見るGoogle Scholar
59
R. ルオト、M.カリオマキ、K.ライティネン、E.イソラウリ
過体重と肥満の発症に対する周産期プロバイオティクス介入の影響:出生から10年までの追跡調査
Int. J. Obes. (Lond), 34 (2010), 1531-1537頁, 10.1038/ijo.2010.50
スコープで見るGoogle Scholar
60
E.G. Zoetendal、J. Raes、B. van den Bogert、M. Arumugam、C.C. Booijink、F.J. Troost、P. Bork、M. Wels、W.M. de Vos、M. Kleerebezem
ヒト小腸内細菌叢は単純糖質の迅速な取り込みと変換によって駆動される
ISME J., 6 (2012), pp.1415-1426, 10.1038/ismej.2011.212
スコープで見るGoogle Scholar
61
O. Koren、A. Spor、J. Felin、F. Fåk、J. Stombaugh、V. Tremaroli、C.J. Behre、R. Knight、B. Fagerberg、R.E. Ley、F. Backhed
アテローム性動脈硬化症患者におけるヒト口腔、腸およびプラーク微生物叢
Proc. Natl. Acad. Sci. USA, 108 (2011), 4592-4598頁, 10.1073/pnas.1011383107
スコープで見るGoogle Scholar
62
B. C.ドローム、J.ドレ、P.ルノー、H.M.ブロティエール、E.ゲドン、N.ラパック
ヒト腸管上皮細胞におけるPPARγ転写活性を調節する常在性連鎖球菌サリバリウス
PLoS One, 10 (2015), Article e0125371, 10.1371/journal.pone.0125371
スコープで見るGoogle Scholar
63
M.X. Maldonado-Gómez、I. Martínez、F. Bottacini、A. O'Callaghan、M. Ventura、D. van Sinderen、B. Hillmann、P. Vangay、D. Knights、R.W. Hutkins、J. Walter
ヒト腸内におけるビフィドバクテリウム・ロンガムAH1206の安定した生着は、常在細菌叢の個体差に依存する
Cell Host Microbe, 20 (2016), pp.515-526, 10.1016/j.chom.2016.09.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
64
M.F. Laursen, M. Sakanaka, N. von Burg, U. Mörbe, D. Andersen, J.M. Moll, C.T. Pekmez, A. Rivollier, K.F. Michaelsen, C. Mølgaard, et al.
母乳育児に関連するビフィズス菌種は乳児の腸内で芳香族乳酸を産生する
Nat. Microbiol., 6 (2021), 1367-1382頁, 10.1038/s41564-021-00970-4
Scopusで見るGoogle Scholar
65
F. ヴァレリオ、P.ラヴェルミコッカ、M.パスカル、A.ヴィスコンティ
乳酸菌によるフェニル乳酸の生産:食品の品質と保存に貢献する菌株の選択へのアプローチ
FEMS Microbiol. Lett., 233 (2004), pp.289-295, 10.1016/j.femsle.2004.02.020
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
66
S. ユウ、チョウ、チャン、ジアン、ムー
ショートコミュニケーション ペディオコッカス・ペントサセウス(Pediococcus pentosaceus)SK25による実験室発酵過程における牛乳中の3-フェニル乳酸生産
J. Dairy Sci., 98 (2015), 813-817頁, 10.3168/jds.2014-8645
PDFで記事を見るScopusで記事を見るGoogle Scholar
67
R.H.ホワイトヘッド、P.E.ヴァニーデン、M.D.ノーブル、P.アタリオティス、P.S.ジャット
成体H-2Kb-tsA58トランスジェニックマウスの結腸および小腸からの条件不死化上皮細胞株の樹立
Proc. Natl. Acad. USA, 90 (1993), 587-591頁, 10.1073/pnas.90.2.587
スコープで見るGoogle Scholar
68
A. Dobin, C.A. Davis, F. Schlesinger, J. Drenkow, C. Zaleski, S. Jha, P. Batut, M. Chaisson, T.R. Gingeras
STAR:超高速ユニバーサルRNA-seqアライナー
バイオインフォマティクス, 29 (2013), pp.15-21, 10.1093/bioinformatics/bts635
スコープで見るGoogle Scholar
69
Y. Liao, G.K. Smyth, W. Shi
featureCounts:配列リードをゲノムの特徴に割り当てるための効率的な汎用プログラム
バイオインフォマティクス, 30 (2014), pp.923-930, 10.1093/bioinformatics/btt656
スコープで見るGoogle Scholar
70
M.I.ラブ、W.フーバー、S.アンダース
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定
Genome Biol., 15 (2014), Article 550, 10.1186/s13059-014-0550-8
スコープで見るGoogle Scholar
71
R. マーフィー、A.W.スチュワート、I.ブレイスウェイト、R.ビーズリー、R.J.ハンコックス、E.A.ミッチェル、ISAAC第3相研究グループ
乳児期の抗生物質治療と男児の肥満度増加:国際横断研究
Int. J. Obes. (Lond), 38 (2014), 1115-1119頁, 10.1038/ijo.2013.218
スコープで見るGoogle Scholar
72
A.E.サリネロ、B.M.アンダーソン、K.L.ズロアガ
食事誘発性肥満の代謝影響における性差は発症年齢によって異なる
Int. J. Obes. (Lond), 42 (2018), 1088-1091頁, 10.1038/s41366-018-0023-3
Scopusで見るGoogle Scholar
73
Y.R. Nobel, L.M. Cox, F.F. Kirigin, N.A. Bokulich, S. Yamanishi, I. Teitler, J. Chung, J. Sohn, C.M. Barber, D.S. Goldfarb, et al.
早期のパルス抗生物質投与による代謝およびメタゲノム学的転帰
Nat. Commun., 6 (2015), Article 7486, 10.1038/ncomms8486
スコープで見るGoogle Scholar
74
C. Eberl, D. Ring, P.C. Münch, M. Beutler, M. Basic, E.C. Slack, M. Schwarzer, D. Srutkova, A. Lange, J.S. Frick, et al.
オリゴマウス-微生物叢による無菌マウスの再現可能なコロニー形成(異なる動物施設において
Front. Microbiol., 10 (2019), Article 2999, 10.3389/fmicb.2019.02999
グーグル・スカラー
75
M.K.バチッチ、C.J.スミス
バクテロイデス属細菌の実験室での維持と培養
Curr. Protoc. Microbiol., Chapter 13 (2008), 10.1002/9780471729259.mc13c01s9
ユニット13C.1
Google Scholar
76
S. Yildiz, J.P. Pereira Bonifacio Lopes, M. Bergé, V. González-Ruiz, D. Baud, J. Kloehn, I. Boal-Carvalho, O.P. Schaeren, M. Schotsaert, L.J. Hathaway, et al.
呼吸器組織関連常在菌は肺炎球菌のコロニー形成に対する治療の可能性を提供する
eLife, 9 (2020), Article e53581, 10.7554/eLife.53581
Google Scholar
77
M. バルマン、D.ウノルド、K.シフリー、E.アミール、K.フン、N.ボス、N.サルツマン
腸管サルモネラ症はマウス消化管の微生物生態を破壊する
Infect. Immun., 76 (2008), 907-915頁, 10.1128/IAI.01432-07
スコープで見るGoogle Scholar
78
R.J.ジャンダチェック、J.E.ホイビ、P.ツォー
新規の非侵襲的腸管脂肪吸収測定法
Gastroenterology, 127 (2004), pp.139-144, 10.1053/j.gastro.2004.04.007
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
79
T. Pauquai, J. Bouchoux, D. Chateau, R. Vidal, M. Rousset, J. Chambaz, S. Demignot
腸管Caco-2細胞のグルコースへの適応は、小胞体内腔へのトリアシルグリセロールのターゲティングを通して、トリアシルグリセロールリッチリポ蛋白質の分泌を調節する。
Biochem. J., 395 (2006), pp.393-403, 10.1042/BJ20051359
スコープで見るGoogle Scholar
80
J.B.キム、H.M.ライト、M.ライト、B.M.スピーゲルマン
ADD1/SREBP1は内因性リガンドの産生を介してPPARγを活性化する
Proc. Natl. Acad. Sci. USA, 95 (1998), 4333-4337頁, 10.1073/pnas.95.8.4333
スコープで見るGoogle Scholar
81
T.M. Popay, J. Wang, C.M. Adams, G.C. Howard, S.G. Codreanu, S.D. Sherrod, J.A. McLean, L.R. Thomas, S.L. Lorey, Y.J. Machida, et al.
MYCは宿主細胞因子-1との相互作用を通してリボソーム生合成とミトコンドリア遺伝子発現プログラムを制御する
eLife, 10 (2021), Article e60191, 10.7554/eLife.60191
Google Scholar
82
D.S. Wishart, T. Jewison, A.C. Guo, M. Wilson, C. Knox, Y. Liu, Y. Djoumbou, R. Mandal, F. Aziat, E. Dong, et al.
HMDB 3.0--2013年のヒトメタボロームデータベース
ヒトのメタボロームデータベース(HMDB 3.0)を作成した。
スコープで見るGoogle Scholar
83
C.A. Smith、G. O'Maille、E.J. Want、C. Qin、S.A. Trauger、T.R. Brandon、D.E. Custodio、R. Abagyan、G. Siuzdak
Metlin:代謝物のマススペクトルデータベース
Ther. Drug Monit., 27 (2005), pp.747-751, 10.1097/01.ftd.0000179845.53213.39
スコープで見るGoogle Scholar
84
F. ジャブロンスキー、F.サルヴァット、C.J.パウエル、A.Y.リー
NIST標準参照データベース番号64
(2016), 10.6028/nist.nsrds.64
グーグル・スカラー
85
A.C.シュリンプ・ラトリッジ、S.G.コドレアヌ、S.D.シェロッド、J.A.マクリーン
非標的メタボロミクス戦略-課題と新たな方向性
J. J. Am. Soc. Mass Spectrom., 27 (2016), pp. 1897-1905, 10.1007/s13361-016-1469-y
スコープで見るGoogle Scholar
引用者: (0)
18
リードコンタクト
© 2023 The Author(s). 発行:エルゼビア社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
