
慢性疼痛に対する適度な身体ストレスは好機的な脳内報酬となる
運動誘発性痛覚鈍麻の脳メカニズム
運動が動物モデルや慢性疼痛患者において鎮痛効果(運動誘発性痛覚低下(EIH))を引き起こすことはよく知られていますが、これらのEIH効果の根底にある脳のメカニズム、特に痛みの感情的側面に関してはまだ完全には理解されていません。この総説では、EIH 効果の誘発を可能にする脳の中皮質大脳系の劇的な変化について説明します。扁桃体(Amyg)は、慢性疼痛と密接に関連する恐怖や不安などの感情を制御する重要なノードです。神経障害性疼痛 (NPP) モデルマウスを使用した最近の研究では、Amyg と EIH の効果の間の関連性を徹底的に調べました。われわれは、随意運動(VE)が、側坐核(NAc)側殻に突き出ている内側基底Amygのグルタミン酸(Glu)ニューロンを活性化する一方、Amygの中心核にあるGABAニューロンのNPP誘発性活性化をほぼ完全に抑制することを発見した( CeA)。さらに、VEは、文脈上の恐怖条件付けと恐怖記憶の想起において重要な役割を果たす海馬腹側CA1領域の錐体ニューロンの活性化を有意に阻害した。
痛みの慢性化の生物心理社会モデルでは、痛みの発生と維持における生物学的要因に加えて心理社会的要因の重要性が強調されています 。痛みに関連する心理的要因の中で、特に不安と恐怖(痛みの感情的側面)は、慢性痛の確立に重要な役割を果たしている可能性があります 。さらに、慢性疼痛患者では、壊滅的な痛みが一般的であり、痛みに対する不安と恐怖は、否定的な感情や脅迫的な病気の情報によってさらに強化されます 。その結果、患者の注意が痛みだけに限定されると、痛みの誘発を予測するあらゆる行動を回避し、身体活動の劇的な減少(不活動状態の確立)につながります。身体活動の不活発は、骨格筋機能の低下、うつ病、社会的引きこもりなどのいくつかの廃用症候群を引き起こす可能性があり、持続的な痛みによって強化される悪循環を引き起こす可能性があります 。Lethemらによって提唱された恐怖回避モデルは、慢性疼痛が不安、恐怖、痛みに関連する回避行動からなる悪循環によって確立されることを示唆しています。また、痛みを回避することを目的とした恐怖に誘発された行動は、慢性腰痛の悪化につながる危険因子となる可能性があると報告しています 。これらの発見は、慢性疼痛を軽減するための効果的な治療法には、痛みに関連した恐怖や不安によって引き起こされる回避行動を軽減する明確な方法が含まれるべきであることを示唆しています。これらの条件を満たす考えられる治療法は運動療法です。しかし、運動誘発性鎮痛効果(運動誘発性痛覚低下(EIH))の根底にある脳のメカニズム、特に痛みの感情的側面に関しては、まだ十分に理解されていません。中皮質大脳系の可塑性変化が慢性疼痛にどのような影響を与える可能性があるか検討する必要がある。さらに、随意運動(VE)は、慢性疼痛状態で機能不全に陥った中皮質大脳系を正常化できるだけでなく、文脈的恐怖条件付けによって獲得された恐怖記憶の消去を促進できることを実証した最近の研究がある。これらの発見は、EIH効果を生み出す脳メカニズムについての新たな洞察を提供し、慢性疼痛患者が恐怖回避行動を克服し、疼痛の慢性化の悪循環を止めることを可能にする可能性がある。
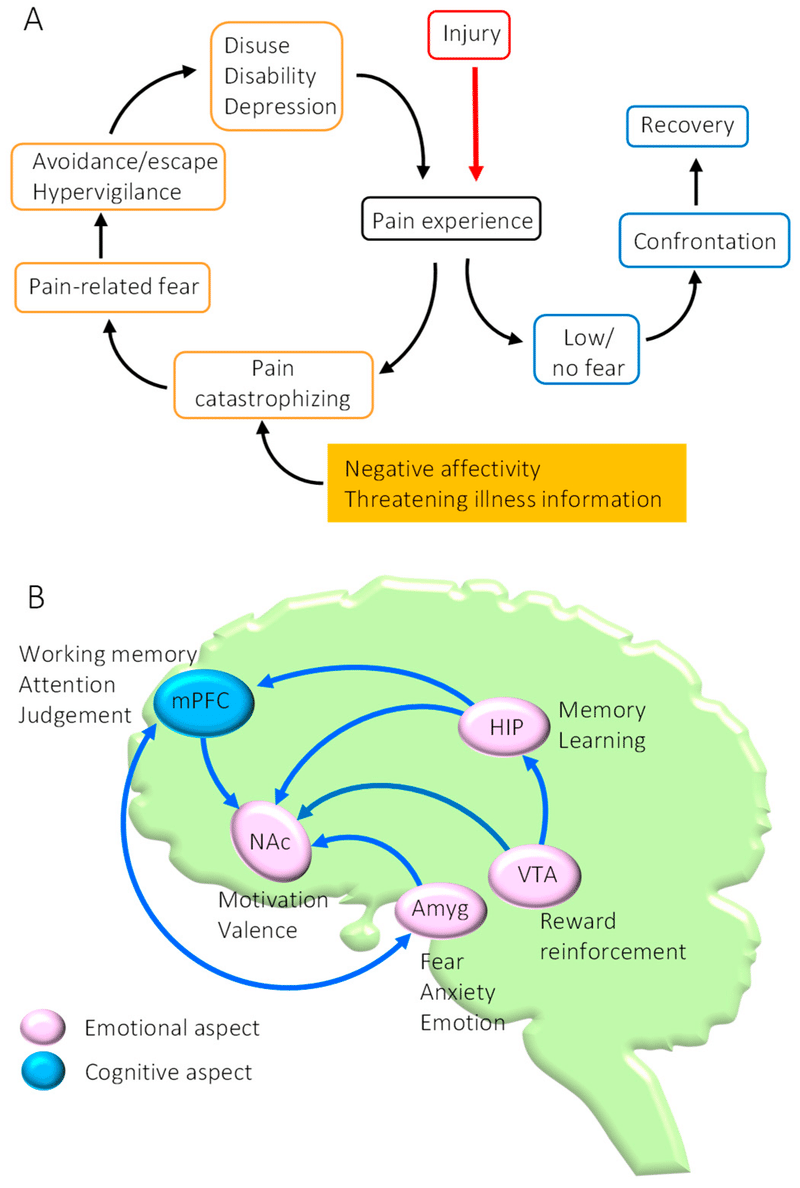
慢性疼痛状態における中皮質大脳辺縁系の機能不全
人間の脳画像研究の研究結果は、痛みの慢性化は、不安や恐怖などの痛みの感情的側面と密接に関連する脳領域の可塑的変化によって引き起こされることを示しています。これらの発見は、有害な刺激の強さだけが慢性疼痛の原因ではないことを示唆しています。特に、内側前頭前皮質(mPFC)、扁桃体(Amyg)、側坐核(NAc)、海馬(HIP)、腹側被蓋野(VTA)からなる脳の中皮質大脳辺縁系は、これらの領域は痛みの認知的および感情的側面と密接に関連しているため、痛みの慢性化が起こります 。この発見は、中皮質大脳系の機能不全が痛みの慢性化に重要な役割を果たしている可能性があることを実証しました 。哺乳類の mPFC は、辺縁前皮質 (PL) と辺縁下皮質 (IL) に分けられます。mPFCは、AmygおよびHIPによって強く神経支配されており、NAc、Amyg、および水道周囲灰色(PAG)。側底扁桃体 (BLA) のグルタミン酸作動性 (Glu) ニューロンの疼痛誘発性活性化は、mPFC 内のパルブアルブミン (PV) 発現 GABA 陽性介在ニューロンを活性化することができます 。一方、過剰活性化された BLA を薬理学的に阻害すると、 PL の Glu ニューロンの脱抑制により、痛みに関連した行動が抑制されます 。したがって、PV 発現 GABA 介在ニューロンの光遺伝学的阻害は、神経因性疼痛 (NPP) のげっ歯類モデルにおいて疼痛関連行動を軽減するが、光遺伝学的活性化は疼痛関連行動を悪化させることが明らかになった 。これらの発見は、mPFC における抑制性 GABA 介在ニューロンの活性化を介した mPFC Glu ニューロンのフィードフォワード阻害が、痛みの慢性化と悪化の強力なメカニズムであることを示しています 。神経障害性疼痛モデルマウスを用いた最近の研究では、PLの第2層/第3層の錐体ニューロンの興奮と第5層の錐体ニューロンの興奮が減少する一方、ILの同等のニューロンは影響を受けないことが明らかになった。さらに、PL の第 5 層の Glu ニューロンの光遺伝学的活性化は、痛みやうつ病に関連するいくつかの行動を抑制することが実証されました 。
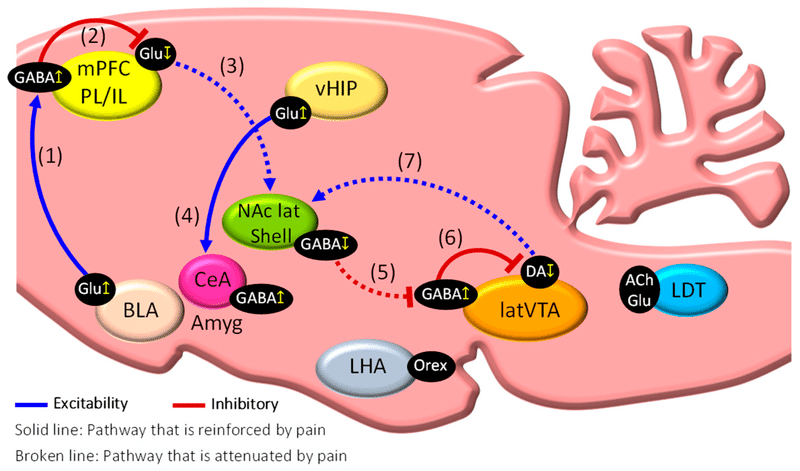
Amyg は主に、BLA、挿入細胞塊 (ITC)、および扁桃体中心核 (CeA) で構成されています。CeA はさらに、CeL (外側区画)、CeM (内側区画)、および CeC (嚢区画) に細分されます。過去の痛みを伴う経験や気分状態によって中枢神経系を介して修正された有害な情報は、BLA (BLA-CeA 経路) を介して CeA に受信されます。一方、末梢組織や臓器に由来する有害な情報は、脊髄後角を介して外側腕傍核(lPBN)に直接受信され、そこからCeAのCeCに送られます(lPBN-CeA経路)。内臓痛、ホルマリン誘発性炎症性疼痛、酸誘発性筋肉痛、関節炎痛、神経因性疼痛などのさまざまな痛み状態に苦しむ実験動物では、Amygニューロンが過剰活性化していることが証明されている。有害な刺激による BLA の Glu ニューロンの過剰興奮は、活性化された mPFC GABA 介在ニューロン (BLA-mPFC 経路) (フィードフォワード阻害) を介して mPFC Glu ニューロン を阻害し、その結果、 NAc GABA ニューロン (mPFC-NAc 経路) 。この有害な刺激による過剰興奮は、腹側 HIP (vHIP) の Glu ニューロンを興奮させ、その後 CeA (vHIP-CeA 経路) の GABA ニューロンを活性化します 。これらすべての出来事は、慢性的な痛みの状態を確立するために重要である可能性があります。一方、lPBN-CeA 経路の活性化は不安やうつ病などの嫌悪行動を引き起こしますが、BLA-CeA 経路の活性化は報酬に関連した行動を誘発し、不安やうつ病を軽減し、痛みの抑制を促進します 。したがって、BLAの異なるニューロンタイプは、それぞれ異なる投射標的を持ち、それぞれ痛みと痛覚鈍麻に密接に関連する嫌悪行動と報酬関連行動を差動的に制御するように作用する。
HIP (海馬) は、背側 HIP (vHIP) と腹側 HIP (vHIP) に分かれており、空間記憶、学習、恐怖、不安など、いくつかの認知機能および感情機能において重要な役割を果たしています。vHIP は mPFC と BLA によって強く神経支配されており、恐怖記憶と不安の発現に寄与する投影を mPFC、BLA、CeA に送ります 。海馬歯状回 (DG) の神経新生は NPP のマウスモデルで阻害されることが知られており 、この発見は慢性疼痛患者で観察される HIP 体積の減少を説明できる可能性がある 。NPP モデルマウスの HIP では腫瘍壊死因子 α (TNF-α) のレベルが増加します。野生型ラットの HIP への TNF-α の投与は、NPP モデルラットで見られるのと同様の疼痛関連行動を促進する一方、NPP モデルマウスにおける TNF 受容体-1 の発現低下は痛みの減少と関連していることが報告されています。これは痛みに関連した行動です 。
予備研究では、NPPモデルマウスのvHIP-CA1領域で活性化されたGluニューロンの有意な増加が検出されました(データは示されていません)。研究では、NPP モデルマウスでは状況に応じた恐怖記憶を消す能力が大幅に低下していることが示されました 。これらの発見は、NPP によって誘発される vHIP-CA1 領域の Glu ニューロンの活性化が「恐怖回避行動」の促進に重要な役割を果たしている可能性を示唆しています。
脳の報酬系は、側方 VTA (latVTA) から NAc 側殻 (NAc lat シェル) へのドーパミン (DA) ニューロンの投射経路で構成されており、この経路の活性化により、ポジティブな行動が促進され、学習と欲求が強化されます。NAc は報酬系の中核となる脳領域であり、価性 (適切な行動を選択する動機となる感情的価値) を制御し、私たちが外部環境に適応できるようにします。慢性疼痛患者ではlatVTAにおけるDAの産生が阻害されており、この阻害がうつ病の発症に寄与する可能性がある。さらに、latVTA の DA レベルがラット NPP モデルで大幅に減少し、機械的痛覚過敏を引き起こすことが示されています。さらに、NPP ラットのNAc にアポモルヒネ (D2/D1 アゴニスト) を直接注射すると、これを防ぐことができます。あるいは、VTA DA ニューロンは、latVTA にある GABA 介在ニューロンから強力な入力を受け取ります。痛みのエピソード中、NAc lat シェル内の GABA 陽性中型有棘ニューロン (MSN) の不活化により、latVTA 内の GABA ニューロンの脱抑制が促進されます。その結果、latVTA 内の活性化された GABA ニューロンは、NAc lat シェルに投射する VTA DA ニューロンを抑制します。その結果、NAc lat シェル (latVTA-NAc 経路) への DA の放出が下方制御され、痛みが増加します。したがって、GABA ニューロンを介した latVTA における DA ニューロンの阻害は、慢性疼痛患者における疼痛の慢性化における重要なメカニズムである可能性があります。
身体的ストレスや運動制限による痛みの慢性化のメカニズム
運動誘発性痛覚低下に関与する中枢神経系経路
「ランナーズハイ」という用語に反映されているように、運動はおそらく内因性オピオイドレベルの上昇とそれに続く人間のドーパミン受容体の活性化によって、短時間持続する多幸感を引き起こす可能性があります。したがって、オピオイド系とドーパミン作動系の間には密接な相互作用があり、身体活動に基づく動機付け行動を引き起こすと仮定されています。急性の身体活動は、視床下部 - 下垂体副腎 (HPA) 軸の活動を増加させる生理学的ストレスの一形態である可能性があり ( Dal-Zotto et al., 2000 )、長期ではなく短期的な車輪走行はストレスと嫌悪感を増加させます。条件付けされた場所選好パラダイムによって測定されるように、短期間ではなく長期間の自発的な回し車は、ラットの中脳辺縁系ドーパミン作動性システムの活性化を通じて報酬効果を生み出します(Greenwood et al.、2011)。さらに、自発的な運動は、報酬関連のシグナル伝達を活性化することにより、ラットの最も困難な条件下で薬物探索行動を減少させることができることが報告されています(Carroll、2021)。したがって、長期的な運動は、ドーパミン伝達の活性化を通じて感情状態を変化させる可能性があります。
これらの研究と一致して、適度な運動は腹側被蓋野(VTA) - 側坐核 (N.Acc.) 経路を活性化し、痛覚鈍麻を誘発することが報告されています。
随意輪行(VWR)が後背被蓋核(LDT)のコリン作動性ニューロンと外側視床下部(LH)のオレキシンニューロンを活性化し、興奮性相互作用を介して外側VTAのドーパミン作動性ニューロンを制御することを発見しました。最近の研究では、VTA-N.Acc の化学遺伝学的阻害が示されています。この経路は、トレッドミル運動下での神経障害性疼痛のマウスモデルで観察された鎮痛効果を有意に消失させた( Wakaizumi et al., 2016 )。これらの発見は、中脳辺縁系ドーパミン作動性ネットワークの活性化がEIHのメカニズムにとって重要であることを実証している。
さらに、運動は脊髄の中枢性感作にさまざまな影響を与えます。運動は、IL-4、IL-1ra、IL-5などの抗炎症性サイトカインのレベルを増加させ、NGFやBDNFなどの一部の成長因子の発現を低下させ、それによって神経因性疼痛の活性化を阻害することにより、神経因性疼痛を抑制することが報告されています。脊髄内のグリア細胞の解析 ( Almeida et al., 2015、Bobinski et al., 2018 )。Iba1陽性ミクログリアにおけるヒストン脱アセチル化酵素1の発現低下と、それに伴うH3K9の高アセチル化の促進もEIHに関与している( Kami et al., 2016a )。さらに、運動は、神経障害性疼痛様状態にある脊髄後角のGABA作動性介在ニューロンの機能不全の改善に寄与します( Kami et al., 2016b)。
運動に関連したエネルギー代謝と痛みの軽減
慢性疼痛のある高齢患者では、上肢と下肢の両方の骨格筋量が減少しています(Sakai et al., 2017 )。したがって、慢性疼痛患者では、運動制限により身体活動が低下すると、骨格筋量が減少する可能性があると考えられます。骨格筋は運動や姿勢制御だけでなく、体全体のエネルギー代謝においても中心的な役割を果たしています。最近、ミトコンドリアのエネルギー代謝が線維筋痛症の発現に関係していると考えられています(Gerdle et al., 2020、van Tilburg et al., 2020)。一方で、運動は骨格筋のミトコンドリア機能を改善することが明らかにされており( Feng et al., 2013 )、適度な運動と薬物療法の組み合わせが線維筋痛症の治療に効果的である可能性があることが示唆されています。さらに、 TRPA1 チャネルの発現と機能を調節する代謝センサーである AMP 活性化プロテインキナーゼ (AMPK) が、糖尿病の db/db マウスにおける疼痛閾値の低下に伴う異痛症の発症に寄与していることが最近判明しました。これは異常なエネルギー代謝 ( Wang et al., 2018、Wang and Dai, 2021 )。したがって、適度な運動により骨格筋量を維持し、エネルギー代謝を改善することが鎮痛に効果的な治療法であると考えられます。
運動による自律神経活動と痛みの軽減
痛みの情報は、体性感覚皮質、前頭前皮質、帯状皮質、視床下部、視床、脳幹などのさまざまな領域で処理されます。これらの痛みを感知する領域は、痛みマトリックスとも呼ばれ ( Tracey and Mantyh, 2007 )、自律神経プロセスと強く関連しています ( Dubé et al., 2009、 Piché et al., 2010、 Rouwette et al., 2012 )。このように、生体の構成要素は自律神経や痛みと相互作用しており、それらの相互作用は痛みの有無で大きく異なります。通常、急性の痛みは交感神経系の興奮を引き起こし、青斑核に由来する下行性ノルアドレナリン作動性系の活性化などの交感神経の興奮により痛みが軽減されます。しかし、慢性疼痛は、繰り返される痛み刺激により、自律神経系の正常な機能を大きく変化させます(Bingel et al., 2007、 Schlereth and Birklein, 2008 )。特に、線維筋痛症などの慢性疼痛によって誘発される交感神経系の活動亢進は、侵害受容性求心性神経を活性化し、これが広範な疼痛、痛覚過敏、および異痛症に対する反応の増大に寄与する( Martinez-Lavin, 2012 )。対照的に、慢性疼痛は疼痛反応に対する感受性を低下させ( Tousignant-Laflamme et al., 2006)、心拍数変動や圧反射感度の低下、交感神経系の反応潜時の延長などの自律神経反応も低下させることも実証されています(Tousignant -Laflamme et al.、2006、 El-Badawy および El Mikkawy、2016、 Bruehl et al.、2018 )。このように、慢性疼痛患者の心身状態は、痛みの感覚だけでなく、痛みによる自律神経の乱れなどの負のスパイラルに陥ってしまいます。このような慢性疼痛における自律神経の乱れに対して、慢性疼痛患者には適度な運動が有効な治療法であると考えられている。一般に、適度な運動は自律神経のバランスを交感神経優位に移行させ、運動後のゆっくりとした呼吸または深呼吸は自律神経のバランスをさらに副交感神経優位に移行させます ( Daniela et al., 2022))、適度な運動は乱れた自律神経バランスの回復に役立つことが示唆されています。さらに、適度な運動は、痛みを和らげるだけでなく、慢性疼痛患者の精神的健康と身体機能の改善にも効果的であることが実際に示されており(Frey and Schiltenwolf、2022)、これは、体の活動に影響を与える内因性エンドルフィンの放出を示唆しています。内因性オピオイド、5-HT およびカンナビノイド系が中枢神経系の鎮痛系に関与していることは十分に文書化されており、カンナビノイド受容体 1 (CB 1 ) および 5-HT 1A受容体は特に EIH に関連しているという仮説が立てられています。
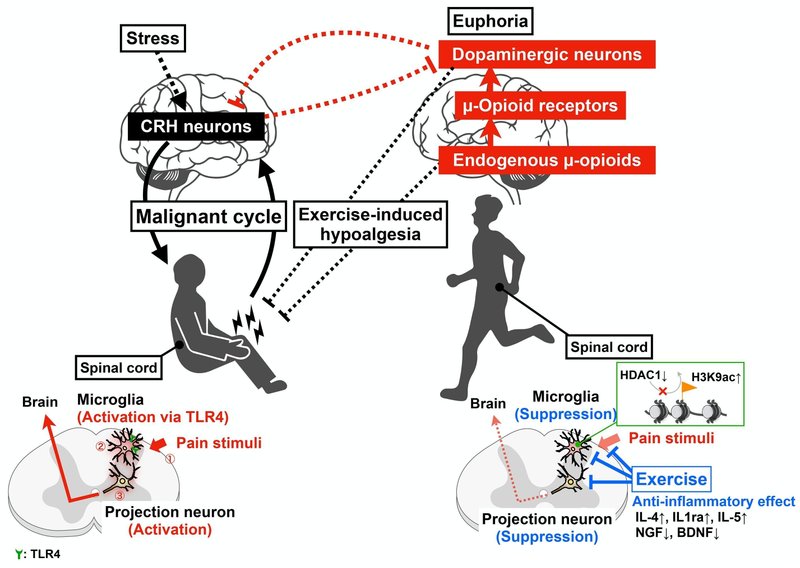
適度な運動は中脳辺縁系ドーパミン作動性ネットワークを活性化します。
脳の報酬回路の活性化は、運動誘発性の痛覚低下にとって重要です。
適度な運動は、ストレスによる身体的および感情的な乱れを回復します。
適度な運動は中脳辺縁系ドーパミン作動性ネットワークの活性化を誘導することで痛みを軽減できることがわかりました。この現象の根底には、痛みによって誘発される中脳辺縁系ドーパミン作動性ネットワークの機能不全が関与している。一方で、運動が制限される状況などのストレス下では、PVN CRHの発火が痛みの長期化を引き起こします。さらに、PVN CRH は中脳辺縁系ドーパミン作動性ネットワークも調節する可能性があります 。
これらの研究結果は、適度な運動は鎮痛だけでなくドーパミン関連の感情にも影響を与え、身体・精神機能の維持・向上にとって極めて重要であることを示しています。
この記事が気に入ったらサポートをしてみませんか?
