
腱の修復機転と血管形成
腱は血流に乏しい
腱は、筋力を効率的に骨に伝達する特殊な結合組織です。腱損傷は病院を受診する最も一般的な理由の 1 つであり、筋骨格系疾患の全症状の 30% を占めています ( Kaux et al., 2011 )。結合組織の固有の特性により、腱損傷の治癒には長いプロセスがかかります ( Evrova and Buschmann、2017 )。皮膚や骨などの他の高度に血管が発達した組織とは異なり、血管網が貧弱で代謝率が低い細胞は、固有の腱治癒能力が低く、腱再生の可能性が限られています(Tempfer and Traweger, 2015 ; Snedeker and Foolen , 2017 )。
腱の治癒は、炎症、増殖、リモデリングという 3 つの重複する段階に分けることができます。腱自体からの内因性腱細胞と外因性末梢線維芽細胞の両方が協力してそれを達成します(Wu et al., 2016 ; Korntner et al., 2019)。腱細胞の活動と腱内の血液供給により、固有の治癒が腱内で起こります。外因性治癒は、線維芽細胞、血漿、炎症細胞の内方成長、および腱外血管浸潤によってもたらされ、腱の外側に由来する物質によって調節される( Zhang et al., 2003 )。したがって、血管新生は腱治癒の最も初期の出来事の 1 つであり、血管新生によって線維芽細胞と炎症細胞が創傷部位に送達されることがわかります ( Petersen et al., 2003a )。血管新生には、酸素と栄養素の送達、老廃物の除去、調節因子の輸送、免疫応答の制御など、腱の治癒を促進する多くの役割があります(nakamura et al., 2008 ; Hall and Ran , 2010 ; Apte et al., 2019) 。さらに、血管分布が悪いと外傷後の腱の適切な修復が妨げられ、さらなる腱の脆弱化につながる可能性があると通常考えられています ( Korntner et al., 2019 )。
最近の研究では、生物学的療法が腱損傷の問題の克服に役立つ可能性があることを示唆しています。腱の修復をサポートするために研究されたアプローチの 1 つは、血管内皮増殖因子 (VEGF) などの増殖因子の適用です。VEGF は腱損傷直後に活性化し、さまざまなプロセスの機能に影響を与え続けます ( Molloy et al., 2003 )。腱損傷の直後、創傷部位の血小板によって分泌されるα顆粒は、VEGF、トランスフォーミング成長因子β(TGF-β)、線維芽細胞成長因子(FGF)、インスリン様成長因子などの多数の成長因子を放出する可能性があります。 IGF および血小板由来成長因子 (PDGF) ( Evrova and Buschmann、2017 )、それらの中で、VEGFは、健康および病気における血管形成を調節する最も重要な血管新生因子の1つである(Molloyら、2003年;Pufeら、2005年)。VEGFは、インビボで血管新生を促進し、血管壁の透過性、ならびに血管内皮細胞および血管周囲細胞の成長および増殖を促進することができ、後者は自己再生する(Molloy et al.,2003;Parsons-Wingerteretal.,2006) ; Wu et al.、2017 ; Peach et al.、2018)。さらに、VEGFは線維芽細胞の増殖を促進し、マクロファージおよび顆粒球に対して走化性を示し、他の成長因子の産生を開始することもできる( Zhang et al., 2003 ; Liu et al., 2021 )。

腱の治癒における内因性血管内皮増殖因子の役割
血管内皮増殖因子は、代謝要求とその機械的機能が制限されているため、健康な腱では完全視できます ( Pufe et al., 2005 )。それは、胚形成中に発現され、成人の体内の肺や腎臓などの少数の部位でのみ発現されます ( Schulze-Tanzil et al., 2011 )。しかし、その発現は、腱のさまざまな疾患状態中および腱の治癒中に再び増加します( Schulze-Tanzil et al., 2011 )。
腱損傷後の内因性VEGF含有量の変化に関する文献を検索し、さまざまな腱損傷モデルにおける腱損傷後の総VEGF濃度の変動傾向がまとめられています。 Boyer et al., 2001; Petersen et al . , 2003b ; Yoshikawa et al., 2006a ; Chen et al., 2008 ; Sahin et al., 2012 ; Stange et al., 2015 )。急性腱損傷後、通常、VEGF は一定期間にわたって増加します。たとえば、Boyer et al. (2001) は、腱切断後のさまざまな時点で犬の滑膜屈筋腱の VEGF レベルをテストし、損傷後 0 日目と 4 日目にはレベルがほぼベースラインに留まり、7 日目にピークに達し、その後着実に低下して 21 日目にベースラインに戻ることを発見しました。Stangeらは、ラット膝蓋腱の現場凍結モデルに腱障害を誘発することにより、手術後 7 日目に VEGF 合成が増加し、その後手術後 14 日目と 28 日目に大幅に減少したことを発見しました。ニワトリの深指屈筋腱の完全切断後の外科的修復のモデルにより、Chen et al. Petersen et al . (2008)は、VEGF 発現パターンの変化が 3 日目に大幅に上方制御され、その後 9 日目から 21 日目までに元のレベルに戻ったことを発見しました。腱損傷モデリングのための上記の直接外科的切開とは異なり、Petersen et al . (2003a)および吉川らは、前十字靱帯 (ACL) 再建後の自家腱移植片を研究し、VEGF の発現が遅く増加し (14 ~ 21 日目にほぼ最高)、その後徐々に減少することを発見しました。このモデリング方法により、腱の全体的な治癒時間が延長された可能性があります。
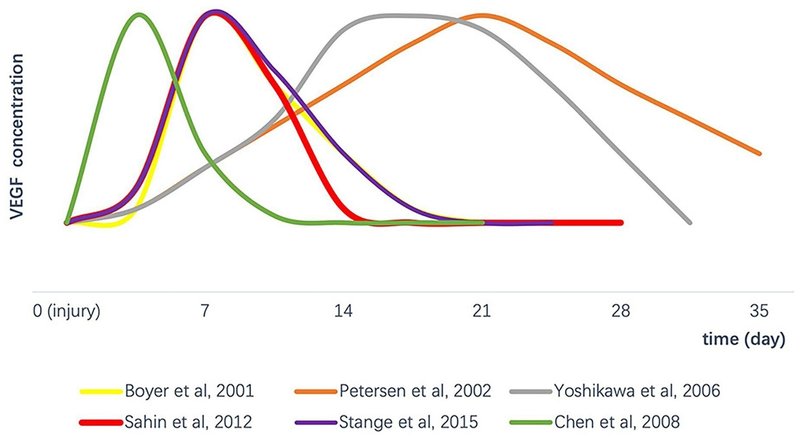
腱の治癒時間は、モデリング方法 (手術および移植片再建) または種 (ラット、ウサギ、イヌ、ニワトリなど) によって異なります。VEGF のさまざまなピーク期間が監視されましたが、それらの傾向はすべて、腱修復の増殖期の初期段階で最初に増加し、その後減少しました。さらに、このVEGF濃度の発現パターンは、腱修復部位で観察される新しい血管の数と一致している(Petersen et al.,2003b;Stange et al.,2015)。
腱損傷後にVEGFが変化する理由は、急性腱損傷と慢性腱損傷の両方で議論されています。VEGF 発現を上方制御できる要因は 4 つあります: 低酸素、炎症性サイトカイン、神経信号、機械的負荷 ( Pufe et al., 2005 ; Li et al., 2013 ; Halper, 2014 ; Rahim et al., 2016 )などです。まず、腱損傷後の組織の低酸素状態により、低酸素誘導因子 1 (HIF-1) の発現が増加し、次に VEGF 遺伝子の転写が誘導されます。第二に、炎症性サイトカイン [インターロイキン (IL)-1β、IL-6、IL-8 など] の放出も VEGF 合成を誘導します。さらに、腱損傷後、神経成長因子 (NGF) の発現増加により、神経線維の内方成長が著しく増加しました。神経由来VEGFの上方制御は血管新生に必要です。最後に、腱障害を引き起こすことが多い腱の使いすぎによる損傷では、機械的負荷が VEGF を上方制御する重要な要素となります。
外因性血管内皮増殖因子の送達は腱の治癒を促進する可能性がある
コーら。(2014) は、急性アキレス腱損傷のラットモデルを確立し、欠損内部への VEGF-111 の局所注射が、術後 15 日および 30 日で治癒中のアキレス腱の極限引張強度が強化され、腱の治癒が著しく促進されることを発見しました。機械的ストレスは、対照群と比較して修復の後期(30日)で増加しました。張ら。(2003)また、ラットの急性アキレス腱損傷に対する VEGF の効果を研究し、足底筋腱を保存した状態で VEGF を注射すると、手術後 1 週間および 2 週間の治癒初期段階での引張強度が大幅に向上することを発見しました。さらに、腱治癒過程の初期において、VEGF 治療腱では TGF-β の発現が大幅に上昇することが判明しました。
さらに、外因性 VEGF 送達の利点もTang らによって発見されました。(2016)およびMao et al。(2017)。タンら。(2016)鶏の屈筋腱の損傷モデルを確立しました。他の送達様式とは異なり、腱への VEGF の本質的な投与は、アデノ随伴ウイルス 2 型 (AAV2) ベクターを介して行われます。その結果、AAV2-VEGFグループではI型コラーゲン、TIMP、腱治癒力が向上していることがわかり、AAV2ベクターを介したVEGF遺伝子の送達が腱修復を改善する良い方法であることが示されました。同様に、マオら。(2017)は、AAV2-VEGF の注射により、腱損傷後の癒着形成を悪化させることなく、鶏の屈筋腱の極限強度が大幅に向上することを発見しました。
他のものとは異なり、Chen et al. (2012) は、ヒアルロン酸ナトリウム (SH) が VEGF の優れたキャリアとして使用できることを発見しました。これは、ウサギ ACL 再建モデルにおける骨 - 膝蓋骨腱 - 骨移植片の血管再生と生体力学的特性を強化しました。
Rigginらは、損傷後の初期(0~2日目)および後期(4~6日目)に1日1回、VEGFまたは抗VEGF抗体(B20.4-1-1)を局所注射することにより、(2020)は、血管反応が初期の時点でのみ腱の治癒に寄与する可能性があるが、逆に、血管反応を低下させると、後の時点での治癒の可能性が向上する可能性があることを実証しました。
最後に、VEGF164 と FGF2 の両方の複合効果が評価されましたが、Kovac et al. (2018) VEGF164 および FGF2 遺伝子をコードするプラスミド DNA を使用した遺伝子治療により、浅指屈筋腱および懸垂靱帯分枝病変 (馬に自然発生する腱炎および皮膚炎) を有する馬 10 頭中 8 頭において、超音波検査および臨床検査で大幅な改善が見られたことを発見しました。 2~6か月で受傷前のレベルに戻ります。同様に、VEGF164およびFGF2遺伝子をコードするプラスミドDNAのプラスの効果が2つの症例報告で報告されました( Kovac et al., 2017 ; Aimaletdinov et al., 2020 )。
まとめると、これらの研究は、I型コラーゲン合成の促進や腱治癒の初期段階での腱の機械的特性の増加など、腱修復における血管新生の促進による外因性VEGFのプラスの効果を裏付けています。
外因性血管内皮増殖因子の送達は腱の治癒を損なう可能性がある
VEGF と血管新生は腱の治癒過程で重要な役割を果たしている可能性がありますが、ECM 破壊に対する VEGF の負の役割はある程度無視できません (内因性 VEGF について前述したように)。
吉川ら(2006b)およびHou et al。(2009) は、外因性 VEGF 送達の適用によるマイナスの影響を示しました。吉川ら。(2006b) は、 ACL 再建後の半腱様筋腱移植片に対する VEGF165 の局所投与の効果を評価し、ACL 再建後 12 週間で VEGF165 がヒツジの膝の弛緩を増加させ、移植された腱の硬さを低下させることを見出した。VEGF のみを使用した実験ではありませんが、Hou et al. (2009) VEGF165 遺伝子が VEGF のみの細胞の骨髄由来間葉系幹細胞 (BMSC) を介してアキレス腱の治癒部位に移され、新しい血管が形成され、コラーゲン ネットワークが破壊され、腱の特性の低下につながることを発見しました。。
上記に基づいて、抗血管新生治療はがん研究や網膜症の治療で一般的に評価されているため、一部の学者は抗血管新生治療が腱の治癒に有益である可能性があると提案しています(Xiao et al., 2016 )。抗血管新生治療は、血管新生の最終的な血管収縮を誘導するだけでなく、新生血管に関連する成長因子も阻害します。ベバシズマブやB20.4-1-1(マウス)などのVEGF結合阻害剤は、複数の疾患モデルにおいて血管分布を減少させることが示されています(Riggin et al., 2019)。いくつかの研究では、腱モデルにおける抗血管新生治療が腱のコラーゲン組織と機械的特性の改善につながる可能性があることも示しています(Dallaudière et al., 2013 ; Tempfer et al., 2018)。
Dallaudièreらの調査結果によると(2013) 、アキレス腱および膝蓋腱炎(化学的コラゲナーゼによって誘発される)におけるベバシズマブの腱内注射は、6日目には毒性がなく、13日目には差が見られず、コラーゲン線維の組織化が減少し、新生血管形成が減少することで腱の治癒を促進する可能性があります。腱損傷後のベバシズマブの注射は、有害なタンパク質分解酵素やプロスタグランジンを阻害することで積極的な役割を果たすだけでなく、瘢痕形成を促進する可能性のある局所成長因子の増加を妨げる可能性もあります (Dallaudière et al., 2013 )。さらに、Tempfer ら。(2018)は、ラットの完全なアキレス腱切開モデルを確立し、腱治癒の初期段階での抗血管新生治療が損傷後の腱の治癒を促進し、マトリックスの組織を増加させ、剛性を高め、最大負荷と応力を増加させることを発見しました。
腱治療の生物学的準備期間
何よりもまず、腱障害の種類、腱の治癒段階、炎症状態など、損傷した組織の現在の生物学的状態を把握する必要があります。急性腱損傷の初期における外因性VEGFの投与は、血管新生を促進し、腱の生体力学的特性を増加させる可能性がある( Zhang et al., 2003 ; Ju et al., 2006 ; Yoshikawa et al., 2006a )。リギンらのように、損傷後の血管反応の低下は初期の時点でのみ治癒の可能性を損なうが、後の時点では治癒の可能性を改善する可能性があることを示しました。しかし、慢性腱疾患に関しては、血管分布の減少(硬化注射)が臨床現場での腱の治癒に役立つ可能性があります(Alfredson et al., 2007 ; Willberg et al., 2008 ; Sunding et al., 2015)。
外因性 VEGF の送達方法も腱の修復に影響を与える可能性があります。外因性 VEGF は半減期が短いため、生体内で容易に分解され、その生物学的役割が容易に失われます。通常の条件下での VEGF の半減期はほぼ 30 ~ 45 分です。外因性 VEGF 送達の最も一般的な方法は、直接局所注射です。VEGFの優れた担体であるヒアルロン酸ナトリウムは、平均滞留時間を延長してVEGFの生物学的役割をより良く果たす可能性がある( Chen et al., 2012 )。さらに、アデノ随伴ウイルス(AAV)ベクターまたは遺伝子をコードするプラスミドDNAによる遺伝子送達も、損傷した腱にVEGFを送達する効果的な方法である可能性があります(Tang et al., 2016 ; Mao et al., 2017 ; Kovac et al., 2018 ; Aimaletdinov 他、2020 )。異なる送達方法も、腱の治癒における外因性 VEGF の効果に影響を与える可能性があります。
Take home message
血管新生は、酸素や栄養素の供給、老廃物の除去、免疫反応の制御など、腱の治癒を促進するために重要です。血管内皮増殖因子 (VEGF) は、腱の治癒における血管形成を調節する最も重要な血管新生因子の 1 つです。最近、外因性 VEGF の適用を含む生物学的治療がますます注目を集めています。しかし、腱における内因性 VEGF の役割も完全には解明されていないため、現時点では、腱治癒における外因性 VEGF の適用の効果については議論の余地があります。腱の治癒における内因性および外因性 VEGF の役割を整理し、論争の考えられる理由について検討が必要です。
腱の修復は初期段階での適切な血管新生とVEGFによってのみ促進されるが、持続的な高VEGF発現と血管の長時間の存在が後の段階での腱の修復を損なう可能性があることも示されている。
この記事が気に入ったらサポートをしてみませんか?
